Jak zachodzi proces parowania wody? Parowanie - napisz do Antoszki
Przeczytaj także
> Parowanie
Odparowanie i parowanie w cieczach: przemiana ciała stałe na ciecz i gaz, jak zachodzi parowanie, prędkość ruchu cząsteczek i energia kinetyczna.
Odparowanie– proces, w którym cząsteczki cieczy zyskują energię wystarczającą do przekształcenia się w gaz.
Cel uczenia się
- Zidentyfikować przyczyny parowania w pobliżu powierzchni cieczy.
Główne punkty
- Parowanie przekształca ciecz w gaz.
- Parowanie zachodzi w temperaturach poniżej temperatury wrzenia, ponieważ cząsteczki cieczy mają różną energię.
- Kiedy cząsteczki cieczy zderzają się, niektóre się zderzają duża ilość energię i wybuchnąć. Obniża to energię pozostałych cząsteczek i powoduje ochłodzenie parujących cieczy.
Termin
- Parowanie to przemiana ciała stałego lub cieczy w gaz.
Co to jest parowanie i dlaczego zachodzi? Parowanie to rodzaj przemiany cieczy zachodzącej na powierzchni. Zazwyczaj cząsteczki w szklance wody nie mają wystarczającej energii, aby uciec z cieczy. Ale jeśli nastąpi niezbędne ogrzewanie, ciecz szybko zamienia się w stan pary.
Po uderzeniu cząsteczki przekazują sobie nawzajem energię. Czasami dzieje się to w jednym kierunku i cząsteczce udaje się uciec. Trzy warunki parowania to ciepło, ciśnienie atmosferyczne i ruch powietrza. Aby cząsteczki cieczy odparowały, muszą znajdować się jak najbliżej powierzchni, poruszać się we właściwym kierunku i mieć wystarczającą energię kinetyczną, aby pokonać siły międzycząsteczkowe. Jeżeli niewielka liczba cząsteczek spełnia te kryteria, wówczas szybkość parowania jest niska.
Kiedy cząsteczki przyspieszają, pozostałe mają niższą średnią energię kinetyczną, a temperatura cieczy spada. Proces ten nazywany jest chłodzeniem wyparnym. Dlatego parowanie potu chłodzi nasze ciało. Z więcej duże prędkości parowanie również przyspiesza.
(a) – Ze względu na rozkład prędkości i określone energie kinetyczne, pewna część cząsteczek ma możliwość ucieczki ze stanu pary nawet w temperaturach poniżej temperatury wrzenia. (b) – Jeśli pojemnik jest szczelnie zamknięty, parowanie będzie kontynuowane, aż gęstość kondensatu osiągnie szybkość kondensacji równą szybkości parowania. Gęstość pary i wytworzone ciśnienie proporcjonalne są wartościami nasycenia. Zwiększają się wraz z temperaturą i nie mają połączenia z innymi gazami (powietrzem). Wpływ na nie ma jedynie ciśnienie pary wodnej
Proces parowania cieczy jest ważną częścią obiegu wody. Słońce stymuluje parowanie wody z ziemskich oceanów, mórz, jezior, gleby i innych źródeł. W hydrologii parowanie i transpiracja łączą się w ewapotranspirację. Woda odparowuje, gdy powierzchnia przetrwa uderzenie i umożliwia cząsteczkom oderwanie się, tworząc parę wodną. Potrafi wznosić się i tworzyć chmury.
W dowolnej temperaturze niektóre cząsteczki odlatują od powierzchni cieczy, tworząc nad nią parę. Proces przenoszenia materii z stan ciekły do stanu gazowego odparowanie. Tworzenie się pary, które zachodzi w dowolnej temperaturze na otwartej powierzchni cieczy, nazywa się parowaniem. Jego prędkość zależy od rodzaju cieczy, wielkości jej swobodnej powierzchni, temperatury, ciśnienia zewnętrznego oraz obecności strumienia powietrza nad cieczą, unoszącego parę.
Usuwanie cząsteczek z powierzchni cieczy podczas parowania wiąże się z kosztami energia wewnętrzna na funkcję pracy A w, którą cząsteczka musi wykonać, aby pokonać siły przyciągania molekularnego i siły ciśnienia zewnętrznego. Praca ta jest wykonywana dzięki energii kinetycznej cząsteczek. Cząsteczka opuści ciecz tylko wtedy, gdy jej energia kinetyczna jest równa lub większa od funkcji pracy: (m jest masą cząsteczki, v jest składową prędkości cząsteczki skierowanej prostopadle do powierzchni cieczy). Podczas parowania ciecz ochładza się, ponieważ emitowane cząsteczki zabierają część jej energii wewnętrznej.
Aby ciecz odparowała bez zmiany jej temperatury, należy do cieczy dostarczyć energię. Wielkość skalarna mierzona jako ilość energii potrzebna do przekształcenia jednostkowej masy cieczy w parę w stałej temperaturze ciepło właściwe odparowanie.
Aby zamienić jednostkową masę cieczy w parę w stałej temperaturze, podaje się jej ilość ciepła równą ciepłu właściwemu parowania. Podczas odparowywania zwiększa się objętość substancji. Zatem para wodna w temperaturze 100°C zajmuje objętość prawie 1700 razy większą niż objętość tej samej masy wody w temperaturze 100°C. Dlatego też, gdy substancja paruje, część ciepła właściwego parowania jest zużywana na wykonanie pracy przeciwko siłę ciśnienia zewnętrznego, a częściowo na zwiększaniu jej wewnętrznej energii potencjalnej. Dlatego w tej samej temperaturze energia wewnętrzna jednostki masy substancji w stanie gazowym jest większa niż w stanie ciekłym. Więc, 1 kg działa para wodna o temperaturze 100°C 2*10 6 j więcej energii wewnętrznej niż 1 kg woda o tej samej temperaturze.
Doświadczenia wykazały, że ciepło właściwe parowania substancji zależy od jej temperatury. Im wyższa temperatura substancji, tym niższe jest jej ciepło właściwe parowania. Na przykład, w temperaturze 0°C ciepło właściwe parowania wody wynosi 2499 kJ/kg, w temperaturze 50° C - 2385 kJ/kg, w 100°C - 2257 kJ/kg, w 200°C - 1943 kJ/kg. Spadek ciepła parowania tłumaczy się tym, że im wyższa jest temperatura substancji, tym większa jest energia kinetyczna jej cząsteczek i tym mniej energii trzeba dodatkowo przekazać cieczy, aby jej cząsteczki wyleciały do wnętrza cieczy. środowisko.
Nazwa ciepła właściwego parowania r kg/j. Przemienić m kg zamiana masy cieczy w parę wymaga określonej ilości energii, w szczególności ilości ciepła Q = rm.
Załóżmy, że w zamkniętym naczyniu ciecz paruje. W wyniku ruchu termicznego część cząsteczek pary zbliżającej się do powierzchni cieczy wraca do niej. W zamkniętym naczyniu zachodzi jednocześnie proces parowania i kondensacji. Jeżeli liczba cząsteczek opuszczających ciecz jest większa niż liczba cząsteczek do niej powracających, wówczas nazywa się parę znajdującą się nad cieczą. nienasycone. Eksperymenty z parami nienasyconymi wykazały, że podlegają one prawom gazowym.
W procesie parowania i kondensacji przychodzi moment, w którym liczba cząsteczek opuszczających ciecz w jednostce czasu będzie równa liczbie cząsteczek powracających do cieczy, to znaczy między cieczą a parą nastąpi równowaga dynamiczna. Para będąca w równowadze dynamicznej ze swą cieczą nazywana jest parą para nasycona. Można go nasycać nie tylko w zamkniętym naczyniu, ale także w atmosferze. Tak więc podczas mgły para wodna w powietrzu jest nasycona.

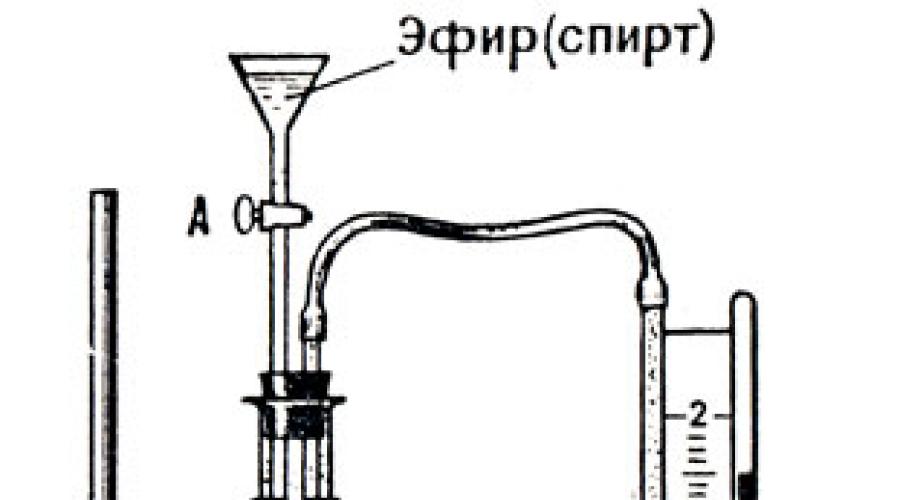
Otwórzmy kran A (rys. 35) i wpuśćmy do kolby kilka kropli eteru, który odparuje tworząc nienasyconą parę. Im więcej eteru wpuścimy do kolby, tym większe będzie ciśnienie jego nienasyconych par. Wpuszczamy eter, aż na dnie kolby pozostanie niewielka ilość ciekłego eteru. Pojawienie się tego ostatniego wskazuje, że pary eteru zostały nasycone. Od tego momentu manometr przestaje wskazywać wzrost ciśnienia - stało się ono stałe pomimo późniejszego dodania eteru. Stąd, ciśnienie i gęstość pary w danej temperaturze są największe, gdy para jest nasycona.
Jeśli w kolbie umieści się na przemian różne ciecze i zmierzy się ciśnienie ich nasyconych par, okazuje się, że w tej samej temperaturze prężność pary nasyconej różnych cieczy jest różna. Najwyższe ciśnienie ma para eteru, najmniejsza para alkoholu, a jeszcze niższa para wodna.
W temperaturze 20°C prężność pary nasyconej tych cieczy jest równa (w mmHg):

Przekonajmy się, czy ciśnienie pary nasyconej w stałej temperaturze zależy od jej objętości. Pod tłokiem w cylindrze podłączonym do manometru znajduje się ciecz i jej nasycona para (ryc. 36). Zmieniając jego objętość przesuwając tłok w górę, a następnie w dół, zgodnie z odczytem manometru to widzimy w stałej temperaturze prężność pary nasyconej nie zależy od objętości, i przy danej temperaturze dla danej cieczy jest to wartość stała. Oznacza to, że pary nasycone nie podlegają prawu Boyle’a-Marriotta. Tak, manometr Boiler parowy w danej temperaturze pokazuje zawsze to samo ciśnienie, niezależnie od tego, jaką objętość zajmuje w nim para nasycona.

Wyjaśnia to fakt, że gdy zmienia się objętość pary nasyconej, zmienia się jej masa. Wraz ze wzrostem objętości wzrasta masa pary (następuje dodatkowe odparowanie cieczy), gdy objętość zmniejsza się, masa pary maleje (część ulega kondensacji).
Przekonajmy się, czy przy stałej objętości ciśnienie pary nasyconej zależy od jej temperatury. Podgrzejmy parę nasyconą w kolbie (patrz ryc. 35), umieszczając ją w gorącej wodzie. Widzimy Wraz ze wzrostem temperatury wzrasta prężność pary nasyconej. Na przykład prężność pary nasyconej wody w temperaturze 50°C wynosi 92,5 mmHg Sztuka. i przy 100° C - 760 mmHg Sztuka.
Doświadczenia i obliczenia dotyczące zmiany prężności pary nasyconej w wyniku ogrzewania pokazują, że ciśnienie wzrasta wielokrotnie bardziej niż powinno zgodnie z prawem Charlesa, tj. zależność ciśnienia od temperatury nie jest zgodna z tym prawem. Wyjaśnia to fakt, że ciśnienie pary nasyconej wzrasta podczas ogrzewania, po pierwsze ze względu na wzrost średniej energii kinetycznej cząsteczek tej pary, a po drugie ze względu na wzrost stężenia cząsteczek pary, tj. wzrost całkowitej masy cząsteczek.
Dopóki para pozostaje nasycona, zmianie jej temperatury lub objętości zawsze towarzyszy zmiana masy pary, tj. parowanie lub kondensacja.
Wykorzystuje się właściwość nasyconej pary wodnej polegającej na zwiększaniu jej ciśnienia wraz ze wzrostem temperatury kotły parowe do wytworzenia pary pod wysokim ciśnieniem, na przykład 100 atm, w temperaturze wrzenia wody 310 ° C. Aby wykorzystać parę w silnikach parowych, usuwa się ją z kotła, podgrzewa i przekształca w parę nienasyconą. Taka para nazywa się przegrzany ma duży zapas energii wewnętrznej. Jeżeli para nie jest przegrzana, zawiera kropelki cieczy.
Po otrzymaniu pary eteru w probówce zaczynamy ją chłodzić, umieszczając ją w mieszaninie lodu i soli. Na ściankach probówki pojawia się powłoka ciekłego eteru, ponieważ po ochłodzeniu jego opary zamieniają się w ciecz. Istnieją dwa sposoby zamiany pary w ciecz: zwiększenie ciśnienia pary, jej sprężenie (patrz ryc. 36) i obniżenie temperatury pary, jej ochłodzenie. Eksperymenty pokazują, że gazy można również przekształcić w ciecz (upłynnienie gazu). Aby to zrobić, należy je jednocześnie sprężyć i ochłodzić, aż zamienią się w ciecz.
Jeśli zostawisz naczynie z wodą odkryte, woda po pewnym czasie wyparuje. Jeśli wykonasz ten sam eksperyment z alkoholem etylowym lub benzyną, proces będzie przebiegał nieco szybciej. Jeśli podgrzejesz garnek z wodą na wystarczająco mocnym palniku, woda się zagotuje.
Wszystkie te zjawiska są szczególnym przypadkiem parowania, przemiany cieczy w parę. Istnieją dwa rodzaje waporyzacji parowanie i wrzenie.
Co to jest parowanie
Parowanie to powstawanie pary z powierzchni cieczy. Parowanie można wyjaśnić w następujący sposób.
Podczas zderzeń zmieniają się prędkości cząsteczek. Często występują cząsteczki, których prędkość jest tak duża, że pokonują przyciąganie sąsiadujących cząsteczek i odrywają się od powierzchni cieczy. (Molekularna struktura materii). Ponieważ nawet w małej objętości cieczy znajduje się wiele cząsteczek, takie przypadki zdarzają się dość często i następuje ciągły proces parowania.
Cząsteczki oddzielone od powierzchni cieczy tworzą nad nią parę. Część z nich na skutek chaotycznego ruchu wraca do cieczy. Dlatego przy wietrze parowanie zachodzi szybciej, gdyż unosi parę z cieczy (tutaj także zachodzi zjawisko „wychwytywania” i oddzielania cząsteczek od powierzchni cieczy przez wiatr).
Dlatego w zamkniętym naczyniu parowanie szybko zatrzymuje się: liczba cząsteczek, które „wypadają” w jednostce czasu, staje się równa liczbie, która „powróciła” do cieczy.
Szybkość parowania zależy od rodzaju cieczy: im mniejsze przyciąganie pomiędzy cząsteczkami cieczy, tym intensywniejsze parowanie.
Im większa powierzchnia cieczy, tym więcej cząsteczek ma możliwość jej opuszczenia. Oznacza to, że intensywność parowania zależy od powierzchni cieczy.
Wraz ze wzrostem temperatury zwiększają się prędkości cząsteczek. Dlatego im wyższa temperatura, tym intensywniejsze parowanie.
Co się gotuje
Gotowanie to intensywne parowanie, które następuje w wyniku podgrzewania cieczy, tworzenia się w niej pęcherzyków pary, wypływających na powierzchnię i tam pękających.
Podczas wrzenia temperatura cieczy pozostaje stała.
Temperatura wrzenia to temperatura, w której wrze ciecz. Zwykle mówiąc o temperaturze wrzenia danej cieczy mamy na myśli temperaturę, w której ciecz ta wrze przy normalnym ciśnieniu atmosferycznym.
Podczas parowania cząsteczki oddzielone od cieczy odbierają jej część energii wewnętrznej. Dlatego gdy ciecz odparowuje, ochładza się.
Ciepło właściwe parowania
Wielkość fizyczna charakteryzująca ilość ciepła wymaganą do odparowania jednostki masy substancji nazywa się ciepłem właściwym parowania. (kliknij link, aby uzyskać więcej informacji szczegółowa analiza ten temat)
W układzie SI jednostką miary tej wielkości jest J/kg. Jest on oznaczony literą L.
Odparowanie cieczy zachodzi w dowolnej temperaturze i im szybciej im wyższa jest temperatura, tym większa jest wolna powierzchnia odparowującej cieczy i tym szybciej usuwane są pary powstałe nad cieczą.
W określonej temperaturze, w zależności od charakteru cieczy i ciśnienia, pod jakim się ona znajduje, rozpoczyna się parowanie w całej masie cieczy. Proces ten nazywa się gotowaniem.
Jest to proces intensywnego odparowania nie tylko z powierzchni swobodnej, ale także w objętości cieczy. W objętości tworzą się pęcherzyki wypełnione parą nasyconą. Pod wpływem siły wyporu unoszą się do góry i pękają na powierzchni. Ośrodkami ich powstawania są maleńkie pęcherzyki obcych gazów lub cząstki różnych zanieczyszczeń.
Jeżeli pęcherzyk ma wymiary rzędu kilku milimetrów lub więcej, wówczas drugi człon można pominąć i dlatego w przypadku dużych pęcherzyków przy stałym ciśnieniu zewnętrznym ciecz wrze, gdy ciśnienie pary nasyconej w pęcherzykach zrówna się z ciśnieniem zewnętrznym .
W wyniku chaotycznego ruchu nad powierzchnią cieczy cząsteczka pary, wpadając w sferę działania sił molekularnych, ponownie powraca do cieczy. Proces ten nazywa się kondensacją.
Parowanie i wrzenie

Parowanie i wrzenie to dwa sposoby, w jakie ciecz może zmienić się w gaz (parę). Proces takiego przejścia nazywa się parowaniem. Oznacza to, że parowanie i gotowanie są metodami odparowywania. Istnieją znaczne różnice pomiędzy tymi dwiema metodami.
Parowanie zachodzi tylko z powierzchni cieczy. Wynika to z faktu, że cząsteczki dowolnej cieczy stale się poruszają. Co więcej, prędkość cząsteczek jest inna. Cząsteczki poruszające się z odpowiednio dużą prędkością, gdy znajdą się na powierzchni, mogą pokonać siłę przyciągania innych cząsteczek i wylądować w powietrzu. Cząsteczki wody, pojedynczo w powietrzu, tworzą parę. Nie da się zobaczyć par ich oczami. To, co postrzegamy jako mgłę wodną, jest już wynikiem kondensacji (procesu odwrotnego do parowania), gdy po ochłodzeniu para gromadzi się w postaci drobnych kropelek.
W wyniku parowania sama ciecz ochładza się, gdy opuszczają ją najszybsze cząsteczki. Jak wiadomo, temperaturę dokładnie określa prędkość ruchu cząsteczek substancji, czyli ich energia kinetyczna.
Szybkość parowania zależy od wielu czynników. Po pierwsze, zależy to od temperatury cieczy. Im wyższa temperatura, tym szybsze parowanie. Jest to zrozumiałe, ponieważ cząsteczki poruszają się szybciej, co oznacza, że łatwiej im uciec z powierzchni. Szybkość parowania zależy od substancji. W niektórych substancjach cząsteczki są przyciągane silniej i dlatego trudniej im wylecieć, w innych są słabsze i dlatego łatwiej opuszczają ciecz. Parowanie zależy również od powierzchni, nasycenia powietrza parą i wiatru.
Najważniejszą rzeczą odróżniającą parowanie od wrzenia jest to, że parowanie zachodzi w dowolnej temperaturze i zachodzi tylko z powierzchni cieczy.
W przeciwieństwie do parowania, wrzenie zachodzi tylko w określonej temperaturze. Każda substancja w stanie ciekłym ma swoją własną temperaturę wrzenia. Na przykład woda pod normalnym ciśnieniem atmosferycznym wrze w temperaturze 100°C, a alkohol w temperaturze 78°C. Jednak ze spadkiem ciśnienie atmosferyczne Temperatura wrzenia wszystkich substancji nieznacznie spada.
Kiedy woda się zagotuje, uwalnia się rozpuszczone w niej powietrze. Ponieważ naczynie jest zwykle podgrzewane od dołu, temperatura w dolnych warstwach wody jest wyższa i tam najpierw tworzą się pęcherzyki. Woda paruje do tych pęcherzyków, które nasycają się parą wodną.
Ponieważ bąbelki są lżejsze od samej wody, unoszą się do góry. Ponieważ górne warstwy wody nie nagrzały się do temperatury wrzenia, pęcherzyki ochładzają się, a zawarta w nich para ponownie skrapla się w wodę, pęcherzyki stają się cięższe i ponownie toną.
Gdy wszystkie warstwy cieczy zostaną podgrzane do temperatury wrzenia, pęcherzyki nie opadają, lecz wypływają na powierzchnię i pękają. Para z nich unosi się w powietrzu. Zatem podczas wrzenia proces parowania zachodzi nie na powierzchni cieczy, ale na całej jej grubości w tworzących się pęcherzykach powietrza. W przeciwieństwie do parowania, gotowanie jest możliwe tylko w określonej temperaturze.
Należy rozumieć, że gdy ciecz wrze, następuje również normalne parowanie z jej powierzchni.
Od czego zależy szybkość parowania cieczy?

Miarą szybkości parowania jest ilość substancji wydostającej się w jednostce czasu z jednostki swobodnej powierzchni cieczy. Angielski fizyk i chemik D. Dalton w początek XIX V. odkryli, że szybkość parowania jest proporcjonalna do różnicy między ciśnieniem pary nasyconej w temperaturze parującej cieczy a rzeczywistym ciśnieniem pary rzeczywistej znajdującej się nad cieczą. Jeśli ciecz i para są w równowadze, wówczas szybkość parowania wynosi zero. Dokładniej, tak się dzieje, ale z tą samą prędkością zachodzi również proces odwrotny - kondensacja(przejście substancji ze stanu gazowego lub parowego w ciecz). Szybkość parowania zależy również od tego, czy zachodzi ono w spokojnej, czy ruchomej atmosferze; jego prędkość wzrasta, jeśli powstała para zostanie wydmuchana przez strumień powietrza lub wypompowana za pomocą pompy.
Jeśli parowanie nastąpi z ciekłego roztworu, wówczas odparowują różne substancje przy różnych prędkościach. Szybkość parowania danej substancji maleje wraz ze wzrostem ciśnienia obcych gazów, takich jak powietrze. Dlatego parowanie do pustki następuje z największą prędkością. I odwrotnie, dodając obcą substancję do naczynia, gaz obojętny, możesz znacznie spowolnić parowanie.
Czasami parowanie nazywane jest także sublimacją, czyli sublimacją, czyli przejściem ciała stałego w stan gazowy. Prawie wszystkie ich wzory są naprawdę podobne. Ciepło sublimacji jest większe od ciepła parowania o mniej więcej ciepło topnienia.
Zatem szybkość parowania zależy od:
- Rodzaj płynu. Ciecz, której cząsteczki przyciągają się z mniejszą siłą, paruje szybciej. Rzeczywiście w tym przypadku większa liczba cząsteczek może pokonać przyciąganie i wylecieć z cieczy.
- Parowanie zachodzi tym szybciej, im wyższa jest temperatura cieczy. Im wyższa temperatura cieczy, tym większa jest liczba szybko poruszających się w niej cząsteczek, które są w stanie pokonać siły przyciągania otaczających cząsteczek i odlecieć od powierzchni cieczy.
- Szybkość parowania cieczy zależy od jej powierzchni. Powód ten tłumaczy się faktem, że ciecz odparowuje z powierzchni, a im większa jest powierzchnia cieczy, tym większa jest liczba cząsteczek jednocześnie wylatujących z niej do powietrza.
- Parowanie cieczy następuje szybciej przy wietrze. Równolegle z przejściem cząsteczek z cieczy do pary zachodzi również proces odwrotny. Poruszając się losowo po powierzchni cieczy, część cząsteczek, które ją opuściły, powraca do niej ponownie. Dlatego masa cieczy w zamkniętym pojemniku nie zmienia się, chociaż ciecz nadal paruje.
wnioski

Mówimy, że woda paruje. Ale co to oznacza? Parowanie to proces, w wyniku którego ciecz znajdująca się w powietrzu szybko zamienia się w gaz lub parę. Wiele płynów odparowuje bardzo szybko, znacznie szybciej niż woda. Dotyczy to alkoholu, benzyny, amoniak. Niektóre ciecze, takie jak rtęć, odparowują bardzo powoli.
Co powoduje parowanie? Aby to zrozumieć, trzeba zrozumieć naturę materii. O ile nam wiadomo, każda substancja składa się z cząsteczek. Na te cząsteczki działają dwie siły. Jednym z nich jest spójność, która przyciąga ich do siebie. Drugim jest ruch termiczny poszczególnych cząsteczek, który powoduje ich rozbicie.
Jeżeli siła przyczepności jest większa, substancja pozostaje w stanie stałym. Jeżeli ruch termiczny jest tak silny, że przekracza spójność, wówczas substancja staje się lub jest gazem. Jeśli obie siły są w przybliżeniu zrównoważone, mamy ciecz.
Woda jest oczywiście cieczą. Ale na powierzchni cieczy znajdują się cząsteczki, które poruszają się tak szybko, że pokonują siłę przyczepności i odlatują w przestrzeń kosmiczną. Proces opuszczania cząsteczek nazywa się parowaniem.
Dlaczego woda wyparowuje szybciej, gdy jest wystawiona na działanie słońca lub podgrzana? Im wyższa temperatura, tym intensywniejsze ruchy termiczne w cieczy. Oznacza to, że coraz więcej cząsteczek zyskuje prędkość wystarczającą do odlotu. Gdy najszybsze cząsteczki odlatują, prędkość pozostałych cząsteczek średnio maleje. Dlaczego pozostała ciecz ochładza się poprzez parowanie?
Kiedy więc woda wysycha, oznacza to, że zamieniła się w gaz lub parę i stała się częścią powietrza.
uczennica klasy 9B Chernyshova Kristina MBOU Liceum nr 27 w Stawropolu.
Temat tego Praca badawcza- badanie zależności szybkości parowania od różnych warunki zewnętrzne. Problem ten pozostaje aktualny w różnych dziedzinach technologii i otaczającej nas przyrody. Dość powiedzieć, że obieg wody w przyrodzie przebiega poprzez fazy parowania i kondensacji objętościowej. Obieg wody z kolei determinuje tak ważne zjawiska, jak wpływ słońca na planetę czy po prostu normalne istnienie istot żywych w ogóle.
Hipoteza: szybkość parowania zależy od rodzaju substancji, powierzchni cieczy i temperatury powietrza, obecności ruchomych przepływ powietrza nad jego powierzchnią.
Pobierać:
Zapowiedź:
MIEJSKA BUDŻETOWA INSTYTUCJA EDUKACYJNA
SZKOŁA ŚREDNIA nr 27
Praca badawcza:
„Parowanie i czynniki wpływające na ten proces”
Ukończył: uczeń klasy 9B
Czernyszowa Krystyna.
Nauczyciel: Vetrova L.I.
Stawropol
2013
I.Wprowadzenie…………………………………………………………………………………....…….3
II Część teoretyczna……………………………………………………….4
1. Podstawowe zasady teorii kinetyki molekularnej…………………4
2. Temperatura………………………………………………………..………...6
3. Charakterystyka stanu ciekłego substancji…………………………….....7
4. Energia wewnętrzna……………………………………………….……..8
5. Parowanie……………………………………………………………………………..10
III.Część badawcza……………………………..…………………..14
IV.Wniosek…………………………………………………………………………….…..21
V. Literatura…………………………………………………………………………….22
Wstęp
Tematem pracy badawczej jest badanie zależności szybkości parowania od różnych warunków zewnętrznych. Problem ten pozostaje aktualny w różnych dziedzinach technologii i otaczającej nas przyrody. Dość powiedzieć, że obieg wody w przyrodzie przebiega poprzez fazy parowania i kondensacji objętościowej. Obieg wody z kolei determinuje tak ważne zjawiska, jak wpływ słońca na planetę czy po prostu normalne istnienie istot żywych w ogóle.
Odparowanie jest szeroko stosowane w praktyka przemysłowa do oczyszczania substancji, suszenia materiałów, rozdzielania mieszanin ciekłych, klimatyzacji. Chłodzenie wyparne woda jest wykorzystywana w obiegowych systemach zaopatrzenia w wodę przedsiębiorstw.
W silnikach gaźnikowych i wysokoprężnych rozkład wielkości cząstek paliwa decyduje o szybkości ich spalania, a co za tym idzie o procesie pracy silnika. Mgły kondensacyjne podczas spalania różnych paliw nie tylko tworzą parę wodną, ale tworzy się wiele jąder kondensacji, które mogą służyć jako centra kondensacji dla innych par. Te złożone procesy determinują współczynnik przydatna akcja silników i utratę paliwa. Osiągnięcie najlepsze wyniki w badaniu tych zjawisk może służyć jako informacja dla ruchu postęp techniczny w naszym kraju.
Więc , cel tej pracy- zbadać zależność szybkości parowania od różne czynnikiśrodowisku i poprzez sporządzanie wykresów i uważną obserwację dostrzegaj prawidłowości.
Hipoteza : szybkość parowania zależy od rodzaju substancji, powierzchni cieczy i temperatury powietrza, obecności ruchomych prądów powietrza nad jej powierzchnią.
W badaniach korzystaliśmy z różnych prostych przyrządów, takich jak termometr, a także z zasobów Internetu i innej literatury.
II Część teoretyczna.
1. Podstawowe zasady teorii kinetyki molekularnej
Właściwości substancji występujących w przyrodzie i technologii są różnorodne i różnorodne: szkło jest przezroczyste i kruche, stal jest elastyczna i nieprzezroczysta, miedź i srebro są dobre przewodniki ciepło i elektryczność, ale porcelana i jedwab są złe itp.
Jakie to jest Struktura wewnętrzna jakaś substancja? Czy ma charakter stały (ciągły), czy też ma strukturę ziarnistą (dyskretną), przypominającą strukturę kopca piasku?
Pytanie o strukturę materii zostało ponownie podniesione Starożytna Grecja jednak brak danych eksperymentalnych uniemożliwił jego rozwiązanie, i przez długi czas(przez ponad dwa tysiące lat) nie udało się zweryfikować błyskotliwych domysłów na temat budowy materii wyrażonych przez starożytni myśliciele greccy Leucypos i Demokryt (460-370 p.n.e.), którzy nauczali, że wszystko w przyrodzie składa się z atomów znajdujących się w ciągłym ruchu. Ich nauczanie zostało później zapomniane, a w średniowieczu materię uważano już za ciągłą, a zmiany i stany ciał wyjaśniano za pomocą nieważkich płynów, z których każdy uosabiał pewną właściwość materii i mógł zarówno wchodzić, jak i wychodzić z ciała . Na przykład wierzono, że dodanie kalorii do organizmu powoduje jego rozgrzanie; wręcz przeciwnie, następuje ochłodzenie organizmu w wyniku przepływu kalorii itp.
W połowa XVII wieku V. Francuski uczony P. Gassendi (1592-1655) powrócił do poglądów Demokryta. Uważał, że w przyrodzie istnieją substancje, których nie da się rozłożyć na prostsze składniki. Takie substancje są obecnie nazywane pierwiastki chemiczne, na przykład wodór, tlen, miedź itp. Według Gassendiego każdy pierwiastek składa się z atomów określonego typu.
W przyrodzie jest stosunkowo niewiele różnych pierwiastków, ale ich atomy, łącząc się w grupy (wśród nich mogą znajdować się identyczne atomy), dają najmniejszą cząsteczkę nowego rodzaju substancji - cząsteczkę. W zależności od liczby i rodzaju atomów w cząsteczce otrzymuje się substancje o różnych właściwościach.
W XVIII wieku Pojawiły się prace M.V. Łomonosowa, kładące podwaliny pod molekularną teorię kinetyczną struktury materii. Łomonosow zdecydowanie walczył o wyrzucenie z fizyki nieważkich cieczy, takich jak kaloryczne, a także atomy zimna, zapachu itp., które były wówczas szeroko stosowane do wyjaśniania odpowiednich zjawisk. Łomonosow udowodnił, że wszystkie zjawiska można w naturalny sposób wytłumaczyć ruchem i interakcją cząsteczek materii. - |Na początku XIX wieku angielski uczony D. Dalton (1766-1844) wykazał, że wykorzystując wyłącznie pojęcia o atomach i cząsteczkach, można wyprowadzić i wyjaśnić znane z eksperymentów prawa chemiczne. W ten sposób potwierdził naukowo struktura molekularna Substancje. Po pracach Daltona zdecydowana większość naukowców uznała istnienie atomów i cząsteczek.
Na początku XX wieku. zmierzono rozmiary, masy i prędkości ruchu cząsteczek materii, określono położenie poszczególnych atomów w cząsteczkach, jednym słowem zakończono budowę molekularnej teorii kinetycznej budowy materii, z której wyciągnięto wnioski potwierdzone wieloma eksperymentami.
Główne założenia tej teorii są następujące:
1) każda substancja składa się z cząsteczek, pomiędzy którymi znajdują się przestrzenie międzycząsteczkowe;
2) cząsteczki zawsze znajdują się w ciągłym, losowym (chaotycznym) ruchu;
3) pomiędzy cząsteczkami działają zarówno siły przyciągające, jak i odpychające. Siły te zależą od odległości pomiędzy cząsteczkami. Są one znaczące tylko na bardzo krótkich dystansach i szybko maleją w miarę oddalania się cząsteczek. Natura tych sił jest elektryczna.
2. Temperatura.
Jeśli wszystkie ciała składają się z ciągle i losowo poruszających się cząsteczek, to w jaki sposób przejawi się zmiana prędkości ruchu cząsteczek, tj. Ich energii kinetycznej i jakie odczucia wywołają te zmiany u człowieka? Okazuje się, że zmiana średniej energii kinetycznej ruch do przodu cząsteczek wiąże się z ogrzewaniem lub chłodzeniem ciał.
Często człowiek określa ciepło ciała za pomocą dotyku, np. dotykając ręką grzejnika, mówimy: grzejnik jest zimny, ciepły lub gorący. Jednak określenie, czy ciało jest gorące na podstawie dotyku, jest często zwodnicze. Kiedy człowiek zimą dotyka ręką drewnianych i metalowych ciał, wydaje mu się, że tak metalowy przedmiot zimniejsze od drewna, chociaż w rzeczywistości ich ogrzewanie jest takie samo. Konieczne jest zatem ustalenie wartości, która obiektywnie oceniłaby nagrzanie organizmu i stworzenie urządzenia do jego pomiaru.
Wielkość charakteryzującą stopień nagrzania ciała nazywa się temperaturą. Urządzenie służące do pomiaru temperatury nazywa się termometrem. Działanie najpopularniejszych termometrów opiera się na rozszerzaniu się ciał po podgrzaniu i ściskaniu po ochłodzeniu. Kiedy zetkną się dwa ciała różne temperatury wymiana energii zachodzi pomiędzy ciałami. W tym przypadku ciało bardziej nagrzane (o wysokiej temperaturze) traci energię, a ciało mniej nagrzane (o niskiej temperaturze) ją zyskuje. Ta wymiana energii między ciałami prowadzi do wyrównania ich temperatur i kończy się, gdy temperatury ciał zrównają się.
Uczucie ciepła u człowieka pojawia się, gdy otrzymuje energię od otaczających go ciał, to znaczy, gdy ich temperatura jest wyższa niż temperatura człowieka. Uczucie zimna wiąże się z uwalnianiem przez człowieka energii do otaczających go ciał. W powyższym przykładzie ciało metalowe wydaje się człowiekowi zimniejsze niż drewniane, ponieważ energia z dłoni przekazywana jest do ciał metalowych szybciej niż do drewnianych, a w pierwszym przypadku temperatura dłoni spada szybciej.
3. Charakterystyka stanu ciekłego substancji.
Cząsteczki cieczy oscylują wokół losowo występującej pozycji równowagi przez pewien czas t, a następnie przeskakują do nowej pozycji. Czas, w którym cząsteczka oscyluje wokół położenia równowagi, nazywany jest czasem „ustalonego życia” cząsteczki. Zależy to od rodzaju cieczy i jej temperatury. Gdy ciecz jest podgrzewana, czas „ustalonej trwałości” maleje.
Jeśli w cieczy wyizoluje się wystarczająco małą objętość, to w czasie „osiadłego życia” zachowany jest w niej uporządkowany układ cząsteczek cieczy, tj. pojawia się pozory sieci krystalicznej ciał stałych. Jeśli jednak weźmiemy pod uwagę ułożenie cząsteczek cieczy względem siebie w dużej objętości cieczy, okazuje się to chaotyczne.
Dlatego można powiedzieć, że w cieczy występuje „porządek krótkiego zasięgu” w rozmieszczeniu cząsteczek. Uporządkowany układ cząsteczek cieczy w małych objętościach nazywa się kwazikrystalicznym (podobnym do kryształu). Stwierdzono krótkotrwały wpływ na ciecz, krótszy niż czas „osiadłego życia”. wielkie podobieństwo właściwości cieczy z właściwościami ciała stałego. Przykładowo, gdy mały kamyczek o płaskiej powierzchni uderza gwałtownie w wodę, kamień się od niej odbija, czyli ciecz wykazuje właściwości sprężyste. Jeśli pływak skaczący z platformy całym ciałem uderzy w powierzchnię wody, dozna poważnych obrażeń, ponieważ w tych warunkach ciecz zachowuje się jak ciało stałe.
Jeśli czas ekspozycji na ciecz jest dłuższy niż czas „osiadłości” cząsteczek, wówczas wykrywana jest płynność cieczy. Na przykład osoba swobodnie wchodzi do wody z brzegu rzeki itp. Głównymi cechami stanu ciekłego są płynność cieczy i zachowanie objętości. Płynność cieczy jest ściśle powiązana z czasem życia jej cząsteczek. Im krótszy jest ten czas, tym większa ruchliwość cząsteczek cieczy, czyli większa płynność cieczy, a jej właściwości są bliższe właściwościom gazu.
Im wyższa temperatura cieczy, tym bardziej jej właściwości różnią się od właściwości ciała stałego i zbliżają się do właściwości gęstych gazów. Zatem stan ciekły substancji jest pośredni między stanem stałym i gazowym tej samej substancji.
4. Energia wewnętrzna
Każde ciało jest zbiorem ogromnej liczby cząstek. W zależności od budowy substancji cząstkami tymi są cząsteczki, atomy lub jony. Z kolei każda z tych cząstek ma dość złożoną strukturę. Zatem cząsteczka składa się z dwóch lub więcej atomów, atomy składają się z jądra i powłoki elektronowej; jądro składa się z protonów i neutronów itp.
Cząsteczki tworzące ciało są w ciągłym ruchu; ponadto wchodzą w interakcję ze sobą w określony sposób.
Energia wewnętrzna ciała jest sumą energii kinetycznych cząstek, z których się ono składa, oraz energii ich wzajemnego oddziaływania (energii potencjalnych).
Dowiedzmy się, w jakich procesach może się zmienić energia wewnętrzna ciała.
1. Przede wszystkim jest oczywiste, że energia wewnętrzna ciała zmienia się pod wpływem jego odkształcenia. W rzeczywistości podczas odkształcania zmienia się odległość między cząstkami; w konsekwencji zmienia się także energia oddziaływania między nimi. Tylko w gazie doskonałym, gdzie zaniedbuje się siły oddziaływania między cząstkami, energia wewnętrzna jest niezależna od ciśnienia.
2. Zmiany energii wewnętrznej podczas procesów termicznych. Procesy termiczne to procesy związane ze zmianami zarówno temperatury ciała, jak i stanu jego skupienia - topnienia lub zestalenia, parowania lub kondensacji. Kiedy zmienia się temperatura, zmienia się energia kinetyczna ruchu jej cząstek. Jednocześnie jednak należy to podkreślić
zgadza się i energia potencjalna ich wzajemne oddziaływanie (z wyjątkiem przypadku gazu rozrzedzonego). Rzeczywiście wzrostowi lub spadkowi temperatury towarzyszy zmiana odległości pomiędzy pozycjami równowagi w węzłach sieci krystalicznej ciała, co rejestrujemy jako rozszerzalność cieplną ciał. Naturalnie, w tym przypadku zmienia się energia oddziaływania cząstek. Przejście z jednego stanu skupienia do drugiego jest wynikiem zmiany struktura molekularna ciała, co powoduje zmianę zarówno energii oddziaływania cząstek, jak i charakteru ich ruchu.
3. Energia wewnętrzna ciała zmienia się podczas reakcji chemicznych. Rzeczywiście, reakcje chemiczne reprezentują procesy restrukturyzacji cząsteczek, ich rozpadu na prostsze części lub odwrotnie, wyłonienia się bardziej złożonych cząsteczek z prostszych lub z pojedynczych atomów (reakcje analizy i syntezy). W tym przypadku siły oddziaływania między atomami i odpowiednio energie ich oddziaływania zmieniają się znacząco. Ponadto zmienia się zarówno charakter ruchu cząsteczek, jak i interakcji między nimi, ponieważ cząsteczki nowo powstałej substancji oddziałują ze sobą inaczej niż cząsteczki substancji pierwotnych.
4. W pewnych warunkach jądra atomów ulegają przemianom zwanym reakcjami jądrowymi. Niezależnie od mechanizmu zachodzących w tym przypadku procesów (a mogą one być bardzo różne), wszystkie one wiążą się ze znaczną zmianą energii oddziałujących cząstek. W konsekwencji reakcjom jądrowym towarzyszy zmiana energii wewnętrznej ciała zawierającego te jądra
5. Parowanie
Przejście substancji ze stanu ciekłego do gazowego nazywa się parowaniem, a przejście substancji ze stanu gazowego do ciekłego nazywa się kondensacją.
Jednym z rodzajów powstawania pary jest parowanie. Parowanie to tworzenie się pary, które zachodzi tylko na swobodnej powierzchni cieczy graniczącej z ośrodkiem gazowym. Dowiedzmy się, jak parowanie wyjaśnia się w oparciu o teorię kinetyki molekularnej.
Ponieważ cząsteczki cieczy podlegają chaotycznemu ruchowi, wśród cząsteczek jej warstwy powierzchniowej zawsze znajdą się cząsteczki, które poruszają się w kierunku od cieczy do środowisko gazowe. Jednak nie wszystkie takie cząsteczki będą mogły wylecieć z cieczy, ponieważ podlegają siłom molekularnym, które wciągają je z powrotem do cieczy. Dlatego tylko te jego cząsteczki, które mają odpowiednio wysoką energię kinetyczną, będą mogły uciec poza powierzchniową warstwę cieczy.
Rzeczywiście, kiedy cząsteczka przechodzi warstwa powierzchniowa, musi działać przeciwko siłom molekularnym, wykorzystując swoją energię kinetyczną. Cząsteczki, których energia kinetyczna jest mniejsza od tej pracy, są wciągane z powrotem do cieczy, a z cieczy wyciągane są tylko te cząsteczki, których energia kinetyczna jest większa od tej pracy. Cząsteczki uwolnione z cieczy tworzą parę nad jej powierzchnią. Ponieważ cząsteczki wydostające się z cieczy uzyskują energię kinetyczną w wyniku zderzeń z innymi cząsteczkami cieczy, Średnia prędkość chaotyczny ruch cząsteczek wewnątrz cieczy podczas jej parowania powinien się zmniejszyć. Zatem do przekształcenia fazy ciekłej substancji w fazę gazową należy wydać pewną energię. Cząsteczki pary znajdujące się nad powierzchnią cieczy, podczas swego chaotycznego ruchu, mogą wlecieć z powrotem do cieczy i zwrócić jej energię, którą poniosły podczas parowania. W konsekwencji podczas parowania zawsze jednocześnie następuje kondensacja pary, której towarzyszy wzrost energii wewnętrznej cieczy.
Jakie przyczyny wpływają na szybkość parowania cieczy?
1. Jeśli do identycznych spodków wlejemy równe objętości wody, alkoholu i eteru i zaobserwujemy ich parowanie, okaże się, że najpierw odparuje eter, potem alkohol, a woda odparuje ostatnia. Dlatego prędkość
parowanie zależy od rodzaju cieczy.
2. Im większa jest jego swobodna powierzchnia, tym szybciej odparowuje ta sama ciecz. Na przykład, jeśli na spodek i do szklanki wlejemy tę samą ilość wody, wówczas woda wyparuje ze spodka szybciej niż ze szklanki.
3. Łatwo to zauważyć gorąca woda paruje szybciej niż zimno.
Powód tego jest jasny. Im wyższa temperatura cieczy, tym większa jest średnia energia kinetyczna jej cząsteczek, a co za tym idzie, większa liczba ich opuszczających ciecz w tym samym czasie.
4. Ponadto szybkość parowania cieczy jest tym większa, im mniejsza ciśnienie zewnętrzne na cieczy i im mniejsza jest gęstość pary tej cieczy nad jej powierzchnią.
Na przykład, gdy wieje wiatr, pranie schnie szybciej niż przy bezwietrznej pogodzie, ponieważ wiatr przenosi parę wodną, co pomaga zmniejszyć kondensację pary wodnej na praniu.
Ponieważ energia jest zużywana na parowanie cieczy ze względu na energię jej cząsteczek, temperatura cieczy spada podczas procesu parowania. Dlatego dłoń zmoczona w eterze lub alkoholu zauważalnie się chłodzi. Wyjaśnia to również uczucie zimna u człowieka, gdy wychodzi z wody po kąpieli w gorący i wietrzny dzień.
Jeśli ciecz paruje powoli, to w wyniku wymiany ciepła z otaczającymi ciałami strata jej energii jest kompensowana napływem energii z środowisko, a jego temperatura faktycznie pozostaje równa temperaturze otoczenia. Jeśli jednak ciecz paruje z dużą szybkością, jej temperatura może być znacznie niższa od temperatury otoczenia. Za pomocą „lotnych” cieczy, takich jak eter, można osiągnąć znaczny spadek temperatury.
Zauważmy też, że wielu ciała stałe, omijając fazę ciekłą, może bezpośrednio przejść do fazy gazowej. Zjawisko to nazywa się sublimacją lub sublimacją. Zapach ciał stałych (na przykład kamfory, naftalenu) tłumaczy się ich sublimacją (i dyfuzją). Sublimacja jest typowa dla lodu, na przykład pranie suszy się w temperaturach poniżej 0° G.
6. Hydrosfera i atmosfera Ziemi
1. Procesy parowania i kondensacji wody odgrywają decydującą rolę w kształtowaniu się warunków pogodowych i klimatycznych na naszej planecie. W skali globalnej procesy te sprowadzają się do oddziaływania hydrosfery i atmosfery ziemskiej.
Hydrosfera składa się z całej wody dostępnej na naszej planecie stany skupienia; 94% hydrosfery przypada na Ocean Światowy, którego objętość szacuje się na 1,4 miliarda m3. Zajmuje 71% całkowitej powierzchni powierzchni Ziemi, a gdyby stała powierzchnia Ziemi była gładką kulą, wówczas woda pokryłaby ją ciągłą warstwą o głębokości 2,4 km; Zajęte jest 5,4% hydrosfery Wody gruntowe, a także lodowce, wilgotność powietrza i gleby. A tylko 0,6% pochodzi ze słodkiej wody rzek, jezior i sztuczne zbiorniki. Stąd jasno wynika, jakie znaczenie ma ochrona świeża woda z zanieczyszczeń pochodzących z odpadów przemysłowych i transportowych.
2. Atmosfera ziemska jest zwykle podzielona na kilka warstw, z których każda ma swoją własną charakterystykę. Dolna, powierzchniowa warstwa powietrza nazywana jest troposferą. Jego górna granica w szerokościach równikowych przebiega na wysokości 16-18 km, a na szerokościach polarnych - na wysokości 10 km. Troposfera zawiera 90% masy całej atmosfery, czyli 4,8 1018 kg. Temperatura w troposferze maleje wraz z wysokością. Najpierw o 1°C na każde 100 m, a następnie począwszy od wysokości 5 km temperatura spada do -70°C.
Ciśnienie i gęstość powietrza stale maleją. Najbardziej zewnętrzna warstwa atmosfery na wysokości około 1000 km stopniowo przechodzi w przestrzeń międzyplanetarną.
3. Badania wykazały, że codziennie około 7.10 3 km 3 wody i mniej więcej tyle samo spada w postaci opadów.
Unoszona przez wznoszące się prądy powietrza para wodna unosi się, opadając do zimnych warstw troposfery. W miarę unoszenia się para staje się nasycona, a następnie skrapla się, tworząc krople deszczu i chmury.
W procesie skraplania pary wodnej w atmosferze średnio dziennie wydziela się pewna ilość ciepła 1,6 10 22 J, czyli dziesiątki tysięcy razy więcej niż energia wytworzona w tym samym czasie na planecie Ziemia. Energia ta jest pochłaniana przez wodę podczas jej parowania. Zatem pomiędzy hydrosferą a atmosferą ziemską zachodzi ciągła wymiana nie tylko materii (obieg wody), ale także energii.
III. CZĘŚĆ BADAWCZA.
Badanie procesów parowania i określenie zależności szybkości parowania od różne warunki przeprowadzono szereg eksperymentów.
Eksperyment 1. Badanie zależności szybkości parowania od temperatury powietrza.
Materiały: Talerze szklane, 3% roztwór nadtlenku wodór, olej roślinny, alkohol, woda, stoper, termometr, lodówka.
Postęp eksperymentu:Za pomocą strzykawki nakładamy substancje na płytki szklane i obserwujemy parowanie substancji.
Alkohol Objętość 0,5·10 -6 m 3
Temperatura powietrza: +24.
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 3 godziny;
Woda. Objętość 0,5·10 -6 m 3
Temperatura powietrza: +24.
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 5 godzin;
Roztwór nadtlenku wodoru. Objętość 0,5·10 -6 m 3
Temperatura powietrza: +24.
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 8 godzin;
Olej roślinny. Objętość 0,5·10 -6 m 3
Temperatura powietrza: +24.
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 40 godzin;
Zmieniamy temperaturę powietrza. Włóż szklanki do lodówki.
Alkohol. Objętość 0,5·10 -6 m 3
Temperatura powietrza: +6.
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 8 godzin;
Woda. Objętość 0,5·10 -6 m 3
Temperatura powietrza: +6.
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 10 godzin;
Roztwór nadtlenku wodoru. Objętość 0,5·10 -6 m 3
Temperatura powietrza: +6.
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 15 godzin;
Olej roślinny. Objętość 0,5·10 -6 m 3
Temperatura powietrza: +6
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 72 godziny;
Wniosek: Z wyników badania wynika, że kiedy różne temperatury ilość czasu potrzebna do odparowania tych samych substancji jest różna. W przypadku tej samej cieczy proces parowania przebiega znacznie szybciej przy większej ilości wysoka temperatura. Świadczy to o zależności badanego procesu od tego parametru fizycznego. Wraz ze spadkiem temperatury wydłuża się czas trwania procesu parowania i odwrotnie.
Eksperyment 2 . Badanie zależności szybkości parowania od powierzchni cieczy.
Cel: Zbadaj zależność procesu parowania od powierzchni cieczy.
Materiały: Woda, alkohol, zegarek, strzykawka medyczna, talerze szklane, linijka.
Postęp eksperymentu:Pole powierzchni mierzymy za pomocą wzoru: S=P·D 2:4.
Za pomocą strzykawki nakładamy na płytkę różne płyny, formujemy z niej okrąg i obserwujemy, aż płyn całkowicie odparuje. Temperatura powietrza w pomieszczeniu pozostaje niezmieniona (+24)
Alkohol. Objętość 0,5·10 -6 m 3
Powierzchnia: 0,00422m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 1 godzinę;
Woda. Objętość 0,5·10 -6 m 3
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 2 godziny;
Roztwór nadtlenku wodoru. Objętość 0,5·10 -6 m 3
Powierzchnia: 0,00422 m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 4 godziny;
Olej roślinny. Objętość 0,5·10 -6 m 3
Powierzchnia: 0,00422 m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 30 godzin;
Zmieniamy warunki. Obserwujemy parowanie tych samych cieczy na różnych powierzchniach.
Alkohol. Objętość 0,5·10 -6 m 3
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 3 godziny;
Woda. Objętość 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 4 godziny;
Roztwór nadtlenku wodoru. Objętość 0,5·10 -6 m 3
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 6 godzin;
Olej roślinny. Objętość 0,5·10 -6 m 3
Powierzchnia 0,00283 m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło 54 godziny;
Wniosek: Z wyników badań wynika, że z naczyń z różne obszary powierzchniach parowanie zachodzi w różnych okresach czasu. Jak widać z wykonanych pomiarów, ze statku o większy obszar powierzchni ciecz ta szybciej odparowuje, co świadczy o zależności badanego procesu od tego parametru fizycznego. Wraz ze zmniejszaniem się powierzchni wzrasta czas trwania procesu parowania i odwrotnie.
Eksperyment 3. Badanie zależności procesu parowania od rodzaju substancji.
Cel: Zbadaj zależność procesu parowania od rodzaju cieczy.
Urządzenia i materiały:Woda, alkohol, olej roślinny, roztwór nadtlenku wodoru, zegarek, strzykawka medyczna, płytki szklane.
Postęp eksperymentu.Za pomocą strzykawki aplikujemy Różne rodzaje ciecz na płytki i obserwować proces aż do całkowitego odparowania. Temperatura powietrza pozostaje niezmieniona. Temperatury cieczy są takie same.
Wyniki badań różnicy pomiędzy odparowaniem alkoholu, wody, 3% roztworu nadtlenku wodoru i oleju roślinnego uzyskujemy z danych z poprzednich badań.
Wniosek: Różne ciecze wymagają różnej ilości czasu do całkowitego odparowania. Z wyników wynika, że proces parowania przebiega szybciej w przypadku alkoholu i wody, a wolniej w przypadku oleju roślinnego, co świadczy o zależności procesu parowania od parametru fizycznego – rodzaju substancji.
Eksperyment 4. Badanie zależności szybkości parowania cieczy od prędkości mas powietrza.
Cel: zbadać zależność szybkości parowania od prędkości wiatru.
Urządzenia i materiały:Woda, alkohol, olej roślinny, roztwór nadtlenku wodoru, zegarek, strzykawka medyczna, płytki szklane, suszarka do włosów.
Postęp. Wywołujemy sztuczny ruch mas powietrza za pomocą suszarki do włosów, obserwujemy proces i czekamy, aż płyn całkowicie odparuje. Suszarka ma dwa tryby: tryb prosty, tryb turbo.
W przypadku trybu prostego:
Alkohol. Objętość: 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2 Wynik eksperymentu: całkowite odparowanie cieczy zajęło około 2 minut;
Woda. Objętość 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło około 4 minut;
Roztwór nadtlenku wodoru. Objętość: 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło około 7 minut;
Olej roślinny. Objętość: 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2 Wynik eksperymentu: całkowite odparowanie cieczy zajęło około 10 minut;
W przypadku trybu Turbo:
Alkohol. Objętość: 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2 Wynik eksperymentu: całkowite odparowanie cieczy zajęło około 1 minuty;
Woda. Objętość: 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło około 3 minut;
Roztwór nadtlenku wodoru. Objętość: 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2 Wynik eksperymentu: całkowite odparowanie cieczy zajęło około 5 minut;
Olej roślinny. Objętość: 0,5·10 -6 m 3
Powierzchnia: 0,00283 m 2
Wynik eksperymentu: całkowite odparowanie cieczy zajęło około 8 minut;
Wniosek: Proces parowania zależy od prędkości ruchu mas powietrza nad powierzchnią cieczy. Im większa prędkość, tym ten proces przebiega szybciej i odwrotnie.
Badania wykazały zatem, że intensywność parowania cieczy jest różna dla różnych cieczy i wzrasta wraz ze wzrostem temperatury cieczy, zwiększeniem jej powierzchni swobodnej oraz obecnością wiatru nad jej powierzchnią.
Wniosek.
W wyniku pracy studiowaliśmy różne źródła informacje o procesie parowania i warunkach jego występowania. Wyznacza się parametry fizyczne mające wpływ na szybkość procesu parowania. Zależność procesu parowania od parametry fizyczne przeprowadzono analizę uzyskanych wyników. Postawiona hipoteza okazała się słuszna. W toku badań potwierdzono założenia teoretyczne – zależność szybkości procesu parowania od parametrów fizycznych przedstawia się następująco:
Wraz ze wzrostem temperatury cieczy wzrasta szybkość procesu parowania i odwrotnie;
Wraz ze zmniejszeniem swobodnej powierzchni cieczy szybkość procesu parowania maleje i odwrotnie;
Szybkość procesu parowania zależy od rodzaju cieczy.
Zatem proces parowania cieczy zależy od takich parametrów fizycznych, jak temperatura, powierzchnia swobodna i rodzaj substancji.
Praca ta ma znaczenie praktyczne, gdyż badała zależność intensywności parowania – zjawiska, z którym spotykamy się m.in. Życie codzienne, z parametrów fizycznych. Korzystając z tej wiedzy, możesz kontrolować postęp procesu.
Literatura
Pinsky A. A., Grakovsky G. Yu Fizyka: Podręcznik dla studentów instytucji
Wykształcenie średnie zawodowe/podstawowe. wyd. Yu.I.Dika, N.S.Puryshevoy.-M.:FORUM:INFRA_M, 2002.-560 s.
Milkovskaya L.B. Powtórzmy fizykę dla rozpoczynających naukę na uniwersytetach M., „Higher School”, 1985.608 s.
Zasoby internetowe:http://ru.wikipedia.org/wiki/;
http://class-fizika.narod.ru/8_l 3.htm;
http://e-him.ru/?page=dynamic§ion=33&article=208 ;
Podręcznik do fizyki G.Ya. Myakishev „Termodynamika”