Czy zmieni się odległość przebyta przez cząsteczkę? Pytanie. Efektywna średnica cząsteczki to minimalna odległość, na jaką zbliżają się centra dwóch cząsteczek podczas zderzenia. Średnia prędkość ruchu termicznego cząsteczek
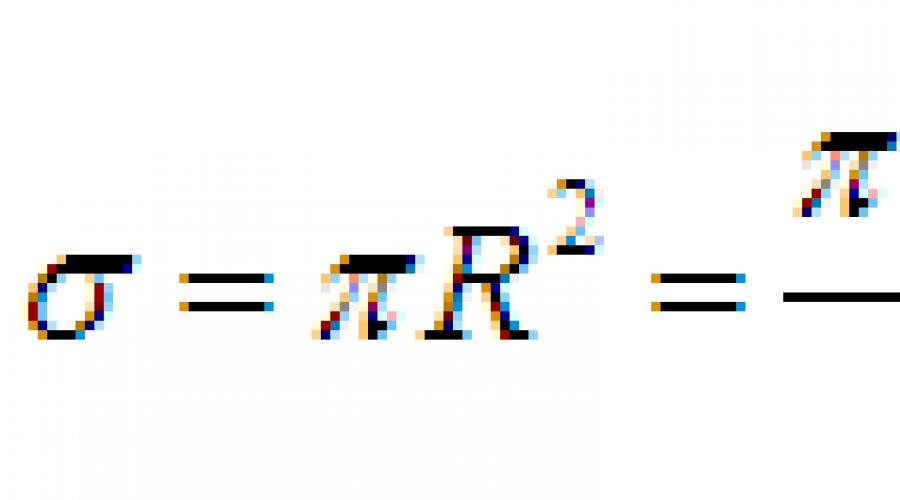
Efektywna średnica molekularna - minimalna odległość, w jakiej centra dwóch cząsteczek zbliżają się do siebie podczas zderzenia.
Średnia liczba zderzeń i średnia droga swobodna cząsteczek
Średnie prędkości cząsteczek i gazu są bardzo wysokie – w normalnych warunkach rzędu setek metrów na sekundę. Jednak proces wyrównywania niejednorodności w gazie na skutek ruchu molekularnego przebiega bardzo powoli. Wynika to z faktu, że podczas poruszania się cząsteczek dochodzi do zderzeń z innymi cząsteczkami. Z każdym zderzeniem prędkość cząsteczki zmienia się pod względem wielkości i kierunku. W rezultacie prędkość, z jaką cząsteczka dyfunduje z jednej części gazu do drugiej, jest znacznie mniejsza niż średnia prędkość ruchu molekularnego. Aby oszacować prędkość ruchu cząsteczek, wprowadzono pojęcie średniej swobodnej drogi. Zatem średnia droga swobodna to średnia odległość, jaką cząsteczka pokonuje od zderzenia do zderzenia.
Aby to ustalić, najpierw obliczamy średnią liczbę zderzeń wybranej cząsteczki z innymi cząsteczkami w jednostce czasu. Zakładamy, że cząsteczka po zderzeniu nadal porusza się po linii prostej ze średnią prędkością ruchu.
Cząsteczki, z którymi zderza się wybrana cząsteczka, uważane są w pierwszym przybliżeniu za nieruchome i traktowane jako ciała kuliste o promieniu r. Niech wybrana cząsteczka przesuwa się w prawo z pozycji do pozycji w linii prostej (ryc. 11.3). Podczas swojego ruchu doznaje zderzeń z tymi nieruchomymi cząsteczkami, których centra leżą nie dalej niż 2r od trajektorii. Innymi słowy, cząsteczka poruszająca się ze średnią prędkością w ciągu jednej sekundy zderzy się ze wszystkimi cząsteczkami, których centra znajdują się w objętości ograniczonej przez walec o promieniu 2r i długości , tj.
Jeżeli stężenie cząsteczek wynosi n, to wewnątrz rozważanego cylindra znajduje się liczba cząsteczek równa
Ta liczba określa średnią liczbę kolizji w jednostce czasu.
Założenie, że wszystkie cząsteczki oprócz jednej są nieruchome, jest oczywiście błędne. W rzeczywistości wszystkie cząsteczki się poruszają, a możliwość zderzenia dwóch cząstek zależy od ich względnej prędkości. Dlatego zamiast średniej arytmetycznej należy uwzględnić średnią prędkość względną cząsteczek. Jeżeli prędkości cząsteczek są rozłożone zgodnie z prawem Maxwella, to, jak można wykazać, średnia prędkość względna dwóch cząsteczek jednorodnego gazu jest razy większa niż . Zatem średnia liczba kolizji musi być zwiększona o współczynnik
Zatem średnia droga swobodna nie zależy od temperatury gazu, ponieważ wraz ze wzrostem temperatury zarówno i , jak i jednocześnie wzrastają. Obliczając liczbę zderzeń i średnią drogę swobodną cząsteczek, za model cząsteczki przyjęto kuliste ciało sprężyste. W rzeczywistości każda cząsteczka jest złożonym układem cząstek elementarnych, a rozważając zderzenia sprężyste cząsteczek, rozumiano, że centra cząsteczek mogą zbliżyć się do siebie na pewną minimalną odległość. Następnie występują siły odpychające, które powodują oddziaływanie podobne do oddziaływania podczas uderzenia sprężystego. Średnia odległość między środkami oddziałujących cząsteczek, jak w przypadku uderzenia sprężystego, nazywana jest średnicą efektywną. Następnie
Praca testowa na temat „Wstępne informacje o budowie materii”.
opcja 1
Część 1.
A1. Najmniejsze cząsteczki, które składają się na różne substancje, nazywane są ...
A. Atomy B. Cząsteczki C. Jony
A2. Cząsteczki różnych substancji ...
B. Nie można udzielić jednoznacznej odpowiedzi.
A3. Po podgrzaniu objętość ciała ...
A. Nie zmienia się B. Zwiększa się C. Zmniejsza
A4. W jakich stanach materii może zachodzić dyfuzja?
A. Tylko w gazach B. W cieczach i gazach
B. W gazach, cieczach i ciałach stałych.
A5. Które z poniższych właściwości należą do cieczy?
A. Mają swój własny kształt B. Zachowują objętość
A6. Jak ułożone są cząsteczki ciał stałych?
A7. W jakim stanie może być powietrze?
A. Tylko w postaci gazowej B. Tylko w płynie
Część 2.
W 1. Czy odległość, jaką cząsteczka gazu pokonuje od jednego zderzenia do następnego, zmieni się, jeśli pewna ilość gazu zostanie uwolniona z butli, w której się znajduje?
W 2. Cukier rozpuszcza się szybciej w gorącej wodzie niż w zimnej. Czemu?
Część 3
C1. Złamanie kawałka drutu wymaga dużej siły. Jeśli jednak podgrzejesz drut w płomieniu palnika, znacznie łatwiej go zerwać. Czemu?
Opcja 2
A1. Cząsteczki tej samej substancji...
A. Nie różnią się od siebie B. Różnią się od siebie
B. Zależy od stanu materii.
A2. Po schłodzeniu objętość ciała ...
A. Zwiększa się B. Zmniejsza C. Nie zmienia się
A3. Jak dyfuzja zależy od temperatury?
A. Proces przyspiesza wraz ze wzrostem temperatury
B. Proces spowalnia wraz ze wzrostem temperatury
B. Proces jest niezależny od zmian temperatury.
A4. Które z poniższych właściwości należą do gazów?
A. Mają swój własny kształt. B. Utrzymuj głośność
B. Nie mają własnego kształtu i objętości
A5. Jak ułożone są cząsteczki płynów?
A. W dużej odległości od siebie
B. Nie rozbiegaj się na duże odległości
B. Ułożone w określonej kolejności.
A6. Jaki jest stan stali?
A. Tylko w postaci stałej B. Tylko w płynie
B. W stanie stałym, ciekłym i gazowym.
A7. Lód stopił się i zamienił w wodę. Czy zmieniły się same cząsteczki lodu?
A. Nie, nie. B. Tak, mają. B. Nie ma jednoznacznej odpowiedzi.
Część 2.
W 1. Kropla olejku rozprowadza się po powierzchni wody, tworząc cienką warstwę. Jaka może być najmniejsza grubość tej folii?
W 2. Czy przewody linii energetycznych rozciągają się tak samo, gdy są zawieszone latem i zimą?
Część 3
C1. Dlaczego trudno jest zdjąć mokrą pończochę lub skarpetę?
Odpowiedzi.
|
Numer zadania | |||||||
Praca testowa na temat „Interakcja ciał”.
opcja 1
Część 1.
A1. Który z poniższych ruchów jest jednolity?
A. Ruch Ziemi wokół własnej osi. B. Ruch wahadła w godzinach.
B. Ruch samochodu podczas przyspieszania.
A2. Jaka jest trajektoria skoku narciarza ze skoczni?
A. Linia prosta B. Linia zakrzywiona C. Okrąg
A3. Które z poniższych wyrażeń pozwala obliczyć odległość przebytą ruchem jednostajnym?
A. s=v/t B. s=vt C. s=t/v
A4. Motocyklista porusza się z prędkością 72 km/h, a autobus z prędkością 20 m/s. Które z tych ciał porusza się szybciej?
A. Autobus B. Motocyklista C. Poruszają się w ten sam sposób.
A5. Czy prędkość ciała zmieni się, jeśli zatrzyma się na nim działanie innych ciał?
A. Nie zmieni się. B. Zwiększenie. B. Zmniejszenie.
A6. Gęstość substancji pokazuje...
A. Jaka jest masa substancji w objętości 1m3.
B. Jaka jest objętość 1 kg substancji.
P. Jaka jest masa substancji w objętości 1 litra.
A7. Wagi równoważono kładąc ciało na jednej wadze, a cały zestaw odważników pokazanych na rysunku na drugiej. Masa ciała to...
A. 10,99 g B. 11,09 g C. 11,90 g
Mówiąc o gazie doskonałym, wyszliśmy z tego, że cząsteczki nie oddziałują ze sobą. W rzeczywistości przypuszczano oczywiście, że nie ma między nimi potencjalnej energii interakcji. Elastyczne zderzenia między molekułami i molekułami ze ścianami muszą koniecznie zachodzić, choćby dlatego, że w przeciwnym razie nie będzie mechanizmu, dzięki któremu zostanie ustalony równy rozkład energii w stopniach swobody, w przeciwnym razie nie będzie można mówić o temperaturze układu, ciśnieniu w nim itp. Zderzenia cząsteczek zdarzają się przypadkowo. Prowadzą do zmiany kierunku i wielkości prędkości cząstek, ale nie zmieniają rozkładu cząsteczek względem prędkości i współrzędnych w układach równowagi.
Powstaje pytanie: czy cząsteczki zawsze będą się ze sobą zderzać? W końcu cząsteczki są bardzo małe, a odległości między nimi w idealnym gazie są o rząd wielkości większe niż ich wymiary liniowe. Może dla statków o małych rozmiarach latają bez kolizji od ściany do ściany? Obliczmy, ile razy w jednostce czasu jedna cząsteczka może zderzać się z innymi i jaką odległość przeciętnie pokonuje między zderzeniami.
Zanim przejdziemy do obliczeń, weźmy najprostszy model dla cząsteczek. Przedstawimy je w postaci elastycznych kulek. W zderzeniu cząsteczek o średnicach efektywnych d1 oraz d2 ich centra zbliżają się do siebie (d 1 + d 2)/2(rys. 4.2).
Ryż. 4.2. Zderzenie dwóch cząsteczek (1) i trajektoria wybranej cząsteczki gazu (2): kierunek jej ruchu zmienia się, gdy jedna z cząsteczek ośrodka wpada w promień oddziaływaniaR = (dt + d 2 )/2
Jeśli wyobrazimy sobie, że cząsteczka 1 uderzając w cząsteczkę 2 , nastąpi kolizja; jeśli pierwsza cząsteczka wpadnie w kulę o promieniu
opisane wokół drugiej cząsteczki. Pole przekroju tej sfery

Wartość R nazywa efektywny promień oddziaływania cząsteczek 1 oraz 2 , a - efektywny przekrój interakcji te cząsteczki. Kiedy zderzają się identyczne cząsteczki d 1 \u003d d 2 \u003d d, R \u003d d oraz
W czasie pomiędzy dwoma kolejnymi zderzeniami cząsteczka leci pewną ścieżką ja. Jest oczywiście kwestią czystego przypadku, jak daleko może zajść każda pojedyncza cząsteczka bez kolizji. Ale uśrednianie ścieżki ja nad wszystkimi cząsteczkami układu otrzymujemy wielkość fizyczną
nazywa oznacza darmową ścieżkę Cząsteczki. Statystyczne znaczenie tej wielkości jest następujące: stosunek małego odcinka długości dx k podaje prawdopodobieństwo kolizji
w drodze dx. Zostawiać P(x) - prawdopodobieństwo lotu bez kolizji X. Następnie
![]()
- prawdopodobieństwo przebycia odległości bezkolizyjnej x + dx. Ostatnie wydarzenie składa się z dwóch niezależnych wydarzeń:
Cząstka poleciała bez kolizji X(którego prawdopodobieństwo jest P(x));
cząstka pokonała również mały odcinek ścieżki bez kolizji dx(którego prawdopodobieństwo jest 1-dx/). Z twierdzenia o mnożeniu prawdopodobieństw mamy wtedy

skąd wynika równanie na prawdopodobieństwo P(x)
Ponieważ prawdopodobieństwo pokonania odległości zerowej bez kolizji jest równe jeden, mamy dodatkowy warunek początkowy P(0) = 1. Całkując równanie różniczkowe, w końcu znajdujemy
|
|
Jak widać, im dłuższa ścieżka X, tym mniej prawdopodobne jest pokonanie go bez kolizji.
Upewnijmy się teraz, że - prawdziwa średnia wolna ścieżka. Obliczmy, z jakim prawdopodobieństwem cząsteczka będzie miała średnią drogę swobodną ja. Oznacza to, że cząsteczka przebyła tę odległość bez kolizji. x = l(prawdopodobieństwo tego, co jest P(l)) i zderzył się z inną cząstką bezpośrednio za nią - na małym odcinku długości dl(którego prawdopodobieństwo można znaleźć jako dl/). Prawdopodobieństwo dw takiego zdarzenia, zgodnie z twierdzeniem o mnożeniu prawdopodobieństwa, jest równe
![]()
Następnie znajdujemy średnią wolną ścieżkę
|
|
Nie należy oczywiście sądzić, że prawdopodobieństwo pokonania dystansu ja bez kolizji wynosi zero: niektóre cząsteczki mogą pokonywać bardzo duże odległości, ale tylko bardzo mała ich część. Na x = , jak wynika z (4.1), prawdopodobieństwo przejścia bez kolizji jest równe
![]()
tj 63,2 % cząstki będą po drodze zderzać się. Z długością ścieżki x = 2 dostajemy
![]()
to znaczy, kolizje są już przeznaczone 86,5 % cząstki, w x = 3 już zaangażowany w starcia 95 % cząstki, ponieważ
![]()
Aby określić średnią liczbę kolizji n jedna cząsteczka z innymi w jednostce czasu, przyjmujemy następujące założenia:
wszystkie cząsteczki są takie same, to znaczy nie bierzemy pod uwagę mieszanin gazów;
wszystkie cząsteczki, z wyjątkiem tej, którą obserwujemy, są nieruchome (później pokażemy, jak pozbyć się tego oczywiście błędnego założenia);
prędkość kolizji v OT cząsteczka się nie zmienia (to założenie jest w zasadzie na tym samym poziomie, co poprzednie: w zderzeniu sprężystym z nieruchomą przeszkodą, moduł prędkości tak naprawdę się nie zmienia (znaczenie indeksu „od” stanie się jasne) później)).
Ścieżka naszej cząsteczki to średnica d pozostaje prostoliniowa, dopóki nie napotka nieruchomej cząsteczki, której środek znajduje się w odległości mniejszej niż R = re. Następnie cząsteczka zmieni kierunek ruchu i będzie poruszać się po linii prostej aż do nowego zderzenia. Przez pewien czas ∆ t cząsteczka pójdzie zepsutą ścieżką vOT ∆ t i zderzy się ze wszystkimi cząsteczkami, które wpadną do rozbitego cylindra o promieniu d i podstawa = pd 2(patrz rysunek 4.1). Objętość tego cylindra wynosi pd 2 przeciwko OT ∆ t. Jeśli n- stężenie cząsteczek w układzie (ich liczba na jednostkę objętości), łatwo jest obliczyć ilość nieruchomych cząsteczek w cylindrze, czyli ilość zderzeń DN:
![]()
To implikuje częstotliwość kolizji (czyli liczbę kolizji w jednostce czasu)
|
|
Pozbądźmy się teraz konsekwencji naszego założenia, że cząsteczki są nieruchome. Podążmy za cząsteczką 1 , który porusza się z prędkością v1 i zderza się z cząsteczką 2 , który ma prędkość v2. W układzie odniesienia powiązanym z drugą cząsteczką jest nieruchoma, ale pierwsza cząsteczka ma prędkość
Teraz jest jasne, że to średnia wartość względnej prędkości cząsteczek odgrywa rolę prędkości v OD, którego użyliśmy do wyprowadzenia zależności (4.3) dla częstotliwości kolizji. Mamy wtedy
gdzie 𝜃 12 jest kątem między kierunkami ruchu cząsteczek. Ze względu na losowość ruchu kąt ten z równym prawdopodobieństwem przyjmie dowolną wartość, tak że średnia wartość jego cosinusa wynosi zero. A uśrednianie kwadratów prędkości prowadzi do pojawienia się średniej kwadratowej prędkości cząsteczek
![]()
znane nam z poprzedniego rozdziału. W końcu dostajemy, że
a wzór (4.3) jest napisany w ostatecznej formie
Zauważ, że przechodząc od prędkości cząsteczki do jej średniej kwadratowej prędkości, w rzeczywistości pozbywamy się również trzeciego założenia, ponieważ vKB stała w danej temperaturze.
Znając częstotliwość kolizji, możesz znaleźć średnią drogę swobodną. Rzeczywiście, średni czas pomiędzy dwoma kolejnymi zderzeniami = 1/n, a w tym czasie cząstka porusza się średnio po ścieżce = vKBt. Zatem średnia swobodna droga cząsteczki gazu wynosi
|
|
Ponieważ w stałej temperaturze stężenie cząstek jest proporcjonalne do ciśnienia, średnia swobodna droga maleje wraz ze wzrostem ciśnienia. Jest to zrozumiałe, ponieważ zmniejsza się średnia odległość między cząstkami. W rzeczywistości cząsteczka nie jest stałą kulą. Dlatego jego efektywna średnica d- wartość ta nie jest całkiem stała: maleje wraz ze wzrostem temperatury, choć tylko nieznacznie. Dlatego też średnia swobodna droga nieznacznie wzrasta wraz ze wzrostem temperatury.
Należy zauważyć, że średnia odległość między cząstkami jest daleka od zbieżności ze średnią średnią drogą swobodnej. Wcześniej szacowaliśmy efektywną średnicę cząsteczki pary wodnej d=3· 10–10 m² i średnia odległość między cząsteczkami w normalnych warunkach L=3· 10–9 m². Stąd znajdujemy stężenie cząsteczek
![]()
Znaleziono zastępstwo n do wyrażenia dla średniej wolnej ścieżki, znajdujemy
Widzimy, że średnia wolna ścieżka w 200 razy większa niż średnica cząsteczki i 20 razy większa niż średnia odległość między cząsteczkami. Aby uzupełnić obraz, szacujemy również częstotliwość kolizji. Energia kinetyczna ruchu translacyjnego cząsteczki
![]()
Znając masę cząsteczki wody

otrzymujemy oszacowanie średniej kwadratowej prędkości

Wreszcie definiujemy
![]()
Innymi słowy, cząsteczka doświadcza 10 miliardów kolizje na sekundę! Liniowy rozmiar naczynia zawierającego jeden litr gazu wynosi l = 10 cm = 0,1 m. Z prędkością 630 m/s cząsteczka mogła podróżować od ściany do ściany w czasie

ale w tym czasie doświadczy
![]()
zderzenia z innymi cząsteczkami.
Zostawiliśmy bez dyskusji pierwsze założenie o identyczności wszystkich cząsteczek. Było to potrzebne nie z powodów fundamentalnych, ale dla uproszczenia wyprowadzenia i wyrażeń końcowych. Jeśli tak nie jest, jeśli weźmiemy pod uwagę mieszaninę gazów, to składniki mają różne stężenia cząstek, różne prędkości średniokwadratowe, a ich cząsteczki mają różne masy. W konsekwencji zmieni się wzór na średnią drogę swobodną, a wyniki będą inne dla molekuły różnego rodzaju.
Przykład. Zobaczmy, jak zmienia się wzór (4.6) na średnią drogę swobodną cząsteczek, jeśli są to płaskie dyski poruszające się w materiale cienkiej warstwy, nie mogące z niego wylecieć?
Jak poprzednio, dla zderzenia cząsteczek o średnicach d1 oraz d2 powinni się zbliżyć
Dlatego też, gdy cząsteczka porusza się wzdłuż płaszczyzny filmu, uderzy we wszystkie inne cząsteczki, które wpadną w pęknięty prostokąt (w przeciwieństwie do cylindra w przypadku trójwymiarowym) o szerokości 2R i długość vOT ∆ t. Powierzchnia tego prostokąta
![]()
Przy stężeniu powierzchniowym n cząsteczki (w tym przypadku n- ich liczba na jednostkę powierzchni) wystąpi ∆ N=Sn kolizje. Stąd dla częstotliwości kolizji znajdujemy

gdzie wzięliśmy pod uwagę, jak poprzednio, prędkość względną
Stąd średnia wolna ścieżka dla poruszanie się w samolocie płaskie cząsteczki jest równe

Dla tych samych cząsteczek ( d 1 = d 2 = d)
![]()
Randka w lesie, jeż we mgle i bomba atomowa. Ideę średniej swobodnej drogi można wykorzystać do oszacowania widoczności w lesie, we mgle, a nawet przybliżonego oszacowania masy krytycznej uranu w bombie atomowej.
Wyobraź sobie, że masz randkę w lesie. Jaka jest maksymalna odległość? R czy zauważysz swojego partnera (i swojego partnera - Ciebie)? Powiedzmy, że włączasz latarkę, aby dać mu/jej sygnał. Jeśli nie weźmiesz pod uwagę rozpraszania światła, wszystkie drzewa rzucają cienie, których rozmiar liniowy można uznać w przybliżeniu równy średnicy d drzewa. Na ryc. 4.3 Twoja lokalizacja jest oznaczona czerwonym kółkiem, wokół niej narysowany jest okrąg z promieniem R, drzewa są pokazane jako zielone okręgi, a ich cienie na okręgu są zaznaczone pomarańczowymi łukami.

Ryż. 4.3. Oszacowanie maksymalnej odległościR widoczność w lesie
Ustalmy, jaką część koła pokrywają cienie. Zostawiać n gęstość sadzenia drzew (ich liczba na jednostkę powierzchni). Jeśli ja to średnia odległość między drzewami, to
Wewnątrz kręgu jest pR2n drzewa. Całkowita długość cienia na kole wynosi zatem pR 2. miejsce. Widzimy, że całkowita długość cienia rośnie jako kwadrat promienia i przy pewnej wartości R przekracza obwód 2pR. Ale jeśli cały krąg pokryty jest cieniami, światło nie przejdzie dalej. Ta wartość R i będzie maksymalną odległością widoczności w lesie. Teraz jest jasne, że wyznacza się ją z równości
![]()
czyli otrzymaliśmy

Jako przykład liczbowy możesz wziąć wartości oparte na swoim doświadczeniu życiowym. Powiedzmy, że data ustalana jest wśród brzóz o średniej średnicy pnia d = 0,25 m i średnia odległość między drzewami l = 10 m. Wtedy znajdujemy R = 800 m.
Ustalmy teraz związek między otrzymanym wynikiem a wzorem na średnią drogę swobodną. Mamy jedną cząsteczkę (wiązkę światła) nie ma rozmiaru ( d1 = 0), wielkość pozostałych cząsteczek jest równa średniej średnicy łodygi ( d2 = d) i wreszcie cząsteczki (pnie) są w spoczynku, to znaczy musimy odrzucić czynnik . Otrzymujemy w rezultacie - w stosunku do naszego zadania - wyrażenie
Tak więc promień widoczności, który znaleźliśmy
Prawdopodobieństwo, że światło pokona tę odległość bez „zderzeń” z drzewami, wynosi

Innymi słowy, z prawdopodobieństwem 86.5 % światła zostanie zablokowane przez drzewa.
Spotkanie w lesie odbyło się w samolocie. Teraz wrócimy do świata wolumetrycznego. Ta sama figura przedstawia teraz kulę o promieniu R oraz przeszkody w postaci kulek o średnicy d. Na przykład chcemy ocenić widoczność jeża, który zgubił się we mgle, a teraz rolę drzew pełnią krople wody. Jeśli stężenie kropel wynosi P(ich liczba na jednostkę objętości), to wewnątrz kuli znajduje się
![]()
Ich cienie na sferze to koła o powierzchni str. 2 /4. Przy maksymalnej odległości widoczności cienie pokrywają całą sferę:

Stąd znajdujemy odległość widoczności we mgle
Porównajmy ponownie ten wynik ze wzorem (4.6) na średnią drogę swobodną cząsteczki w ośrodku gazowym, gdzie musimy odrzucić czynnik i wziąć

dostajemy
![]()
Prawdopodobieństwo pokonania ścieżki R = 3l bez kolizji jest równe

Dlatego jest prawdopodobne 95 % po drodze nastąpi kolizja.
Otrzymujemy oszacowanie liczbowe. Nasze rozumowanie jest słuszne, jeśli wielkość kropel zauważalnie (powiedzmy o jeden lub dwa rzędy wielkości) przekracza długość fali światła. Ponieważ zakres widzialny ma długości fal 0,40–0,76 µm, to dla średnicy kropli bierzemy oszacowanie d = 10–4 m. Dla stężenia kropel przyjmujemy wartość n=3· 10 7 m² – 3 (Patrz poniżej pochodzenie tego numeru.) Wtedy widoczność we mgle będzie

Stężenie kropelek oszacowaliśmy w następujący sposób. Ciśnienie pary wodnej nasyconej przy, powiedzmy, 20°C (T = 293 K) równa się pH = 2,3· 10 3 Pa. Stosując równanie Clapeyrona - Mendelejewa, znajdujemy gęstość pary wodnej przy 100 % wilgotność:
Przy gwałtownym spadku temperatury cała para skrapla się w kropelki o określonej wielkości - powstaje gęsta mgła. Masa jednej kropli to

Liczba kropel uformowanych w objętości V znajdujemy jako stosunek masy pary m do masy kropli m WPR. Następnie z zależności określa się koncentrację kropel

Na d = 10–4 m otrzymujemy wartość użytą powyżej n=3· 10–7 m–3.
Zależność odległości widzialności we mgle od wielkości kropel jest zatem dana przez zależność

Dla bardzo małych kropelek o średnicy około dziesięciu długości fal świetlnych d = 10 - 5 m widoczność jest zmniejszona do jednego metra. To, co nazywa się „nie możesz patrzeć poza nos”. Przy jeszcze mniejszych rozmiarach kropel nasz model staje się niepoprawny, ponieważ światła nie można już traktować po prostu jako zbiór cząstek o znikomym rozmiarze. Efekty dyfrakcyjne zaczynają odgrywać rolę, a wyrażenie na efektywny przekrój dla oddziaływania światła z kroplami nie będzie już determinowane przez czysto geometryczny przekrój kropli.
Rozwiązany problem wiąże się również z kwestią masy krytycznej uranu-235 używanego do produkcji bomb atomowych. Zamiast światła w tym zadaniu mamy neutrony, a zamiast kropli jądra 235 U. Po zderzeniu z jądrami neutrony dzielą je na fragmenty i wylatują 3-4 kolejne neutrony. W promieniu krytycznym R kryt liczba neutronów nie zmniejszy się i nastąpi samopodtrzymująca się reakcja łańcuchowa - nastąpi eksplozja atomowa. Za podstawę wyznaczania promienia krytycznego można przyjąć promień widzialności
i masa krytyczna M kryt
Zauważamy, że nie zdradzamy żadnych tajemnic produkcji broni jądrowej: te szacunki są zbyt przybliżone. Naszym jedynym celem jest ponowne zademonstrowanie jedności praw fizyki działających w najróżniejszych układach.
« Fizyka - klasa 10 "
Czy znając temperaturę można obliczyć średnią energię kinetyczną cząsteczek gazu? średnia prędkość cząsteczki?
Czy tę prędkość można zmierzyć?
Średnia prędkość ruchu termicznego cząsteczek.
Równanie (9.16) umożliwia znalezienie średniego kwadratu prędkości cząsteczki. Podstawiając do tego równania otrzymujemy wyrażenie na średnią wartość kwadratu prędkości:
Średnia prędkość kwadratowa to ilość

Obliczając ze wzoru (9.19) prędkość cząsteczek, np. azotu w t = 0 °C, otrzymujemy ![]() Cząsteczki wodoru w tej samej temperaturze mają prędkość średniokwadratową
Cząsteczki wodoru w tej samej temperaturze mają prędkość średniokwadratową ![]() Prędkości te są duże, ale ponieważ cząsteczki gazu poruszają się losowo, stale zderzając się ze sobą, a czas między dwoma zderzeniami jest krótki, odległość, jaką przelatują cząsteczki, jest również niewielka. W wyniku zderzenia trajektoria każdej cząsteczki jest splątaną linią łamaną (ryc. 9.6). Cząsteczka ma duże prędkości na prostych odcinkach linii łamanej. Jak widać z rysunku, gdy cząsteczka przemieszcza się z punktu A do punktu B, droga przez nią przebyta okazuje się znacznie większa niż odległość AB. Przy ciśnieniu atmosferycznym odległość ta wynosi około 10-5 cm.
Prędkości te są duże, ale ponieważ cząsteczki gazu poruszają się losowo, stale zderzając się ze sobą, a czas między dwoma zderzeniami jest krótki, odległość, jaką przelatują cząsteczki, jest również niewielka. W wyniku zderzenia trajektoria każdej cząsteczki jest splątaną linią łamaną (ryc. 9.6). Cząsteczka ma duże prędkości na prostych odcinkach linii łamanej. Jak widać z rysunku, gdy cząsteczka przemieszcza się z punktu A do punktu B, droga przez nią przebyta okazuje się znacznie większa niż odległość AB. Przy ciśnieniu atmosferycznym odległość ta wynosi około 10-5 cm.
Kiedy po raz pierwszy uzyskano te liczby (druga połowa XIX wieku), wielu fizyków było oszołomionych. Według obliczeń prędkości cząsteczek gazu okazały się większe niż prędkości pocisków artyleryjskich! Na tej podstawie wyrażono nawet wątpliwości co do słuszności teorii kinetycznej. Wiadomo przecież, że zapachy rozprzestrzeniają się dość wolno: potrzeba czasu rzędu kilkudziesięciu sekund, aby zapach perfum rozlanych w jednym kącie pokoju rozprzestrzenił się w drugim kącie.
Eksperymentalne wyznaczanie prędkości cząsteczek. Eksperymenty mające na celu określenie prędkości cząsteczek potwierdziły słuszność wzoru (9.19). Jeden z eksperymentów został zaproponowany i przeprowadzony przez O. Sterna w 1920 roku.
Co decyduje o średniej energii kinetycznej ruchu termicznego molekuł oraz o średniej kwadratowej prędkości tego ruchu.
Urządzenie Stern składa się z dwóch współosiowych cylindrów A i B, sztywno połączonych ze sobą (ryc. 9.7, a). Cylindry mogą obracać się ze stałą prędkością kątową. Cienki drut platynowy C, pokryty warstwą srebra, rozciągnięty jest wzdłuż osi małego walca.
W 1943 r. O. Stern otrzymał Nagrodę Nobla w dziedzinie fizyki „za wkład w rozwój metod wiązek molekularnych oraz odkrycie i pomiar momentu magnetycznego protonu”.
Jak myślisz, dlaczego drut jest wykonany z platyny?

Przez przewód przepływa prąd elektryczny. W ściance tego cylindra znajduje się wąska szczelina O. Powietrze zostało usunięte z cylindrów. Butla B ma temperaturę pokojową. Na początku urządzenie jest nieruchome. Kiedy prąd przepływa przez żarnik, nagrzewa się i w temperaturze 1200 ° C atomy srebra odparowują. Wewnętrzny cylinder wypełniony jest gazem zawierającym atomy srebra. Niektóre atomy przechodzą przez szczelinę O i po dotarciu do wewnętrznej powierzchni cylindra B osadzają się na niej. W rezultacie wąski pasek D srebra powstaje bezpośrednio naprzeciwko szczeliny (ryc. 9.7, b).
Następnie cylindry wprawiane są w ruch obrotowy z dużą liczbą obrotów n na sekundę (do 1500 1/c).
Teraz, w czasie t wymaganym, aby atom przebył drogę równą różnicy między promieniami cylindrów R B - R A, cylindry obrócą się o pewien kąt φ. W rezultacie atomy poruszające się ze stałą prędkością nie uderzają w wewnętrzną powierzchnię dużego cylindra naprzeciwko szczeliny O (ryc. 9.7, c), ale w pewnej odległości s od końca promienia przechodzącego przez środek szczelina (ryc. 9.7, d): po tym, jak wszystkie atomy poruszają się w linii prostej.
Jeżeli oznaczymy przez υ B moduł prędkości obrotu punktów na powierzchni walca zewnętrznego, to
s = υ B t = 2 πnR B t. (9.20)
W rzeczywistości atomy srebra mają różne prędkości. Dlatego odległości s dla różnych atomów będą się nieco różnić. Przez s należy rozumieć odległość między odcinkami na paskach D i D "o największej grubości warstwy srebra. Odległość ta będzie odpowiadać średniej prędkości atomów, która jest równa ![]()
Podstawiając do tego wzoru wartość czasu t z wyrażenia (9.20), otrzymujemy
Znając n, R A i R B oraz mierząc średnie przemieszczenie paska srebra spowodowane obrotem przyrządu, można obliczyć średnią prędkość atomów srebra.
Wyznaczone z doświadczenia moduły prędkości pokrywają się z teoretyczną wartością średniej kwadratowej prędkości. Służy to jako eksperymentalny dowód ważności wzoru (9.19), a w konsekwencji wzoru (9.16), zgodnie z którym średnia energia kinetyczna cząsteczki jest wprost proporcjonalna do temperatury bezwzględnej.


