Rola ciśnienia zewnętrznego w procesach parowania i kondensacji. Parowanie cieczy Jak ciśnienie zależy od parowania
Wykorzystanie zjawiska chłodzenia cieczy podczas jej parowania; zależność temperatury wrzenia wody od ciśnienia.
Podczas waporyzacji substancja przechodzi ze stanu ciekłego do stanu gazowego (para). Istnieją dwa rodzaje waporyzacji: parowanie i gotowanie.
Odparowanie Parowanie następuje z wolnej powierzchni cieczy.
Jak przebiega parowanie? Wiemy, że cząsteczki każdej cieczy poruszają się w sposób ciągły i chaotyczny, przy czym niektóre poruszają się szybciej, a inne wolniej. Siły przyciągania do siebie uniemożliwiają im odlot. Jeżeli jednak w pobliżu powierzchni cieczy pojawi się cząsteczka o wystarczająco dużej energii kinetycznej, to może przezwyciężyć siły przyciągania międzycząsteczkowego i wylecieć z cieczy. To samo powtórzy się z inną szybką cząsteczką, z drugą, trzecią itd. Wylatując, cząsteczki te tworzą parę nad cieczą. Powstawanie tej pary to parowanie.
Ponieważ najszybsze cząsteczki uciekają z cieczy podczas parowania, średnia energia kinetyczna cząsteczek pozostających w cieczy staje się coraz mniejsza. W rezultacie spada temperatura parującej cieczy: ciecz jest chłodzona. Dlatego w szczególności osobie w mokrych ubraniach jest chłodniej niż w suchych (zwłaszcza gdy wieje wiatr).
Jednocześnie każdy wie, że jeśli wlejesz wodę do szklanki i zostawisz ją na stole, to mimo parowania nie będzie ona ciągle stygła, stając się coraz bardziej zimna, aż zamarznie. Co temu zapobiega? Odpowiedź jest bardzo prosta: wymiana ciepła wody z ciepłym powietrzem otaczającym szkło.
Chłodzenie cieczy podczas parowania jest bardziej zauważalne, gdy parowanie następuje wystarczająco szybko (aby ciecz nie miała czasu na przywrócenie swojej temperatury z powodu wymiany ciepła z otoczeniem). Ciecze lotne szybko odparowują, w których siły przyciągania międzycząsteczkowego są niewielkie, np. eter, alkohol, benzyna. Jeśli upuścisz taki płyn na rękę, poczujemy chłód. Odparowując z powierzchni dłoni, taki płyn ostygnie i odbierze z niego trochę ciepła.
Substancje parujące są szeroko stosowane w inżynierii. Na przykład w technologii kosmicznej pojazdy zjazdowe są pokrywane takimi substancjami. Przechodząc przez atmosferę planety, ciało-aparat nagrzewa się w wyniku tarcia, a pokrywająca je substancja zaczyna parować. Odparowując, chłodzi statek kosmiczny, chroniąc go w ten sposób przed przegrzaniem.
Chłodzenie wody podczas jej parowania jest również wykorzystywane w przyrządach służących do pomiaru wilgotności powietrza - psychrometry(z greckiego „psychros” - zimno). Psychrometr składa się z dwóch termometrów. Jeden z nich (suchy) pokazuje temperaturę powietrza, a drugi (którego zbiornik jest wiązany kambrem, zanurzony w wodzie) - niższą temperaturę ze względu na intensywność parowania z mokrego batystu. Im bardziej suche powietrze, którego wilgotność jest mierzona, tym silniejsze parowanie, a tym samym niższy odczyt temperatury mokrej. I odwrotnie, im wyższa wilgotność powietrza, tym mniej intensywne parowanie, a tym samym wyższa temperatura, jaką pokazuje ten termometr. Na podstawie wskazań termometrów suchych i zwilżonych, za pomocą specjalnej tabeli (psychrometrycznej), określa się wilgotność powietrza wyrażoną w procentach. Najwyższa wilgotność wynosi 100% (przy tej wilgotności na obiektach pojawia się rosa). Dla osoby uważa się, że najbardziej korzystna wilgotność zawiera się w przedziale od 40 do 60%.
Za pomocą prostych eksperymentów łatwo jest ustalić, że szybkość parowania wzrasta wraz ze wzrostem temperatury cieczy, a także ze wzrostem jej wolnej powierzchni i w obecności wiatru.
Dlaczego ciecz szybciej odparowuje w obecności wiatru? Faktem jest, że jednocześnie z parowaniem na powierzchni cieczy zachodzi proces odwrotny - kondensacja. Kondensacja następuje dzięki temu, że część cząsteczek pary, losowo poruszająca się nad cieczą, powraca do niej ponownie. Wiatr unosi cząsteczki, które wyleciały z cieczy i nie pozwala im wrócić.
Kondensacja może również wystąpić, gdy para nie ma kontaktu z cieczą. Na przykład kondensacja wyjaśnia powstawanie chmur: cząsteczki pary wodnej unoszące się nad ziemią w zimniejszych warstwach atmosfery grupują się w maleńkie kropelki wody, których nagromadzeniem są chmury. Kondensacja pary wodnej w atmosferze powoduje również deszcz i rosę.
Temperatura wrzenia a ciśnienie
Temperatura wrzenia wody wynosi 100°C; można by pomyśleć, że jest to nieodłączna właściwość wody, że woda, gdziekolwiek i w jakich warunkach, zawsze będzie wrzeć w 100°C.
Ale tak nie jest, a mieszkańcy wysokogórskich wiosek doskonale zdają sobie z tego sprawę.
W pobliżu szczytu Elbrusa znajduje się dom dla turystów oraz stacja naukowa. Początkujący czasami zastanawiają się „jak trudno jest ugotować jajko we wrzącej wodzie” lub „dlaczego wrząca woda się nie pali”. W tych warunkach mówi się im, że woda wrze na szczycie Elbrusa już w 82°C.
O co tu chodzi? Jaki czynnik fizyczny zakłóca zjawisko wrzenia? Jakie znaczenie ma wysokość?
Tym czynnikiem fizycznym jest ciśnienie działające na powierzchnię cieczy. Nie musisz wspinać się na szczyt góry, aby sprawdzić słuszność tego, co zostało powiedziane.
Umieszczając podgrzaną wodę pod dzwonem i wypompowując lub wypompowując z niej powietrze, można być przekonanym, że temperatura wrzenia wzrasta wraz ze wzrostem ciśnienia i spada, gdy spada.
Woda wrze w 100°C tylko pod pewnym ciśnieniem - 760 mm Hg. Sztuka. (lub 1 atm).
Krzywa temperatury wrzenia w funkcji ciśnienia jest pokazana na ryc. 4.2. Na szczycie Elbrusa ciśnienie wynosi 0,5 atm, a ciśnienie to odpowiada temperaturze wrzenia 82 ° C.
Ryż. 4.2
Ale woda wrząca przy 10-15 mm Hg. Art., możesz odświeżyć się w czasie upałów. Przy tym ciśnieniu temperatura wrzenia spadnie do 10-15°C.
Można nawet dostać „wrzącą wodę”, która ma temperaturę zamarzającej wody. Aby to zrobić, będziesz musiał zmniejszyć ciśnienie do 4,6 mm Hg. Sztuka.
Ciekawy obraz można zaobserwować, umieszczając pod dzwonem otwarte naczynie z wodą i wypompowując powietrze. Pompowanie sprawi, że woda się zagotuje, ale gotowanie wymaga ciepła. Nie ma skąd go wziąć, a woda będzie musiała oddać swoją energię. Temperatura wrzącej wody zacznie spadać, ale wraz z kontynuowaniem pompowania spada ciśnienie. Dlatego gotowanie nie ustanie, woda będzie nadal stygła i ostatecznie zamarznie.
Takie zagotowanie zimnej wody następuje nie tylko przy wypompowywaniu powietrza. Przykładowo, gdy śruba statku obraca się, ciśnienie w warstwie wody gwałtownie poruszającej się w pobliżu metalowej powierzchni gwałtownie spada i woda w tej warstwie wrze, tj. pojawiają się w niej liczne bąbelki wypełnione parą. Zjawisko to nazywa się kawitacją (od łacińskiego słowa cavitas - jama).
Obniżając ciśnienie obniżamy temperaturę wrzenia. A co z jego zwiększeniem? Wykres taki jak nasz odpowiada na to pytanie. Ciśnienie 15 atm może opóźnić wrzenie wody, zacznie się ono dopiero przy 200 °C, a ciśnienie 80 atm sprawi, że woda wrze dopiero w 300 °C.
Tak więc pewne ciśnienie zewnętrzne odpowiada określonej temperaturze wrzenia. Ale to stwierdzenie można również „odwrócić”, mówiąc: każdemu punktowi wrzenia wody odpowiada jego własne ciśnienie. To ciśnienie nazywa się prężnością pary.
Krzywa przedstawiająca temperaturę wrzenia w funkcji ciśnienia jest również krzywą prężności pary w funkcji temperatury.
Liczby wykreślone na wykresie temperatury wrzenia (lub wykresie ciśnienia pary) pokazują, że ciśnienie pary zmienia się bardzo szybko wraz z temperaturą. W temperaturze 0°C (tj. 273 K) prężność pary wynosi 4,6 mm Hg. Art., w temperaturze 100 ° C (373 K) wynosi 760 mm Hg. Art., czyli zwiększa się o 165 razy. Gdy temperatura podwoi się (z 0 °C, czyli 273 K, do 273 °C, tj. 546 K), prężność pary wzrasta z 4,6 mm Hg. Sztuka. do prawie 60 atm, czyli około 10 000 razy.
Dlatego wręcz przeciwnie, temperatura wrzenia zmienia się powoli pod wpływem ciśnienia. Gdy ciśnienie zostanie podwojone z 0,5 atm do 1 atm, temperatura wrzenia wzrasta z 82°C (355 K) do 100°C (373 K), a gdy ciśnienie zostanie podwojone z 1 do 2 atm, ze 100°C (373 K) do 120°C (393 K).
Ta sama krzywa, którą teraz rozważamy, kontroluje również kondensację (zagęszczenie) pary w wodę.
Para może zostać przekształcona w wodę przez sprężanie lub chłodzenie.
Zarówno podczas wrzenia, jak i podczas kondensacji punkt nie przesunie się poza krzywą, dopóki nie zakończy się konwersja pary w wodę lub wody w parę. Można to również sformułować w następujący sposób: w warunkach naszej krzywej i tylko w tych warunkach możliwe jest współistnienie cieczy i pary. Jeśli w tym samym czasie nie będzie dodawane lub odbierane ciepło, to ilości pary i cieczy w zamkniętym naczyniu pozostaną niezmienione. Mówi się, że taka para i ciecz są w równowadze, a para w równowadze z cieczą jest nasycona.
Krzywa wrzenia i kondensacji, jak widzimy, ma inne znaczenie: jest to krzywa równowagi cieczy i pary. Krzywa równowagi dzieli pole diagramu na dwie części. Po lewej stronie i w górę (w kierunku wyższych temperatur i niższych ciśnień) znajduje się obszar pary w stanie ustalonym. W prawo iw dół - region stabilnego stanu cieczy.
Krzywa równowagi para-ciecz, tj. zależność temperatury wrzenia od ciśnienia lub tym samym prężności pary od temperatury, jest w przybliżeniu taka sama dla wszystkich cieczy. W niektórych przypadkach zmiana może być nieco bardziej gwałtowna, w innych nieco wolniejsza, ale zawsze ciśnienie pary wzrasta gwałtownie wraz ze wzrostem temperatury.
Wielokrotnie używaliśmy słów „gaz” i „para”. Te dwa słowa są prawie takie same. Możemy powiedzieć: gaz wodny to para wodna, tlen gazowy to para ciekłego tlenu. Niemniej jednak, w używaniu tych dwóch słów rozwinął się pewien nawyk. Ponieważ jesteśmy przyzwyczajeni do pewnego stosunkowo małego zakresu temperatur, zwykle używamy słowa „gaz” do tych substancji, których prężność pary w zwykłych temperaturach jest wyższa od ciśnienia atmosferycznego. Wręcz przeciwnie, mówimy o parze, gdy w temperaturze pokojowej i ciśnieniu atmosferycznym substancja jest bardziej stabilna w postaci cieczy.
Proces intensywnego parowania cieczy rozpoczyna się w temperaturze, gdy ciśnienie pary cieczy przekracza ciśnienie zewnętrzne atmosfery gazowej nad cieczą. W temperaturze wrzenia powstaje para wodna w całej masie cieczy i przepływa w prawie stałej temperaturze, aż do całkowitego przejścia cieczy (jednoskładnikowej) i pary. Poprzez sztuczne obniżenie ciśnienia możliwe jest zagotowanie cieczy w niższych temperaturach, co jest szeroko stosowane w technice, ponieważ łatwiej jest znaleźć odpowiedni materiał na sprzęt do pracy w niskich temperaturach. Nowoczesna technologia próżniowa ma do dyspozycji potężne pompy rotacyjne zdolne do wytworzenia próżni, przy której ciśnienie resztkowe nie przekracza 0,001 mmHg, oraz pompy dyfuzyjne strumieniowe, które wytwarzają próżnię do 10v-7-10v-8 mmHg. Sztuka.Destylacja próżniowa służy do uzyskiwania metali o wysokiej czystości; Zn, Cd, Mg, Ca itp. Zwykle działają pod ciśnieniem nieco wyższym niż prężność par destylowanego metalu w jego temperaturze topnienia. Następnie poprzez destylację ciekłego metalu uzyskuje się stały kondensat, co umożliwia zastosowanie bardzo prostej konstrukcji aparatu destylacyjnego pokazanego na ryc. 24. Urządzenie to cylinder, w którego dolnej części znajduje się naczynie z ciekłym metalem destylowanym. Opary kondensowane są w górnej części cylindra na specjalnym kompozytowym metalowym cylindrze (skraplaczu) w postaci krystalicznej skorupy, która po zakończeniu procesu jest usuwana wraz z kondensatorem. Przed nagrzaniem metalu najpierw powietrze jest wypompowywane z urządzenia za pomocą pompy próżniowej, a następnie co jakiś czas przywracana jest próżnia, która zmienia się na skutek wycieku powietrza z zewnątrz przez nieszczelności urządzenia. Jeśli aparat jest wystarczająco hermetyczny, to podczas procesu destylacji, ponieważ nie są uwalniane nieskraplające się gazy, ciągła praca pompy próżniowej nie jest konieczna.
Opisywane urządzenie jest niezwykle proste, wykonane jest ze stali lub żaroodpornych stopów metali. Co szczególnie ważne, jego pokrywa oraz wszystkie elementy uszczelniająco – uszczelniające są chłodzone wodą tzn. pracują w temperaturze pokojowej, co pozwala na zastosowanie bardzo zaawansowanych uszczelniaczy – gumy, kity próżniowe itp. Zastosowanie próżni pozwala na czyszczenie poprzez destylację przy stosunkowo niskie temperatury (700 -900 °) takie chemicznie aktywne i bardzo agresywne metale jak wapń, magnez, bar, których destylacja pod ciśnieniem atmosferycznym nie jest możliwa ze względu na brak możliwości doboru materiału na osprzęt.
Rozważmy cechy procesu parowania w próżni.
Diagram stanów ciecz - para ze spadkiem ciśnienia ma taki sam charakter jak diagramy dla ciśnienia atmosferycznego, jedynie linie cieczy i pary przesuwają się w rejon niższych temperatur. Wynika z tego, że skuteczność oddzielania składników podczas odparowywania ich roztworu w próżni jest w przybliżeniu taka sama jak pod ciśnieniem atmosferycznym, ale odbywa się w niższych temperaturach; temperatura jest tym niższa, im głębsza jest zastosowana próżnia. Cechą działania próżniowego jest brak porywania małych kropel cieczy wraz z oparami, co zawsze obserwuje się podczas pracy pod ciśnieniem atmosferycznym. Podczas gwałtownego wrzenia cieczy pękające bąbelki pary unoszącej się z głębi cieczy dają rozpryski, które są odprowadzane przez opary do skraplacza i zanieczyszczają destylat. W próżni (wystarczająco głębokiej) nie dochodzi do rozpryskiwania, ponieważ proces wrzenia zasadniczo różni się od wrzenia pod ciśnieniem atmosferycznym. W próżni tworzenie się pary następuje tylko na powierzchni cieczy, wewnątrz cieczy nie tworzą się pęcherzyki, powierzchnia jest spokojna, nie gotuje się, dlatego nie mogą wystąpić rozpryski. Dlatego destylacja próżniowa daje czystszy destylat niż destylacja atmosferyczna.
Posłużmy się przykładem, aby pokazać specyfikę procesu wrzenia w próżni. W jednym przypadku woda w naczyniu o grubości warstwy 250 mm zagotować się pod ciśnieniem atmosferycznym (760 mm Hg). Wówczas para uwalniana z powierzchni wody, aby pokonać ciśnienie zewnętrzne, musi mieć ciśnienie atmosferyczne (760 mm Hg), które rozwija się przy temperaturze powierzchni wody 100°. Pęcherzyk pary powstający na dnie naczynia musi mieć wyższe ciśnienie, ponieważ oprócz ciśnienia atmosferycznego musi pokonać ciśnienie hydrostatyczne słupa wody o wysokości 250 mm, co odpowiada nadciśnieniu 18 mm Hg. Sztuka. Zatem para uwalniana z dna naczynia musi mieć ciśnienie 760 + 18 = 778 mm Hg. Art., co odpowiada temperaturze wody na dnie naczynia 100,6 °. Tak niewielkie przegrzanie wody na dnie (0,6°) jest całkiem realne, a proces wrzenia przebiega tak, że w całej masie warstwy powstaje para. Woda wrze energicznie i rozpryskuje się, gdy bąbelki pękają na powierzchni.
Rozważmy teraz gotowanie tej samej warstwy wody w próżni 4,58 mm Hg. Sztuka. Do wrzenia warstwa powierzchniowa wody musi mieć temperaturę 0 °, w której prężność pary nasyconej wynosi 4,58 mm Hg. Sztuka. Pęcherzyk tworzący się na dnie musi pokonać ciśnienie hydrostatyczne słupa wody o wartości 250 mm, co odpowiada ciśnieniu 18 mm Hg. Art. i mają całkowite ciśnienie 4,58 + 18 = 22,58 mm Hg. Sztuka. Taką prężność pary nasyconej będzie miała woda w temperaturze ~23 °, tj. aby na dnie naczynia utworzył się pęcherzyk pary, konieczne jest, aby miała na dnie temperaturę 23 °. Nie da się uzyskać takiej różnicy między temperaturami przy dnie i na powierzchni, ponieważ zapobiegną temu prądy konwekcyjne. Dzięki temu w głębi warstwy cieczy nie będą się tworzyć pęcherzyki, a parowanie będzie odbywać się tylko z powierzchni cieczy.
Stopione metale mają wysoką przewodność cieplną, co zapobiega miejscowemu przegrzaniu cieczy, a w konsekwencji zagotowaniu z tworzeniem się pęcherzyków.
Dopóki ciśnienie w urządzeniu nie stanie się bardzo małe, następuje wymiana cząsteczek między powierzchnią cieczy a parą i ustala się ruchoma równowaga ciecz-para. Do skraplacza przepływa konwencjonalny gazowy strumień pary, a wyniki procesu destylacji określa wykres stanu ciecz-para.
Jeżeli ciśnienie w aparacie jest tak niskie, że średnia swobodna droga cząsteczek staje się większa niż wymiary aparatu, charakter procesu destylacji zmienia się radykalnie.
W tych warunkach nie dochodzi do wymiany cząsteczek między parami a cieczą, ruchoma równowaga ciecz-para nie jest ustalana, a diagram stanu ciecz-para nie opisuje procesu parowania. Zwykłe strupy gazowe między parownikiem a skraplaczem. Powstaje, cząsteczki pary oddzielone od powierzchni cieczy podążają prostą drogą, nie zderzając się z innymi cząsteczkami, opadają na zimną powierzchnię skraplacza i tam pozostają - kondensują; proces parowania jest całkowicie nieodwracalny i ma charakter parowania molekularnego. O wyniku destylacji decyduje szybkość parowania, która zależy od rodzaju odparowanej substancji i temperatury i jest niezależna od ciśnienia zewnętrznego w układzie, jeśli ciśnienie to jest wystarczająco niskie. Szybkość parowania w tych warunkach można obliczyć za pomocą wzoru Langmuira:
Przyjmując jako szybkość parowania masę substancji parującej na sekundę z powierzchni jednostkowej, wyrażając prężność pary p w milimetrach słupa rtęci i zastępując wartości R i π ich wartościami liczbowymi, otrzymujemy równanie (III, 13 ) w innej formie, wygodnej do praktycznych obliczeń:
W przypadku odparowywania molekularnego substancje o tej samej prężności pary mogą być oddzielane, jeśli ich masy cząsteczkowe są różne, jak wykazały eksperymenty z rozdzielaniem izotopów.
17.10.2019
W segmencie rosyjskim kwitnie biznes Hoffmann-group. Partnerom grupy firm udaje się z roku na rok zwiększać wielkość sprzedaży w Federacji Rosyjskiej....
17.10.2019
Plastik to praktyczny i tani materiał. To jest powód jego szerokiego zastosowania w produkcji rzeczy. Ma jednak również wady...
17.10.2019
Stal nierdzewna znajduje szerokie zastosowanie w różnych dziedzinach przemysłu i budownictwa. Walcowany metal i produkty z niego są wykorzystywane przez przedsiębiorstwa stoczniowe i ...
17.10.2019
Drut dziewiarski to materiał budowlany w postaci cienkiej nici, do produkcji którego używana jest stal niskowęglowa walcowana, poddawana...
17.10.2019
Panele korkowe wykonane są z naturalnego materiału. W tym celu stosuje się korę dębu (dąb korkowy rośnie w północnej Afryce i na niektórych obszarach południowego ...
17.10.2019
Działalność gospodarcza człowieka często wzmaga proces naturalnej erozji gleby. Rzeźba stopniowo się zmienia, powstają kanały, zmienia się kierunek rzeki, rowy...
17.10.2019
Funkcje etykiet mogą się różnić. Po naklejeniu na produkt stają się źródłem danych o producencie i produktach, służą do promocji i...
Odparowanie
Odparowanie nad kubkiem herbaty
Odparowanie- proces przejścia substancji ze stanu ciekłego do stanu gazowego, zachodzący na powierzchni substancji (pary). Proces parowania jest odwrotnością procesu kondensacji (przejście z pary do cieczy). Odparowanie (odparowanie), przejście substancji z fazy skondensowanej (stałej lub ciekłej) w gazową (parę); przejście fazowe pierwszego rzędu.
W wyższej fizyce istnieje bardziej szczegółowa koncepcja parowania.
Odparowanie- jest to proces, w którym cząstki (cząsteczki, atomy) wylatują (odrywają się) z powierzchni cieczy lub ciała stałego, natomiast E k > E p.
ogólna charakterystyka
Parowanie ciała stałego nazywamy sublimacją (sublimacją), a parowanie w objętości cieczy nazywamy wrzeniem. Zwykle przez parowanie rozumie się parowanie na swobodnej powierzchni cieczy w wyniku ruchu termicznego jej cząsteczek w temperaturze poniżej temperatury wrzenia odpowiadającej ciśnieniu ośrodka gazowego znajdującego się nad określoną powierzchnią. W tym przypadku cząsteczki o wystarczająco dużej energii kinetycznej uciekają z powierzchniowej warstwy cieczy do ośrodka gazowego; niektóre z nich są odbijane i wychwytywane przez ciecz, podczas gdy reszta jest przez nią bezpowrotnie tracona.
Parowanie jest procesem endotermicznym, w którym pochłaniane jest ciepło przemian fazowych – ciepło parowania zużyte na pokonanie sił kohezji molekularnej w fazie ciekłej oraz na pracę rozprężania podczas przemiany cieczy w parę. Ciepło właściwe parowania odnosi się do 1 mola cieczy (ciepło molowe parowania, J/mol) lub do jednostki masy (ciepło masy parowania, J/kg). Szybkość parowania jest określona przez gęstość powierzchniową strumienia pary jп, przenikającego w jednostce czasu do fazy gazowej z jednostki powierzchni cieczy [w mol / (s.m 2) lub kg / (s.m 2)]. Największą wartość jp osiąga się w próżni. W obecności stosunkowo gęstego ośrodka gazowego nad cieczą parowanie spowalnia ze względu na fakt, że szybkość usuwania cząsteczek pary z powierzchni cieczy do ośrodka gazowego staje się mała w porównaniu z szybkością ich emisji przez ciecz . W tym przypadku w pobliżu granicy faz tworzy się warstwa mieszaniny para-gaz, praktycznie nasycona parą. Ciśnienie cząstkowe i stężenie pary w tej warstwie jest wyższe niż w masie mieszaniny para-gaz.
Proces parowania zależy od intensywności ruchu termicznego cząsteczek: im szybciej poruszają się cząsteczki, tym szybciej następuje parowanie. Ponadto ważnymi czynnikami wpływającymi na proces parowania są szybkość dyfuzji zewnętrznej (w stosunku do substancji), a także właściwości samej substancji. Mówiąc najprościej, przy wietrze parowanie następuje znacznie szybciej. Jeśli chodzi o właściwości substancji, na przykład alkohol odparowuje znacznie szybciej niż woda. Ważnym czynnikiem jest również powierzchnia cieczy, z której następuje parowanie: z wąskiej karafki będzie przebiegać wolniej niż z szerokiej płyty.
Poziom molekularny
Rozważ ten proces na poziomie molekularnym: cząsteczki, które mają wystarczającą energię (prędkość), aby przezwyciężyć przyciąganie sąsiednich cząsteczek, wyłamują się z granic substancji (cieczy). W tym przypadku ciecz traci część swojej energii (schładza się). Na przykład bardzo gorąca ciecz: dmuchamy na jej powierzchnię, aby ją schłodzić, jednocześnie przyspieszając proces parowania.
Równowaga termodynamiczna
Naruszenie równowagi termodynamicznej między cieczą i parą zawartą w mieszaninie gaz-para tłumaczy się skokiem temperatury na granicy faz. Jednak skok ten można zwykle pominąć i można przyjąć, że ciśnienie cząstkowe i stężenie pary na granicy faz odpowiadają ich wartościom dla pary nasyconej w temperaturze powierzchni cieczy. Jeżeli ciecz i mieszanina gazowo-parowa są nieruchome, a wpływ w nich konwekcji swobodnej jest znikomy, usuwanie pary powstałej podczas parowania z powierzchni cieczy do ośrodka gazowego następuje głównie w wyniku dyfuzji molekularnej i pojawienie się masowego (tzw. Stefana) przepływu mieszaniny parowo-gazowej skierowanej z powierzchni cieczy do ośrodka gazowego (patrz Dyfuzja). Rozkład temperatury w różnych trybach chłodzenia cieczą wyparną. Przepływy ciepła kierowane są: a - z fazy ciekłej na powierzchnię parowania do fazy gazowej; b - od fazy ciekłej tylko do powierzchni parowania; c - do powierzchni parowania od strony obu faz; d - do powierzchni parowania tylko od strony fazy gazowej.
Baro-, dyfuzja termiczna
Efekty dyfuzji baro- i termicznej zwykle nie są uwzględniane w obliczeniach inżynierskich, ale efekt dyfuzji termicznej może być znaczący przy dużej niejednorodności mieszaniny gazowo-parowej (z dużą różnicą mas molowych jej składników) i znaczne gradienty temperatury. Gdy jedna lub obie fazy poruszają się względem ich powierzchni międzyfazowej, wzrasta rola konwekcyjnego transferu materii i energii mieszaniny para-gaz i cieczy.
W przypadku braku zasilania układu ciecz-gaz z zewn. źródła ciepła Parowanie może być dostarczane do warstwy powierzchniowej cieczy z jednej lub obu faz. W przeciwieństwie do wynikowego przepływu substancji, który zawsze jest kierowany podczas parowania z cieczy do ośrodka gazowego, przepływy ciepła mogą mieć różne kierunki w zależności od stosunku temperatur masy cieczy tl, granicy faz tgr i medium gazowe tg. W przypadku kontaktu pewnej ilości cieczy z półnieskończoną objętością lub przepływem czynnika gazowego myjącego jej powierzchnię i przy temperaturze cieczy wyższej od temperatury gazu (tl > tgr > tg) następuje przepływ ciepła od strony ciecz do interfejsu: (Qlg = Qzh - Qi, gdzie Qi to ciepło parowania, Qzhg to ilość ciepła przekazana z cieczy do medium gazowego. W tym przypadku ciecz jest schładzana (tzw. chłodzenie wyparne Jeśli w wyniku takiego chłodzenia zostanie osiągnięta równość tgr \u003d tg, przenoszenie ciepła z cieczy do zatrzymuje się gaz ( Qzhg = 0), a całe ciepło dostarczane od strony cieczy do interfejsu jest zużywane na parowanie (Ql = Qi).
W przypadku ośrodka gazowego, który nie jest nasycony parą, ciśnienie cząstkowe tego ostatniego na granicy faz i przy Ql = Qi pozostaje wyższe niż w masie gazu, w wyniku czego parowanie i chłodzenie wyparne ciecz nie zatrzymuje się, a tgr staje się niższe niż tl i tg. W tym przypadku ciepło jest dostarczane do granicy faz z obu faz, aż w wyniku spadku tl zostanie osiągnięta równość tgr = tl i ustanie przepływ ciepła od strony cieczy oraz od strony czynnika gazowego Qgl staje się równy Qi. Dalsze odparowywanie cieczy następuje przy stałej temperaturze tm = tl = tgr, która nazywana jest granicą chłodzenia cieczy podczas chłodzenia wyparnego lub temperaturą mokrego termometru (ponieważ pokazuje ją mokry termometr psychrometru). Wartość tm zależy od parametrów medium gazowo-parowego oraz warunków wymiany ciepła i masy pomiędzy fazą ciekłą i gazową.
Jeżeli medium płynne i gazowe, o różnych temperaturach, znajdują się w ograniczonej objętości, która nie odbiera energii z zewnątrz i jej nie oddaje, parowanie następuje do momentu, gdy pomiędzy dwiema fazami wystąpi równowaga termodynamiczna, przy której temperatury obu faz są wyrównywane przy stałej entalpii układu, a faza gazowa jest nasycana parą wodną o temperaturze układu tad. Ta ostatnia, zwana adiabatyczną temperaturą nasycenia gazu, jest determinowana jedynie przez początkowe parametry obu faz i nie zależy od warunków wymiany ciepła i masy.
Szybkość parowania
Szybkość parowania izotermicznego [kg/(m 2 s)] z jednokierunkową dyfuzją pary do utrwalonej warstwy dwuskładnikowej mieszaniny para-gaz znajdującej się nad powierzchnią cieczy o grubości d, [m] można określić wzorem Stefana: , gdzie D jest współczynnikiem wzajemnej dyfuzji, [m 2 /z]; - para stała gazowa, [J / (kg K)] lub [m 2 / (s 2 K)]; T oznacza temperaturę mieszaniny, [K]; p jest ciśnieniem mieszaniny gaz-para, [Pa]; - prężność par na granicy faz i zewnętrznej granicy warstwy mieszaniny, [Pa].
W ogólnym przypadku (poruszająca się ciecz i gaz, warunki nieizotermiczne) w warstwie przyściennej cieczy przy granicy przejściu pędu towarzyszy przenoszenie ciepła, a w warstwie przyściennej gazu (para-gaz) mieszaniny), zachodzi wzajemne przenikanie ciepła i masy. W tym przypadku do obliczenia szybkości parowania stosuje się eksperymentalne współczynniki wnikania ciepła i masy, a w stosunkowo prostszych przypadkach przybliżone metody numerycznego rozwiązywania układu równań różniczkowych dla sprzężonych warstw granicznych fazy gazowej i ciekłej.
Intensywność wymiany masy podczas parowania zależy od różnicy potencjałów chemicznych pary na granicy faz oraz w masie mieszaniny para-gaz. Jeśli jednak można pominąć dyfuzję baro- i termiczną, to różnicę potencjałów chemicznych zastępuje się różnicą ciśnień cząstkowych lub stężeń par i przyjmuje: cp, gr - cp, osn), gdzie bp, bc - współczynnik wnikania masy, p - prężność mieszaniny, pp - ciśnienie cząstkowe par, yp = pp/p - stężenie molowe par, cp = rp/r - stężenie masowe par, rp, r - gęstości lokalne par i mieszanin; indeksy oznaczają: „gr” – na granicy faz, „główny” – w głównej. masa mieszanki. Gęstość strumienia ciepła oddanego podczas parowania przez ciecz wynosi [w J/(m2 s)]: q = azh(tl - tgr) = rjp + ag (tgr - tg), gdzie azh, ag to wymiana ciepła współczynnik od strony cieczy i gazu , [W/(m2K)]; r - parowanie ciepła, [J/kg].
Przy bardzo małych promieniach krzywizny powierzchni parowania (np. podczas parowania małych kropel cieczy) uwzględniany jest wpływ napięcia powierzchniowego cieczy, co prowadzi do tego, że prężność par równowagowych powyżej granica faz jest wyższa niż prężność par nasyconych tej samej cieczy nad płaską powierzchnią. Jeśli tgr ~ tl, to przy obliczaniu parowania można brać pod uwagę tylko wymianę ciepła i masy w fazie gazowej. Przy stosunkowo małej intensywności wymiany masy, analogia między procesami wymiany ciepła i masy jest w przybliżeniu słuszna, z czego wynika: Nu/Nu0 = Sh*/Sh0, gdzie Nu = ag l/lg to liczba Nusselta, l jest charakterystyczną wielkością powierzchni parowania, lg jest przewodnością cieplną mieszaniny para-gaz, Sh* = bpyg, grl/Dp = bccg, grl/D jest liczbą Sherwooda dla składowej dyfuzyjnej przepływu pary, Dp = D/ RpT to współczynnik dyfuzji związany z gradientem ciśnienia cząstkowego pary. Wartości bp i bc są obliczane z powyższych stosunków, liczby Nu0 i Sh0 odpowiadają jp:0 i można je wyznaczyć z danych dla oddzielnie występujących procesów wymiany ciepła i masy. Liczbę Sh0 dla całkowitego (dyfuzyjnego i konwekcyjnego) przepływu pary wyznacza się dzieląc Sh* przez molowe (yg, gr) lub masowe (sg, gr) stężenie gazu na granicy faz, w zależności od siły napędowej wnikania masy współczynnika b jest przypisane do.
Równania
Równania podobieństwa dla Nu i Sh* podczas parowania obejmują, oprócz zwykłych kryteriów (liczby Reynoldsa Re, Archimedes Ar, Prandtl Pr lub Schmidt Sc oraz parametry geometryczne), parametry uwzględniające wpływ poprzecznego przepływu pary i stopień niejednorodności mieszaniny para-gaz (stosunki mas molowych lub stałych gazowych jej składowych) na profilach, prędkościach, temperaturach lub stężeniach w przekroju warstwy przyściennej.
Przy małych jp, które nie naruszają znacząco hydrodynamicznego reżimu ruchu mieszaniny gazowo-parowej (na przykład podczas parowania wody do powietrza atmosferycznego) i podobieństwa warunków brzegowych pól temperatury i stężenia, wpływ dodatkowe argumenty w równaniach podobieństwa są nieistotne i można je pominąć, zakładając, że Nu = Sh. Kiedy mieszanki wieloskładnikowe odparowują, prawidłowości te stają się znacznie bardziej skomplikowane. W tym przypadku ciepło parowania składników mieszaniny oraz składy fazy ciekłej i parowo-gazowej, które są ze sobą w równowadze, są różne i zależą od temperatury. Gdy dwuskładnikowa mieszanina cieczy odparowuje, uzyskana mieszanina par jest stosunkowo bogatsza w bardziej lotny składnik, z wyjątkiem mieszanin azeotropowych, które odparowują w ekstremum (maksimum lub minimum) krzywych stanu jako czysta ciecz.
Projekty urządzeń
Całkowita ilość parującej cieczy wzrasta wraz ze wzrostem powierzchni kontaktu fazy ciekłej i gazowej, dlatego konstrukcja urządzeń, w których następuje parowanie, przewiduje zwiększenie powierzchni parowania poprzez utworzenie dużego lustra cieczy, rozbijając ją na strumienie i krople lub tworzące cienkie warstwy spływające po powierzchni dysz. Wzrost intensywności wymiany ciepła i masy podczas parowania uzyskuje się również poprzez zwiększenie prędkości ośrodka gazowego względem powierzchni cieczy. Jednak zwiększenie tej prędkości nie powinno prowadzić do nadmiernego porywania cieczy przez ośrodek gazowy i znacznego wzrostu oporów hydraulicznych aparatu.
Podanie
Odparowanie jest szeroko stosowane w praktyce przemysłowej do czyszczenia substancji, suszenia materiałów, rozdzielania mieszanin płynnych i klimatyzacji. Chłodzenie wyparne wody jest stosowane w systemach zaopatrzenia przedsiębiorstw w wodę obiegową.
Zobacz też
Literatura
- // Słownik encyklopedyczny Brockhausa i Efrona: W 86 tomach (82 tomy i 4 dodatkowe). - Petersburg. , 1890-1907.
- Berman L.D., Chłodzenie wyparne wody obiegowej, wyd. 2, M.-L., 1957;
- Fuchs N.A., Odparowanie i wzrost kropli w środowisku gazowym, M., 1958;
- Byrd R., Stuart W., Lightfoot E., Transfer Phenomena, przeł. z angielskiego, M., 1974;
- Berman L.D., „Teoretyczne podstawy chemii. technologie”, 1974, t. 8, nr 6, s. 811-22;
- Sherwood T., Pigford R., Wilkie C., Transfer masy, przeł. z ang., M., 1982. L.D. Berman.
Spinki do mankietów
Fundacja Wikimedia. 2010 .
Synonimy:Zobacz, co „parowanie” znajduje się w innych słownikach:
Przejście w va ze stanu skupienia ciekłego lub stałego do stanu gazowego (pary). I. jest zwykle rozumiany jako przejście cieczy w parę, które zachodzi na swobodnej powierzchni cieczy. I. ciała stałe tzw. sublimacja lub sublimacja. Zależność od ciśnienia ... ... Encyklopedia fizyczna
Parowanie zachodzące na swobodnej powierzchni cieczy. Odparowywanie z powierzchni ciała stałego nazywamy sublimacją... Wielki słownik encyklopedyczny
SPALANIE CIECZY
Spalanie cieczy charakteryzuje się dwoma powiązanymi ze sobą zjawiskami - parowaniem i spalaniem mieszaniny para-powietrze nad powierzchnią cieczy. W konsekwencji spalaniu cieczy towarzyszy nie tylko reakcja chemiczna (utlenianie, przekształcenie w spalanie płomieniowe), ale także zjawiska fizyczne (parowanie i tworzenie mieszaniny para-powietrze nad powierzchnią cieczy), bez których spalanie jest niemożliwe.
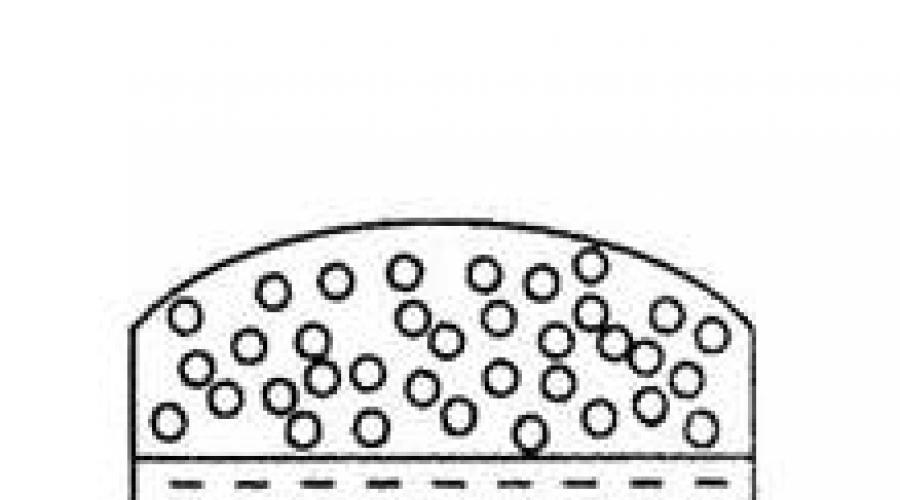
Nazywa się przejście substancji ze stanu ciekłego do stanu pary odparowanie. Istnieją dwie formy tego procesu: parowanie i gotowanie. Odparowanie- jest to przejście cieczy w parę ze swobodnej powierzchni w temperaturze poniżej temperatury wrzenia cieczy (patrz ryc. 4.1). Parowanie następuje w wyniku ruchu termicznego cząsteczek cieczy. Szybkość ruchu cząsteczek jest bardzo zróżnicowana, silnie odbiegając w obu kierunkach od średniej wartości. Część cząsteczek o wystarczająco dużej energii kinetycznej ucieka z powierzchniowej warstwy cieczy do ośrodka gazowego (powietrza). Nadmiar energii cząsteczek traconych przez ciecz jest wydatkowany na pokonanie sił oddziaływania między cząsteczkami i pracy rozprężania (wzrostu objętości) podczas przejścia cieczy w parę. Wrzenie- jest to parowanie nie tylko z powierzchni, ale także z objętości cieczy poprzez tworzenie w całej objętości pęcherzyków pary i ich uwalnianie. Parowanie obserwuje się w dowolnej temperaturze cieczy. Wrzenie następuje tylko w temperaturze, w której prężność pary nasyconej osiąga wartość ciśnienia zewnętrznego (atmosferycznego).
Ze względu na ruchy Browna w strefie gazowej zachodzi również proces odwrotny - kondensacja. Jeżeli objętość nad cieczą jest zamknięta, to w dowolnej temperaturze cieczy ustala się dynamiczna równowaga między procesami parowania i kondensacji.
Para w równowadze z cieczą nazywana jest parą nasyconą. Stan równowagi odpowiada stężeniu pary wyznaczonemu dla danej temperatury. Nazywa się ciśnienie pary w równowadze z cieczą ciśnienie pary nasyconej.

Ryż. 4.1. Schemat parowania cieczy w: a) naczyniu otwartym, b) naczyniu zamkniętym
Prężność pary nasyconej (p n.p.) danej cieczy w stałej temperaturze jest dla niej stała i niezmienna. Wartość prężności pary nasyconej zależy od temperatury cieczy: wraz ze wzrostem temperatury wzrasta prężność pary nasyconej. Wynika to ze wzrostu energii kinetycznej cząsteczek cieczy wraz ze wzrostem temperatury. W tym przypadku coraz większa część cząsteczek okazuje się mieć energię wystarczającą do przejścia w parę.
Zatem nad powierzchnią (zwierciadłem) cieczy zawsze istnieje mieszanina para-powietrze, która w stanie równowagi charakteryzuje się ciśnieniem nasyconych par cieczy lub ich stężeniem. Wraz ze wzrostem temperatury prężność pary nasyconej wzrasta zgodnie z równaniem Claiperona-Clasiusa:
 , (4.1)
, (4.1)
lub w formie integralnej:
 , (4.2)
, (4.2)
gdzie p n.p. – ciśnienie pary nasyconej, Pa;
DH isp to ciepło parowania, ilość ciepła niezbędna do przekształcenia jednostki masy cieczy w stan pary, kJ / mol;
T to temperatura cieczy, K.
Stężenie pary nasyconej C nad powierzchnią cieczy związane jest z jej ciśnieniem zależnością:
 . (4.3)
. (4.3)
Z (4.1 i 4.2) wynika, że wraz ze wzrostem temperatury cieczy ciśnienie par nasyconych (lub ich stężenie) rośnie wykładniczo. W związku z tym, w określonej temperaturze, nad powierzchnią cieczy powstaje stężenie pary, równe dolnej granicy stężenia rozprzestrzeniania się płomienia. Temperatura ta nazywana jest dolną granicą temperatury propagacji płomienia (LTLP).
Dlatego dla każdej cieczy zawsze istnieje taki przedział temperatur, w którym stężenie par nasyconych nad lustrem będzie w obszarze zapłonu, tj. HKPRP £ j n £ VKPRP.
Aby wyregulować ciśnienie parowania, użyj regulatora KVP, który jest zainstalowany na przewodzie ssawnym za parownikiem (rys. 6.13).
Oprócz swojej głównej funkcji, regulator ciśnienia parowania zapewnia ochronę w przypadku silnego spadku ciśnienia parowania, aby zapobiec zamarzaniu schłodzonej wody na ścieżce wymiany ciepła parowników agregatów wody lodowej.
Regulator działa w następujący sposób: gdy ciśnienie wzrośnie powyżej ustawionego ciśnienia regulator otwiera się, a gdy ciśnienie spada poniżej ustawionej wartości zamyka się. Sygnałem sterującym jest tylko ciśnienie na wlocie do regulatora.
W instalacjach z kilkoma parownikami i pracujących przy różnych ciśnieniach parowania regulator montowany jest za parownikiem, w którym ciśnienie jest najwyższe. Aby uniknąć kondensacji czynnika chłodniczego podczas postojów, zawór zwrotny jest montowany na linii ssawnej bezpośrednio za parownikiem z minimalnym ciśnieniem. W instalacjach z równoległymi parownikami i wspólną sprężarką, na linii ssawnej instalowany jest regulator w celu utrzymania takiego samego ciśnienia w parownikach.
Oprócz tego typu regulatora ciśnienie parowania jest stabilizowane za pomocą elektronicznych układów sterowania dla jednej lub kilku komór chłodniczych, szaf itp., zapewniając wysoką dokładność utrzymywania zadanej temperatury (±0,5 K) w szerokim zakresie wydajności chłodniczej - od 10 do 100% wartości nominalnej .
8. Regulatory wydajności.
Regulatory wydajności (rys. 6.14) pomagają dostosować wydajność chłodniczą sprężarki do zmian obciążenia cieplnego parownika w instalacjach o bardzo niskim ładunku czynnika chłodniczego. Unikają niskiego ciśnienia ssania i bezużytecznych rozruchów.

Wraz ze spadkiem obciążenia cieplnego parownika spada ciśnienie ssania, powodując podciśnienie w obwodzie, co prowadzi do niebezpieczeństwa przedostania się wilgoci do instalacji. Gdy ciśnienie ssania spadnie poniżej ustawionej wartości, regulator otwiera się powodując przejście pewnej ilości gorących gazów z wylotu do ssania. W rezultacie wzrasta ciśnienie ssania i spada wydajność chłodnicza. Regulator reaguje tylko na ciśnienie w przewodzie ssawnym tj. przy wyjściu z niego.
9. Uruchamianie regulatorów.
Regulatory rozruchu zapobiegają pracy i rozruchowi sprężarki przy zbyt wysokich wartościach ciśnienia ssania, które występują po długim postoju maszyny lub po rozmrożeniu parownika.
Regulator rozruchowy KVL należy do typu regulatorów ciśnienia dławiącego „po sobie”. Utrzymuje stałe ciśnienie w przewodzie ssawnym pomiędzy regulatorem a sprężarką i odciąża sprężarkę podczas rozruchu.
Ciśnienie wlotowe regulatora działa na mieszek od dołu i na płytę zaworu od góry. Ponieważ efektywna powierzchnia mieszka jest równa powierzchni kryzy, ciśnienie wlotowe jest neutralizowane. Ciśnienie wylotowe (w skrzyni korbowej) działa od dołu na płytkę zaworową, przeciwdziałając sile naciągu regulowanej sprężyny. Te dwie siły to siły działające regulatora. Gdy regulowane ciśnienie na wylocie (w skrzyni korbowej) spada, zawór otwiera się, przepuszczając parę czynnika chłodniczego do sprężarki. W przypadku układów chłodniczych o dużej pojemności możliwy jest montaż równoległy rozruszników KVL. W takim przypadku regulatory są wybierane z warunku takiego samego spadku ciśnienia w każdym rurociągu i równoważnej wydajności. 
Regulator nastawia się na wartości maksymalne, nie przekraczając jednak wartości zalecanych przez producenta dla sprężarki lub agregatu skraplającego. Ustawienie odbywa się zgodnie z odczytami manometru na przewodzie ssawnym sprężarki.
Regulator startu jest zainstalowany na linii ssawnej między parownikiem a sprężarką (rys. 6.15).
W regulatorze tym istnieje możliwość podłączenia przewodu odciągu oparów poprzez wylot manometryczny na rurze wlotowej o średnicy otworu 1/4". Przy takim sposobie regulacji odciąg oparów odbywa się „po sobie".
Wybór regulatora rozruchu zależy od pięciu głównych wskaźników:
Rodzaj czynnika chłodniczego
wydajność systemu,
ciśnienie projektowe ssania,
Maksymalne ciśnienie projektowe,
spadek ciśnienia w regulatorze.
Różnica między projektowym a maksymalnym projektowym ciśnieniem ssania określa, jak długo zawór będzie się otwierał. Spadek ciśnienia na regulatorze jest ważnym czynnikiem, ponieważ straty ciśnienia w przewodzie ssawnym wpływają na wydajność maszyny. Dlatego spadek ciśnienia na regulatorze musi być ograniczony do minimum. Zazwyczaj w niskotemperaturowych układach chłodniczych spadek ciśnienia wynosi 3...7 kPa. Maksymalny spadek ciśnienia dla większości systemów chłodniczych wynosi 14 kPa.
Przy maksymalnym otwarciu zaworu regulator z jednej strony zapewnia maksymalną wydajność, a z drugiej powoduje duże straty ciśnienia, co zmniejsza wydajność układu. Dlatego spadek ciśnienia na regulatorze musi być utrzymywany na jak najniższym poziomie.