Suche ogniwo galwaniczne. Źródła prądu chemicznego - ogniwa galwaniczne
W nowoczesne warunki Najczęstszymi źródłami prądu chemicznego są ogniwa galwaniczne. Mimo swoich indywidualnych mankamentów znajdują szerokie zastosowanie w elektronice. stała praca za ich poprawę. Zasada działania ogniwa galwanicznego jest dość prosta. Blachy miedziane i cynkowe zanurzane są w wodnym roztworze kwasu siarkowego, które pełnią wówczas rolę bieguna dodatniego i ujemnego.
Zasada działania ogniwa galwanicznego
Kiedy bieguny są połączone przewodem, pojawia się najprostszy obwód elektryczny. Przepływ prądu wewnątrz elementu będzie przebiegał od ładunku ujemnego do dodatniego, czyli od płyty cynkowej do miedzianej. Ruch naładowanych cząstek wzdłuż obwodu zewnętrznego będzie się odbywał w przeciwnym kierunku.
Po odsłonięciu prąd elektryczny ruch reszt kwasu siarkowego, a także jonów wodorowych, będzie następował w różnych kierunkach. W tym przypadku wodór przenosi ładunek na blachę miedzianą, a resztę kwasu na blachę cynkową. W ten sposób napięcie zostanie utrzymane na zaciskach. W tym samym czasie na miedzianej płytce osadzają się pęcherzyki wodoru, osłabiając ogólne działanie elementu i tworząc dodatkowe napięcie. To napięcie jest znane jako polaryzacyjna siła elektromotoryczna. Aby uniknąć tego zjawiska, do kompozycji wprowadza się substancję zdolną do pochłaniania atomów wodoru i pełnienia funkcji depolaryzacji.
Ogniwa galwaniczne: zalety i wady
Do produkcji nowoczesnych ogniw galwanicznych najbardziej różne materiały. Najczęściej spotykane są materiały na bazie pierwiastków węglowo-cynkowych stosowane do paznokci.
Ich główne pozytywna jakość uważane za względnie niska cena. Jednak takie elementy mają małą moc i krótki okres trwałości. Bardzo najlepsza opcja jest użycie pierwiastków alkalicznych. Tutaj nie węgiel, ale roztwór alkaliczny działa jak elektrolit. Podczas rozładowywania nie wydziela się gaz, co zapewnia całkowitą szczelność. Pierwiastki alkaliczne różnią się bardziej długoterminowy składowanie.

Ogólna zasada działania ogniwa galwanicznego dla wszystkich ich typów jest dokładnie taka sama. Na przykład pierwiastki na bazie tlenku rtęci przypominają strukturalnie pierwiastki alkaliczne. Charakteryzują się podwyższoną odpornością na wysokie temperatury, dużą wytrzymałością mechaniczną oraz stabilną wartością napięcia. Wadą jest toksyczność rtęci, która wymaga ostrożnego obchodzenia się ze zużytymi elementami.
Ogniwa galwaniczne to dziś jedne z najpowszechniejszych ogniw chemicznych, które pomimo swoich wad są aktywnie wykorzystywane w elektrotechnice i są stale ulepszane.
Zasada działania
Najprostszy przykład działania ogniwa galwanicznego wygląda tak. Dwie płytki zanurza się w szklanym słoju z wodnym roztworem kwasu siarkowego: jedna to miedź, druga to cynk. Stają się dodatnimi i ujemnymi biegunami żywiołu. Jeśli te bieguny są połączone przewodem, okaże się najprostszy.Wewnątrz elementu prąd płynie z płytki cynkowej, która ma ładunek ujemny, do płytki miedzianej, która jest naładowana dodatnio. W obwodzie zewnętrznym ruch naładowanych cząstek nastąpi w przeciwnym kierunku.
Pod wpływem prądu jony wodorowe i reszta kwasowa kwasu siarkowego przeniosą się do różne kierunki. Wodór przekaże swoje ładunki miedzianej płycie, a kwasową pozostałość - cynkowi. Więc napięcie będzie utrzymywane na zaciskach elementu. Jednocześnie na powierzchni blachy miedzianej osadzają się pęcherzyki wodoru, co osłabia działanie ogniwa galwanicznego. Wodór tworzy wraz z metalem płyty dodatkowe napięcie, które nazywamy elektromotoryczną siłą polaryzacji. Kierunek ładunku tej EMF jest przeciwny do kierunku ładunku EMF ogniwa galwanicznego. Same bąbelki tworzą dodatkowy opór w żywiole.
Element, który rozważaliśmy, jest klasycznym przykładem. W rzeczywistości takie ogniwa galwaniczne po prostu nie są używane ze względu na dużą polaryzację. Aby temu zapobiec, podczas produkcji elementów wprowadza się do ich składu specjalną substancję, która pochłania atomy wodoru, co nazywa się depolaryzatorem. Z reguły są to preparaty zawierające tlen lub chlor.
Zalety i wady nowoczesnych ogniw galwanicznych
Nowoczesne ogniwa galwaniczne wykonane są z różnych materiałów. Najpopularniejszym i najbardziej znanym typem są pierwiastki węglowo-cynkowe stosowane w baterie palcowe. Ich zalety to względna taniość, ich wady nie długoterminowy przechowywanie i niska moc.
Więcej wygodna opcja to alkaliczne ogniwa galwaniczne. Nazywane są również manganem-cynkiem. Tutaj elektrolit nie jest suchą substancją, taką jak węgiel, ale roztworem alkalicznym. Rozładowanie takie elementy praktycznie nie wydzielają gazu, dzięki czemu można je uszczelnić. Trwałość takich elementów jest wyższa niż karbonowo-cynkowych.
Pierwiastki rtęci są podobne w budowie do pierwiastków alkalicznych. Stosowany jest tutaj tlenek rtęci. Takie źródła prądu są wykorzystywane na przykład w sprzęcie medycznym. Ich zalety to odporność na wysokie temperatury (do +50, aw niektórych modelach do +70 ˚С), stabilne napięcie, wysoka wytrzymałość mechaniczna. Wadą są toksyczne właściwości rtęci, przez co zużyte elementy należy obchodzić się bardzo ostrożnie i wysyłać do recyklingu.
W niektórych pierwiastkach do wytwarzania katod stosuje się tlenek srebra, ale ze względu na wysoki koszt metalu ich zastosowanie nie jest ekonomicznie opłacalne. Częściej spotykane są ogniwa z anodami litowymi. Wyróżniają się również wysokim kosztem, ale mają najwyższe napięcie spośród wszystkich rozważanych typów ogniw galwanicznych.
Innym rodzajem ogniw galwanicznych są ogniwa koncentracyjne. W nich proces ruchu cząstek może przebiegać z transferem jonów lub bez niego. Pierwszy typ to element, w którym dwie identyczne elektrody są zanurzone w różnych stężeniach, oddzielone półprzepuszczalną przegrodą. W takich pierwiastkach EMF powstaje dzięki temu, że jony są przenoszone do roztworu o niższym stężeniu. W elementach drugiego typu elektrody wykonane są z różne metale, a stężenie jest wyrównane dzięki procesom chemicznym zachodzącym na każdej z elektrod. te elementy są wyższe niż elementy pierwszego typu.
Ogniwa i baterie galwaniczne G. element lub para galwaniczna to urządzenie składające się z dwóch metalowe talerze(z których jeden można zastąpić koksem), zanurzony w jednej lub dwóch różnych cieczach i służący jako źródło prądu galwanicznego. Pewna liczba elementów G., połączonych ze sobą w znany sposób, tworzy baterię galwaniczną. Element, który jest najprostszy w konstrukcji, składa się z dwóch talerzy zanurzonych w glinianym lub szklanym zlewce, do której wlewa się płyn odpowiedni do rodzaju talerzy; płytki nie powinny mieć kontaktu metalicznego w cieczy. G. elementy nazywają się podstawowy, jeśli są niezależnymi źródłami prądu oraz wtórny, jeśli stają się skuteczne dopiero po mniej lub bardziej długotrwałym działaniu na nie ładujących je źródeł energii elektrycznej. Biorąc pod uwagę pochodzenie pierwiastków G., należy zacząć od kolumny Volta, przodka wszystkich kolejnych baterii galwanicznych, lub od baterii kubkowej Volta. Biegun wolta. Aby go skompilować, Volta wziął pary odmiennych metalowych kółek, złożonych lub nawet przylutowanych u podstawy, oraz tekturowe lub płócienne kółka zwilżone wodą lub roztworem żrącego potażu. Początkowo używano kubków srebrno-miedzianych, a potem najczęściej cynkowo-miedzianych. Spośród nich wykonano filar, jak pokazano na ryc. 1, a mianowicie: najpierw umieszcza się miedzianą płytkę, a na nią cynkową (lub odwrotnie), na którą nakłada się zwilżony kartonowy okrąg; stanowiło to jedną parę, na którą nałożono drugą, złożoną ponownie z kręgów miedzianych, cynkowych i kartonowych, nałożonych na siebie w tej samej kolejności, co w pierwszej parze. Kontynuując nakładanie kolejnych par w tej samej kolejności, możesz zrobić kolumnę; słup pokazany na ryc. 1, po lewej, składa się z 11 par woltów. Jeżeli słup zostanie zainstalowany na płycie z materiału izolującego, czyli nieprzewodzącego prądu elektrycznego, np. na szkle, to zaczynając od jego środka, połowa słupa (dolna na naszym rysunku) zostanie naładowana dodatnim elektryczność, a druga (górna na rysunku) - ujemna. Natężenie prądu, niedostrzegalne w środku, wzrasta w miarę zbliżania się do końców, na których jest największe. Druty są przylutowane do najniższej i najwyższej płytki; zetknięcie się wolnych końców drutów powoduje ruch dodatniej elektryczności od dolnego końca kolumny przez drut do góry i ruch ujemnej elektryczności w przeciwnym kierunku; powstaje prąd elektryczny lub galwaniczny (patrz to słowo). Volta uważał dwie płytki z różnych metali za parę i przypisywał tylko zdolność przewodzenia elektryczności cieczom (patrz Galwanizm); ale zgodnie z przyjętym później poglądem para składa się z dwóch niejednorodnych płytek i warstwy cieczy między nimi; dlatego można usunąć najwyższą i najniższą płytę słupka (rys. 1 po prawej). Taka kolumna będzie składać się z 10 par, a następnie jej najniższa płyta będzie miedziana, a najwyższa - cynk i kierunek ruchu elektryczności lub kierunek prądu galwanicznego pozostaną w niej takie same: od dolnego końca kolumna (teraz z cynku) do góry (do miedzi). Miedziany koniec słupka nazwano biegunem dodatnim, cynkowy biegun ujemny. Następnie, zgodnie z terminologią Faradaya, biegun dodatni nazywa się anoda, negatywny - katoda. Kolumna woltaiczna może być układana poziomo w rynnie, pokryta od wewnątrz izolacyjną warstwą wosku skondensowanego z harpiuszem. Teraz kolumna woltaiczna nie jest używana z powodu ogromnej pracy i czasu wymaganego do jej kompilacji i demontażu; ale w dawnych czasach używali filarów złożonych z setek i tysięcy par; w Petersburgu profesor W. Pietrow używany w latach 1801-2. podczas swoich eksperymentów z kolumną, składającą się czasem z 4200 par (patrz Galwanizm), Volta zbudował swój aparat w innej postaci, jaką jest postać późniejszych baterii. Bateria Volty (corona di tazze) składała się z kubków umieszczonych na obwodzie koła, w które ciepła woda lub roztwór soli; w każdym kubku znajdowały się dwie odmienne metalowe płytki, jedna naprzeciw drugiej. Każda płytka jest połączona drutem z niejednorodną płytką sąsiedniego kubka, dzięki czemu od jednego kubka do drugiego na całym obwodzie płytki stale naprzemiennie: cynk, miedź, potem znowu cynk i miedź itd. W miejscu, w którym koło się zamyka, w jednym kubku znajduje się blaszka cynkowa, w drugim miedź; drut łączący te skrajne płyty będzie przewodził prąd z płyty miedzianej (biegun dodatni) do płyty cynkowej (biegun ujemny). Volta uważał tę baterię za mniej wygodną niż słup, ale w rzeczywistości to forma baterii stała się powszechna. W rzeczywistości urządzenie kolumny Voltaic zostało wkrótce zmienione (Kruikshank): podłużne drewniane pudło, podzielony w poprzek płytami z miedzi i cynku, lutowanymi razem, na małe przedziały, do których wlewano ciecz, był wygodniejszy niż konwencjonalna kolumna elektroenergetyczna. Jeszcze lepsza była skrzynka, podzielona na przedziały drewnianymi poprzecznymi ściankami; Po obu stronach każdej przegrody umieszczono blachy miedziane i cynkowe, lutowane ze sobą od góry, gdzie dodatkowo pozostawiono oczko. Drewniany kij, przechodzący przez wszystkie uszy, służył do podnoszenia wszystkich talerzy z płynu lub do ich zanurzania. Elementy z jednym płynem. Niedługo potem powstały pojedyncze pary lub ogniwa, które można było połączyć w baterie. różne sposoby, którego przydatność została szczególnie wyraźnie ujawniona po wyrażeniu przez Ohma wzoru na natężenie prądu w zależności od siły elektrowzbudzającej (lub elektromotorycznej) elementów oraz od oporu napotykanego przez prąd zarówno w przewodnikach zewnętrznych, jak i wewnątrz elementów (patrz Prąd galwaniczny). Elektryczna siła wzbudzenia elementów zależy od metali i cieczy, które je tworzą, a opór wewnętrzny zależy od cieczy i wymiarów elementów. Aby zmniejszyć opór i zwiększyć natężenie prądu, konieczne jest zmniejszenie grubości warstwy cieczy między różnymi płytami i zwiększenie wymiarów zanurzonej powierzchni metalu. Odbywa się to w element wollastonu(Wollaston - według bardziej poprawnej wymowy Wolsten). Cynk jest umieszczony wewnątrz wygiętej miedzianej płyty, w którą wkłada się kawałki drewna lub korka, zapobiegając stykaniu się płyt; do każdej z płytek przylutowany jest drut, zwykle miedziany; końce tych przewodów stykają się z przedmiotem, przez który chcą przepuścić prąd płynący w kierunku od miedzi do cynku wzdłuż przewodów zewnętrznych i od cynku do miedzi wzdłuż części wewnętrzne element. Ogólnie prąd płynie w cieczy z metalu, na który ciecz działa chemicznie silniej, do drugiego, na który działa słabiej. W tym elemencie obie powierzchnie blachy cynkowej służą do przepływu energii elektrycznej; taki sposób podwojenia powierzchni jednej z płyt znalazł później zastosowanie w konstrukcji wszystkich elementów za pomocą jednej cieczy. W elemencie Wollaston stosuje się rozcieńczony kwas siarkowy, który rozkłada się pod wpływem prądu (patrz Przewodność galwaniczna); wynikiem rozkładu będzie utlenienie cynku i powstanie siarczanu cynku, który rozpuszcza się w wodzie, oraz uwolnienie wodoru na płycie miedzianej, który przechodzi z niej do stanu spolaryzowanego (patrz Polaryzacja galwaniczna i Przewodność galwaniczna), co zmniejsza aktualną siłę. Zmienności tego spolaryzowanego stanu towarzyszy zmienność natężenia prądu. Spośród wielu pierwiastków w jednym płynie nazywamy elementy multimedialne(Smee) i zielony, w pierwszym platyna lub platynowane srebro pomiędzy dwiema płytkami cynkowymi, wszystkie zanurzone w rozcieńczonym kwasie siarkowym. Działanie chemiczne jest takie samo jak w elemencie Wollaston, a platyna jest spolaryzowana przez wodór; ale prąd jest mniej zmienny. Siła elektrowzbudzania jest większa niż w przypadku miedzi i cynku. Grenet element składa się z płytki cynkowej umieszczonej między dwiema płytkami wyciętymi z koksu; płyn do tego pierwiastka przygotowywany jest według różnych receptur, ale zawsze z soli dwuchromopotasowej, kwasu siarkowego i wody. Według jednego przepisu na 2500 gramów wody trzeba wziąć 340 gramów wymienionej soli i 925 gramów kwasu siarkowego. Elektryczna siła wzbudzająca jest większa niż w elemencie Wollaston. Podczas działania elementu Grenet powstaje siarczan cynku, jak w poprzednich przypadkach; ale wodór w połączeniu z tlenem kwasu chromowego tworzy wodę; w cieczy powstaje ałun chromowy; polaryzacja jest zmniejszona, ale nie wyeliminowana. W przypadku elementu Grenet stosuje się szklane naczynie z rozszerzoną dolną częścią, jak pokazano na ryc. 7 tabel „Ogniwa i baterie galwaniczne”. Ciecz wlewa się tak bardzo, że płyta cynkowa Z, który jest krótszy niż koks Z, można było pociągnąć za dołączony do niego drążek T, wyjąć z płynu na czas, w którym element powinien pozostać nieaktywny. zaciski B, B, połączony - jeden z obrzeżem pręta T, a w konsekwencji, z cynkiem, a drugi z obrzeżem węgli, są przypisane do końców drutów przewodzących. Ani płyty, ani ich ramy nie stykają się ze sobą metalicznie; prąd przepływa przez przewody łączące przez obiekty zewnętrzne w kierunku od koksu do cynku. Element węglowo-cynkowy można stosować z roztworem soli kuchennej (w Szwajcarii do telegrafów, rozmów), a następnie jest ważny 9-12 miesięcy. bez opieki. Żywioł Lalande i Chaperon, ulepszony przez Edisona, składa się z płytki cynkowej i drugiej sprasowanej z tlenku miedzi. Ciecz - roztwór kaustycznego potasu. Działanie chemiczne - utlenianie cynku, który następnie tworzy związek z potasem; oddzielony wodór, utleniany przez tlen z tlenku cynku, jest częścią powstałej wody, a miedź jest redukowana. Opór wewnętrzny jest niewielki. Siła wzbudzająca nie została określona precyzyjnie, ale jest mniejsza niż w przypadku elementu Daniela. Elementy z dwoma płynami. Ponieważ uwolnienie wodoru na jednym z ciał stałych pierwiastków G. jest przyczyną, która zmniejsza siłę prądu (właściwie wzbudzającego elektrycznie) i czyni go niestabilnym, umieszczenie płytki, na której uwalniany jest wodór, jest tlen do połączenia go z wodorem powinien robić prąd stały. Becquerel jako pierwszy zaaranżował (1829) pierwiastek miedziano-cynkowy z dwoma płynami w wymienionym celu, gdy pierwiastki Grenet i Lalande nie były jeszcze znane. Później Daniel(1836) zaaranżował podobny element, ale wygodniejszy w użyciu. Do oddzielenia płynów potrzebne są dwa naczynia: jedno szklane lub glazurowane naczynie ceramiczne, zawiera cylindryczne, gliniane, lekko wypalone, a przez to porowate, naczynie, do którego wlewa się jeden z płynów i jeden z metali; w pierścieniowej szczelinie między dwoma naczyniami wlewa się inną ciecz, w której zanurza się płytkę z innego metalu. W elemencie Daniella cynk jest zanurzony w słabym kwasie siarkowym, a miedź w wodnym roztworze witriolu miedziowego (niebieskiego). Figa. 1 w tabeli pokazuje 3 ogniwa Daniela połączone w akumulator; wygięte z cynku cylindry umieszczone są w zewnętrznych szklanych kubkach, miedziane płytki, również w formie cylindra lub wygięte jak litera S, umieszczone są w wewnętrznych cylindrach glinianych. Można go również umieścić na odwrocie, czyli miedzi w naczyniach zewnętrznych. Prąd płynie od miedzi do cynku przez przewody zewnętrzne i od cynku do miedzi przez ciecz w samym ogniwie lub samym akumulatorze, a obie ciecze rozkładają się jednocześnie: w naczyniu z kwasem siarkowym powstaje siarczan cynku, a wodór trafia na miedzianą płytkę, w tym samym czasie siarczan miedzi (CuSO 4) rozkłada się na miedź (Cu), osadza się na miedzianej płycie i nie jest oddzielnie istniejące połączenie(SO 4 ), który w procesie chemicznym tworzy wodę z wodorem, zanim zdąży się wyróżnić w postaci bąbelków na miedzi. Porowata glina, łatwo zwilżana przez obie ciecze, umożliwia przenoszenie procesów chemicznych z cząstki na cząstkę przez obie ciecze z jednego metalu do drugiego. Po działaniu prądu, którego czas trwania zależy od jego siły (a ten ostatni częściowo od oporów zewnętrznych), a także od ilości cieczy zawartych w naczyniach, cały siarczan miedzi zostaje zużyty, na co wskazuje odbarwienie jego rozwiązanie; wtedy zaczyna się oddzielanie pęcherzyków wodoru na miedzi, a jednocześnie zaczyna się polaryzacja tego metalu. Ten element nazywa się stałym, co jednak należy rozumieć względnie: po pierwsze, nawet przy nasyconym witriolu występuje słaba polaryzacja, ale najważniejsze jest to, że opór wewnętrzny elementu najpierw maleje, a następnie wzrasta. W tym drugim i główny powód stopniowy wzrost prądu obserwuje się na początku działania elementu, im bardziej znaczący, tym mniejsza siła prądu jest osłabiana przez rezystancje zewnętrzne lub wewnętrzne. Po pół godzinie, godzinie lub więcej (czas trwania wzrasta wraz z ilością płynu z cynkiem) prąd zaczyna słabnąć wolniej niż rósł, a po kilku godzinach osiąga swoją pierwotną siłę, stopniowo słabnąc dalej. Jeżeli nierozpuszczony zapas tej soli zostanie umieszczony w naczyniu z roztworem siarczanu miedzi, to kontynuuje to istnienie prądu, a także zastąpienie powstałego roztworu siarczanu cynku świeżym rozcieńczonym kwasem siarkowym. Jednak przy zamkniętym elemencie poziom cieczy stopniowo spada wraz z cynkiem, a z miedzią podnosi się - okoliczność sama w sobie osłabiająca prąd (z tego powodu ze wzrostu oporu), a ponadto wskazująca na przejście cieczy z jednego naczynia do innego (transfer jonów, patrz Przewodność galwaniczna, osmoza galwaniczna). Siarczan miedzi przedostaje się do naczynia z cynkiem, z którego cynk oddziela miedź w sposób czysto chemiczny, powodując jej wytrącanie się częściowo na cynk, częściowo na ściankach naczynia ceramicznego. Z tych powodów istnieje duże marnotrawstwo siarczanu cynku i miedzi, które są bezużyteczne dla prądu. Jednak żywioł Daniela jest jednym z najbardziej stałych. Ceramika, choć zwilżona cieczą, wykazuje dużą odporność na prąd; Używając pergaminu zamiast gliny, prąd można znacznie zwiększyć, zmniejszając opór. (element Carré); pergamin można zastąpić pęcherzem zwierzęcym. Zamiast rozcieńczonego kwasu siarkowego można użyć roztworu chlorku sodu lub sól morska; siła wzbudzająca pozostaje prawie taka sama. Nie badano działań chemicznych. Element Meidingera. Dla częstego i długotrwałego, a ponadto dość stałego, ale słabego prądu, może służyć element Meidingera (ryc. 2 tabeli), będący modyfikacją elementu Daniela. Zewnętrzna miseczka ma u góry przedłużenie, w którym na wewnętrznej stronie znajduje się cynkowy cylinder; na dnie szklanki umieszcza się drugą małą, w której umieszcza się walec zwinięty z blachy miedzianej lub na dno naczynia wewnętrznego umieszcza się miedziany okrąg, który następnie wypełnia się roztworem siarczanu miedzi. Następnie ostrożnie wylewa się na wierzch roztwór siarczanu magnezu, który wypełnia wszystko wolna przestrzeń naczynie zewnętrzne i nie wypiera roztworu witriolu, ponieważ ma większy środek ciężkości. Niemniej jednak, poprzez dyfuzję cieczy, witriol powoli dociera do cynku, gdzie oddaje miedź. Aby utrzymać nasycenie tego roztworu, wewnątrz elementu umieszcza się odwróconą szklaną kolbę z kawałkami siarczanu miedzi i wody. Przewodniki wychodzą z metali; ich części znajdujące się w płynie mają skorupkę gutaperkową. Brak glinianego słoika w żywiole pozwala na jego użycie długi czas bez zmiany jego części; ale jego wewnętrzny opór jest wielki; w kolbie nawet małego elementu umieszcza się około 1/2 kilograma witriolu. Nadaje się bardzo dobrze do telegrafów, dzwonków elektrycznych itp. i wytrzymuje miesiące. Elementy Callot i Trouvé-Callot podobne do elementów Meidingera, ale prostsze od tych ostatnich. Kresten Petersburg zorganizował także użyteczną modyfikację elementu Meidingera. Element Thomsona w formie naczynia lub tacy jest zmodyfikowany Danielevsky; porowate płaskie membrany z pergaminu oddzielają jedną ciecz od drugiej, ale można zrezygnować z membran. Element Siemens oraz Halske należy również do kategorii Danielevsky. Element Minotto. Miedziany okrąg na dole słoik, na który wylewa się kryształy siarczanu miedzi, a na wierzchu znajduje się gruba warstwa piasku krzemionkowego, na który nakłada się okrąg cynkowy. Wszystko jest wypełnione wodą. Służy od 1 1/2 do 2 lat na liniach telegraficznych. Zamiast piasku możesz wziąć proszek węgla zwierzęcego (Darsonval). Element Truve. Miedziany krąg, na którym kolumna kółek wykonana z przepuszczalnego papieru, od dołu impregnowana siarczanem miedzi, a od góry siarczanem cynku. Niewielka ilość wody zwilżająca papier aktywuje element. Opór jest dość duży, akcja długa i ciągła. Element Gaju, platynowo-cynkowy; platyna jest zanurzona w mocnym kwasie azotowym, cynk w słabym kwasie siarkowym. Wodór uwalniany pod wpływem prądu utlenia się pod wpływem tlenu z kwasu azotowego (NHO 2), który zamienia się w bezwodnik azotowy (N 2 O 4), którego emitowane czerwono-pomarańczowe opary są szkodliwe dla oddychania i psują wszystko miedziane części aparatu, które w związku z tym najlepiej wykonane są z ołowiu. Te elementy mogą być używane tylko w laboratoriach, w których są dygestorium, i w zwykły pokój należy umieścić w piecu lub kominku; mają dużą siłę wzbudzenia i niski opór wewnętrzny – wszystkie warunki dla dużej natężenia prądu, który jest tym bardziej stały, im większa objętość płynów zawartych w elemencie. Figa. 6 tabeli przedstawia taki element Płaski; na zewnątrz po prawej stronie wygięta blacha cynkowa połączona z platynową blachą elementu Z drugi element, w którego fałdzie znajduje się płaskie naczynie gliniane V dla platyny. Po lewej stronie znajduje się blacha platynowa połączona zaciskiem z cynkiem elementu i należąca do trzeciego elementu. Przy takiej postaci elementów jej opór wewnętrzny jest bardzo mały, ale silne działanie prądu nie trwa długo ze względu na niewielką ilość płynów. Prąd płynie z platyny przez zewnętrzne przewodniki do cynku, zgodnie z ogólną zasadą podaną powyżej. Element Bunsena(1843), węglowo-cynkowy, całkowicie zastępuje poprzedni i jest od niego tańszy, ponieważ kosztowną platynę zastąpiono kaflami koksowymi. Płyny są takie same jak w elemencie Grove, elektryczna siła wzbudzająca i opór są w przybliżeniu takie same; kierunek prądu jest taki sam. Taki element pokazano na ryc. 3 stoły; płytka węglowa oznaczona literą Z, z metalowym klipsem ze znakiem +; jest to dodatni biegun lub anoda elementu. Z cylindra cynkowego Z z zaciskiem (biegun ujemny lub katoda) dostarczana jest płyta z innym zaciskiem, nałożona na płytkę węglową drugiego elementu w przypadku składu baterii. Grove jako pierwszy zastąpił platynę w swoim żywiole węglem, ale jego eksperymenty zostały zapomniane. element darsonvalski, węgiel-cynk; w węglu, mieszanina azotu i kwasu solnego 1 objętość z 2 objętościami wody zawierającej 1/20 kwasu siarkowego. Element handicapowy.- Zamiast płytek koksu używa się butelki z grafitem i gliną; wlewa się do niego kwas azotowy. Ta najwyraźniej zewnętrzna zmiana w elemencie Bunsena sprawia, że stosowanie kwasu azotowego jest pełniejsze. Żywioł Sosnowskiego.- Cynk w roztworze sody kaustycznej lub potażu kaustycznego; węgiel w płynie składającym się z 1 objętości kwasu azotowego, 1 objętości kwasu siarkowego, 1 objętości kwasu solnego, 1 objętości wody. Wyróżnia się bardzo wysoką elektryczną mocą wzbudzającą. Element Callana.- Węgiel z elementów Bunsena zostaje zastąpiony żelazem; moc wzbudzenia pozostaje taka sama jak przy użyciu węgla. Żelazo nie jest narażone na działanie kwasu azotowego, będąc w stanie pasywnym. Zamiast żeliwa może być użyte żeliwo z pewną zawartością krzemu. Element Poggendorfa różni się od pierwiastka Bunsena tym, że kwas azotowy jest zastępowany płynem podobnym do zastosowanego w elemencie Greneta. Na 12 części wagowych dwuchromianu potasu rozpuszczonego w 100 częściach wody dodaje się 25 części mocnego kwasu siarkowego. Siła wzbudzająca jest taka sama jak w elemencie Bunsena; ale opór wewnętrzny jest większy. W tej cieczy jest mniej tlenu, który jest oddany do utleniania wodoru, niż w kwasie azotowym o tej samej objętości. Brak zapachu podczas używania tych elementów w połączeniu z innymi zaletami sprawił, że jest to najwygodniejsze w użyciu. Jednak polaryzacja nie jest całkowicie wyeliminowana. Element Imszenieckiego, węgiel-cynk. Płyta grafitowa (węglowa) w roztworze kwasu chromowego, cynk - w roztworze soli siarczynowo-sodowej. Duża moc wzbudzająca, niski opór wewnętrzny, prawie całkowite wykorzystanie cynku i bardzo dobre wykorzystanie kwasu chromowego. Element Leclanche, węgiel-cynk; zamiast cieczy utleniającej zawiera proszek (gruboziarnisty) nadtlenku manganu zmieszany z proszkiem koksowym (rys. 5 tabeli) w wewnętrznym, przepuszczalnym dla cieczy dzbanie glinianym, z piecem węglowym; na zewnątrz w jednym z rogów kolby o specjalnym kształcie umieszczony jest pręt cynkowy. Ciecz - wodny roztwór amoniaku - wylewa się z zewnątrz i wnika do wnętrza glinianego słoika do węgla (koksu), zwilżając nadtlenek manganu; górna część słoika jest zwykle wypełniona żywicą; otwory do uwalniania gazów. Siła wzbudzenia jest średnia między elementami Daniella i Bunsena, opór jest duży. Ten element, pozostawiony zamknięty, daje prąd o szybko malejącej sile, ale do telegrafów i użytku domowego wytrzymuje rok lub dwa lata po dodaniu płynu. Podczas rozkładu amoniaku (NH 4 Cl) chlor jest uwalniany do cynku, tworząc chlorek cynku i amoniak na węglu. Nadtlenek manganu, bogaty w tlen, stopniowo przechodzi w związek o najniższym stopniu utlenienia, ale nie we wszystkich częściach masy wypełniającej gliniane naczynie. Dla pełniejszego wykorzystania nadtlenku manganu i redukcji opór wewnętrzny elementy te układane są bez glinianej puszki, a płytki są prasowane z nadtlenku manganu i węgla, pomiędzy którymi umieszczony jest piec koksowniczy, jak pokazano na ryc. 4 stoły. Tego rodzaju elementy mogą być zamknięte i łatwe do przenoszenia; szkło zastępuje guma rogowa. Geff również zmodyfikował ten pierwiastek, zastępując roztwór amoniaku roztworem chlorku cynku. Element Marie Devi, węgiel-cynk, zawiera na węglu pastowatą masę siarczanu rtęciowego (Hg 2 SO 4) zwilżoną wodą, umieszczoną w porowatym glinianym słoiku. Słaby kwas siarkowy lub nawet wodę wylewa się na cynk, ponieważ ten pierwszy jest już uwalniany z soli rtęci przez działanie prądu, podczas którego utlenia się wodór, a rtęć metaliczna jest uwalniana z węglem, tak że po pewnym czasie pierwiastek staje się cynk-rtęć. Elektryczna siła wzbudzająca nie zmienia się dzięki zastosowaniu czystej rtęci zamiast węgla; jest nieco większy niż w elemencie Leclanchet, opór wewnętrzny jest duży. Nadaje się do telegrafów i ogólnie do prądu przerywanego. Pierwiastki te są również wykorzystywane do celów medycznych i wolą ładować je siarczanem rtęci (HgSO 4). Wygodna do celów medycznych i innych forma tego pierwiastka to wysoki cylinder z gumy rogowej, którego górna połowa zawiera cynk i węgiel, a dolna połowa zawiera wodę i siarczan rtęci. Jeśli element jest odwrócony do góry nogami, działa iw pierwszej pozycji nie tworzy prądu. Element Varrena Delarue- cynk-srebro. Wąski srebrny pasek wystaje z cylindra ze stopionego chlorku srebra (AgCl) umieszczonego w pergaminowej tubie; cynk ma postać cienkiego pręta. Oba metale są umieszczone w szklanej rurce zamkniętej korkiem parafinowym. Ciecz - roztwór amoniaku (23 części soli na 1 litr wody). Elektryczna siła wzbudzająca jest prawie taka sama (nieco większa) jak w elemencie Daniella. Srebro metaliczne osadza się z chlorku srebra na srebrnym pasku elementu i polaryzacja nie występuje. Złożone z nich baterie służyły do eksperymentów nad przechodzeniem światła w rozrzedzonych gazach (V, Warren Delarue). Geff nadał tym elementom urządzenie ułatwiające ich przenoszenie; są używane do medycznych cewek indukcyjnych i do prądu stałego. Elementy Duchomina, Partza, Figiera. Pierwszy to węgiel cynkowy; cynk w słabym roztworze soli kuchennej, węgiel - w roztworze chlorku żelazowego. Niespójne i mało zbadane. Parz zastąpił cynk żelazem; roztwór soli kuchennej ma gęstość 1,15, roztwór chlorku żelazowego ma gęstość 1,26. Lepszy niż poprzedni, chociaż elektryczna siła wzbudzająca jest mniejsza. Figier wykorzystuje jedną ciecz w elemencie żelazo-węgiel, uzyskaną przez przepuszczenie strumienia chloru przez nasycony roztwór siarczanu żelaza. Element Niodowy, węgiel-cynk. Cynk ma postać cylindra otaczającego porowaty gliniany cylinder zawierający piec koksowniczy pokryty wybielaczem. Element zakorkowany korkiem wypełnionym woskiem; przez otwór wlewa się w nim roztwór soli kuchennej (24 części na 100 części wody). Elektryczna siła wzbudzająca jest duża; przy stałym, nieco przedłużonym działaniu na zewnętrzny mały opór szybko słabnie, ale po godzinie lub dwóch bezczynności pierwiastka osiąga poprzednią wartość. suche rzeczy. Tę nazwę można nadać pierwiastkom, w których obecność cieczy jest domniemana, gdy jest ona zasysana do porowatych ciał elementu; powinny być nazwane mokry. Należą do nich opisany powyżej miedziano-cynkowy element Trouvé oraz zmodyfikowany przez Germaina element Leclanchet. Ten ostatni wykorzystuje błonnik pozyskiwany z orzechów kokosowych; przygotowuje się z niego masę, która silnie pochłania ciecze i gazy, ma wygląd suchy i dopiero pod ciśnieniem nabiera mokrego wyglądu. Łatwo przenośny i odpowiedni do mobilnych central telegraficznych i telefonicznych. Elementy Gasnera (węgiel-cynk), w tym gips, prawdopodobnie impregnowany chlorkiem cynku lub amoniakiem (utrzymywane w tajemnicy). Siła pobudzająca jest w przybliżeniu taka sama jak w żywiole Leclanche, jakiś czas po rozpoczęciu działania tego ostatniego; opór wewnętrzny jest mniejszy niż w przypadku Leclancheta. W komorze suchej Leclanchet-Barbier szczelina pomiędzy zewnętrznym cylindrem cynkowym a wewnętrznym pustym cylindrem aglomeratu zawierającego nadtlenek manganu jest wypełniona gipsem nasyconym roztworem o nieznanym składzie. Pierwsze, dość długie testy tych elementów były dla nich korzystne. element gliceryny żelatyny Kuzniecowa jest miedź-cynk; składa się z kartonu nasączonego parafiną z dnem wyłożonym od wewnątrz i na zewnątrz cyną. Na cynę wylewa się warstwę pokruszonego siarczanu miedzi, na którą wylewa się masę żelatynowo-glicerynową zawierającą kwas siarkowy. Kiedy ta masa stwardnieje, wylewa się warstwę pokruszonego amalgamatu cynku, ponownie wypełnianą tą samą masą. Te elementy tworzą baterię niczym kolumnę woltaiczną. Przeznaczony do rozmów, telegrafów i telefonów. Ogólnie liczba różnych suchych pierwiastków jest bardzo znacząca; ale w większości, ze względu na tajny skład płynów i aglomeratów, sądy na ich temat są tylko praktyczne, a nie naukowe. Elementy o dużej powierzchni i małej odporności. W przypadkach, w których konieczne jest podgrzanie krótkich, dość grubych drutów lub płyt, jak np. przy niektórych operacjach chirurgicznych (patrz Galwanokaustyka), stosuje się elementy o dużych powierzchniach metalowych zanurzone w cieczach, co zmniejsza opór wewnętrzny, a tym samym zwiększa obecny. Metodę podwojenia powierzchni Wollaston stosuje się do kompozycji powierzchni z dużej liczby płyt, jak pokazano na ryc. 2, gdzie y, y, y- w szczelinach między płytami umieszcza się płytki z jednego metalu c, c, c, c inny metal. Wszystkie płytki są do siebie równoległe i nie stykają się, ale wszystkie o tej samej nazwie są połączone zewnętrznymi przewodami w jedną całość. Cały ten układ jest jednolity dla elementu składającego się z dwóch płyt, każda sześciokrotnie większa od powierzchni w porównaniu z pokazanymi, z grubością warstwy cieczy między płytami równą odległości między każdą z dwóch płyt pokazanych na rysunku. Już na początku tego stulecia (1822 r.) montowano urządzenia o dużej metalowej powierzchni. Wśród nich jest duży element Garé, zwany deflagratorem. Blachy cynkowe i miedziane świetna długość, oddzielone flanelą lub drewnianymi patyczkami, zwija się w lodowisko, w którym arkusze nie stykają się ze sobą metalicznie. To lodowisko zanurzone jest w wannie z płynem i daje prąd o bardzo dużej sile, działając na bardzo małe opory zewnętrzne. Powierzchnia każdego arkusza to około 50 metrów kwadratowych. stopy (4 metry kwadratowe). Obecnie na ogół starają się zmniejszyć opór wewnętrzny elementów, ale dają im szczególnie dużą powierzchnię do niektórych szczególnych zastosowań, na przykład w chirurgii do wycinania bolesnych narośli rozgrzanym drutem lub płytą, do kauteryzacji ( patrz Galwanokaustyka). Ponieważ przewodniki o niskiej rezystancji są nagrzewane, możliwe jest uzyskanie prądu dokładnie poprzez zmniejszenie rezystancji wewnętrznej. Dlatego w elementach galwanokaustycznych duża liczba płytki ułożone w taki sam sposób, jak pokazano na ryc. 2 teksty. Urządzenie nie posiada funkcji, ale jest przystosowane do wygodnego użytkowania; są to np. ogniwa węglowo-cynkowe czy baterie Chardin z płynnym chromem, stosowane w Paryżu, Lyonie, Montpellier i Brukseli. Należy zwrócić uwagę operatorów na konieczność użycia miernika prądu o bardzo niskiej rezystancji (amperomierza lub amperomierza), aby mieć pewność, że akumulator jest w dobrym stanie przed rozpoczęciem pracy. Normalne elementy muszą zachować swoją siłę elektrowzbudzeniową lub mieć stałą różnicę potencjałów tak długo, jak to możliwe, gdy są otwarte, aby służyć jako normalna jednostka miary podczas porównywania sił elektrowzbudzających ze sobą. Renier zaproponował w tym celu parę miedź-cynk, w której powierzchnia miedzi jest bardzo duża w porównaniu z cynkiem. Płyn jest roztworem 200 części suchej soli kuchennej w 1000 częściach wody. W tych warunkach polaryzacja miedzi jest bardzo słaba, jeśli element ten zostanie wprowadzony do obwodu z dużą rezystancją i na krótki czas. normalny element Latimer Clark składa się z cynku w roztworze siarczanu cynku, rtęci i soli siarczkowej rtęci (Hg 2 SO 4). normalny element Flamand, miedź-cynk, z roztworami siarczanu miedzi i siarczanu cynku o określonej, zawsze stałej gęstości. normalny element Londyńskie Biuro Poczty i Telegrafu, bardzo odpowiednia jest miedź-cynk z roztworem siarczanu cynku i kryształy siarczanu miedzi z miedzią. Informacje na temat elektrycznej siły wzbudzającej elementu Fleminga można znaleźć na tabliczce na końcu artykułu. elementy wtórne, lub akumulatory, pochodzą z drugorzędnych filarów Rittera (patrz Galwanizm), które pozostawały bez szczególnej uwagi przez 50 lat. Kolumna Rittera, składająca się z miedzianych płytek zanurzonych w jakiejś cieczy, po działaniu na nią kolumny woltatycznej uległa polaryzacji, a następnie sama mogła wytwarzać prąd, którego kierunek był przeciwny do prądu pierwotnego. W 1859 roku Plante ułożył element składający się z dwóch blach ołowianych zwiniętych w spiralę jak deflagrator Gare, bez wzajemnego kontaktu metalicznego i zanurzony w słabym kwasie siarkowym. Podłączając jedną blachę ołowianą do anody (biegun dodatni), a drugą do katody baterii złożonej z co najmniej 2 ogniw Bunsena lub Poggendorfa połączonych szeregowo, a tym samym przepuszczając prąd płynący w cieczy od ołowiu do ołowiu, powodują separację tlenu na ołowianej płycie połączonej z anodą i wodoru na blasze połączonej z katodą. Na płycie anodowej tworzy się warstwa nadtlenku ołowiu, podczas gdy płyta katodowa jest całkowicie oczyszczona z tlenków. Ze względu na niejednorodność płytek tworzą one pary o dużej sile elektrowzbudzającej, która daje prąd w kierunku przeciwnym do poprzedniego. Ogromna siła wzbudzająca, która powstaje w ogniwie wtórnym, a która jest przeciwna do tej w baterii pierwotnej, jest powodem żądania, aby to drugie było lepsze od pierwszego. Dwa elementy Poggendorffa połączone szeregowo mają moc wzbudzenia około 4 woltów, podczas gdy element Plante tylko około 2 1/2. Do ładowania 3 lub 4 elementów Plante połączonych równolegle (patrz rys. baterie galwaniczne), faktycznie 2 poprzednie pierwiastki Poggendorffa byłyby wystarczające, ale ich działanie byłoby bardzo powolne, aby utlenić tak dużą powierzchnię ołowiu; dlatego, aby jednocześnie ładować na przykład 12 elementów Plante połączonych równolegle, potrzebne jest działanie 3-4 elementów Bunsena o sile wzbudzenia 6-8 woltów przez kilka godzin. Naładowane ogniwa Plante, połączone szeregowo, wytwarzają elektryczną siłę wzbudzającą 24 V i wytwarzają więcej np. żarzenia niż ładowany akumulator, ale działanie akumulatora wtórnego będzie krótkie. Ilość energii elektrycznej wprawianej w ruch przez baterię wtórną nie jest większa niż ilość energii elektrycznej przepuszczonej przez nią z baterii głównej, ale przepuszczana przez przewody zewnętrzne przy większym napięciu lub różnicy potencjałów jest zużywana w krótszym czasie. Elementy Plante, po różnych praktycznych ulepszeniach, nazwano akumulatorami. W 1880 roku Faure wpadł na pomysł pokrycia płyt ołowianych warstwą czerwonego ołowiu, czyli gotowego tlenku ołowiu, który pod wpływem działania prądu pierwotnego jeszcze bardziej utlenił się na jednej płycie i odtlenił. Na innej. Jednak sposób mocowania czerwonego ołowiu wymagał udoskonaleń technicznych, polegających zasadniczo na zastosowaniu siatki ołowianej, w której puste komórki wypełnia się czerwonym ołowiem i masą litarską na słabym kwasie siarkowym. Akumulator Fitz-Gerald wykorzystuje płytki z tlenku ołowiu bez podstawy melicznej; ogólnie istnieje wiele systemów akumulatorów, a tutaj pokazano tylko jeden z najlepszych (rys. 8 tabeli). Ołowiana krata Hagen składa się z dwóch występów naprzeciw siebie, co zapobiega wypadaniu kawałków tlenku ołowiu z ramy; specjalnie przedstawione cięcia wzdłuż linii ab oraz płyta CD główny rysunek wyjaśnia strukturę tej ramy. Jedna rama wypełniona jest czerwonym ołowiem, druga litarką (najniższy stopień utlenienia ołowiu). Liczba nieparzysta, zwykle pięć lub siedem, płyty są połączone w taki sam sposób, jak wyjaśniono w piekle. 2; w pierwszym przypadku 3, w drugim 4 pokryte kolcami. Spośród rosyjskich techników Jabłoczkow i Chotinski skorzystali z urządzenia akumulatorowego. Te drugorzędne elementy, przedstawiające jedną techniczną niedogodność - bardzo duża waga, otrzymał różne aplikacje techniczne, nawiasem mówiąc, do domowego oświetlenia elektrycznego w przypadkach, gdy niemożliwe jest wykorzystanie do tego celu prądu stałego z prądnic. Akumulatory naładowane w jednym miejscu można przenosić w inne. Są teraz ładowane nie za pomocą podstawowych elementów, ale za pomocą dynama, zgodnie z pewnymi specjalnymi zasadami (patrz Dynamo, Oświetlenie elektryczne). Kompilacja baterii galwanicznych. Bateria składa się z elementów na trzy sposoby: 1) połączenie szeregowe, 2) połączenie równoległe, 3) połączenie z obu poprzednich. Na RYS. Tabela 1 pokazuje szeregowe połączenie 3 elementów Daniela: cynk z pierwszej pary, licząc od prawej, jest połączony Taśma miedziana z miedzią drugiej pary, cynkiem drugiej pary z miedzią trzeciej. Wolny koniec miedzi pierwszej pary to anoda lub dodatni biegun baterii; wolny koniec trzeciej pary to katoda lub ujemny biegun baterii. Do równoległego połączenia tych samych elementów konieczne jest połączenie wszystkich cynków ze sobą metalowymi taśmami i połączenie wszystkich blach miedzianych taśmami lub drutami w jedną odrębną od cynku całość; złożona powierzchnia cynku będzie katodą, złożona powierzchnia miedzi będzie anodą. Działanie takiego akumulatora jest takie samo jak działanie jednego elementu, który miałby powierzchnię trzykrotnie większą niż pojedyncze ogniwo akumulatora. Wreszcie trzeci sposób połączenia można zastosować do co najmniej 4 elementów. Łącząc je równolegle po dwa, otrzymujemy dwie złożone anody i te same dwie katody; łącząc pierwszą złożoną anodę z drugą złożoną katodą otrzymujemy baterię złożoną z dwóch elementów o podwójnej powierzchni. Cholera. 3 tekst przedstawia dwa różne złożone połączenia 8 elementów, każdy reprezentowany przez dwa koncentryczne pierścienie oddzielone czarnymi przestrzeniami. Nie wchodząc w szczegóły, zauważamy, że wygląd zewnętrzny sposób, w jaki te baterie są zbudowane, różni się od tych właśnie opisanych. W (I) 4 elementy są połączone szeregowo, ale na jednym końcu dwa skrajne cynki są połączone metalową taśmą kontrola jakości, a z przeciwnej strony dwie skrajne płyty miedziane są połączone płytą AA, która jest anodą, podczas gdy Kontrola jakości -
katoda złożonej baterii, równoważna 4 połączonym szeregowo elementom o podwójnej powierzchni. Rysunek 3 (II) przedstawia baterię równoważną dwóm poczwórnym elementom powierzchniowym połączonym szeregowo. Przypadki, w których potrzebne są baterie, które są w określony sposób skomponowane, całkowicie wyjaśnia formuła Ohma (prąd galwaniczny), przy zachowaniu wynikającej z niej zasady, że w celu uzyskania najlepsza akcja na jakimś przewodniku o określonej liczbie ogniw galwanicznych należy z nich skompletować baterię w taki sposób, aby jej rezystancja wewnętrzna była równa rezystancji przewodnika zewnętrznego lub przynajmniej, jeśli to możliwe, zbliżała się do niego. Do tego trzeba jeszcze dodać, że przy połączeniu szeregowym rezystancja wewnętrzna wzrasta proporcjonalnie do liczby połączonych par, a przy połączeniu równoległym, przeciwnie, maleje proporcjonalnie do tej liczby. Dlatego na liniach telegraficznych, które prezentują dużą odporność na prąd galwaniczny, baterie składają się z ogniw połączonych szeregowo; w operacjach chirurgicznych (galwanokaustyka) potrzebna jest bateria elementów połączonych równolegle. Przedstawiony w piekle. 3 (I) bateria reprezentuje najlepsze połączenie 8 elementów, aby oddziaływać na opór zewnętrzny dwukrotnie większy niż opór wewnętrzny pojedynczego elementu. Jeśli rezystancja zewnętrzna była czterokrotnie mniejsza niż w pierwszym przypadku, należy nadać baterii wygląd linii. 3(II). Wynika to z obliczeń z wykorzystaniem wzoru Ohma. [O ogniwach i bateriach, zobacz pracę Niodet (w tłumaczeniu na rosyjski D. Golova - " Elementy elektryczne"1891); mniej szczegółowe: "Die galvanischen Batterien", Hauck, 1883. Artykuły w czasopiśmie "Elektryczność", 1891 i 1892) Porównanie ogniw galwanicznych pomiędzy nimi. Powiązane tu uwagi zostały częściowo podane w opisie elementów. Godność ogniwa galwanicznego mierzy się siłą wytwarzanego przez nie prądu i czasem jego działania, czyli produktem pierwszej wartości przez drugą. Jeśli przyjmiemy amper jako jednostkę prądu (patrz Prąd galwaniczny) i godzinę jako jednostkę czasu, możemy zmierzyć wydajność ogniwa galwanicznego w amperogodzinach. Na przykład baterie, w zależności od wielkości, mogą dawać od 40 do 90 amperogodzin. Sposoby mierzenia pracy dostarczanej przez prąd elektryczny, równoważnej pracy tak zwanego konika parowego przez godzinę, patrz Praca, Energia prądu elektrycznego.


Ogniwo galwaniczne
Schemat ogniwa galwanicznego autorstwa Daniela-Jacobi
Ogniwo galwaniczne- w oparciu o oddziaływanie dwóch metali i (lub) ich tlenków w elektrolicie, prowadzące do pojawienia się prądu elektrycznego w obwodzie zamkniętym. Nazwany na cześć Luigiego Galvaniego.
Zjawisko występowania prądu elektrycznego w kontakcie z różnymi metalami odkrył włoski fizjolog, profesor medycyny na Uniwersytecie Bolońskim Luigi Galvani w 1786 roku. Galvani opisał skurcze mięśni tylnych nóg świeżo rozciętej żaby przyczepionej do miedzianych haczyków po dotknięciu stalowym skalpelem. Obserwacje zostały zinterpretowane przez odkrywcę jako przejaw „elektryczności zwierząt”.
Generatory elektrochemiczne (ogniwa paliwowe) to pierwiastki, w których energia chemiczna zamieniana jest na energię elektryczną. Środek utleniający i środek redukujący są przechowywane na zewnątrz ogniwa i są stale i oddzielnie dostarczane do elektrod podczas pracy. Podczas pracy ogniwa paliwowego elektrody nie są zużywane. Czynnikiem redukującym jest wodór (H2), metanol (CH3OH), metan (CH4) w stanie ciekłym lub gazowym. Czynnikiem utleniającym jest zwykle tlen z powietrza lub czysty tlen. W tleno-wodorowym ogniwo paliwowe W przypadku elektrolitu alkalicznego energia chemiczna jest przekształcana w energię elektryczną. Elektrownie są używane na statkach kosmicznych, dostarczają energię statkom kosmicznym i astronautom.
Podanie
- Baterie stosowane w systemie alarmowym, latarkach, zegarach, kalkulatorach, systemach audio, zabawkach, radioodbiornikach, sprzęcie samochodowym, pilotach.
- Baterie służą do uruchamiania silników samochodów, istnieje również możliwość wykorzystania ich jako tymczasowego źródła energii elektrycznej w miejscach oddalonych od osiedli.
- ogniwa paliwowe wykorzystywane do produkcji energii elektrycznej Elektrownie), źródła zasilania awaryjnego, zasilanie autonomiczne, transport, zasilanie pokładowe, urządzenia mobilne.
Zobacz też
Literatura
- Achmetow N.S. Chemia ogólna i nieorganiczna
- Aksenovich L. A. Fizyka w Liceum: Teoria. Zadania.
Spinki do mankietów
| Ogniwo galwaniczne | Ogniwo galwaniczne Daniela | Pierwiastek alkaliczny | | Suchy element | Stężenie pierwiastka | Element powietrzno-cynkowy | Normalny element Westona |
|---|---|
| Akumulatory elektryczne | kwas ołowiowy | Srebro-cynk | Nikiel Kadm | Wodorek niklu metalicznego | Bateria niklowo-cynkowa | Li-ion | Polimer litowy | Siarczek litowo-żelazowy | Fosforan litowo-żelazowy | Tytan litu | Wanad | Żelazo-nikiel |
| ogniwa paliwowe | Metanol bezpośredni | Tlenek stały | Alkaliczny |
| Modele | Bateria | Akumulator elektryczny | ogniwo paliwowe |
| Urządzenie | Anoda | Katoda | Elektrolit |
1. Ogniwo galwaniczne
Ogniwo galwaniczne to chemiczne źródło prądu elektrycznego nazwane na cześć Luigiego Galvaniego. Zasada działania ogniwa galwanicznego opiera się na interakcji dwóch metali przez elektrolit, co prowadzi do pojawienia się prądu elektrycznego w obwodzie zamkniętym. EMF ogniwa galwanicznego zależy od materiału elektrod i składu elektrolitu. Są to pierwotne HP, których ze względu na nieodwracalność zachodzących w nich reakcji nie można ponownie naładować.
Ogniwa galwaniczne są źródłem energii elektrycznej o pojedynczym działaniu. Odczynniki (utleniacz i reduktor) są bezpośrednio częścią ogniwa galwanicznego i są zużywane podczas jego pracy. Ogniwo galwaniczne charakteryzuje się EMF, napięciem, mocą, pojemnością i energią oddaną do obwodu zewnętrznego, a także trwałością i bezpieczeństwem środowiskowym.
EMF zależy od charakteru procesów zachodzących w ogniwie galwanicznym. Napięcie ogniwa galwanicznego U jest zawsze mniejsze niż jego EMF ze względu na polaryzację elektrod i straty rezystancyjne:
U = Ee – I(r1–r2) – ΔE,
gdzie Ee jest polem elektromagnetycznym elementu; I to aktualna siła w trybie pracy elementu; r1 i r2 są rezystancją przewodników typu I i II wewnątrz ogniwa galwanicznego; ΔЕ to polaryzacja ogniwa galwanicznego, która składa się z polaryzacji jego elektrod (anody i katody). Polaryzacja wzrasta wraz ze wzrostem gęstości prądu (i), określonej wzorem i = I/S, gdzie S jest polem przekroju elektrody, oraz ze wzrostem rezystancji układu.
Podczas pracy ogniwa galwanicznego jego EMF i odpowiednio napięcie stopniowo spadają z powodu spadku stężenia odczynników i wzrostu stężenia produktów procesów redoks na elektrodach (przypomnij sobie równanie Nernsta). Jednak im wolniej spada napięcie podczas rozładowywania ogniwa galwanicznego, tym większe możliwości jego zastosowania w praktyce. Pojemność ogniwa to całkowita ilość energii elektrycznej Q, którą ogniwo galwaniczne jest w stanie oddać podczas pracy (podczas rozładowywania). Pojemność zależy od masy odczynników przechowywanych w ogniwie galwanicznym oraz stopnia ich konwersji. Wraz ze wzrostem prądu rozładowania i spadkiem temperatury pracy elementu, zwłaszcza poniżej 0°C, zmniejsza się stopień konwersji reagentów i pojemność elementu.
Energia ogniwa galwanicznego jest równa iloczynowi jego pojemności i napięcia: ΔН = Q.U. Elementy o dużej wartości EMF, małej masie i wysoki stopień konwersja odczynników.
Trwałość to czas przechowywania danego elementu, podczas którego jego właściwości pozostają w określonych parametrach. Wraz ze wzrostem temperatury przechowywania i pracy elementu zmniejsza się jego trwałość.
Skład ogniwa galwanicznego: z reguły cynk Zn, lit Li, magnez Mg służą jako reduktory (anody) w przenośnych ogniwach galwanicznych; utleniaczami (katodami) są tlenki manganu MnO2, miedzi CuO, srebra Ag2O, siarki SO2, a także sole CuCl2, PbCl2, FeS i tlen O2.
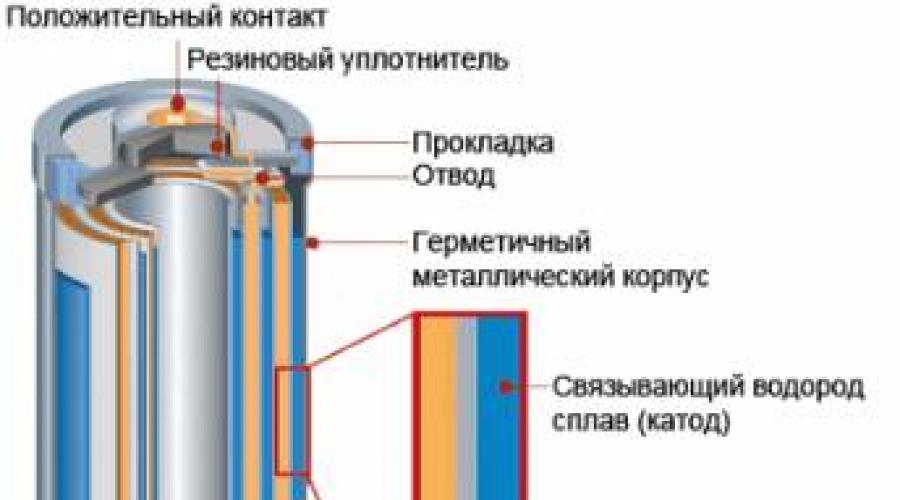
Najbardziej masywną na świecie jest produkcja elementów manganowo-cynkowych Mn-Zn, szeroko stosowanych do zasilania urządzeń radiowych, urządzeń komunikacyjnych, magnetofonów, latarek itp. Konstrukcję takiego ogniwa galwanicznego pokazano na rysunku.
Reakcje generujące prąd w tym elemencie to:
Na anodzie (–): Zn – 2ē → Zn2+ (w praktyce powłoka cynkowa korpusu komórki stopniowo się rozpuszcza);
Na katodzie (+): 2MnO2 + 2NH4+ + 2² → Mn2O3 + 2NH3 + H2O.
W przestrzeni elektrolitycznej zachodzą również następujące procesy:
Na anodzie Zn2+ + 2NH3 →2+;
Na katodzie Mn2O3 + H2O → lub 2.
W postaci molekularnej chemiczną stronę działania ogniwa galwanicznego można przedstawić za pomocą całkowitej reakcji:
Zn + 2MnO2 + 2NH4Cl → Cl2 + 2.
Schemat ogniwa galwanicznego:
(–) Zn|Zn(NH3)2]2+|||MnO2 (С) (+).
EMF takiego systemu to E = 1,25 ÷ 1,50 V.
Ogniwa galwaniczne o podobnym składzie odczynników w elektrolicie alkalicznym (KOH) mają lepszą charakterystykę wyjściową, ale nie mają zastosowania w urządzenia przenośne ze względu na zagrożenie dla środowiska. Pierwiastki srebrno-cynkowe Ag-Zn mają jeszcze korzystniejsze właściwości, ale są niezwykle drogie, a co za tym idzie nieefektywne ekonomicznie. Obecnie znanych jest ponad 40 różnych typów przenośnych ogniw galwanicznych, które w życiu codziennym nazywane są „suchymi bateriami”.
2. Baterie elektryczne
Baterie elektryczne (secondary HIT) to ładowalne ogniwa galwaniczne, które wykorzystują zewnętrzne źródło prądu ( ładowarka) można doładować.
Baterie to urządzenia, w których pod wpływem zewnętrznego źródła prądu system akumuluje się (akumuluje) energia chemiczna(proces ładowania baterii), a następnie podczas pracy urządzenia (rozładowania) energia chemiczna jest ponownie zamieniana na energię elektryczną. Tak więc podczas ładowania akumulator działa jak elektrolizer, a podczas rozładowywania działa jak ogniwo galwaniczne.
W uproszczonej formie bateria składa się z dwóch elektrod (anody i katody) oraz znajdującego się między nimi przewodnika jonowego - elektrolitu. Reakcje utleniania zachodzą na anodzie zarówno podczas rozładowywania, jak i ładowania, a reakcje redukcji zachodzą na katodzie.
Do niedawna w Rosji, a także w Naddniestrzu, najbardziej rozpowszechnione były kwasowo-ołowiowe i alkaliczne akumulatory niklowo-kadmowe i niklowo-żelazne.

Elektrody w nim to siatki ołowiane, z których jedna wypełniona jest w porach proszkiem tlenku ołowiu IV - PbO2. Elektrody są połączone z elektrolitem przez porowaty separator. Cały akumulator umieszczony jest w zbiorniku wykonanym z ebonitu lub polipropylenu.
Podczas pracy takiego urządzenia zachodzą w nim następujące procesy elektrodowe:
ALE). Rozładowanie lub eksploatacja akumulatora jako źródła energii elektrycznej.
Na anodzie: (–) Pb – 2ē → Pb2+;
na katodzie: (+) PbO2 + 4H+ + 2² → Pb2+ + 2H2O.
Tworzące się na elektrodach kationy ołowiu oddziałują z anionami elektrolitu z uwolnieniem białego osadu siarczanu ołowiu
Pb2+ + SO42– = ↓PbSO4.
Całkowita reakcja prądotwórcza procesu rozładowywania akumulatora:
Pb + PbO2 + 2H2SO4 = 2PbSO4↓ + 2H2O,
a obwód działającej baterii jako ogniwa galwanicznego ma postać (-) Pb|PbSO4||PbO2 (+).
Napięcie na zaciskach pracującego akumulatora osiąga wartość 2,0 ÷ 2,5V. Podczas pracy urządzenia następuje zużycie elektrolitu, a w układzie odkłada się osad. Gdy stężenie aktywnych jonów wodoru [H+] staje się krytyczne dla reakcji na katodzie, bateria przestaje działać.
B). Ładowanie lub przywracanie potencjału chemicznego akumulatora w celu jego późniejszego przekształcenia w energia elektryczna. W tym celu bateria jest podłączona do zewnętrznego źródła prądu w taki sposób, że biegun ujemny jest doprowadzany do zacisku „anody”, a biegun dodatni do zacisku „katody”. W takim przypadku pod działaniem napięcia zewnętrznego na elektrodach zachodzą procesy odwrotne, przywracając je do pierwotnego stanu.
Metaliczny ołów przywraca powierzchnię elektrody (–): PbSO4 + 2² → Pb + SO42;
Powstały tlenek ołowiu IV wypełnia pory sieci ołowiu (+): PbSO4 + 2H2O – 2ē → ↓PbO2 + 4H+ + SO42.
Całkowita reakcja redukcji: 2PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4.
Zakończenie procesu ładowania akumulatora można określić po pojawieniu się pęcherzyków gazu nad jego zaciskami („gotowanie”). Wynika to z występowania procesów ubocznych redukcji kationów wodorowych i utleniania wody wraz ze wzrostem napięcia podczas redukcji elektrolitu:
2Н+ + 2ē → Н2; 2Н2О – 4ē → О2 + 2Н2.
Wydajność baterii sięga 80% i napięcie robocze długi czas zachowuje swoją wartość.
Siłę emf baterii można obliczyć za pomocą równania:
RT α4(H+) α2(SO42–)
EE = EE0 + –––– ℓn –––––––––––––– (ciała stałe w komp.
2F α2(H2O) są brane pod uwagę).
Należy zauważyć, że w akumulatorze nie można stosować stężonego kwasu siarkowego (ω(H2SO4) > 30%), ponieważ jednocześnie zmniejsza się jego przewodność elektryczna i wzrasta rozpuszczalność metalicznego ołowiu. Akumulatory ołowiowe są szeroko stosowane w transport drogowy wszystkie typy, w telefonach i elektrowniach. Jednak ze względu na wysoką toksyczność ołowiu i jego produktów, akumulatory ołowiowe wymagają szczelnych opakowań i pełnej automatyzacji procesów ich eksploatacji.
A) W bateriach alkalicznych elektroda dodatnia wykonana jest z siatki niklowej impregnowanej żelopodobnym wodorotlenkiem niklu II Ni (OH) 2; i ujemny - z kadmu lub żelaza. Przewodnikiem jonowym jest 20% roztwór wodorotlenku potasu KOH. Całkowite reakcje generujące i generujące prąd w takich akumulatorach mają postać:
2NiOOH + Cd + 2H2O ◄====== 2Ni(OH)2 + Cd(OH)2; EE0 = 1,45V.
2NiOOH + Fe + 2H2O ◄====== 2Ni(OH)2 + Fe(OH)2; EE0 = 1,48V.
Zaletami tych akumulatorów jest ich długa żywotność (do 10 lat) i duża wytrzymałość mechaniczna, a wadami niska sprawność i napięcie robocze. Baterie alkaliczne są wykorzystywane do zasilania samochodów elektrycznych, ładowarek, górniczych lokomotyw elektrycznych, sprzętu łączności i elektroniki oraz radia. Przypomnijmy również, że kadm jest metalem wysoce toksycznym, co wymaga przestrzegania zasad bezpieczeństwa przy utylizacji zużytych urządzeń.
EMF i prąd. Należy pamiętać, że do akumulatora muszą być podłączone elementy o tych samych parametrach. Plan pracy Narysuj obwody zastępcze: Obwody przełączające reostatu Obwody przełączające potencjometru Schematy połączeń ogniw galwanicznych. Wniosek Na podstawie skonstruowanych obwodów i warunków każdy obwód ma swoją własną wartość pola elektromagnetycznego; w każdym obwodzie jest ona określana na różne sposoby. Odpowiedzi na...
Rozwój galwanizacji w XIX - XX wieku. pozostaje w dużej mierze otwarty. Wydaje się, że można to rozwiązać na podstawie rekonstrukcji procesu tworzenia produkcji galwanicznej; śledzenie, którym dziedzinom nauki i techniki, ich konkretnym osiągnięciom, zawdzięcza swoją kreację; uwzględnienie społeczno-ekonomicznych warunków powstawania i rozwoju galwanizacji. ...
Prąd jest niższy niż w galwanizacji; w żelaznych kąpielach galwanoplastycznych nie przekracza 10–30 A/m2, natomiast podczas prasowania (galwanizacji) gęstość prądu sięga 2000–4000 A/m2. Powłoki galwaniczne muszą mieć drobnoziarnistą strukturę i równomierną grubość w różnych miejscach powlekanych wyrobów - występach i wgłębieniach. To wymaganie jest szczególnie ważne w galwanotechnice...