ملخص الدرس تسمية وتزاوج الكحوليات. الخواص الكيميائية للكحول. العلاقة الجينية بين الكحول والهيدروكربونات. العلاقة الجينية بين الهيدروكربونات والكحولات والألدهيدات والكحولات والأحماض الكربوكسيلية
التجارب المعملية حول الموضوع: "الرابط الجيني بين الهيدروكربونات والكحول والألدهيد والأحماض"
قلل من استخدام الهيدروكربونات
من بين الهيدروكربونات المشبعة ، تتم دراسة الميثان بالتفصيل في المدرسة كمادة هي الأبسط في التركيب والهيكل ، والأكثر سهولة في الوصول إلى المعرفة العملية وذات الأهمية الاقتصادية الوطنية الكبيرة كمادة خام كيميائية ووقود.
يجب إجراء التجارب على المادة الأولى التي تمت دراستها في الكيمياء العضوية بكميات كافية وبعناية خاصة من الناحية المنهجية ، حيث يجب أن تظهر جوانب جديدة للتجربة في دراسة الكيمياء العضوية. هنا ، تجريبيًا ، سيكون من الممكن تحديد التركيب والصيغة الجزيئية للمادة ، وهي الخطوة الأولى في تحديد الصيغ الهيكليةمركبات العضوية.
ميثان.
قد يكون ترتيب التجارب مع الميثان مختلفًا. في الأساس ، سيتم تحديده من خلال ما إذا كان المعلم يبدأ الموضوع بالحصول على الميثان ثم يقوم بإجراء تجارب لدراسة خصائصه باستخدام المادة التي تم الحصول عليها في الدرس ، أو باستخدام الميثان المُعد مسبقًا من أجل متابعة تسلسل أسئلة الدراسة بوضوح - فكر أولاً في الخصائص الفيزيائية للمادة ، ثم الخصائص الكيميائية ، وتطبيق المادة ، وأخيراً إنتاجها. في الحالة الأخيرة ، سيتم تقديم تجربة الحصول على الميثان فقط في نهاية الموضوع.
الطريقة الأولى لدراسة الموضوع ، وبالتالي ، بناء تجربة أكثر تعقيدًا من الناحية المنهجية ، ولكنها أكثر اقتصادية في الوقت المناسب. ستتطلب الطريقة الثانية مزيدًا من الوقت ، لكنها أبسط من الناحية المنهجية ، علاوة على ذلك ، ذات قيمة من حيث أنها ستسمح في النهاية بتكرار وتوحيد معرفة التجارب الأساسية مع المادة عند تلقيها في الدرس.
عند دراسة الميثان ، لا توجد حاجة خاصة للتجارب المعملية. في الأساس ، يمكن اختزالها هنا فقط للحصول على الميثان وحرقه. لكن الحصول على الميثان من أسيتات الصوديوم وحرقه يمكن أن يظهر بسهولة على طاولة توضيحية.
سيكون من الأفضل بعد دراسة موضوع "الهيدروكربونات" بأكمله تقديم درس عملي خاص. في هذا الدرس ، سيقوم الطلاب بإعادة إنتاج تجربة صنع الميثان وسيكونون قادرين على التحقق من أن الميثان لا يزيل لون ماء البروم ومحلول برمنجنات البوتاسيوم.
الحصول على الميثان في المختبر. الطريقة المختبرية الأكثر ملاءمة لإنتاج الميثان هي تفاعل أسيتات الصوديوم مع الجير الصودا.
تفاعل أملاح الأحماض الكربوكسيلية مع القلويات هو بشكل عامالحصول على الهيدروكربونات. رد فعل في نظرة عامةتمثله المعادلة:
إذا كان R = CH 3 ، يتشكل الميثان.
نظرًا لأن الصودا الكاوية هي مادة استرطابية ، ويتداخل وجود الرطوبة مع الإكمال الناجح للتفاعل ، يضاف إليها أكسيد الكالسيوم. يسمى خليط الصودا الكاوية مع أكسيد الكالسيوم صودا الجير.
مطلوب تسخين قوي إلى حد ما للمسار الناجح للتفاعل ، ومع ذلك ، يؤدي ارتفاع درجة حرارة الخليط إلى عمليات جانبية وإنتاج منتجات غير مرغوب فيها ، مثل الأسيتون:
يجب تجفيف أسيتات الصوديوم قبل الاختبار. يجب أيضًا تكليس الجير الصودا قبل تحضير الخليط. إذا لم يكن هناك جير صودا جاهز ، يتم تحضيره على النحو التالي. في كوب من الحديد أو الخزف ، يُسكب الجير المكلس جيدًا CaO مع نصف كمية محلول مائي مشبع من NaOH القلوي. يتبخر الخليط حتى يجف ثم يكلس ويسحق. يتم تخزين المواد في مجفف.
لإثبات إنتاج الميثان ، من الأفضل استخدام قارورة صغيرة مع أنبوب مخرج ، ومن أجل جلسة عملية- أنبوب اختبار (شكل 1 و 2).
قم بتجميع الجهاز كما هو موضح في الشكل. 1 أو 2. يُسكب محلول قلوي في زجاجة غسيل لاحتجاز الشوائب (الشكل 1). يتم وضع خليط من أسيتات الصوديوم وجير الصودا في قارورة تفاعل أو أنبوب اختبار. للقيام بذلك ، يتم خلط المواد المقسمة جيدًا بنسبة حجم 1: 3 ، أي مع وجود فائض كبير من الجير لجعل أسيتات الصوديوم تتفاعل بشكل كامل قدر الإمكان.

أرز.

يتم تسخين القارورة بموقد من خلال شبكة الأسبستوس ، ويتم وضع أنبوب الاختبار على لهب مكشوف. يتم جمع الميثان في أنبوب اختبار وفقًا لطريقة إزاحة الماء. للتحقق من نقاء الغاز الناتج ، يُزال أنبوب الاختبار من الماء ويُشعل الغاز دون قلبه.
نظرًا لأنه لا يُنصح بقطع عملية الحصول على الميثان ، ومن المستحيل إكمال جميع التجارب الأخرى أثناء إجراء التفاعل ، يوصى بجمع الغاز لإجراء تجارب لاحقة في عدة أسطوانات (أنابيب اختبار) أو في مقياس غاز.
تُترك الأسطوانات المملوءة لفترة من الوقت في الحمام أو تُغلق تحت الماء بلوح زجاجي (الفلين) وتوضع رأسًا على عقب على المنضدة.
الميثان أخف من الهواء. للتعرف على الخصائص الفيزيائية للميثان ، يوضح المعلم اسطوانة مع الغاز المجمع. يلاحظ الطلاب أن الميثان غاز عديم اللون. يشير جمع الميثان بطريقة إزاحة الماء إلى أن هذا الغاز غير قابل للذوبان في الماء على ما يبدو. المعلم يؤكد هذا الاستنتاج.
قوارير متطابقة متوازنة على ميزان. سعة أكبر. يتم تعليق إحدى القوارير رأسًا على عقب (الشكل 3). يتم تمرير الميثان من الجهاز إلى هذه القارورة لبعض الوقت. المقاييس ترتفع. لئلا يعتقد الطلاب أن التغير في الوزن يرجع إلى ضغط تدفق الغاز في قاع القارورة ، انتبه إلى حقيقة أن عدم التوازن يبقى حتى بعد توقف مرور الميثان.
بعد إعادة الموازين إلى التوازن مرة أخرى (لهذا ، يتم قلب زجاجة الميثان رأسًا على عقب لفترة من الوقت) ، للمقارنة والاستنتاجات الأكثر إقناعًا ، يتم تمرير الميثان إلى القارورة التي تقف بشكل طبيعي على الميزان. ميزان الميزان غير مضطرب.

بعد أن أظهر أن الميثان أخف من الهواء ، أبلغ المعلم عن مقدار وزن لتر من الميثان في الظروف العادية. ستكون هذه المعلومات مطلوبة لاحقًا في اشتقاق الصيغة الجزيئية للمادة.
احتراق الميثان. بعد النظر في الخصائص الفيزيائية للميثان ، يمكن طرح مسألة ماهية الصيغة الجزيئية للميثان. يعلم المعلم أنه من أجل توضيح هذه المشكلة ، سيكون من الضروري أولاً التعرف على إحدى الخصائص الكيميائية للميثان - الاحتراق.
يمكن إظهار احتراق الميثان بطريقتين.
1. اسطوانة زجاجية(السعة ، على سبيل المثال ، 250 مل) ، مملوءة بالميثان ، توضع على المنضدة ، أزل الصفيحة منها أو افتح الفلين واشعل النار على الفور في الغاز بشظية. عندما يحترق الميثان ، ينزل اللهب إلى الأسطوانة.

لكي يظل اللهب فوق الأسطوانة طوال الوقت ويكون مرئيًا بوضوح للطلاب ، يمكن سكب الماء تدريجياً في الأسطوانة مع حرق غاز الميثان ، وبالتالي إزاحة الغاز إلى الخارج (الشكل 4).
2. يتم إشعال الميثان مباشرة في أنبوب مخرج الجهاز للحصول على الغاز أو مقياس الغاز (في كلتا الحالتين ، يكون التحقق من النقاء إلزاميًا!). يتم التحكم في حجم اللهب من خلال شدة التسخين في الحالة الأولى وارتفاع عمود السائل المزاح في الحالة الثانية. إذا تمت تنقية الميثان من الشوائب ، فإنه يحترق بلهب عديم اللون تقريبًا. للقضاء على بعض لمعان اللهب (اللون الأصفر) بسبب أملاح الصوديوم في زجاج الأنبوب ، يمكن توصيل طرف معدني بنهاية الأنبوب.
الديهايدات والكيتونات
عند دراسة الألدهيدات ، يتعرف الطلاب في التجارب على الطبيعة التدريجية للأكسدة المواد العضويةمع الكيمياء عمليات الانتاجوبمبدأ الحصول على الراتنجات الاصطناعية.
لكي يفهم الطلاب مكان الألدهيدات في سلسلة منتجات أكسدة الهيدروكربون ، عند تجميع المعادلات الكيميائية ، لا ينبغي على المرء تجنب استخدام أسماء وصيغ الأحماض التي يتم تحويل الألدهيدات إليها. يمكن إعطاء صيغ الأحماض عقائديًا مسبقًا ؛ في المستقبل ، سيتلقى الطلاب تبريرًا تجريبيًا لهم.
في دراسة الألدهيدات ، يتم إجراء معظم التجارب باستخدام الفورمالديهايد باعتباره مادة يسهل الوصول إليها في المدرسة وذات أهمية صناعية كبيرة. وفقًا لهذا ، يتم إعطاء الفورمالديهايد المكانة الرئيسية في هذا الفصل. بالنسبة للأسيتالديهيد ، يتم أخذ تفاعلات الإنتاج فقط في الاعتبار. لا يتم تدريس الكيتونات في المدرسة على وجه التحديد ؛ لذلك ، من بين هؤلاء ، يتم أخذ ممثل واحد فقط هنا - الأسيتون ، ويتم إجراء التجارب عليه بشكل أساسي نشاطات خارجيةالطلاب.
فورمالديهايد (ميثانال)
يُنصح بوضع خطة لدراسة هذه المادة بحيث يتعلم الطلاب فور التعرف على الخصائص الفيزيائية للألدهيدات كيفية الحصول عليها ، ثم الخصائص الكيميائية ، إلخ. إن التعرف المبكر قليلاً على طرق الحصول على الألدهيد سيجعل من الممكن ، عند دراسة الخصائص الكيميائية (تفاعلات الأكسدة) ، اعتبار الألدهيدات كحلقة وصل في سلسلة أكسدة الهيدروكربون.
يمكن استخدام الفورمالين كعينة عند التعرف على خصائص الفورمالديهايد. يجب أن يضمن هذا على الفور أن الطلاب يفهمون بوضوح الفرق بين الفورمالين والفورمالديهايد.
رائحة الفورمالديهايد. من بين الخصائص الفيزيائية للفورمالديهايد ، فإن التعرف على الرائحة هو الأكثر سهولة في الممارسة العملية. لهذا الغرض ، يتم توزيع أنابيب اختبار تحتوي على 0.5-1 مل من الفورمالين على طاولات الطلاب. بمجرد أن يتعرف الطلاب على الرائحة ، يمكن جمع الفورمالين واستخدامه لإجراء مزيد من التجارب. إن التعرف على رائحة الفورمالين سيمكن الطلاب من اكتشاف هذه المادة في تجارب أخرى.
قابلية الفورمالديهايد للاشتعال. يسخن الفورمالين في أنبوب اختبار ويتم إشعال الأبخرة المنبعثة منه ؛ يحترقون بلهب عديم اللون تقريبًا. يمكن رؤية اللهب إذا أشعلت النار في شظية أو قطعة من الورق بداخلها. يتم إجراء التجربة في غطاء دخان.
الحصول على الفورمالديهايد. نظرًا لأنه قبل التعرف على الخصائص الكيميائية ، لا يمكن اكتشاف الفورمالديهايد إلا عن طريق الرائحة ، يجب إجراء التجربة الأولى للحصول عليها في شكل عمل مخبري.
1. صب بضع قطرات من الميثانول في أنبوب اختبار. في لهب الموقد ، يتم لف قطعة صغيرة من شبكة نحاسية في أنبوب أو لولب سلك نحاسوخفضه بسرعة إلى ميثانول.
عندما يتكلس ، يتأكسد النحاس ويصبح مغطى بطبقة سوداء من أكسيد النحاس ، في الكحول يتم استعادته مرة أخرى ويتحول إلى اللون الأحمر:

تم الكشف عن رائحة قوية للألدهيد. إذا تكررت عملية الأكسدة 2-3 مرات ، فيمكن الحصول على تركيز كبير من الفورمالديهايد ويمكن استخدام المحلول في التجارب اللاحقة.
2. بالإضافة إلى أكسيد النحاس ، يمكن استخدام عوامل مؤكسدة أخرى مألوفة لدى الطلاب للحصول على الفورمالديهايد.
إلى محلول ضعيف من برمنجنات البوتاسيوم في أنبوب مظاهرة ، أضف 0.5 مل من الميثانول ، ويسخن الخليط حتى الغليان. تظهر رائحة الفورمالديهايد ويختفي اللون الأرجواني للبرمنجنات.
يتم سكب 2-3 مل من محلول مشبع من ثنائي كرومات البوتاسيوم K 2 Cr 2 O 7 ونفس الحجم من حمض الكبريتيك المركز في أنبوب اختبار. يضاف الميثانول بالتنقيط ويسخن الخليط بحذر شديد (وجه فتحة الأنبوب إلى الجانب!). علاوة على ذلك ، يستمر التفاعل مع إطلاق الحرارة. يختفي اللون الأصفر لخليط الكروم ويظهر اللون الأخضر لكبريتات الكروم.

لا يمكن تفكيك معادلة التفاعل مع الطلاب. كما في الحالة السابقة ، تم إبلاغهم فقط أن ثنائي كرومات البوتاسيوم يؤكسد كحول الميثيل إلى ألدهيد ، بينما يتحول إلى ملح من الكروم ثلاثي التكافؤ Cr 2 (SO 4) 3.
تفاعل الفورمالديهايد مع أكسيد الفضة(رد فعل مرآة فضية). يجب إظهار هذه التجربة للطلاب بطريقة تعمل في نفس الوقت كإرشادات للجلسة العملية اللاحقة.
الحصول على راتنجات الفينول فورمالدهايد. يستخدم الجزء الأكبر من الفورمالديهايد الذي يتم الحصول عليه في الصناعة لتخليق الفينول فورمالديهايد والراتنجات الأخرى اللازمة لإنتاج البلاستيك. يعتمد إنتاج راتنجات الفينول فورمالدهايد على تفاعل التكثيف المتعدد.
الأكثر توفّرًا بتنسيق ظروف المدرسةتخليق راتنج الفينول فورمالديهايد. أصبح الطلاب بحلول هذا الوقت على دراية بكل من المواد الأولية للحصول على الراتنج - الفينول والفورمالديهايد ؛ التجربة غير معقدة نسبيًا وتستمر بسلاسة ؛ كيمياء العملية ليست صعبة بشكل خاص على الطلاب إذا تم تصويرها على النحو التالي:

اعتمادًا على النسبة الكمية للفينول والفورمالديهايد ، وكذلك على المحفز المستخدم (الحمضي أو القلوي) ، يمكن الحصول على نوفولاك أو راتينج الراتنج. أولها هو لدن بالحرارة وله الهيكل الخطي الموضح أعلاه. والثاني هو التصلد بالحرارة ، حيث تحتوي جزيئاته الخطية على مجموعات كحول حرة - CH 2 OH ، قادرة على التفاعل مع ذرات الهيدروجين المتحركة للجزيئات الأخرى ، مما ينتج عنه بنية ثلاثية الأبعاد.
اسيتيك الديهايد (ايثانال)
بعد التعرف التفصيلي على خصائص الفورمالديهايد في هذا القسم من الموضوع ، فإن التجارب المتعلقة بإنتاج الأسيتالديهيد لها أهمية قصوى. يمكن تصميم هذه التجارب من أجل: أ) إظهار أنه يمكن الحصول على جميع الألدهيدات عن طريق أكسدة الكحولات أحادية الماء المقابلة ، ب) إظهار كيف يمكن إثبات بنية الألدهيدات تجريبياً ، ج) إدخال كيمياء الطريقة الصناعية للحصول على الأسيتالديهيد وفقًا إلى كوتشسروف.
تحضير الأسيتالديهيد بأكسدة الإيثانول. يمكن أن يؤخذ أكسيد النحاس (II) كعامل مؤكسد للكحول. يستمر التفاعل بشكل مشابه لأكسدة الميثانول:
- 1. لا يتم سكب أكثر من 0.5 مل من الكحول الإيثيلي في أنبوب اختبار ويتم غمر سلك نحاسي ساخن باللون الأحمر. تم الكشف عن رائحة الأسيتالديهيد ، التي تشبه الفاكهة ، ويلاحظ انخفاض النحاس. إذا تم أكسدة الكحول مرتين أو ثلاث مرات ، في كل مرة يتم تسخين النحاس حتى يتشكل أكسيد النحاس ، بعد ذلك ، بعد جمع الحلول التي حصل عليها الطلاب في أنابيب الاختبار ، سيكون من الممكن استخدام الألدهيد لإجراء التجارب عليه.
- 2. ضع 5 جم من ثنائي كرومات البوتاسيوم المسحوق K2Cr2O7 في دورق صغير به أنبوب تصريف ، صب 20 مل من حمض الكبريتيك المخفف (1: 5) ثم 4 مل من الكحول الإيثيلي. يتم توصيل ثلاجة بالقارورة ويتم تسخينها على لهب صغير عبر شبكة من الأسبستوس. يتم وضع مستقبل نواتج التقطير في ماء مثلج أو ثلج. يُسكب القليل من الماء في جهاز الاستقبال ويتم إنزال نهاية الثلاجة في الماء. يتم ذلك من أجل تقليل تطاير أبخرة الأسيتالديهيد (درجة حرارة الغرفة 21 درجة مئوية). جنبًا إلى جنب مع الإيثانول ، يتم تقطير كمية معينة من الماء والكحول غير المتفاعل وحمض الأسيتيك المتشكل ومنتجات ثانوية أخرى للتفاعل في المستقبل. ومع ذلك ، ليس من الضروري عزل الأسيتالديهيد النقي ، لأن المنتج الناتج يعطي أداءً جيدًا في التفاعلات المعتادة للألدهيدات. يتم تحديد وجود الألدهيد بواسطة الرائحة ورد فعل مرآة فضية.
ينجذب انتباه الطلاب إلى تغير اللون في القارورة. يصبح اللون الأخضر لكبريتات الكروم الناتجة (III) Cr 2 (SO 4) 3 مميزًا بشكل خاص إذا تم تخفيف محتويات القارورة بالماء بعد التجربة. ويلاحظ أن التغير في لون ثنائي كرومات البوتاسيوم حدث بسبب أكسدة الكحول به.
الحصول على الأسيتالديهيد عن طريق ترطيب الأسيتيلين. الاكتشاف الرائع للكيميائي الروسي M.G. Kucherov - إضافة الماء إلى الأسيتيلين في وجود أملاح الزئبق شكلت الأساس لطريقة صناعية واسعة الانتشار لإنتاج الأسيتالديهيد.
على الرغم من أهمية عظيمةوإمكانية الوصول للمدرسة ، نادرًا ما يتم عرض هذه الطريقة في فصول الكيمياء.
في الصناعة ، تتم العملية عن طريق تمرير الأسيتيلين في ماء يحتوي على أملاح الزئبق ثنائي التكافؤ وحمض الكبريتيك عند درجة حرارة 70 درجة مئوية. يتم تقطير الأسيتالديهيد المتكون في ظل هذه الظروف وتكثيفه ، وبعد ذلك يدخل أبراج خاصة للأكسدة إلى حمض الاسيتيك. يتم الحصول على الأسيتيلين من كربيد الكالسيوم بالطريقة المعتادة ويتم تنقيته من الشوائب.
الحاجة إلى تنقية الأسيتيلين والحفاظ على درجة الحرارة في وعاء التفاعل ، من ناحية ، وعدم اليقين في الحصول على المنتج المطلوب ، من ناحية أخرى ، عادة ما تقلل من الاهتمام بهذه التجربة. وفي الوقت نفسه ، يمكن إجراء التجربة بكل بساطة وموثوقية في شكل مبسط وفي ظل ظروف تقترب من الصناعية.
1. يمكن إجراء تجربة تعكس ، إلى حد ما ، شروط تنفيذ التفاعل في الإنتاج وتجعل من الممكن الحصول على محلول مركّز بدرجة كافية من الألدهيد ، في الجهاز الموضح في الشكل. 29.

المرحلة الأولى هي إنتاج الأسيتيلين. يتم وضع قطع من كربيد الكالسيوم في الدورق ويتم إضافة الماء أو محلول مشبع ببطء من قمع التنقيط. ملح الطعام. يتم ضبط سرعة التثبيت بحيث يتم إنشاء تدفق ثابت للأسيتيلين ، فقاعة واحدة تقريبًا لكل 1-2 ثانية. يتم تنقية الأسيتيلين في غسالة بمحلول من كبريتات النحاس:
CuSO 4 + H 2 S H 2 SO 4
بعد التنقية ، يتم تمرير الغاز إلى دورق بمحلول محفز (15-20 مل من الماء ، 6-7 مل من حامض الكبريتيك المركب وحوالي 0.5 جرام من أكسيد الزئبق (II). الدورق ، حيث يتم ترطيب الأسيتيلين ، يتم تسخينه بموقد (كحول) ، ويدخل الأسيتالديهيد الناتج في شكل غازي أنابيب الاختبار بالماء ، حيث يتم امتصاصه.
بعد 5-7 دقائق في أنبوب الاختبار ، من الممكن الحصول على محلول من الإيثانيل بتركيز كبير. لإكمال التجربة ، قم أولاً بإيقاف إمداد الماء لكربيد الكالسيوم ، ثم افصل الجهاز ، وبدون أي تقطير إضافي للألدهيد من دورق التفاعل ، استخدم الحلول الناتجة في أنابيب الاختبار للتجارب المقابلة.
2. في أبسط صورة ، يمكن تنفيذ تفاعل M.G. Kucherov على النحو التالي.
في دورق صغير مستدير القاع ، 30 مل من الماء و 15 مل من الماء المضغوط. حامض الكبريتيك. يبرد الخليط ويضاف إليه قليلاً (على طرف الملعقة) أكسيد الزئبق (II). يتم تسخين الخليط بعناية من خلال شبكة الأسبستوس حتى يغلي ، بينما يتم تحويل أكسيد الزئبق إلى كبريتات الزئبق (II).
الدرس: التسمية والتشابه للكحول. الخواص الكيميائية للكحول. اتصال جينيبين الكحول والهيدروكربونات.
الغرض من الدرس. لتعميق معرفة الطلاب بالتسميات المنهجية والتشابه. أظهر عمومية خصائص الكحولات أحادية الماء المشبعة ، بسبب بنية مماثلة. تطوير مفهوم التأثير المتبادل للذرات في الجزيء ، العلاقة الجينية بين المركبات العضوية ، باستخدام مثال تحويل الهيدروكربونات المشبعة إلى كحول (من خلال الاستبدال ، التبادل ، تفاعلات الإضافة).
المعدات: على طاولة العرض التوضيحي: عينات من كحول أحادي الهيدرات مشبع (ميثيل ، إيثيل (ABS) ، بوتيل (أميل) ، معدن الصوديوم ، كلوريد الصوديوم (مكلس) ، حامض الكبريتيك (conc.) ، 3 أكواب ،
يبدأ الدرس بأسئلة عن المادة التي يتم تناولها:
1) ما هي أسباب الاختلافات في الخصائص الفيزيائية للمتماثلات في سلسلة الكحوليات أحادية الماء المشبعة؟
2) ما هي الرابطة الهيدروجينية وكيف تؤثر على خواص الكحول؟
مواد جديدةالدراسة بالطريقة عمل مستقلالطلاب. نظرًا لأنهم يعرفون التسمية والتشابه للهيدروكربونات ومشتقاتها الهالوجينية ، يتم تعلم هذا القسم أثناء التمرين (على السبورة وفي أجهزة الكمبيوتر المحمولة). يقرأ الطلاب الكتاب المدرسي أولاً ثم يقومون بالمهام التالية:
1) اكتب الصيغ التركيبية للكحولات: أ) 2،2-ميثيل إثيل بوتانول -1 ، ب) 3،3-ثنائي ميثيل بنتانول -2. ما هي هذه المواد بالنسبة لبعضها البعض؟
2) اكتب الصيغ التركيبية لجميع الكحولات الأيزومرية المقابلة للصيغة C 5 H 11 OH.
3) عمل صيغ من الايزومري الايزومري لبروبيل الكحول.
محادثة مع الفصل حول تركيبة الكحولات ، حول وجود مجموعة وظيفية فيها تحدد خواصها الكيميائية. باستخدام مثال الكحول الإيثيلي ، يتم استدعاء العديد من التفاعلات التي تحدث بمشاركة الهيدروجين من مجموعة الهيدروكسو ، مجموعة الهيدروكسو بأكملها.
مع العلم أن خصائص المتماثلات يجب أن تكون متشابهة ، فإن الطلاب - ؛ لحاء استنتاج حول الخصائص الكيميائية العامة للكحول من هذه السلسلة. لتأكيد الاستنتاج ، نعرض تجارب على إنتاج الكلوروميثان من كحول الميثيل ؛ تفاعل كحول البروبيل مع الصوديوم.
من أجل اختبار معرفة الطلاب حول التأثير المتبادل للذرات في الجزيء ، نطرح سؤالاً عليهم: كيف يجب أن يؤثر الجذر الهيدروكربوني للكحول على معدل تفاعل الاستبدال؟ نقترح أنه مع زيادة الجذر الهيدروكربوني ، يجب أن ينخفض معدل تفاعل الكحول مع الصوديوم. نؤكد الافتراض من خلال إظهار التجربة: صب 10 مل من الإيثيل (abs.) ، البوتيل وكحول الأميل في 3 أكواب كيميائية وخفض قطع الصوديوم المنقى من نفس الحجم (نغطي الأكواب بالقمع ), يقارن الطلاب معدلات إطلاق فقاعات الهيدروجين في كل حالة.
نكتب بشكل انتقائي عدة معادلات للتفاعلات التي تحدث أثناء التجارب.
2C 2 H 5 OH + 2 Na \ u003d 2 C 2 H 5 ONa + H 2
2C 4 H 9 OH + 2 نا= 2 ج 4 ح 9 على+ ح 2
لتطوير مفهوم التأثير المتبادل ، فإننا ننظر في القدرة على فصل 2-كلورو إيثانول.
بعض الآخرين الخصائص العامةيتم إصلاحها نظريًا في عملية إكمال المهمة: من خلال أي تفاعلات يمكن تحويل بروبانول -1 إلى بروبانول -2؟ اكتب معادلات التفاعل المقابلة ، واشرح آلية أحدها. لإكمال المهمة ، يستخدم الطلاب المعرفة حول الجفاف الجزيئي للكحوليات:
1) CH3-CH2-CH2OH (H2SO4 عند t (-H2O)) = CH3-CH = CH2
CH3-CH = CH2 + HCl = CH3-CHCl-CH3
CH3-CHCl-CH3 + KOH = CH3-CHOH-CH3 + بوكل
بعد ذلك ، ندعو الطلاب لتحليل تفاعل ترطيب البروبيلين من أجل تعزيز المعرفة بقاعدة ماركوفنيكوف والآلية الأيونية. يجب أن يشرحوا أنه تحت تأثير جذر الميثيل ، تتحول كثافة سحابة الإلكترون لرابطة π إلى ذرة الكربون المعاكسة.
نؤكد هنا أنه من خلال تفاعل الماء ، ترتبط الهيدروكربونات غير المشبعة ارتباطًا مباشرًا بالكحول ، وننتقل إلى السؤال الأخير في الدرس - حول العلاقة الجينية بين الكحول والهيدروكربونات. نقدم للطلاب مهمة كتابة معادلات التفاعل التي يمكنك من خلالها الحصول على كحول الميثيل من الميثان. إنهم يعملون أولاً وفقًا للكتاب المدرسي ، ثم يكملون المهام. , نقوم بصياغة استنتاج حول وجود علاقة وراثية بين الهيدروكربونات (المشبعة وغير المشبعة) ومشتقات الهالوجين من الهيدروكربونات والكحول.
15) الرابطة الهيدروجينية بين الجزيئات.
الخصائص الفيزيائيةكحول.
1. قوة الرابطة الهيدروجينية أقل بكثير من قوة الرابطة التساهمية التقليدية (حوالي 10 مرات).
2. بسبب الروابط الهيدروجينية ، ترتبط جزيئات الكحول ، كما لو كانت عالقة مع بعضها البعض ، فمن الضروري إنفاق طاقة إضافية لكسر هذه الروابط حتى تصبح الجزيئات حرة وتكتسب المادة قابلية للتطاير.
3. هذا هو سبب ارتفاع نقطة الغليان لجميع الكحوليات مقارنة بالهيدروكربونات المقابلة.
4. الماء في مثل هذه الصغيرة الوزن الجزيئي الغراميلديه نقطة غليان عالية بشكل غير عادي.
40. الخواص الكيميائية وتطبيق الكحولات أحادية الماء المشبعة
كمواد تحتوي على الكربون والهيدروجين ، تحترق الكحوليات عند الاشتعال وتطلق الحرارة ، على سبيل المثال:
С2Н5ОН + 3O2؟ 2CO2 + 3H2O +1374 كيلوجول ،
عند الاحتراق ، لديهم أيضًا اختلافات.
ميزات الخبرة:
1) من الضروري صب 1 مل من الكحوليات المختلفة في أكواب خزفية وإشعال النار في السائل ؛
2) سيكون من الملاحظ أن الكحوليات - الممثلين الأوائل للسلسلة - تشتعل بسهولة وتحترق بلهب مزرق غير مضيء تقريبًا.
ملامح هذه الظواهر:
أ) من الخصائص بسبب وجود مجموعة OH الوظيفية ، من المعروف عن تفاعل الكحول الإيثيلي مع الصوديوم: 2C2H5OH + 2Na؟ 2C2H5ONa + H2 ؛
ب) يسمى ناتج استبدال الهيدروجين في الإيثانول بإيثوكسيد الصوديوم ، ويمكن عزله بعد التفاعل في صورة صلبة ؛
ج) الكحولات الأخرى القابلة للذوبان تتفاعل مع الفلزات القلوية التي تشكل الكحولات المقابلة ؛
د) يأتي تفاعل الكحول مع المعادن مع انقسام أيوني للقطب اتصالات O-N;
ه) في مثل هذه التفاعلات ، تظهر الكحوليات خصائص حمضية - التخلص من الهيدروجين في شكل بروتون.
يمكن تفسير الانخفاض في درجة تفكك الكحوليات مقارنة بالماء بتأثير الجذور الهيدروكربونية:
أ) يؤدي الإزاحة الجذرية لكثافة الإلكترون لرابطة C-O نحو ذرة الأكسجين إلى زيادة الشحنة السالبة الجزئية على الأخيرة ، بينما تحافظ على ذرة الهيدروجين بقوة أكبر ؛
ب) يمكن زيادة درجة تفكك الكحوليات إذا تم إدخال بديل في الجزيء ، مما يجذب إلكترونات الرابطة الكيميائية.
ويمكن تفسير ذلك على النحو التالي.
1. تقوم ذرة الكلور بتحويل كثافة الإلكترون لرابطة Cl-C تجاه نفسها.
2. تكتسب ذرة الكربون شحنة موجبة جزئية نتيجة لذلك ، لتعويضها ، وتغير كثافة الإلكترون في اتجاهها اتصالات سي سي.
3. للسبب نفسه ، تتحول كثافة الإلكترون لرابطة C-O إلى حد ما نحو ذرة الكربون ، وتتحول كثافة رابطة O-H من ذرة الهيدروجين إلى الأكسجين.
4. يزداد احتمال انفصال الهيدروجين على شكل بروتون عن هذا ، بينما تزداد درجة تفكك المادة.
5. في الكحوليات ، ليس فقط ذرة الهيدروكسيل الهيدروجين ، ولكن مجموعة الهيدروكسيل بأكملها يمكن أن تدخل في تفاعلات كيميائية.
6. إذا قمت بتسخين الكحول الإيثيلي بحمض الهيدروهاليك ، على سبيل المثال ، حمض الهيدروليك ، في دورق به ثلاجة ملحقة به (يتم أخذ مزيج من بروميد البوتاسيوم أو بروميد الصوديوم مع حمض الكبريتيك لتكوين بروميد الهيدروجين) ، ثم بعد فترة يمكنك ملاحظة أن الماء الثقيل يتجمع في جهاز الاستقبال تحت طبقة من الماء. سائل - بروموثان.
41- الميثانول والإيثانول
كحول الميثيل أو الميثانول خصائصه:
1) الصيغة الهيكلية - CH3OH ؛
2) سائل عديم اللون مع درجة غليان 64.5 درجة مئوية ؛
3) السامة (قد تسبب العمى والموت) ؛
4) في كميات كبيرةيتم الحصول على كحول الميثيل بالتخليق من أول أكسيد الكربون (II) والهيدروجين عند ضغط مرتفع (20-30 ميجا باسكال) و درجة حرارة عالية(400 درجة مئوية) في وجود محفز (حوالي 90٪ ZnO و 10٪ Cr2O3): CO + 2H2؟ CH3OH.
5) يتشكل كحول الميثيل أيضًا أثناء التقطير الجاف للخشب ، لذلك يطلق عليه أيضًا كحول الخشب. يتم استخدامه كمذيب وكذلك للحصول على مواد عضوية أخرى.
كحول الإيثيل (النبيذ) ، أو الإيثانول ، وخصائصه:
1) الصيغة الهيكلية - CH3CH2OH ؛
2) نقطة الغليان 78.4 درجة مئوية ؛
3) الإيثانولهي واحدة من أهم المواد الخام في صناعة حديثةالتوليف العضوي.
طرق الحصول على الايثانول:
1) تستخدم مواد سكرية مختلفة للحصول على (سكر العنب والجلوكوز الذي يتحول إلى كحول إيثيلي عن طريق "التخمير"). يستمر التفاعل وفقًا للمخطط:
C6H12O6 (الجلوكوز)؟ 2C2H5OH + 2CO2.
2) يوجد الجلوكوز الحر ، على سبيل المثال ، في عصير العنب ، الذي ينتج عن تخميره نبيذ العنب الذي يحتوي على نسبة من 8 إلى 16٪ كحول ؛
3) يمكن أن يكون المنتج الأولي للحصول على الكحول هو عديد السكاريد النشا ، الموجود ، على سبيل المثال ، في درنات البطاطس وحبوب الجاودار والقمح والذرة ؛
4) للتحويل إلى مواد سكرية (جلوكوز) ، يخضع النشا مبدئيًا للتحلل المائي.
للقيام بذلك ، يتم تخمير الدقيق أو البطاطس المقطعة بالماء الساخن ، وعند تبريدها ، يضاف إليها الشعير.
شراب الشعير- وهي حبوب شعير نبتت ثم تجفف وتدق بالماء.
يحتوي الشعير على دياستاز ، والذي يعمل بشكل محفز على عملية تكسير النشا.
الانبساطهو مزيج معقد من الإنزيمات.
5) في نهاية التكسير ، تضاف الخميرة إلى السائل الناتج ، تحت تأثير الإنزيمات التي يتكون منها الكحول (zymase) ؛
6) يتم تقطيره ثم تنقيته بالتقطير المتكرر.
حاليًا ، يتعرض عديد السكاريد ، السليلوز (الألياف) ، الذي يشكل الكتلة الرئيسية للخشب ، أيضًا إلى التكسير.
للقيام بذلك ، يخضع السليلوز للتحلل المائي في وجود الأحماض (على سبيل المثال ، نشارة الخشبعند درجة حرارة 150-170 درجة مئوية ، يتم معالجتها بـ 0.1-5٪ حمض الكبريتيك عند ضغط 0.7-1.5 ميجا باسكال).
42. الكحولات كمشتقات للهيدروكربونات. التوليف الصناعي للميثانول
الارتباط الجيني بين الكحول والهيدروكربونات:
1) يمكن اعتبار الكحوليات من مشتقات الهيدروكسيل للهيدروكربونات ؛
2) يمكن أن تعزى أيضًا إلى الهيدروكربونات المؤكسدة جزئيًا ، لأنها تحتوي أيضًا على الأكسجين ، بالإضافة إلى الكربون والهيدروجين ؛
3) من الصعب جدًا استبدال ذرة الهيدروجين مباشرةً بمجموعة هيدروكسيل أو إدخال ذرة أكسجين في جزيء هيدروكربون ؛
4) يمكن عمل ذلك من خلال مشتقات الهالوجين.
على سبيل المثال ، للحصول على الكحول الإيثيلي من الإيثان ، تحتاج أولاً إلى الحصول على البروموثان:
C2H6 + Br؟ C2H5Br + HBr.
ثم قم بتحويل البروموثان إلى كحول عن طريق التسخين بالقلويات المائية:
C2H5 Br + H OH؟ C2H5OH + HBr ؛
5) القلويات ضرورية لتحييد بروميد الهيدروجين والقضاء على إمكانية تفاعله مع الكحول ؛
6) بنفس الطريقة ، يمكن الحصول على كحول الميثيل من الميثان: CH4؟ CH3Br؟ CH3OH.
7) ترتبط الكحولات وراثيا بالهيدروكربونات غير المشبعة.
على سبيل المثال ، يتم الحصول على الإيثانول عن طريق ترطيب الإيثيلين:
CH2 = CH2؟ H2O = CH3-CH2-OH.
يستمر التفاعل عند درجة حرارة 280-300 درجة مئوية وضغط 7-8 ميجا باسكال في وجود حمض الفوسفوريك كمحفز.
التوليف الصناعي للميثانول وخصائصه.
1. لا يمكن الحصول على كحول الميثيل عن طريق ترطيب الهيدروكربون غير المشبع.
2. يتم الحصول عليها من الغاز التخليقي ، وهو خليط من أول أكسيد الكربون (II) مع الهيدروجين.
يتم الحصول على كحول الميثيل من غاز التوليف عن طريق التفاعل:
ثاني أكسيد الكربون + 2H2؟ CH3OH + س.
السمات المميزة للتفاعل.
1. يسير التفاعل في اتجاه تقليل حجم الخليط ، بينما يتم تسهيل تحول التوازن نحو تكوين المنتج المطلوب عن طريق زيادة الضغط.
2. من أجل أن يستمر التفاعل بمعدل كافٍ ، يكون محفزًا و حمة.
3. يكون التفاعل قابلاً للانعكاس ، والمواد الأولية لا تتفاعل تمامًا عند المرور عبر المفاعل.
4. من أجل استخدامها اقتصاديًا ، يجب فصل الكحول المتكون عن نواتج التفاعل ، ويجب إعادة الغازات غير المتفاعلة إلى المفاعل ، أي لإجراء عملية الدوران.
5. من أجل توفير تكاليف الطاقة ، يجب استخدام نفايات التفاعل الطارد للحرارة لتسخين الغازات المستخدمة في التخليق.
43. مفهوم المبيدات
مبيدات الآفات- هذه مواد كيميائيةالسيطرة على الكائنات الحية الدقيقة الضارة أو غير المرغوب فيها من وجهة نظر اقتصادية أو الصحة العامة.
أهم أنواع المبيدات هي الآتي.
1. مبيدات الأعشاب. الخصائص الأساسية:
أ) هذه محضرات لمكافحة الحشائش ، وتنقسم إلى مبيدات شجر ومبيدات طحالب ؛
ب) هذه هي أحماض الفينوكسي ومشتقات حمض البنزويك.
ج) هذه هي ثنائي نيتروانيلين ، دينيتروفينول ، هالوفينول ؛
د) هناك العديد من المركبات الحلقية غير المتجانسة ؛
ه) أول مبيد أعشاب عضوي تخليقي - 2-ميثيل-4،6-دينيتروفينول ؛
و) مبيدات الأعشاب الأخرى الشائعة الاستخدام - الأترازين (2-كلورو-4-إيثيل أمين-6-إيزوبروبيل أمين-1،3،5-تريازين) ؛ 2،4-ثنائي كلورو فينوكسي أسيتيك حامض.
2. المبيدات الحشرية. الخصائص:
أ) مواد مدمرة الحشرات الضارة، تنقسم عادة إلى عوامل مضادة للتغذية ، عوامل جذب ومعقمات كيماوية ؛
ب) تشمل الكلور العضوي ، والمواد الفوسفورية العضوية ، والمستحضرات التي تحتوي على الزرنيخ ، ومستحضرات الكبريت ، وما إلى ذلك ؛
ج) أحد أشهر المبيدات الحشرية - ثنائي كلورو ثنائي الفينيل - ثلاثي كلورو ميثيل ميثان (DDT) ؛
د) تستخدم المبيدات الحشرية مثل سداسي كلوران على نطاق واسع في الزراعة وفي الحياة اليومية (سداسي كلورو حلقي الهكسان).
3. مبيدات الفطريات.
السمات المميزة لمبيدات الفطريات:
أ) هذه المواد لمكافحة الأمراض الفطرية للنباتات ؛
ب) تستخدم العديد من المضادات الحيوية ومستحضرات السلفانيلاميد كمبيدات للفطريات ؛
ج) أحد أبسط مبيدات الفطريات من حيث التركيب الكيميائي هو خماسي كلورو الفينول ؛
د) معظم مبيدات الآفات لها خصائص سامة ليس فقط ضد الآفات ومسببات الأمراض ؛
هـ) إذا أسيء التعامل معها ، يمكن أن تتسبب في تسمم الناس والحيوانات الأليفة والبرية أو موت المحاصيل الزراعية والمزارع ؛
و) يجب استخدام مبيدات الآفات بحذر شديد ، مع الالتزام الصارم بالتعليمات الخاصة باستخدامها ؛
ز) من أجل التقليل تأثيرات مؤذيةمبيدات الآفات على البيئة يجب أن:
- تطبيق مواد ذات نشاط بيولوجي أعلى ، وبالتالي ، قم بتطبيقها بكمية أقل لكل وحدة مساحة ؛
- استخدام مواد غير مخزنة في التربة ولكنها تتحلل إلى مركبات غير ضارة.
44. كحول متعدد الهيدروكسيل
السمات الهيكلية للكحولات متعددة الهيدروكسيل:
1) تحتوي في الجزيء على عدة مجموعات هيدروكسيل متصلة بجذر هيدروكربوني ؛
2) إذا تم استبدال ذرتين هيدروجين بمجموعات هيدروكسيل في جزيء هيدروكربوني ، فهذا هو كحول ثنائي الهيدروجين ؛
3) أبسط ممثل لمثل هذه الكحوليات هو جلايكول الإيثيلين (إيثانيديول -1،2):
CH2 (OH) - CH2 (OH) ؛
4) في جميع الكحولات متعددة الهيدروكسيل ، توجد مجموعات الهيدروكسيل عند ذرات كربون مختلفة ؛
5) للحصول على كحول تكون فيه مجموعتان من الهيدروكسيل على الأقل عند ذرة كربون واحدة ، تم إجراء العديد من التجارب ، ولكن تعذر الحصول على الكحول: تبين أن هذا المركب غير مستقر.
الخصائص الفيزيائية للكحول متعدد الهيدروكسيل:
1) أهم ممثلي الكحولات المتعددة الهيدروجين هم جلايكول الإيثيلين والجلسرين;
2) هذه عبارة عن سوائل شراب عديمة اللون وذات مذاق حلو.
3) شديدة الذوبان في الماء ؛
4) هذه الخصائص متأصلة أيضًا في الكحوليات المتعددة الهيدروجين الأخرى ، على سبيل المثال ، الإيثيلين جلايكول سام.
الخواص الكيميائية للكحولات متعددة الهيدروكسيل.
1. كمواد تحتوي على مجموعات الهيدروكسيل ، فإن الكحولات متعددة الهيدروكسيل لها خصائص مشابهة للكحولات أحادية الماء.
2. تحت تأثير الأحماض المائية على الكحول ، يتم استبدال مجموعة الهيدروكسيل:
CH2OH-CH2OH + H CI؟ CH2OH-CH2CI + H2O.
3. العديد من الكحوليات لها أيضًا خصائص خاصة: تُظهر الكحولات متعددة الذرات خواصًا حمضية أكثر من الكحولات أحادية الماء وتتشكل بسهولة كحول ليس فقط مع المعادن ، ولكن أيضًا مع هيدروكسيدات المعادن الثقيلة. على عكس الكحولات أحادية الماء ، تتفاعل الكحولات متعددة الهيدروكسيد مع هيدروكسيد النحاس لإعطاء معقدات من اللون الأزرق(رد فعل نوعي للكحولات متعددة الهيدروكسيل).
4. باستخدام مثال الكحولات متعددة الهيدروكسيل ، يمكن للمرء أن يقتنع بأن التغييرات الكمية تتحول إلى تغييرات نوعية: تسبب تراكم مجموعات الهيدروكسيل في الجزيء ، نتيجة مظهرها المتبادل ، في خصائص جديدة في الكحول مقارنة بالكحولات أحادية الماء.
طرق تحضير واستخدام الكحولات متعددة الهيدروكسيل: 1) مثل الكحولات أحادية الماء ، يمكن الحصول على الكحولات متعددة الهيدروكربونات من الهيدروكربونات المقابلة من خلال مشتقات الهالوجين الخاصة بها ؛ 2) أكثر أنواع الكحول متعدد الهيدرات شيوعًا هو الجلسرين ، ويتم الحصول عليه عن طريق تقسيم الدهون ، والآن يتم الحصول عليه بشكل أكثر وأكثر صناعياً من البروبيلين ، والذي يتشكل أثناء تكسير المنتجات البترولية.
45. الفينولات
مشتقات الهيدروكسيل التي تحتوي على مجموعات وظيفية في سلسلة جانبية،تنتمي إلى فئة الكحوليات.
الفينولات -هذه مشتقات هيدروكسيل للهيدروكربونات العطرية ، في جزيئاتها ترتبط مجموعاتها الوظيفية بحلقة البنزين.
أبسط الفينول هو مشتق هيدروكسيل أحادي الذرة للبنزين C6H5OH ، والذي يسمى عادةً الفينول.
خصائص الفينول:
1) مادة بلورية عديمة اللون لها رائحة مميزة ، مع أكسدة جزئية في الهواء تحدث غالبًا. اللون الوردي، منصهر جدا
2) الفينول له بعض التشابه في الخواص الكيميائية مع الكحولات أحادية الماء ؛
3) إذا تم تسخين الفينول قليلاً (حتى الذوبان) وتم وضع الصوديوم المعدني فيه ، يتم إطلاق الهيدروجين. في هذه الحالة ، عن طريق القياس مع الكحول ، فينولات الصوديوم 2C6H5OH + 2Na؟ 2C6H5ONa + H2 ؛
4) على عكس الكحولات ، يتم الحصول على الفينولات إذا تم معالجة الفينول بمحلول قلوي ؛
5) في نفس الوقت ، يتحول الفينول الصلب إلى فينولات الصوديوم ، والذي يذوب بسرعة في الماء: C6H5OH + NaOH؟ C6H5ONa + H2O ؛
6) مع مراعاة تقسيم الرابطة الأيونية ، تصبح المعادلة العرض التالي: С6Н5О (Н) + Na ++ OH-؟ [C6H5O] - + Na ++ H2O.
ميزة رد الفعل:
أ) في هذه التفاعلات ، تتجلى الخصائص الحمضية للفينول ؛
ب) درجة تفكك الفينول أكبر من تلك الموجودة في الماء والكحولات المشبعة ، لذلك يطلق عليه أيضًا حمض الكربوليك ؛
3) الفينول حمض ضعيف حتى حمض الكربونيكأقوى ، يمكن أن يحل محل الفينول من فينولات الصوديوم.
طرق استخدام وإنتاج الفينول
1. كمادة تقتل العديد من الكائنات الدقيقة ، يستخدم الفينول منذ فترة طويلة في شكل محلول مائي لتطهير الغرف والأثاث ، الأدوات الجراحيةإلخ.
2. يذهب للحصول على أصباغ ومواد طبية كثيرة.
3. يتم إنفاق كمية كبيرة منه بشكل خاص على إنتاج لدائن الفينول فورمالدهيد واسعة الانتشار.
4. بالنسبة للاحتياجات الصناعية ، يتم استخدام الفينول بشكل أساسي ، والذي يتم الحصول عليه من قطران الفحم.
لكن هذا المصدر لا يمكن أن يلبي بشكل كامل الحاجة إلى الفينول.
لذلك ، بكميات كبيرة ، يتم إنتاجه أيضًا صناعياً من البنزين.
الألدهيدات- هذه مواد عضوية تحتوي جزيئاتها على مجموعة وظيفية من الذرات المتصلة بجذر هيدروكربوني.
46. الألدهيدات وخواصها الكيميائية
الألدهيدات- هذه مواد عضوية تحتوي جزيئاتها على مجموعة كربونيل ، والتي ترتبط بذرة هيدروجين واحدة على الأقل وجذر هيدروكربوني.
يتم تحديد الخصائص الكيميائية للألدهيدات من خلال وجود مجموعة كربونيل في جزيءها. في مكان الرابطة المزدوجة في جزيء مجموعة الكربونيل ، يمكن أن تحدث تفاعلات إضافة. على سبيل المثال ، إذا تم تمرير أبخرة الفورمالديهايد مع الهيدروجين فوق محفز نيكل ساخن ، يضاف الهيدروجين: يتم تقليل الفورمالديهايد إلى كحول الميثيل. تحدد الطبيعة القطبية للرابطة المزدوجة أيضًا تفاعلات أخرى للألدهيدات ، مثل إضافة الماء.
ملامح تفاعل إضافة الماء:أ) تضاف مجموعة الهيدروكسيل إلى ذرة الكربون في مجموعة الكربونيل ، والتي تحمل شحنة موجبة جزئية ، بسبب زوج الإلكترون من ذرة الأكسجين ؛ ب) زوج إلكترون؟ - يمرر الرابطة إلى ذرة الأكسجين لمجموعة الكاربونيل ويضاف بروتون إلى الأكسجين ؛
يتميز تفاعل الإضافة بما يلي:
1) الهدرجة (الاختزال) مع تكوين الكحولات الأولية RCH2OH.
2) إضافة الكحوليات لتشكيل hemiacetals R-CH (OH) - أو.
في وجود محفز ، كلوريد الهيدروجين حمض الهيدروكلوريك ، ومع وجود فائض من الكحول ، تتشكل الأسيتال RCH (OR) 2 ؛
3) إضافة هيدروسلفيت الصوديوم NaHSO3 لتكوين مشتقات هيدروسلفيت من الألدهيدات.
ملامح تفاعل أكسدة الألدهيدات:تتفاعل مع محلول الأمونيا من أكسيد الفضة (I) ومع هيدروكسيد النحاس (II) لتكوين أحماض كربوكسيلية.
ملامح تفاعل البلمرة للألدهيدات: 1) البلمرة الخطية مميزة ؛ 2) البلمرة الحلقية هي خاصية مميزة (تقليم ، tetramerization).
ملامح رد فعل "المرآة الفضية": 1) تظهر الفضة على جدران أنبوب الاختبار في شكل طلاء لامع ؛ 2) في تفاعل الأكسدة والاختزال ، يتحول الألدهيد إلى حمض (مع وجود فائض من الأمونيا ، يتشكل ملح الأمونيوم) ؛ 3) يتم تحرير الفضة في شكلها الحر ؛ 4) يمكن أيضًا استخدام هيدروكسيد النحاس Сu (OH) 2 كعامل مؤكسد للألدهيدات ؛ 3) إذا تمت إضافة محلول ألدهيد إلى هيدروكسيد النحاس وتم تسخين الخليط ، يتم تكوين راسب أصفر من هيدروكسيد النحاس (I) ، والذي يتحول إلى أكسيد النحاس الأحمر ؛ 4) هيدروكسيد النحاس (II) يؤكسد الألدهيد في حمض ، ويختزل في حد ذاته إلى أكسيد النحاس (I).
يمكن أن تساعد التفاعلات مع محلول الأمونيا المكون من أكسيد الفضة (I) وهيدروكسيد النحاس (II) في الكشف عن الألدهيدات.
يمكن اختزال مركبات الكربونيل إلى كحول. يتم تقليل الألدهيدات إلى كحول أولي ، وتتحول الكيتونات إلى كحول ثانوي. تسمح لك بعض الطرق بتقليل مجموعة الكاربونيل إلى الميثيلين.
47. تطبيق وإنتاج الألدهيدات
استخدام الألدهيدات.
من بين الألدهيدات ، يعتبر الفورمالديهايد هو الأكثر استخدامًا. ميزات استخدام الفورمالديهايد: يستخدم عادة في شكل محلول مائي - الفورمالين ؛ تعتمد العديد من استخدامات الفورمالديهايد على القدرة على طي البروتينات ؛ في الزراعة ، يعتبر الفورمالين ضروريًا لتجهيز البذور ؛ يستخدم الفورمالين في إنتاج الجلود ؛ الفورمالين له تأثير تسمير على بروتينات الجلد ، ويجعلها أكثر صلابة وغير متعفنة ؛ كما يستخدم الفورمالين لحفظ مستحضرات بيولوجية؛ عندما يتفاعل الفورمالديهايد مع الأمونيا ، يتم الحصول على المادة الطبية المعروفة urotropin.
يستخدم الجزء الأكبر من الفورمالديهايد للحصول على لدائن الفينول فورمالدهيد ، والتي تستخدم في صنع: أ) المنتجات الكهربائية ؛ ب) أجزاء الماكينة ، إلخ. يستخدم الأسيتالديهيد (ألدهيد الخل) بكميات كبيرة لإنتاج حمض الأسيتيك.
يتم الحصول على الكحول الإيثيلي عن طريق تقليل الأسيتالديهيد في بعض البلدان.
الحصول على الألدهيدات:
1) الطريقة العامة للحصول على الألدهيدات هي أكسدة الكحولات ؛
2) إذا قمت بتسخين دوامة من الأسلاك النحاسية في لهب مصباح كحول وخفضته في أنبوب اختبار بالكحول ، فإن السلك الذي يتم تغطيته عند تسخينه الزنجار الداكنأكسيد النحاس (II) ، يصبح لامعًا في الكحول ؛
3) تم الكشف عن رائحة الألدهيد.
بمساعدة مثل هذا التفاعل ، يتم الحصول على الفورمالديهايد في الصناعة.
للحصول على الفورمالديهايد ، يتم تمرير خليط من أبخرة كحول الميثيل مع الهواء عبر مفاعل بشبكة من النحاس أو الفضة ملتهبة باللون الأحمر ؛
4) في التحضير المختبري للألدهيدات ، يمكن استخدام عوامل مؤكسدة أخرى لأكسدة الكحولات ، على سبيل المثال ، برمنجنات البوتاسيوم ؛
5) في تكوين الألدهيد أو الكحول أو الكحول ، يخضع لنزع الهيدروجين.
ميزات تفاعل ترطيب الأسيتيلين:
أ) أولاً ، يضاف الماء إلى الأسيتيلين في موقع واحد؟
ب) يتكون كحول الفينيل ؛
ج) الكحولات غير المشبعة ، التي توجد فيها مجموعة الهيدروكسيل في ذرة الكربون ، والتي ترتبط برابطة مزدوجة ، تكون غير مستقرة ومتشابكة بسهولة ؛
د) يتم تحويل كحول الفينيل إلى ألدهيد:
ه) يتم تنفيذ التفاعل بسهولة إذا تم تمرير الأسيتيلين إلى ماء ساخن يحتوي على حامض الكبريتيك وأكسيد الزئبق (II) ؛
و) بعد بضع دقائق ، يمكن الكشف عن محلول الألدهيد في المستقبل.
في السنوات الأخيرة ، تم تطوير طريقة وتوزيعها لإنتاج الأسيتالديهيد عن طريق أكسدة الإيثيلين بالأكسجين في وجود البلاديوم وكلوريد النحاس.
48. الفورمالديهايد والاسيتالديهيد
هيكل وخصائص الفورمالديهايد:إنه غاز عديم اللون ذو رائحة نفاذة وخانقة وسامة ؛ قابل للذوبان في الماء بدرجة عالية. محلول مائي 40٪ من الفورمالديهايد يسمى الفورمالين.
الخواص الكيميائية للفورمالديهايد.
يتميز الفورمالديهايد بتفاعلات الأكسدة والإضافة (بما في ذلك التكثيف المتعدد):
1) تفاعل الأكسدة:
أ) يحدث تفاعل الأكسدة بسهولة شديدة - الألدهيدات قادرة على أخذ الأكسجين من العديد من المركبات ؛
ب) عندما يتم تسخين الفورمالديهايد بمحلول أمونيا من أكسيد الفضة (أكسيد الفضة غير قابل للذوبان في الماء) ، يتأكسد الفورمالديهايد إلى حمض الفورميك HCOOH ويتم تقليل الفضة. تعليم "مرآة الفضة"بمثابة رد فعل نوعي لمجموعة الألدهيد ؛
د) تختزل الألدهيدات النحاس (II) هيدروكسيد النحاس (I) هيدروكسيد ، والذي يتحول إلى أكسيد النحاس (I) البرتقالي ؛
ه) يستمر التفاعل عند تسخينه: 2CuOH؟ Cu2O + H2O ؛
و) يمكن أيضًا استخدام هذا التفاعل للكشف عن الألدهيدات ؛
2) رد فعل الإضافة:
أ) يستمر تفاعل الإضافة عن طريق كسر الرابطة المزدوجة لمجموعة الكربونيل للألدهيد ؛
ب) إضافة الهيدروجين ، والتي تحدث عندما يتم تمرير خليط من الفورمالديهايد والهيدروجين فوق محفز ساخن - مسحوق النيكل ، مما يؤدي إلى اختزال الألدهيد إلى الكحول ؛
ج) يعلق الفورمالديهايد أيضًا على الأمونيا وهيدروسلفيت الصوديوم ومركبات أخرى.
طرق الحصول على الفورمالديهايد:
1) في الصناعة ، يتم الحصول على الفورمالديهايد من الميثانول عن طريق تمرير بخار الكحول مع الهواء فوق محفز نحاسي يتم تسخينه إلى 300 درجة مئوية: 2CH3OH + O2؟ 2HCHO + 2H2O ؛
2) من الطرق الصناعية المهمة أيضًا أكسدة الميثان بالهواء عند درجة حرارة 400-600 درجة مئوية في وجود كمية صغيرة من أكسيد النيتريك كمحفز: CH4 + O2؟ CH2O + H2O.
تطبيق الفورمالديهايد: 1) يستخدم الفورمالديهايد بكميات كبيرة لإنتاج راتنجات الفينول فورمالدهايد ؛ 2) تعمل كمواد أولية لإنتاج الأصباغ ، والمطاط الصناعي ، والمخدرات ، والمتفجرات ، إلخ.
ملامح الاسيتالديهيد:أسيتالدهيد (أو أسيتالديهيد ، أو إيثانال) هو سائل عديم اللون له رائحة نفاذة ، قابل للذوبان في الماء بدرجة عالية ؛ تتم إضافة الهيدروجين إلى الأسيتالديهيد في نفس الظروف مثل الفورمالديهايد.
ملامح البارالدهيد:إنه سائل يتحول إلى كتلة بلورية عند 12 درجة مئوية ، وعند تسخينه في وجود أحماض معدنية مخففة ، يتحول إلى أسيتالديهيد ؛ له تأثير قوي منوم.
49. تفاعل التكاثف. الكربوهيدرات
كثرة التكاثف- هذه هي عملية تكوين مركبات جزيئية عالية من مركبات منخفضة الجزيئات ، والتي يصاحبها إطلاق منتج ثانوي (ماء ، أمونيا ، كلوريد الهيدروجين ومواد أخرى).
ميزات تفاعل التكاثف المتعدد:
1) أثناء البلمرة ، على عكس التكثيف المتعدد ، لا يحدث إطلاق المواد الجانبية ؛
2) تسمى منتجات التكاثف المتعدد (باستثناء المنتجات الثانوية) ، وكذلك منتجات البلمرة ، البوليمرات ؛
3) أثناء تفاعل التكثيف المتعدد ، تنمو السلسلة تدريجيًا: أولاً ، تتفاعل المونومرات الأولية مع بعضها البعض ، ثم تتفاعل المركبات المتكونة بالتناوب مع جزيئات المونومرات نفسها ، وتشكل في النهاية مركب البوليمر. مثال على تفاعل التكثيف المتعدد هو تكوين راتنجات الفينول فورمالدهايد ، والتي تستخدم لتصنيع البلاستيك ؛
4) يستمر التفاعل عند تسخينه في وجود محفز (حمض أو قلوي) ؛
5) في جزيء الفينول ، تكون ذرات الهيدروجين متحركة ، ومجموعة كربونيل من الألدهيد قادرة على تفاعلات إضافة ، بينما يتفاعل الفينول والفورمالدهيد مع بعضهما البعض ؛
6) يتفاعل المركب الناتج بشكل أكبر مع الفينول مع إطلاق جزيء الماء ؛
7) يتفاعل المركب الجديد مع الفورمالديهايد.
8) يتكثف هذا المركب مع الفينول ، ثم مرة أخرى مع الفورمالديهايد ، وما إلى ذلك ؛
إرسال عملك الجيد في قاعدة المعرفة أمر بسيط. استخدم النموذج أدناه
سيكون الطلاب وطلاب الدراسات العليا والعلماء الشباب الذين يستخدمون قاعدة المعرفة في دراساتهم وعملهم ممتنين جدًا لك.
"تعليم وتنمية الطلاب في دراسة العلاقة الجينية بين الهيدروكربونات والألدهيدات والأحماض"
مقدمة
1. ملامح دراسة الكيمياء العضوية في المدرسة الثانوية
2. مهام التجربة في تدريس الكيمياء العضوية
3. التطورات المنهجية
4. التجارب المعملية حول موضوع: "العلاقة الجينية بين الهيدروكربونات والكحول والألدهيدات والأحماض
المؤلفات
المقدمة
تقرر الكيمياء العضوية كجزء من دورة الكيمياء المدرسية أولاً وقبل كل شيء المهام العامةمواجهة موضوعاتعموما. وبالتالي يساهم في التعليم العام وتدريب الطلاب على الفنون التطبيقية. في الوقت نفسه ، تسمح الكيمياء العضوية للمعلم بحل الفرد بنجاح المهام التعليميةوتطرح بشكل أعمق بعض الأسئلة المتعلقة بتعليم الطلاب.
الكيمياء العضوية ، باعتبارها فرعًا مستقلاً من العلوم الكيميائية ، تدرس المواد المحتوية على الكربون والتحولات التي تحدث معها. إنها تعمل بمجموعة متنوعة هائلة من المواد ، وتختلف في الغالب عن المواد غير العضوية في المواد الأكثر تعقيدًا: التركيب والهيكل والخصائص الكيميائية.
بالنظر إلى المواد والظواهر ، تساعد الكيمياء العضوية على فهم العمليات التي تحدث في عالم النبات والحيوان من حولنا ، لمعرفة جوهر وأنماط الحياة.
هذا ، أولاً وقبل كل شيء ، يحدد القيمة التعليمية والتعليمية لمسار الكيمياء العضوية.
1. خصائصدراسات الكيمياء العضوية في المدرسة الثانوية
السمة المميزة للمركبات العضوية هي الاعتماد الواضح لخصائصها الكيميائية ليس فقط على التركيب النوعي والكمي ، ولكن أيضًا على التركيب الداخلي للجزيئات. لذلك ، فإن عقيدة التركيب الكيميائي ، بما في ذلك مفهوم الإزاحة الإلكترونية والجوانب الكيميائية الفراغية ، لها أهمية أساسية في الكيمياء العضوية. يمكننا القول أن التفكير العلمي للكيميائي العضوي يقوم على الأفكار الحديثة حول بنية المواد العضوية.
يساهم تعريف الطلاب بأهم المنتجات العضوية مساهمة كبيرة في تدريبهم على الفنون التطبيقية. يعطي النظر في عمليات معالجة الغاز والنفط والفحم مفهوم الأساسيات صناعة الوقود. باستخدام مثال تخليق الكحول الإيثيلي أو حمض الأسيتيك ، يتم تعريف الطلاب على صناعة التخليق العضوي الثقيل. يتيح لك التعرف على معالجة الدهون والنشا والمنتجات الزراعية الأخرى تكوين فهم لاستخدام الكيمياء في الصناعات الغذائية. تعطي دراسة الطرق الصناعية لإنتاج المطاط والراتنجات والبلاستيك والألياف فكرة عن أهم صناعة في الوقت الحاضر. اقتصاد وطني- صناعة المواد التركيبية.
في عملية دراسة كل قضايا الإنتاج هذه ، يواجه الطلاب التنفيذ العملي لمثل هذه العمليات النموذجية للكيمياء العضوية مثل الاختزال والأكسدة والهدرجة ونزع الهيدروجين والهدرجة والتحلل المائي والبلمرة والتكثيف المتعدد وغيرها. يتعرفون على تشغيل أكثر الأجهزة الكيميائية شيوعًا ، سواء تلك المستخدمة في المقام الأول في صناعة الكيمياء العضوية ، وتلك الشائعة في الصناعة الكيميائية ككل. هنا ، باستخدام أمثلة جديدة ، يتم إثراء معرفة الطلاب بأهم مبادئ الإنتاج الكيميائي وتعزيزها - استمرارية العمليات ، والتدفق المضاد للمواد ، وتطوير سطحها ، واستخدام المحفزات ، واختيار الظروف المثلى للتفاعلات ، إلخ.
يساهم محتوى مقرر الكيمياء العضوية ، مع التغطية المناسبة له ، في تكوين رؤية علمية للعالم لدى الطلاب. إن التنبؤ بخصائص المواد وفقًا للبنية القائمة وإمكانية تخليق المواد بناءً على تعليمات نظرية التركيب يقنع الطلاب بواقع وجود الذرات والجزيئات وحقيقة نفسها. النظريات العلمية. هنا ، وبإقناع كبير ، يتم الكشف عن الوحدة المادية للعالم (تتكون العديد من المواد من عدد محدود من العناصر) ، والاتصال العالمي للمواد والظواهر في الطبيعة (القواسم المشتركة لخصائص المواد داخل الطبقة ، والاتصال الجيني بين فئات مختلفة من المركبات) ، وسببية الظواهر ، وما إلى ذلك. تساعد الكيمياء العضوية على فهم الحركة والتطور في الطبيعة (تحول المواد ، وتداول العناصر ، وتكوين المواد المعقدة من المواد البسيطة).
إنه يقود الطلاب إلى فهم قوانين التطور الديالكتيكي للطبيعة ، وقبل كل شيء قانون انتقال التغييرات الكمية إلى تغييرات نوعية ، والتي تتجلى بوضوح هنا بشكل خاص. تساعد الأحكام الرئيسية لنظرية التركيب الكيميائي للمواد العضوية على فهم هذا القانون بشكل أفضل ، حيث توضح كيف تؤدي التغييرات الكمية في تكوين الجزيئات وهيكلها بسبب التأثير المتبادل للذرات إلى ظهور مواد جديدة. حتى في بعبارات عامةيمكن تمييز القيمة التعليمية والتربوية لمادة الكيمياء العضوية في المدرسة الثانوية.
2. مهام التجربة في تدريس الكيمياء العضوية
عند دراسة العلاقة الجينية بين الفئات الرئيسية للمركبات العضوية ، يُنصح باستخدام تجربة كيميائية تكشف علاقتها بشكل كامل.
في الكيمياء العضوية ، يتم دراسة مواد من فئات مختلفة من المركبات العضوية. يتم تحديد اختيار هذه المواد من خلال: أ) أهميتها في إتقان أساسيات العلم. ب) الأهمية بالنسبة للإنسان والاقتصاد القومي للبلاد ؛ ج) سهولة الوصول لفهم الطالب.
في هذا الصدد ، يقدم مقرر الكيمياء المدرسية فئات أساسية من المركبات مثل الهيدروكربونات والكحول والألدهيدات والأحماض والإسترات والكربوهيدرات والنيترو والمركبات الأمينية والبروتينات. لا يتم تضمين العديد من المركبات متعددة الوظائف والأصباغ والمركبات الحلقية غير المتجانسة والقلويدات وعدد من فئات المواد الأخرى التي يتعذر على الطالب الوصول إليها لاستيعابها في الوقت المخصص لها في الدورة.
المهمة الأولى للتجربة هي توفير التعارف البصري مع المواد المدروسة. لهذا الغرض ، يتم عرض المجموعات ، ويتم توزيع النشرات للمراجعة ، ويتم إجراء التجارب لتوصيف الخصائص الفيزيائية للمواد.
المهمة الثانية للتجربة هي إظهار التفاعلات الكيميائية للمواد بشكل أكثر وضوحًا. بغض النظر عما إذا كانت التجربة قد أجريت في شكل توضيح لما قاله المعلم أو ، بناءً على نتائج التجربة ، يتوصل الطلاب إلى استنتاجات حول خصائص المادة ، يجب أن توفر التجربة "تأملًا حيًا" للواقع.
يجب أن تتوافق الملاحظات المباشرة وكلمة المعلم هنا تمامًا مع بعضها البعض وفي تفاعل وثيق تضمن التكوين الصحيح للمفاهيم العلمية.
تتمثل المهمة الثالثة للتجربة في مساعدة المعلم على أن يكشف للطلاب فكرة التطور في الكيمياء العضوية: الارتباط الجيني للمواد ، والانتقالات بين فئات المركبات العضوية ، وتخليق المواد المعقدة من المواد البسيطة ، والشرطية من ردود الفعل الظروف الخارجيةإلخ. يجب أن تظهر العمليات المقابلة ، والتي لها أهمية كبيرة لتشكيل نظرة عالمية ، للطلاب كظواهر حقيقية ، وليس كمعادلات على السبورة والورق.
في الوقت نفسه ، يجب ألا يغيب عن الأذهان أنه على الرغم من أن مشكلة الارتباط المتبادل والتنمية تظهر بشكل أوضح في الكيمياء العضوية منها في الكيمياء غير العضوية ، إلا أنها لا تزال تفتقر إلى هذا التعبير وإمكانية الوصول الفوري هنا ، على سبيل المثال ، في الظواهر الطبيعية التي درسها علم الأحياء. لذلك ، يحتاج المعلم إلى إظهار الاهتمام الكافي هنا حتى يتم الكشف عن هذا الجانب المهم من العلوم بشكل صحيح للطلاب ، بحيث تساعدهم الكيمياء العضوية على إدراك العلوم الطبيعية ككل.
تتمثل المهمة التالية للتجربة ، وخاصة السمات المميزة لتدريس الكيمياء العضوية ، في إظهار حقائق مقنعة وملموسة اعتماد الخواص الكيميائية للمواد على بنيتها وطبيعة التأثير المتبادل للذرات في الجزيئات.
نظرًا لأن هذه الأسئلة لا يتم أخذها في الاعتبار عادةً في دراسة الكيمياء غير العضوية ولا يمتلك الطلاب الأفكار الأولية المناسبة ، يصبح دور التجربة هنا مهمًا بشكل خاص. من المستحيل اللجوء إلى "تجربة فكرية" هنا ، على الأقل حتى يرى الطلاب ، من خلال اشتقاق صيغ للعديد من المواد ، بوضوح كيف يتم تحديد التركيب الكيميائي للمواد في العلم ، وكيف تعتمد الخصائص على هذا الهيكل ، وكيف أن وجود تؤثر بعض الذرات على سلوك الذرات الأخرى والمادة بشكل عام.
تُظهر التجربة أن دراسة وصفية بحتة للكيمياء العضوية ، عندما يُطلب من الطلاب فقط سرد المعلومات حول المواد الفردية وكتابة المعادلات تفاعلات كيميائية، يبدو أنها كومة من عدد لا حصر له من الحقائق العشوائية. الصيغ الهيكلية ، التي يتم تقديمها بشكل دوغماتي ، تصبح بالنسبة لهم فقط مخططات يجب حفظها والقدرة على الرسم. دون معرفة الأسس الحقيقية لتحديد بنية الجزيئات ، يتعلم الطلاب نظرية التركيب الكيميائي بشكل سطحي. تم إجراء مقارنة بين الخصائص مع بنية الهلام ، فغالبًا ما تكون رسمية بحتة وترابطية وليست داخلية وذات مغزى. هنا يتعايش التركيب الكيميائي للمادة وخصائصها المميزة ، وليست في علاقة سببية.
مع الانتقال إلى عالم الكيمياء العضوية ، فتحت آفاق واسعة للطلاب للتعرف على واحدة من المشاكل الكيميائية الرئيسية - العلاقة بين خصائص المواد وبنيتها.
لسوء الحظ ، في ظروف المدرسة ، لا تتاح لنا دائمًا الفرصة لتقديم دليل تجريبي صارم بدرجة كافية على التركيب الكيميائي للمواد.
هذا يرجع إلى حقيقة أن الطلاب لا يعرفون بنية العديد من المواد الأخرى ، من خلال التحول الذي يمكن للمرء أن يحكم فيه على بنية المادة الأولية ، والتجارب الكمية التي غالبًا ما تكون ضرورية لهذا الغرض ليست متاحة بسهولة في الفصل الدراسي ، إلخ. لذلك ، في بعض الحالات ، عند إثبات الهيكل ، يتعين على المرء إجراء بعض التبسيط ، لكن لا ينبغي أن تتجاوز حدود التبسيط المسموح به في الانتقال من تجربة علمية إلى أخرى تعليمية.
قال طلاب إحدى المدارس التي تم فيها إجراء إثبات تجريبي لصيغ التركيب في تدريس الكيمياء العضوية: "الشيء الأكثر إثارة للاهتمام والأكثر أهمية في الكيمياء العضوية هو أن المواد تُدرس بعمق أكبر فيها و لقد ثبت لماذا تحتوي المادة على مثل هذه الصيغة ، وليس غيرها ".
علاوة على ذلك ، تتمثل مهمة التجربة في المساهمة في تعليم الفنون التطبيقية الناجح لأطفال المدارس.
3. التطورات المنهجية
المواد العضوية المحتوية على الأكسجين
تخطيط الدرس
موضوع "الكحوليات والفينولات" (6-7 ساعات)
1. الكحولات: التركيب ، التسمية ، الايزومرية.
2. الخصائص الفيزيائية والكيميائية للكحول.
3. الحصول على واستخدام الميثانول والإيثانول.
4. الكحولات متعددة الهيدروكسيل.
5. الفينول: التركيب والخصائص.
6. العلاقة الجينية بين الهيدروكربونات والكحول.
الموضوع "الألدهيدات والأحماض الكربوكسيلية" (9 ساعات).
1. الألدهيدات: هيكل وخصائص.
2. تحضير واستخدام الألدهيدات.
3. الحد من الأحماض الكربوكسيلية أحادية القاعدة.
4. الممثلين الفرديين للأحماض الكربوكسيلية (الفورميك ، البالمتيك ، الأحماض الدهنية ، الأوليك).
5. الصابون كأملاح الأحماض الكربوكسيلية العالية. استخدام الأحماض.
6. العمل التطبيقيرقم 3 "الحصول على الأحماض الكربوكسيلية وخصائصها".
7. العمل العملي رقم 4 "حل تجريبي لمشاكل التعرف على المركبات العضوية".
8 ، 9. برنامج معياري "تعميم المعلومات حول المركبات العضوية المحتوية على الأكسجين".
هدف تعليمي معقد
تعرف على التسمية والتركيب والخصائص المميزة للكحولات والألدهيدات والأحماض الكربوكسيلية.
أن تكون قادرًا على تكوين الصيغ التركيبية للمواد المدروسة ؛ اكتب معادلات التفاعلات الكيميائية التي تعكس العلاقة الجينية للمركبات العضوية.
لتكون قادرًا على المقارنة والتحليل واستخلاص النتائج حول خصائص المواد وفقًا لبنيتها.
تكون قادرة على تطبيق المعرفة المكتسبة في أداء المهام على مستويات مختلفة.
الدروس 8 و 9.
برنامج معياري
"تعميم المعلومات حول احتواء الأكسجين
مركبات العضوية"
هدف متكامل.نتيجة العمل على العناصر التربوية:
- ترسيخ المعرفة حول موضوعات: "الكحوليات والفينولات" و "الألدهيدات والأحماض الكربوكسيلية"؛
- تطوير المهارات:
أ) تجميع الصيغ التركيبية للمواد العضوية ؛
ب) كتابة معادلات التفاعلات الكيميائية التي تعكس خصائص المواد العضوية ؛
ج) ضبط النفس والرقابة المتبادلة ؛
-يتعلم:
أ) العمل بشكل مستقل مع برنامج معياري ؛
ب) العمل حسب المستويات.
ج) العمل على الثقة.
د) مقارنة نتيجة عملهم بالأهداف المحددة.
UE-1: التحكم في الدخول
هدف. تحقق من الاستعداد لتصور الوحدة.
اكتب الإجابات في دفتر ملاحظاتك.اتبع الوقت!
مهام الاختبار (5 دقائق)
أنا الخيار
1. ماذا يسمى الكحول؟
أ) 2-ميثيل -3-إيثيل بوتانول -2 ؛
ب) 2-إيثيل -3-ميثيل بوتانول -3 ؛
ج) 2،3-ثنائي ميثيل بنتانول -2 ؛
د) 3،4-ثنائي ميثيل بنتانول -4.
2. أي من المواد ستتفاعل مع حمض الأسيتيك؟
أ) كربونات الكالسيوم 3 ؛
ج) CH 3 OH ؛
الثاني الخيار
1. ما هو اسم الالدهيد؟
أ) 2-ميثيل -3 بروبيل بوتانال ؛
ب) 2،3-ثنائي ميثيل هكسانال ؛
ج) 4،5-ثنائي ميثيل هكسانال ؛
د) 2-ميثيل -2-بروبيل بوتانال.
2. أي من المواد سوف تتفاعل مع الكحول الإيثيلي؟
ج) كربونات الكالسيوم 3 ؛
تبادل دفاتر الملاحظات مع زميل في المكتب ، والتحقق من إجاباته في الملحق 1 ، وناقش الأخطاء. قم بتقييم عمل الصديق: المهمة 1 - 1 نقطة ، المهمة 2 - 2 نقطة. سجل الدرجات على ورقة النتيجة UE-1.
إذا سجلت 3 نقاط - انتقل إلى UE-4.
إذا كنت قد أحرزت نقطة أو نقطتين - فانتقل إلى UE-3.
إذا سجلت 0 نقطة - انتقل إلى UE-2.
UE-2
هدف. كرر المادة التعليمية حول تركيب وخصائص الكحولات والألدهيدات والأحماض.
العمل لفظيا.
الكحولات المشبعة أحادية الماء
مع نح 2n + 1أوه
هيكل الجزيئات
من الصيغة الإلكترونية للكحول ، يمكن ملاحظة أن الرابطة الكيميائية بين ذرة الأكسجين وذرة الهيدروجين في جزيءها قطبية للغاية. لذلك ، يحتوي الهيدروجين على شحنة موجبة جزئية ، بينما يحتوي الأكسجين على شحنة سالبة. ونتيجة لذلك: 1) تكون ذرة الهيدروجين المرتبطة بذرة الأكسجين متحركة ومتفاعلة ؛ 2) يمكن تكوين روابط هيدروجينية بين جزيئات الكحول الفردية وبين جزيئات الكحول والماء:
إيصال
في الصناعة:
أ) ترطيب الألكينات:
ب) تخمير المواد السكرية:
ج) التحلل المائي للمنتجات المحتوية على النشا والسليلوز ، متبوعًا بتخمير الجلوكوز الناتج ؛
د) يتم الحصول على الميثانول من غاز التوليف:
في المختبر:
أ) من الألكانات المهلجنة ، التي تعمل عليها مع AgOH أو KOH:
C 4 H 9 Br + AgOH C 4 H 9 OH + AgBr ؛
ب) ترطيب الألكينات:
الخواص الكيميائية
2C 2 H 5 - OH + 2Na 2C 2 H 5 - ONa + H 2.
3. تفاعلات الأكسدة:
أ) الكحوليات يحترقون:
2C 3 H 7 OH + 9O 2 6CO 2 + 8H 2 O ؛
ب) في وجود العوامل المؤكسدة والكحول تتأكسد:
4. تتعرض الكحوليات نزع الهيدروجينو تجفيف:
كحول مشبع متعدد الهيدروكسيل
هيكل الجزيئات
من حيث بنية الجزيئات ، فإن الكحولات متعددة الهيدروكسيل تشبه الكحولات أحادية الماء. يكمن الاختلاف في حقيقة أن جزيئاتها تحتوي على عدة مجموعات هيدروكسيل. الأكسجين الذي تحتويه ينقل كثافة الإلكترون بعيدًا عن ذرات الهيدروجين. هذا يؤدي إلى زيادة في حركة ذرات الهيدروجين وزيادة في الخواص الحمضية.
إيصال
في الصناعة:
أ) ترطيب أكسيد الإيثيلين:
ب) يتم الحصول على الجلسرين صناعيا من البروبيلين وعن طريق التحلل المائي للدهون.
في المختبر:
مثل الكحولات أحادية الماء ، عن طريق التحلل المائي للألكانات المهلجنة مع المحاليل المائية للقلويات:
الخواص الكيميائية
تحتوي الكحولات متعددة الهيدروكسيل على بنية مشابهة للكحولات أحادية الماء. في هذا الصدد ، خصائصهم متشابهة أيضًا.
1. التفاعل مع الفلزات القلوية:
2. التفاعل مع الأحماض:
3. فيما يتعلق بتقوية الخواص الحمضية ، تتفاعل الكحولات متعددة الهيدروكسيل ، على عكس الكحولات أحادية الماء ، مع القواعد (مع وجود فائض من القلويات):
الفينولات R-OH أو R (OH) ن
هيكل الجزيئات
على عكس جذور الألكانات (CH 3 - ، C 2 H 5 - ، إلخ) ، تتميز حلقة البنزين بخاصية جذب كثافة الإلكترون لذرة الأكسجين من مجموعة الهيدروكسيل إليها.
نتيجة لذلك ، تكون ذرة الأكسجين أقوى من جزيئات الكحول ، وتجذب كثافة الإلكترون من ذرة الهيدروجين. لذلك ، في جزيء الفينول ، تصبح الرابطة الكيميائية بين ذرة الأكسجين وذرة الهيدروجين أكثر قطبية ، وتكون ذرة الهيدروجين أكثر قدرة على الحركة والتفاعل.
إيصال
في الصناعة:
أ) معزولة عن منتجات الانحلال الحراري للفحم ؛
ب) من البنزين والبروبيلين:
ج) من البنزين:
C 6 H 6 C 6 H 5 Cl C 6 H 5 - OH.
الخواص الكيميائية
في جزيء الفينول ، يتجلى التأثير المتبادل للذرات والمجموعات الذرية بشكل واضح. تم الكشف عن ذلك من خلال مقارنة الخواص الكيميائية للفينول والبنزين والخواص الكيميائية للفينول والكحول أحادي الهيدرات.
1. الخصائص المرتبطة بوجود مجموعة -OH:
2. الخصائص المرتبطة بوجود حلقة البنزين:
3. تفاعلات التكاثف المتعدد:
الألدهيدات
هيكل الجزيئات
الصيغ الإلكترونية والهيكلية للألدهيدات هي كما يلي:
الألدهيدات في مجموعة الألدهيد لها رابطة ألفا بين ذرات الكربون والهيدروجين ، ورابطة ألفا واحدة ورابطة ألفا واحدة بين ذرات الكربون والأكسجين ، والتي يمكن كسرها بسهولة.
إيصال
في الصناعة:
أ) أكسدة الألكانات:
ب) أكسدة الألكينات:
ج) ترطيب الألكينات:
د) أكسدة الكحولات الأولية:
(تستخدم هذه الطريقة أيضًا في المختبر).
الخواص الكيميائية
1. نظرًا لوجود مجموعة الألدهيد ، فإن السندات هي الأكثر تميزًا تفاعلات الإضافة:
2. تفاعلات الأكسدة(يتدفق بسهولة):
3.تفاعلات البلمرة والتكثيف المتعدد:
الأحماض الكربوكسيلية أحادية القاعدة
هيكل الجزيئات
الصيغ الإلكترونية والهيكلية للأحماض الكربوكسيلية أحادية القاعدة هي كما يلي:
بسبب تحول كثافة الإلكترون نحو ذرة الأكسجين في مجموعة الكربونيل ، تكتسب ذرة الكربون شحنة موجبة جزئية. نتيجة لذلك ، يجذب الكربون كثافة الإلكترون من مجموعة الهيدروكسيل ، وتصبح ذرة الهيدروجين أكثر قدرة على الحركة من جزيئات الكحول.
إيصال
في الصناعة:
أ) أكسدة الألكانات:
ب) أكسدة الكحول:
ج) أكسدة الألدهيدات:
د) طرق محددة:
الخواص الكيميائية
1. أبسط الأحماض الكربوكسيلية في محلول مائي تتفكك:
CH 3 COOH H + CH 3 COO-.
2. تفاعل مع المعادن:
2HCOOH + Mg (HCOO) 2 مجم + H 2.
3. التفاعل مع الأكاسيد والهيدروكسيدات الأساسية:
HCOOH + KOH NCOOK + H 2 O.
4. التفاعل مع أملاح الأحماض الضعيفة والمتطايرة:
2CH 3 COOH + K 2 CO 3 2CH 3 COOK + CO 2 + H 2 O.
5. بعض الأحماض تشكل أنهيدريدات:
6. تفاعل مع الكحوليات:
استرات
إيصال
يتم الحصول على استرات بشكل رئيسي في تفاعل الأحماض الكربوكسيلية والمعادن مع الكحوليات:
الخواص الكيميائية
خاصية مميزة للإسترات القدرة على الخضوع للتحلل المائي:
انتقل إلى UE-3.
UE-3
هدف. تطوير المهارات في تجميع الصيغ الهيكلية للمركبات العضوية ، كرر التسمية.
العمل كتابة في دفتر. في حالة الصعوبة ، راجع الملاحظات الموجودة في دفتر الملاحظات وإلى UE-2.
أنا الخيار
1.
أ) 2-ميثيل فينول ؛
ب) 3-حمض كلوروبوتانويك ؛
ج) إيثيل إستر لحمض البروبانويك.
2. اسم المواد:
الثاني الخيار
1. اكتب الصيغ التركيبية للمواد:
أ) بروبانديول -1،3 ؛
ب) 2-حمض الكلوروبروبانويك ؛
ج) إستر ميثيل حمض البوتانويك.
2. اسم المواد:
تحقق من إجاباتك في الملحق 2. لكل مهمة - 3 نقاط كحد أقصى. أدخل الدرجات في ورقة نقاط UE-3.
إذا سجلت 4-6 نقاط - انتقل إلى UE-4.
UE-4
هدف. تنمية المهارات في كتابة معادلات التفاعلات الكيميائية التي تعكس خصائص المركبات العضوية.
العمل كتابة في دفتر. في حالة الصعوبة ، راجع الملاحظات الموجودة في دفتر الملاحظات وإلى UE-2.
أنا الخيار
1 . أي من الكواشف وبأي تسلسل يجب استخدامه لإجراء التحولات:
أ) CH 3 OH ؛
2.
الثاني الخيار
1. أي من الكواشف وبأي تسلسل يجب استخدامه لإجراء التحولات:
الكواشف لسلسلة التحولات:
2. قم بتكوين معادلات التفاعل للمهمة 1 ، مع الإشارة إلى شروط تنفيذها.
تحقق من إجاباتك في الملحق 3. لكل مهمة - 3 نقاط كحد أقصى. أدخل الدرجات في ورقة نقاط UE-4.
إذا سجلت 4-6 نقاط - انتقل إلى UE-5.
إذا سجلت 0-3 نقاط - قم أولاً بفرز أخطائك بمساعدة دفتر ملاحظات وكتاب مدرسي أو اطلب المشورة من المعلم.
UE-5
هدف. ترسيخ مفهوم "الخصائص الحمضية للمادة" ، وتنمية مهارات المقارنة والتحليل.
تذكر أن وجود الخصائص الحمضية للمادة يتحدد بالقدرة على فصل H +. كلما زادت الشحنة الموجبة الجزئية + على ذرة الهيدروجين وكلما كان استقطاب رابطة OH أقوى ، زادت الخصائص الحمضية للمركب.
العمل كتابة في دفتر.
أنا الخيار
الثاني الخيار
رتب المواد بترتيب زيادة الحموضة.
تحقق من الإجابات في الملحق 4. أعط 3 نقاط لمهمة مكتملة بشكل صحيح. أدخل الدرجات في ورقة درجات UE-5.
إذا تبقت 10 دقائق أو أكثر قبل التحكم النهائي ، فانتقل إلى تنفيذ UE-6.
إذا كان هناك القليل من الوقت المتبقي ، فاستعد للتحكم النهائي من خلال تحليل أخطائك في UE-3 ، -4 ، -5.
UE-6
هدف. تقوية مهارات حل المسائل الحسابية.
العمل كتابة في دفتر.
أنا الخيار
كم جرام من KOH سيكون مطلوبًا لتحييد 300 جرام من محلول 9٪ من حمض الأسيتيك؟
الثاني الخيار
كم جرام من الأسيتالديهيد يمكن الحصول عليه من 4.48 لترًا من الأسيتيلين إذا كان العائد العملي 70٪ من الممكن نظريًا؟
إرسال المشكلة المكتملة إلى المعلم للمراجعة. الحل الصحيحإعطاء تقييم منفصل.
احصل على استعداد لأداء التحكم النهائي في أجهزة الكمبيوتر المحمولة لأعمال التحكم.
4 - التجارب المعملية على الموضوع: "الرابط الجيني بين الهيدروكربونات والكحول والألدهيد والأحماض"
قلل من استخدام الهيدروكربونات
من بين الهيدروكربونات المشبعة ، تتم دراسة الميثان بالتفصيل في المدرسة كمادة هي الأبسط في التركيب والهيكل ، والأكثر سهولة في الوصول إلى المعرفة العملية وذات الأهمية الاقتصادية الوطنية الكبيرة كمادة خام كيميائية ووقود.
يجب إجراء التجارب على المادة الأولى التي تمت دراستها في الكيمياء العضوية بكميات كافية وبعناية خاصة من الناحية المنهجية ، حيث يجب أن تظهر جوانب جديدة للتجربة في دراسة الكيمياء العضوية. هنا ، تجريبيًا ، سيكون من الممكن تحديد التركيب والصيغة الجزيئية للمادة ، وهي الخطوة الأولى في تحديد الصيغ الهيكلية للمركبات العضوية.
ميثان.
قد يكون ترتيب التجارب مع الميثان مختلفًا. في الأساس ، سيتم تحديده من خلال ما إذا كان المعلم يبدأ الموضوع بالحصول على الميثان ثم يقوم بإجراء تجارب لدراسة خصائصه باستخدام المادة التي تم الحصول عليها في الدرس ، أو باستخدام الميثان المُعد مسبقًا من أجل متابعة تسلسل أسئلة الدراسة بوضوح - فكر أولاً في الخصائص الفيزيائية للمادة ، ثم الخصائص الكيميائية ، وتطبيق المادة ، وأخيراً إنتاجها. في الحالة الأخيرة ، سيتم تقديم تجربة الحصول على الميثان فقط في نهاية الموضوع.
الطريقة الأولى لدراسة الموضوع ، وبالتالي ، بناء تجربة أكثر تعقيدًا من الناحية المنهجية ، ولكنها أكثر اقتصادية في الوقت المناسب. ستتطلب الطريقة الثانية مزيدًا من الوقت ، لكنها أبسط من الناحية المنهجية ، علاوة على ذلك ، ذات قيمة من حيث أنها ستسمح في النهاية بتكرار وتوحيد معرفة التجارب الأساسية مع المادة عند تلقيها في الدرس.
عند دراسة الميثان ، لا توجد حاجة خاصة للتجارب المعملية. في الأساس ، يمكن اختزالها هنا فقط للحصول على الميثان وحرقه. لكن الحصول على الميثان من أسيتات الصوديوم وحرقه يمكن أن يظهر بسهولة على طاولة توضيحية.
سيكون من الأفضل بعد دراسة موضوع "الهيدروكربونات" بأكمله تقديم درس عملي خاص. في هذا الدرس ، سيقوم الطلاب بإعادة إنتاج تجربة صنع الميثان وسيكونون قادرين على التحقق من أن الميثان لا يزيل لون ماء البروم ومحلول برمنجنات البوتاسيوم.
الحصول على الميثان في المختبر. الطريقة المختبرية الأكثر ملاءمة لإنتاج الميثان هي تفاعل أسيتات الصوديوم مع الجير الصودا.
يعتبر تفاعل أملاح الأحماض الكربوكسيلية مع القلويات طريقة شائعة للحصول على الهيدروكربونات. يتم تمثيل التفاعل بشكل عام بالمعادلة:
إذا كان R = CH 3 ، يتشكل الميثان.
نظرًا لأن الصودا الكاوية هي مادة استرطابية ، ويتداخل وجود الرطوبة مع الإكمال الناجح للتفاعل ، يضاف إليها أكسيد الكالسيوم. يسمى خليط الصودا الكاوية مع أكسيد الكالسيوم صودا الجير.
مطلوب تسخين قوي إلى حد ما للمسار الناجح للتفاعل ، ومع ذلك ، يؤدي ارتفاع درجة حرارة الخليط إلى عمليات جانبية وإنتاج منتجات غير مرغوب فيها ، مثل الأسيتون:
يجب تجفيف أسيتات الصوديوم قبل الاختبار. يجب أيضًا تكليس الجير الصودا قبل تحضير الخليط. إذا لم يكن هناك جير صودا جاهز ، يتم تحضيره على النحو التالي. في كوب من الحديد أو الخزف ، يُسكب الجير المكلس جيدًا CaO مع نصف كمية محلول مائي مشبع من NaOH القلوي. يتبخر الخليط حتى يجف ثم يكلس ويسحق. يتم تخزين المواد في مجفف.
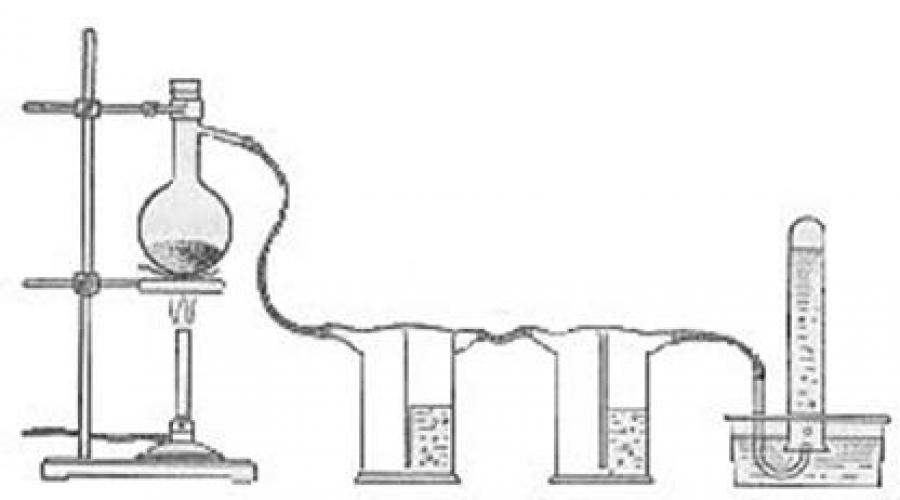
لإثبات إنتاج الميثان ، من الأفضل استخدام قارورة صغيرة مع أنبوب مخرج ، وللحصول على درس عملي ، استخدام أنبوب اختبار (الشكل 1 و 2).
قم بتجميع الجهاز كما هو موضح في الشكل. 1 أو 2. يُسكب محلول قلوي في زجاجة غسيل لاحتجاز الشوائب (الشكل 1). يتم وضع خليط من أسيتات الصوديوم وجير الصودا في قارورة تفاعل أو أنبوب اختبار. للقيام بذلك ، يتم خلط المواد المقسمة جيدًا بنسبة حجم 1: 3 ، أي مع وجود فائض كبير من الجير لجعل أسيتات الصوديوم تتفاعل بشكل كامل قدر الإمكان.
أرز. أولاً - الحصول على الميثان في المختبر (تجربة إيضاحية)
يتم تسخين القارورة بموقد من خلال شبكة الأسبستوس ، ويتم وضع أنبوب الاختبار على لهب مكشوف. يتم جمع الميثان في أنبوب اختبار وفقًا لطريقة إزاحة الماء. للتحقق من نقاء الغاز الناتج ، يُزال أنبوب الاختبار من الماء ويُشعل الغاز دون قلبه.
نظرًا لأنه لا يُنصح بقطع عملية الحصول على الميثان ، ومن المستحيل إكمال جميع التجارب الأخرى أثناء إجراء التفاعل ، يوصى بجمع الغاز لإجراء تجارب لاحقة في عدة أسطوانات (أنابيب اختبار) أو في مقياس غاز.
تُترك الأسطوانات المملوءة لفترة من الوقت في الحمام أو تُغلق تحت الماء بلوح زجاجي (الفلين) وتوضع رأسًا على عقب على المنضدة.
الميثان أخف من الهواء. للتعرف على الخصائص الفيزيائية للميثان ، يوضح المعلم اسطوانة مع الغاز المجمع. يلاحظ الطلاب أن الميثان غاز عديم اللون. يشير جمع الميثان بطريقة إزاحة الماء إلى أن هذا الغاز غير قابل للذوبان في الماء على ما يبدو. المعلم يؤكد هذا الاستنتاج.
على الميزان ، يتم موازنة قارورتين متطابقتين بأكبر سعة ممكنة. يتم تعليق إحدى القوارير رأسًا على عقب (الشكل 3). يتم تمرير الميثان من الجهاز إلى هذه القارورة لبعض الوقت. المقاييس ترتفع. لئلا يعتقد الطلاب أن التغير في الوزن يرجع إلى ضغط تدفق الغاز في قاع القارورة ، انتبه إلى حقيقة أن عدم التوازن يبقى حتى بعد توقف مرور الميثان.
بعد إعادة الموازين إلى التوازن مرة أخرى (لهذا ، يتم قلب زجاجة الميثان رأسًا على عقب لفترة من الوقت) ، للمقارنة والاستنتاجات الأكثر إقناعًا ، يتم تمرير الميثان إلى القارورة التي تقف بشكل طبيعي على الميزان. ميزان الميزان غير مضطرب.
بعد أن أظهر أن الميثان أخف من الهواء ، أبلغ المعلم عن مقدار وزن لتر من الميثان في الظروف العادية. ستكون هذه المعلومات مطلوبة لاحقًا في اشتقاق الصيغة الجزيئية للمادة.
احتراق الميثان. بعد النظر في الخصائص الفيزيائية للميثان ، يمكن طرح مسألة ماهية الصيغة الجزيئية للميثان. يعلم المعلم أنه من أجل توضيح هذه المشكلة ، سيكون من الضروري أولاً التعرف على إحدى الخصائص الكيميائية للميثان - الاحتراق.
يمكن إظهار احتراق الميثان بطريقتين.
1. يتم وضع أسطوانة زجاجية (سعتها ، على سبيل المثال ، 250 مل) مملوءة بالميثان على الطاولة ، ويتم إزالة لوحة منها أو فتح الفلين ويتم إشعال الغاز على الفور بشظية. عندما يحترق الميثان ، ينزل اللهب إلى الأسطوانة.
لكي يظل اللهب فوق الأسطوانة طوال الوقت ويكون مرئيًا بوضوح للطلاب ، يمكن سكب الماء تدريجياً في الأسطوانة مع حرق غاز الميثان ، وبالتالي إزاحة الغاز إلى الخارج (الشكل 4).
2. يتم إشعال الميثان مباشرة في أنبوب مخرج الجهاز للحصول على الغاز أو مقياس الغاز (في كلتا الحالتين ، يكون التحقق من النقاء إلزاميًا!). يتم التحكم في حجم اللهب من خلال شدة التسخين في الحالة الأولى وارتفاع عمود السائل المزاح في الحالة الثانية. إذا تمت تنقية الميثان من الشوائب ، فإنه يحترق بلهب عديم اللون تقريبًا. للقضاء على بعض لمعان اللهب (اللون الأصفر) بسبب أملاح الصوديوم في زجاج الأنبوب ، يمكن توصيل طرف معدني بنهاية الأنبوب.
الديهايدات والكيتونات
في دراسة الألدهيدات ، يتم تعريف الطلاب تجريبيًا على الطبيعة التدريجية لأكسدة المواد العضوية ، وكيمياء عمليات الإنتاج المهمة ، ومبدأ الحصول على الراتنجات الاصطناعية.
لكي يفهم الطلاب مكان الألدهيدات في سلسلة منتجات أكسدة الهيدروكربون ، عند تجميع المعادلات الكيميائية ، لا ينبغي على المرء تجنب استخدام أسماء وصيغ الأحماض التي يتم تحويل الألدهيدات إليها. يمكن إعطاء صيغ الأحماض عقائديًا مسبقًا ؛ في المستقبل ، سيتلقى الطلاب تبريرًا تجريبيًا لهم.
في دراسة الألدهيدات ، يتم إجراء معظم التجارب باستخدام الفورمالديهايد باعتباره مادة يسهل الوصول إليها في المدرسة وذات أهمية صناعية كبيرة. وفقًا لهذا ، يتم إعطاء الفورمالديهايد المكانة الرئيسية في هذا الفصل. بالنسبة للأسيتالديهيد ، يتم أخذ تفاعلات الإنتاج فقط في الاعتبار. لا يتم تدريس الكيتونات في المدرسة على وجه التحديد ؛ لذلك ، من بين هؤلاء ، يتم أخذ ممثل واحد فقط هنا - الأسيتون ، ويتم إجراء التجارب معه بشكل أساسي للعمل اللامنهجي للطلاب.
فورمالديهايد (معدن)
يُنصح بوضع خطة لدراسة هذه المادة بحيث يتعلم الطلاب فور التعرف على الخصائص الفيزيائية للألدهيدات كيفية الحصول عليها ، ثم الخصائص الكيميائية ، إلخ. إن التعرف المبكر قليلاً على طرق الحصول على الألدهيد سيجعل من الممكن ، عند دراسة الخصائص الكيميائية (تفاعلات الأكسدة) ، اعتبار الألدهيدات كحلقة وصل في سلسلة أكسدة الهيدروكربون.
يمكن استخدام الفورمالين كعينة عند التعرف على خصائص الفورمالديهايد. يجب أن يضمن هذا على الفور أن الطلاب يفهمون بوضوح الفرق بين الفورمالين والفورمالديهايد.
رائحة الفورمالديهايد. من بين الخصائص الفيزيائية للفورمالديهايد ، فإن التعرف على الرائحة هو الأكثر سهولة في الممارسة العملية. لهذا الغرض ، يتم توزيع أنابيب اختبار تحتوي على 0.5-1 مل من الفورمالين على طاولات الطلاب. بمجرد أن يتعرف الطلاب على الرائحة ، يمكن جمع الفورمالين واستخدامه لإجراء مزيد من التجارب. إن التعرف على رائحة الفورمالين سيمكن الطلاب من اكتشاف هذه المادة في تجارب أخرى.
قابلية الفورمالديهايد للاشتعال. يسخن الفورمالين في أنبوب اختبار ويتم إشعال الأبخرة المنبعثة منه ؛ يحترقون بلهب عديم اللون تقريبًا. يمكن رؤية اللهب إذا أشعلت النار في شظية أو قطعة من الورق بداخلها. يتم إجراء التجربة في غطاء دخان.
الحصول على الفورمالديهايد. نظرًا لأنه قبل التعرف على الخصائص الكيميائية ، لا يمكن اكتشاف الفورمالديهايد إلا عن طريق الرائحة ، يجب إجراء التجربة الأولى للحصول عليها في شكل عمل مخبري.
1. صب بضع قطرات من الميثانول في أنبوب اختبار. في لهب الموقد ، يتم تسخين قطعة صغيرة من شبكة نحاسية ملفوفة في أنبوب أو لولب من الأسلاك النحاسية ويتم إنزالها بسرعة إلى ميثانول.
عندما يتكلس ، يتأكسد النحاس ويصبح مغطى بطبقة سوداء من أكسيد النحاس ، في الكحول يتم استعادته مرة أخرى ويتحول إلى اللون الأحمر:
تم الكشف عن رائحة قوية للألدهيد. إذا تكررت عملية الأكسدة 2-3 مرات ، فيمكن الحصول على تركيز كبير من الفورمالديهايد ويمكن استخدام المحلول في التجارب اللاحقة.
2. بالإضافة إلى أكسيد النحاس ، يمكن استخدام عوامل مؤكسدة أخرى مألوفة لدى الطلاب للحصول على الفورمالديهايد.
إلى محلول ضعيف من برمنجنات البوتاسيوم في أنبوب مظاهرة ، أضف 0.5 مل من الميثانول ، ويسخن الخليط حتى الغليان. تظهر رائحة الفورمالديهايد ويختفي اللون الأرجواني للبرمنجنات.
يتم سكب 2-3 مل من محلول مشبع من ثنائي كرومات البوتاسيوم K 2 Cr 2 O 7 ونفس الحجم من حمض الكبريتيك المركز في أنبوب اختبار. يضاف الميثانول بالتنقيط ويسخن الخليط بحذر شديد (وجه فتحة الأنبوب إلى الجانب!). علاوة على ذلك ، يستمر التفاعل مع إطلاق الحرارة. يختفي اللون الأصفر لخليط الكروم ويظهر اللون الأخضر لكبريتات الكروم.
لا يمكن تفكيك معادلة التفاعل مع الطلاب. كما في الحالة السابقة ، تم إبلاغهم فقط أن ثنائي كرومات البوتاسيوم يؤكسد كحول الميثيل إلى ألدهيد ، بينما يتحول إلى ملح من الكروم ثلاثي التكافؤ Cr 2 (SO 4) 3.
تفاعل الفورمالديهايد مع أكسيد الفضة(رد فعل مرآة فضية). يجب إظهار هذه التجربة للطلاب بطريقة تعمل في نفس الوقت كإرشادات للجلسة العملية اللاحقة.
الحصول على راتنجات الفينول فورمالدهايد. يستخدم الجزء الأكبر من الفورمالديهايد الذي يتم الحصول عليه في الصناعة لتخليق الفينول فورمالديهايد والراتنجات الأخرى اللازمة لإنتاج البلاستيك. يعتمد إنتاج راتنجات الفينول فورمالدهايد على تفاعل التكثيف المتعدد.
أكثر ما يمكن الوصول إليه في ظروف المدرسة هو تخليق راتنج الفينول فورمالديهايد. أصبح الطلاب بحلول هذا الوقت على دراية بكل من المواد الأولية للحصول على الراتنج - الفينول والفورمالديهايد ؛ التجربة غير معقدة نسبيًا وتستمر بسلاسة ؛ كيمياء العملية ليست صعبة بشكل خاص على الطلاب إذا تم تصويرها على النحو التالي:
اعتمادًا على النسبة الكمية للفينول والفورمالديهايد ، وكذلك على المحفز المستخدم (الحمضي أو القلوي) ، يمكن الحصول على نوفولاك أو راتينج الراتنج. أولها هو لدن بالحرارة وله الهيكل الخطي الموضح أعلاه. والثاني هو التصلد بالحرارة ، حيث تحتوي جزيئاته الخطية على مجموعات كحول حرة - CH 2 OH ، قادرة على التفاعل مع ذرات الهيدروجين المتحركة للجزيئات الأخرى ، مما ينتج عنه بنية ثلاثية الأبعاد.
أسيتك الديهايد (أثنال)
بعد التعرف التفصيلي على خصائص الفورمالديهايد في هذا القسم من الموضوع ، فإن التجارب المتعلقة بإنتاج الأسيتالديهيد لها أهمية قصوى. يمكن تصميم هذه التجارب من أجل: أ) إظهار أنه يمكن الحصول على جميع الألدهيدات عن طريق أكسدة الكحولات أحادية الماء المقابلة ، ب) إظهار كيف يمكن إثبات بنية الألدهيدات تجريبياً ، ج) إدخال كيمياء الطريقة الصناعية للحصول على الأسيتالديهيد وفقًا إلى كوتشسروف.
تحضير الأسيتالديهيد بأكسدة الإيثانول. يمكن أن يؤخذ أكسيد النحاس (II) كعامل مؤكسد للكحول. يستمر التفاعل بشكل مشابه لأكسدة الميثانول:
1. لا يتم سكب أكثر من 0.5 مل من الكحول الإيثيلي في أنبوب اختبار ويتم غمر سلك نحاسي ساخن باللون الأحمر. تم الكشف عن رائحة الأسيتالديهيد ، التي تشبه الفاكهة ، ويلاحظ انخفاض النحاس. إذا تم أكسدة الكحول مرتين أو ثلاث مرات ، في كل مرة يتم تسخين النحاس حتى يتشكل أكسيد النحاس ، بعد ذلك ، بعد جمع الحلول التي حصل عليها الطلاب في أنابيب الاختبار ، سيكون من الممكن استخدام الألدهيد لإجراء التجارب عليه.
2. ضع 5 جم من ثنائي كرومات البوتاسيوم المسحوق K2Cr2O7 في دورق صغير به أنبوب تصريف ، صب 20 مل من حمض الكبريتيك المخفف (1: 5) ثم 4 مل من الكحول الإيثيلي. يتم توصيل ثلاجة بالقارورة ويتم تسخينها على لهب صغير عبر شبكة من الأسبستوس. يتم وضع مستقبل نواتج التقطير في ماء مثلج أو ثلج. يُسكب القليل من الماء في جهاز الاستقبال ويتم إنزال نهاية الثلاجة في الماء. يتم ذلك من أجل تقليل تطاير أبخرة الأسيتالديهيد (درجة حرارة الغرفة 21 درجة مئوية). جنبًا إلى جنب مع الإيثانول ، يتم تقطير كمية معينة من الماء والكحول غير المتفاعل وحمض الأسيتيك المتشكل ومنتجات ثانوية أخرى للتفاعل في المستقبل. ومع ذلك ، ليس من الضروري عزل الأسيتالديهيد النقي ، لأن المنتج الناتج يعطي أداءً جيدًا في التفاعلات المعتادة للألدهيدات. يتم تحديد وجود الألدهيد بواسطة الرائحة ورد فعل مرآة فضية.
ينجذب انتباه الطلاب إلى تغير اللون في القارورة. يصبح اللون الأخضر لكبريتات الكروم الناتجة (III) Cr 2 (SO 4) 3 مميزًا بشكل خاص إذا تم تخفيف محتويات القارورة بالماء بعد التجربة. ويلاحظ أن التغير في لون ثنائي كرومات البوتاسيوم حدث بسبب أكسدة الكحول به.
الحصول على الأسيتالديهيد عن طريق ترطيب الأسيتيلين. الاكتشاف الرائع للكيميائي الروسي M.G. Kucherov - إضافة الماء إلى الأسيتيلين في وجود أملاح الزئبق شكلت الأساس لطريقة صناعية واسعة الانتشار لإنتاج الأسيتالديهيد.
على الرغم من الأهمية الكبيرة وإمكانية الوصول للمدرسة ، نادرًا ما يتم عرض هذه الطريقة في فصول الكيمياء.
في الصناعة ، تتم العملية عن طريق تمرير الأسيتيلين في ماء يحتوي على أملاح الزئبق ثنائي التكافؤ وحمض الكبريتيك عند درجة حرارة 70 درجة مئوية. يتم تقطير الأسيتالديهيد المتكون في ظل هذه الظروف وتكثيفه ، وبعد ذلك يدخل أبراج خاصة للأكسدة إلى حمض الأسيتيك. يتم الحصول على الأسيتيلين من كربيد الكالسيوم بالطريقة المعتادة ويتم تنقيته من الشوائب.
الحاجة إلى تنقية الأسيتيلين والحفاظ على درجة الحرارة في وعاء التفاعل ، من ناحية ، وعدم اليقين في الحصول على المنتج المطلوب ، من ناحية أخرى ، عادة ما تقلل من الاهتمام بهذه التجربة. وفي الوقت نفسه ، يمكن إجراء التجربة بكل بساطة وموثوقية في شكل مبسط وفي ظل ظروف تقترب من الصناعية.
1. يمكن إجراء تجربة تعكس ، إلى حد ما ، شروط تنفيذ التفاعل في الإنتاج وتجعل من الممكن الحصول على محلول مركّز بدرجة كافية من الألدهيد ، في الجهاز الموضح في الشكل. 29.
المرحلة الأولى هي إنتاج الأسيتيلين. توضع قطع من كربيد الكالسيوم في القارورة ويضاف الماء أو محلول مشبع من الملح الشائع ببطء من قمع التنقيط. يتم ضبط سرعة التثبيت بحيث يتم إنشاء تدفق ثابت للأسيتيلين ، فقاعة واحدة تقريبًا لكل 1-2 ثانية. يتم تنقية الأسيتيلين في غسالة بمحلول من كبريتات النحاس:
CuSO 4 + H 2 S H 2 SO 4
بعد التنقية ، يتم تمرير الغاز إلى دورق بمحلول محفز (15-20 مل من الماء ، 6-7 مل من حامض الكبريتيك المركب وحوالي 0.5 جرام من أكسيد الزئبق (II). الدورق ، حيث يتم ترطيب الأسيتيلين ، يتم تسخينه بموقد (كحول) ، ويدخل الأسيتالديهيد الناتج في شكل غازي أنابيب الاختبار بالماء ، حيث يتم امتصاصه.
بعد 5-7 دقائق في أنبوب الاختبار ، من الممكن الحصول على محلول من الإيثانيل بتركيز كبير. لإكمال التجربة ، قم أولاً بإيقاف إمداد الماء لكربيد الكالسيوم ، ثم افصل الجهاز ، وبدون أي تقطير إضافي للألدهيد من دورق التفاعل ، استخدم الحلول الناتجة في أنابيب الاختبار للتجارب المقابلة.
2. في أبسط صورة ، يمكن تنفيذ تفاعل M.G. Kucherov على النحو التالي.
في دورق صغير مستدير القاع ، 30 مل من الماء و 15 مل من الماء المضغوط. حامض الكبريتيك. يبرد الخليط ويضاف إليه قليلاً (على طرف الملعقة) أكسيد الزئبق (II). يتم تسخين الخليط بعناية من خلال شبكة الأسبستوس حتى يغلي ، بينما يتم تحويل أكسيد الزئبق إلى كبريتات الزئبق (II).
المؤلفات
Kotlyarova O.S. يمثل المعرفة في الكيمياء. - م: التنوير ، 1977.
لاغوتينا ن. السيطرة النهائية على المعرفة في الكيمياء العضوية // الكيمياء في المدرسة. مكتبة المجلات. - م: مطبعة المدرسة ، 1998.
بوتابوف في إم ، تشيرتكوف آي إن. اختبر معلوماتك عن الكيمياء العضوية. - م: التنوير ، 1985.
Ryss V.L. السيطرة على معرفة الطلاب. - م: علم أصول التدريس ، 1982.
إريجين دي بي ، بيليبينكو زي. طرق تحسين التجربة الكيميائية في الكيمياء العضوية بالمرحلة الثانوية. -M: MGPI، 1987، 227p.
كوزنتسوفا إن. تكوين نظم مفاهيم في تدريس الكيمياء. -M: التنوير ، 1989 ، 115 ثانية.
كوروشينكو أ. في دراسة المركبات العضوية المحتوية على الأكسجين // الكيمياء في المدرسة. - 1993 ، رقم 1.
وثائق مماثلة
طرق الحصول على مركبات النيترو ، الخواص الكيميائية ، قياس توتر مركبات النيترو. تكثيف مركبات النيترو الأليفاتية مع الألدهيدات والكيتونات. قواعد العمل في المختبر في الكيمياء العضوية. استخدام مركبات النيترو في الاقتصاد القومي.
ورقة مصطلح ، تمت الإضافة بتاريخ 04/29/2011
معنى ومكان موضوع "إعادة الترتيب الجزيئي" في سياق الكيمياء العضوية. الغايات والأهداف والمقاربات التربوية في دراسة هذا الموضوع. استخدام الأدوات التعليمية الإلكترونية في تدريس الكيمياء ، ولا سيما إعادة الترتيب الجزيئي.
دليل التدريب ، تمت إضافة 2010/07/22
آدمانتان هو سلف السلسلة المتماثلة لعائلة الهيدروكربونات ذات الهيكل الشبيه بالماس ديامانتان ، تريامانتان. يعد الظهور والتطور على أساس كيمياء الأدمانتان أحد مجالات الكيمياء العضوية الحديثة - كيمياء متعدد السطوح العضوية.
ورقة مصطلح ، تمت الإضافة في 10/08/2008
نبذة لمحة تاريخيةتطوير الكيمياء العضوية. أولى الآراء النظرية. نظرية هيكل أ.م. بتليروف. طرق تصوير الجزيئات العضوية. أنواع الهيكل العظمي الكربوني. ايزومرية ، تنادد ، إيزولوجيا. أصناف المركبات العضوية.
التحكم في العمل ، تمت إضافة 08/05/2013
العمليات الأساسية عند العمل في معمل الكيمياء العضوية. أهم الثوابت الفيزيائية. طرق تحديد هيكل المركبات العضوية. أساسيات تركيب وخصائص وتحديد المركبات العضوية. توليفات المركبات العضوية.
دليل التدريب ، أضيفت في 2015/06/24
دور الكيمياء في التنمية معرفة العلوم الطبيعية. مشكلة إدخال عناصر كيميائية جديدة في إنتاج المواد. حدود الكيمياء العضوية الإنشائية. الإنزيمات في الكيمياء الحيوية والكيمياء العضوية. حركية التفاعلات الكيميائية ، الحفز.
البرنامج التعليمي ، تمت إضافة 11/11/2009
أصول وتطور الكيمياء ، ارتباطها بالدين والكيمياء. أهم سمات الكيمياء الحديثة. المستويات الهيكلية الأساسية للكيمياء وأقسامها. مبادئ وقوانين الكيمياء الأساسية. الرابطة الكيميائية والحركية الكيميائية. عقيدة العمليات الكيميائية.
الملخص ، تمت الإضافة في 10/30/2009
الخصائص العامةمثل الكربون عنصر كيميائي، خصائصه الرئيسية ، السمات الهيكلية. أنواع الروابط الكيميائية: التساهمية والأيونية والهيدروجين. طرق لكسر الرابطة الكيميائية. المؤثرات الإلكترونية. الأحماض والقواعد ومقارنتها.
التحكم في العمل ، تمت إضافة 08/05/2013
المراحل الرئيسية في تطور الكيمياء. الخيمياء كظاهرة لثقافة العصور الوسطى. نشأة وتطور الكيمياء العلمية. أصول الكيمياء. لافوازييه: ثورة في الكيمياء. انتصار العلوم الذرية والجزيئية. أصل الكيمياء الحديثة ومشاكلها في القرن الحادي والعشرين.
الملخص ، تمت الإضافة 11/20/2006
فترة نشوء وتطور النظريات الكيميائية. سبل تطوير التطورات العلمية والتكنولوجية في مجال الإبداع الأدوية. موضوع الكيمياء الطبية. المشاكل الأساسية للكيمياء العضوية. المركبات العضوية للزرنيخ.
الموضوع 1. الأسس النظرية للكيمياء العضوية (4 ساعات)
تشكيل الكيمياء العضوية كعلم. المواد العضوية. الكيمياء العضوية. نظرية هيكل المركبات العضوية A. M. Butlerova. هيكل عظمي من الكربون. الراديكاليون. المجموعات الوظيفية. سلسلة متجانسة. متماثلون.
التماثل الهيكلي. التسمية. أهمية نظرية تركيب المركبات العضوية.
الطبيعة الإلكترونية للروابط الكيميائية في المركبات العضوية. طرق كسر الروابط في جزيئات المواد العضوية. اليكتروفيل. نوكليوفيلز.
تصنيف المركبات العضوية.
مظاهرات. التعرف على عينات من المواد والمواد العضوية. نماذج من جزيئات المواد العضوية. ذوبان المواد العضوية في الماء والمذيبات غير المائية. ذوبان وتفحم واحتراق المواد العضوية.
الهيدروكربونات (23 سا)
الموضوع 2 الحد من الهيدروكربونات (الألكانات) (7 ساعات).
التركيب الإلكتروني والمكاني للألكانات. سلسلة متجانسة. التسمية والتشابه. الخصائص الفيزيائية والكيميائية للألكانات. تفاعل الاستبدال. إيصالواستخدام الألكانات.
سيكلو ألكانات. هيكل الجزيئات ، متسلسلة متجانسة. البحث في الطبيعة. الخصائص الفيزيائية والكيميائية.
العروض.انفجار خليط من غاز الميثان والهواء. نسبة الألكانات إلى الأحماض والقلويات ومحلول برمنجنات البوتاسيوم وماء البروم.
التجارب المعملية.صنع نماذج من جزيئات الهيدروكربون و
مشتقات الهالوجين.
العمل التطبيقي.التحديد النوعي للكربون والهيدروجين والكلور في المواد العضوية.
مهام الحساب.إيجاد الصيغة الجزيئية لمركب عضوي بالوزن (الحجم) لمنتجات الاحتراق.
الموضوع 3. الهيدروكربونات غير المشبعة (6 ساعات)
الألكينات.التركيب الإلكتروني والمكاني للألكينات. سلسلة متجانسة. التسمية. التماكب: سلسلة الكربون ، مواضع رابطة متعددة ، رابطة الدول المستقلة ، عبر-ايزومرية. الخواص الكيميائية: تفاعل الأكسدة ، الإضافة ، البلمرة. حكم ماركوفنيكوف.تحضير واستخدام الألكينات.
Alkadienes.بنية. الخصائص والتطبيق. المطاط الطبيعي.
ألكينز.التركيب الإلكتروني والمكاني للأسيتيلين. المتماثلات والأيزومرات. التسمية. الخصائص الفيزيائية والكيميائية. تفاعلات الإضافة والاستبدال. إيصال. تطبيق.
العروض.الحصول على الأسيتيلين بطريقة الكربيد. تفاعل الأسيتيلين مع محلول برمنجنات البوتاسيوم وماء البروم. حرق الأسيتيلين. تحلل المطاط أثناء التسخين واختبار منتجات التحلل.
العمل التطبيقي.الحصول على الاثيلين ودراسة خصائصه.
الموضوع 4. الهيدروكربونات العطرية (أرينيس) (4 ساعات)
الساحات.التركيب الإلكتروني والمكاني للبنزين. التماثل والتسمية. الخصائص الفيزيائية والكيميائية للبنزين. متماثلات البنزين. خصائص الخصائص الكيميائية لمتناظرات البنزين في مثال التولوين. العلاقة الجينية للهيدروكربونات العطرية مع فئات الهيدروكربونات الأخرى.
العروض.البنزين كمذيب ، احتراق البنزين. نسبة البنزين إلى ماء البروم ومحلول برمنجنات البوتاسيوم. أكسدة التولوين.
الموضوع 5. المصادر الطبيعية للهيدروكربونات (6 ساعات)
غاز طبيعي. تمرير الغازات البترولية. النفط ومنتجاته. الخصائص الفيزيائية. طرق تكرير البترول. التقطير. التكسير الحراري والتحفيزي. إنتاج فحم الكوك.
التجارب المعملية.التعرف على عينات المنتجات المكررة.
مهام الحساب.
المركبات العضوية التي تحتوي على الأكسجين (25 سا)
الموضوع 6. الكحوليات والفينولات (6 ساعات).
الكحولات المشبعة أحادية الماء. هيكل الجزيئات ، مجموعة وظيفية. رابطة الهيدروجين. التماثل والتسمية. خصائص الميثانول (الإيثانول) والإنتاج والتطبيق. التأثير الفسيولوجي للكحوليات على جسم الإنسان. العلاقة الجينية للكحولات المشبعة أحادية الماء بالهيدروكربونات.
كحول متعدد الهيدروكسيل. إيثيلين جلايكول ، جلسرين. الخصائص والتطبيق.
الفينولات. هيكل جزيء الفينول. التأثير المتبادل للذرات في الجزيء على مثال جزيء الفينول.خصائص الفينول. سمية الفينول ومركباته. استخدام الفينول.
العروض.تفاعل الفينول مع ماء البروم ومحلول هيدروكسيد الصوديوم.
التجارب المعملية.إذابة الجلسرين في الماء. تفاعل الجلسرين مع هيدروكسيد النحاس (II).
مهام الحساب.حسابات ل معادلات كيميائيةبشرط أن يتم إعطاء أحد المتفاعلات بشكل زائد.
الموضوع 7. الألدهيدات والكيتونات (3 ساعات).
الألدهيدات. هيكل جزيء الفورمالديهايد. مجموعة وظيفية. التماثل والتسمية. خصائص الألدهيدات. الفورمالديهايد والأسيتالديهيد: الإنتاج والتطبيق.
الأسيتون ممثل الكيتونات. هيكل الجزيء. تطبيق.
العروض.تفاعل الميثان (الإيثانيل) مع محلول الأمونيا من أكسيد الفضة (I) وهيدروكسيد النحاس (II). ذوبان في الأسيتون من المواد العضوية المختلفة.
التجارب المعملية.تحضير الإيثانول بأكسدة الإيثانول. أكسدة الميثانال (الإيثانيل) بمحلول أمونيا من أكسيد الفضة (I). أكسدة الميثان (الإيثانيل) مع هيدروكسيد النحاس (II).
الموضوع 8. الأحماض الكربوكسيلية (6 ساعات)
الأحماض الكربوكسيلية أحادية القاعدة. هيكل الجزيئات. مجموعة وظيفية. التماثل والتسمية. خصائص الأحماض الكربوكسيلية. تفاعل الأسترة. الحصول على الأحماض الكربوكسيلية وتطبيقها.
معلومات موجزة عن الأحماض الكربوكسيلية غير المشبعة.
العلاقة الجينية للأحماض الكربوكسيلية مع فئات المركبات العضوية الأخرى.
العمل التطبيقي
تحضير وخصائص الأحماض الكربوكسيلية.
حل المشكلات التجريبية للتعرف على المواد العضوية.
الموضوع 9. الاثيرات المعقدة. الدهون (3 ساعات)
الإسترات: الخصائص ، الإنتاج ، التطبيق. الدهون. هيكل الدهون. الدهون في الطبيعة. ملكيات. تطبيق.
منظفات. قواعد التعامل الآمن مع المواد الكيميائية المنزلية.
التجارب المعملية.ذوبان الدهون ، دليل على طبيعتها غير المشبعة ، تصبن الدهون. مقارنة خصائص الصابون والمنظفات الصناعية. التعرف على عينات المنظفات. دراسة تكوينها وتعليمات استخدامها.
الموضوع 10. الكربوهيدرات (7 ساعات)
الجلوكوز. هيكل الجزيء. التماثل البصري (المرآة). الفركتوز هو أيزومر جلوكوز. خصائص الجلوكوز. تطبيق. السكروز. هيكل الجزيء. الخصائص والتطبيق.
النشا والسليلوز ممثلون للبوليمرات الطبيعية. تفاعل التكاثف المتعدد. الخصائص الفيزيائية والكيميائية. البحث في الطبيعة. تطبيق. ألياف خلات.
التجارب المعملية.تفاعل الجلوكوز مع هيدروكسيد النحاس (II). تفاعل الجلوكوز مع محلول أمونيا من أكسيد الفضة (I). تفاعل السكروز مع هيدروكسيد الكالسيوم. تفاعل النشا مع اليود. التحلل المائي للنشا. التعرف على عينات من الالياف الطبيعية والاصطناعية.
العمل التطبيقي.حل المشكلات التجريبية لإنتاج والتعرف على المواد العضوية.
الموضوع 11. الأمينات والأحماض الأمينية (3 ساعات)
الأمينات.هيكل الجزيئات. مجموعة امينو. الخصائص الفيزيائية والكيميائية. هيكل جزيء الأنيلين. التأثير المتبادل للذرات في الجزيء على مثال جزيء الأنيلين. خصائص الأنيلين. تطبيق.
أحماض أمينية.التماثل والتسمية. ملكيات. الأحماض الأمينية كمركبات عضوية مذبذبة. تطبيق. العلاقة الجينية للأحماض الأمينية مع فئات المركبات العضوية الأخرى.
الموضوع 12. البروتينات (4 ساعات)
السناجب- بوليمرات طبيعية. التكوين والهيكل. الخصائص الفيزيائية والكيميائية. تحول البروتينات في الجسم. التطورات في دراسة وتركيب البروتينات.
مفهوم المركبات الحلقية غير المتجانسة المحتوية على النيتروجين. بيريدين. بيرول. قواعد بيريميدين وبيورين. الأحماض النووية: التركيب والتركيب.
الكيمياء وصحة الإنسان. الأدوية. المشاكل المصاحبة لاستخدام الأدوية.
العروض.صباغة الأقمشة بصبغة الأنيلين. دليل على التوافر المجموعات الوظيفيةفي محاليل الأحماض الأمينية.
التجارب المعملية.تفاعلات اللون للبروتينات (تفاعلات البيوريت والبروتين xantoprotein).
المركبات الجزيئية عالية (7 ساعات)
الموضوع 13. البوليمرات الاصطناعية (7 ساعات)
مفهوم المركبات الجزيئية. البوليمرات التي تم الحصول عليها في تفاعلات البلمرة. هيكل الجزيئات. التركيب المجسم التنظيمي والمجسم للبوليمرات. بولي ايثيلين. بولى بروبلين. اللدونة الحرارية. البوليمرات التي تم الحصول عليها في تفاعلات التكثيف المتعدد. راتنجات الفينول فورمالديهايد. بالحرارة.
المطاط الصناعي. الهيكل والخصائص والحصول والتطبيق.
ألياف تركيبية. كابرون. لافسان.
تعميم المعرفة على مسار الكيمياء العضوية. الكيمياء العضوية الإنسان والطبيعة.
العروض.عينات من البلاستيك والمطاط الصناعي
والألياف الاصطناعية.
التجارب المعملية.دراسة خواص البوليمرات المتلدنة بالحرارة. تقدير الكلور في البولي فينيل كلوريد. دراسة خواص الالياف التركيبية.
العمل التطبيقي.التعرف على اللدائن والألياف.
مهام الحساب.تحديد الكتلة أو الكسر الحجمي لعائد ناتج التفاعل من الممكن نظريًا.
الصف 11
70 ساعة / سنة (2 ساعة / أسبوع ؛ 7 ساعات وقت احتياطي)