ترتيب المعاملات في أمثلة المعادلات الكيميائية. الكيمياء في المدرسة. التحضير للامتحان. يكاترينبورغ

هناك عدة طرق لتحديد المعاملات في معادلات تفاعلات الأكسدة والاختزال. نستخدم طريقة التوازن الإلكتروني ، حيث يتم تجميع معادلة الإجمالي الكامل بالتسلسل التالي:
1. ضع مخطط تفاعل ، يوضح المواد التي تفاعلت والمواد الناتجة عن التفاعل ، على سبيل المثال:
2. تحديد حالة أكسدة الذرات وكتابة علامتها وقيمتها فوق رموز العناصر ، مع تحديد العناصر التي تغيرت حالة الأكسدة الخاصة بها:
3. اكتب المعادلات الإلكترونية لتفاعلات الأكسدة والاختزال ، وحدد عدد الإلكترونات التي تبرع بها عامل الاختزال والتي يقبلها العامل المؤكسد ، ثم قم بتعادلها بضربها في المعاملات المناسبة:
4. يتم تحويل المعاملات التي تم الحصول عليها المقابلة للميزان الإلكتروني إلى المعادلة الرئيسية:
5. معادلة عدد الذرات والأيونات التي لا تغير درجة الأكسدة (في التسلسل: المعادن ، اللافلزات ، الهيدروجين):
6. تحقق من صحة اختيار المعاملات بعدد ذرات الأكسجين في الجزأين الأيمن والأيسر من معادلة التفاعل - يجب أن تكون متساوية (في هذه المعادلة 24 = 18 + 2 + 4 ، 24 = 24).
لنلقِ نظرة على مثال أكثر تعقيدًا:
لنحدد حالات أكسدة الذرات في الجزيئات:
نقوم بتكوين المعادلات الإلكترونية لتفاعلات الأكسدة والاختزال ونعادل عدد الإلكترونات المعطاة والمستلمة:
لننقل المعاملات إلى المعادلة الرئيسية:
معادلة عدد الذرات التي لا تغير حالة الأكسدة:
من خلال حساب عدد ذرات الأكسجين على الجانبين الأيمن والأيسر من المعادلة ، نتأكد من اختيار المعاملات بشكل صحيح.
أهم عوامل الأكسدة والاختزال
تعتمد خصائص الأكسدة والاختزال للعناصر على بنية غلاف الإلكترون للذرات ويتم تحديدها من خلال موقعها في النظام الدوري لمندليف.
المعادن ، التي تحتوي على 1-3 إلكترونات على مستوى الطاقة الخارجية ، تتخلى عنها بسهولة وتظهر فقط خصائص الاختزال. يمكن لغير المعادن (عناصر المجموعات IV-VII) التبرع بالإلكترونات وقبولها على حدٍ سواء ، حتى تتمكن من إظهار خصائص الاختزال والأكسدة. في الفترات التي يزداد فيها العدد الترتيبي للعنصر ، تضعف الخواص المختزلة للمواد البسيطة وتزداد المواد المؤكسدة. في المجموعات التي تحتوي على زيادة في الرقم التسلسلي ، يتم تحسين خصائص الاختزال ، وتضعف الخواص المؤكسدة. هكذا، من المواد البسيطة ، فإن أفضل عوامل الاختزال هي الفلزات القلوية والألمنيوم والهيدروجين والكربون ؛ أفضل العوامل المؤكسدة هي الهالوجينات والأكسجين.
تعتمد خصائص الأكسدة والاختزال للمواد المعقدة على درجة أكسدة الذرات التي تتكون منها. المواد التي تحتوي على ذرات مع أدنى حالة أكسدة تظهر خصائص مختزلة. أهم عوامل الاختزال هي أول أكسيد الكربون.  ، كبريتيد الهيدروجين
، كبريتيد الهيدروجين  ، كبريتات الحديد (II)
، كبريتات الحديد (II)  .المواد التي تحتوي على ذرات ذات أعلى حالة أكسدة تظهر خصائص مؤكسدة. ومن أهم العوامل المؤكسدة برمنجنات البوتاسيوم
.المواد التي تحتوي على ذرات ذات أعلى حالة أكسدة تظهر خصائص مؤكسدة. ومن أهم العوامل المؤكسدة برمنجنات البوتاسيوم  ، ثاني كرومات البوتاسيوم
، ثاني كرومات البوتاسيوم  بيروكسيد الهيدروجين
بيروكسيد الهيدروجين  ، حمض النيتريك
، حمض النيتريك  حمض الكبريتيك المركز
حمض الكبريتيك المركز  .
.
يمكن أن تتصرف المواد التي تحتوي على ذرات بحالة أكسدة وسيطة كعوامل مؤكسدة أو مختزلة.اعتمادًا على خصائص المواد التي تتفاعل معها وظروف التفاعل. حتى في رد فعل مع  يعرض حامض الكبريتيك خصائص مختزلة:
يعرض حامض الكبريتيك خصائص مختزلة:
وعند التفاعل مع كبريتيد الهيدروجين فهو عامل مؤكسد:

بالإضافة إلى ذلك ، بالنسبة لمثل هذه المواد ، تكون تفاعلات الأكسدة الذاتية والشفاء الذاتي ممكنة ، والتي تحدث مع زيادة ونقصان متزامنين في درجة أكسدة ذرات نفس العنصر ، على سبيل المثال:
تعتمد قوة العديد من العوامل المؤكسدة والاختزال على درجة الحموضة في الوسط. علي سبيل المثال، 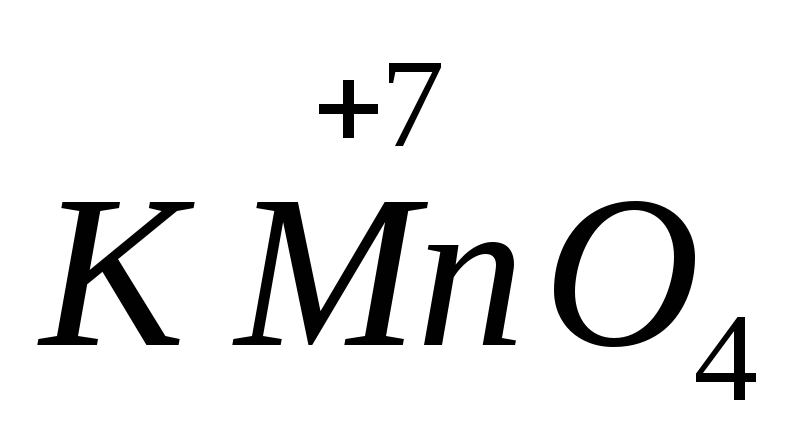 في بيئة قلوية يتم تقليلها إلى
في بيئة قلوية يتم تقليلها إلى  ، في محايد
، في محايد  ، في وجود حامض الكبريتيك - حتى
، في وجود حامض الكبريتيك - حتى  .
.
إل  هل من السهل ترتيب المعاملات في المعادلات الكيميائية؟
هل من السهل ترتيب المعاملات في المعادلات الكيميائية؟
ها هم أطفالي وقد نشأوا على الكيمياء (أنا معلم الصففي فئة 8 "ب"). غالبًا ما يتم إعطاء الكيمياء للأطفال في الدرس الأول ، لكن يوم الخميس ليس لدي الدرس الأول ، وطلبت درسًا مع فالنتينا إيفانوفنا "للنظر إلى الأطفال" والتحقق من اليوميات. لقد أذهلني الموضوع ، في المدرسة أحببت الكيمياء ، ولم أتحقق من المذكرات. مرة أخرى ، كنت مقتنعًا بأن الطلاب غالبًا ما يواجهون صعوبات بسبب حقيقة أنهم لا يرون الاتصالات بين الموضوع. في درس الكيمياء هذا ، كان على الطلاب كتابة معادلات كيميائية من خلال معرفة تكافؤ المواد الكيميائية. وواجه العديد من الطلاب صعوبة في تحديد المعاملات العددية. تم قضاء درس الكيمياء التالي يوم السبت مع فالنتينا إيفانوفنا.
التمرين 1.
اكتب الجمل التالية في شكل معادلات كيميائية:
أ) "أثناء حرق كربونات الكالسيوم ، يتكون أكسيد الكالسيوم وأول أكسيد الكربون (IV)" ؛ ب) "عندما يتفاعل أكسيد الفوسفور (V) مع الماء ، يتم الحصول على حمض الفوسفوريك."
قرار:
أ) كربونات الكالسيوم 3 \ u003d CaO + CO 2 - يكون التفاعل ماصًا للحرارة. لم تكن هناك صعوبات في هذه المهمة ، حيث لم يكن من الضروري البحث عن المعاملات العددية. في البداية ، في الجزأين الأيمن والأيسر من المساواة ، ذرة كالسيوم واحدة ، ذرة كربون وثلاث ذرات أكسجين لكل منهما.
ب) P 2 O 5 + 3H 2 O \ u003d 2H 3 PO 4 - يكون التفاعل طاردًا للحرارة. نشأت مشاكل مع المعادلة الثانية ، بدون معاملات عددية ، لم تظهر المساواة الصحيحة: P 2 O 5 + H 2 O → H 3 PO 4. من الواضح ، لتجميع المساواة الصحيحة ، تحتاج إلى تحديد المعاملات العددية. إذا حددت ، يمكنك البدء بالفوسفور: توجد ذرتان على اليسار ، وواحدة على اليمين ، لذلك نضع عاملاً عدديًا يساوي اثنين أمام صيغة حمض النيتريك ثم نحصل على: P 2 O 5 + H 2 O → 2H 3 PO 4. لكن يبقى الآن معادلة عدد ذرات الأكسجين والهيدروجين: توجد ذرتان من الهيدروجين على اليسار وست ذرات على اليمين ، لذلك نضع معاملًا عدديًا يساوي ثلاثة أمام صيغة الماء ثم نحصل على: P 2 O 5 + 3H 2 O → 2H 3 PO 4. من السهل الآن التأكد من وجود كميات متساوية من ذرات الفوسفور وذرات الهيدروجين والأكسجين في كل جزء من المعادلة ، لذلك حصلنا على معادلة التفاعل الكيميائي الصحيحة: P 2 O 5 + 3H 2 O \ u003d 2H 3 PO 4.
الطريقة الثانية: جبري.لنفترض أننا وضعنا ثلاثة معاملات في المعادلة أ ، ب ، ج ، مما أدى إلى معادلة التفاعل الكيميائي الصحيحة: أ P2O5 + في H 2 O = مع H3PO4. لأن المعادلة تستخدم الذرات ثلاثة أنواع، ثم نصنع نظامًا من ثلاثة المعادلات الخطيةمع ثلاثة مجاهيل أ ، فيو مع .
المواد التي استخدمت في التفاعل الكيميائي: P - الفوسفور ؛ O 2 - أكسجين P 2 O 5 - أكسيد الفوسفور (V).
ج) Fe 2 (SO 4) 3 + KOH → Fe (OH) 3 + K 2 SO 4.
المواد التي استخدمت في التفاعل الكيميائي: Fe 2 (SO 4) 3 - كبريتات الحديد (III) ؛ KOH ، هيدروكسيد البوتاسيوم. Fe (OH) 3 - هيدروكسيد الحديد (III) ؛ K 2 SO 4 - كبريتات البوتاسيوم.
د) CuOH → Cu 2 O + H 2 O.
قرار: 2CuOH \ u003d Cu 2 O + H 2 O. تم حل مشكلة تحديد المعاملات العددية عن طريق تجميع نظام المعادلات: 
المواد التي استخدمت في التفاعل الكيميائي: CuOH - هيدروكسيد النحاس (I) ؛ Cu 2 O - أكسيد النحاس (I) ؛ H 2 O - الماء.
هـ) CS 2 + O 2 → CO 2 + SO 2.
قرار: CS 2 + 3O 2 \ u003d CO 2 + 2SO 2. تقرر عن طريق اختيار المعاملات: معادلة عدد ذرات الكبريت (2) ؛ يساوي عدد ذرات الأكسجين (3).
المواد التي استخدمت في التفاعل الكيميائي: CS 2 - كبريتيد الكبريت (IV) ؛ O2-
المواد التي استخدمت في التفاعل الكيميائي: FeS 2 - بيريت ؛ O 2 - أكسجين Fe 2 O 3 - أكسيد الحديد (III) ؛ SO 2 - أكسيد الكبريت (IV).
التمرين 3
(تم اقتراح حله كعمل مستقل).
شرط:
اكتب المعادلات تفاعلات كيميائيةوفق المخططات التالية:
أ) حامض الفوسفوريك + هيدروكسيد الصوديوم ← فوسفات الصوديوم + ماء ؛
ب) أكسيد الصوديوم + الماء ← هيدروكسيد الصوديوم.
ج) أكسيد الحديد (II) + الألومنيوم ← أكسيد الألومنيوم + الحديد ؛
د) هيدروكسيد النحاس (II) ← أكسيد النحاس (II) + الماء.
إجابه:
أ) 2H 3 PO 4 + 6NaOH \ u003d 2Na 3 PO 4 + 6H 2 O ؛
ب) Na 2 O + H 2 O \ u003d 2NaOH ؛
ج) 3FeO + 2Al = Al 2 O 3 + 3Fe ؛
د) النحاس (أوه) 2 \ u003d CuO + H 2 O.
في 10 دقائق ، أكمل 85٪ من الطلاب المهمة بعلامات ممتازة ، والتي فاجأت فالنتينا إيفانوفنا بسرور.
ترتيب المعامل
يجب أن يكون عدد ذرات عنصر واحد على الجانب الأيسر من المعادلة مساويًا لعدد ذرات هذا العنصر في الجانب الأيمن من المعادلة.
المهمة 1 (للمجموعات).حدد عدد ذرات كل عنصر كيميائي مشترك في التفاعل.
1. احسب عدد الذرات:
أ) الهيدروجين: 8NH3 ، هيدروكسيد الصوديوم ، 6NaOH ، 2NaOH ، H3PO4 ، 2H2SO4 ، 3H2S04 ، 8H2SO4 ؛
6) الأكسجين: C02 ، 3C02 ، 2C02 ، 6CO ، H2SO4 ، 5H2SO4 ، 4H2S04 ، HN03.
2. احسب عدد الذرات: أ)هيدروجين:
1) هيدروكسيد الصوديوم + حمض الهيدروكلوريك 2) CH4 + H20 3) 2Na + H2
ب) الأكسجين:
1) 2CO + 02 2) CO2 + 2H.O. 3) 4NO2 + 2H2O + O2
خوارزمية لترتيب المعاملات في معادلات التفاعلات الكيميائية
A1 + O2 → A12O3A1-1 ذرة A1-2
ذرات O-2 O-3
2. من بين العناصر مع عدد مختلففي الجزأين الأيمن والأيسر من المخطط ، اختر تلك التي يكون عدد ذراتها أكبر
ذرات O-2 على اليسار
ذرات O-3 على اليمين
3. أوجد المضاعف المشترك الأصغر (LCM) لعدد ذرات هذا العنصر على الجانب الأيسر من المعادلة وعدد ذرات هذا العنصر في الجانب الأيمن من المعادلة
المضاعف المشترك الأصغر = 6
4. قسّم المضاعف المشترك الأصغر على عدد ذرات هذا العنصر على الجانب الأيسر من المعادلة ، واحصل على المعامل الخاص بالجانب الأيسر من المعادلة
6:2 = 3
آل + 3O 2 → آل 2 ا 3
5. اقسم المضاعف المشترك الأصغر على عدد ذرات هذا العنصر على الجانب الأيمن من المعادلة ، واحصل على المعامل الخاص بالجانب الأيمن من المعادلة
6:3 = 2
A1 + O 2 → 2A1 2 O3
6. إذا غيّر معامل المجموعة عدد ذرات عنصر آخر ، فكرر الخطوات 3 و 4 و 5 مرة أخرى.
A1 + 3O 2 → → 2A1 2 ا 3
A1 -1 ذرة A1 - 4
المضاعف المشترك الأصغر = 4
4:1=4 4:4=1
4A1 + ZO 2 → → 2A1 2 ا 3
. الاختبار الأساسي لاكتساب المعرفة (8-10 دقائق .).
توجد ذرتان من الأكسجين على الجانب الأيسر من الرسم التخطيطي ، وواحدة على الجانب الأيمن. يجب محاذاة عدد الذرات باستخدام المعاملات.
1) 2 ملغ + س2 → 2MgO
2) كربونات الكالسيوم3 + 2HCl → CaCl2 + ح2 O + CO2
المهمة 2 رتب المعاملات في معادلات التفاعلات الكيميائية (لاحظ أن المعامل يغير عدد ذرات عنصر واحد فقط):
1. Fe 2 ا 3 + أ ل → لكن ل 2 ا 3 + الحديد ؛ ملغ + ن 2 → ملغ 3 ن 2 ;
2 آل + س → ال 2 س 3 ؛ A1 + مع → ال 4 ج 3 ;
3. آل + كر 2 ا 3 → Cr + Al 2 ا 3 ؛ كاليفورنيا + ص → كاليفورنيا 3 ص 2 ;
4. C + ح 2 → CH 4 ; كاليفورنيا + ج → CaS 2 ;
5. Fe + O 2 → الحديد 3 ا 4 ؛ سي + ملغ → ملغ 2 سي.
6 / نا + س → نا 2 س؛ CaO + مع → CaC 2 + أول أكسيد الكربون ؛
7.Ca + N 2 → ج أ 3 ن 2 ؛ سي + Cl 2 → SiCl 4 ;
8 حج + س → اي جي 2 س؛ ح 2 + مع ل 2 → NS ل ؛
9. ن 2 + س 2 → لا؛ لذا 2 + مع → لذا ;
10.HI → ح 2 → + 1 2 ؛ ملغ + NS ل → مغكل 2 + ح 2 ;
11. FeS + NS 1 → FeCl 2 + ح 2 س؛ الزنك + حمض الهيدروكلوريك → زنكل 2 + ح 2 ;
12.Br 2 + KI → KBr + أنا 2 ؛ سي + HF (ص) → SiF 4 + ح 2 ;
1. / HCl+Na 2 كو 3 → كو 2 + ح 2 O + كلوريد الصوديوم ؛ بوكلو 3 + S. → → بوكل + سو 2 ;
14. cl 2 + KBr → KCl + Br 2 ؛ SiO 2 + مع → سي + كو ؛
15. SiO 2 + مع → كربيد + أول أكسيد الكربون ؛ ملغ + شافي 2 → ملغ 2 Si + MgO
16 .
3. ماذا تعني علامة "+" في المعادلة؟
4. لماذا وضع المعاملات في المعادلات الكيميائية
في الدرس 13 "" من الدورة " كيمياء الدمى»ضع في اعتبارك ما هي المعادلات الكيميائية ؛ تعلم كيفية معادلة التفاعلات الكيميائية التنسيب الصحيحالمعاملات. سيطلب منك هذا الدرس أن تعرف قواعد كيميائيةمن الدروس السابقة. تأكد من قراءة تحليل العناصر للحصول على نظرة مفصلة على الصيغ التجريبية والتحليل الكيميائي.
نتيجة لتفاعل احتراق الميثان CH 4 في الأكسجين O 2 ، يتكون ثاني أكسيد الكربون CO 2 والماء H 2 O. يمكن وصف هذا التفاعل معادلة كيميائية:
- CH 4 + O 2 → CO 2 + H 2 O (1)
دعنا نحاول استخراج معلومات أكثر من المعادلة الكيميائية من مجرد إشارة المنتجات والكواشفتفاعلات. المعادلة الكيميائية (1) ليست كاملة وبالتالي لا تعطي أي معلومات حول عدد جزيئات O 2 المستهلكة لكل جزيء 1 CH 4 وكم عدد جزيئات CO 2 و H2 O التي تم الحصول عليها نتيجة لذلك. ولكن إذا كتبنا معاملات عددية أمام الصيغ الجزيئية المقابلة ، والتي تشير إلى عدد الجزيئات من كل نوع التي تشارك في التفاعل ، فسنحصل على معادلة كيميائية كاملةتفاعلات.
لإكمال تكوين المعادلة الكيميائية (1) ، عليك أن تتذكر قاعدة بسيطة واحدة: يجب أن يحتوي الجانبان الأيمن والأيسر من المعادلة نفس العددذرات من كل نوع ، لأنه أثناء التفاعل الكيميائي لا يتم تكوين ذرات جديدة ولا يتم تدمير الذرات الموجودة. هذه القاعدةيستند إلى قانون الحفاظ على الكتلة ، والذي ناقشناه في بداية الفصل.
من الضروري الحصول على واحدة كاملة من معادلة كيميائية بسيطة. لذا ، دعنا ننتقل إلى المعادلة المباشرة للتفاعل (1): انظر مرة أخرى إلى المعادلة الكيميائية ، بالضبط في الذرات والجزيئات على الجانبين الأيمن والأيسر. من السهل أن نرى أن ثلاثة أنواع من الذرات تشارك في التفاعل: الكربون C ، الهيدروجين H والأكسجين O. دعونا نحسب ونقارن عدد ذرات كل نوع على الجانبين الأيمن والأيسر من المعادلة الكيميائية.

لنبدأ بالكربون. على الجانب الأيسر ، تعد ذرة C واحدة جزءًا من جزيء CH 4 ، وعلى الجانب الأيمن ، تعد ذرة C واحدة جزءًا من CO 2. وبالتالي ، فإن عدد ذرات الكربون في الجانب الأيسر والجانب الأيمن هو نفسه ، لذلك نتركه وشأنه. ولكن من أجل الوضوح ، نضع المعامل 1 أمام الجزيئات مع الكربون ، على الرغم من أن هذا ليس ضروريًا:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
ثم ننتقل إلى حساب ذرات الهيدروجين H. على الجانب الأيسر توجد 4 ذرات H (بالمعنى الكمي H 4 = 4H) في تكوين جزيء CH 4 ، وعلى اليمين - 2 ذرات H فقط في تكوين جزيء H 2 O ، وهو أقل مرتين من الجانب الأيسر من المعادلة الكيميائية (2). دعونا نعادل! للقيام بذلك ، نضع العامل 2 أمام جزيء H 2 O. الآن سيكون لدينا 4 جزيئات هيدروجين H في كل من الكواشف والنواتج:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
يرجى ملاحظة أن المعامل 2 ، الذي كتبناه أمام جزيء الماء H 2 O لمعادلة الهيدروجين H ، يضاعف جميع الذرات التي يتكون منها تركيبه ، أي 2H 2 O يعني 4H و 2O. حسنًا ، يبدو أنه تم فرز هذا ، ويبقى حساب ومقارنة عدد ذرات الأكسجين O في المعادلة الكيميائية (3). إنه يلفت الانتباه على الفور أنه في الجانب الأيسر من ذرات O أقل مرتين بالضبط من الجانب الأيمن. أنت الآن تعرف بالفعل كيفية معادلة المعادلات الكيميائية بنفسك ، لذلك سأقوم على الفور بتدوين النتيجة النهائية:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O أو CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
كما ترى ، فإن معادلة التفاعلات الكيميائية ليست بالأمر الصعب ، وليست الكيمياء هي المهمة هنا ، بل الرياضيات. المعادلة (4) تسمى معادلة كاملةتفاعل كيميائي ، لأنه يلاحظ فيه قانون حفظ الكتلة ، أي عدد الذرات من كل نوع التي تدخل التفاعل هو بالضبط عدد الذرات من هذا النوع في نهاية التفاعل. يحتوي كل جزء من هذه المعادلة الكيميائية الكاملة على ذرة كربون واحدة و 4 ذرات هيدروجين و 4 ذرات أكسجين. ومع ذلك ، فإن الأمر يستحق فهم الزوجين نقاط مهمة: تفاعل كيميائي تسلسل معقدمراحل وسيطة منفصلة ، وبالتالي من المستحيل ، على سبيل المثال ، تفسير المعادلة (4) بمعنى أن جزيء ميثان واحد يجب أن يصطدم في نفس الوقت بجزيئي أكسجين. تعتبر العمليات التي تحدث أثناء تكوين نواتج التفاعل أكثر تعقيدًا. النقطة الثانية: معادلة كاملةلا يخبرنا التفاعل بأي شيء عن آليته الجزيئية ، أي عن تسلسل الأحداث التي تحدث على المستوى الجزيئي أثناء مساره.
معاملات في معادلات التفاعلات الكيميائية
اخر مثال جيدكيفية الترتيب بشكل صحيح احتمالفي معادلات التفاعلات الكيميائية: يتحد Trinitrotoluene (TNT) C 7 H 5 N 3 O 6 بقوة مع الأكسجين ، مكونًا H 2 O و CO 2 و N 2. نكتب معادلة التفاعل ، والتي سنكافئها:
- ج 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
من الأسهل كتابة المعادلة الكاملة بناءً على جزيئين من مادة تي إن تي ، حيث يحتوي الجانب الأيسر عدد فرديذرات الهيدروجين والنيتروجين وفي اليمين - حتى:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
ثم يتضح أن 14 ذرة كربون و 10 ذرات هيدروجين و 6 ذرات نيتروجين يجب أن تتحول إلى 14 جزيء من ثاني أكسيد الكربون و 5 جزيئات ماء و 3 جزيئات نيتروجين:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
الآن كلا الجزأين يحتويان على نفس العدد من جميع الذرات باستثناء الأكسجين. من بين 33 ذرة أكسجين موجودة على الجانب الأيمن من المعادلة ، يتم توفير 12 ذرة بواسطة جزيئي TNT الأصلي ، ويجب توفير الـ 21 المتبقية بواسطة جزيئات 10.5 O 2. وبالتالي ، فإن المعادلة الكيميائية الكاملة ستبدو كما يلي:
- 2C 7 H 5 N 3 O 6 + 10.5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
يمكنك ضرب كلا الجانبين في 2 والتخلص من العامل غير الصحيح 10.5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
لكن هذا لا يمكن القيام به ، لأن جميع معاملات المعادلة لا يجب أن تكون أعدادًا صحيحة. بل إنه من الأصح عمل معادلة بناءً على جزيء TNT واحد:
- ج 7 H 5 N 3 O 6 + 5.25O 2 → 7CO 2 + 2.5H 2 O + 1.5N 2 (10)
تحمل المعادلة الكيميائية الكاملة (9) الكثير من المعلومات. بادئ ذي بدء ، يشير إلى المواد الأولية - الكواشف، إلى جانب منتجاتتفاعلات. بالإضافة إلى ذلك ، يُظهر أنه أثناء التفاعل يتم الحفاظ على جميع الذرات من كل نوع على حدة. إذا ضربنا طرفي المعادلة (9) في رقم أفوجادرو N A = 6.022 10 23 ، يمكننا القول أن 4 مولات من مادة تي إن تي تتفاعل مع 21 مولًا من O 2 لتكوين 28 مولًا من ثاني أكسيد الكربون ، و 10 مولات من H 2 O و 6 مولات من N 2.
هناك ميزة أخرى. باستخدام الجدول الدوري ، نحدد الأوزان الجزيئيةكل هذه المواد:
- C 7 H 5 N 3 O 6 = 227.13 جم / مول
- O2 = 31.999 جم / مول
- ثاني أكسيد الكربون = 44.010 جم / مول
- H2O = 18.015 جم / مول
- N2 = 28.013 جم / مول
ستشير المعادلة 9 الآن أيضًا إلى أن 4227.13 جم \ u003d 908.52 جم من مادة تي إن تي تتطلب 21 31.999 جم \ u003d 671.98 جم من الأكسجين لإكمال التفاعل ونتيجة لذلك تم تشكيل 28 44.010 جم \ u003d 1232.3 جم ثاني أكسيد الكربون ، 10 18.015 جم = 180.15 جم H 2 O و 6 28.013 جم = 168.08 جم N 2. دعنا نتحقق مما إذا كان قانون حفظ الكتلة يتحقق في هذا التفاعل:
| الكواشف | منتجات | |
| 908.52 جرام من مادة تي إن تي | 1232.3 جرام من ثاني أكسيد الكربون | |
| 671.98 جرام من ثاني أكسيد الكربون | 180.15 جرام H2O | |
| 168.08 جرام N2 | ||
| المجموع | 1580.5 جرام | 1580.5 جرام |
لكن ليس من الضروري أن تشارك الجزيئات الفردية في تفاعل كيميائي. على سبيل المثال ، تفاعل الحجر الجيري CaCO3 و حمض الهيدروكلوريكحمض الهيدروكلوريك ، مع تكوين محلول مائي من كلوريد الكالسيوم CaCl2 وثاني أكسيد الكربون CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
تصف المعادلة الكيميائية (11) تفاعل كربونات الكالسيوم CaCO 3 (الحجر الجيري) وحمض الهيدروكلوريك HCl لتكوين محلول مائي من كلوريد الكالسيوم CaCl 2 وثاني أكسيد الكربون CO 2. هذه المعادلة كاملة ، لأن عدد الذرات من كل نوع في جانبيها الأيمن والأيسر متماثل.
معنى هذه المعادلة هو المستوى العياني (الضرس)يكون على النحو التالي: 1 مول أو 100.09 جم من كربونات الكالسيوم 3 يتطلب 2 مول أو 72.92 جم من حمض الهيدروكلوريك لإكمال التفاعل ، مما ينتج عنه 1 مول من CaCl 2 (110.99 جم / مول) ، CO 2 (44.01 جم / مول) و H 2 O (18.02 جم / مول). من هذه البيانات العددية ، من السهل التحقق من استيفاء قانون حفظ الكتلة في هذا التفاعل.
تفسير المعادلة (11) في المستوى المجهري (الجزيئي)ليس واضحًا جدًا ، نظرًا لأن كربونات الكالسيوم عبارة عن ملح وليس مركبًا جزيئيًا ، وبالتالي من المستحيل فهم المعادلة الكيميائية (11) بمعنى أن جزيء واحد من كربونات الكالسيوم CaCO 3 يتفاعل مع جزيئين من حمض الهيدروكلوريك. علاوة على ذلك ، فإن جزيء حمض الهيدروكلوريك في المحلول يتفكك (يتحلل) بشكل عام إلى H + و Cl - أيونات. والكثير الوصف الصحيحما يحدث في هذا التفاعل على المستوى الجزيئي يعطي المعادلة:
- CaCO 3 (صلب) + 2H + (aq.) → Ca 2+ (aq.) + CO 2 (g.) + H 2 O (l.) (12)
هنا ، بين قوسين ، يتم اختصار الحالة الفيزيائية لكل نوع من الجسيمات ( تلفزيون.- صعب، عبد القدير.هو أيون رطب في محلول مائي ، ج.- غاز، نحن سوف.- سائل).
توضح المعادلة (12) أن كربونات الكالسيوم 3 الصلبة تتفاعل مع أيوني H + رطب ، وتشكل أيون Ca 2+ موجب ، و CO 2 و H 2 O. المعادلة (12) ، مثل المعادلات الكيميائية الكاملة الأخرى ، لا تعطي فكرة عن تتفاعل الآلية الجزيئية وتكون أقل ملاءمة لحساب كمية المواد ، ومع ذلك ، فإنها تعطي أفضل وصفيحدث على المستوى المجهري.
عزز معرفتك بصياغة المعادلات الكيميائية من خلال التحليل المستقل للمثال باستخدام الحل:
أتمنى من الدرس 13 " تجميع المعادلات الكيميائية»لقد تعلمت شيئًا جديدًا لنفسك. إذا كان لديك أي أسئلة ، فاكتبها في التعليقات.
تعليمات
قبل الشروع في المهمة نفسها ، عليك أن تتعلم أن الرقم الذي تم وضعه من قبل عنصر كيميائيأو الصيغة الكاملة بالمعامل. وشكل الوقوف (وقليلا) الفهرس. بالإضافة إلى ذلك:
ينطبق المعامل على جميع الرموز الكيميائية التي تليها في الصيغة
المعامل مضروب في الفهرس (لا يضيف!)
يجب أن تتطابق ذرات كل عنصر من عناصر المواد المتفاعلة مع عدد ذرات هذه العناصر المتضمنة في نواتج التفاعل.
على سبيل المثال ، الصيغة 2H2SO4 تعني 4 H (هيدروجين) ، 2 S (كبريت) ، و 8 O (أكسجين) ذرات.
1. مثال رقم 1. ضع في الاعتبار احتراق الإيثيلين.
عند الاحتراق المواد العضويةيتكون أول أكسيد الكربون (IV) ( نشبع) و الماء. لنجرب المعاملات واحدًا تلو الآخر.
C2H4 + O2 => CO2 + H2O
نبدأ في التحليل. دخلت 2 ذرات C (كربون) في التفاعل ، وتم الحصول على ذرة واحدة فقط ، مما يعني أننا وضعنا 2 أمام ثاني أكسيد الكربون ، والآن أصبح عددها كما هو.
C2H4 + O2 => 2CO2 + H2O
انظر الآن إلى H (الهيدروجين). دخلت 4 ذرات هيدروجين في التفاعل ، ونتيجة لذلك تم الحصول على ذرتين فقط ، لذلك وضعنا 2 أمام H2O (الماء) - والآن نحصل أيضًا على 4
C2H4 + O2 => 2CO2 + 2H2O
نحن نعتبر جميع ذرات O (الأكسجين) التي تشكلت نتيجة التفاعل (أي بعد المساواة). 4 ذرات في 2CO2 و 2 ذرات في 2H2O - 6 ذرات في المجموع. وقبل التفاعل ، هناك ذرتان فقط ، مما يعني أننا وضعنا 3 أمام جزيء الأكسجين O2 ، مما يعني أن هناك أيضًا 6 ذرات.
C2H4 + 3O2 => 2CO2 + 2H2O
وهكذا ، فقد ظهر نفس عدد ذرات كل عنصر قبل وبعد علامة التساوي.
C2H4 + 3O2 => 2CO2 + 2H2O
2. مثال رقم 2. ضع في الاعتبار تفاعل تفاعل الألومنيوم مع حمض الكبريتيك المخفف.
Al + H2SO4 => Al2 (SO4) 3 + H2
ننظر إلى ذرات S التي تتكون منها Al2 (SO4) 3 - يوجد 3 منها ، وفي H2SO4 (حمض الكبريتيك) 1 فقط ، لذلك ، نضع 3 أيضًا أمام حامض الكبريتيك.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
ولكن الآن اتضح قبل تفاعل 6 ذرات من H (الهيدروجين) ، وبعد التفاعل 2 فقط ، مما يعني أننا وضعنا 3 أمام جزيء H2 (الهيدروجين) ، بحيث نحصل بشكل عام على 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
أخيرًا ، انظر إلى. نظرًا لوجود ذرتين من الألومنيوم فقط في Al2 (SO4) 3 (كبريتات الألومنيوم) ، فإننا نضع 2 قبل التفاعل قبل Al (الألومنيوم).
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
الآن عدد جميع الذرات قبل وبعد التفاعل هو نفسه. اتضح أنه ليس من الصعب ترتيب المعاملات في المعادلات الكيميائية. مجرد ممارسة كافية وستكون بخير.
تأكد من أن تضع في اعتبارك أن المعامل مضروب في الفهرس ، وليس مضافًا.
مصادر:
- كيف تتفاعل العناصر
- اختبار حول الموضوع " المعادلات الكيميائية»
بالنسبة للعديد من أطفال المدارس ، اكتب معادلات التفاعلات الكيميائية ورتبها بشكل صحيح احتمالليست مهمة سهلة. علاوة على ذلك ، لسبب ما ، فإن الجزء الثاني منه هو الذي يسبب لهم الصعوبة الرئيسية. يبدو أنه لا يوجد شيء صعب في ذلك ، لكن في بعض الأحيان يستسلم الطلاب ، فيقع في ارتباك تام. لكن عليك فقط أن تتذكر القليل قواعد بسيطة، ولن تتسبب المهمة في صعوبات بعد الآن.
تعليمات
المعامل ، أي الرقم الموجود أمام صيغة الجزيء المواد الكيميائية، لجميع الشخصيات ، ومضروبة في كل شخصية! يتكاثر ، لا يضيف! قد يبدو الأمر مذهلاً ، لكن بعض الطلاب يضيفون رقمين بدلاً من ضربهما.
يجب أن يتطابق عدد ذرات كل عنصر من عناصر المواد الأولية (أي تلك الموجودة على الجانب الأيسر من المعادلة) مع عدد ذرات كل عنصر من نواتج التفاعل (على التوالي ، تلك الموجودة على جانبه الأيمن).