Quem propôs o modelo planetário do átomo. Quem propôs o modelo nuclear da estrutura do átomo? Modelo nuclear da estrutura do átomo e seu esquema
Um dos primeiros modelos da estrutura do átomo foi proposto J. Thomson em 1904, o Atom foi apresentado como um "mar de eletricidade positiva" com elétrons oscilando nele. A carga negativa total dos elétrons de um átomo eletricamente neutro foi igualada à sua carga positiva total.
A experiência de Rutherford
Para testar a hipótese de Thomson e mais definição exata estrutura do átomo E. Rutherford organizou uma série de experimentos sobre espalhamento α -partículas finas placas de metal - folha. Em 1910, os alunos de Rutherford Hans Geiger e Ernest Marsden realizou experimentos de bombardeio α - partículas finas placas metálicas. Eles descobriram que a maioria α -as partículas passam pela folha sem mudar sua trajetória. E isso não foi surpreendente, se aceitarmos a exatidão do modelo do átomo de Thomson.
Fonte α - a radiação foi colocada em um cubo de chumbo com um canal perfurado nele, para que fosse possível obter um fluxo α -partículas voando em uma determinada direção. As partículas alfa são átomos de hélio duplamente ionizados ( Não 2+). Eles têm uma carga positiva de +2 e uma massa quase 7350 vezes a massa de um elétron. Atingindo uma tela revestida com sulfeto de zinco, α -partículas o faziam brilhar, e com uma lupa podia-se ver e contar os flashes individuais que aparecem na tela quando cada α -partículas. Uma folha foi colocada entre a fonte de radiação e a tela. A partir dos flashes na tela foi possível julgar a dispersão α -partículas, i.e. sobre seu desvio da direção original ao passar pela camada de metal.
Acontece que a maioria α -as partículas passam pela folha sem mudar sua direção, embora a espessura da folha corresponda a centenas de milhares de diâmetros atômicos. Mas alguns compartilham α - as partículas ainda são desviadas por pequenos cantos, mas ocasionalmente α -partículas mudaram abruptamente a direção de seu movimento e até (cerca de 1 em 100.000) foram jogadas para trás, como se tivessem encontrado um grande obstáculo. Casos de um desvio tão acentuado α -as partículas podiam ser observadas movendo a tela com uma lupa em arco.
A partir dos resultados deste experimento, as seguintes conclusões podem ser tiradas:
- Há algum "obstáculo" no átomo, que tem sido chamado de núcleo.
- O núcleo tem uma carga positiva (caso contrário, carregado positivamente α partículas não seriam refletidas de volta).
- O núcleo é muito pequeno em comparação com o tamanho do próprio átomo (apenas uma pequena parte α -partículas mudaram de direção).
- O núcleo tem mais massa que a massa α -partículas.
Rutherford explicou os resultados do experimento propondo modelo "planetário" do átomo comparou-o ao sistema solar. De acordo com o modelo planetário, no centro do átomo há um núcleo muito pequeno, cujo tamanho é aproximadamente 100.000 vezes tamanhos menores o próprio átomo. Este núcleo contém quase toda a massa do átomo e carrega uma carga positiva. Os elétrons se movem ao redor do núcleo, cujo número é determinado pela carga do núcleo. A trajetória externa dos elétrons determina dimensões externasátomo. O diâmetro de um átomo é de cerca de 10 -8 cm, e o diâmetro do núcleo é de cerca de 10 -13 ÷10 -12 cm.
Quanto mais carga núcleo atômico, mais forte ele irá repelir α -partícula, mais frequentemente haverá casos de fortes desvios α -partículas que passam pela camada de metal, a partir da direção original do movimento. Portanto, experimentos de espalhamento α -partículas tornam possível não apenas detectar a existência de um núcleo atômico, mas também determinar sua carga. Já se deduzia dos experimentos de Rutherford que a carga do núcleo (expressa em unidades da carga do elétron) é numericamente igual ao número ordinal do elemento no sistema periódico. foi confirmado G. Moseley, que em 1913 estabeleceu uma relação simples entre os comprimentos de onda de certas linhas do espectro de raios X de um elemento e seu número de série, e D. Chadwick, que em 1920 determinou com grande precisão as cargas dos núcleos atômicos de vários elementos por espalhamento α -partículas.
O significado físico do número de série de um elemento no sistema periódico foi estabelecido: o número de série acabou sendo a constante mais importante do elemento, expressando a carga positiva do núcleo de seu átomo. Da neutralidade elétrica do átomo, segue-se que o número de elétrons girando em torno do núcleo é igual ao número ordinal do elemento.
Essa descoberta deu uma nova justificativa para o arranjo dos elementos no sistema periódico. Ao mesmo tempo, eliminou a aparente contradição no sistema de Mendeleev - a posição de alguns elementos de maior massa atômica à frente de elementos de menor massa atômica (telúrio e iodo, argônio e potássio, cobalto e níquel). Descobriu-se que não há contradição aqui, pois o lugar de um elemento no sistema é determinado pela carga do núcleo atômico. Foi estabelecido experimentalmente que a carga do núcleo do átomo de telúrio é 52 e a do átomo de iodo é 53; portanto, telúrio, apesar da grande massa atômica, deve resistir ao iodo. Da mesma forma, as cargas dos núcleos de argônio e potássio, níquel e cobalto correspondem totalmente à sequência de arranjo desses elementos no sistema.
Assim, a carga do núcleo atômico é a principal quantidade da qual dependem as propriedades do elemento e sua posição no sistema periódico. É por isso lei periódica de Mendeleev atualmente pode ser formulado da seguinte forma:
As propriedades dos elementos e as substâncias simples e complexas formadas por eles estão em uma dependência periódica da carga do núcleo dos átomos dos elementos.
A determinação dos números de série dos elementos pelas cargas dos núcleos de seus átomos permitiu estabelecer número total coloca no sistema periódico entre o hidrogênio, que tem número de série 1, e o urânio (número atômico 92), que era considerado na época o último membro do sistema periódico de elementos. Quando a teoria da estrutura do átomo foi criada, os lugares 43, 61, 72, 75, 85 e 87 permaneceram desocupados, o que indicava a possibilidade da existência de elementos ainda não descobertos. E, de fato, em 1922, foi descoberto o elemento háfnio, que substituiu o 72; então em 1925 - rênio, classificado 75. Elementos a serem ocupados pelos quatro restantes lugares gratuitos as tabelas revelaram-se radioativas e não foram encontradas na natureza, mas foram obtidas artificialmente. Os novos elementos foram nomeados tecnécio (número 43), promécio (61), astato (85) e frâncio (87). Atualmente, todas as células do sistema periódico entre hidrogênio e urânio estão cheias. No entanto, ela sistema periódico não está concluído.
Espectros atômicos
O modelo planetário foi um passo importante na teoria da estrutura do átomo. No entanto, em alguns aspectos, contradizia fatos bem estabelecidos. Vamos considerar duas dessas contradições.
Primeiro, a teoria de Rutherford não poderia explicar a estabilidade do átomo. Um elétron girando em torno de um núcleo carregado positivamente deve, como uma carga elétrica oscilante, emitir energia eletromagnética na forma de ondas de luz. Mas, ao emitir luz, o elétron perde parte de sua energia, o que leva a um desequilíbrio entre a força centrífuga associada à rotação do elétron e a força de atração eletrostática do elétron ao núcleo. Para restaurar o equilíbrio, o elétron deve se aproximar do núcleo. Assim, o elétron, irradiando continuamente energia eletromagnética e movendo-se em espiral, se aproximará do núcleo. Tendo esgotado toda a sua energia, ele deve “cair” sobre o núcleo, e o átomo deixará de existir. Essa conclusão contradiz as propriedades reais dos átomos, que são formações estáveis e podem existir sem serem destruídos por um tempo extremamente longo.
Em segundo lugar, o modelo de Rutherford levou a conclusões incorretas sobre a natureza dos espectros atômicos. Quando a luz emitida por um corpo sólido ou líquido quente passa através de um prisma de vidro ou de quartzo, um chamado espectro contínuo é observado em uma tela colocada atrás do prisma, cuja parte visível é uma faixa colorida contendo todas as cores do prisma. arco Iris. Este fenômeno é explicado pelo fato de que a radiação de um corpo sólido ou líquido quente consiste em ondas eletromagnéticas de várias frequências. Ondas de diferentes frequências são refratadas de forma desigual por um prisma e caem sobre lugares diferentes tela. Constelação de frequência radiação eletromagnética, emitido pela substância, e é chamado de espectro de emissão. Por outro lado, as substâncias absorvem a radiação de certas frequências. A totalidade deste último é chamada de espectro de absorção de uma substância.
Para obter um espectro, em vez de um prisma, você pode usar uma grade de difração. Este último é uma placa de vidro, em cuja superfície são aplicados traços paralelos finos a uma distância muito próxima um do outro (até 1500 traços por 1 mm). Ao passar por essa grade, a luz se decompõe e forma um espectro semelhante ao obtido com um prisma. A difração é inerente a qualquer movimento ondulatório e serve como uma das principais provas da natureza ondulatória da luz.
Quando aquecida, uma substância emite raios (radiação). Se a radiação tem um comprimento de onda, então é chamada de monocromática. Na maioria dos casos, a radiação é caracterizada por vários comprimentos de onda. Quando a radiação é decomposta em componentes monocromáticos, obtém-se um espectro de radiação, onde seus componentes individuais são expressos por linhas espectrais.
Os espectros obtidos por radiação de átomos livres ou fracamente ligados (por exemplo, em gases ou vapores) são chamados de espectros atômicos.
A radiação emitida por sólidos ou líquidos sempre dá um espectro contínuo. A radiação emitida por gases e vapores quentes, em contraste com a radiação de sólidos e líquidos, contém apenas certos comprimentos de onda. Portanto, em vez de uma faixa contínua na tela, é obtida uma série de linhas coloridas separadas por lacunas escuras. O número e a localização dessas linhas dependem da natureza do gás ou vapor quente. Assim, o vapor de potássio dá - um espectro composto por três linhas - duas vermelhas e uma violeta; existem várias linhas vermelhas, amarelas e verdes no espectro de vapores de cálcio, etc.
A radiação emitida por sólidos ou líquidos sempre dá um espectro contínuo. A radiação emitida por gases e vapores quentes, em contraste com a radiação de sólidos e líquidos, contém apenas certos comprimentos de onda. Portanto, em vez de uma faixa contínua na tela, é obtida uma série de linhas coloridas separadas por lacunas escuras. O número e a localização dessas linhas dependem da natureza do gás ou vapor quente. Assim, o vapor de potássio fornece um espectro composto por três linhas - duas vermelhas e uma violeta; existem várias linhas vermelhas, amarelas e verdes no espectro de vapores de cálcio, etc.
Esses espectros são chamados de espectros de linha. Verificou-se que a luz emitida pelos átomos dos gases possui um espectro de linhas, no qual as linhas espectrais podem ser combinadas em série.
Em cada série, a disposição das linhas corresponde a um determinado padrão. As frequências de linhas individuais podem ser descritas Fórmula de Balmer:
O fato de os átomos de cada elemento fornecerem um espectro completamente específico inerente apenas a este elemento, e a intensidade das linhas espectrais correspondentes ser tanto maior quanto maior for o conteúdo do elemento na amostra retirada, é amplamente utilizado para determinar a qualidade qualitativa. e composição quantitativa de substâncias e materiais. Esse método de pesquisa é chamado análise espectral.
O modelo planetário da estrutura do átomo revelou-se incapaz de explicar o espectro de emissão de linhas dos átomos de hidrogênio e, mais ainda, a combinação de linhas espectrais em uma série. Um elétron girando em torno do núcleo deve se aproximar do núcleo, mudando continuamente a velocidade de seu movimento. A frequência da luz emitida por ele é determinada pela frequência de sua rotação e, portanto, deve estar em constante mudança. Isso significa que o espectro de radiação de um átomo deve ser contínuo, contínuo. De acordo com este modelo, a frequência de radiação de um átomo deve ser igual à frequência de vibração mecânica ou ser um múltiplo dela, o que é inconsistente com a fórmula de Balmer. Assim, a teoria de Rutherford não poderia explicar nem a existência de átomos estáveis nem a presença de seus espectros de linha.
teoria quântica da luz
Em 1900 M. Prancha mostrou que a capacidade de um corpo aquecido de emitir radiação pode ser descrita quantitativamente corretamente apenas assumindo que a energia radiante é emitida e absorvida pelos corpos não continuamente, mas discretamente, ou seja, em porções separadas - quanta. Ao mesmo tempo, a energia E cada porção está relacionada com a frequência de radiação por uma relação chamada Equações de Planck:
o próprio Planck por muito tempo acreditava que a emissão e absorção de luz pelos quanta é uma propriedade dos corpos radiantes, e não da própria radiação, que é capaz de ter qualquer energia e, portanto, poderia ser absorvida continuamente. No entanto, em 1905 Einstein, analisando o fenômeno do efeito fotoelétrico, chegou à conclusão de que a energia eletromagnética (radiante) existe apenas na forma de quanta e que, portanto, a radiação é um fluxo de "partículas" de material indivisível (fótons), cuja energia é determinado equação de Planck.

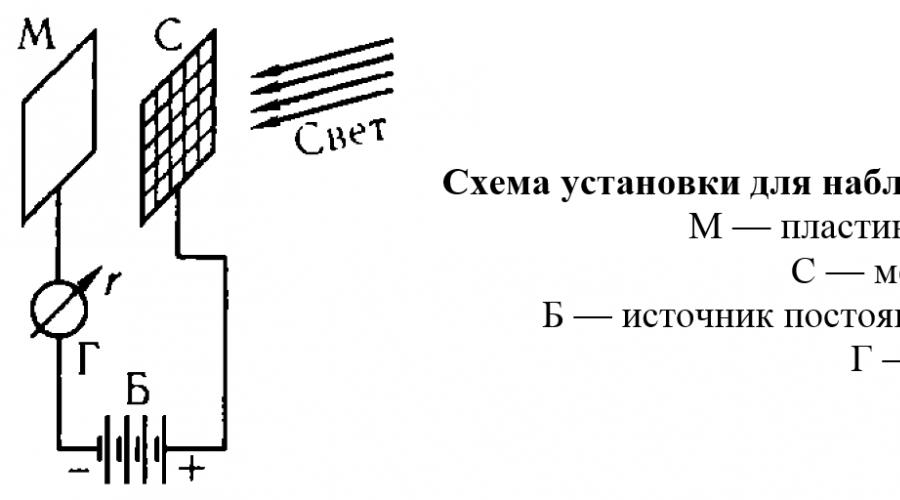
efeito fotoelétrico A emissão de elétrons por um metal sob a ação da luz incidente sobre ele é chamada. Este fenômeno foi estudado em detalhes em 1888-1890. A. G. Stoletov. Se você colocar a configuração em um vácuo e aplicar na placa M potencial negativo, então não haverá corrente no circuito, pois não há partículas carregadas no espaço entre a placa e a grade que possam transportar corrente elétrica. Mas quando a placa é iluminada com uma fonte de luz, o galvanômetro detecta a ocorrência de uma corrente (chamada fotocorrente), cujos portadores são os elétrons puxados pela luz do metal.
Descobriu-se que quando a intensidade da luz muda, apenas o número de elétrons emitidos pelo metal muda, ou seja, força da fotocorrente. Mas o máximo energia cinética de cada elétron emitido do metal não depende da intensidade da iluminação, mas muda apenas quando a frequência da luz incidente no metal muda. É com o aumento do comprimento de onda (ou seja, com a diminuição da frequência) que a energia dos elétrons emitidos pelo metal diminui, e então, em um comprimento de onda determinado para cada metal, o efeito fotoelétrico desaparece e não aparece mesmo a muito alta intensidade de luz. Assim, quando iluminado com luz vermelha ou laranja, o sódio não apresenta efeito fotoelétrico e passa a emitir elétrons apenas em comprimento de onda inferior a 590 nm (luz amarela); no lítio, o efeito fotoelétrico é detectado em níveis ainda mais baixos comprimentos de onda, a partir de 516 nm (luz verde); e retirar elétrons da platina sob a ação da luz visível não ocorre e começa apenas quando a platina é irradiada com raios ultravioleta.
Essas propriedades do efeito fotoelétrico são completamente inexplicáveis do ponto de vista da teoria ondulatória clássica da luz, segundo a qual o efeito deve ser determinado (para um determinado metal) apenas quantidade de energia absorvida pela superfície do metal por unidade de tempo, mas não deve depender do tipo de radiação incidente no metal. No entanto, essas mesmas propriedades recebem uma explicação simples e convincente se assumirmos que a radiação consiste em porções separadas, fótons, com uma energia bem definida.
De fato, um elétron em um metal está ligado aos átomos do metal, de modo que uma certa quantidade de energia deve ser gasta para retirá-lo. Se o fóton tiver a quantidade de energia necessária (e a energia do fóton for determinada pela frequência da radiação), o elétron será ejetado e o efeito fotoelétrico será observado. No processo de interação com o metal, o fóton cede completamente sua energia ao elétron, porque o fóton não pode ser dividido em partes. A energia do fóton será em parte gasta na quebra da ligação entre o elétron e o metal e em parte na transmissão da energia cinética do movimento ao elétron. Portanto, a energia cinética máxima de um elétron expulso de um metal não pode ser maior que a diferença entre a energia do fóton e a energia de ligação de um elétron com átomos de metal. Consequentemente, com um aumento no número de fótons incidentes na superfície do metal por unidade de tempo (ou seja, com um aumento na intensidade de iluminação), apenas o número de elétrons ejetados do metal aumentará, o que levará a um aumento na fotocorrente, mas a energia de cada elétron não aumentará. Se a energia do fóton for menor que a energia mínima necessária para ejetar um elétron, o efeito fotoelétrico não será observado para qualquer número de fótons incidentes no metal, ou seja, em qualquer intensidade de luz.
teoria quântica da luz, desenvolvido Einstein, foi capaz de explicar não só as propriedades do efeito fotoelétrico, mas também as leis da ação química da luz, dependência da temperatura capacidade calorífica dos sólidos e uma série de outros fenômenos. Acabou sendo extremamente útil no desenvolvimento de ideias sobre a estrutura de átomos e moléculas.
A partir de teoria quântica luz, segue-se que o fóton é incapaz de se fragmentar: ele interage como um todo com o elétron do metal, derrubando-o da placa; como um todo, ele também interage com a substância sensível à luz do filme fotográfico, fazendo com que ele escureça em um determinado ponto, e assim sucessivamente, nesse sentido, o fóton se comporta como uma partícula, ou seja, apresenta propriedades corpusculares. No entanto, o fóton também possui propriedades ondulatórias: isso se manifesta na natureza ondulatória da propagação da luz, na capacidade do fóton de interferir e difração. Um fóton difere de uma partícula no sentido clássico do termo, pois sua posição exata no espaço, como a posição exata de qualquer onda, não pode ser especificada. Mas também difere da onda "clássica" - a incapacidade de dividir em partes. Combinando propriedades corpusculares e ondulatórias, o fóton não é, estritamente falando, nem partícula nem onda - tem uma dualidade corpuscular-onda.
Palestra: Modelo planetário do átomo
A estrutura do átomo
A maneira mais precisa de determinar a estrutura de qualquer substância é a análise espectral. A radiação de cada átomo de um elemento é exclusivamente individual. No entanto, antes de entender como ocorre a análise espectral, vamos descobrir qual estrutura tem um átomo de qualquer elemento.
A primeira suposição sobre a estrutura do átomo foi apresentada por J. Thomson. Este cientista muito tempoátomos estudados. Além disso, é ele o dono da descoberta do elétron - pelo qual recebeu premio Nobel. O modelo que Thomson propôs não tinha nada a ver com a realidade, mas serviu como um incentivo forte o suficiente para Rutherford estudar a estrutura do átomo. O modelo proposto por Thomson foi chamado de "pudim de passas".

Thomson acreditava que o átomo é uma bola sólida com uma carga elétrica negativa. Para compensar isso, os elétrons são intercalados na bola, como passas. Em suma, a carga dos elétrons coincide com a carga de todo o núcleo, o que torna o átomo neutro.
Durante o estudo da estrutura do átomo, descobriu-se que todos os átomos em sólidos comprometer-se movimentos oscilatórios. E, como você sabe, qualquer partícula em movimento irradia ondas. É por isso que cada átomo tem seu próprio espectro. No entanto, essas afirmações não se encaixavam de forma alguma no modelo de Thomson.
A experiência de Rutherford
Para confirmar ou refutar o modelo de Thomson, Rutherford propôs um experimento que resultou no bombardeio de um átomo de algum elemento por partículas alfa. Como resultado desse experimento, era importante ver como a partícula se comportaria.
As partículas alfa foram descobertas como resultado do decaimento radioativo do rádio. Seus fluxos eram raios alfa, cada partícula com uma carga positiva. Como resultado de vários estudos, foi determinado que a partícula alfa é como um átomo de hélio, no qual não há elétrons. Usando o conhecimento atual, sabemos que a partícula alfa é o núcleo de hélio, enquanto Rutherford acreditava que eram íons de hélio.
Cada partícula alfa tinha uma energia tremenda, como resultado da qual poderia voar em alta velocidade nos átomos em questão. Portanto, o principal resultado do experimento foi determinar o ângulo de deflexão das partículas.
Para o experimento, Rutherford usou folha fina de ouro. Ele dirigiu partículas alfa de alta velocidade para ele. Ele assumiu que, como resultado desse experimento, todas as partículas voariam através da folha, e com pequenos desvios. No entanto, para ter certeza, ele instruiu seus alunos a verificar se havia grandes desvios nessas partículas.

O resultado do experimento surpreendeu a todos, porque muitas partículas não apenas se desviaram por um ângulo suficientemente grande - alguns ângulos de deflexão chegaram a mais de 90 graus.
Esses resultados surpreenderam a todos, Rutherford disse que parecia que um pedaço de papel foi colocado no caminho dos projéteis, o que não permitiu que a partícula alfa penetrasse no interior, como resultado do qual voltou.
Se o átomo fosse realmente sólido, então teria que ter algum campo elétrico, o que desacelerou a partícula. No entanto, a força do campo não foi suficiente para detê-la completamente, muito menos empurrá-la para trás. Isso significa que o modelo de Thomson foi refutado. Então Rutherford começou a trabalhar em um novo modelo.
Modelo Rutherford
Para obter esse resultado do experimento, é necessário concentrar a carga positiva em menor quantidade, resultando em um campo elétrico maior. De acordo com a fórmula do potencial de campo, pode-se determinar tamanho necessário uma partícula positiva que poderia repelir uma partícula alfa na direção oposta. Seu raio deve ser da ordem de máximo 10-15m. É por isso que Rutherford propôs o modelo planetário do átomo.

Este modelo é chamado assim por um motivo. O fato é que dentro do átomo existe um núcleo carregado positivamente, semelhante ao Sol no sistema solar. Os elétrons giram em torno do núcleo como planetas. O sistema solar está organizado de tal forma que os planetas são atraídos pelo Sol com a ajuda de forças gravitacionais, porém, eles não caem na superfície do Sol em função da velocidade disponível que os mantém em sua órbita. A mesma coisa acontece com os elétrons - as forças de Coulomb atraem elétrons para o núcleo, mas devido à rotação, eles não caem na superfície do núcleo.
Uma suposição de Thomson acabou sendo absolutamente correta - a carga total dos elétrons corresponde à carga do núcleo. No entanto, como resultado de uma interação forte, os elétrons podem ser expulsos de sua órbita, como resultado, a carga não é compensada e o átomo se transforma em um íon carregado positivamente.
Altamente informação importante em relação à estrutura do átomo é que quase toda a massa do átomo está concentrada no núcleo. Por exemplo, um átomo de hidrogênio tem apenas um elétron, cuja massa é mais de mil e quinhentas vezes menor que a massa do núcleo.
| | |
Os modelos históricos1 do átomo refletem os níveis de conhecimento correspondentes a um determinado período do desenvolvimento da ciência.
A primeira etapa no desenvolvimento de modelos atômicos caracterizou-se pela ausência de dados experimentais sobre sua estrutura.
Explicando os fenômenos do microcosmo, os cientistas buscaram analogias no macrocosmo, apoiando-se nas leis da mecânica clássica.
J. Dalton, o criador do atomismo químico (1803), assumiu que os átomos do mesmo elemento químico são as mesmas partículas esféricas menores e, portanto, indivisíveis.
O físico francês Jean Baptiste Perrin (1901) propôs um modelo que de fato antecipou o modelo "planetário". De acordo com este modelo, um núcleo carregado positivamente está localizado no centro do átomo, em torno do qual os elétrons carregados negativamente se movem em certas órbitas, como planetas ao redor do Sol. O modelo de Perrin não atraiu a atenção dos cientistas, pois forneceu apenas uma característica qualitativa, mas não quantitativa, do átomo (na Fig. 7, isso é mostrado pela discrepância entre a carga do núcleo atômico e o número de elétrons).
Em 1902, o físico inglês William Thomson (Kelvin) desenvolveu a ideia de um átomo como uma partícula esférica carregada positivamente, dentro da qual oscilam elétrons carregados negativamente (irradiam e absorvem energia). Kelvin chamou a atenção para o fato de que o número de elétrons é igual à carga positiva da esfera, portanto, em geral, o átomo não possui carga elétrica(Fig. 7).
Um ano depois, o físico alemão Philipp Lenard propôs um modelo segundo o qual o átomo é uma esfera oca, dentro da qual existem dipolos elétricos (dinamidas). O volume ocupado por esses dipolos é muito menor que o volume da esfera, e a parte principal do átomo está vazia.
De acordo com as ideias do físico japonês Gontaro (Hantaro) Nagaoka (1904), um núcleo carregado positivamente está localizado no centro do átomo, e os elétrons se movem no espaço ao redor do núcleo em anéis planos semelhantes aos anéis do planeta Saturno (este modelo foi chamado de átomo "saturniano"). A maioria dos cientistas não prestou atenção às ideias de Nagaoka, embora até certo ponto tenham algo em comum com a ideia moderna do orbital atômico.
Nenhum dos modelos considerados (Fig. 7) explicou como as propriedades elementos químicos associados à estrutura de seus átomos.
Arroz. 7. Alguns modelos históricos do átomo
Em 1907, J. J. Thomson propôs um modelo estático da estrutura do átomo, representando o átomo como uma partícula esférica carregada de eletricidade positiva, na qual os elétrons carregados negativamente são distribuídos uniformemente. modelo"pudim", Figura 7).
Cálculos matemáticos mostraram que os elétrons em um átomo devem estar localizados em anéis dispostos concentricamente. Thomson chegou a uma conclusão muito importante: a razão da mudança periódica nas propriedades dos elementos químicos está associada às características da estrutura eletrônica de seus átomos. Graças a isso, o modelo do átomo de Thomson foi muito apreciado por seus contemporâneos. No entanto, não explicou certos fenômenos, por exemplo, o espalhamento de partículas α quando passam por uma placa de metal.
Com base em suas idéias sobre o átomo, Thomson derivou uma fórmula para calcular o desvio médio das partículas α, e esse cálculo mostrou que a probabilidade de dispersão de tais partículas em grandes ângulos é próxima de zero. No entanto, foi provado experimentalmente que aproximadamente uma em cada oito mil partículas alfa que caem na folha de ouro é desviada através de um ângulo maior que 90°. Isso contradizia o modelo de Thomson, que assumia desvios apenas em pequenos ângulos.
Ernest Rutherford, resumindo dados experimentais, em 1911 propôs um modelo "planetário" (às vezes chamado de "nuclear") da estrutura do átomo, segundo o qual 99,9% da massa do átomo e sua carga positiva estão concentradas em um núcleo muito pequeno, e elétrons carregados negativamente, o número que é igual à carga do núcleo, giram em torno dele, como planetas sistema solar 1 (Fig. 7).
Rutherford, junto com seus alunos, montou experimentos que possibilitaram investigar a estrutura do átomo (Fig. 8). Uma corrente de partículas carregadas positivamente (partículas α) foi direcionada para a superfície de uma folha fina de metal (ouro) 2 de uma fonte de radiação radioativa 1. No caminho, foi instalada uma tela fluorescente 3, que possibilitou observar a direção do movimento posterior das partículas α.

Arroz. 8. A experiência de Rutherford
Verificou-se que a maioria das partículas α passou pela folha, praticamente sem mudar de direção. Apenas partículas individuais (uma média de uma em dez mil) foram desviadas e voaram quase na direção oposta. Concluiu-se que a maior parte da massa do átomo está concentrada no núcleo carregado positivamente, razão pela qual as partículas α são tão fortemente desviadas (Fig. 9).

Arroz. 9. Espalhamento de partículas α por um núcleo atômico
Os elétrons que se movem em um átomo, de acordo com as leis do eletromagnetismo, devem irradiar energia e, ao perdê-la, ser atraídos para o núcleo de carga oposta e, portanto, "cair" sobre ele. Isso deveria levar ao desaparecimento do átomo, mas como isso não aconteceu, concluiu-se que esse modelo era inadequado.
No início do século 20, o físico alemão Max Planck e o físico teórico Albert Einstein criaram a teoria quântica da luz. De acordo com essa teoria, a energia radiante, como a luz, é emitida e absorvida não continuamente, mas em porções separadas (quanta). Além disso, a magnitude do quantum de energia não é a mesma para diferentes radiações e é proporcional à frequência de oscilação. onda eletromagnética: Е = hν, onde h – A constante de Planck igual a 6,6266 10 -34 J s, ν é a frequência de radiação. Esta energia é transportada por partículas de luz - fótons.
Em uma tentativa de combinar artificialmente as leis da mecânica clássica e da teoria quântica, o físico dinamarquês Niels Bohr em 1913 complementou o modelo do átomo de Rutherford com dois postulados sobre uma mudança gradual (discreta) na energia dos elétrons em um átomo. Bohr acreditava que um elétron em um átomo de hidrogênio só pode ser localizado em pontos bem definidos. órbitas estacionárias, cujos raios estão relacionados entre si como quadrados números naturais (1 2: 2 2: 3 2: ... :página 2). Os elétrons se movem ao redor do núcleo atômico em órbitas estacionárias. O átomo está em estado estável, sem absorver ou emitir energia - este é o primeiro postulado de Bohr. De acordo com o segundo postulado, a emissão de energia ocorre apenas quando um elétron se move para uma órbita mais próxima do núcleo atômico. Quando um elétron se move para uma órbita mais distante, a energia é absorvida pelo átomo. Este modelo foi aprimorado em 1916 pelo físico teórico alemão Arnold Sommerfeld, que apontou o movimento dos elétrons ao longo órbitas elípticas.
O modelo planetário, devido à sua visibilidade e aos postulados de Bohr, há muito é utilizado para explicar fenômenos atômicos e moleculares. No entanto, descobriu-se que o movimento de um elétron em um átomo, a estabilidade e as propriedades de um átomo, em contraste com o movimento dos planetas e a estabilidade do sistema solar, não podem ser descritos pelas leis da mecânica clássica. Essa mecânica é baseada nas leis de Newton, e o objeto de seu estudo é o movimento de corpos macroscópicos, realizado em velocidades que são pequenas em comparação com a velocidade da luz. Para descrever a estrutura do átomo, é necessário aplicar os conceitos da mecânica quântica (ondulatória) sobre a natureza de onda corpuscular dual das micropartículas, que foram formulados na década de 1920 por físicos teóricos: o francês Louis de Broglie, os alemães Werner Heisenberg e Erwin Schrödinger, o inglês Paul Dirac e outros.
Em 1924, Louis de Broglie apresentou a hipótese de que o elétron tem propriedades ondulatórias (o primeiro princípio mecânica quântica) e propôs uma fórmula para calcular seu comprimento de onda. A estabilidade de um átomo é explicada pelo fato de que os elétrons nele não se movem em órbitas, mas em certas regiões do espaço ao redor do núcleo, chamadas de orbitais atômicos. O elétron ocupa quase todo o volume do átomo e não pode "cair sobre o núcleo" localizado em seu centro.
Em 1926, Schrödinger, continuando o desenvolvimento das idéias de L. de Broglie sobre as propriedades ondulatórias de um elétron, selecionou empiricamente uma equação matemática semelhante à equação de vibração de cordas, que pode ser usada para calcular as energias de ligação de um elétron em um átomo em diferentes níveis de energia. Esta equação tornou-se a equação básica da mecânica quântica.
A descoberta das propriedades ondulatórias do elétron mostrou que a disseminação do conhecimento sobre o macrocosmo para os objetos do microcosmo é ilegal. Em 1927, Heisenberg estabeleceu que é impossível determinar a posição exata no espaço de um elétron com uma certa velocidade, portanto, as idéias sobre o movimento de um elétron em um átomo são de natureza probabilística (o segundo princípio da mecânica quântica).
O modelo da mecânica quântica do átomo (1926) descreve o estado do átomo através de funções matemáticas e não possui uma expressão geométrica (Fig. 10). Tal modelo não considera a natureza dinâmica da estrutura do átomo e a questão do tamanho de um elétron como partícula. Acredita-se que os elétrons ocupam certos níveis de energia e emitem ou absorvem energia durante as transições para outros níveis. Na fig. 10 níveis de energia são mostrados esquematicamente como anéis concêntricos localizados a diferentes distâncias do núcleo atômico. As setas mostram as transições de elétrons entre os níveis de energia e a emissão de fótons que acompanham essas transições. O esquema é mostrado qualitativamente e não reflete as distâncias reais entre os níveis de energia, que podem diferir entre si por dezenas de vezes.
Em 1931, o cientista americano Gilbert White propôs pela primeira vez uma representação gráfica dos orbitais atômicos e um modelo "orbital" do átomo (Fig. 10). Modelos de orbitais atômicos são usados para refletir o conceito de "densidade de elétrons" e para demonstrar a distribuição de carga negativa em torno de um núcleo em um átomo ou um sistema de núcleos atômicos em uma molécula.

Arroz. 10. Histórico e modelos modernosátomo
Em 1963, o artista, escultor e engenheiro americano Kenneth Snelson propôs um "modelo anelar" das camadas eletrônicas de um átomo (Fig. 10), o que explica a distribuição quantitativa dos elétrons em um átomo sobre camadas eletrônicas estáveis. Cada elétron é modelado por um ímã de anel (ou um circuito fechado com uma corrente elétrica com um momento magnético). Os ímãs de anel são atraídos um pelo outro e formam formas simétricas de anéis - anelhedra. A presença de dois pólos em ímãs impõe uma limitação opções possíveis montagens de anéis. Modelos de camadas de elétrons estáveis são as figuras mais simétricas dos anéis, compostas levando em consideração a presença de suas propriedades magnéticas.
A presença de um spin em um elétron (veja a Seção 5) é uma das principais razões para a formação de camadas estáveis de elétrons em um átomo. Os elétrons formam pares com spins opostos. O modelo de face anelar de um par de elétrons, ou um orbital atômico preenchido, são dois anéis localizados em planos paralelos em lados opostos do núcleo atômico. Quando mais de um par de elétrons está localizado próximo ao núcleo de um átomo, os anéis-elétrons são forçados a se orientar mutuamente, formando uma camada eletrônica. Ao mesmo tempo, anéis próximos direções diferentes magnético linhas de força, que é denotado cor diferente anéis representando elétrons.
O experimento do modelo mostra que o mais estável de todos os modelos de faces anulares possíveis é o modelo de 8 anéis. Geometricamente, o modelo é formado de tal forma como se um átomo em forma de esfera fosse dividido em 8 partes (metade três vezes) e um elétron de anel fosse colocado em cada parte. Nos modelos de face anelar, são usados anéis de duas cores: vermelho e azul, que refletem o valor positivo e negativo do spin do elétron.
O "modelo de face de onda" (Fig. 10) é semelhante ao modelo de "face de anel", com a diferença de que cada elétron de um átomo é representado por um anel de "onda", que contém um número inteiro de ondas (como proposto por L. de Broglie).
A interação dos elétrons da camada eletrônica neste modelo do átomo é mostrada pela coincidência dos pontos de contato dos anéis de "onda" azul e vermelho com os nós das ondas estacionárias.
Os modelos do átomo têm o direito de existir e os limites de aplicação. Qualquer modelo de um átomo é uma aproximação que reflete de forma simplificada uma certa parte do conhecimento sobre o átomo. Mas nenhum dos modelos reflete totalmente as propriedades do átomo ou de suas partículas constituintes.
Muitos modelos hoje são apenas de interesse histórico. Ao construir modelos de objetos do micromundo, os cientistas confiaram no que pode ser observado diretamente. Assim surgiram os modelos de Perrin e Rutherford (uma analogia com a estrutura do sistema solar), Nagaoka (uma espécie de planeta Saturno), Thomson ("pudim de passas"). Algumas ideias foram descartadas (modelo dinâmico de Lenard), outras foram revisitadas depois de algum tempo, mas em um novo nível teórico mais elevado: os modelos Perrin e Kelvin foram desenvolvidos nos modelos Rutherford e Thomson. As idéias sobre a estrutura do átomo estão sendo constantemente aprimoradas. Quão preciso é o modelo moderno - "mecânico quântico" - o tempo dirá. É por isso que um ponto de interrogação é desenhado no topo da espiral, simbolizando o caminho da cognição (Fig. 7).
A ideia de que os átomos são as menores partículas da matéria surgiu pela primeira vez na Grécia antiga. No entanto, apenas em final do XVIII século, graças ao trabalho de cientistas como A. Lavoisier, M. V. Lomonosov e alguns outros, provou-se que os átomos realmente existem. No entanto, naqueles dias, ninguém se perguntava qual era sua estrutura interna. Os cientistas ainda consideravam os átomos como os "tijolos" indivisíveis que compõem toda a matéria.
Tenta explicar a estrutura do átomo
Quem propôs o modelo nuclear primeiro de todos os cientistas? A primeira tentativa de criar um modelo dessas partículas pertenceu a J. Thomson. No entanto, não pode ser chamado de sucesso no sentido pleno da palavra. Afinal, Thomson acreditava que o átomo é um sistema esférico e eletricamente neutro. Ao mesmo tempo, o cientista assumiu que a carga positiva é distribuída uniformemente pelo volume dessa bola e dentro dela há um núcleo carregado negativamente. Todas as tentativas do cientista de explicar a estrutura interna do átomo foram infrutíferas. Ernest Rutherford foi quem propôs o modelo nuclear da estrutura do átomo alguns anos depois que Thomson apresentou sua teoria.

Histórico de Pesquisa
Com a ajuda do estudo da eletrólise em 1833, Faraday conseguiu estabelecer que a corrente na solução eletrolítica é um fluxo de partículas carregadas, ou íons. Com base nesses estudos, ele foi capaz de determinar a carga mínima de um íon. Também um papel importante no desenvolvimento dessa direção na física foi desempenhado pelo químico doméstico D. I. Mendeleev. Foi ele quem primeiro levantou nos círculos científicos a questão de que todos os átomos podem ter a mesma natureza. Vemos que antes do modelo nuclear de Rutherford da estrutura do átomo ser proposto pela primeira vez, um grande número de experimentos igualmente importantes foi realizado por uma variedade de cientistas. Eles avançaram a teoria atomística da estrutura da matéria.

Primeiras experiências
Rutherford é um cientista verdadeiramente brilhante, porque suas descobertas viraram a ideia da estrutura da matéria de cabeça para baixo. Em 1911, ele conseguiu montar um experimento com o qual os pesquisadores puderam examinar as misteriosas profundezas do átomo, para ter uma ideia de qual é sua estrutura interna. Os primeiros experimentos foram realizados por cientistas com o apoio de outros pesquisadores, porém o papel principal na abertura pertencia a Rutherford.

Experimentar
Usando fontes naturais radiação radioativa Rutherford foi capaz de construir um canhão que emitia um fluxo de partículas alfa. Era uma caixa feita de chumbo, dentro da qual havia uma substância radioativa. O canhão tinha uma fenda através da qual todas as partículas alfa atingiam a tela principal. Eles só podiam voar através do slot. Várias outras telas estavam no caminho desse feixe de partículas radioativas.
Eles separaram partículas que se desviaram da direção previamente definida. Um golpe estritamente focado atingiu o alvo. Como alvo, Rutherford usou folha fina da folha de ouro. Depois que as partículas atingiram esta folha, elas continuaram seu movimento e eventualmente atingiram a tela fluorescente, que foi instalada atrás desse alvo. Quando as partículas alfa atingiam essa tela, flashes eram registrados, pelos quais o cientista poderia julgar quantas partículas se desviam da direção original ao colidir com a folha e qual é a magnitude desse desvio.

Diferenças de experiências anteriores
Alunos e estudantes interessados naqueles que propuseram o modelo nuclear da estrutura do átomo devem saber que experimentos semelhantes foram realizados em física antes de Rutherford. Eles Ideia principal era coletar o maior número possível Mais Informações sobre a estrutura do átomo. Todos esses estudos levaram ao acúmulo de uma certa quantidade de informações na ciência, provocaram a reflexão sobre estrutura interna as menores partículas.
Já no início do século 20, os cientistas sabiam que o átomo contém elétrons com carga negativa. Mas entre a maioria dos pesquisadores, a opinião predominante era de que o átomo de dentro é mais como uma grade cheia de partículas carregadas negativamente. Experiências semelhantes permissão para obter muitas informações - por exemplo, para determinar dimensões geométricasátomos.
suposição de gênio
Rutherford notou que nenhum de seus predecessores jamais havia tentado determinar se as partículas alfa poderiam se desviar em ângulos muito grandes de sua trajetória. O antigo modelo, às vezes chamado de “pudim de passas” entre os cientistas (porque de acordo com esse modelo, os elétrons no átomo são distribuídos como passas no pudim), simplesmente não permitia a existência de componentes estruturais densos dentro do átomo. Nenhum dos cientistas sequer se preocupou em considerar essa opção. O pesquisador pediu a seu aluno que reequipasse a instalação de tal forma que também fossem registrados grandes desvios de partículas da trajetória - apenas para excluir tal possibilidade. Imagine a surpresa tanto do cientista quanto de seu aluno quando descobriu que algumas partículas se separam em um ângulo de 180º.
O que há dentro de um átomo?
Aprendemos quem propôs o modelo nuclear da estrutura do átomo e qual foi a experiência desse cientista. Naquela época, o experimento de Rutherford foi um verdadeiro avanço. Ele foi forçado a concluir que dentro do átomo, a maior parte da massa está contida em uma substância muito densa. O esquema do modelo nuclear da estrutura do átomo é extremamente simples: dentro está um núcleo carregado positivamente.
Outras partículas, chamadas elétrons, giram em torno desse núcleo. O resto é várias ordens de magnitude menos densa. O arranjo dos elétrons dentro de um átomo não é caótico - as partículas estão dispostas em ordem crescente de energia. O pesquisador chamou as partes internas dos átomos de núcleos. Os nomes que o cientista introduziu ainda são usados na ciência.
Como se preparar para a aula?
Aqueles alunos que estão interessados naqueles que sugeriram o modelo nuclear da estrutura do átomo podem mostrar conhecimento adicional na lição. Por exemplo, você pode dizer como Rutherford, muito depois de seus experimentos, gostava de fazer uma analogia para sua descoberta. O país sul-africano é contrabandeado com armas para os rebeldes, que estão envoltas em fardos de algodão. Como os funcionários da alfândega podem determinar exatamente onde estão os suprimentos perigosos se todo o trem está cheio desses fardos? O funcionário da alfândega pode começar a atirar nos fardos, e onde as balas ricocheteiam, e há uma arma. Rutherford enfatizou que foi assim que sua descoberta foi feita.
Alunos que estão se preparando para responder sobre este tópico na lição, é aconselhável preparar respostas para as seguintes perguntas:
1. Quem propôs o modelo nuclear da estrutura do átomo?
2. Qual foi o significado do experimento?
3. Diferença do modelo nuclear de outros modelos.

Importância da teoria de Rutherford
As conclusões radicais que Rutherford tirou de seus experimentos fizeram muitos de seus contemporâneos duvidarem da validade desse modelo. Mesmo o próprio Rutherford não foi exceção - ele publicou os resultados de sua pesquisa apenas dois anos após a descoberta. Tomando como base as ideias clássicas sobre como as micropartículas se movem, ele propôs um modelo planetário nuclear da estrutura do átomo. Em geral, o átomo tem uma carga neutra. Os elétrons se movem ao redor do núcleo, assim como os planetas giram ao redor do sol. Este movimento ocorre devido às forças de Coulomb. No momento, o modelo de Rutherford passou por um refinamento significativo, mas a descoberta do cientista não perde sua relevância hoje.
O modelo planetário do átomo foi proposto por E. Rutherford em 1910. Os primeiros estudos da estrutura do átomo foram feitos por ele com a ajuda de partículas alfa. Com base nos resultados obtidos em experimentos de espalhamento, Rutherford sugeriu que toda a carga positiva do átomo está concentrada em um minúsculo núcleo em seu centro. Por outro lado, os elétrons carregados negativamente são distribuídos por todo o resto de seu volume.
Um pouco de fundo
A primeira suposição brilhante sobre a existência de átomos foi feita pelo antigo cientista grego Demócrito. Desde então, a ideia da existência de átomos, cujas combinações dão todas as substâncias ao nosso redor, não saiu da imaginação das pessoas da ciência. De tempos em tempos, seus vários representantes se voltavam para ela, mas até o início do século XIX, suas construções eram apenas hipóteses, não suportadas por dados experimentais.
Finalmente, em 1804, mais de cem anos antes do surgimento do modelo planetário do átomo, o cientista inglês John Dalton forneceu evidências de sua existência e introduziu o conceito de peso atômico, que foi sua primeira característica quantitativa. Como seus predecessores, ele imaginou que os átomos fossem os menores pedaços de matéria, como bolas sólidas, que não podiam ser divididas em partículas ainda menores.
Descoberta do elétron e o primeiro modelo do átomo
Quase um século se passou quando, finalmente, em final do XIX século, o inglês J. J. Thomson também descobriu o primeiro partícula subatômica, um elétron carregado negativamente. Como os átomos são eletricamente neutros, Thomson pensou que eles deveriam ser compostos de um núcleo carregado positivamente com elétrons espalhados por todo o seu volume. Baseado em vários resultados obtido experimentalmente, em 1898 ele propôs seu modelo do átomo, às vezes chamado de “ameixas em um pudim”, porque o átomo nele era representado como uma esfera cheia de algum líquido carregado positivamente, no qual os elétrons eram incorporados, como “ameixas em um pudim". O raio de tal modelo esférico era de cerca de 10 -8 cm A carga positiva total do líquido é equilibrada de forma simétrica e uniforme pelas cargas negativas dos elétrons, conforme mostrado na figura abaixo.
Esse modelo explicou satisfatoriamente o fato de que, quando uma substância é aquecida, ela começa a emitir luz. Embora essa tenha sido a primeira tentativa de entender o que era um átomo, ela não satisfez os resultados dos experimentos realizados posteriormente por Rutherford e outros. Thomson concordou em 1911 que seu modelo simplesmente não poderia responder como e por que ocorre o espalhamento de raios α observados em experimentos. Portanto, foi abandonado e substituído por um modelo planetário mais perfeito do átomo.
Afinal, como o átomo está organizado?
Ernest Rutherford forneceu uma explicação do fenômeno da radioatividade que lhe rendeu o Prêmio Nobel, mas sua contribuição mais significativa para a ciência veio depois, quando estabeleceu que o átomo consiste em um núcleo denso cercado por órbitas de elétrons, assim como o Sol é cercado pelas órbitas dos planetas.

De acordo com o modelo planetário do átomo, a maior parte de sua massa está concentrada em um núcleo minúsculo (comparado ao tamanho do átomo inteiro). Os elétrons se movem ao redor do núcleo, viajando a velocidades incríveis, mas a maior parte do volume dos átomos é espaço vazio.
O tamanho do núcleo é tão pequeno que seu diâmetro é 100.000 vezes menor que o de um átomo. O diâmetro do núcleo foi estimado por Rutherford como 10 -13 cm, em contraste com o tamanho do átomo - 10-8 cm. Fora do núcleo, os elétrons giram em torno dele com altas velocidades, resultando em forças centrífugas que equilibram as forças eletrostáticas de atração entre prótons e elétrons.
experimentos de Rutherford
O modelo planetário do átomo surgiu em 1911, após experimento famoso com folha de ouro, o que permitiu obter algumas informações fundamentais sobre sua estrutura. O caminho de Rutherford para a descoberta do núcleo atômico é bom exemplo o papel da criatividade na ciência. Sua busca começou em 1899, quando descobriu que certos elementos emitem partículas carregadas positivamente que podem penetrar em qualquer coisa. Ele chamou essas partículas de partículas alfa (α) (agora sabemos que eram núcleos de hélio). Como todos os bons cientistas, Rutherford era curioso. Ele se perguntou se as partículas alfa poderiam ser usadas para descobrir a estrutura de um átomo. Rutherford decidiu apontar um feixe de partículas alfa em uma folha de folha de ouro muito fina. Ele escolheu o ouro porque poderia produzir folhas tão finas quanto 0,00004 cm. Atrás da folha de ouro, ele colocou uma tela que brilhava quando partículas alfa a atingiam. Foi usado para detectar partículas alfa depois de terem passado pela folha. Uma pequena fenda na tela permitia que o feixe de partículas alfa alcançasse a folha após sair da fonte. Alguns deles devem passar pela folha e continuar a se mover na mesma direção, a outra parte deve ricochetear na folha e ser refletida sob cantos afiados. Você pode ver o esquema do experimento na figura abaixo.

O que aconteceu no experimento de Rutherford?
Com base no modelo do átomo de J. J. Thomson, Rutherford assumiu que as regiões sólidas de carga positiva que preenchem todo o volume de átomos de ouro desviariam ou curvariam as trajetórias de todas as partículas alfa à medida que passassem pela folha.
No entanto, a grande maioria das partículas alfa passou direto pela folha de ouro como se nem estivesse lá. Eles pareciam estar passando pelo espaço vazio. Apenas alguns deles se desviam do caminho reto, como se supunha no início. Abaixo está um gráfico do número de partículas espalhadas na respectiva direção versus o ângulo de espalhamento.

Surpreendentemente, uma pequena porcentagem das partículas ricocheteou do papel alumínio, como uma bola de basquete quicando em uma tabela. Rutherford percebeu que esses desvios eram o resultado de uma colisão direta entre as partículas alfa e os componentes carregados positivamente do átomo.
O núcleo ocupa o centro do palco
Com base na porcentagem insignificante de partículas alfa refletidas da folha, podemos concluir que toda a carga positiva e quase toda a massa do átomo estão concentradas em uma pequena área, e o resto do átomo é principalmente espaço vazio. Rutherford chamou a área de carga positiva concentrada de núcleo. Ele previu e logo descobriu que continha partículas carregadas positivamente, que ele chamou de prótons. Rutherford previu a existência de partículas atômicas neutras chamadas nêutrons, mas não conseguiu detectá-las. No entanto, seu aluno James Chadwick os descobriu alguns anos depois. A figura abaixo mostra a estrutura do núcleo de um átomo de urânio.

Os átomos consistem em núcleos pesados carregados positivamente cercados por partículas extremamente leves carregadas negativamente - elétrons girando em torno deles, e a velocidades tais que as forças centrífugas mecânicas simplesmente equilibram sua atração eletrostática ao núcleo e, nesse contexto, a estabilidade do átomo é supostamente assegurada.
As desvantagens deste modelo
A ideia principal de Rutherford estava relacionada à ideia de um pequeno núcleo atômico. A suposição sobre as órbitas dos elétrons era pura conjectura. Ele não sabia exatamente onde e como os elétrons giram em torno do núcleo. Portanto, o modelo planetário de Rutherford não explica a distribuição dos elétrons nas órbitas.
Além disso, a estabilidade do átomo de Rutherford só foi possível com o movimento contínuo de elétrons em órbitas sem perda de energia cinética. Mas os cálculos eletrodinâmicos mostraram que o movimento dos elétrons ao longo de qualquer trajetória curvilínea, acompanhado por uma mudança na direção do vetor velocidade e o aparecimento de uma aceleração correspondente, é inevitavelmente acompanhado por radiação. energia eletromagnética. Neste caso, de acordo com a lei da conservação da energia, a energia cinética do elétron deve ser gasta muito rapidamente na radiação, e deve cair sobre o núcleo, conforme mostrado esquematicamente na figura abaixo.

Mas isso não acontece, pois os átomos são formações estáveis. Uma típica contradição científica surgiu entre o modelo do fenômeno e os dados experimentais.
De Rutherford a Niels Bohr
O próximo grande passo em história atômica ocorreu em 1913, quando o cientista dinamarquês Niels Bohr publicou uma descrição de um modelo mais detalhado do átomo. Ela determinou mais claramente os lugares onde os elétrons poderiam estar. Embora cientistas posteriores desenvolvessem projetos atômicos mais sofisticados, o modelo planetário do átomo de Bohr estava basicamente correto, e muito dele ainda é aceito hoje. Ela tinha muitos aplicativos úteis, por exemplo, com sua ajuda, explica as propriedades de vários elementos químicos, a natureza do espectro de sua radiação e a estrutura do átomo. O modelo planetário e o modelo de Bohr foram os marcos mais importantes que marcaram o surgimento de uma nova direção na física - a física do micromundo. Bohr recebeu o Prêmio Nobel de Física de 1922 por suas contribuições para nossa compreensão da estrutura do átomo.
Que novidade Bohr trouxe para o modelo do átomo?
Ainda jovem, Bohr trabalhou no laboratório de Rutherford na Inglaterra. Como o conceito de elétrons era pouco desenvolvido no modelo de Rutherford, Bohr se concentrou neles. Como resultado, o modelo planetário do átomo foi significativamente melhorado. Os postulados de Bohr, que ele formulou em seu artigo "On the Structure of Atoms and Molecules", publicado em 1913, dizem:
1. Os elétrons podem se mover ao redor do núcleo apenas a distâncias fixas dele, determinadas pela quantidade de energia que possuem. Ele chamou esses níveis fixos de níveis de energia ou camadas de elétrons. Bohr os imaginou como esferas concêntricas, com um núcleo no centro de cada uma. Neste caso, os elétrons com energia mais baixa serão encontrados em mais níveis baixos, mais próximo do núcleo. Aqueles que têm mais energia serão encontrados em mais níveis altos, longe do núcleo.
2. Se um elétron absorve alguma quantidade (bastante certa para um determinado nível) de energia, então ele pulará para o próximo nível de energia mais alto. Por outro lado, se ele perder a mesma quantidade de energia, ele retornará ao seu nível original. No entanto, um elétron não pode existir em dois níveis de energia.
Essa ideia é ilustrada por uma figura.

Porções de energia para elétrons
O modelo de Bohr do átomo é na verdade uma combinação de dois várias ideias: o modelo atômico de Rutherford com elétrons girando em torno do núcleo (na verdade, este é o modelo planetário do átomo de Bohr-Rutherford), e as ideias do cientista alemão Max Planck sobre a quantização da energia da matéria, publicadas em 1901. Um quantum (em plural- quanta) é a quantidade mínima energia que pode ser absorvida ou emitida pela matéria. É uma espécie de passo de discretização da quantidade de energia.
Se a energia é comparada à água e você deseja adicioná-la à matéria na forma de um copo, você não pode simplesmente derramar água em um fluxo contínuo. Em vez disso, você pode adicioná-lo em pequenas quantidades, como uma colher de chá. Bohr acreditava que se os elétrons só podem absorver ou perder quantidades fixas de energia, então eles devem variar sua energia apenas por essas quantidades fixas. Assim, eles só podem ocupar níveis fixos de energia ao redor do núcleo que correspondem a incrementos quantizados de sua energia.
Assim, a partir do modelo de Bohr surge uma abordagem quântica para explicar qual é a estrutura do átomo. O modelo planetário e o modelo de Bohr foram uma espécie de passos da física clássica para a física quântica, que é a principal ferramenta na física do micromundo, incluindo a física atômica.