Koloidna hemija. Fizička i koloidna hemija. Površinski fenomeni i adsorpcija
Plan:
Disperzovani sistemi.
Struktura koloidne micele.
Metode za dobijanje liofobnih koloida (CL).
Predmet i značenje koloidna hemija.
Koloidna hemija- Ovo nauka o dispergovanim sistemima i površinskim pojavama koje nastaju na interfejsima.
Koloidna hemija je hemija stvarnih tela, budući da su stvarni objekti živi i nežive prirode, proizvodi i materijali koje stvaraju i koriste ljudi gotovo su uvijek u raspršenom stanju, odnosno sadrže male čestice, tanki filmovi, membrane, vlakna sa jasno definisanim interfejsom. Istovremeno, površinski fenomeni i disperzni sistemi se javljaju daleko izvan Zemlje. Na primjer, međuzvjezdana materija su oblaci plina i prašine. Meteorološke pojave - grmljavina, kiša, snijeg, grad, magla i druge - su koloidni procesi.
Koloidna hemija čini naučnu osnovu proizvodnja plastike, gume, sintetičkih vlakana, ljepila, boja i građevinski materijal, hranu, lijekove itd. Praktično ne postoji oblast industrije koja se u ovom ili onom stepenu ne bavi koloidnim sistemima.
Uloga koloidne hemije je također velika u rješavanju niza problema očuvanja. okruženje uključujući čišćenje Otpadne vode, tretman vode, hvatanje aerosola, kontrola erozije tla, itd.
Koloidna hemija otvara nove pristupe proučavati istoriju zemljine kore, uspostaviti veze između koloidno-hemijskih svojstava tla i njegove plodnosti, razjasniti uslove za nastanak života, mehanizme života; ona je jedna od vodećih fondacija moderna biologija, nauka o tlu, geologija, meteorologija. Zajedno sa biohemijom i fizičkom hemijom polimera, čini osnova doktrine o nastanku i razvoju života na Zemlji. Činjenica da su svi živi sistemi visoko disperzovani naglašava važnost koloidne hemije za razvoj moderne nauke u celini.
Značaj koloidnih procesa u poljoprivredi je ogroman (stvaranje dima i magle za suzbijanje poljoprivrednih štetočina, granulacija đubriva, poboljšanje strukture zemljišta i dr.). Kulinarski procesi: starenje želea (stajanje hleba, odvajanje tečnosti od želea, želea i sl.), adsorpcija (bistrenje čorba) koloidni su procesi koji su u osnovi pečenja, vinarstva, pivarstva i druge proizvodnje hrane.
2. Disperzovani sistemi.
Disperzovani sistemi- to su sistemi u kojima je jedna supstanca u obliku čestica razne veličine distribuira u drugoj supstanci.
U disperznim sistemima razlikuje se disperzna faza (DP) - fino usitnjena supstanca i disperzioni medij (DS) - homogena supstanca u kojoj je disperzovana faza raspoređena (u mutna voda koji sadrže glinu, DF su čvrste čestice gline, a DS su voda).
Važna karakteristika disperznih sistema je stepen disperzije - prosječne veličinečestice disperzne faze.
Prema stepenu disperzije, obično se razlikuju sljedeće klase dispergiranih sistema:
Grubi sistemi– sistemi u kojima veličina čestica dispergovane faze prelazi 10 -7 m (suspenzije i emulzije).
Koloidni sistemi– sistemi u kojima je veličina čestica dispergovane faze 10 -7 – 10 -9 m. To su mikroheterogeni sistemi sa dobro razvijenim interfejsom između faza. Njihove čestice se ne talože pod uticajem gravitacije i prolaze kroz papirne filtere, već ih zadržavaju biljne i životinjske membrane. Na primjer, proteinske otopine, koloidi tla, itd.
Ponekad su izolovani molekularni (jonski) dispergovani sistemi, koji, strogo govoreći, jesu istinita rješenja, tj. homogeni sistemi, jer nemaju fazne interfejse. Veličina čestica dispergirane faze je manja od 10 -9 m. Otopljena supstanca je u obliku molekula ili jona. Na primjer, otopine elektrolita, šećera.
Koloidni sistemi, pak, podijeljeni su u dvije grupe, oštro različite po prirodi interakcije između čestica dispergirane faze i disperzijskog medija - liofobne koloidne otopine (soli) i otopine jedinjenja visoke molekularne težine (HMC), koje su se ranije nazivale liofilnih koloida.
TO liofobni koloidi To uključuje sisteme u kojima čestice dispergirane faze slabo interaguju sa disperzionim medijem; ovi sistemi se mogu dobiti samo uz utrošak energije i stabilni su samo u prisustvu stabilizatora.
IUD rješenja nastaju spontano zbog snažne interakcije čestica dispergirane faze sa disperzijskim medijem i mogu ostati stabilne bez stabilizatora.
Liofobni koloidi i rastvori spirale razlikuju se po komponentama dispergovane faze. Za liofobne koloide jedinica strukture je složen višekomponentni agregat promjenljivog sastava – micelle, za IUD rješenja – makromolekula.
Dispergirani sistemi se dijele u grupe koje se razlikuju po prirodi i stanju agregacije dispergirane faze i disperzione sredine:
Ako je disperzioni medij tečan, a disperzna faza čvrste čestice, sistem se naziva suspenzija ili suspenzija;
Ako se raspršena faza sastoji od kapljica tekućine, tada se sistem naziva emulzija. Emulzije se, pak, dijele na dvije vrste: ravno, ili "ulje u vodi"(kada je disperzna faza nepolarna tečnost, a disperzioni medij je polarna tečnost) i obrnuto, ili "voda u ulju"(kada je polarna tečnost raspršena u nepolarnoj).
Među dispergovanim sistemima postoje i Pjena(gas dispergovan u tečnosti) i porozna tijela(čvrsta faza u kojoj je raspršen gas ili tečnost). Glavni tipovi disperznih sistema su dati u tabeli.
3. Struktura koloidne micele.
DF čestice u liofobnim koloidima imaju složenu strukturu u zavisnosti od sastava DF, DS i uslova za dobijanje koloidnog rastvora. Neophodan uslov za dobijanje stabilnih solova je prisustvo treće komponente, koja ima ulogu stabilizatora.
Raspršena čestica – micela se sastoji od:
jezgra, u kristalnom ili tekućem stanju;
monomolekularni adsorpcioni sloj joni koji određuju potencijal;
tečna ljuska, više zbijena na površini čestice i koja se postepeno pretvara u običan disperzioni medij;
čvrsto vezan sloj protivjona, tj. ioni koji nose naboj suprotan znaku naboja jona koji određuju potencijal;
difuzionog sloja kontrajoni koji se slobodno kreću tokom elektroforeze ili elektroosmoze.
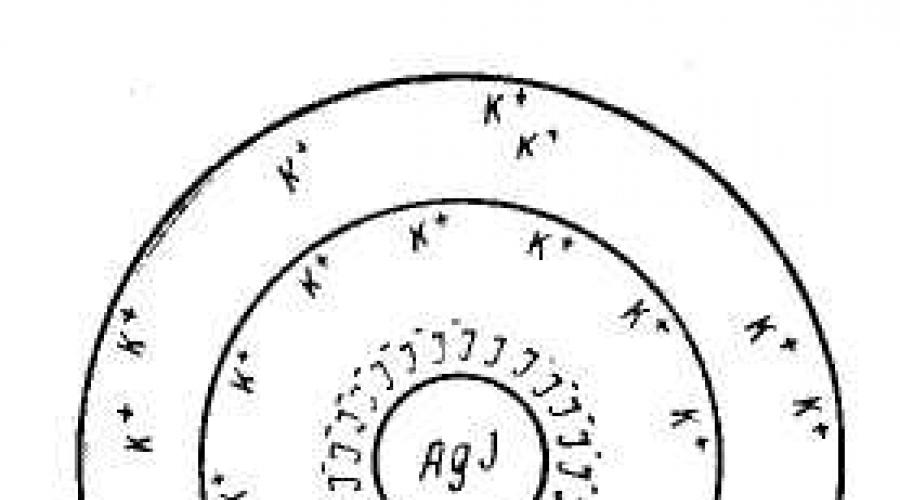
Struktura strukturna jedinica liofobni koloidi - micele– može se prikazati samo shematski, jer micela nema specifičan sastav. Razmotrimo strukturu koloidne micele koristeći primjer hidrosol srebrnog jodida, dobijen reakcijom razrijeđenih otopina srebrnog nitrata i kalijevog jodida:
AgNO 3 + KI ––> AgI + KNO 3
Koloidna micela sola srebrnog jodida formirana je od mikrokristala AgI, koji je sposoban za selektivnu adsorpciju Ag + ili I - katjona iz okoline. Da bi se dobio stabilan sol, potrebno je da jedan od elektrolita AgNO 3 ili KI bude prisutan u višku kao stabilizator.
Ako se reakcija izvodi u višku kalijum jodida, kristal će adsorbirati I - ; sa viškom srebrnog nitrata, mikrokristal adsorbira Ag + ione. Kao rezultat, mikrokristal dobiva negativan ili pozitivan naboj.
1. Višak KI
Nerastvorljivi molekuli AgI formu jezgro koloidne čestice (micele) m[ AgI].
I - joni se adsorbiraju na površini jezgra (obično oni ioni koji su dio jezgre, tj. adsorbirani su u ovom slučaju Ag + ili I -), dajući mu negativan naboj. Oni dovršavaju kristalnu rešetku jezgra, čvrsto ulazeći u njegovu strukturu, formirajući se adsorpcioni sloj m[ AgI] · nI – . Ioni koji se adsorbiraju na površini jezgra i daju mu odgovarajući naboj nazivaju se joni koji određuju potencijal.
Adsorbirani ioni koji određuju potencijal privlače ione iz otopine suprotan znak kontrajoni(K +), a dio njih (n-x) je adsorbiran na čestici { m[ AgI] · nI – · (n- x) K + } x – . Jezgra + adsorpcioni sloj = granula.
Preostali kontrajoni se formiraju difuznog sloja jona.
Jezgro sa adsorpcijskim i difuznim slojevima predstavlja micelle.
Shematski dijagram dobivene sol micele srebrnog jodida u višku kalijum jodida (joni koji određuju potencijal su I – anjoni, protujoni su K+ joni) može se prikazati na sljedeći način:
(m · nI – · (n-x)K + ) x– · xK +

2. Po prijemu sol srebrnog jodida u višku srebrnog nitrata koloidne čestice će imati pozitivan naboj:
(m nAg + (n-x)NO 3 – ) x+ x NO 3 –


S. V. Egorov, E. S. Orobeyko, E. S. Mukhacheva
Koloidna hemija, varalica
1. Nastanak i glavne faze razvoja koloidne hemije. Predmet i objekti istraživanja koloidne hemije
Pojava nauke o koloidnoj hemiji povezana je sa istraživanjem engleskog hemičara T. Graham . Nakon pionirskog istraživanja M. Faraday (1857), kada su prvi put dobijeni stabilni koloidni rastvori visoko dispergovanog zlata, Graham je 1861. godine proučavao difuziju različitih supstanci u vodenim rastvorima i otkrio da neke od njih (želatin, agar-agar itd.) difunduju u vodi mnogo sporije od na primjer, soli i kiseline. Takođe, kada su rastvori bili prezasićeni, ove supstance nisu kristalisale, već su formirale želatinastu, lepljivu masu. T. Graham je ove tvari nazvao koloidima (od grčkog kolla - "ljepilo", eidos - "vrsta"). Tako se pojavilo ime nauke - "koloidna hemija". T. Graham je iznio hipotezu o postojanju dvije suprotstavljene klase u prirodi hemijske supstance– kristaloidi i koloidi. Ova ideja je zainteresovala mnoge naučnike, i u drugoj polovini 19. veka. Počeo je nagli razvoj koloidne hemije. U Rusiji je u to vreme, koloidna hemija takođe dobila veliku pažnju, uglavnom pod uticajem D. I. Mendeljejev . Istraživanja temperaturna zavisnost površinski napon organskih tečnosti (1861) doveo je Mendeljejeva do otkrića koncepta kritična temperatura supstance. Mendeljejev je također izrazio ideju o vezi između površinske napetosti i drugih svojstava materije. Tokom ovih godina otkrivene su mnoge supstance sa koloidnim svojstvima, razne metode prečišćavanje i stabilizacija koloida, stvorene su metode za njihovo istraživanje. Kako su otkriveni novi koloidi, hipoteza T. Grahama je zamijenjena u prvoj polovini 20. stoljeća. došao u koncept univerzalnosti koloidnog (raspršenog) stanja materije:“Koloidno stanje nije određeno sastavom supstance. Pod određenim uslovima, svaka supstanca može biti u koloidnom stanju.” Ovaj koncept je formulisao profesor na Rudarskom institutu u Sankt Peterburgu P. P. Weymarn V 1906–1910. Pokazao je da se tipični koloidi (na primjer, želatin) mogu izolirati u kristalnom obliku i, naprotiv, koloidna otopina se može pripremiti od kristaloidnih supstanci (npr. kuhinjska so u benzenu). Došlo je do promjene u prioritetima koloidne hemije. Glavni smjer je bio proučavanje dispergiranog (koloidnog) stanja tvari. Oko 1920-ih. fundamentalni problemi koloidne hemije se konvencionalno dijele u tri grupe: sastav, struktura i svojstva koloidnih čestica; interakcija čestica sa dispergovanim medijem; kontaktne interakcije čestica jedna s drugom, što dovodi do stvaranja koloidnih struktura. U tom periodu otkriveni su osnovni zakoni koloidne hemije - zakon Brownovog kretanja i difuzije koloidnih čestica. (A. Einstein) , heterogena priroda koloidnih rastvora (R. Zsigmondy) , sedimentaciono-difuziona ravnoteža disperzija u gravitacionom polju (J. Perrin) i u centrifugi (T. Svedberg) , rasipanje svjetlosti (J. Rayleigh) , koagulacija sola sa elektrolitima (G. Schulze I V. Hardy) . Pojava u drugoj polovini 20. veka. Metode visoke rezolucije za proučavanje strukture supstanci (NMR, elektronska i atomska silovna mikroskopija, kompjutersko modeliranje, fotonska korelaciona spektroskopija itd.) omogućile su prelazak na sistematsko proučavanje strukture i svojstava koloidnih sistema. Moderna definicija ove nauke glasi: koloidna hemija je doktrina o svojstvima i transformacijama supstanci u dispergovanim i ultradisperznim stanjima i površinskim pojavama u dispergovanim sistemima. Predmeti istraživanja koloidne hemije imaju visoko razvijenu površinu i predstavljaju različite solove, suspenzije, emulzije, pene, površinske filmove, membrane i porozna tela, nanostrukturne sisteme (nanocevi, Langmuir-Blodgett filmovi, hibridni organsko-anorganski kompozitni materijali, nanokompoziti).
2. Glavne karakteristike disperznih sistema. Karakteristike ultramikroheterogenog stanja (nanostate)
Disperzovani sistemi formirana od dvije ili više faza sa visoko razvijenim međuprostorom između njih, a najmanje jedna od faza je disperzovana faza– raspoređeni u obliku malih čestica (kristala, kapi, mjehurića, itd.) u drugoj, kontinuiranoj fazi – disperzioni medij. Primjeri su stijene, tla, dim, oblaci, padavine, biljna i životinjska tkiva, itd. Najvažnija karakteristika dispergiranih sistema je heterogenost. Feature disperzovanih sistema– visoko razvijena međufazna površina i, kao posljedica toga, visoka slobodna energija, stoga su obično dispergirani sistemi (osim liofilnih) termodinamički nestabilni. Imaju povećan kapacitet adsorpcije, hemijsku, a ponekad i biološku aktivnost. Disperzovane sisteme karakteriše povećanje površine sa povećanjem disperzije i sve veća uloga površinskih pojava. Disperzovane sisteme karakteriše veoma velika specifična površina W disperzovana faza.
W < K/dr,
Gdje K– bezdimenzionalni koeficijent (za sferne i kubične čestice K = 6); r– gustina dispergovane faze.
Drugi važni termodinamički parametri koji karakterišu koloidne sisteme su specifična slobodna površinska energija σ (površinska napetost), površinska entropija h i specifična adsorpcija G. Važna karakteristika dispergovanih sistema je da je značajan deo ukupne mase i slobodne energije sistema koncentrisan u međufaznim površinskim slojevima. S ovom karakteristikom povezana su sljedeća svojstva: ireproducibilnost(ili individualnost) sistemi zbog nejednake površine čestica dispergirane faze, koje imaju različite površinske energije čak i sa istom specifičnom površinom; strukturiranje, povezano sa tendencijom termodinamičke nestabilnosti. Fundamental property dispergovani sistemi je njihova sposobnost da postepeno evoluiraju, što je povezano sa prirodom dispergovanog stanja materije, prvenstveno sa termodinamičkom neravnotežom. Višak slobodne energije uzrokovan prisustvom visoko razvijene granice između dispergirane faze i disperzijskog medija stimulira protok razne procese(fizički, fizičko-hemijski), što dovodi do smanjenja Helmholtzove slobodne energije F. Znak kao labilnost, posljedica je termodinamičke nestabilnosti i tendencije smanjenja slobodne energije kroz formiranje manje dispergiranih struktura. Glavne karakteristike dispergovani sistemi - veličine čestica (ili disperzija), koji je određen omjerom ukupna površina površinske površine prema zapremini dispergirane faze. Na osnovu ovog kriterijuma, grubo (nisko dispergovano) (čestice imaju veličinu od 10–4 cm i više) i fino dispergovane (visoko dispergovane) (čestice imaju veličinu od 10–4 do 10–5–10–7 cm), ili se razlikuju koloidni sistemi (koloidi). Granični stepen disperzije na kojem koloidni sistem zadržava svoje glavno svojstvo – heterogenost – nalazi se u rasponu od 1 do 100 nm. Ultrafine čestice zauzimaju srednja pozicija između molekula (atoma, jona) i makroskopskih tijela (faze). Veličina čestica dispergirane faze d je blizu maksimalno mogućeg, jači će biti uticaj efekata razmjera - ovisnost svojstava o veličini čestica. Ako se za sisteme sa prosječnim stepenom disperzije određuje samo površinski napon s hemijski sastav, tada je za nanosisteme već potrebno uzeti u obzir zavisnost površinske napetosti od veličine dispergovanih čestica.
3. Razne vrste klasifikacija dispergovanih sistema. Liofilni i liofobni disperzni sistemi
Disperzovani sistemi heterogeni i sastoje se od dvije faze, od kojih jedna (raspršena faza) u obliku čestica različitih veličina raspoređenih u drugoj fazi – kontinuiranoj disperzioni medij. Dispergovani sistemi se klasifikuju prvenstveno prema veličini čestica dispergovane faze (ili prema stepenu disperzije). Osim toga, dijele se na grupe koje se razlikuju po prirodi i stanju agregacije dispergirane faze i disperzione sredine (može biti čvrsta, tečna i plinovita), strukturi i prirodi međufaznih interakcija. Ako je disperzioni medij tečan, a disperzna faza čvrste čestice, sistem se naziva suspenzija ili suspenzija; ako se disperzna faza sastoji od kapljica tekućine, tada se sistem naziva emulzija. Dispergovani sistemi takođe uključuju pene (gas dispergovan u tečnosti), aerosole (tečnost u gasu) i porozna tela (čvrsta faza u kojoj je raspršen gas ili tečnost). Skraćeni tip disperznog sistema u zavisnosti od stanje agregacije napisano kao razlomak, gdje je disperzna faza u brojiocu, a disperzioni medij u nazivniku (na primjer, T/T (čvrste koloidne otopine - minerali, legure), T/L (soli - suspenzije), T/G (aerosoli - prašina, isparenja); L/T (porozna tijela - gelovi), L/L (emulzije), L/G (aerosoli - magle); G/T (porozni i kapilarni sistemi), G/L (pjene - gasne emulzije)). H/G sistemi se obično ne pojavljuju u klasifikaciji jer... neophodno stanje formiranje disperznog sistema - ograničena rastvorljivost supstance u medijumu.
Koloidna hemija je nauka o fizičkim i hemijskim svojstvima dispergovanih sistema i površinskih pojava.
Disperzni sistem (DS) je sistem u kojem je najmanje jedna supstanca u manje ili više usitnjenom (raspršenom) stanju jednoliko raspoređena u masi druge supstance. DS je heterogena, sastoji se od najmanje dvije faze. Zdrobljena faza naziva se disperzovana faza. Kontinuirani medij u kojem je raspršena faza fragmentirana naziva se disperzioni medij. Karakteristično svojstvo DS-a je prisustvo velike međufazne površine. U tom smislu, određujuća svojstva su svojstva površine, a ne čestica u cjelini. DS karakteriziraju procesi koji se odvijaju na površini, a ne unutar faze.
Površinski fenomeni i adsorpcija
Površinski fenomeni su fenomeni koji se javljaju na granici između faza dispergovanih sistema. To uključuje: površinski napon, vlaženje, adsorpciju, itd. Najvažnije tehnički procesi: prečišćavanje vazduha i otpadnih voda od štetnih nečistoća, obogaćivanje mineralnih ruda (flotacija), zavarivanje metala, čišćenje, podmazivanje, farbanje raznih površina i mnoge druge.
Površinski napon
Bilo koji fazni interfejs ima posebna svojstva koja se razlikuju od svojstava unutrašnjih delova susednih faza. To je zbog činjenice da površinski slojevi imaju višak slobodne energije. Razmotrimo sistem koji se sastoji od tečnosti i gasa (slika 1).
Po molekulu A, koji se nalazi unutar tečnosti, sile međusobnog privlačenja djeluju na dio svih susjednih molekula koji ga okružuju. Rezultanta ovih sila je nula. Za molekul IN, koji se nalazi na površini tekućine, neće biti kompenzirane sve sile molekularne privlačnosti. To je zbog činjenice da su u plinu molekule udaljene jedna od druge, a privlačne sile između njih su zanemarljive. Dakle, molekuli IN doživite privlačnost samo iz tečnosti. Za njih rezultanta sila molekularne privlačnosti nije nula i usmjerena je duboko u tečnu fazu. Ova sila se zove unutrašnji pritisak. Ovaj pritisak teži da povuče sve molekule sa površine duboko u tečnost. Pod ovim pritiskom, tečnost se skuplja i ponaša kao da ima „kožu“. Što su intermolekularne interakcije u susjednim fazama različite, to je veći unutrašnji pritisak.
U cilju stvaranja nova površina razdvajanje faza, na primjer, da bi se tekućina razvukla u film, potrebno je uložiti rad protiv unutrašnjih sila pritiska. Što je veći unutrašnji pritisak, potrebno je više energije. Ova energija je koncentrisana u molekulima koji se nalaze na površini i naziva se slobodna površinska energija.
Rad utrošen na formiranje 1 cm 2 međufazne površine, ili njene ekvivalentne slobodne površinske energije, naziva se površinski napon i označiti , J/m 2. Tada je rezerva slobodne energije (F s) koncentrisana na međufaznoj granici (S) jednaka: F s = S. Stoga, nego manja veličinačestica, što je veća površina S, to je veća rezerva slobodne površinske energije ovaj dispergovani sistem ima u poređenju sa konvencionalnim masivnim tijelima.
Iz termodinamike je poznato da uslov za stabilnu ravnotežu sistema je minimalna slobodna energija. U tom smislu, disperzni sistemi su termodinamički nestabilni: u njima procesi se odvijaju spontano , povezano sa smanjenjem međufaznog interfejsa usled povećanja čestica. Očigledno, stanje ravnoteže odgovara stratifikacija sistema (na primjer, emulzija se dijeli na dvije tekućine, a suspenzija na tekućinu i sediment). Osim toga, budući da vrijednost teži minimumu, tečnost u slobodnom stanju uzima oblik sfere, (kapi tečnosti). Ovo se objašnjava činjenicom da je površina lopte minimalna za dati volumen materije.
Minimalna vrijednost F s, odnosno stanje ravnoteže sistema, može se postići i težnjom ka minimalnoj vrijednosti . dakle, spontano u disperznim sistemima postoje i procesi povezani sa smanjenjem površinske napetosti. Za čvrste materije , koje ne mogu promijeniti svoj oblik tako lako kao tekućine, slobodna površinska energija F s može se smanjiti samo jedan način ─ zbog smanjenja površinske napetosti . To se dešava ovako: molekuli leže unutra površinski sloj, su u stanju da privuku i ponekad vrlo čvrsto drže druge molekule iz okoline koja okružuje čvrstu materiju. Ovaj fenomen se zove sorpcija.
Na vrijednost površinske napetosti utiču:
1. Priroda supstance . Magnituda je određena strukturom kondenzirane faze, odnosno prirodom sila koje djeluju između čestica. Što je veći polaritet hemijskih veza u supstanci, to su veće vrednosti karakteristika ove supstance. Među tečnostima (na granici sa vazduhom) najveću vrednost ima voda. Čak i veće vrijednosti uočeno u topljenjima jonskih kristala i čvrstih metala.
2.Temperatura. Kako temperatura raste, vrijednost smanjuje se jer termičko kretanječestice kada se zagrijaju slabi djelovanje međučestičnih sila u tvari.
3.Koncentracije dodanih aditiva. Magnituda ovisi o koncentraciji tvari otopljenih u ispitivanoj tekućini. Postoje dvije vrste supstanci. Površina ─ neaktivne supstance (PIS), podizanje površinski napon rastvora u poređenju sa čistim rastvaračem. To uključuje najjače elektrolite.
Surfaktanti (surfaktant), snažno snižavanje površinski napon dobijenog rastvora. S povećanjem koncentracije surfaktanta u otopini, vrijednost naglo opada, jer je tvar koncentrirana (sorbirana) u površinskom sloju otopine i nije ravnomjerno raspoređena po volumenu otopine. U vodenim rastvorima polarna organska jedinjenja pokazuju površinsku aktivnost ─ alkoholi, kiseline, soli itd. Molekuli takvih jedinjenja istovremeno sadrže polarne grupe (O, OH, COOH, NH 2) i nepolarni ugljikovodični lanac. Šematski, molekul surfaktanta se konvencionalno označava na sljedeći način: "O─────." Tipičan primjer surfaktanta je natrijumova so stearinske kiseline C 17 H 35 COONa (čvrsti sapun).
Predmet koloidne hemije
Koloidni sistemi i predmet koloidne hemije
Koloidni sistemi
U početku je koloidna hemija bila samo poglavlje fizička hemija. Sada je to nezavisna disciplina sa sopstvenim rasponom ideja. Razvijene su posebne specifične koloidno-hemijske metode istraživanja: ultramikroskopija, elektronska mikroskopija, ultracentrifugiranje, elektroforeza itd. Praksa je pokazala ogroman značaj koloidne hemije za moderna tehnologija. Ne može se navesti industrija Nacionalna ekonomija, u kojem se ne bi koristili koloidni sistemi i koloidni procesi. Čovjek se od pamtivijeka bavi koloidnim sistemima. Međutim, njihovo proučavanje počelo je relativno nedavno.
Obično se smatra da je osnivač koloidne hemije engleski naučnik Tomas Grejem (*) (1805-1869), koji je 50-60-ih godina prošlog veka uveo u opticaj osnovne koloidne hemijske koncepte. Međutim, ne treba zaboraviti da je imao prethodnike, a prije svega Jacoba Berzeliusa (*) i italijanskog hemičara Francesca Selmija (*). Berzelius je 30-ih godina 19. stoljeća opisao niz sedimenata koji prolaze kroz filter kada se operu (silicijumska i vanadinska kiselina, srebrni hlorid, prusko plavo, itd.). Berzelius je ove precipitate koji prolaze kroz filter nazvao „rastvorima“, ali je istovremeno istakao njihovu blisku srodnost sa emulzijama i suspenzijama, čija svojstva je dobro poznavao. Frančesko Selmi je 50-ih godina 19. veka nastavio rad u ovom pravcu, tražeći fizičko-hemijske razlike između sistema formiranih sedimentima koji prolaze kroz filter (nazvao ih je „pseudo-rešenja“) i običnih pravih rešenja.
Engleski naučnik Michael Faraday (*) je 1857. sintetizirao koloidne otopine zlata - suspenziju Au u vodi s veličinom čestica od 1 do 10 nm. i razvijene metode za njihovu stabilizaciju.
Ova „pseudo-otopina“ raspršuju svjetlost, tvari otopljene u njima talože se kada se dodaju male količine soli, prijelaz tvari u otopinu i taloženje iz nje nije praćeno promjenom temperature i volumena sistema, što se obično uočava pri rastvaranju kristalnih supstanci.
Thomas Graham je razvio ove ideje o razlici između "pseudo-rješenja" i pravih rješenja i uveo koncept "koloida". Graham je otkrio da tvari sposobne da formiraju želatinozne amorfne sedimente, kao što su aluminij hidroksid, albumin, želatin, difundiraju u vodi malom brzinom u odnosu na kristalne tvari (NaCl, saharoza). U isto vrijeme, kristalne tvari lako prolaze kroz pergamentne ljuske u otopini („dijalizuju“), ali želatinozne tvari ne prolaze kroz te ljuske. Smatrajući da je ljepilo tipičan predstavnik želatinoznih, nedifuzijskih i nedijalitičkih supstanci, Graham im je dao uobičajeno ime"koloid", tj. nalik na ljepilo (od grčke riječi kolla - ljepilo). Kristalne supstance i supstance koje su dobre u difuziji i dijalizi, on je nazvao "kristaloidi".
Nabrojimo anomalna svojstva nekih rješenja, koje danas nazivamo koloidnim sistemima.
Osobine koloidnih sistema:
1. rasipanje svjetlosti (opalescencija) (ukazuje na heterogenost, višefazni sistem).
Opalescencija postaje posebno uočljiva ako se, kao što je Tyndall učinio (*), snop konvergentnih zraka prođe kroz koloidni rastvor, postavljajući sočivo između izvora svjetlosti i kivete s otopinom. U ovom slučaju, rastvori koji su prozirni u propuštenoj svetlosti, u bočno osvetljenje pokazuju sva svojstva zamućenih medija. U koloidnoj tekućini gledano sa strane, formira se svijetli svjetleći konus (Tyndall cone).
2. spora difuzija
3. nizak osmotski pritisak
(tačke 2 i 3 ukazuju na prisustvo velikih čestica u sistemu)
4. koloidne otopine su sposobne za dijalizu, tj. mogu se odvojiti od nečistoća pomoću membrane
5. sposoban za koagulaciju (destrukciju) sistema pri: dodavanju nečistoća, promeni T, mešanju itd.
6. ponekad otkrivaju fenomen elektroforeze, koji je otkrio Reuss (6) u Rusiji 1808. godine, tj. čestice u sistemu mogu imati naboj.
Da biste zamislili o čemu se bavi nauka o "koloidnoj hemiji", morate odgovoriti na pitanje šta su koloidi ili koloidni sistemi?
Predmet koloidne hemije
Koloidna hemija – nauka o površinskim pojavama i dispergovanim sistemima.
TO površne pojave To uključuje procese koji se odvijaju na međufaznom sloju, u međufaznom površinskom sloju i koji nastaju kao rezultat interakcije konjugiranih faza.
Da vas podsjetimo na to faza je dio termodinamičkog sistema koji ima određena fizička i hemijska svojstva i odvojen je od ostalih dijelova sistema interfejsom.
U pravim otopinama, supstanca je usitnjena do molekularnog stanja i nema međudjelovanja između otopljene tvari i rastvarača.
Uzrok površinskih pojava je postojanje na granici dodirnih faza nezasićenog polja međuatomskih, međumolekulskih sila, koje nastaje zbog drugačiji sastav i strukturu susjednih faza i razlike u vezama njihovih površinskih atoma i molekula.
Površinski slojevi tekućih i čvrstih tijela uz granicu faze oštro se razlikuju po mnogim fizičkim i kemijskim pokazateljima od svojstava faza duboko u njihovoj zapremini (specifična energija, gustoća, viskozitet, specifična električna provodljivost, itd.). Razlike su povezane i sa određenom orijentacijom molekula u površinskim slojevima i njihovim različitim energetskim stanjem u odnosu na molekule u masi. Osim toga, u višekomponentnim sistemima (rješenjima) sastav površinskog sloja se ne poklapa sa sastavom masovnih faza.
Karakteristike površinskih slojeva su posljedica prisutnosti viška površinske energije. Svojstva interfejsa imaju jači uticaj na ponašanje sistema u celini, što više veća površina površine (S takt). Ovo objašnjava dominantnu ulogu površinskih pojava u svojstvima visoko dispergovanih sistema, čiji Ssp dostiže ogromne vrednosti.
Prisustvo viška energije u površinskom sloju molekula nastaje zbog nepotpune kompenzacije međumolekulskih sila privlačenja među molekulima površinskog sloja zbog njihove slaba interakcija sa susednom fazom.
Studije koloidne hemije disperzovanih sistema – heterogeni sistemi koji se sastoje od dvije ili više faza, od kojih jedna disperzovana faza - fragmentirano (diskontinuirano), a drugo - disperzioni medij - je kontinuirani dio sistema.
Koncept mikroheterogene prirode koloidnih rastvora i drugih dispergovanih sistema je od fundamentalnog značaja. Za svoje otkriće austrijski naučnik Zsigmondy (*) postao je laureat nobelova nagrada na hemiji 1925
Odabir u posebna grupa dispergovane čestice su uzrokovane njihovom razlikom u fizičkom i hemijska svojstva od sličnih svojstava velikih objekata iste supstance. Ova svojstva uključuju čvrstoću, toplinski kapacitet, T pl, magnetsku i električne karakteristike, reaktivnost.
Ove razlike su uzrokovane efektima veličine. Što je manja veličina čestica, to su posebna svojstva izraženija, posebno za nanočestice. Ova svojstva otvaraju fundamentalno nove praktične primjene u hemiji, fizici i biologiji. Proučavanje svojstava dispergovanih čestica (metode proizvodnje, strukture, fizike i hemije) jedan je od najhitnijih i najperspektivnijih zadataka u nizu disciplina.
Dispergovane čestice mogu biti veoma različite formu : cilindrični, sferni, pravougaoni, nepravilni. Na primjer, dispergirane čestice uključuju:
sistemi sa kubičnim, sfernim česticama - solovi, emulzije, suspenzije, paste;
filamentozna – vlakna nervnih ćelija, 2-dimenzionalna mišićna vlakna, kapilare, pore (drvo, tkivo, kosa, koža),
filmovi - površinski slojevi na sučeljima u emulzijama, pjenama, u porama katalizatora i adsorbenata, membrane.
Dakle, 1 m 3 početni materijal može se usitniti na kockice dužine ivice A, uvucite u navoj s poprečnim presjekom A ili izravnati u debeli film A.
Ako čestice imaju nepravilnog oblika, zatim da koristimo koncept “poprečne veličine”, njihov oblik je izjednačen sa sfernim s ekvivalentnim prečnikom.
Kvantitativne karakteristike disperznog sistema:
1. Veličina čestica d avg, d min, d max
2. Koncentracija čestica ν = n d /V, gdje je n d broj čestica dispergirane faze po jedinici volumena disperzionog medija V
3. Fragmentaciju sistema karakteriše disperzija D I specifična površina dispergirane faze Ssp:
Prva opcija za kvantitativnu procjenu je osnovni
D= 1/d I S otkucaj = S / V,(1.1)
Gdje d – minimalna veličinačestice, S – ukupna površina površine, V- zapremine tela.
Moderna koloidna hemija je nauka na razmeđu hemije, fizike i biologije. Poseban interdisciplinarni položaj koloidne hemije naglašen je činjenicom da se u literaturi na engleskom jeziku često koristi naziv “koloidna nauka”. koloidna nauka).
Istorija koloidne hemije
Koloidna hemija kao nauka ima mala priča Međutim, ljudi od davnina koriste svojstva koloidnih sistema i koloidno-hemijskih procesa. To su, na primjer, zanati kao što su izrada boja, keramike, glazure, predenje lana, pamuka, vune i štavljenje kože.
Počevši od 18. stoljeća pojavljuju se opisi pojedinačnih studija, koji su kasnije uključeni u odgovarajuće dijelove koloidne hemije. To uključuje rad M.V. Lomonosova o kristalizaciji i proizvodnji obojenih stakla pomoću metalnih disperzija (1745-1755). U K. Scheeleu i F. Fontani, nezavisno jedan od drugog, otkrili su fenomen adsorpcije gasa ugljem. U T. E. Lovitz je otkrio fenomen adsorpcije iz otopina. P. Laplace je primio prvu kvantitativnim odnosima za kapilarni pritisak. Godine 1808. F. F. Reiss je, provodeći eksperimente s Voltinim elementom, otkrio fenomen elektroforeze i elektroosmoze.
Neka od najranijih studija koloidnih sistema izveo je Italijan F. Selmi 1845. godine. Proučavao je sisteme koji se sastoje od srebrnog hlorida, sumpora i pruskog plavog raspoređenih u zapremini vode. Ovi sistemi koje je Selmi dobio vrlo su slični pravim rješenjima, međutim, Selmi je vjerovao da ni supstance koje je proučavao niti druge slične tvari ne mogu biti prisutne u vodi u obliku istih malih čestica kao one nastale u pravim otopinama, tj. obliku pojedinačnih molekula ili jona.
Stavove bliske Selmiju iznio je K. Naegeli, koji je smatrao da su u takvim sistemima čestice sumpora, srebrnog hlorida i drugih supstanci veći agregati od pojedinačnih molekula. Za polimolekularne agregate uveo je koncept "micele". Kako bi razlikovao sisteme koji sadrže micele od otopina, gdje je otopljena tvar prisutna kao pojedinačni molekuli, Nägeli je sisteme koji sadrže micele nazvao "solovima". Termini "micel" i "sol" postali su opšteprihvaćeni.
Trenutna drzava
Glavni pravci moderne koloidne hemije:
- Termodinamika površinskih pojava.
- Studija adsorpcije surfaktanta.
- Proučavanje formiranja i stabilnosti disperznih sistema, njihovih molekularno-kinetičkih, optičkih i električnih svojstava.
- Fizičko-hemijska mehanika dispergovanih struktura.
- Razvoj teorije i molekularnih mehanizama procesa koji se odvijaju u dispergovanim sistemima pod uticajem surfaktanata, električnih naboja, mehanički udar itd.
Budući da je dispergirano stanje materije univerzalno, a predmeti proučavanja koloidne hemije veoma raznoliki, koloidna hemija je usko povezana sa fizikom, biologijom, geologijom, naukom o tlu, medicinom itd.
Postoji Institut za koloidnu hemiju i hemiju vode po imenu. A. V. Dumansky NASU (Kijev).
Izdaje se naučni „Colloid Journal”.
Književnost
- Handbook of Surface and Colloid Chemistry / Ed. K.S. Birdi. - 2nd ed. - N.Y.: CRC Press, 2003. - 765 str.
- Ablesimov N. E. Sinopsis hemije: Referenca i udžbenik iz opšte hemije - Habarovsk: Izdavačka kuća FEGUPS, 2005. - 84 str.
- Ablesimov N. E. Koliko hemija postoji na svijetu? Dio 1. // Hemija i život - XXI vijek. - 2009. - br. 5. - Str. 49-52.
- Summ B. D. Osnove koloidne hemije: udžbenik. pomoć studentima viši udžbenik institucije / B. D. Sum. - 2. izdanje, izbrisano. - M.: Izdavački centar"Akademija", 2007. - 240 str.
- Hemijska enciklopedija. - M.: "BRE", 1998.
- Friedrichsberg D. A. Kurs koloidne hemije. L.: Hemija, 1984. - 352 str.
- Zakharchenko V.N. Koloidna hemija: Udžbenik. za medicinskog biologa. specijalista. univerziteti - 2. izd., revidirano. i dopunski - M.: Viša škola, 1989.-238 str.: ilustr.
Wikimedia fondacija. 2010.
Pogledajte šta je "koloidna hemija" u drugim rječnicima:
KOLOIDNA HEMIJA, proučava disperzovane sisteme koji imaju visok stepen fragmentacija (veličina čestica od 10 2 do 10 7 cm) i ogromna površina (na primjer, aktivni ugljen ima specifičnu površinu od hiljade m2/g), što ih određuje ... ... Moderna enciklopedija
Veliki enciklopedijski rječnik
koloidna hemija- - grana hemije čiji su predmet visoko dispergovani sistemi i sistemi koji teku u njima. Rječnik analitičke hemije... Hemijski termini
KOLOIDNA KEMIJA- nauka koja proučava fiziku. chem. svojstva dispergovanih sistema i nekih visokomolekularnih proizvoda, kao i površinske fizičke pojave. chem. procesi koji se dešavaju na interfejsu (vidi) ... Velika politehnička enciklopedija
Tradicionalni naziv za fizičku hemiju dispergovanih sistema (Vidi Disperzni sistemi) i površinskih fenomena (Vidi Površinski fenomeni). K. x. kao samostalna nauka nastala je 60-ih godina 19. veka. Od tada su njegov predmet i metode značajno... Velika sovjetska enciklopedija
Pojam koloidna hemija Pojam u engleskom koloidnoj hemiji Sinonimi koloidna nauka Skraćenice Vezani pojmovi adhezija, adsorpcija, električni dvostruki sloj, disperznost, sol, koloidni rastvor, kritična koncentracija... ... Enciklopedijski rečnik nanotehnologije
Oblast hemije koja proučava disperzne sisteme i površinske pojave koje se javljaju na granicama faza. Budući da čestice dispergirane faze i disperzioni medij koji ih okružuje imaju veoma veliku međufaznu površinu (u visoko disperznim sistemima ... ... Hemijska enciklopedija
Tradicionalni naziv za nauku o dispergovanim sistemima i površinskim pojavama. Proučava procese i pojave kao što su adhezija, adsorpcija, vlaženje, koagulacija, elektroforeza. Razvija naučne principe tehnologije građevinskih materijala, bušenja... enciklopedijski rječnik
koloidna hemija- koloidų chemija statusas T sritis chemija apibrėžtis Dispersinių sistemų ir paviršinių reiškinių chemija. atitikmenys: engl. koloidna hemija rus. koloidna hemija... Chemijos terminų aiškinamasis žodynas
Nauka o površinskim pojavama i dispergovanim sistemima. Sva priroda Zemljina kora i podzemlje, atmosfera i hidrosfera, životinjski i biljni organizmi, složen skup raznolikih disperznih sistema. Univerzalnost dispergovanog stanja određuje ... ... Veliki enciklopedijski politehnički rječnik
Knjige
- Koloidna hemija. Fizička hemija disperznih sistema. Udžbenik za studente ustanova visokog stručnog obrazovanja. Grif Ministarstvo odbrane Ruske Federacije, Eršov Jurij Aleksejevič. U udžbeniku se izlažu osnove fizičke hemije dispergovanih sistema (koloidna hemija) u skladu sa okvirni program u disciplini "Fizikalna i koloidna hemija" za specijalnost 060301...