Mn w układzie okresowym. Układ okresowy pierwiastków chemicznych
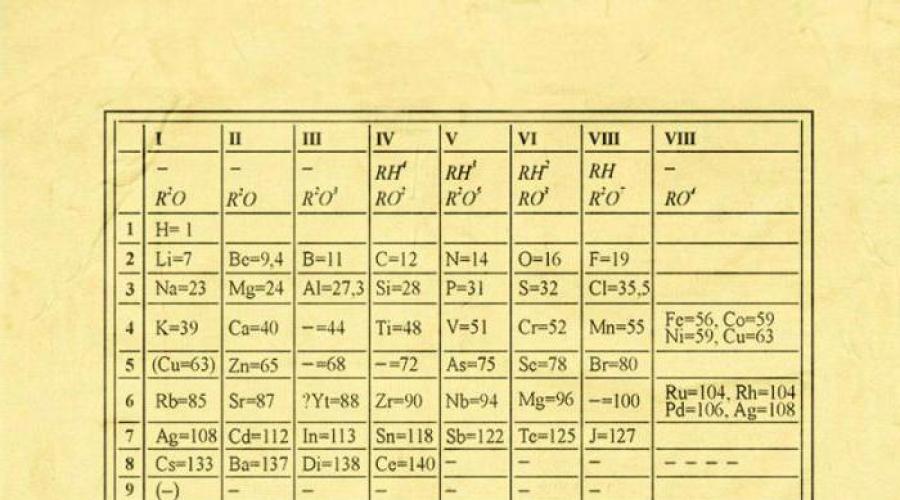
Wiek XIX w historii ludzkości to wiek, w którym zreformowano wiele nauk, w tym chemię. W tym czasie pojawił się układ okresowy Mendelejewa, a wraz z nim prawo okresowości. To on stał się podstawą współczesna chemia. Układ okresowy D.I. Mendelejewa to systematyzacja pierwiastków, która ustala zależność właściwości chemicznych i fizycznych od struktury i ładunku atomu substancji.
Fabuła
Początek okresu okresowego wyznaczyła książka „Korelacja właściwości z masą atomową pierwiastków”, napisana w trzeciej ćwierci XVII wieku. Przedstawiono w nim podstawowe pojęcia stosunkowo dobrze znane pierwiastki chemiczne(wówczas było ich tylko 63). Co więcej, wielu z nich masy atomowe zostały zdefiniowane błędnie. To znacznie przeszkodziło w odkryciu D.I. Mendelejewa.
Dmitrij Iwanowicz rozpoczął swoją pracę od porównania właściwości pierwiastków. Najpierw zajmował się chlorem i potasem, dopiero potem zajął się metalami alkalicznymi. Uzbrojony w specjalne karty, na których przedstawiono pierwiastki chemiczne, wielokrotnie próbował złożyć tę „mozaikę”: kładł ją na stole w poszukiwaniu niezbędnych kombinacji i dopasowań.
Po wielu wysiłkach Dmitrij Iwanowicz w końcu znalazł poszukiwany wzór i ułożył elementy w okresowe rzędy. Otrzymawszy w rezultacie puste komórki między pierwiastkami, naukowiec zdał sobie sprawę, że nie wszystkie pierwiastki chemiczne są znane rosyjskim badaczom i że to on musi dać temu światu wiedzę z zakresu chemii, której nie przekazał jeszcze jego przodkowie.

Wszyscy znają mit, że Mendelejewowi we śnie ukazał się układ okresowy, a on zebrał pierwiastki z pamięci. ujednolicony system. Jest to, mówiąc najprościej, kłamstwo. Faktem jest, że Dmitrij Iwanowicz pracował dość długo i skoncentrował się na swojej pracy, co go bardzo wyczerpało. Pracując nad układem elementów, Mendelejew pewnego razu zasnął. Kiedy się obudził, zdał sobie sprawę, że nie dokończył stołu i raczej kontynuował wypełnianie pustych komórek. Jego znajomy, niejaki Inostrantsev, nauczyciel akademicki, stwierdził, że Mendelejew marzył o układzie okresowym, i rozpowszechnił tę plotkę wśród swoich uczniów. W ten sposób powstała ta hipoteza.
Sława
Pierwiastki chemiczne Mendelejewa są odzwierciedleniem prawa okresowego stworzonego przez Dmitrija Iwanowicza w trzeciej ćwierci XIX wieku (1869). To właśnie w 1869 roku na zebraniu rosyjskiej społeczności chemicznej odczytano zawiadomienie Mendelejewa o utworzeniu pewnej struktury. W tym samym roku ukazała się książka „Podstawy chemii”, w której po raz pierwszy opublikowano okresowy układ pierwiastków chemicznych Mendelejewa. A w książce” System naturalny pierwiastków i ich wykorzystanie do wskazania cech nieodkrytych pierwiastków” D.I. Mendelejew jako pierwszy wspomniał o pojęciu „prawa okresowego”.

Konstrukcja i zasady umieszczania elementów
Pierwsze kroki w tworzeniu prawa okresowego podjął Dmitrij Iwanowicz już w latach 1869–1871, w tym czasie ciężko pracował nad ustaleniem zależności właściwości tych pierwiastków od masy ich atomu. Wersja nowoczesna reprezentuje elementy podsumowane w dwuwymiarowej tabeli.
Pozycja pierwiastka w tabeli ma określone znaczenie chemiczne i fizyczne. Po umieszczeniu elementu w tabeli możesz dowiedzieć się, jaka jest jego wartościowość i określić inną cechy chemiczne. Dmitrij Iwanowicz próbował ustalić połączenie między elementami, zarówno podobnymi pod względem właściwości, jak i różniącymi się.

Klasyfikację znanych wówczas pierwiastków chemicznych oparł na wartościowości i masie atomowej. Porównując względne właściwości pierwiastków Mendelejew próbował znaleźć wzór, który zjednoczyłby wszystkie znane pierwiastki chemiczne w jeden układ. Układając je w oparciu o rosnące masy atomowe, nadal osiągał okresowość w każdym z rzędów.
Dalszy rozwój systemu
Układ okresowy, który pojawił się w 1969 roku, był wielokrotnie udoskonalany. Wraz z pojawieniem się gazów szlachetnych w latach trzydziestych XX wieku możliwe było ujawnienie nowej zależności pierwiastków - nie od masy, ale od liczby atomowej. Później udało się ustalić liczbę protonów w jądrach atomowych i okazało się, że pokrywa się ona z liczbą atomową pierwiastka. Naukowcy XX wieku badali energię elektronową. Okazało się, że wpływa ona również na okresowość. To znacznie zmieniło poglądy na temat właściwości pierwiastków. Punkt ten znalazł odzwierciedlenie w późniejszych wydaniach układu okresowego Mendelejewa. Każde nowe odkrycie właściwości i cech pierwiastków organicznie wpasowuje się w tabelę.
Charakterystyka układu okresowego Mendelejewa
Układ okresowy dzieli się na okresy (7 rzędów ułożonych poziomo), które z kolei dzielą się na duże i małe. Okres rozpoczyna się od metalu alkalicznego, a kończy na pierwiastku o właściwościach niemetalicznych.
Tabela Dmitrija Iwanowicza jest podzielona pionowo na grupy (8 kolumn). Każda z nich w układzie okresowym składa się z dwóch podgrup, a mianowicie głównej i wtórnej. Po wielu dyskusjach, za sugestią D.I. Mendelejewa i jego kolegi U. Ramsaya, zdecydowano się na wprowadzenie tzw. grupy zerowej. Obejmuje gazy obojętne (neon, hel, argon, radon, ksenon, krypton). W 1911 roku naukowcy F. Soddy zostali poproszeni o umieszczenie w układzie okresowym nierozróżnialnych pierwiastków, tzw. izotopów - przydzielono im osobne komórki.

Pomimo poprawności i dokładności układu okresowego, społeczność naukowa długo nie chciała uznać tego odkrycia. Wielu wielkich naukowców wyśmiewało prace D.I. Mendelejewa i uważało, że nie da się przewidzieć właściwości pierwiastka, który nie został jeszcze odkryty. Ale po odkryciu rzekomych pierwiastków chemicznych (a były to na przykład skand, gal i german) układ Mendelejewa i jego prawo okresowości stały się nauką chemiczną.
Stół w czasach nowożytnych
Układ okresowy pierwiastków Mendelejewa jest podstawą większości odkryć chemicznych i fizycznych związanych z nauką atomowo-molekularną. Nowoczesna koncepcja pierwiastek powstał właśnie dzięki wielkiemu naukowcowi. Pojawienie się układu okresowego Mendelejewa wprowadziło zasadnicze zmiany w poglądach na ten temat różne połączenia I proste substancje Oh. Stworzenie przez naukowców układu okresowego miało ogromny wpływ na rozwój chemii i wszystkich nauk z nią związanych.
Prawdopodobnie wszyscy widzieliście układ okresowy pierwiastków. Możliwe, że nadal nawiedza Cię w snach, a może na razie jest jedynie wizualnym tłem zdobiącym ścianę klasa szkolna. Jednak w tym pozornie przypadkowym zbiorze komórek jest znacznie więcej, niż mogłoby się wydawać.
Układ okresowy (lub PT, jak będziemy go od czasu do czasu nazywać w tym artykule) i tworzące go pierwiastki mają cechy, których być może nigdy nie odgadłeś. Od utworzenia tabeli po dodanie do niej ostatnich elementów — oto dziesięć faktów, o których większość ludzi nie wie.
10. Mendelejew otrzymał pomoc
Układ okresowy jest używany od 1869 roku, kiedy to został opracowany przez mocno brodatego Dymitra Mendelejewa. Większość ludzi uważa, że Mendelejew był jedynym, który pracował na tym stole i dzięki temu stał się najwybitniejszym chemikiem stulecia. Jednak w jego wysiłkach pomogło kilku europejskich naukowców, którzy wnieśli istotny wkład w ukończenie tego kolosalnego zestawu elementów.
Mendelejew jest powszechnie znany jako ojciec układ okresowy, ale kiedy go skompilował, nie wszystkie elementy tabeli były już otwarte. Jak to się stało możliwe? Naukowcy słyną ze swojego szaleństwa...
9. Ostatnio dodane elementy

Wierzcie lub nie, ale układ okresowy nie zmienił się zbytnio od lat pięćdziesiątych XX wieku. Natomiast 2 grudnia 2016 roku dodano od razu cztery nowe pierwiastki: nihonium (element nr 113), moscovium (element nr 115), tennessine (element nr 117) i oganesson (element nr 118). Nazwy tych nowych elementów nadano dopiero w czerwcu 2016 r., ponieważ przed oficjalnym dodaniem ich do PT wymagany był pięciomiesięczny przegląd.
Trzy pierwiastki nazwano na cześć miast lub stanów, w których je uzyskano, a Oganesson na cześć rosyjskiego fizyka jądrowego Jurija Oganesjana za jego wkład w otrzymanie tego pierwiastka.
8. Której litery nie ma w tabeli?

Alfabet łaciński składa się z 26 liter i każda z nich jest ważna. Jednak Mendelejew postanowił tego nie zauważyć. Spójrz na tabelę i powiedz mi, która litera jest pechowa? Wskazówka: szukaj w kolejności i zginaj palce po każdej znalezionej literze. W rezultacie znajdziesz „brakującą” literę (jeśli masz wszystkie dziesięć palców na rękach). Zgadłeś? To jest litera numer 10, litera „J”.
Mówią, że „jeden” to liczba osób samotnych. Może więc powinniśmy nazwać literę „J” literą singli? Ale oto zabawny fakt: większość chłopców urodzonych w Stanach Zjednoczonych w 2000 roku otrzymała imiona zaczynające się na tę literę. Dlatego też list ten nie pozostał bez należytej uwagi.
7. Elementy syntetyzowane

Jak zapewne już wiesz, obecnie w układzie okresowym znajduje się 118 pierwiastków. Czy zgadniesz, ile z tych 118 pierwiastków uzyskano w laboratorium? Wszystkiego lista ogólna V naturalne warunki można znaleźć tylko 90 elementów.
Czy uważasz, że 28 sztucznie stworzonych elementów to dużo? No cóż, uwierz mi na słowo. Syntetyzuje się je od 1937 r. i naukowcy kontynuują to dzisiaj. Wszystkie te elementy znajdziesz w tabeli. Spójrz na pierwiastki od 95 do 118. Wszystkie te pierwiastki nie występują na naszej planecie i zostały zsyntetyzowane w laboratoriach. To samo dotyczy elementów o numerach 43, 61, 85 i 87.
6. 137 element

W połowie XX wieku słynny naukowiec Richard Feynman wygłosił dość głośne oświadczenie, które zszokowało wszystkich. świat naukowy naszej planety. Według niego, jeśli kiedykolwiek odkryjemy pierwiastek 137, nie będziemy w stanie określić liczby znajdujących się w nim protonów i neutronów. Liczba 1/137 jest godna uwagi, ponieważ jest to wartość stałej struktury drobnej, która opisuje prawdopodobieństwo, że elektron zaabsorbuje lub wyemituje foton. Teoretycznie pierwiastek nr 137 powinien mieć 137 elektronów i 100% szans na zaabsorbowanie fotonu. Jego elektrony będą się obracać z prędkością światła. Co jeszcze bardziej niewiarygodne, elektrony pierwiastka 139 muszą wirować szybciej niż prędkość światła, aby istnieć.
Czy jesteś już zmęczony fizyką? Być może zainteresuje Cię fakt, że liczba 137 łączy w sobie trzy ważne obszary fizyki: teorię prędkości światła, mechanikę kwantową i elektromagnetyzm. Od początku XX wieku fizycy spekulowali, że liczba 137 może być podstawą Wielkiego ujednolicona teoria, który obejmie wszystkie trzy powyższe obszary. Trzeba przyznać, że brzmi to tak samo niewiarygodnie, jak legendy o UFO i Trójkącie Bermudzkim.
5. Co możesz powiedzieć o imionach?

Prawie wszystkie nazwy elementów mają pewne znaczenie, choć nie jest to od razu jasne. Nazwy nowych elementów nie są nadawane arbitralnie. Nazwałbym element pierwszym słowem, które przyszło mi do głowy. Na przykład „kerflump”. Myślę, że nie jest źle.
Zazwyczaj nazwy elementów należą do jednej z pięciu głównych kategorii. Pierwsza to nazwiska znanych naukowców, wersja klasyczna- einstein. Ponadto pierwiastki mogą otrzymać swoje nazwy w zależności od miejsca, w którym zostały po raz pierwszy zarejestrowane, na przykład german, ameryk, gal itp. Jak opcja dodatkowa używane są nazwy planet. Pierwiastek uran został po raz pierwszy odkryty wkrótce po odkryciu planety Uran. Pierwiastki mogą mieć nazwy kojarzone z mitologią, na przykład tytan, nazwany na cześć starożytnych greckich tytanów i tor, nazwany na cześć nordyckiego boga piorunów (lub gwiazdowego „mściciela”, w zależności od upodobań).
I wreszcie istnieją nazwy opisujące właściwości elementów. Argon pochodzi od greckiego słowa „argos”, które oznacza „leniwy” lub „powolny”. Nazwa sugeruje, że gaz ten nie jest aktywny. Brom to kolejny pierwiastek, którego nazwa pochodzi od greckiego słowa. „Bromos” oznacza „smród” i właściwie opisuje zapach bromu.
4. Czy tworzenie stołu było „momentem eureki”?

Jeśli kochasz gry karciane, to ten fakt jest dla Ciebie. Mendelejew musiał jakoś ułożyć wszystkie elementy i znaleźć na to system. Naturalnie, aby stworzyć tabelę kategorii, sięgnął po pasjansa (no cóż, co jeszcze?). Mendelejew zapisał masę atomową każdego pierwiastka na osobnej karcie, a następnie zaczął układać swoją zaawansowaną grę w pasjansa. Ułożył pierwiastki według ich specyficznych właściwości, a następnie ułożył je w każdej kolumnie według ich masy atomowej.
Wiele osób nie może grać w zwykłego pasjansa, więc ten pasjans robi wrażenie. Co się później stanie? Prawdopodobnie ktoś przy pomocy szachów zrewolucjonizuje astrofizykę lub stworzy rakietę zdolną dolecieć na obrzeża galaktyki. Wydaje się, że nie będzie w tym nic niezwykłego, biorąc pod uwagę, że Mendelejewowi udało się uzyskać tak genialny wynik za pomocą zwykłej talii zwykłych kart do gry.
3. Pechowe gazy szlachetne

Pamiętasz, jak sklasyfikowaliśmy argon jako najbardziej leniwy i najwolniejszy pierwiastek w historii naszego wszechświata? Wydaje się, że Mendelejewa ogarnęły te same uczucia. Kiedy w 1894 roku po raz pierwszy uzyskano czysty argon, nie mieścił się on w żadnej kolumnie tabeli, więc zamiast szukać rozwiązania, naukowiec postanowił po prostu zaprzeczyć jego istnieniu.
Co jeszcze bardziej uderzające, argon nie był jedynym pierwiastkiem, który początkowo spotkał taki los. Oprócz argonu niesklasyfikowanych pozostało pięć innych pierwiastków. Dotyczyło to radonu, neonu, kryptonu, helu i ksenonu - i wszyscy zaprzeczali ich istnieniu tylko dlatego, że Mendelejew nie mógł znaleźć dla nich miejsca na stole. Po kilku latach przegrupowania i przeklasyfikowania elementy te (tzw gazy obojętne) miał jeszcze szczęście dołączyć do godnego klubu, uznanego za naprawdę istniejący.
2. Miłość atomowa

Rady dla wszystkich, którzy uważają się za romantyków. Weź papierową kopię układu okresowego i wytnij wszystkie skomplikowane i stosunkowo niepotrzebne środkowe kolumny, tak aby pozostało 8 kolumn (będziesz miał „krótką” formę układu). Złóż go na środku grupy IV - a dowiesz się, które elementy mogą ze sobą tworzyć związki.
Elementy, które po złożeniu „całują się”, potrafią tworzyć stabilne związki. Elementy te mają uzupełniające się struktury elektroniczne i będą się ze sobą łączyć. A jeśli to nie jest prawdziwa miłość, jak Romeo i Julia albo Shrek i Fiona, to nie wiem, czym jest miłość.
1. Zasady dotyczące węgla

Carbon stara się być w centrum gry. Myślisz, że wiesz wszystko o węglu, ale tak nie jest; Czy wiesz, że występuje w ponad połowie wszystkich znanych związków? A co z faktem, że 20 procent masy wszystkich żywych organizmów stanowi węgiel? To naprawdę dziwne, ale przygotuj się: każdy atom węgla w twoim ciele był kiedyś częścią frakcji dwutlenek węgla w atmosferze. Węgiel jest nie tylko superpierwiastkiem naszej planety, jest czwartym najbardziej rozpowszechnionym pierwiastkiem w całym Wszechświecie.
Jeśli układ okresowy jest jak impreza, wówczas głównym żywicielem jest węgiel. I wydaje się, że tylko on wie, jak wszystko poprawnie zorganizować. Cóż, między innymi jest to główny element wszystkich diamentów, dlatego przy całej swojej natrętności on także błyszczy!
Prawdziwym przełomem w chemii było odkrycie układu okresowego pierwiastków chemicznych przez Dmitrija Mendelejewa w marcu 1869 roku. Rosyjskiemu naukowcowi udało się usystematyzować wiedzę o pierwiastkach chemicznych i przedstawić ją w formie tabeli, której uczniowie nadal są zobowiązani uczyć się na lekcjach chemii. Układ okresowy stał się podstawą szybkiego rozwoju tej złożonej i interesującej nauki, a historia jego odkrycia owiana jest legendami i mitami. Dla wszystkich zainteresowanych nauką interesujące będzie poznanie prawdy o tym, jak Mendelejew odkrył tablicę pierwiastków okresowych.
Historia układu okresowego: jak to się wszystko zaczęło
Próby klasyfikacji i usystematyzowania znanych pierwiastków chemicznych podejmowano na długo przed Dmitrijem Mendelejewem. Swoje układy pierwiastków zaproponowali tak znani naukowcy, jak Döbereiner, Newlands, Meyer i inni. Jednak ze względu na brak danych na temat pierwiastków chemicznych i ich prawidłowych mas atomowych zaproponowane układy nie były w pełni niezawodne.
Historia odkrycia układu okresowego rozpoczyna się w 1869 roku, kiedy rosyjski naukowiec na spotkaniu Rosyjskiego Towarzystwa Chemicznego opowiedział swoim kolegom o swoim odkryciu. W zaproponowanej przez naukowca tabeli ułożono pierwiastki chemiczne w zależności od ich właściwości, jakie zapewnia wielkość ich masy cząsteczkowej.
Ciekawostką układu okresowego była także obecność pustych komórek, które w przyszłości zostały wypełnione przewidywanymi przez naukowca otwartymi pierwiastkami chemicznymi (german, gal, skand). Od czasu odkrycia układu okresowego wielokrotnie wprowadzano do niego uzupełnienia i poprawki. Wraz ze szkockim chemikiem Williamem Ramsayem Mendelejew dodał do stołu grupę gazów obojętnych (grupa zerowa).
Następnie historia układu okresowego Mendelejewa została bezpośrednio powiązana z odkryciami w innej nauce - fizyce. Prace nad układem pierwiastków okresowych trwają do dziś, a współcześni naukowcy dodają nowe pierwiastki chemiczne w miarę ich odkrywania. Znaczenie układu okresowego Dmitrija Mendelejewa jest trudne do przecenienia, ponieważ dzięki niemu:
- Usystematyzowano wiedzę na temat właściwości odkrytych już pierwiastków chemicznych;
- Stało się możliwe przewidzenie odkrycia nowych pierwiastków chemicznych;
- Zaczęły się rozwijać takie gałęzie fizyki, jak fizyka atomowa i fizyka jądrowa;
Istnieje wiele opcji przedstawiania pierwiastków chemicznych zgodnie z prawem okresowym, ale najbardziej znaną i powszechną opcją jest znany wszystkim układ okresowy.
Mity i fakty na temat powstania układu okresowego
Najczęstszym błędnym przekonaniem w historii odkrycia układu okresowego jest to, że naukowiec widział go we śnie. W rzeczywistości sam Dmitrij Mendelejew obalił ten mit i stwierdził, że zastanawiał się nad prawem okresowości od wielu lat. Aby usystematyzować pierwiastki chemiczne, spisał każdy z nich na osobnej kartce i wielokrotnie łączył je ze sobą, układając je w rzędy w zależności od ich podobnych właściwości.
Mit o „proroczym” śnie naukowca można wytłumaczyć faktem, że Mendelejew całymi dniami pracował nad usystematyzowaniem pierwiastków chemicznych, przerywany krótkim snem. Jednak tylko ciężka praca i naturalny talent naukowca dały długo oczekiwany rezultat i zapewniły Dmitrijowi Mendelejewowi światową sławę.
Wielu uczniów w szkole, a czasami na uniwersytecie, jest zmuszonych do zapamiętywania lub przynajmniej z grubsza poruszania się po układzie okresowym. Aby to zrobić, osoba musi nie tylko mieć dobra pamięć, ale także myśleć logicznie, łącząc elementy w osobne grupy i klasy. Studiowanie stołu jest najłatwiejsze dla osób, które stale utrzymują mózg w dobrej kondycji, przechodząc szkolenia na BrainApps.
Każdy, kto chodził do szkoły, pamięta, że jednym z obowiązkowych przedmiotów do nauki była chemia. Możesz ją lubić, możesz jej nie lubić – to nie ma znaczenia. I jest prawdopodobne, że duża część wiedzy z tej dyscypliny została już zapomniana i nie jest wykorzystywana w życiu. Jednak wszyscy prawdopodobnie pamiętają tabelę pierwiastków chemicznych D.I. Mendelejewa. Dla wielu pozostała wielokolorową tabelą, na której w każdym kwadracie wpisane są określone litery, wskazujące nazwy pierwiastków chemicznych. Ale tutaj nie będziemy rozmawiać o chemii jako takiej i będziemy opisywać setki reakcje chemiczne i procesy, ale przede wszystkim opowiemy Ci, jak pojawił się układ okresowy - ta historia będzie interesująca dla każdej osoby, a nawet dla wszystkich, którzy są głodni ciekawych i przydatnych informacji.
Trochę tła
Już w 1668 roku wybitny irlandzki chemik, fizyk i teolog Robert Boyle opublikował książkę, w której obalił wiele mitów na temat alchemii i w której omówił potrzebę poszukiwania nierozkładalnych pierwiastków chemicznych. Naukowiec podał także ich listę, zawierającą zaledwie 15 elementów, ale przyznał, że pierwiastków może być więcej. Stało się to punktem wyjścia nie tylko w poszukiwaniu nowych elementów, ale także w ich systematyzacji.
Sto lat później francuski chemik Antoine Lavoisier sporządził nową listę, która zawierała już 35 elementów. Później okazało się, że 23 z nich nie nadają się do rozkładu. Jednak poszukiwania nowych pierwiastków są kontynuowane przez naukowców na całym świecie. I główna rola W procesie tym rolę odegrał słynny rosyjski chemik Dmitrij Iwanowicz Mendelejew, który jako pierwszy wysunął hipotezę, że może istnieć związek pomiędzy masą atomową pierwiastków a ich umiejscowieniem w układzie.
Dzięki żmudnej pracy i porównywaniu pierwiastków chemicznych Mendelejewowi udało się odkryć związek między pierwiastkami, w którym mogą stanowić jedność, a ich właściwości nie są czymś oczywistym, ale stanowią okresowo powtarzające się zjawisko. W rezultacie w lutym 1869 r. Mendelejew sformułował pierwsze prawo okresowe, a już w marcu jego raport „Związek właściwości z masą atomową pierwiastków” został przedstawiony Rosyjskiemu Towarzystwu Chemicznemu przez historyka chemii N. A. Menshutkina. Następnie w tym samym roku ukazała się publikacja Mendelejewa w czasopiśmie „Zeitschrift fur Chemie” w Niemczech, a w 1871 r. w innym niemieckim czasopiśmie „Annalen der Chemie” ukazała się nowa obszerna publikacja naukowca poświęcona jego odkryciu.
Tworzenie układu okresowego

W 1869 roku główna idea została już uformowana przez Mendelejewa i to w dość krótkim czasie, lecz przez długi czas nie potrafił jej sformalizować w żaden uporządkowany system, który jasno wskazywałby, co jest co. W jednej z rozmów ze swoim kolegą A.A. Inostrantsevem powiedział nawet, że ma już wszystko poukładane w głowie, ale nie potrafi wszystkiego ułożyć w tabelę. Następnie, według biografów Mendelejewa, rozpoczął żmudną pracę przy swoim stole, która trwała trzy dni bez przerw na sen. Próbowali na różne sposoby ułożyć pierwiastki w tabelę, a pracę komplikował także fakt, że w tamtym czasie nauka nie wiedziała jeszcze o wszystkich pierwiastkach chemicznych. Ale mimo to stół nadal powstawał, a elementy usystematyzowano.
Legenda o śnie Mendelejewa
Wielu słyszało historię, że D.I. Mendelejew marzył o swoim stole. Wersję tę aktywnie rozpowszechniał wspomniany współpracownik Mendelejewa A. A. Inostrantsev jako zabawna historia którymi zabawiał swoich uczniów. Powiedział, że Dmitrij Iwanowicz poszedł spać i we śnie wyraźnie widział swój stół, na którym ułożone były wszystkie pierwiastki chemiczne we właściwej kolejności. Potem uczniowie żartowali nawet, że w ten sam sposób odkryto wódkę 40°. Ale nadal istniały realne warunki wstępne dla historii ze snem: jak już wspomniano, Mendelejew pracował przy stole bez snu i odpoczynku, a Inostrantsev pewnego razu stwierdził, że jest zmęczony i wyczerpany. W ciągu dnia Mendelejew postanowił chwilę odpocząć, a jakiś czas później obudził się nagle, od razu wziął kartkę papieru i narysował na niej gotowy stół. Ale sam naukowiec obalił całą tę historię snem, mówiąc: „Myślałem o tym, może od dwudziestu lat, i myślisz: siedziałem i nagle… gotowe”. Tak więc legenda snu może być bardzo atrakcyjna, ale stworzenie stołu było możliwe tylko dzięki ciężkiej pracy.

Dalsza praca
W latach 1869–1871 Mendelejew rozwinął ideę okresowości, ku której skłaniała się społeczność naukowa. I jeden z ważne etapy ten proces panowało zrozumienie, że każdy element systemu powinien posiadać, w oparciu o całość swoich właściwości w porównaniu z właściwościami innych elementów. Na tej podstawie, a także opierając się na wynikach badań zmian zachodzących w tlenkach szklistych, chemik był w stanie wprowadzić poprawki do wartości mas atomowych niektórych pierwiastków, m.in. uranu, indu, berylu i innych.
Mendelejew chciał oczywiście szybko wypełnić puste komórki, które pozostały w tabeli, iw 1870 r. przepowiedział, że wkrótce zostaną odkryte nieznane nauce pierwiastki chemiczne, których masy atomowe i właściwości udało mu się obliczyć. Pierwszymi z nich były gal (odkryty w 1875 r.), skand (odkryty w 1879 r.) i german (odkryty w 1885 r.). Następnie przewidywania się spełniły i odkryto osiem kolejnych pierwiastków, w tym: polon (1898), ren (1925), technet (1937), frans (1939) i astat (1942-1943). Nawiasem mówiąc, w 1900 r. D.I. Mendelejew i szkocki chemik William Ramsay doszli do wniosku, że w tabeli powinny znajdować się również pierwiastki grupy zerowej - do 1962 r. nazywano je gazami obojętnymi, a potem gazami szlachetnymi.
Organizacja układu okresowego
Pierwiastki chemiczne w tabeli D.I. Mendelejewa ułożone są w rzędy zgodnie ze wzrostem ich masy, a długość rzędów jest tak dobrana, aby zawarte w nich pierwiastki miały podobne właściwości. Na przykład gazy szlachetne, takie jak radon, ksenon, krypton, argon, neon i hel, trudno reagują z innymi pierwiastkami, a także mają niską reaktywność chemiczną, dlatego znajdują się w skrajnej prawej kolumnie. A pierwiastki w lewej kolumnie (potas, sód, lit itp.) dobrze reagują z innymi pierwiastkami, a same reakcje są wybuchowe. Mówiąc najprościej, w każdej kolumnie elementy mają podobne właściwości, które różnią się w zależności od kolumny. Wszystkie elementy aż do nr 92 występują w przyrodzie, a od nr 93 zaczynają się sztuczne elementy, które można wytworzyć jedynie w warunkach laboratoryjnych.
W pierwotnej wersji układ okresowy rozumiany był jedynie jako odzwierciedlenie porządku istniejącego w przyrodzie i nie było żadnych wyjaśnień, dlaczego wszystko tak ma być. I tylko wtedy, gdy się pojawiła mechanika kwantowa, prawdziwe znaczenie kolejności elementów w tabeli stało się jasne.
Lekcje procesu twórczego
Rozmawiamy o jakich lekcjach proces twórczy można wydobyć z całej historii tworzenia układu okresowego przez D.I. Mendelejewa, jako przykład możemy przytoczyć idee angielskiego badacza w tej dziedzinie kreatywne myslenie Graham Wallace i francuski naukowiec Henri Poincaré. Przedstawmy je krótko.
Według badań Poincarégo (1908) i Grahama Wallace'a (1926) istnieją cztery główne etapy twórczego myślenia:
- Przygotowanie– etap formułowania problemu głównego i pierwsze próby jego rozwiązania;
- Inkubacja– etap, podczas którego następuje chwilowe odwrócenie uwagi od procesu, ale praca nad rozwiązaniem problemu odbywa się na poziomie podświadomości;
- Wgląd– etap, na którym znajduje się intuicyjne rozwiązanie. Co więcej, rozwiązanie to można znaleźć w sytuacji zupełnie niezwiązanej z problemem;
- Badanie– etap testowania i wdrażania rozwiązania, na którym rozwiązanie to jest testowane i możliwy jego dalszy rozwój.
Jak widać, w procesie tworzenia swojej tablicy Mendelejew intuicyjnie podążał właśnie tymi czterema etapami. Skuteczność tego rozwiązania można ocenić po wynikach, tj. przez fakt, że tabela została stworzona. A biorąc pod uwagę, że jego powstanie było ogromnym krokiem naprzód nie tylko dla nauk chemicznych, ale także dla całej ludzkości, powyższe cztery etapy można zastosować zarówno do wdrożenia małe projekty oraz do realizacji planów globalnych. Najważniejszą rzeczą do zapamiętania jest to, że ani jedno odkrycie, ani jedno rozwiązanie problemu nie mogą zostać znalezione samodzielnie, bez względu na to, jak bardzo chcemy je zobaczyć we śnie i bez względu na to, ile śpimy. Aby coś wyszło, nie ma znaczenia, czy będzie to stworzenie tabeli pierwiastków chemicznych, czy opracowanie nowego planu marketingowego, trzeba mieć pewną wiedzę i umiejętności, a także umiejętnie wykorzystać swój potencjał i ciężko pracować.
Życzymy powodzenia w przedsięwzięciach i pomyślnej realizacji planów!
Nawet w szkole, siedząc na lekcjach chemii, wszyscy pamiętamy stół na ścianie klasy lub laboratorium chemicznego. Tabela ta zawierała klasyfikację wszystkich znanych ludzkości pierwiastków chemicznych, czyli podstawowych składników tworzących Ziemię i cały Wszechświat. Wtedy nie mogliśmy nawet tak myśleć Tablica Mendelejewa jest niewątpliwie jednym z największych odkrycia naukowe, co jest podstawą naszej nowoczesna wiedza o chemii.
Układ okresowy pierwiastków chemicznych autorstwa D. I. Mendelejewa
Na pierwszy rzut oka jej pomysł wydaje się zwodniczo prosty: organizować pierwiastki chemiczne w kolejności rosnącej masy ich atomów. Co więcej, w większości przypadków okazuje się, że substancja chemiczna i właściwości fizyczne każdy element jest podobny do poprzedniego elementu w tabeli. Ten wzór pojawia się dla wszystkich pierwiastków z wyjątkiem kilku pierwszych, po prostu dlatego, że nie mają przed sobą pierwiastków podobnych do nich pod względem masy atomowej. To dzięki odkryciu tej właściwości możemy umieścić liniowy ciąg pierwiastków w tabeli niczym w kalendarzu ściennym i w ten sposób połączyć ogromną liczbę rodzajów pierwiastków chemicznych w przejrzystej i spójnej formie. Oczywiście dzisiaj używamy pojęcia liczby atomowej (liczby protonów) w celu uporządkowania układu pierwiastków. Pomogło to rozwiązać tzw problem techniczny„para permutacji” nie doprowadziła jednak do zasadniczej zmiany wyglądu układu okresowego.
W układ okresowy wszystkie pierwiastki są uporządkowane na podstawie ich liczby atomowej, konfiguracji elektronicznej i powtarzających się właściwości chemicznych. Wiersze tabeli nazywane są okresami, a kolumny grupami. Pierwszy stół, pochodzący z 1869 roku, zawierał zaledwie 60 elementów, ale teraz trzeba było go powiększyć, aby pomieścić 118 elementów, które znamy dzisiaj.
Układ okresowy Mendelejewa systematyzuje nie tylko pierwiastki, ale także ich najróżniejsze właściwości. Często wystarczy, że chemik ma przed oczami układ okresowy, aby poprawnie odpowiedzieć na wiele pytań (nie tylko egzaminacyjnych, ale także naukowych).
Identyfikator YouTube 1M7iKKVnPJE jest nieprawidłowy.
Prawo okresowe
Istnieją dwa preparaty prawo okresowe pierwiastki chemiczne: klasyczne i współczesne.
Klasyczna w ujęciu jej odkrywcy D.I. Mendelejew: właściwości prostych ciał, a także formy i właściwości związków pierwiastków są okresowo zależne od wartości mas atomowych pierwiastków.
Nowoczesne: właściwości prostych substancji, a także właściwości i formy związków pierwiastków są okresowo zależne od ładunku jądra atomów pierwiastków (liczba porządkowa).
Graficzną reprezentacją prawa okresowego jest okresowy układ elementów, który reprezentuje klasyfikacja naturalna pierwiastki chemiczne, opierające się na regularnych zmianach właściwości pierwiastków w zależności od ładunków ich atomów. Najpopularniejszymi obrazami układu okresowego pierwiastków są D.I. Formy Mendelejewa są krótkie i długie.

Grupy i okresy układu okresowego
W grupach nazywane są pionowymi rzędami układu okresowego. W grupach elementy są łączone według atrybutów najwyższy stopień utlenianie w tlenkach. Każda grupa składa się z podgrupy głównej i podgrupy drugorzędnej. Główne podgrupy obejmują elementy małych okresów i elementy dużych okresów o tych samych właściwościach. Podgrupy boczne składają się tylko z elementów o dużych okresach. Właściwości chemiczne pierwiastków podgrup głównych i drugorzędnych znacznie się różnią.
Okres nazywany poziomym rzędem pierwiastków ułożonych w kolejności rosnącej liczby atomowej. W układzie okresowym jest siedem okresów: pierwszy, drugi i trzeci okres nazywane są małymi, zawierają odpowiednio 2, 8 i 8 elementów; pozostałe okresy nazywane są dużymi: w czwartym i piątym okresie jest 18 elementów, w szóstym - 32, a w siódmym (jeszcze nieukończonym) - 31 elementów. Każdy okres, z wyjątkiem pierwszego, zaczyna się od metalu alkalicznego, a kończy na gazie szlachetnym.
Fizyczne znaczenie numeru seryjnego pierwiastek chemiczny: liczba protonów w jądrze atomowym i liczba krążących wokół niego elektronów jądro atomowe, są równe liczbie porządkowej elementu.
Właściwości układu okresowego
Przypomnijmy to grupy nazywane są pionowymi rzędami w układzie okresowym i Właściwości chemiczne elementy podgrupy głównej i drugorzędnej znacznie się różnią.
Właściwości elementów w podgrupach naturalnie zmieniają się od góry do dołu:
- nasilają się właściwości metaliczne i niemetaliczne osłabiają się;
- promień atomowy wzrasta;
- wzrasta siła zasad i kwasów beztlenowych tworzonych przez pierwiastek;
- elektroujemność maleje.
Wszystkie pierwiastki z wyjątkiem helu, neonu i argonu tworzą związki tlenu; istnieje tylko osiem form związków tlenu. W układzie okresowym są często przedstawiane ogólne formuły, umieszczone pod każdą grupą w kolejności rosnącej stopnia utlenienia pierwiastków: R 2 O, RO, R 2 O 3, RO 2, R 2 O 5, RO 3, R 2 O 7, RO 4, gdzie symbol R oznacza element tej grupy. Wzory wyższych tlenków dotyczą wszystkich pierwiastków grupy, z wyjątkiem wyjątkowych przypadków, gdy pierwiastki nie wykazują stopnia utlenienia równego numerowi grupy (na przykład fluor).
Tlenki kompozycji R 2 O wykazują silne właściwości zasadowe, a ich zasadowość wzrasta wraz ze wzrostem liczby atomowej; tlenki kompozycji RO (z wyjątkiem BeO) wykazują właściwości zasadowe. Tlenki o składzie RO 2, R 2 O 5, RO 3, R 2 O 7 wykazują właściwości kwasowe, a ich kwasowość wzrasta wraz ze wzrostem liczby atomowej.
Pierwiastki głównych podgrup, począwszy od grupy IV, tworzą gazowe związki wodorowe. Istnieją cztery formy takich związków. Znajdują się one pod elementami głównych podgrup i są reprezentowane przez ogólne wzory w sekwencji RH 4, RH 3, RH 2, RH.
Związki RH4 mają charakter obojętny; RH 3 - słabo zasadowy; RH 2 - lekko kwaśny; RH – charakter silnie kwaśny.
Przypomnijmy to okres nazywany poziomym rzędem pierwiastków ułożonych w kolejności rosnącej liczby atomowej.
W okresie wraz ze wzrostem numeru seryjnego elementu:
- wzrasta elektroujemność;
- właściwości metaliczne maleją, właściwości niemetaliczne rosną;
- promień atomowy maleje.

Elementy układu okresowego
Pierwiastki alkaliczne i pierwiastki ziem alkalicznych
Należą do nich pierwiastki z pierwszej i drugiej grupy układu okresowego. Metale alkaliczne z pierwszej grupy - metale miękkie, w kolorze srebrnym, łatwe do cięcia nożem. Wszystkie mają pojedynczy elektron na swojej zewnętrznej powłoce i reagują doskonale. Metale ziem alkalicznych z drugiej grupy mają również srebrzysty odcień. Dwa elektrony są umieszczone na poziomie zewnętrznym, w związku z czym metale te trudniej oddziałują z innymi pierwiastkami. W porównaniu do metali alkalicznych metale ziem alkalicznych topią się i wrzą w wyższych temperaturach.
Pokaż/Ukryj tekst
Lantanowce (pierwiastki ziem rzadkich) i aktynowce
Lantanowce- grupa pierwiastków pierwotnie występujących w rzadkich minerałach; stąd ich nazwa pierwiastki „ziem rzadkich”. Później okazało się, że pierwiastki te nie są tak rzadkie, jak początkowo sądzono, dlatego też pierwiastkom ziem rzadkich nadano nazwę lantanowce. Lantanowce i aktynowce zajmują dwa bloki, które znajdują się pod główną tabelą elementów. Obie grupy obejmują metale; wszystkie lantanowce (z wyjątkiem prometu) są nieradioaktywne; Przeciwnie, aktynowce są radioaktywne.
Pokaż/Ukryj tekst
Halogeny i gazy szlachetne
Halogeny i gazy szlachetne są pogrupowane w grupy 17 i 18 układu okresowego. Halogeny są pierwiastkami niemetalicznymi, wszystkie mają siedem elektronów na swojej zewnętrznej powłoce. W Gazy szlachetne Wszystkie elektrony znajdują się w powłoce zewnętrznej, więc prawie nie uczestniczą w tworzeniu związków. Gazy te nazywane są gazami „szlachetnymi”, ponieważ rzadko reagują z innymi pierwiastkami; to znaczy odnoszą się do członków kasty szlacheckiej, którzy tradycyjnie stronili od innych ludzi w społeczeństwie.
Pokaż/Ukryj tekst
Metale przejściowe
Metale przejściowe zajmują grupy 3-12 w układzie okresowym. Większość z nich jest gęsta, twarda, ma dobrą przewodność elektryczną i cieplną. Ich elektrony walencyjne (za pomocą których są połączone z innymi pierwiastkami) znajdują się w kilku powłokach elektronowych.
Pokaż/Ukryj tekst
| Metale przejściowe |
| Skand Sc 21 |
| Tytan Ti 22 |
| Wanad V 23 |
| Chrome Cr 24 |
| Mangan Mn 25 |
| Żelazo Fe 26 |
| Kobalt Co 27 |
| Nikiel Ni 28 |
| Miedź Cu 29 |
| Cynk Zn 30 |
| Itr Y 39 |
| Cyrkon Zr 40 |
| Niob Nb 41 |
| Molibden Mo 42 |
| Technet Tc 43 |
| Ruten Ru 44 |
| Rod Rh 45 |
| Pallad Pd 46 |
| Srebro Ag 47 |
| Kadm Cd 48 |
| Lutet Lu 71 |
| Hafn Hf 72 |
| Tantal Ta 73 |
| Wolfram W 74 |
| Ren Re 75 |
| Osm Os 76 |
| Iryd Ir 77 |
| Platyna Pt 78 |
| Złoto Au 79 |
| Rtęć Hg 80 |
| Lawrence Lr 103 |
| Rutherford Rf 104 |
| Dubnium Db 105 |
| Seaborgium Sg 106 |
| Bor Bh 107 |
| Hassiy Hs 108 |
| Meitner Mt 109 |
| Darmstadt DS 110 |
| Rentgen Rg 111 |
| Kopernik Cn 112 |
Metaloidy
Metaloidy zajmują grupy 13-16 układu okresowego. Metaloidy, takie jak bor, german i krzem, są półprzewodnikami i są wykorzystywane do produkcji czipy komputerowe i opłaty.
Pokaż/Ukryj tekst
Metale poprzejściowe
Elementy tzw metale po przejściowe, należą do grup 13-15 układu okresowego. W przeciwieństwie do metali nie mają połysku, ale mają matowy kolor. W porównaniu z metalami przejściowymi metale poprzejściowe są bardziej miękkie i mają więcej niska temperatura topienie i wrzenie, wyższa elektroujemność. Ich elektrony walencyjne, z którymi przyłączają inne pierwiastki, znajdują się tylko na zewnętrznej powłoce elektronowej. Elementy z grupy metali poprzejściowych mają ich znacznie więcej wysoka temperatura temperaturze wrzenia niż metaloidy.
Teraz utrwal swoją wiedzę, oglądając film o układzie okresowym i nie tylko.
Świetnie, pierwszy krok na drodze do wiedzy został zrobiony. Teraz jesteś mniej więcej zorientowany w układzie okresowym i będzie to dla ciebie bardzo przydatne, ponieważ Układ Okresowy Mendelejewa jest podstawą, na której stoi ta niesamowita nauka.