Boja osmija. Jedan od najskupljih metala na svijetu je osmij i njegova cijena po gramu
Redni element s atomskim brojem 76 in kemijski sustav DI. Mendeljejevljevo ime je osmij. U čvrstom obliku, metal ima sjajnu srebrno-bijelu boju s plavkastim nijansama. Osmij, koji se smatra teškim metalom, ima gustoću 22,6 g/cm3. No, istovremeno je krhak i od njega se može napraviti puder. U tom je stanju metal otkrio engleski kemičar S. Tennant. Prijelazni metal, dio platinske skupine. U malom stanju podložan je oksidaciji pri sobna temperatura.
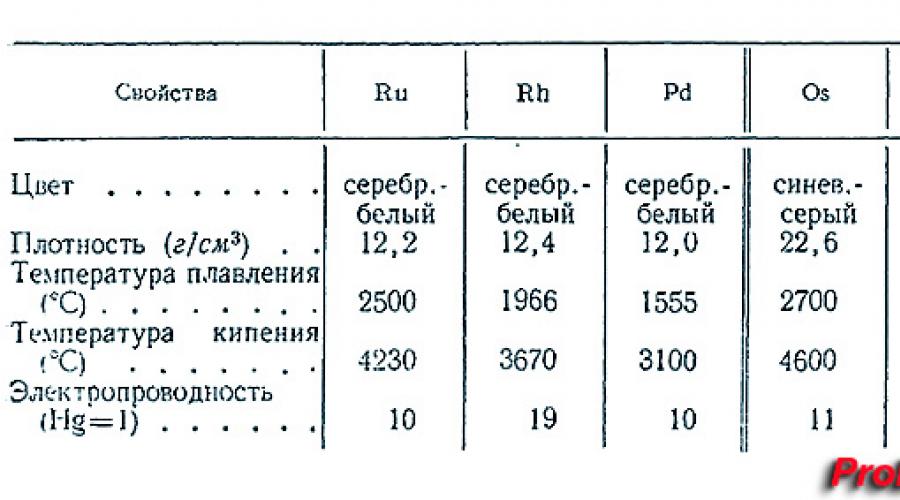
Svojstva osmija
Plemeniti metal je najgušći (22,61 g/cm3) i vatrostalan. Fizička svojstva osmija su sljedeća:
1. Topi se na temperaturi od 3047 °C, vrije na 5025 °C, ne može se prerađivati mehanički, ne može se otopiti u kiselini i aqua regia.
2. Neugodnog je mirisa koji podsjeća na mješavinu češnjaka i izbjeljivača, koji se dodaje da leguri platine daje tvrdoću i elastičnost.
3. Atomska masa osmij je 190,23 g/mol.
4. Izotop 187 rezultat je raspada izotopa renija. Zbog svoje kemijske inertnosti, legura osmija se koristi u agresivnim kiselim sredinama.
5. Metal se lako drobi, u obliku praha ljubičasta sporo se otapa u kiselinama, reagira na spojeve kao što su sumpor, selen, telur i fosfor.
6. U mrvičastom stanju reagira sa živom stvarajući osmijev amalgam.
7. U interakciji s drugim tvarima, emitira loš miris.
8. Izvana, kristali izgledaju lijepo. Kada je izložen visokim temperaturama, topi se, stvarajući tvrde i lomljive kristale. Boja metala je sivo-plava sa srebrnastim odsjajem.
Njegova vanjska svojstva mogli bi cijeniti i draguljari, no zbog svoje toksičnosti i kemijske interakcije s drugim elementima ne koristi se za izradu nakita.
Zemljina kora se sastoji od 0,5% ovog metala, uglavnom u središtu zemlje – jezgri. Komad metala, poput jajeta, težak je jedan kilogram. Ako se prah iz ove tvari ulije u posudu od 0,5 litara, njegova težina će biti 16 kg.
Kemijska svojstva plemeniti metal sljedeće:
- u čvrstom stanju oksidira na temperaturama iznad 400 C, u prahu reagira već na sobnoj temperaturi (OsO4);
- kada se zagrijava, komunicira sa sumporom, klorom, fluorom, sumporom i drugim kemijskim elementima;
- u kipućem klorovodična kiselina e se ne otapa, već se u fino usitnjenom obliku spaja s molekulama dušične kiseline i oksidira: Os + 8HNO3 = OsO4 + 4H2O + 8NO2;
- crni osmijev dioksid OsO2 oslobađa se tijekom dehidracije u atmosferi dušika;
- Hidroksil osmij (IV)Os(OH)4 (OsO2 2H2O) dobiva se redukcijom soli metala(VI).
U prirodi postoji šest izotopa, jedan od 186 izotopa se raspada u spojeve alfa skupine. Osmij postoji najduže - 194 s poluvijekom od dvije godine. Osmij se malo razlikuje od svojih kolega metala platinske skupine (rutenij, paladij, osmij, iridij, platina), ali je superiorniji od drugih metala zbog svoje gustoće i sposobnosti vrenja na vrlo visokim temperaturama.
U prirodi se nalazi u prirodnom obliku kao čvrsta otopina s iridijem (minerali nevyanskite i sysertskite).
Primjena
Dodavanje osmija u razne legurečini ih stabilnijim, izdržljivijim, ne podliježu mehanizaciji i koroziji.
- Elektrokemijska industrija: koristi se u spojevima volframa, nikla i kobalta. Svi proizvodi su otporni na habanje.
- Uvođenje metala platinske skupine u metalne proizvode povećava njihovu čvrstoću. Za izradu oštrih oštrica, medicinskih i tehničkih proizvoda potrebno je vrlo malo tvari.
- Nalivpera s vrhom dugo se ne troše.
- U kardiologiji: metal je našao svoju namjenu u implantatima (pacemakers) i u zamjeni plućnih zalistaka.
- U kombinaciji s volframom koristi se za proizvodnju žarne niti za električne svjetiljke.
- Ne posjeduje magnetsku privlačnost, zbog čega je svoju primjenu našao u izradi dijelova satova.
- Katalizatori napravljeni od njega koriste se u proizvodnji lijekovi, sintetizirati amonijak. Viši oksid ovog metala koristi se u proizvodnji umjetnih lijekova iu laboratoriju - njime se boje tkiva pod mikroskopom.
- Tvrdi metal se koristi u proizvodnji nosača i osi za visoko precizne mjerne instrumente. Zbog svoje tvrdoće, metal se koristi u izradi instrumenata.
- Osmij 187 i drugi izotopi koriste se u teškoj industriji: raketna tehnika, avioni, vojne opreme. Zahvaljujući otpornosti na habanje, pomaže u podnošenju ekstremnih uvjeta.
Povijest otkrića
Osmij je plemeniti metal. Ali to je u suprotnosti s njegovim statusom: u prijevodu s grčkog, "osme" znači miris, to jest, kemijski aktivan. A plemenitost podrazumijeva inertnost ove tvari.
Osmij je otkriven 1803. Engleski kemičar S. Tennant u suradnji s Williamom H. Wollastonom eksperimentirao je s otapanjem osmija u carskoj vodici, ali od toga nije bilo ništa. Slične testove proveli su francuski kemičari Collet-Descoti, Antoine de Fourcroix i Vauquelin. U ovom elementu otkrili su netopljivi talog rude platine. Kemijski element dobio je ime pten, prema grčkoj riječi koja znači letjeti. Ovim pokusom dokazali su prisutnost dva kemijske tvari- osmij i iridij.
Gdje ga ima u prirodi i kako se dobiva?
U prirodi plemeniti metal ne postoji u grumenima. Vadi se iz sljedećih stijena: sysertskite, nevyanskite, osmiirid i sarsite. Ulazi u sastav ruda bakra, molibdena i nikla. Prema nekim podacima sadrži spojeve arsena i sumpora.
Udio materije na planeti je 0,000005% ukupne mase svih stijene. U prirodi se osmij spaja s iridijumom, postotak koji se kreće od 10 do 50. Rezerve ovog metala postoje u Africi, Tasmaniji, Australiji, Sjedinjenim Državama, Kanadi, Kolumbiji i Rusiji. Najbogatija zemlja po sadržaju osmija je Južnoafrička Republika (ležište kompleksa Bushveld). Plemeniti metal nalazimo u legurama samorodne platine, ali češće u legurama osmija i iridija.
Mrvljivo stanje je najprihvatljiviji oblik postojanja. U ovom obliku bolje ulazi u kemijske reakcije i prolazi toplinska obrada. Metal platinske skupine može se dobiti na sljedeće načine:
- korištenje elektronskog snopa;
- lučno grijanje;
- korištenje zonskog taljenja bez lončića.
Dobiveni kristali posljednji put vrlo skupo. Netko je uspio uzgojiti kristale iz praha, ali metoda je teška i dugotrajna.
Cijena
Metal je u prirodi prilično rijedak, a vađenje osmija je skup projekt, pa to određuje njegovu cijenu na tržištu. U 60-70-im godinama 20. stoljeća plemeniti metal bio je nekoliko puta skuplji od zlata. Prodavali su ga jeftino, ali su ga cijenili visoko; zbog toga su ponude na tržištu bile nevjerojatne: gram metala procijenjen je na 10 tisuća, a na 200 tisuća dolara. Zlato nije jednako vrijedno kao njegov pandan iz platinske skupine.
Zašto je osmij opasan?
Kemijski spoj osmij oštećuje ljudske organe. Udisanje para je kobno. Kad su životinje bile pijane, primijećena je anemija i poremećaj plućne funkcije.
Znate li da je tetraosmijev oksid OsO4 prilično agresivan spoj, a ako se otruje, na koži se pojavljuju zeleni ili crni mjehurići. Čovjeku nije lako, jer će liječenje trajati dugo.
Oni koji rade u opasnim industrijama trebaju biti oprezni. U tu svrhu poduzeća izdaju zaštitna odijela i respiratore.
Osmij je kemijski element s atomskim brojem 76. U periodnom sustavu kemijskih elemenata D. I. Mendeljejeva označen je simbolom Os (lat. Osmium). U standardnim uvjetima to je srebrnasto-plavkasti krti prijelazni metal. Spada u skupinu platinskih metala. Ima visoku gustoću, usporedivu u ovom parametru samo s iridijem (gustoće Os i Ir su gotovo jednake, uzimajući u obzir izračunatu pogrešku).
Priča
Osmij je 1804. godine otkrio engleski kemičar Smithson Tennant u talogu koji je ostao nakon otapanja platine u carskoj vodici. Slična istraživanja proveli su francuski kemičari Collet-Descoti, Antoine Francois de Fourcroix i Vauquelin, koji su također došli do zaključka da netopljivi ostatak rude platine sadrži nepoznati element. Hipotetski element dobio je ime pten (krilati), no Tennantovi pokusi su pokazali da se radi o mješavini dva elementa - iridija i osmija.
Ime je dobio po starogrčkom. ὀσμή (miris), baziran na hlapljivom oksidu OsO 4 oštrog mirisa (podsjeća na ozon).
Priznanica
Osmij se izdvaja iz obogaćenih sirovina platinskih metala kalciniranjem ovog koncentrata na zraku na temperaturama od 800-900 °C. U tom slučaju kvantitativno se sublimiraju pare vrlo hlapljivog osmij tetroksida OsO 4, koje zatim apsorbira otopina NaOH.
Isparavanjem otopine izdvaja se sol - natrijev perosmat, koji se zatim reducira vodikom na 120 °C do osmija:
Na2 + 3H2 = 2NaOH + Os + 4H2O.
U ovom slučaju, osmij se dobiva u obliku spužve.
Svojstva
Fizički
Osmij je sivo-plavkast, tvrd ali krt metal vrlo velike specifične težine koji zadržava svoj sjaj čak i pri visokim temperaturama. Zbog svoje tvrdoće, krhkosti, niski pritisak pare (najniži od svih metala platine), kao i vrlo visoko talište, metalni osmij je teško strojno obraditi. Osmij se smatra najgušćim od svih kemijskih elemenata, malo premašujući iridij u ovom parametru. Najpouzdanije gustoće za ove metale mogu se izračunati iz parametara njihovih kristalnih rešetki: 22,562 ± 0,009 g/cm³ za iridij i 22,587 ± 0,009 g/cm³ za osmij. Kada se uspoređuju različiti izotopi ovih metala, 192 Os je najgušći. Izvanredno visoka gustoća osmij se objašnjava kontrakcijom lantanida.
Kemijski
Kada se zagrijava, osmijev prah reagira s kisikom, halogenima, parama sumpora, selenom, telurijem, fosforom, dušičnom i sumpornom kiselinom. Kompaktni osmij ne reagira ni s kiselinama ni s lužinama, već s rastaljenim alkalijama stvara osmate topive u vodi. Sporo reagira s dušičnom kiselinom i aqua regia, reagira s rastaljenim alkalijama u prisutnosti oksidirajućih sredstava (kalijev nitrat ili klorat), te s rastaljenim natrijevim peroksidom. U spojevima pokazuje oksidacijska stanja od -2 do +8, od kojih su najčešća +2, +3, +4 i +8.
Osmij je jedan od rijetkih metala koji tvore polinuklearne (ili klaster) spojeve. Polinuklearni osmij karbonil Os 3 (CO) 12 koristi se za modeliranje i istraživanje kemijske reakcije ugljikovodici na metalnim centrima. Karbonilne skupine u Os 3 (CO) 12 mogu se zamijeniti drugim ligandima, uključujući one koji sadrže jezgre klastera drugih prijelaznih metala.
Nisu zlato ili platina najskuplji metali iz tablice D.I. Mendeljejeva, već metal osmij. Ovo je rijedak i skup metal srebrno-bijele boje sa sivom nijansom plave boje. Kemičari smatraju da je ovaj metal plemenit, pripada skupini platine.
Sastoji se od nekoliko izotopa. Vrlo ih je teško odvojiti, što se odražava na cijenu. Najpopularniji izotop je osmij-187.
Pretpostavlja se da pri 0,5% mase Zemljina kora sastoji se od osmija, a nalazi se u jezgri. Omjer veličine i težine je iznenađujući. Kilogram spoja po veličini je usporediv s prosječnom veličinom kokošje jaje. Posuda od 0,5 litara napunjena prahom osmija teška je više od 15 kg. Ali želja za lijevanjem bučica od tako zgodnog materijala u smislu omjera veličine i težine odmah nestaje ne samo zbog cijene pudera, za neke to nije problem, već i zbog njegove izuzetne rijetkosti i nedostupnosti.
Ingote nećete moći pronaći u šumama, planinama ili akumulacijama. Do sada nije pronađen niti jedan grumen. Eksploatiše se na rudnim nalazištima u sastavu s rudama iridija, platine, platine-paladija, rude bakra i nikla. Ali sadržaj osmija u njemu je 0,001%. A ima ga i u meteoritima. Istina, izotopi se odvajaju od njih nakon više od 9 mjeseci. Stoga se za industrijsku proizvodnju osmija koriste sekundarne sirovine koje nisu puno jeftinije.
Ukupna proizvodnja najtežeg metala godišnje u cijelom svijetu iznosi nekoliko desetaka kilograma. Ali ekstrakcija platine, gdje je osmij prisutan i istovremeno se ekstrahira, raste. Cifre su već 200 kg godišnje. Dakle, zadatak se ne nameće toliko tražiti osmij, već pronaći više jeftin način odvajajući ga od njegovih “susjeda”.
Rudarsko-metalurški kombinat Norilsk postigao je određeni uspjeh u ovom zadatku. Dobili smo čisti metal iz ruda bakra i nikla. Njegova količina na planetu je 0,000005% ukupne mase stijena. Ali u Rusiji postoji. I u Kazahstanu. A glavne rezerve nalaze se u Tasmaniji, Americi i Australiji. Najveći su koncentrirani u Južnoj Africi. Ona diktira cijene.
Povijest otkrića i prirodna svojstva
Godine 1803.-1804. u Engleskoj, tijekom pokusa na platini s aqua regia (mješavina dušične kiseline i klorovodične kiseline), u nastalom nepoznatom talogu, nakon otapanja platine, pojavio se oštar, loš miris, podsjeća na klor. Zahvaljujući tom mirisu, novootkriveni metal je dobio ime. Istina, na grčki. S grčkog "osmij" se prevodi kao "miris".

Formalno, to je zato što je uključen u skupinu platine. Ovdje prestaje prava plemenitost. Svojstva ovog metala, kako kemijska tako i fizikalna, još nisu u potpunosti proučena. fizičke karakteristike više-manje razjašnjeno prije nekoliko godina.
Osmij
| Kemijska svojstva | Fizička svojstva |
|---|---|
| Netopljiv u alkalijama i kiselinama | Izvana, kristali su tvrdi i krhki, imaju prekrasan srebrnasti sjaj s nijansama od sive do plave. Ingoti – tamno plava, puder je ljubičast. I sve to s nevjerojatnim srebrnim sjajem. |
| Ne reagira na paklenu mješavinu dušične i klorovodične kiseline - jedini metal na planetu. | Temperatura legura je takva da ih je poželjno taliti na površini Sunca. |
| Inertan. Moguće je koristiti osmijeve legure i premaze u agresivnim sredinama. | Najveća toksičnost ne dopušta korištenje takve ljepote za izradu nakita. |
| Izuzetno otrovan, čak iu malim dozama. Posebno hlapljivi osmijev oksid koji se oslobađa iz platine. | Izuzetno krhko. Strojna obrada izvan kontrole. |
| Vri na temperaturi od 5500°C, ali nije točno određena - nema proračuna za provjeru | Infuzibilnost. Omekšava tek na temperaturama iznad 3000 stupnjeva C. |
| Nema magnetna svojstva. | |
| Nevjerojatna tvrdoća. Legura s dodatkom osmija postaje otpornija na habanje, izdržljiva, s povećanom otpornošću na koroziju i mehanička naprezanja. | |
| Najveća gustoća je 22,61 g/cm3. |
Cijena
Visoki trošak je zbog ograničene količine. Budući da ga u prirodi nema, a proizvodnja je skupa, tržište reagira u skladu s tim. Ako ga usporedimo sa zlatom, to će biti tisuće tona zlata naspram nekoliko desetaka kilograma proizvodnje. Otuda i cijena - počinje od 15 tisuća i doseže 200 tisuća dolara po gramu. Na svjetskom tržištu zlato je 7,5 puta jeftinije.
Takve brojke ukazuju na nepopularnost materijala za široku upotrebu. Čvrstoća igra glavnu ulogu u upotrebi ovog teškog metala u legurama. Proizvodi postaju nevjerojatno otporni na habanje zbog dodavanja vrlo malih dijelova metala u sastav.
Primjena
Široko industrijska proizvodnja Osmij se rijetko koristi zbog svoje visoke cijene. Ali tamo gdje učinak može premašiti materijalne troškove, on se, naravno, koristi. Sirovina je najčešće u obliku praha. Sam metal je krhak i lako se mrvi. Nabavka praha nije teška.
Više slučajeva upotrebe:

Nisu svi spojevi osmija prikladni za upotrebu. Ali znanstvenici rade na tome.
Opasnost i sigurnost
Poput drugih teških metala, osmija nema najviše blagotvoran utjecaj na živim organizmima, ne zaobilazeći ljudske. Svaki spoj s osmijem je štetan unutarnji organi, uzrokovati gubitak vida. Trovanje parama elementa također može dovesti do smrti. Pri promatranju životinja uočen je nagli razvoj anemije, a pluća su prestala funkcionirati. Vjeruje se da je ovo edem koji se brzo razvija.
Što je osmijev tetroksid OsO4? I to je sama tvar po kojoj element nosi svoje ime. Izuzetno agresivan. Njegov miris se ne može zanemariti. Nema strašnijeg i odvratnijeg mirisa u prirodi. Kod trovanja je zahvaćena i koža. Dermis postaje zelen, postaje crn, a može čak i odumrijeti. Mogu se pojaviti mjehurići i čirevi. Za sve treba jako puno vremena da zacijeli.
Opasnost od trovanja prvenstveno pogađa radnike proizvodni prostori pri najmanjoj koncentraciji para u zraku. Nijedan prihvatljivim standardima Znanstvenici više ne mucaju. Stoga je predviđeno posebna odjeća, respiratori – uobičajena pojava u proizvodnji koristeći osmijev oksid. Sve je zapečaćeno, spremnici su zapečaćeni i uskladišteni po već provjerenim pravilima.
Ako vam iz nekog nezamislivog razloga spoj osmija dospije u oči, potrebno ih je dugo ispirati, oko 20 minuta. Čist tekuća voda. I odmah posjetite liječnika. Prilikom ulaska u tijelo kroz Zračni putovi Pare osmija neutraliziraju se natrijevim bikarbonatom. Dostupan je u pakiranju aerosola. Puno mlijeka unutra. I isperite želudac.
Nedvojbene prednosti najtežeg metala
Prema engleskim znanstvenicima, ovaj teški metal blokira razvoj stanica raka. Metode liječenja raka pomoću osmija, iako vrlo sporo, već se razvijaju.
U medicini, u stimulaciji srca, koristi se u implantatima za čiju su izradu potrebni plemeniti metali kako bi se spriječio razvoj alergija. Sastav implantata koji zamjenjuje srčane elemente uključuje 10% osmija i 90% platine. Naravno, takvi uređaji imaju odgovarajuću cijenu. Isti se omjer koristi za izradu plućnih zalistaka.

Primjena osmijevih spojeva za medicinske potrebe primjetna je u izradi posebno izdržljivih, dugotrajnih instrumenata, kao što su skalpeli i sve vrste metalokeramičkih sjekutića. I za to vam treba vrlo malo sirovina, ali učinak je nevjerojatan.
Mikroskopski dodaci osmija u čelik za rezanje omogućuju izradu iznimno oštrih oštrica.
Proizvodi čija uporaba uključuje uporabu teški metal, pokazuju se nenadmašnim u otpornosti na habanje.
Komercijalni interes
Razna nevjerojatna svojstva metalnog osmija izazivaju nesumnjivo zanimanje i istinsko iznenađenje. Ali ta ista svojstva izravno ubijaju komercijalni interes. I, unatoč svemu, cijena na tržištu ne pada.
Bučice i utezi kojima bodybuilderi pumpaju mišiće izrađeni su od čelika. Projektili napravljeni od olova - ili još bolje - izgubili bi značajan volumen. Ali još je bolje koristiti osmij za proizvodnju utega: Kilogram osmija mala je kuglica koja bez problema stane u stisnutu šaku. Boca od pola litre osmija u prahu (ovo je oblik u kojem plemeniti metal napušta zidove postrojenja za obogaćivanje) teži znatno više od kante vode.
Ali ne možete pronaći nikoga dovoljno hrabrog da lije utege od osmija: previše je vatrostalan. A cijena metala je takva da bi atletski klub morao raditi tri stotine godina da kupi jednu osmijsku bučicu...
Nema dovoljno osmija!
I to je razumljivo. Kako bi se dobilo teški elementi priroda mora "stvoriti" posebni uvjeti, što se ne događa prečesto. Međutim, pola posto mase zemljine kore čini osmij. Postoje svi razlozi za vjerovanje da je većina plemenitih metala prikupljenih u tijelu našeg planeta koncentrirana u jezgri.U prirodi se osmij javlja uglavnom u obliku spoja s iridijem, koji je dio ili izvorne platine ili platinsko-paladijeve rude. Minerali koji se smatraju sirovinama za rudarenje osmija sadrže u prosjeku jednu tisućinku postotka teške "relativne" platine. Tijekom cijelog razdoblja istraživanja nije izvađen niti jedan grumen osmija, čak ni najmanje veličine.
Mala količina i teškoća dobivanja osmija određuju visinu njegove cijene. Prije pola stoljeća osmij je procijenjen na sedam do osam puta skuplji od zlata. Nagađanje zadnjih godina dovela je do pojave potpuno suludih ponuda: gram osmija prodavao se i za 10 tisuća i za 200 tisuća dolara. Prodano je, ali nije prodano: osmij se aktivno ne koristi, iako se ponegdje koristi.
Otkriće osmija
Osmij je dio platinske skupine i formalno se smatra plemenitim metalom. Ime kemijski element, međutim, proturječi statusu: “osme” na grčkom znači “miris”; prisutnost mirisa ukazuje na značajnu kemijsku aktivnost - dok "plemenitost" tvari podrazumijeva inertnost.Wollaston, koji je eksperimentirao s rudama platine, bio je blizu otkrića osmija. Potaknuti njegovim uspjesima, Francuzi Antoine de Fourcroy i Louis-Nicolas Vauquelin započeli su vlastita istraživanja i ispravno pretpostavili postojanje novog elementa koji je tijekom pokusa ispario u obliku crnog dima.
Fourcroix i Vauquelin su supstanci dali ime "ptene" - što znači "hlapljiv", i smirili su se, čekajući priznanje. Međutim, engleski kemičar Smithson Tennant podijelio je "pten" u dva srodna metala, od kojih je jedan nazvan iridij zbog raznolikosti boja njegovih spojeva, a drugi je, zbog iritantnog smrada, nazvan osmij.
Takve se stvari događaju važni događaji godine 1803., velikodušan otkrićima.
Svojstva osmija
Istraživanje fizikalno-kemijske karakteristike osmija u cijelosti još nije dobivena. Znanstvenici su se dugo raspravljali o tome koji je metal gušći - iridij ili osmij. Precizna mjerenja laboratorijskih uzoraka u u ovom slučaju dati samo približne rezultate – zbog velika količina izotopa različite gustoće.Sve do nedavno smatralo se da su točke taljenja i vrelišta uvjetno jednake 3000° i 5000°C: nije bilo sredstava za potpunu provjeru izračuna. Tek prije nekoliko godina bilo je moguće razjasniti fizički parametri metal Navodno se pokazalo da je legure osmija bolje kuhati na površini Sunca...
Zanimljiv izgled Osmija. Stvrdnjavajući se iz taline, osmij stvara tvrde i lomljive kristale, čiji je srebrnasti sjaj zasjenjen sivkasto-plavom (pa čak i plavom) nijansom. Vanjske prednosti osmija mogle bi privući draguljare, ali visoka kemijska aktivnost metala i toksičnost njegovih spojeva isključuju mogućnost korištenja ove platine u nakitu.
Primjena osmija
Osmij ima vrlo ograničenu primjenu u različitim područjima ljudska aktivnost. Legiranje legura jedan je od glavnih zadataka, čije se rješenje ponekad dodjeljuje osmiju. U kombinaciji s volframom, niklom i kobaltom, osmij postaje “radnik” elektrokemijske industrije. Kontakti, vrhovi i jezgre izrađeni od legura osmija poznati su po minimalnom habanju. Žarulje sa žarnom niti volfram-osmij traju dulje i učinkovitije su.Uvođenje tvrde i teške platine u materijal dramatično povećava otpornost na habanje trljajućih parova. Dovoljno je malo osmija da metalokeramičkom rezaču daju posebnu snagu. Mikroskopski dodaci osmija vrstama rezanja čelika omogućuju vam stvaranje najoštrijih oštrica tehničkih, medicinskih i industrijskih noževa.
Osmijevi katalizatori koriste se u hidrogenaciji organskih spojeva, u proizvodnji lijekova i u sintezi amonijaka. Istina, visoka cijena metala prisiljava industrijalce da traže pristupačne zamjene, a danas je osmij sve rjeđi u kemijskoj industriji.
Osovine, nosači i utičnice potpora izrađeni su od čvrstog i nemagnetskog osmija. mjerni instrumenti visoka preciznost. I iako su rubinski nosači tvrđi i jeftiniji od osmijskih, izdržljivost metala ponekad je poželjnija za izradu instrumenata.
Osmij je opasan i zahtijeva oprez
Sam osmij nije ništa opasniji od bilo kojeg drugog teškog metala. Međutim, osmijev tetroksid OsO4 - sama tvar zbog koje je element dobio svoje ne baš zavidno ime - izuzetno je agresivan. Nadražuje dišne puteve i sluznice ljudi, percipira se kao isparavanje iz trulih rotkvica pomiješano sa zgnječenim češnjakom i prekriveno izbjeljivačem.Gotovo je nemoguće izbjeći oksidaciju osmija, ako metal dođe u dodir s atmosferskim kisikom. Stoga se osmij ne koristi u