Mn u periodnom sustavu. Periodični sustav kemijskih elemenata
Devetnaesto stoljeće u povijesti čovječanstva stoljeće je u kojem su reformirane mnoge znanosti, uključujući i kemiju. U to vrijeme pojavio se Mendeljejevljev periodični sustav, a s njim i periodični zakon. On je bio taj koji je postao osnova moderna kemija. Periodični sustav D. I. Mendelejeva je sistematizacija elemenata, koja utvrđuje ovisnost kemijskih i fizikalnih svojstava o strukturi i naboju atoma tvari.
Priča
Početak časopisa postavila je knjiga "Korelacija svojstava s atomskom težinom elemenata", napisana u trećoj četvrtini 17. stoljeća. Prikazao je osnovne koncepte relativno dobro poznatih kemijski elementi(tada ih je bilo samo 63). Štoviše, mnogi od njih atomske mase bili pogrešno definirani. To je uvelike ometalo otkriće D. I. Mendeljejeva.
Dmitrij Ivanovič je započeo svoj rad usporedbom svojstava elemenata. Prije svega, preuzeo je klor i kalij, a tek onda prešao na rad s alkalnim metalima. Naoružan posebnim karticama s prikazom kemijskih elemenata, više puta je pokušavao sastaviti ovaj "mozaik": položio ga je na svoj stol u potrazi za potrebnim kombinacijama i šibicama.
Nakon mnogo truda, Dmitrij Ivanovič je ipak pronašao obrazac koji je tražio i ugradio elemente u periodične serije. Dobivši prazne stanice između elemenata kao rezultat, znanstvenik je shvatio da ruskim istraživačima nisu poznati svi kemijski elementi i da je on taj koji bi ovom svijetu trebao dati znanje iz područja kemije koje mu još nije dao prethodnici.

Svi znaju mit da se periodni sustav pojavio Mendeljejevu u snu, a on je prikupio elemente iz sjećanja u jedinstveni sustav. Ovo je, grubo rečeno, laž. Činjenica je da je Dmitrij Ivanovič dosta dugo i koncentrirano radio na svom poslu i to ga je jako iscrpilo. Dok je radio na sustavu elemenata, Mendeljejev je jednom zaspao. Kad se probudio, shvatio je da nije završio stol, već je nastavio popunjavati prazne ćelije. Njegov poznanik, izvjesni Inostrantsev, sveučilišni učitelj, odlučio je da je Mendeljejevljev stol bio san i proširio ovu glasinu među svojim studentima. Tako je nastala ova hipoteza.
Slava
Kemijski elementi Mendeljejeva odraz su periodičnog zakona koji je stvorio Dmitrij Ivanovič još u trećoj četvrtini 19. stoljeća (1869.). Bilo je to 1869. na sastanku ruske kemijske zajednice pročitana je obavijest Mendeljejeva o stvaranju određene strukture. A iste godine objavljena je knjiga "Osnove kemije" u kojoj je prvi put objavljen Mendeljejevljev periodični sustav kemijskih elemenata. I u knjizi prirodni sustav elementi i njihova upotreba za označavanje kvaliteta neotkrivenih elemenata "D. I. Mendeljejev prvi je spomenuo koncept" periodičnog zakona ".

Struktura i pravila postavljanja
Prve korake u stvaranju periodičnog zakona napravio je Dmitrij Ivanovič još 1869.-1871., u to je vrijeme naporno radio na utvrđivanju ovisnosti svojstava ovih elemenata o masi njihovog atoma. Moderna verzija predstavlja elemente sažete u dvodimenzionalnu tablicu.
Položaj elementa u tablici ima određeno kemijsko i fizikalno značenje. Po položaju elementa u tablici možete saznati koja je njegova valencija, odrediti drugo kemijske značajke. Dmitrij Ivanovič je pokušao uspostaviti vezu između elemenata, sličnih po svojstvima i različitih.

Valenciju i atomsku masu stavio je kao osnovu za klasifikaciju tada poznatih kemijskih elemenata. Uspoređujući relativna svojstva elemenata, Mendeljejev je pokušao pronaći obrazac koji bi ujedinio sve poznate kemijske elemente u jedan sustav. Nakon što ih je rasporedio, na temelju povećanja atomskih masa, on je ipak postigao periodičnost u svakom od redova.
Daljnji razvoj sustava
Periodični sustav, koji se pojavio 1969. godine, dorađen je više puta. S pojavom plemenitih plinova 1930-ih, bilo je moguće otkriti najnoviju ovisnost elemenata - ne o masi, već o serijskom broju. Kasnije je bilo moguće utvrditi broj protona u atomskim jezgrama, a pokazalo se da se poklapa s serijskim brojem elementa. Znanstvenici 20. stoljeća proučavali su elektron, a pokazalo se da i on utječe na periodičnost. To je uvelike promijenilo ideju o svojstvima elemenata. Ova se točka odrazila u kasnijim izdanjima Mendeljejevljevog periodnog sustava. Svako novo otkriće svojstava i značajki elemenata organski se uklapa u tablicu.
Karakteristike periodnog sustava Mendeljejeva
Periodni sustav podijeljen je na razdoblja (7 redaka raspoređenih vodoravno), koja su, pak, podijeljena na velike i male. Razdoblje počinje s alkalnim metalom, a završava s elementom s nemetalnim svojstvima.
Okomito, tablica Dmitrija Ivanoviča podijeljena je u grupe (8 stupaca). Svaki od njih u periodnom sustavu sastoji se od dvije podskupine, glavne i sekundarne. Nakon dugih sporova, na prijedlog D. I. Mendeleeva i njegovog kolege W. Ramsaya, odlučeno je uvesti tzv. nultu grupu. Uključuje inertne plinove (neon, helij, argon, radon, ksenon, kripton). Godine 1911. znanstvenici F. Soddy predložili su da se u periodični sustav smjeste nerazlučivi elementi, takozvani izotopi - za njih su dodijeljene zasebne stanice.

Unatoč vjernosti i točnosti periodnog sustava, znanstvena zajednica dugo nije željela priznati ovo otkriće. Mnogi veliki znanstvenici ismijavali su aktivnosti D. I. Mendelejeva i vjerovali da je nemoguće predvidjeti svojstva elementa koji još nije bio otkriven. No nakon što su otkriveni navodni kemijski elementi (a to su bili, na primjer, skandij, galij i germanij), Mendeljejevljev sustav i njegov periodični zakon postali su kemijska znanost.
Stol u moderno doba
Mendeljejevljev periodični sustav elemenata temelj je većine kemijskih i fizikalnih otkrića vezanih uz atomsku i molekularnu znanost. Moderan koncept element je nastao upravo zahvaljujući velikom znanstveniku. Pojava periodičnog sustava Mendeljejeva donijela je temeljne promjene u idejama o raznih spojeva i jednostavne tvari Oh. Stvaranje periodičnog sustava od strane znanstvenika imalo je ogroman utjecaj na razvoj kemije i svih znanosti povezanih s njom.
Vjerojatno ste svi vidjeli periodni sustav elemenata. Moguće je da vas ona i danas proganja u snovima, ili vam je samo vizualna pozadina koja ukrašava zid. razred. Međutim, u ovoj naizgled slučajnoj zbirci stanica postoji mnogo više nego što se na prvi pogled čini.
Periodni sustav (ili PT, kako ćemo ga s vremena na vrijeme pozivati u ovom članku), kao i elementi koji ga čine, imaju osobine koje možda nikada niste pogodili. Evo deset činjenica, od stvaranja tablice do dodavanja posljednjih elemenata u nju, koje većina ljudi ne zna.
10. Mendeljejevu je pomoglo
Periodični sustav počeo se koristiti od 1869. godine, kada ga je sastavio Dimitri Mendeljejev, koji je bio obrastao gustom bradom. Većina ljudi misli da je Mendeljejev bio jedini koji je radio na ovom stolu, te je zbog toga postao najsjajniji kemičar stoljeća. Međutim, njegove napore pomoglo je nekoliko europskih znanstvenika koji su dali važan doprinos dovršenju ovog kolosalnog skupa elemenata.
Mendeljejev je nadaleko poznat kao otac periodni sustav elemenata, ali kada ju je sastavio, nisu svi elementi tablice već bili otvoreni. Kako je to postalo moguće? Znanstvenici su poznati po svom ludilu...
9. Nedavno dodane stavke

Vjerovali ili ne, periodni sustav se nije puno promijenio od 1950-ih. No, 2. prosinca 2016. dodana su četiri nova elementa odjednom: nihonium (element br. 113), moscovium (element br. 115), tennessine (element br. 117) i oganesson (element br. 118). Ovi novi elementi dobili su imena tek u lipnju 2016., jer je trebalo pet mjeseci ekspertize prije nego što su službeno dodani PT-u.
Tri elementa su nazvana prema gradovima ili državama u kojima su dobiveni, a oganesson je dobio ime po ruskom nuklearnom fizičaru Yuriju Oganesyanu zbog doprinosa proizvodnji ovog elementa.
8. Kojeg slova nema u tablici?

Latinska abeceda ima 26 slova i svako od njih je važno. Međutim, Mendeljejev je odlučio to ne primijetiti. Pogledaj tablicu i reci mi koje je slovo nesretno? Savjet: tražite redom i savijte prste nakon svakog pronađenog slova. Kao rezultat toga, naći ćete slovo "nedostaje" (ako imate svih deset prstiju na rukama). Pogodio? Ovo je slovo na broju 10, slovo "J".
Kažu da je "jedan" broj usamljenih ljudi. Dakle, možda bismo slovo "J" trebali nazvati slovom usamljenih? Ali evo zabavne činjenice: većina dječaka rođenih u SAD-u 2000. godine dobila je imena koja počinju tim slovom. Stoga ovo pismo nije prošlo nezapaženo.
7. Sintetizirani elementi

Kao što možda već znate, danas postoji 118 elemenata u periodnom sustavu. Možete li pogoditi koliko je od ovih 118 elemenata dobiveno u laboratoriju? Od svega opći popis u prirodni uvjeti može se pronaći samo 90 artikala.
Mislite li da je 28 umjetno stvorenih elemenata puno? Pa, samo mi vjerujte na riječ. Sintetiziraju se od 1937. godine, a znanstvenici to rade i danas. Sve ove elemente možete pronaći u tablici. Pogledajte elemente od 95 do 118, svi ovi elementi su odsutni na našem planetu i sintetizirani su u laboratorijima. Isto vrijedi i za elemente označene brojevima 43, 61, 85 i 87.
6. 137. element

Sredinom 20. stoljeća poznati znanstvenik po imenu Richard Feynman dao je prilično glasnu izjavu koja je gurnula cijeli svijet u čuđenje. znanstveni svijet naš planet. Prema njemu, ako ikada otkrijemo 137. element, tada nećemo moći odrediti broj protona i neutrona u njemu. Broj 1/137 je izvanredan po tome što je vrijednost konstante fine strukture, koja opisuje vjerojatnost da elektron apsorbira ili emitira foton. Teoretski, element #137 trebao bi imati 137 elektrona i 100% vjerojatnosti da će apsorbirati foton. Njegovi će se elektroni rotirati brzinom svjetlosti. Još je nevjerojatnije da se elektroni elementa 139 moraju okretati brže od brzine svjetlosti da bi postojali.
Jeste li već umorni od fizike? Možda će vas zanimati da broj 137 objedinjuje tri važna područja fizike: teoriju brzine svjetlosti, kvantnu mehaniku i elektromagnetizam. Od ranih 1900-ih, fizičari su nagađali da bi broj 137 mogao biti osnova Velikog jedinstvena teorija, koji će uključivati sva tri navedena područja. Doduše, ovo zvuči nevjerojatno kao i legende o NLO-ima i Bermudskom trokutu.
5. Što se može reći o imenima?

Gotovo svi nazivi elemenata imaju neko značenje, iako nije odmah jasno. Nazivi novih elemenata nisu proizvoljni. Element bih nazvao samo prvom riječju koja mi je pala na pamet. Na primjer, "kerflump". Mislim da je dobro.
Tipično, nazivi elemenata spadaju u jednu od pet glavnih kategorija. Prva su imena poznatih znanstvenika, klasična verzija- einsteinium. Osim toga, elementi mogu dobiti svoja imena ovisno o mjestima gdje su prvi put registrirani, na primjer germanij, americij, galij itd. dodatna opcija koriste se nazivi planeta. Element uran je prvi put otkriven ubrzo nakon otkrića planeta Urana. Elementi mogu imati imena povezana s mitologijom, na primjer, postoji titan, nazvan po drevnim grčkim titanima, i torij, nazvan po skandinavskom bogu groma (ili zvijezda "osvetnik", ovisno o tome što više volite).
I na kraju, tu su imena koja opisuju svojstva elemenata. Argon dolazi od grčke riječi "argos", što znači "lijeni" ili "spori". Naziv implicira pretpostavku da ovaj plin nije aktivan. Brom je još jedan element čije ime dolazi od grčke riječi. "Bromos" znači "smrad" i to prilično točno opisuje miris broma.
4. Je li stvaranje tablice bio "uvid"

ako voliš kartaške igre onda je ova činjenica za vas. Mendeljejev je trebao nekako posložiti sve elemente i pronaći sustav za to. Naravno, da bi napravio tablicu po kategorijama, okrenuo se pasijansu (pa, što još?) Mendeljejev je zapisao atomsku težinu svakog elementa na zasebnoj kartici, a zatim nastavio s izlaganjem svog naprednog solitera. Složio je elemente prema njihovim specifičnim svojstvima, a zatim ih rasporedio u svaki stupac prema njihovoj atomskoj težini.
Puno ljudi ne može raditi ni obične pasijanse, pa je ovaj pasijans impresivan. Što će se dalje dogoditi? Možda će netko uz pomoć šaha revolucionirati astrofiziku ili stvoriti raketu sposobnu letjeti do predgrađa galaksije. Čini se da to neće biti neobično s obzirom na to da je Mendeljejev uspio postići tako briljantan rezultat samo s špilom običnih igraćih karata.
3. Nesretni inertni plinovi

Sjećate li se kako smo argon klasificirali kao "najlijeniji" i "najsporiji" element u povijesti našeg svemira? Čini se da je i Mendeljejev imao iste osjećaje. Kada je 1894. prvi put dobiven čisti argon, nije stao ni u jedan od stupaca tablice, pa je umjesto traženja rješenja znanstvenik odlučio jednostavno zanijekati njegovo postojanje.
Što je još upečatljivije, argon nije bio jedini element koji je uopće doživio ovakvu sudbinu. Osim argona, pet drugih elemenata ostalo je neklasificirano. To je utjecalo na radon, neon, kripton, helij i ksenon – a svi su poricali njihovo postojanje jednostavno zato što Mendeljejev nije mogao naći mjesto za njih u tablici. Nakon nekoliko godina preuređivanja i reklasifikacije, ovi elementi (im inertnih plinova) još uvijek imao dovoljno sreće da se pridruži vrijednom klubu koji je prepoznat kao stvarno postojeći.
2. Atomska ljubav

Savjet za sve one koji sebe smatraju romantičnima. Uzmite papirnati primjerak periodnog sustava i iz njega izrežite sve komplicirane i relativno nepotrebne srednje stupce tako da vam ostane 8 stupaca (dobit ćete "kratki" oblik tablice). Presavijte ga u sredinu grupe IV - i saznat ćete koji elementi mogu tvoriti spojeve jedni s drugima.
Elementi koji se "ljube" kada su presavijeni u stanju su formirati stabilne veze. Ovi elementi imaju komplementarne elektronske strukture i oni će se međusobno kombinirati. A ako to nije prava ljubav, kao Romeo i Julija ili Shrek i Fiona, onda ne znam što je ljubav.
1. Pravila ugljika

Carbon pokušava biti u središtu igre. Mislite da znate sve o ugljiku, ali ne znate, on je mnogo važniji nego što mislite. Jeste li znali da je prisutan u više od polovice svih poznatih spojeva? A što je s činjenicom da 20 posto težine svih živih organizama čini ugljik? Ovo je stvarno čudno, ali pripremite se: svaki atom ugljika u vašem tijelu nekoć je bio dio frakcije ugljični dioksid u atmosferi. Ugljik nije samo superelement našeg planeta, on je četvrti najzastupljeniji element u cijelom svemiru.
Ako se periodni sustav usporedi sa strankom, tada je ugljik njegov glavni vođa. A čini se da je on jedini koji zna sve pravilno organizirati. Pa, između ostalog, glavni je element svih dijamanata, pa uza svu svoju nametljivost, i sjaji!
Otkriće Dmitrija Mendeljejeva periodnog sustava kemijskih elemenata u ožujku 1869. bio je pravi proboj u kemiji. Ruski znanstvenik uspio je sistematizirati znanje o kemijskim elementima i predstaviti ih u obliku tablice, koju školarci i sada uče u nastavi kemije. Periodični sustav postao je temelj brzog razvoja ove složene i zanimljive znanosti, a povijest njegovog otkrića obavijena je legendama i mitovima. Za sve one koji vole znanost bit će zanimljivo saznati istinu o tome kako je Mendeljejev otkrio tablicu periodičnih elemenata.
Povijest periodnog sustava: kako je sve počelo
Pokušaji klasificiranja i sistematizacije poznatih kemijskih elemenata učinjeni su mnogo prije Dmitrija Mendeljejeva. Njihove sustave elemenata predložili su poznati znanstvenici kao što su Debereiner, Newlands, Meyer i drugi. Međutim, zbog nedostatka podataka o kemijskim elementima i njihovim ispravnim atomskim masama, predloženi sustavi nisu bili posve pouzdani.
Povijest otkrića periodnog sustava počinje 1869. godine, kada je ruski znanstvenik na sastanku Ruskog kemijskog društva rekao svojim kolegama o svom otkriću. U tablici koju je predložio znanstvenik, kemijski elementi su raspoređeni ovisno o njihovim svojstvima, što ih osigurava vrijednost njihove molekularne težine.
Zanimljiva značajka periodnog sustava bila je i prisutnost praznih stanica, koje su u budućnosti bile ispunjene otkrivenim kemijskim elementima koje je znanstvenik predvidio (germanij, galij, skandij). Nakon otkrića periodnog sustava, u njega su se mnogo puta dopunjavali i mijenjali. Zajedno sa škotskim kemičarem Williamom Ramsayem, Mendelejev je na stol dodao skupinu inertnih plinova (nulta skupina).
U budućnosti je povijest Mendeljejevljevog periodnog sustava bila izravno povezana s otkrićima u drugoj znanosti - fizici. Rad na tablici periodičnih elemenata još uvijek traje, a moderni znanstvenici dodaju nove kemijske elemente kako budu otkriveni. Važnost periodnog sustava Dmitrija Mendeljejeva teško je precijeniti, jer zahvaljujući njemu:
- Sistematizirana su znanja o svojstvima već otkrivenih kemijskih elemenata;
- Postalo je moguće predvidjeti otkriće novih kemijskih elemenata;
- Počele su se razvijati takve grane fizike kao što su fizika atoma i fizika jezgre;
Postoji mnogo opcija za prikazivanje kemijskih elemenata prema periodičnom zakonu, ali najpoznatija i najčešća opcija je periodični sustav poznat svima.
Mitovi i činjenice o stvaranju periodnog sustava
Najčešća zabluda u povijesti otkrića periodnog sustava je da ga je znanstvenik vidio u snu. Zapravo, sam Dmitrij Mendeljejev opovrgao je ovaj mit i izjavio da je o periodičnom zakonu razmišljao mnogo godina. Kako bi sistematizirao kemijske elemente, napisao je svaki od njih na zasebnoj kartici i više puta ih kombinirao jedan s drugim, slažući ih u redove ovisno o njihovim sličnim svojstvima.
Mit o "proročkom" snu znanstvenika može se objasniti činjenicom da je Mendeljejev danima radio na sistematizaciji kemijskih elemenata, prekinut kratkim snom. Međutim, samo naporan rad i prirodni talent znanstvenika dali su dugo očekivani rezultat i osigurali Dmitriju Mendeleevu svjetsku slavu.
Mnogi učenici u školi, a ponekad i na sveučilištu, prisiljeni su pamtiti ili barem približno kretati po periodnom sustavu. Da bi to učinila, osoba ne mora samo imati dobro pamćenje, ali i logično razmišljati, povezujući elemente u zasebne skupine i klase. Proučavanje tablice najlakše je onim ljudima koji svoj mozak neprestano održavaju u dobroj formi pohađajući treninge na BrainApps.
Svatko tko je išao u školu sjeća se da je jedan od obveznih predmeta za studiranje bila kemija. Moglo bi joj se svidjeti, ili joj se ne bi moglo svidjeti - nije važno. I vjerojatno je mnogo znanja u ovoj disciplini već zaboravljeno i ne primjenjuje se u životu. Međutim, svi se vjerojatno sjećaju tablice kemijskih elemenata D. I. Mendelejeva. Za mnoge je to ostala raznobojna tablica, gdje su u svaki kvadrat upisana određena slova koja označavaju nazive kemijskih elemenata. Ali ovdje nećemo govoriti o kemiji kao takvoj, već opisati stotine kemijske reakcije i procesi, ali ćemo govoriti o tome kako se periodni sustav pojavio općenito - ova će priča biti zanimljiva svakoj osobi, a zapravo i svima onima koji su gladni zanimljivih i korisnih informacija.
Malo pozadine
Davne 1668. godine, izvanredni irski kemičar, fizičar i teolog Robert Boyle objavio je knjigu u kojoj su razobličeni mnogi mitovi o alkemiji, te u kojoj govori o potrebi traženja nerazgradivih kemijskih elemenata. Znanstvenik je također dao njihov popis, koji se sastojao od samo 15 elemenata, ali je dopustio ideju da može biti više elemenata. To je postalo polazište ne samo u potrazi za novim elementima, već i u njihovoj sistematizaciji.
Stotinu godina kasnije, francuski kemičar Antoine Lavoisier sastavio je novi popis koji je već uključivao 35 elemenata. Kasnije je utvrđeno da su njih 23 nerazgradiva. No, potragu za novim elementima nastavili su znanstvenici diljem svijeta. I vodeća uloga poznati ruski kemičar Dmitrij Ivanovič Mendeljejev igrao je u tom procesu - on je prvi iznio hipotezu da bi mogla postojati veza između atomske mase elemenata i njihovog položaja u sustavu.
Zahvaljujući mukotrpnom radu i usporedbi kemijskih elemenata, Mendeljejev je uspio otkriti odnos između elemenata u kojem oni mogu biti jedno, a njihova svojstva nisu nešto što se podrazumijeva, već su fenomen koji se periodično ponavlja. Kao rezultat toga, u veljači 1869. Mendeljejev je formulirao prvi periodični zakon, a već u ožujku je svoje izvješće "Odnos svojstava s atomskom težinom elemenata" Ruskom kemijskom društvu podnio povjesničar kemije N. A. Menshutkin. Zatim je iste godine Mendeljejevljeva publikacija objavljena u časopisu Zeitschrift fur Chemie u Njemačkoj, a 1871. nova opsežna publikacija znanstvenika posvećena njegovom otkriću objavljena je u drugom njemačkom časopisu Annalen der Chemie.
Izrada periodnog sustava

Do 1869. Mendeljejev je već formirao glavnu ideju i to u prilično kratkom vremenu, ali ju nije mogao formalizirati u bilo kakav uređeni sustav koji jasno prikazuje što je što, dugo vremena nije mogao. U jednom od razgovora s kolegom A. A. Inostrantsevim čak je rekao da mu se sve već posložilo u glavi, ali nije mogao sve iznijeti na stol. Nakon toga, prema Mendeljejevljevim biografima, započeo je mukotrpan rad na svom stolu, koji je trajao tri dana bez pauze za spavanje. Razvrstani su se razni načini organiziranja elemenata u tablici, a posao je bio kompliciran činjenicom da u to vrijeme znanost još nije znala za sve kemijske elemente. No, unatoč tome, tablica je ipak stvorena, a elementi su sistematizirani.
Legenda o snu Mendeljejeva
Mnogi su čuli priču da je D. I. Mendeljejev sanjao svoj stol. Ovu verziju aktivno je distribuirao već spomenuti kolega Mendeljejeva A. A. Inostrantsev kao smiješna priča kojim je zabavljao svoje učenike. Rekao je da je Dmitrij Ivanovič otišao u krevet i u snu je jasno vidio svoj stol, u kojem su raspoređeni svi kemijski elementi. prava narudžba. Nakon toga su se studenti čak i našalili da je na isti način otkrivena i votka od 40°. Ali još su postojali stvarni preduvjeti za priču o spavanju: kao što je već spomenuto, Mendeljejev je radio na stolu bez sna i odmora, a Inostrantsev ga je jednom zatekao umornog i iscrpljenog. Popodne je Mendeljejev odlučio uzeti pauzu, a nešto kasnije se naglo probudio, odmah uzeo komad papira i na njemu prikazao gotov stol. No, sam je znanstvenik opovrgao cijelu ovu priču snom, rekavši: "Razmišljao sam o tome možda dvadeset godina, a vi mislite: sjedio sam i odjednom je ... spremno." Dakle, legenda o snu može biti vrlo privlačna, ali stvaranje stola bilo je moguće samo teškim radom.

Daljnji rad
U razdoblju od 1869. do 1871. Mendeljejev je razvio ideje periodičnosti, kojima je znanstvena zajednica bila sklona. I jedan od prekretnice ovaj proces postojalo je shvaćanje koje svaki element u sustavu treba imati, na temelju ukupnosti njegovih svojstava u usporedbi sa svojstvima drugih elemenata. Na temelju toga, a također i na temelju rezultata istraživanja promjene oksida koji tvore staklo, kemičar je uspio izmijeniti vrijednosti atomskih masa nekih elemenata, među kojima su uran, indij, berilij i drugi.
Naravno, Mendeljejev je želio što prije popuniti prazne ćelije koje su ostale u tablici, a 1870. je predvidio da će uskoro biti otkriveni kemijski elementi nepoznati znanosti, čije je atomske mase i svojstva uspio izračunati. Prvi od njih bili su galij (otkriven 1875.), skandij (otkriven 1879.) i germanij (otkriven 1885.). Potom su se predviđanja nastavila ostvarivati, te je otkriveno još osam novih elemenata, među njima: polonij (1898), renij (1925), tehnecij (1937), francij (1939) i astat (1942-1943). Inače, 1900. godine D. I. Mendeleev i škotski kemičar William Ramsay došli su do zaključka da u tablicu treba uključiti i elemente nulte skupine - do 1962. zvali su se inertni, a poslije - plemeniti plinovi.
Organizacija periodnog sustava
Kemijski elementi u tablici D. I. Mendeljejeva raspoređeni su u redove, u skladu s povećanjem njihove mase, a duljina redova je odabrana tako da elementi u njima imaju slična svojstva. Primjerice, plemeniti plinovi kao što su radon, ksenon, kripton, argon, neon i helij ne reagiraju lako s drugim elementima, a također imaju nisku kemijsku aktivnost, zbog čega se nalaze u krajnjem desnom stupcu. I elementi lijevog stupca (kalij, natrij, litij itd.) savršeno reagiraju s ostalim elementima, a same reakcije su eksplozivne. Pojednostavljeno rečeno, unutar svakog stupca elementi imaju slična svojstva, koja se razlikuju od stupca do stupca. Svi elementi do br. 92 nalaze se u prirodi, a s brojem 93. počinju umjetni elementi koji se mogu stvoriti samo u laboratoriju.
U svojoj izvornoj verziji periodični se sustav shvaćao samo kao odraz poretka koji postoji u prirodi, a nije bilo objašnjenja zašto bi sve tako trebalo biti. I to tek kad se pojavio kvantna mehanika, postalo je jasno pravo značenje redoslijeda elemenata u tablici.
Lekcije kreativnog procesa
Razgovarajući o tome koje lekcije kreativni proces može se izvući iz cjelokupne povijesti stvaranja periodnog sustava D. I. Mendeljejeva, možemo kao primjer navesti ideje engleskog istraživača na tom području. kreativno razmišljanje Graham Wallace i francuski znanstvenik Henri Poincaré. Hajdemo ih ukratko.
Prema Poincaréu (1908) i Grahamu Wallaceu (1926), postoje četiri glavne faze u kreativnom razmišljanju:
- Trening- faza formuliranja glavnog zadatka i prvi pokušaji njegovog rješavanja;
- Inkubacija- faza tijekom koje dolazi do privremenog odvraćanja od procesa, ali se rad na pronalaženju rješenja problema provodi na podsvjesnoj razini;
- uvid- faza u kojoj se pronalazi intuitivno rješenje. Štoviše, ovo rješenje može se pronaći u situaciji koja apsolutno nije relevantna za zadatak;
- Ispitivanje- faza testiranja i implementacije rješenja, u kojoj se vrši provjera ovog rješenja i njegov mogući daljnji razvoj.
Kao što vidimo, u procesu stvaranja svoje tablice, Mendeljejev je intuitivno slijedio ove četiri faze. Koliko je to učinkovito može se suditi po rezultatima, t.j. jer je tablica stvorena. A s obzirom na to da je njegovo stvaranje bio veliki korak naprijed ne samo za kemijsku znanost, već i za cijelo čovječanstvo, gore navedene četiri faze mogu se primijeniti i na implementaciju male projekte, te provedbi globalnih planova. Glavna stvar koju treba zapamtiti je da se niti jedno otkriće, niti jedno rješenje problema ne mogu pronaći sami, bez obzira koliko ih želimo vidjeti u snu i koliko god spavali. Da biste uspjeli, bilo da se radi o izradi tablice kemijskih elemenata ili izradi novog marketinškog plana, potrebno je posjedovati određena znanja i vještine, te vješto koristiti svoj potencijal i vrijedno raditi.
Želimo Vam uspjeh u Vašim nastojanjima i uspješnu realizaciju Vaših planova!
Čak i u školi, sjedeći na satovima kemije, svi se sjećamo stola na zidu učionice ili kemijskog laboratorija. Ova tablica sadržavala je klasifikaciju svih kemijskih elemenata poznatih čovječanstvu, onih temeljnih komponenti koje čine Zemlju i cijeli Svemir. Tada to nismo mogli ni pomisliti periodni sustav elemenata nesumnjivo jedan od najvećih znanstvenih otkrićašto je temelj našeg moderno znanje o kemiji.
Periodični sustav kemijskih elemenata D. I. Mendeljejeva
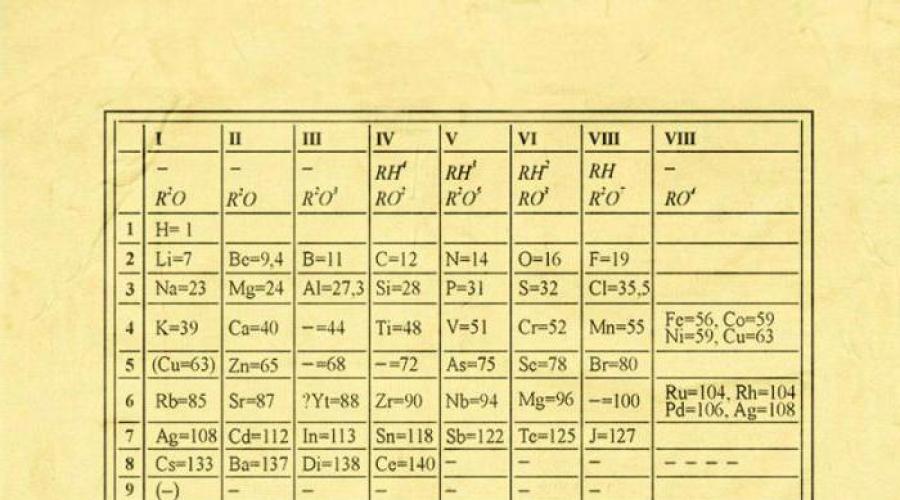
Na prvi pogled njezina ideja izgleda varljivo jednostavno: organizirati kemijski elementi uzlaznim redoslijedom težine njihovih atoma. Štoviše, u većini slučajeva ispada da kemijska i fizikalna svojstva svaki element je sličan elementu koji mu prethodi u tablici. Ovaj uzorak se pojavljuje za sve osim nekoliko prvih elemenata, jednostavno zato što ispred sebe nemaju elemente koji su im slični atomskom težinom. Upravo zahvaljujući otkriću ovog svojstva možemo postaviti linearni slijed elemenata u tablicu koja vrlo podsjeća na zidni kalendar i tako na jasan i koherentan način kombinirati ogroman broj vrsta kemijskih elemenata. Naravno, danas koristimo koncept atomskog broja (broj protona) kako bismo uredili sustav elemenata. To je pomoglo u rješavanju tzv tehnički problem"Parovi permutacija", međutim, nisu doveli do temeljne promjene u izgledu periodnog sustava.
NA Mendeljejevljev periodni sustav svi elementi su poredani prema njihovom atomskom broju, elektronskoj konfiguraciji i kemijskim svojstvima koja se ponavljaju. Redovi u tablici nazivaju se periodima, a stupci grupe. Prva tablica, datirana iz 1869. godine, sadržavala je samo 60 elemenata, ali je sada tablicu trebalo povećati da primi 118 elemenata koji su nam danas poznati.
Periodični sustav Mendeljejeva sistematizira ne samo elemente, već i njihova najrazličitija svojstva. Kemičaru je često dovoljno imati periodni sustav pred očima kako bi točno odgovorio na mnoga pitanja (ne samo ispitna, već i znanstvena).
YouTube ID 1M7iKKVnPJE nije važeći.
Periodični zakon
Postoje dvije formulacije periodični zakon kemijski elementi: klasični i moderni.
Klasični, kako ga je predstavio njegov otkrivač D.I. Mendeljejev: svojstva jednostavnih tijela, kao i oblici i svojstva spojeva elemenata, u periodičnoj su ovisnosti o vrijednostima atomskih težina elemenata.
Moderno: svojstva jednostavnih tvari, kao i svojstva i oblici spojeva elemenata, u periodičnoj su ovisnosti o naboju jezgre atoma elemenata (serijski broj).
Grafički prikaz periodnog zakona je periodični sustav elemenata, koji je prirodna klasifikacija kemijski elementi, temeljeni na redovitim promjenama svojstava elemenata zbog naboja njihovih atoma. Najčešće slike periodnog sustava elemenata D.I. Mendeljejev su kratki i dugi oblici.

Grupe i razdoblja periodnog sustava
grupe nazivaju se okomiti redovi u periodnom sustavu. U skupinama se elementi kombiniraju prema atributu najviši stupanj oksidacija u oksidima. Svaka grupa se sastoji od glavne i sekundarne podskupine. Glavne podskupine uključuju elemente malih razdoblja i elemente velikih razdoblja koji su im identični po svojstvima. Bočne podskupine sastoje se samo od elemenata velikih razdoblja. Kemijska svojstva elemenata glavne i sekundarne podskupine značajno se razlikuju.
Razdoblje nazivaju vodoravni red elemenata poredanih uzlaznim redoslijedom rednih (atomskih) brojeva. U periodnom sustavu postoji sedam razdoblja: prvo, drugo i treće razdoblje nazivaju se malim, sadrže 2, 8 i 8 elemenata; preostala razdoblja nazivaju se velikim: u četvrtom i petom razdoblju ima po 18 elemenata, u šestom - 32, au sedmom (još nedovršenom) - 31 element. Svako razdoblje, osim prvog, počinje alkalijskim metalom i završava plemenitim plinom.
Fizičko značenje serijskog broja kemijski element: broj protona u atomskoj jezgri i broj elektrona koji se okreću oko atomska jezgra, jednaki su rednom broju elementa.
Svojstva periodnog sustava
Prisjetite se toga grupe imenovati okomite redove u periodnom sustavu i Kemijska svojstva elementi glavne i sekundarne podskupine značajno se razlikuju.
Svojstva elemenata u podskupinama prirodno se mijenjaju od vrha do dna:
- intenzivirati metalna svojstva i oslabiti nemetalni;
- atomski radijus se povećava;
- povećava se snaga baza i anoksičnih kiselina koje stvara element;
- pada elektronegativnost.
Svi elementi, osim helija, neona i argona, tvore kisikove spojeve, postoji samo osam oblika kisikovih spojeva. Često su prikazani u periodnom sustavu. opće formule, koji se nalazi ispod svake grupe uzlaznim redoslijedom oksidacijskog stanja elemenata: R 2 O, RO, R 2 O 3, RO 2, R 2 O 5, RO 3, R 2 O 7, RO 4, gdje je simbol R označava element ove grupe. Formule za više okside primjenjuju se na sve elemente skupine, osim u iznimnim slučajevima kada elementi ne pokazuju oksidacijsko stanje jednako broju skupine (na primjer, fluor).
Oksidi sastava R 2 O pokazuju jaka bazična svojstva, a bazičnost im raste s povećanjem serijskog broja, oksidi sastava RO (s izuzetkom BeO) pokazuju osnovna svojstva. Oksidi sastava RO 2 , R 2 O 5 , RO 3 , R 2 O 7 pokazuju kisela svojstva, a njihova kiselost raste s povećanjem serijskog broja.
Elementi glavnih podskupina, počevši od skupine IV, tvore plinovite vodikove spojeve. Postoje četiri oblika takvih spojeva. Smješteni su pod elemente glavnih podskupina i predstavljeni su općim formulama u slijedu RH 4 , RH 3 , RH 2 , RH.
RH 4 spojevi su neutralni; RH 3 - slabo bazičan; RH 2 - blago kiselo; RH je jako kisela.
Prisjetite se toga razdoblje nazivaju vodoravni red elemenata poredanih uzlaznim redoslijedom rednih (atomskih) brojeva.
Unutar razdoblja s povećanjem serijskog broja elementa:
- povećava se elektronegativnost;
- metalna svojstva se smanjuju, nemetalna se povećavaju;
- atomski radijus pada.

Elementi periodnog sustava
Alkalni i zemnoalkalni elementi
To uključuje elemente iz prve i druge skupine periodnog sustava. alkalni metali iz prve skupine - mekani metali, srebrni, dobro rezani nožem. Svi oni imaju jedan elektron u vanjskoj ljusci i savršeno reagiraju. zemnoalkalijskih metala iz druge skupine također imaju srebrnu nijansu. Dva elektrona postavljena su na vanjsku razinu i, sukladno tome, ovi metali su manje spremni na interakciju s drugim elementima. U usporedbi s alkalijskim metalima, zemnoalkalijski metali se tope i kuhaju na višim temperaturama.
Prikaži/sakrij tekst
Lantanidi (rijetkozemni elementi) i aktinidi
Lantanidi je skupina elemenata izvorno pronađenih u rijetkim mineralima; otuda i njihov naziv "rijetke zemlje" elementi. Kasnije se pokazalo da ti elementi nisu tako rijetki kao što su isprva mislili, pa je naziv lantanidi dao rijetkim zemnim elementima. lantanidi i aktinidi zauzimaju dva bloka, koji se nalaze ispod glavne tablice elemenata. Obje skupine uključuju metale; svi lantanidi (osim prometija) su neradioaktivni; aktinidi su, s druge strane, radioaktivni.
Prikaži/sakrij tekst
Halogeni i plemeniti plinovi
Halogeni i plemeniti plinovi grupirani su u skupine 17 i 18 periodnog sustava. Halogeni su nemetalni elementi, svi imaju sedam elektrona u svojoj vanjskoj ljusci. NA plemeniti plinovi svi elektroni se nalaze u vanjskoj ljusci, pa gotovo da ne sudjeluju u stvaranju spojeva. Ti se plinovi nazivaju "plemenitim" jer rijetko reagiraju s drugim elementima; tj. odnose se na pripadnike plemićke kaste koji su se tradicionalno klonili drugih ljudi u društvu.
Prikaži/sakrij tekst
prijelazni metali
prijelazni metali zauzimaju grupe 3-12 u periodnom sustavu. Većina ih je gusta, čvrsta, s dobrom električnom i toplinskom vodljivošću. Njihovi valentni elektroni (preko kojih se povezuju s drugim elementima) nalaze se u nekoliko elektronskih ljuski.
Prikaži/sakrij tekst
| prijelazni metali |
| Scandium Sc 21 |
| Titan Ti 22 |
| Vanadij V 23 |
| Krom Cr 24 |
| Mangan Mn 25 |
| Željezo Fe 26 |
| Kobalt Co27 |
| Nikl Ni 28 |
| Bakar Cu 29 |
| Cink Zn 30 |
| Itrij Y 39 |
| Cirkonij Zr 40 |
| Niobij Nb 41 |
| molibden Mo 42 |
| Tehnecij Tc 43 |
| Rutenij Ru 44 |
| Rh 45 rodij |
| Paladij Pd 46 |
| Srebro Ag 47 |
| Kadmij Cd 48 |
| Lutecij Lu 71 |
| Hafnij Hf 72 |
| Tantal Ta 73 |
| Volfram W 74 |
| Renij Re 75 |
| Osmij Os 76 |
| Iridij Ir 77 |
| Platinum Pt 78 |
| Zlato Au 79 |
| Merkur Hg 80 |
| Lorencij Lr 103 |
| Rutherfordij Rf 104 |
| Dubnij Db 105 |
| Seaborgium Sg 106 |
| Bory Bh 107 |
| Hasij Hs 108 |
| Meitnerium Mt 109 |
| Darmstadtius Ds 110 |
| Rendgen Rg 111 |
| Kopernije Cn 112 |
Metaloidi
Metaloidi zauzimaju grupe 13-16 periodnog sustava. Metaloidi kao što su bor, germanij i silicij su poluvodiči i koriste se za proizvodnju računalni čipovi i daske.
Prikaži/sakrij tekst
Post-tranzicijski metali
Elementi tzv post-tranzicijskih metala, pripadaju skupinama 13-15 periodnog sustava. Za razliku od metala, nemaju sjaj, već imaju mat završnicu. U usporedbi s prijelaznim metalima, postprijelazni metali su mekši, imaju više niska temperatura taljenje i vrenje, veća elektronegativnost. Njihovi valentni elektroni, kojima pričvršćuju druge elemente, nalaze se samo na vanjskoj elektronskoj ljusci. Elementi iz skupine post-tranzicijskih metala imaju mnogo više visoka temperatura kipuće od metaloida.
A sada konsolidirajte svoje znanje gledajući video o periodnom sustavu i još mnogo toga.
Super, prvi korak na putu do znanja je napravljen. Sada ste manje-više vođeni periodnim sustavom i to će vam biti od velike koristi, jer je periodni sustav temelj na kojem stoji ova nevjerojatna znanost.