Kolika je otpornost materijala na koroziju? Koji su načini poboljšanja otpornosti na koroziju. Otpornost građevinskih materijala na koroziju
Svrha rada: upoznavanje s mehanizmima i brzinama korozijskog razaranja metala.
1. Smjernice
Korozijsko uništavanje metala je spontani prijelaz metala u stabilnije oksidirano stanje pod djelovanjem okoliš. Ovisno o prirodi okoliša razlikuju se kemijska, elektrokemijska i biokorozija.
Elektrokemijska korozija je najčešći tip korozije. Korozija metalnih konstrukcija u prirodnim uvjetima - u moru, u tlu, u podzemne vode, pod kondenzacijskim ili adsorpcijskim filmovima vlage (u atmosferskim uvjetima) je elektrokemijske prirode. Elektrokemijska korozija je uništavanje metala, popraćeno izgledom električna struja kao rezultat rada mnogih makro- i mikrogalvanskih parova. Mehanizam električne korozije podijeljen je na dva neovisni proces:
1) anodni proces - prijelaz metala u otopinu u obliku hidratiziranih iona, ostavljajući ekvivalentnu količinu elektrona u metalu:
(-)A: Me + mH 2 O → 1+ + ne
2) katodni proces je asimilacija suvišnih elektrona u metalu pomoću nekih depolarizatora (molekula ili iona otopine koji se mogu reducirati na katodi). Tijekom korozije u neutralnom mediju, depolarizator je obično korozija u kisik otopljen u elektrolitu:
(+)K: O 2 + 4e +2H 2 O →4OH¯
Tijekom korozije u kiselim sredinama - vodikov ion
(+)K: H H 2 O + e → 1/2 H 2 +H 2 O
Makrogalvanski parovi nastaju kontaktom razni metali. U ovom slučaju, metal koji ima negativniji potencijal elektrode je anoda i podliježe oksidaciji (koroziji).
Metal s pozitivnijim potencijalom služi kao katoda. Djeluje kao vodič elektrona od metala anode do čestica okoline koje su sposobne primiti te elektrone. Prema teoriji mikroparova, uzrok elektrokemijske korozije metala je prisutnost na njihovoj površini mikroskopskih kratkospojnih galvanskih ćelija koje nastaju zbog heterogenosti metala i njegovog kontakta s okolinom. Za razliku od galvanskih ćelija posebno izrađenih u tehnici, one se spontano pojavljuju na metalnoj površini. NA tanki sloj vlaga, koja uvijek postoji na površini metala, otapa O 2, CO 2, SO 2 i druge plinove iz zraka. Time se stvaraju uvjeti za kontakt metala s elektrolitom.
S druge strane, različiti dijelovi površine određenog metala imaju različite potencijale. Razlozi za to su brojni, primjerice, razlika potencijala između različito obrađenih dijelova površine, različitih strukturnih komponenti legure, nečistoća i osnovnog metala.
Područja figurativne površine s negativnijim potencijalom postaju anode i otapaju se (korodiraju) (slika 1.1).
Dio oslobođenih elektrona prijeći će s anode na katodu. Međutim, polarizacija elektroda sprječava koroziju, budući da elektroni preostali na anodi tvore dvostruki električni sloj s pozitivnim ionima koji su prešli u otopinu, otapanje metala se zaustavlja. Stoga se može dogoditi električna korozija ako se elektroni s anodnih mjesta kontinuirano povlače na katodi, a zatim uklanjaju s katodnih mjesta. Proces uklanjanja elektrona s katodnih mjesta naziva se depolarizacija, a tvari ili ioni koji uzrokuju depolarizaciju nazivaju se depolarizatori. Ako dođe do kontakta bilo kojeg metala s legurom, legura dobiva potencijal koji odgovara potencijalu najnegativnijeg metala u svom sastavu. Kada mjed (legura bakra i cinka) dođe u dodir sa željezom, mjed će početi korodirati (zbog prisutnosti cinka u njemu). Kada se medij promijeni, potencijal elektrode pojedinih metala može se dramatično promijeniti. Krom, nikal, titan, aluminij i drugi metali čiji je normalni elektrodni potencijal oštro negativan, snažno su pasivizirani u normalnim atmosferskim uvjetima, prekriveni oksidnim filmom, uslijed čega njihov potencijal postaje pozitivan. u atmosferskim uvjetima i svježa voda sljedeća galvanska ćelija će raditi:
(-) Fe | H 2 O, O 2 | Al 2 O 3 (Al) +
(-)A: 2Fe - 4e = 2Fe 2+
(+)K: O 2 + 4e + 2H 2 O \u003d 4OH¯
Kao rezultat: 2Fe 2 + 4OH¯ \u003d 2Fe (OH) 2
4Fe(OH) 2 + O 2 + 2H 2 O = 2Fe(OH) 3
Međutim, u kiselom, alkalnom ili neutralnom okruženju koje sadrži ione klora (na primjer, u morskoj vodi), koji uništavaju oksidni film, aluminij u dodiru sa željezom postaje anoda i prolazi kroz proces korozije. Sljedeća galvanska ćelija radit će u otopini NaCl i morskoj vodi:
| |
(-)A: Al - 3e = Al 3+
(+)K: O 2 +4e + 2H 2 O \u003d 4OH¯
4Al 3 + 12OH¯ \u003d 4Al (OH) 3
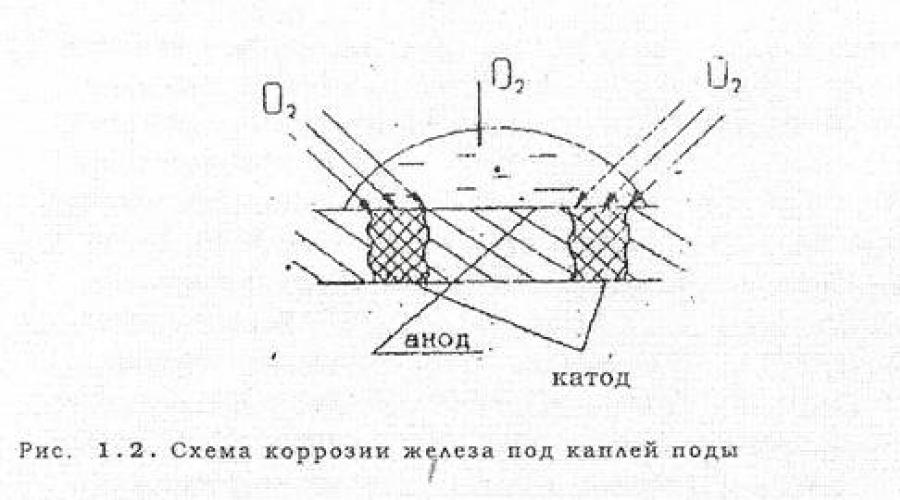
Vrlo često se elektrokemijska korozija javlja kao posljedica različite aeracije, odnosno nejednakog pristupa kisika zraka pojedinim dijelovima metalne površine. Na sl.1.2. prikazan je slučaj korozije željeza i kap vola. Blizu rubova kapi, gdje je kisik lakše prodirati, pojavljuju se katodni dijelovi, a u središtu, gdje je debljina zaštitnog sloja vode veća i kisik teže prodire u anodni dio.

Na pojavu korozivnih galvanskih ćelija utječu razlika u koncentraciji otopljenog elektrolita, razlika u temperaturi i osvjetljenju te drugi fizički uvjeti.
Zaštita od korozije
Razlozi koji uzrokuju korozijsko uništavanje metala su brojni. Postoje različite metode zaštite od korozije:
liječenje vanjsko okruženje;
zaštitni premazi;
elektrokemijska zaštita;
proizvodnja legura posebno otpornih na koroziju.
Obrada vanjskog okoliša je uklanjanje ili smanjenje aktivnosti nekih korozivnih tvari prisutnih u njemu. Na primjer, uklanjanje kisika otopljenog u jodu (odzračivanje). Ponekad se u otopinu dodaju posebne tvari koje usporavaju koroziju, koje se nazivaju usporivači ili INHIBITORI (urotropin, tiourea, anilin i dr.).
Dijelovi koji su zaštićeni u atmosferskim uvjetima stavljaju se zajedno s inhibitorima u posudu ili zamotaju u papir, unutarnji sloj koji je impregniran inhibitorom, a vanjski sloj parafinom. Inhibitor se, isparavajući, adsorbira na površini dijela, uzrokujući inhibiciju elektrodnih procesa.
Uloga zaštitni premazi svodi se na izoliranje metala od utjecaja zaštitnog vanjskog okruženja. To se postiže nanošenjem lakova, boja, metalnih premaza na metalnu površinu.
Metalni premazi se dijele na anodne i katodne. U slučaju ANODE prevlake, elektrodni potencijal metala premaza je negativniji od potencijala zaštićenog metala. U slučaju KATODNE prevlake, elektrodni potencijal metala prevlake je pozitivniji od potencijala osnovnog metala.
Do zaštitni sloj potpuno izolira osnovni metal od okoliša, nema temeljne razlike između anodnog i katodnog premaza. Kada se naruši integritet premaza, nastaju novi uvjeti. Katodni premaz, na primjer, kositar na željezo, ne samo da prestaje štititi osnovni metal, već svojom prisutnošću pojačava koroziju željeza (u nastaloj galvanskoj ćeliji željezo je anoda).
Elektrokemijskom zaštitom smanjenje ili potpuni prestanak korozije postiže se stvaranjem visokog elektronegativnog potencijala na zaštićenom metalnom proizvodu. Da bi se to postiglo, proizvod koji se štiti je spojen ili na metal koji ima negativniji potencijal elektrode, sposoban lakše odustati od elektrona (zaštitna zaštita) ili s negativnim polom vanjskog izvora struje (katodna električna zaštita).

Anodni premaz, na primjer, cink na željezo, naprotiv, ako je narušen integritet sloja prevlake, sam će se uništiti, čime se osnovni metal štiti od korozije (cink je anoda u nastaloj galvanskoj ćeliji).

Proizvodnja specijalnih legura otpornih na koroziju, nehrđajućih čelika itd. svodi se na unošenje u njih aditiva raznih metala.
Ovi aditivi utječu na mikrostrukturu legure i doprinose nastanku u njoj takvih mikrogalvanskih ćelija, u kojima se ukupni EMF zbog međusobne kompenzacije približava nuli. Takvi korisni aditivi, posebno za čelik, su krom, nikal i drugi metali.
1. Obavljanje posla
Vježba 1
Provođenje visokokvalitetnih kemijskih reakcija koje omogućuju otkrivanje metalnih iona koji su prešli u otopinu tijekom procesa anodne korozije.
Instrumenti i reagensi: otopine ZnSO 4 , FeSO 4 i K 3 , set epruveta.
Tok rada: U epruvete uliti 1-2 ml otopine soli:
a) ZnSO 4 i nekoliko kapi K 3 ;
b) FeSO i nekoliko kapi K 3 .
Obratite pažnju na oborine. Napiši odgovarajuće reakcije u molekularnom i ionskom obliku.
Zadatak 2
Proučavanje mehanizma korozije metala u izravnom kontaktu u neutralnom okruženju.
Eksperiment se provodi na postavci prikazanoj na sl. 1.7

U epruvetu u obliku slova U ulijte 5-10 ml vodene otopine NaCl. Metalne ploče se spuštaju u njega, međusobno povezane stezaljkama.
Metalne ploče moraju se pažljivo očistiti brusnom krpom, a mjesto kontakta ploče i stezaljke je izvan otopine. Prilikom izvođenja pokusa potrebno je uočiti promjenu boje otopine na katodi i anodi.
Pisati:
1) procesi anodne i katodne korozije
2) odgovarajuće reakcije kojima je metalni ion pronađen u otopini
3) dijagram galvanske ćelije.
1. Zn i Fe ploče se spuštaju.
U otopinu gdje se nalazi cinkova elektroda, dodajte nekoliko kapi K 3, gdje se nalazi željezna elektroda, nekoliko kapi fenolftaleina.
2. Fe i Cu ploče su spuštene,
U otopinu gdje se nalazi željezna elektroda dodajte nekoliko kapi K 3, gdje se nalazi bakrena elektroda, nekoliko kapi fenolftaleina.
Usporedite ponašanje željeza u oba slučaja, izvucite odgovarajuće zaključke.
Zadatak 3
Proučavanje mehanizma korozije metala u njihovom izravnom dodiru u kiseloj sredini.
Pokus se provodi na instalaciji prikazanoj na slici 1.8.
Ulijte 10% otopinu HCl u porculansku šalicu. Umočite dva metala Al i Cu u otopinu i promatrajte ponašanje metala. Koji metal proizvodi mjehuriće vodika? Napišite odgovarajuće odgovore. Dovedite dva metala u kontakt jedan s drugim. Na kojem metalu nastaju vodikovi mjehurići kada metali dođu u dodir? Nacrtajte dijagram galvanskog elementa i elektrodnih procesa na njegovim elektrodama. Napišite ukupnu jednadžbu reakcije.

3. Primjeri rješavanja problema
Primjer 1
Razmotrimo proces korozije u kontaktu željeza s olovom u otopini HCl
U otopini elektrolita (HCl) ovaj sustav je galvanska ćelija, u čijem je unutarnjem krugu Fe anoda (E°=0,1260). atomi željeza, prolazeći dva elektrona do olova, prelaze u otopinu u obliku iona. Elektroni na olovu obnavljaju vodikove ione koji su u otopini, tk.
HCl = H + + Cl¯
Anodni proces Fe 0 - 2e \u003d Fe 2+
Katodni proces 2H + + 2e = 2H 0
Primjer 2
Proces korozije pri kontaktu Fe s Ph u otopini NaCl. Budući da otopina NaCl ima neutralnu reakciju (sol koju čine jaka baza i jaka kiselina), onda
Anodni proces Fe - 2e \u003d Fe 2+,
Katodni proces O 2 + 4e + 2H 2 O = 4OH¯
Natrijev klorid (NaCl) ne sudjeluje u procesima korozije, na dijagramu je prikazan samo kao tvar koja može povećati električnu vodljivost otopine elektrolita.
Primjer 3
Zašto je kemijski čisto željezo otpornije na koroziju od komercijalnog željeza? Sastaviti elektroničke jednadžbe procesa anode i katode koji nastaju tijekom korozije tehničkog željeza.
Odluka
Proces korozije tehničkog željeza ubrzava se zbog stvaranja mikro i submikrogalvanskih elemenata u njemu. U mikrogalvanskim parovima, osnovni metal, u pravilu, služi kao anoda; željezo. Katode su inkluzije u metalu, na primjer, zrna grafita, cementa. Na anodnim mjestima ioni metala prelaze u otopinu (oksidacija).
A: Fe - 2e = Fe 2+
Na katodnim mjestima, elektroni koji su ovdje prošli s anodnih mjesta vezani su ili kisikom u zraku otopljenom u vodi, ili vodikovim ionima. U neutralnim sredinama dolazi do depolarizacije kisika:
K: O 2 + 4e + 2H 2 O \u003d 4OH¯
U kiselim sredinama (visoka koncentracija H - iona), depolarizacija vodika
K: 2H + + 2e = 2H 0
Primjer 4
Naziv, katodni ili anodni je cink i premaz na željeznom proizvodu? Koji će se procesi odvijati ako je narušen integritet premaza i proizvod je u vlažnom zraku?
Odluka
Elektrodni potencijal cinka je po svojoj algebarskoj vrijednosti niži od elektrodnog potencijala željeza, pa je premaz anodni. U slučaju kršenja integriteta sloja cinka, formira se korozivni galvanski par, u kojem je cink anoda, a željezo katoda. Anodni proces sastoji se od oksidacije cinka:
Zn 2+ + 2OH \u003d Zn (OH) 2
Katodni proces se odvija na željezu. U vlažnom zraku pretežno dolazi do depolarizacije kisika.
K(Fe): O 2 + 4e + 2H 2 O = 4OH¯
Primjer 5
Ploče kadmija i nikla, uronjene u razrijeđenu sumpornu kiselinu, otapaju se u njoj uz oslobađanje vodika. Što će se promijeniti ako se oboje istovremeno spuste u posudu s kiselinom, povezujući krajeve žicom?
Odluka
Spojite li krajeve kadmijeve i nikalne ploče žicom, nastaje kadmij, nikl galvanska ćelija u kojoj je kadmij, kao aktivniji metal, anoda. Kadmij će oksidirati:
A: Cd - 2e \u003d Cd 2+,
Višak elektrona otići će na ploču od nikla, gdje će se odvijati proces redukcije vodikovih iona:
K(Ni): 2H + 2e =2H0.
Dakle, samo kadmij se otapa, nikal će postati samo vodič elektrona i neće se sam otapati. Vodik će se oslobađati samo na niklovanoj ploči.
Primjer 6
Kako pH okoliša utječe na brzinu korozije aluminija?
Odluka
Smanjenje pH okoliša, t.j. povećanje koncentracije H-iona naglo povećava stopu korozije nikla, - budući da kiselo okruženje sprječava stvaranje zaštitnih filmova nikal hidroksida, aktivna oksidacija nikla događa se u kiseloj sredini
A: Ni - 2e = Ni 2+
Smanjenje koncentracije H-iona, t.j. povećanje koncentracije OH potiče stvaranje sloja nikal hidroksida:
Ni 2+ - 2OH¯ \u003d NI (OH) 2
Aluminijev hidroksid ima amfoterna svojstva, t.j. topiv u kiselinama i lužinama:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al (OH) 3 + NaOH \u003d Na AlO 2 + 2H 2 O
Točnije, ova reakcija se odvija na sljedeći način:
Al(OH) 3 + NaOH = Na
Dakle, najniža stopa korozije nikla je u alkalnom okruženju, aluminij - u neutralnom.
4. Zadaci
1. Željezna ploča uronjena u klorovodična kiselina, vrlo sporo otpušta vodik, ali ako ga dodirnete cink žicom, odmah je prekriven mjehurićima vodika. Objasnite ovaj fenomen. Koji metal ulazi u otopinu u ovom slučaju?
2. U željeznom proizvodu postoje dijelovi od nikla. Kako će to utjecati na koroziju željeza? Napišite odgovarajuće anodne i katodne procese ako je proizvod u vlažnoj atmosferi.
3. U kojem je mediju brzina razaranja željeza veća? Koje okruženje pogoduje anodnoj oksidaciji cinka? Napišite odgovarajuće odgovore.
4. Kako nastaje atmosferska korozija pokositrenog željeza i pokositrenog bakra kada je narušen integritet prevlake? Sastavite elektronske jednadžbe procesa anode i katode.
5. Bakar ne istiskuje vodik iz razrijeđenih kiselina. Zašto? Međutim, ako se cink ploča dotakne bakrene ploče, tada počinje brza evolucija vodika na bakru. Objasnite to pisanjem elektroničkih jednadžbi za katodni i anodni proces.
6. Cinkova ploča i cinkova ploča djelomično prekrivena bakrom spuštene su u otopinu elektrolita koja sadrži otopljeni kisik. U kojem slučaju se proces korozije cinka događa intenzivnije? Sastavite elektronske jednadžbe katodnog i anodnog procesa.
7. Što se može dogoditi ako se proizvod u kojem je tehničko željezo u kontaktu s bakrom ostavi na zraku na visoka vlažnost zraka? Napišite jednadžbe odgovarajućih procesa.
8. Aluminij zakovan željezom. Koji metal će korodirati? Koji će se procesi odvijati ako proizvod dospije u morsku vodu?
9. Zašto na kontakt proizvodi od željeza s aluminijem - proizvodi od željeza su podložni intenzivnijoj koroziji, iako aluminij ima negativniji standardni potencijal elektrode?
10. Izostavljene željezne ploče:
a) destilirana voda
b) morska voda
U kojem slučaju je proces korozije intenzivniji? Motivirajte svoj odgovor.
11. Napravite jednadžbe procesa koji se događaju tijekom korozije aluminija uronjenog u otopinu:
a) kiseline
b) lužine
12. Zašto industrijski cink interagira s kiselinom intenzivnije od kemijski čistog cinka?
13. Ploča se spušta u otopinu elektrolita:
b) bakar, djelomično prekriven kositrom
U kojem slučaju je proces korozije intenzivniji?
Motivirajte odgovor
14. Zašto se, kada su željezni proizvodi poniklani, najprije premazuju bakrom, a zatim niklom?
Sastavite elektronske jednadžbe za reakcije koje se javljaju u procesima korozije kada je nikalna prevlaka oštećena.
15. Željezni proizvod obložen je kadmijem. Kakav je to premaz - anoda ili katoda?
Motivirajte svoj odgovor. Koji metal će korodirati ako je zaštitni sloj oštećen? Sastavite elektronske jednadžbe odgovarajućih procesa (neutralni medij).
16. Koji od metala:
b) kobalt
c) magnezij
može biti zaštitnik legure na bazi željeza. Sastavite elektronske jednadžbe odgovarajućih procesa (kiseli medij).
17. Koji će se procesi dogoditi na pločama cinka i željeza ako se svaka zasebno uroni u otopinu plavi vitriol? Koji će se procesi odvijati ako se vanjski krajevi u otopini ploča spoje vodičem? Napišite elektronske jednadžbe
18. Aluminijska ploča spuštena
a) destilirana voda
b) u otopini natrijevog klorida
U kojem slučaju je proces korozije intenzivniji? Napraviti jednadžbe za procese anodne i katodne korozije tehničkog aluminija u neutralnom okruženju.
19. Ako se čavao zabije u vlažno drvo, tada je dio koji se nalazi unutar stabla prekriven hrđom. Kako se to može objasniti? Je li ovo dio anode ili katode nokta?
20. Nedavno su drugi metali premazani kobaltom radi zaštite od korozije. Je li čelik obložen kobaltom anodni ili katodni? Koji se procesi odvijaju u vlažnom zraku kada je narušen integritet premaza?
©2015-2019 stranica
Sva prava pripadaju njihovim autorima. Ova stranica ne tvrdi autorstvo, ali omogućuje besplatno korištenje.
Datum izrade stranice: 11.04.2016
Što se zove otpornost na koroziju materijala? Koji su načini poboljšanja otpornosti na koroziju
Uništavanje proizvoda iz raznih materijala pod utjecajem fizikalno-kemijskih i bioloških čimbenika nazvana je korozija (od latinske riječi, što znači korodirati).
Sposobnost materijala da se odupru korozivnim utjecajima okoline naziva se otpornošću na koroziju.
Kao posljedica korozijskog razaranja strojeva i aparata, građevinskih konstrukcija, raznih metalnih proizvoda, oko 12% taljenog metala nepovratno se gubi u raznim industrijama. Nacionalna ekonomija. Produljenje vijeka trajanja proizvoda i opreme uštedjet će milijune tona metala i istovremeno smanjiti troškove njegove proizvodnje.
Načini poboljšanja otpornosti na koroziju:
* Upotreba metala otpornih na koroziju. Najčešći iz ove skupine su krom (13--30%), krom-nikl (do 10-12%, takozvani "nehrđajući čelik"), krom-nikl-molibden i drugi čelici. Ovi čelici zadržavaju otpornost na koroziju na temperaturama do 300--400 °C. Takvi se materijali koriste u vlažnoj atmosferi, u vodi iz slavine i rijeke, dušičnim i organskim kiselinama. Legiranje s molibdenom Mo, cirkonijem 2g, berilijem Be, manganom Mn također povećava otpornost na koroziju.
* Upotreba pasivizirajućih materijala koji se formiraju na površini zaštitni film. Ti materijali uključuju: titan i njegove legure.
* Bronca i mjed otporni su na kavitacijsku koroziju (razaranje pri zajedničko djelovanje udarna opterećenja i elektrokemijski učinci).
Upotreba nemetalnih materijala otpornih na koroziju:
ѕ silikatnih materijala-- spojevi silicija dobiveni topljenjem ili sinteriranjem stijene. Taline stijena (bazalt), kvarc i silikatno staklo, keramički materijali otporni na kiseline, cementi i betoni.
* Plastika (polipropilen, pvc, tekstolit, epoksid).
* Guma (guma).
Primjena metalnih premaza:
* Galvanski premazi (pocinčavanje, kalajisanje, kadmij, ponikl, posrebrenje, pozlata).
* Oblaganje je postupak zaštite od korozije osnovnog metala ili legure drugim metalom koji je otporan na agresivna okruženja.
* Najveću primjenu našla je metoda spojnog valjanja dvaju metala. Kao materijali za oblaganje koriste se nehrđajući čelici, aluminij, nikal, titan, tantal itd.
* Pokrivanje sprejom. Koristi se za zaštitu od korozije spremnika velikih dimenzija: željeznički mostovi, piloti, brodske cijevi. Sprej cink, aluminij, olovo, volfram.
Nanošenje nemetalnih premaza:
Premazi boja (laneno ulje, lakovi, boje, emajli, temeljni premazi, kitovi, sintetičke smole). Materijali za lakiranje nanose se na površinu proizvoda valjanjem, prskanjem, umakanjem, izlijevanjem, četkom, elektrostatičkom metodom.
Primjer: Posebne antivegetativne boje nanose se na trupove morskih plovila kako bi ih zaštitili od obraštanja školjkama morskih organizama. U jednoj godini sloj obraštanja u južnim morima doseže 0,5 m, t.j. 100--150 kg/m. Time se povećava otpor kretanju plovila, koje troši do 8% snage motora, te povećava potrošnja goriva. Vrlo je teško ukloniti takav sloj s površine. Stoga je podvodni dio plovila prekriven antivegetativnim bojom, koja uključuje živin oksid, smole i spojeve arsena.
Polimerni premazi (polietilen, polipropilen, fluoroplastika, polistiren, epoksidne smole i tako dalje.). Smola se nanosi kao talina ili suspenzija četkom, uranjanjem, prskanjem. Fluoroplasti su otporni na udarce morska voda, anorganske kiseline, osim oleuma i dušične kiseline, imaju visoka električna izolacijska svojstva.
Gumiranje - premazivanje gumom i ebonitom kemijskih aparata, cjevovoda, spremnika, kontejnera za transport i skladištenje kemijskih proizvoda i dr. Meke gume aparati podvrgnuti udarcima, temperaturnim fluktuacijama ili sadrže suspenzije gumiraju se, a za aparate koji rade na konstantnoj temperaturi i nisu podvrgnuti mehaničkom naprezanju koriste se tvrde gume (eboniti).
Premazi silikatnim emajlima (staklena tvar). Emajliranje je podvrgnuto opremi koja radi na povišenim temperaturama, pritiscima iu vrlo agresivnim okruženjima.
Premazi mastima i pastama. Antikorozivna maziva pripremaju se na bazi mineralna ulja(stroj, vazelin) i voštane tvari (parafin, sapun, masne kiseline).
Korištenje elektrokemijska zaštita(katoda i anoda). Do metalne konstrukcije vanjska jaka anoda je pričvršćena izvana (izvor istosmjerna struja), što uzrokuje katodnu polarizaciju elektroda na površini zaštićenog metala, uslijed čega se anodni dijelovi metala pretvaraju u katodne. Broj znači da neće biti uništen metal strukture, već pričvršćena anoda.
Otpornost na koroziju
Otpornost na koroziju- sposobnost materijala otpornosti na koroziju, određena brzinom korozije u danim uvjetima. Za procjenu brzine korozije koriste se i kvalitativne i kvantitativne karakteristike. Promijeniti izgled metalne površine, promjene u njegovoj mikrostrukturi primjeri su kvalitativne procjene brzine korozije. Za kvantifikaciju možete koristiti:
- vrijeme proteklo prije pojave prvog žarišta korozije;
- broj centara korozije nastalih tijekom određenog vremenskog razdoblja;
- smanjenje debljine materijala u jedinici vremena;
- promjena mase metala po jedinici površine u jedinici vremena;
- volumen plina koji se oslobađa (ili apsorbira) tijekom korozije površinske jedinice u jedinici vremena;
- gustoća struje koja odgovara brzini zadanog procesa korozije;
- promjena nekog svojstva tijekom određenog vremena korozije (na primjer, električni otpor, reflektivnost materijala, mehanička svojstva).
Različiti materijali imaju različitu otpornost na koroziju, za poboljšanje koje se koriste posebne metode. Dakle, povećanje otpornosti na koroziju moguće je legiranjem (npr. nehrđajući čelici), nanošenjem zaštitnih premaza (kromiranje, niklanje, aluminiziranje, pocinčavanje, bojanje proizvoda), pasiviranjem itd. Otpornost materijala na koroziju, tipična za morske uvjete, proučava se u komorama slana magla.
Izvori
Zaklada Wikimedia. 2010 .
Pogledajte što je "otpornost na koroziju" u drugim rječnicima:
Otpornost na koroziju- sposobnost metala da odoli korozivnim utjecajima okoline. Izvor: snip id 5429: Smjernice za dizajn i zaštitu od korozije za podzemne metalne komunikacijske strukture Co... Rječnik-priručnik pojmova normativne i tehničke dokumentacije
Sposobnost materijala otpornosti na koroziju. Za metale i legure određuje se brzinom korozije, tj. masom materijala pretvorenog u produkte korozije, iz jedinice površine u jedinici vremena, ili debljinom uništenog sloja u mm godišnje. ... Velika enciklopedijski rječnik
otpornost na koroziju- Sposobnost materijala da izdrži djelovanje korozivnog okoliša bez promjene svojih svojstava. Za metal, to može biti lokalno oštećenje površine - udubljenje ili hrđanje; za organski materijali- ovo je formiranje kose ... ... Priručnik tehničkog prevoditelja
Sposobnost materijala otpornosti na koroziju. Za metale i legure određuje se brzinom korozije, odnosno masom materijala pretvorenog u produkte korozije, iz jedinice površine u jedinici vremena, ili debljinom uništenog sloja u ... ... enciklopedijski rječnik
Otpornost na koroziju Otpornost na koroziju. Sposobnost materijala da izdrži korozivnu okolinu bez promjene svojih svojstava. Za metal, to može biti lokalizirana površinska rupica ili hrđa; za organsko ...... Rječnik metalurških pojmova
OTPORNOST NA KOROZIJU- svojstva otpornosti materijala na koroziju. Otpornost na koroziju određuje se masom materijala koji se pretvara u produkte korozije u jedinici vremena po jedinici površine proizvoda koji je u interakciji s agresivnim okruženjem, kao i veličinom ... ... Metalurški rječnik
otpornost na koroziju- atsparumas korozijai statusas T sritis Standartizacija ir metrologija apibrėžtis Metalo gebėjimas priešintis korozinės aplinkos poveikiui. atitikmenys: engl. otpornost na koroziju vok. Korozije širina, m; Rostbeständigkeit, f; … Penkiakalbis aiskinamasis metrologijos terminų žodynas
otpornost na koroziju- korozinis atsparumas statusas T sritis chemija apibrėžtis Metalo atsparumas aplinkos medžiagų poveikiui. atitikmenys: engl. otpornost na koroziju. otpornost na koroziju... Chemijos terminų aiskinamasis žodynas
otpornost na koroziju- sposobnost materijala, kao što su metali i legure, da odolijeva koroziji u korozivnom okruženju; procijenjeno brzinom korozije; Vidi također: otpornost kemijska otpornost opuštanje otpornost... Enciklopedijski rječnik metalurgije
Metali, sposobnost metala ili legure da se odupru korozivnim učincima okoline. K. s. određena brzinom korozije u danim uvjetima. Brzinu korozije karakteriziraju kvalitativni i kvantitativnih pokazatelja. Do prvog ... ... Velika sovjetska enciklopedija
knjige
- Otpornost materijala na koroziju u agresivnim okruženjima kemijske industrije, G. Ya. Vorobieva. U knjizi su sažeti podaci o svojstvima i otpornosti na koroziju metalnih i nemetalnih materijala. Sadrži tablice i dijagrame otpornosti na koroziju metala i legura, ...
- Otpornost na koroziju i zaštita od korozije metala, praha i kompozitnih materijala, Vladimir Vasiljev. Ovaj priručnik posvećen je opisu otpornosti na koroziju najčešće korištenih u Moderna tehnologija i tehnologije građevinski materijali: željezo, čelik, lijevano željezo, aluminij,…
Ocjena otpornosti na koroziju
Za karakterizaciju korozijskih svojstava materijala, obično se ispituju na otpornost. protiv opće korozije, intergranularne korozije i naponske korozije.
Opća ispitivanja korozije. Opća ispitivanja korozije provode se na uzorcima s velikim omjerom površine i volumena. Korozivno okruženje odabire se uzimajući u obzir radne uvjete materijala. Ispitivanja se provode u tekućini uz stalno ili više puta ponovljeno naizmjenično uranjanje uzoraka, u kipuću otopinu soli, u paru ili ambijentalnu atmosferu.
Stopu korozije metala i legura karakterizira dubok indeks korozije h K , mm/godina - tab. 2 ili gubitak težine g K, g / (m 2 ∙ h) - tablica. 3.
Ponovno izračunavanje oba pokazatelja provodi se prema formuli:
h K = 8,76 g K / ρ,(1)
gdje h K - brzina korozije, mm/god;
ρ – gustoća, g/cm 3 ;
g K – gubitak težine uzorka, g/(m 2 h).
Karakteristike h K i g K pretpostavljaju jednoličnu koroziju i tipično predstavljaju površinski prosječne stope korozije. Međutim, poznato je da su lokalne vrste korozije najopasnije. Uz relativno mali ukupni gubitak metalne mase, dolazi do snažnog lokalnog razaranja strukture, što dovodi do prijevremenog kvara opreme.
tablica 2
Desetostepena skala otpornosti metala na koroziju prema dubini korozije
| Ocjena otpornosti na koroziju | Stopa korozije h K, mm/god | Grupa otpora |
| ≤ 0,001 | Potpuno otporan | |
| (> 0,001) – 0,005 | Vrlo otporan | |
| (> 0,005) – 0,01 | Vrlo otporan | |
| (> 0,01) – 0,05 | Uporan | |
| (> 0,05) – 0,1 | Uporan | |
| (> 0,1) – 0,5 | Uporno spušteno | |
| (> 0,5) – 1,0 | Uporno spušteno | |
| (> 1,0) – 5,0 | Nizak otpor | |
| (> 5,0) – 10,0 | Nizak otpor | |
| > 10,0 | nestabilan |
Tablica 3
Skala otpornosti na koroziju u deset točaka prema stopi korozije uzorka
| Osnovni rezultat elastičnost | Grupa otpora | Gubitak težine, g K, g / (m 2 ∙ h) | |||||
| Crni metali | Bakar i legure | Nikl i legure | Olovo i legure | Aluminij i legure | Magnezij i legure | ||
| Potpuno otporan | <0,0009 | <0,001 | <0,001 | <0,0012 | <0,0003 | <0,0002 | |
| Vrlo otporan | 0,0009-0,0045 | 0,001-0,0051 | 0,001-0,005 | 0,0012-0,0065 | 0,0003-0,0015 | 0,0002-0,001 | |
| Vrlo otporan | (>0,0045)-0,009 | (>0,0051)-0,01 | (>0,005)-0,01 | (>0,0065)-0,012 | (>0,0015)-0,003 | (>0,001)-0,002 | |
| Uporan | 0,009-0,045 | 0,01-0,051 | 0,01-0,05 | 0,012-0,065 | 0,003-0,015 | 0,002-0,01 | |
| Uporan | (>0,045)-0,09 | (>0,051)-0,1 | (>0,05)-0,1 | (>0,065)-0,12 | (>0,015)-0,03 | (>0,01)-0,02 | |
| Uporno spušteno | (>0,09)-0,45 | (>0,1)-0,5 | (>0,1)-0,5 | (>0,12)-0,65 | (>0,03)-0,15 | (>0,02)-0,1 | |
| Uporno spušteno | (>0,45)-0,9 | (>0,5)-1,02 | (>0,5)-1,0 | (>0,65)-1,2 | (>0,15)-0,31 | (>0,1)-0,2 | |
| Nizak otpor | (>0,9)-4,5 | (>1,02)-5,1 | (>1,0)-5,0 | (>1,2)-6,5 | (>0,31)-1,54 | (>0,2)-1,0 | |
| Nizak otpor | (>4,5)-9,1 | (>5,1)-10,2 | (>5,0)-10,0 | (>6,5)-12,0 | (>1,54)-3,1 | (>1,0)-2,0 | |
| nestabilan | >9,1 | >10,2 | >10,0 | >12,0 | >3,1 | >2,0 |
Stoga je potrebno provjeriti otpornost materijala na koroziju u specifičnim radnim uvjetima, posebno u slučajevima kada postoji opasnost od lokalne korozije.
Ispitivanja intergranularne korozije(GOST 6032-84). Glavni uzrok intergranularne korozije materijala otpornih na koroziju je zagrijavanje tijekom tlačne obrade ili zavarivanja, što dovodi do elektrokemijske heterogenosti između graničnih područja i volumena zrna.
Temperaturno-vremensko područje precipitacije duž granica zrna čelika otpornih na koroziju krom karbida prikazano je na sl. 4. Unutar njega je područje senzibilizacije - povećana osjetljivost na intergranularnu koroziju. Sklonost intergranularnoj koroziji očituje se u temperaturnom rasponu T max –T min za minimalno vrijeme τ min tijekom kojeg dolazi do preosjetljivosti.
Riža. 4. Područje temperaturno-vremenske sklonosti
austenitni čelik otporan na koroziju do intergranularne korozije (ICC) povezanu s iscrpljivanjem granica zrna u kromu:
T p je temperatura otapanja karbida; γ – austenit;
K - karbidi
Prilikom ispitivanja na MCC, krom čelici se podvrgavaju izazivačkom zagrijavanju na temperaturi od 1100 °C tijekom 30 sati, a krom-nikl austenitni čelici na temperaturi od oko 700 °C 60 sati. Nakon zagrijavanja uzorci se čuvaju tijekom dugo vremena u kipućoj vodenoj otopini sumporne ili dušične kiseline . Izbor vremena držanja i vrste korozivnog medija ovisi o specifičnoj vrsti čelika i njegovoj namjeni. Kako bi se kontrolirala sklonost ICC-u, uzorci se ili savijaju na trnu pod kutom od 90°, ili se podvrgavaju jetkanju posebnim reagensima i metalografskom ispitivanju. Odsutnost pukotina na površini uzorka ukazuje na njegovu otpornost na ICC.
Na sl. Slika 5 prikazuje mikrostrukturu čelika 08Kh18N10 nakon ispitivanja na međugranularnu koroziju u različitim medijima.

sl.5. Mikrostruktura čelika 08X18H10
nakon gašenja od 1050°C u vodi i temperiranja na 700°C:
a - intergranularna korozija tijekom ispitivanja
u otopini 25% HNO 3 + 40 g/l Cr 6+, trajanje 200 sati;
b - isto u otopini kipuće 65% HNO 3 + Cr 6+, × 500
Ispitivanja pucanja na koroziju pod naprezanjem. Ova vrsta ispitivanja provodi se kada je uzorak opterećen u korozivnom okruženju koje odgovara radnim uvjetima dijela. Okoliš ne smije uzrokovati opću koroziju i utjecati na neopterećene uzorke metala. Za austenitne krom-nikl čelike, primjer takvog medija je kipuća otopina mješavine soli MgCl 2 , NaCl i NaNO. Agresivnost medija ne smije biti manja od one u kojoj testirani materijali moraju poslužiti.
Ispitivanja pucanja na koroziju pod naprezanjem mogu se provoditi ili u uvjetima koji uzrokuju lom materijala (testovi na vlačnost, žilavost loma i zamor) ili određivanjem vremena prve pukotine. Posljednja vrsta ispitivanja sastoji se od pričvršćivanja opterećenih uzoraka posebnim uređajima ili stvaranjem naprezanja klinom u rezanim prstenovima. Vrijeme do pucanja karakterizira otpornost materijala na korozijsko pucanje pod naponom.
1. Navedite metode zaštite metala i legura od korozije.
2. Što određuje izbor metode zaštite od korozije?
3. Što je legiranje čelika?
4. Što su bimetali?
5. Koja se metoda koristi za izradu bimetala?
6. Što su inhibitori korozije?
7. Koji je mehanizam zaštite metala i legura od korozije korištenjem anodnih inhibitora?
8. Koji je mehanizam zaštite metala i legura od korozije korištenjem katodnih inhibitora?
9. Koje su prednosti korištenja hlapljivih inhibitora?
10. Koji oblik proizvoda je poželjniji za usporavanje procesa korozije?
11. Kako čistoća obrade dijelova utječe na brzinu korozije?
12. Što objašnjava visoku otpornost na koroziju aluminija i njegovih legura?
13. Navedite željezne legure koje su najotpornije na koroziju.
14. Navedi najotpornije na koroziju obojene legure.
15. Što određuje izbor vrste zaštite od korozije?
16. Koje se vrste korozije istražuju prilikom ispitivanja otpornosti na koroziju?
17. U kojem se korozivnom okruženju provode opća ispitivanja korozije?
18. Koji pokazatelji karakteriziraju brzinu korozije metala i legura?
19. Koja je dimenzija indeksa duboke korozije?
20. Koja je dimenzija gubitka mase uzorka tijekom korozije?
21. Kolika je stopa korozije materijala koji su potpuno otporni?
22. Kolika je stopa korozije materijala koji su vrlo otporni?
23. Kolika je stopa korozije otpornih materijala?
24. Kolika je stopa korozije materijala niske otpornosti?
25. Kolika je stopa korozije nestabilnih materijala?
26. Koliki je gubitak mase uzorka željezne legure s ocjenom otpornosti na koroziju 3?
27. Koliki je gubitak mase uzorka bakrene legure s ocjenom otpornosti na koroziju 7?
28. Koliki je gubitak mase uzorka legure nikla s ocjenom otpornosti na koroziju 4?
29. Koliki je gubitak mase uzorka legure olova s ocjenom otpornosti na koroziju 5?
30. Koliki je gubitak mase uzorka aluminijske legure s ocjenom otpornosti na koroziju 9?
31. Koliki je gubitak mase uzorka legure magnezija s ocjenom otpornosti na koroziju 10?
32. Koji je glavni uzrok intergranularne korozije?
33. Dešifrirajte marku legure 08X18H10.
34. U kojem se korozivnom okruženju provode ispitivanja korozijskog pucanja?
35. Kako se provode ispitivanja na korozijsko pucanje?
1. Osnovni pojmovi, pojmovi i definicije
Otpornost na koroziju- sposobnost materijala da izdrži djelovanje agresivnog okruženja (korozija).
Korozija (dt lat, corrosio - korozivno) - uništavanje materijala uslijed kemijske ili elektrokemijske interakcije s okolinom.
Građevinski materijali, a prvenstveno njihove površine, tijekom dugotrajnog rada uništavaju se uglavnom kao posljedica dvije vrste utjecaja: korozivnog, povezanog s utjecajem vanjskog, agresivnog okoliša na materijal, i erozivnog uzrokovanog mehaničkim djelovanjem.
Erozivna destrukcija se odvija intenzivno relativno brzo
rum koji pomiče medij ili materijal. Posebno veliku vrijednost erozija postiže kada materijal dođe u dodir s otopljenim metalima i troskom, kao i s plinovitim oksidantima itd.
Pojave korozije i erozije često prate jedna drugu, pa ih stoga nije uvijek moguće razdvojiti. U znanosti o građevinskim materijalima ovi se fenomeni razmatraju zasebno. U studiji se razmatraju procesi erozije operativna svojstva podne obloge, površina ceste itd.
2. Vrste korozije Građevinski materijal
Korozija građevinskih materijala razlikuje se prema vrsti korozivnog okoliša, prirodi razaranja i procesima koji se u njima odvijaju:
Korozivno okruženje:
Plin
Reaktivni plin;
tekućina:
Kiselina;
Sol;
alkalni;
marinac;
u talini:
metali;
silikati;
2) priroda uništenja:
Uniforma;
neravnomjerno:
Selektivno;
površan;
Pucanje;
lokalni;
Intergranular;
3) vrste utjecaja (procesa);
Kemijski;
elektrokemijski;
biološki;
Organogena.
Vrste korozivnog okruženja:
Plinska korozija je korozija u plinovito okruženje u potpunoj odsutnosti kondenzacije vlage na površini materijala. Ova vrsta korozije je sklona materijalima koji rade u uvjetima visoke temperature u suhom plinskom okruženju (keramika).
Plinska korozija se odnosi na procese kemijskog uništavanja. Njegova brzina ovisi; o prirodi materijala, njegovoj strukturi i svojstvima neoplazmi na njegovoj površini.
Tekuća korozija prirodni i umjetni kameni materijali, koji nastaju pod djelovanjem otopina elektrolita i neelektrolita, kao i raznih talina, uglavnom su kemijske prirode, iako se, ovisno o vrsti i svojstvima tekućine, razlikuju po nizu značajki .
Najvažnija značajka tekućine je prisutnost u njima sila međumolekularne interakcije. To je zbog dva svojstva tekućem stanju: molekularni tlak i s njim povezana površinska napetost.
Površinska napetost tekućine ima veliki utjecaj na intenzitet razaranja materijala, što je također određeno svojstvima vlaženja tekućine.
Priroda uništenja:
jednolična korozija nastaje kao posljedica djelovanja agresivnog okruženja s dovoljnom debljinom proizvoda i jednolikom raspodjelom tlačnih, savijajućih ili vlačnih naprezanja. Korozija ove vrste, za razliku od drugih, u mnogo manjoj mjeri utječe na svojstva čvrstoće materijala.
Neravnomjerna ili lokalizirana korozija(mrlje, čirevi, pruge) javlja se pri različitim koncentracijama agresivnog okoliša na pojedinim područjima ili heterogenosti samog materijala (njegovog sastava i strukture). Dakle, kao rezultat neravnomjerne raspodjele kristalne i staklaste faze u keramički materijal destrukcija korozije u njegovim pojedinim dijelovima nastavlja s različita brzina. U tom se slučaju proces razvija mnogo brže u staklastoj fazi nego u kristalnoj fazi. Prisutnost nehomogene poroznosti u materijalu također doprinosi stvaranju neravnomjerne korozije u materijalu.
Selektivna korozija karakteristika materijala u kojima jedna od komponenti tijekom formiranja strukture tvori lako topive spojeve. Tijekom rada, ti spojevi mogu prijeći u otopinu, stvarajući takozvanu "cvjetanje" na površini materijala.
Intergranularna korozija Nastaje kao rezultat uništavanja materijala duž granica zrna i brzo se širi duboko u materijal, oštro smanjujući njegova svojstva. Ova vrsta korozije svojstvena je nekim materijalima za pečenje, tijekom čijeg sinteriranja nastaju nove faze, čvrste otopine itd., a posljedično i međupovršine.
Djelovanje korozije u općem slučaju može imati dva u osnovi razni mehanizam: kemijska interakcija i otapanje.
Kemijska interakcija svodi se na reakciju između medija i materijala s stvaranjem novih spojeva. U prisutnosti nečistoća u agresivnom mediju, te u materijalu - aditivima, može doći do kemijskih reakcija između svih elemenata interakcije.
Ukoliko kamenih materijala su dielektrici i njihovu interakciju s agresivnim okruženjem ne prati pojava električnih struja, proces razaranja materijala naziva se kemijska korozija.
Pod utjecajem korozivnih medija na metale odvija se elektrokemijski proces prijenosa elektrona iz metalnog sloja s nižim električnim potencijalom u sloj s većim potencijalom i obnavljaju se elektropozitivni ioni, nakon čega slijedi uništavanje površinskog sloja. Ovaj proces uništavanja naziva se elektrokemijska korozija.
biološka korozija- uništavanje materijala pod izravnim utjecajem biljnih i životinjskih organizama, kao i mikroorganizama.
1. Viši biljni organizmi ( korijenski sustav, stabljike, lišće, sjemenke itd.) u procesu života proizvode različite vrste tvari, od kojih je većina agresivna u odnosu na građevinske materijale.
2. Živi organizmi uzrokuju biooštećenje materijala kako izravno svojim mehaničkim djelovanjem (glodavci, ptice, itd.), tako i produktima svoje životne aktivnosti.
3. Niži biljni organizmi i mikroorganizmi (alge, lišajevi, mahovine, gljive, bakterije i dr.) uništavaju površinske slojeve betona i stvaraju uvjete za propadanje drvenih konstrukcija.
Korozija koja je posljedica utjecaja proizvoda tehnološke obrade na građevinski materijal organska tvar kao nutrijent (voće, povrće, biljna ulja, krv, sokovi, masti itd.), a nebiogenog porijekla (nafta, ugljen, škriljci, školjkasti vapnenac, ispušni plinovi, čađa itd.), prihvaćeno je kao organogena korozija.