Poder calorífico del gas natural mJ kg. Poder calorífico de los gases
Leer también
El combustible de gas se divide en natural y artificial y es una mezcla de gases combustibles y no combustibles que contienen una cierta cantidad de vapor de agua y, a veces, polvo y alquitrán. Cantidad combustible gaseoso expresado en metros cúbicos en condiciones normales (760 mm Hg y 0 ° C), y la composición - en porcentaje en volumen. Bajo la composición del combustible, entienda la composición de su parte gaseosa seca.
combustible de gas natural
El combustible gaseoso más común es el gas natural, que tiene un alto poder calorífico. La base del gas natural es el metano, cuyo contenido es del 76,7 al 98%. Otros compuestos de hidrocarburos gaseosos forman parte del gas natural del 0,1 al 4,5%.
El gas licuado es un producto de la refinación del petróleo; consiste principalmente en una mezcla de propano y butano.
Gas natural (GNC, NG): metano CH4 más del 90 %, etano C2 H5 menos del 4 %, propano C3 H8 menos del 1 %
Gas licuado (GLP): propano C3 H8 más del 65%, butano C4 H10 menos del 35%
Los gases combustibles incluyen: hidrógeno H 2, metano CH 4, otros compuestos de hidrocarburos C m H n, sulfuro de hidrógeno H 2 S y gases no combustibles, dióxido de carbono CO2, oxígeno O 2, nitrógeno N 2 y una pequeña cantidad de vapor de agua H 2 O. Índices metro y PAG en C y H caracterizan compuestos de varios hidrocarburos, por ejemplo, para metano CH 4 t = 1 y norte= 4, para etano С 2 Н b t = 2 y norte= b etc
Composición del combustible gaseoso seco (en porcentaje por volumen):
CO + H 2 + 2 C m H norte + H2S + CO2 + O2 + N2 = 100%.
La parte no combustible del combustible gaseoso seco - lastre - es nitrógeno N y dióxido de carbono CO 2 .
La composición del combustible gaseoso húmedo se expresa de la siguiente manera:
CO + H 2 + Σ C metro H norte + H 2 S + CO 2 + O 2 + N 2 + H 2 O \u003d 100%.
El calor de combustión, kJ/m (kcal/m 3 ), 1 m 3 de gas seco puro en condiciones normales se determina de la siguiente manera:
Q n s \u003d 0.01,
donde Qco, Q n 2 , Q con m n n Q n 2 s. - calor de combustión de los gases individuales que componen la mezcla, kJ / m 3 (kcal / m 3); CO, H2, Cm H n , H 2 S - componentes que forman mezcla de gases, % por volumen.
El calor de combustión de 1 m3 de gas natural seco en condiciones normales para la mayoría de campos domésticos es de 33,29 - 35,87 MJ/m3 (7946 - 8560 kcal/m3). Las características del combustible gaseoso se dan en la tabla 1.
Ejemplo. Determinar el poder calorífico neto del gas natural (en condiciones normales) de la siguiente composición:
H2S = 1%; CH4 = 76,7%; C2H6 = 4,5%; C3H8 = 1,7%; C4H10 = 0,8%; C5H12 = 0,6%.
Sustituyendo en la fórmula (26) las características de los gases de la Tabla 1, obtenemos:
Q ns \u003d 0.01 \u003d 33981 kJ / m 3 o
Q ns \u003d 0.01 (5585.1 + 8555 76.7 + 15 226 4.5 + 21 795 1.7 + 28 338 0.8 + 34 890 0.6) \u003d 8109 kcal / m 3.
Tabla 1. Características del combustible gaseoso
|
Gas |
Designación |
Calor de combustión Q n s |
|
|
KJ/m3 |
kcal/m3 |
||
| Hidrógeno | H, | 10820 | 2579 |
| monóxido de carbono | ASI QUE | 12640 | 3018 |
| sulfuro de hidrógeno | H 2 S | 23450 | 5585 |
| Metano | Canal 4 | 35850 | 8555 |
| etano | C 2 H 6 | 63 850 | 15226 |
| Propano | C 3 H 8 | 91300 | 21795 |
| Butano | C 4 H 10 | 118700 | 22338 |
| pentano | C 5 H 12 | 146200 | 34890 |
| Etileno | C 2 H 4 | 59200 | 14107 |
| propileno | C 3 H 6 | 85980 | 20541 |
| butileno | C 4 H 8 | 113 400 | 27111 |
| Benceno | C 6 H 6 | 140400 | 33528 |
Las calderas del tipo DE consumen de 71 a 75 m3 de gas natural para producir una tonelada de vapor. El costo del gas en Rusia en septiembre de 2008 es de 2,44 rublos por metro cúbico. En consecuencia, una tonelada de vapor costará 71 × 2,44 = 173 rublos 24 kopeks. El costo real de una tonelada de vapor en las fábricas es de al menos 189 rublos por tonelada de vapor para las calderas DE.
Las calderas del tipo DKVR consumen de 103 a 118 m3 de gas natural para producir una tonelada de vapor. Mínimo costo estimado toneladas de vapor para estas calderas es 103 × 2,44 = 251 rublos 32 kopeks. El costo real del vapor para las plantas es de al menos 290 rublos por tonelada.
¿Cómo calcular el consumo máximo de gas natural para una caldera de vapor DE-25? eso especificaciones técnicas caldera. 1840 cubos por hora. Pero también se puede calcular. 25 toneladas (25 mil kg) hay que multiplicarlas por la diferencia entre las entalpías del vapor y del agua (666,9-105) y todo ello dividido por el rendimiento de la caldera del 92,8% y el calor de combustión del gas. 8300. y todo
Combustible de gas artificial
Los gases combustibles artificiales son combustibles locales, ya que tienen un poder calorífico mucho más bajo. Sus principales elementos combustibles son el monóxido de carbono CO y el hidrógeno H2. Estos gases se utilizan dentro de los límites de la producción donde se obtienen como combustible para plantas tecnológicas y de energía.
Todos los gases combustibles naturales y artificiales son explosivos, capaces de encenderse con una llama abierta o una chispa. Hay límites explosivos inferior y superior de gas, es decir, las concentraciones porcentuales más altas y más bajas en el aire. límite inferior la explosividad de los gases naturales varía del 3% al 6%, y la parte superior, del 12% al 16%. Todos los gases combustibles pueden causar envenenamiento del cuerpo humano. Las principales sustancias tóxicas de los gases combustibles son: monóxido de carbono CO, sulfuro de hidrógeno H2S, amoníaco NH3.
Tanto los gases combustibles naturales como los artificiales son incoloros (invisibles), inodoros, lo que los hace peligrosos cuando penetran en interior sala de calderas por fugas en accesorios de gasoductos. Para evitar el envenenamiento, los gases combustibles deben tratarse con un odorante, una sustancia con un olor desagradable.
Obtención de monóxido de carbono CO en la industria por gasificación de combustible sólido
Para fines industriales, el monóxido de carbono se obtiene por gasificación del combustible sólido, es decir, su transformación en combustible gaseoso. Entonces puede obtener monóxido de carbono de cualquier combustible sólido: carbón fósil, turba, leña, etc.
Proceso de gasificación combustible sólido se muestra en experiencia de laboratorio(Figura 1). Habiendo llenado el tubo refractario con trozos de carbón, lo calentamos fuertemente y dejamos pasar oxígeno a través del gasómetro. Dejar pasar los gases que salen del tubo por un lavador de agua con cal y luego prenderle fuego. El agua de cal se vuelve turbia, el gas arde con una llama azulada. Esto indica la presencia de dióxido de CO2 y monóxido de carbono CO en los productos de reacción.
La formación de estas sustancias puede explicarse por el hecho de que cuando el oxígeno entra en contacto con el carbón caliente, este último se oxida primero en dióxido de carbono: C + O 2 \u003d CO 2
Luego, pasando por brasas, dióxido de carbono parcialmente reducido a monóxido de carbono: CO 2 + C \u003d 2CO
Arroz. 1. Obtención de monóxido de carbono (experiencia de laboratorio).
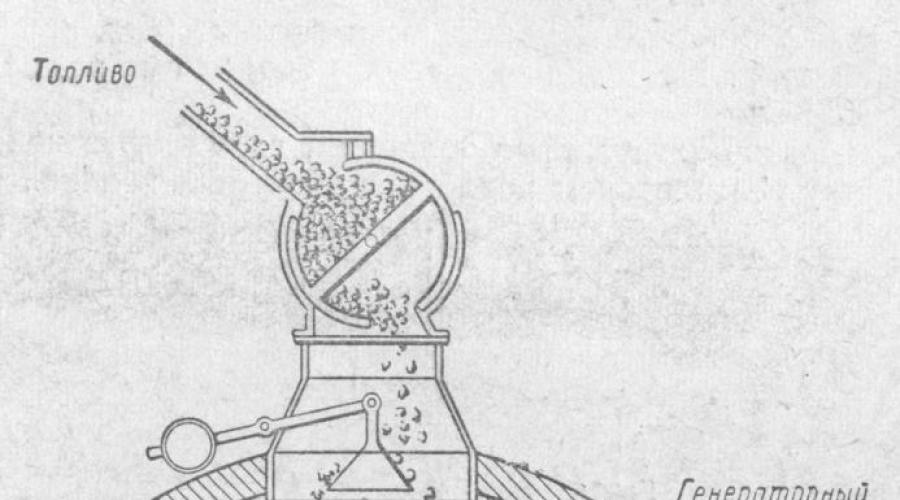
En condiciones industriales, la gasificación de combustibles sólidos se realiza en hornos llamados generadores de gas.
La mezcla resultante de gases se llama gas pobre.
El dispositivo generador de gas se muestra en la figura. Es un cilindro de acero con una altura de unos 5 metro y un diámetro de aproximadamente 3,5 metro, revestido interiormente con ladrillos refractarios. Desde arriba, el generador de gas se carga con combustible; Desde abajo, un ventilador suministra aire o vapor de agua a través de la rejilla.
El oxígeno del aire reacciona con el carbono del combustible, formando dióxido de carbono, el cual, ascendiendo a través de una capa de combustible caliente, es reducido por el carbono a monóxido de carbono.
Si solo se sopla aire en el generador, se obtiene un gas que en su composición contiene monóxido de carbono y nitrógeno del aire (así como una cierta cantidad de CO 2 y otras impurezas). Este gas generador se llama gas de aire.
Sin embargo, si se inyecta vapor de agua en el generador con carbón caliente, se forma monóxido de carbono e hidrógeno como resultado de la reacción: C + H 2 O \u003d CO + H 2
Esta mezcla de gases se llama gas de agua. El gas de agua tiene un valor calorífico más alto que el gas de aire, ya que, junto con el monóxido de carbono, también contiene un segundo gas combustible: el hidrógeno. Gas de agua (gas de síntesis), uno de los productos de la gasificación de los combustibles. El gas de agua se compone principalmente de CO (40%) y H2 (50%). El gas de agua es un combustible (valor calorífico 10.500 kJ/m3, o 2730 kcal/mg) y al mismo tiempo materia prima para la síntesis de metanol. Sin embargo, el gas de agua no se puede obtener durante mucho tiempo, ya que la reacción de su formación es endotérmica (con absorción de calor) y, por lo tanto, el combustible en el generador se enfría. Para mantener caliente el carbón, se alterna la inyección de vapor de agua en el generador con la inyección de aire, cuyo oxígeno, como es sabido, reacciona con el combustible para liberar calor.
Recientemente, el chorro de vapor y oxígeno se ha utilizado ampliamente para la gasificación de combustibles. El soplado simultáneo de vapor de agua y oxígeno a través de la capa de combustible permite llevar a cabo el proceso de forma continua, aumentar significativamente la productividad del generador y obtener gas con un alto contenido de hidrógeno y monóxido de carbono.
Los generadores de gas modernos son dispositivos poderosos acción continua
De modo que cuando se suministre combustible al generador de gas, combustible y gases venenosos no penetró en la atmósfera, el tambor de carga se hizo doble. Mientras el combustible ingresa a un compartimiento del tambor, el combustible se vierte desde el otro compartimiento hacia el generador; cuando el tambor gira, estos procesos se repiten, mientras que el generador permanece aislado de la atmósfera todo el tiempo. La distribución uniforme del combustible en el generador se realiza mediante un cono, que se puede instalar a diferentes alturas. Cuando se baja, el carbón se encuentra más cerca del centro del generador; cuando se eleva el cono, el carbón se lanza más cerca de las paredes del generador.
La eliminación de cenizas del generador de gas está mecanizada. La rejilla en forma de cono gira lentamente mediante un motor eléctrico. En este caso, las cenizas se desplazan hacia las paredes del generador y se arrojan al cenicero con dispositivos especiales, de donde se retiran periódicamente.
Las primeras lámparas de gas se encendieron en San Petersburgo en la isla Aptekarsky en 1819. El gas que se utilizó se obtuvo por gasificación del carbón. Se llamaba gas ligero.
El gran científico ruso D. I. Mendeleev (1834-1907) fue el primero en expresar la idea de que la gasificación del carbón se puede llevar a cabo directamente bajo tierra, sin levantarlo. El gobierno zarista no apreció la propuesta de Mendeleev.
La idea de la gasificación subterránea fue calurosamente apoyada por V. I. Lenin. Lo llamó "uno de los grandes triunfos de la tecnología". La gasificación subterránea fue realizada por primera vez por el estado soviético. Ya antes de la Gran Guerra Patria, los generadores subterráneos estaban operando en las cuencas de carbón de la región de Donetsk y Moscú en la Unión Soviética.
La Figura 3 da una idea de uno de los métodos de gasificación subterránea.Se colocan dos pozos en la veta de carbón, que están conectados en la parte inferior por un canal. Se prende fuego al carbón en un canal de este tipo cerca de uno de los pozos y se suministra la ráfaga allí. Los productos de combustión, moviéndose a lo largo del canal, interactúan con el carbón caliente, lo que resulta en la formación de gas combustible, como en un generador convencional. El gas sale a la superficie a través del segundo pozo.
El gas del generador es ampliamente utilizado para la calefacción. hornos industriales- metalúrgico, coque y como combustible en automóviles (Fig. 4).
Arroz. 3. Esquema de gasificación subterránea del carbón.
A partir del hidrógeno y el monóxido de carbono del gas de agua, se sintetiza una serie productos orgánicos como combustible líquido. Combustible líquido sintético - combustible (principalmente gasolina) obtenido por síntesis a partir de monóxido de carbono e hidrógeno a 150-170 grados Celsius y una presión de 0,7 - 20 MN / m2 (200 kgf / cm2), en presencia de un catalizador (níquel, hierro , cobalto ). La primera producción de sintético combustible líquido organizada en Alemania durante la 2ª Guerra Mundial debido a la falta de petróleo. Los combustibles líquidos sintéticos no han recibido una amplia distribución debido a su Alto costo. El gas de agua se utiliza para producir hidrógeno. Para ello, se calienta gas de agua en una mezcla con vapor de agua en presencia de un catalizador y como resultado se obtiene hidrógeno además del ya presente en el gas de agua: CO + H 2 O \u003d CO 2 + H 2
Las sustancias de origen orgánico incluyen combustibles que, cuando se queman, liberan una cierta cantidad de energía térmica. La generación de calor debe caracterizarse por una alta eficiencia y la ausencia de efectos secundarios en particular, las sustancias nocivas para la salud humana y el medio ambiente.
Para facilitar la carga en el horno. material de madera Corte dentro elementos individuales hasta 30 cm de largo Para aumentar la eficiencia de su uso, la leña debe estar lo más seca posible y el proceso de combustión debe ser relativamente lento. En muchos aspectos, la leña de tales madera dura como el roble y el abedul, el avellano y el fresno, el espino. Debido al alto contenido de resina, mayor velocidad combustión y bajo poder calorífico arboles coniferos son significativamente inferiores en este sentido.
Debe entenderse que la densidad de la madera afecta el valor del poder calorífico.
eso materiales naturales origen vegetal, extraído de roca sedimentaria.
Este tipo de combustible sólido contiene carbono y otros elementos químicos. Hay una división del material en tipos dependiendo de su edad. El lignito se considera el más joven, seguido de la hulla, y la antracita es la más antigua de todos los demás tipos. La edad de la sustancia combustible también determina su contenido de humedad, que está más presente en el material joven.
Durante la combustión del carbón, se contamina el medio ambiente y se forma escoria en la parrilla de la caldera, lo que, en cierta medida, crea un obstáculo para la combustión normal. La presencia de azufre en el material es también un factor desfavorable para la atmósfera, ya que este elemento se convierte en ácido sulfúrico en el espacio aéreo.
Sin embargo, los consumidores no deben temer por su salud. Los fabricantes de este material, atendiendo a los clientes particulares, buscan reducir el contenido de azufre en el mismo. El poder calorífico del carbón puede diferir incluso dentro del mismo tipo. La diferencia depende de las características de la subespecie y el contenido en ella. minerales, así como la geografía de la producción. Como combustible sólido, no solo se encuentra carbón puro, sino también escoria de carbón poco enriquecida prensada en briquetas.
Pellets (pellets de combustible) es un combustible sólido creado industrialmente a partir de residuos de madera y plantas: virutas, cortezas, cartón, paja.
La materia prima triturada al estado de polvo se seca y se vierte en el granulador, de donde ya sale en forma de gránulos. cierta forma. Para añadir viscosidad a la masa se utiliza un polímero vegetal, la lignina. Complejidad proceso de producción y alta demanda desde el costo de los gránulos. El material se utiliza en calderas especialmente equipadas.
Los tipos de combustible se determinan según el material del que se procesan:
- madera en rollo de árboles de cualquier especie;
- Paja;
- turba;
- cáscara de girasol.
Entre las ventajas que pastillas de combustible, cabe destacar las siguientes cualidades:
- respeto al medio ambiente;
- incapacidad para deformarse y resistencia a los hongos;
- facilidad de almacenamiento incluso al aire libre;
- uniformidad y duración de la quema;
- costo relativamente bajo;
- la posibilidad de usar para varios dispositivos de calefacción;
- tamaño de gránulo adecuado para descarga automática en una caldera especialmente equipada.
Briquetas
Las briquetas se denominan combustibles sólidos, en muchos aspectos similares a los gránulos. Para su fabricación se utilizan materiales idénticos: astillas de madera, virutas, turba, cascarilla y paja. Durante el proceso de producción, la materia prima se tritura y se forma en briquetas por compresión. Este material también es ambientalmente combustible limpio. Es conveniente almacenar incluso al aire libre. La combustión suave, uniforme y lenta de este combustible se puede observar tanto en chimeneas y estufas como en calderas de calefacción.
Las variedades de combustibles sólidos ambientalmente amigables discutidas anteriormente son una buena alternativa para generar calor. En comparación con las fuentes fósiles de energía térmica, que afectan negativamente a la combustión de medioambiente y son, además, no renovables, combustible alternativo tiene claras ventajas y un costo relativamente bajo, lo cual es importante para los consumidores de ciertas categorías.
Al mismo tiempo, el riesgo de incendio de dichos combustibles es mucho mayor. Por lo tanto, se deben tomar algunas precauciones con respecto a su almacenamiento y el uso de materiales de pared resistentes al fuego.
Combustibles líquidos y gaseosos
En cuanto a las sustancias combustibles líquidas y gaseosas, la situación es la siguiente.
Las tablas muestran la masa. calor especifico combustión de combustibles (líquidos, sólidos y gaseosos) y algunos otros materiales combustibles. Se consideran combustibles como: carbón, leña, coque, turba, queroseno, petróleo, alcohol, gasolina, gas natural, etc.
Lista de tablas:
En la reacción exotérmica de oxidación del combustible, su energía química se transforma en energía térmica con la liberación de una cierta cantidad de calor. el emergente energía térmica llamado calor de combustión del combustible. Depende de su composición química, humedad y es el principal. El poder calorífico del combustible, referido a 1 kg de masa o 1 m 3 de volumen, forma el poder calorífico específico másico o volumétrico.
El calor específico de combustión de un combustible es la cantidad de calor liberado durante combustión completa unidades de masa o volumen de un combustible sólido, líquido o gaseoso. En el Sistema Internacional de Unidades, este valor se mide en J/kg o J/m 3.
El calor específico de combustión de un combustible puede determinarse experimentalmente o calcularse analíticamente. Metodos experimentales definiciones valor calorífico Residencia en dimensión práctica la cantidad de calor liberado durante la combustión del combustible, por ejemplo, en un calorímetro con un termostato y una bomba de combustión. Para un combustible con una composición química conocida, el calor específico de combustión se puede determinar a partir de la fórmula de Mendeleev.
Hay calores específicos de combustión más altos y más bajos. El valor calorífico bruto es igual a el número máximo calor liberado durante la combustión completa del combustible, teniendo en cuenta el calor gastado en la evaporación de la humedad contenida en el combustible. Valor calorífico neto menos valor mayor por el valor del calor de condensación, que se forma a partir de la humedad del combustible y el hidrógeno de la masa orgánica, que se convierte en agua durante la combustión.
Determinar indicadores de calidad de combustibles, así como en cálculos termotécnicos Usualmente usan el calor específico de combustión más bajo., que es la más importante térmica y característica operativa combustible y se muestra en las siguientes tablas.
Calor específico de combustión de combustibles sólidos (carbón, leña, turba, coque)
La tabla muestra los valores del calor específico de combustión del combustible sólido seco en la unidad de MJ/kg. El combustible en la tabla está ordenado por nombre en orden alfabético.
De los combustibles sólidos considerados, el carbón de coque tiene el valor calorífico más alto: su calor específico de combustión es de 36,3 MJ/kg (o 36,3·10 6 J/kg en unidades SI). Además, el alto poder calorífico es característico del carbón, la antracita, carbón y lignito.
Los combustibles con baja eficiencia energética incluyen la madera, la leña, la pólvora, el freztorf y el esquisto bituminoso. Por ejemplo, el calor específico de combustión de la leña es 8,4 ... 12,5 y la pólvora, solo 3,8 MJ / kg.
| Combustible | |
|---|---|
| Antracita | 26,8…34,8 |
| Bolitas de madera (pillets) | 18,5 |
| leña seca | 8,4…11 |
| Leña seca de abedul | 12,5 |
| coque de gasolina | 26,9 |
| coque de alto horno | 30,4 |
| semicoque | 27,3 |
| Polvo | 3,8 |
| Pizarra | 4,6…9 |
| esquisto bituminoso | 5,9…15 |
| Sólido combustible para cohetes | 4,2…10,5 |
| Turba | 16,3 |
| turba fibrosa | 21,8 |
| Turba de molienda | 8,1…10,5 |
| migas de turba | 10,8 |
| carbón marron | 13…25 |
| Carbón pardo (briquetas) | 20,2 |
| Carbón pardo (polvo) | 25 |
| Carbón de Donetsk | 19,7…24 |
| Carbón | 31,5…34,4 |
| Carbón | 27 |
| Carbón de coque | 36,3 |
| Carbón de Kuznetsk | 22,8…25,1 |
| Carbón de Cheliábinsk | 12,8 |
| Carbón Ekibastuz | 16,7 |
| freztorf | 8,1 |
| Escoria | 27,5 |
Calor específico de combustión del combustible líquido (alcohol, gasolina, queroseno, aceite)
Se da la tabla de calor específico de combustión del combustible líquido y algunos otros líquidos orgánicos. Cabe señalar que los combustibles como la gasolina, el diésel y el aceite se caracterizan por una gran liberación de calor durante la combustión.
El calor específico de combustión del alcohol y la acetona es significativamente menor que el de los combustibles de motor tradicionales. Además, el combustible líquido para cohetes tiene un poder calorífico relativamente bajo y, con la combustión completa de 1 kg de estos hidrocarburos, se liberará una cantidad de calor igual a 9,2 y 13,3 MJ, respectivamente.
| Combustible | Calor específico de combustión, MJ/kg |
|---|---|
| Acetona | 31,4 |
| Gasolina A-72 (GOST 2084-67) | 44,2 |
| Gasolina de aviación B-70 (GOST 1012-72) | 44,1 |
| Gasolina AI-93 (GOST 2084-67) | 43,6 |
| Benceno | 40,6 |
| Combustible diesel de invierno (GOST 305-73) | 43,6 |
| Combustible diesel de verano (GOST 305-73) | 43,4 |
| Propelente líquido (queroseno + oxígeno líquido) | 9,2 |
| Queroseno de aviación | 42,9 |
| Queroseno de iluminación (GOST 4753-68) | 43,7 |
| xileno | 43,2 |
| Combustóleo con alto contenido de azufre | 39 |
| Combustóleo bajo en azufre | 40,5 |
| Combustóleo bajo en azufre | 41,7 |
| Combustible sulfuroso | 39,6 |
| Alcohol metílico (metanol) | 21,1 |
| alcohol n-butílico | 36,8 |
| Petróleo | 43,5…46 |
| Metano de petróleo | 21,5 |
| tolueno | 40,9 |
| Espíritu blanco (GOST 313452) | 44 |
| etilenglicol | 13,3 |
| Alcohol etílico (etanol) | 30,6 |
Calor específico de combustión de combustible gaseoso y gases combustibles
Se presenta una tabla del calor específico de combustión del combustible gaseoso y algunos otros gases combustibles en la dimensión de MJ/kg. De los gases considerados, difiere el mayor calor específico de masa de combustión. Con la combustión completa de un kilogramo de este gas, se liberarán 119,83 MJ de calor. Además, un combustible como el gas natural tiene un alto poder calorífico: el calor específico de combustión del gas natural es 41 ... 49 MJ / kg (para puro 50 MJ / kg).
| Combustible | Calor específico de combustión, MJ/kg |
|---|---|
| 1-buteno | 45,3 |
| Amoníaco | 18,6 |
| Acetileno | 48,3 |
| Hidrógeno | 119,83 |
| Hidrógeno, mezcla con metano (50% H 2 y 50% CH 4 en masa) | 85 |
| Hidrógeno, mezcla con metano y monóxido de carbono (33-33-33% en peso) | 60 |
| Hidrógeno, mezcla con monóxido de carbono (50 % H 2 50 % CO 2 en masa) | 65 |
| Gas de alto horno | 3 |
| gas de horno de coque | 38,5 |
| Gas licuado de hidrocarburos GLP (propano-butano) | 43,8 |
| isobutano | 45,6 |
| Metano | 50 |
| n-butano | 45,7 |
| n-hexano | 45,1 |
| n-pentano | 45,4 |
| gas asociado | 40,6…43 |
| Gas natural | 41…49 |
| Propadien | 46,3 |
| Propano | 46,3 |
| propileno | 45,8 |
| Propileno, mezcla con hidrógeno y monóxido de carbono (90%-9%-1% en peso) | 52 |
| etano | 47,5 |
| Etileno | 47,2 |
Calor específico de combustión de algunos materiales combustibles
Se da una tabla del calor específico de combustión de algunos materiales combustibles (madera, papel, plástico, paja, caucho, etc.). Cabe señalar los materiales con alta liberación de calor durante la combustión. Estos materiales incluyen: caucho varios tipos, poliestireno expandido (styrofoam), polipropileno y polietileno.
| Combustible | Calor específico de combustión, MJ/kg |
|---|---|
| Papel | 17,6 |
| Polipiel | 21,5 |
| Madera (barras con un contenido de humedad del 14%) | 13,8 |
| Madera en pilas | 16,6 |
| madera de roble | 19,9 |
| Madera de abeto | 20,3 |
| madera verde | 6,3 |
| madera de pino | 20,9 |
| Kapron | 31,1 |
| Productos de carbolito | 26,9 |
| Cartulina | 16,5 |
| Caucho de estireno-butadieno SKS-30AR | 43,9 |
| Caucho natural | 44,8 |
| Caucho sintético | 40,2 |
| Caucho SCS | 43,9 |
| Caucho de cloropreno | 28 |
| Linóleo de cloruro de polivinilo | 14,3 |
| Linóleo de cloruro de polivinilo de dos capas | 17,9 |
| Cloruro de polivinilo de linóleo a base de fieltro | 16,6 |
| Cloruro de polivinilo de linóleo sobre una base tibia | 17,6 |
| Cloruro de polivinilo de linóleo a base de tela | 20,3 |
| Caucho de linóleo (relin) | 27,2 |
| Sólido de parafina | 11,2 |
| Poliespuma PVC-1 | 19,5 |
| Poliespuma FS-7 | 24,4 |
| Poliespuma FF | 31,4 |
| Poliestireno expandido PSB-S | 41,6 |
| espuma de poliuretano | 24,3 |
| fibra vulcanizada | 20,9 |
| Cloruro de polivinilo (PVC) | 20,7 |
| policarbonato | 31 |
| polipropileno | 45,7 |
| Poliestireno | 39 |
| Polietileno de alta densidad | 47 |
| Polietileno de baja presión | 46,7 |
| Caucho | 33,5 |
| ruberoide | 29,5 |
| Canal de hollín | 28,3 |
| Heno | 16,7 |
| Paja | 17 |
| Vidrio orgánico (plexiglás) | 27,7 |
| Textolita | 20,9 |
| tol | 16 |
| TNT | 15 |
| Algodón | 17,5 |
| Celulosa | 16,4 |
| Lana y fibras de lana | 23,1 |
Fuentes:
- GOST 147-2013 Combustible mineral sólido. Determinación del poder calorífico superior y cálculo del poder calorífico inferior.
- GOST 21261-91 Productos derivados del petróleo. Método de determinación del poder calorífico bruto y cálculo del poder calorífico neto.
- GOST 22667-82 Gases naturales combustibles. Método de cálculo para determinar el poder calorífico, la densidad relativa y el número de Wobbe.
- GOST 31369-2008 Gas natural. Cálculo del poder calorífico, la densidad, la densidad relativa y el número de Wobbe en función de la composición de los componentes.
- Zemsky G. T. Propiedades inflamables de inorgánicos y materiales orgánicos: libro de referencia M.: VNIIPO, 2016 - 970 p.
El calor de combustión está determinado por la composición química de la sustancia combustible. Los elementos químicos contenidos en la sustancia combustible se designan mediante los símbolos aceptados DE , H , O , norte , S, y la ceniza y el agua son símbolos Y y W respectivamente.
YouTube enciclopédico
-
1 / 5
El calor de combustión se puede relacionar con la masa de trabajo del combustible. Q PAGS (\displaystyle Q^(P)), es decir, a una sustancia combustible en la forma en que ingresa al consumidor; a la materia seca Q C (\displaystyle Q^(C)); a la masa combustible de la materia Q Γ (\displaystyle Q^(\Gamma )), es decir, a una sustancia combustible que no contenga humedad y cenizas.
Distinguir más alto ( Q segundo (\displaystyle Q_(B))) y más bajo ( QH (\displaystyle Q_(H))) Calor de combustión.
Por debajo mayor poder calorífico comprender la cantidad de calor que se libera durante la combustión completa de una sustancia, incluido el calor de condensación del vapor de agua durante el enfriamiento de los productos de la combustión.
Valor calorífico neto corresponde a la cantidad de calor que se desprende durante la combustión completa, sin tener en cuenta el calor de condensación del vapor de agua. El calor de condensación del vapor de agua también se llama calor latente de vaporización (condensación).
El poder calorífico inferior y superior están relacionados por la relación: Q segundo = Q H + k (W + 9 H) (\displaystyle Q_(B)=Q_(H)+k(W+9H)),
donde k es un coeficiente igual a 25 kJ/kg (6 kcal/kg); W - la cantidad de agua en la sustancia combustible,% (en peso); H es la cantidad de hidrógeno en la sustancia combustible, % (en masa).
Cálculo del calor de combustión
Así, el poder calorífico superior es la cantidad de calor liberado durante la combustión completa de una unidad de masa o volumen (para gas) de una sustancia combustible y el enfriamiento de los productos de combustión a la temperatura del punto de rocío. En los cálculos de ingeniería térmica, el poder calorífico bruto se toma como 100%. El calor latente de combustión del gas es el calor que se libera durante la condensación del vapor de agua contenido en los productos de la combustión. En teoría, puede llegar al 11%.
En la práctica, no es posible enfriar los productos de la combustión hasta la completa condensación, por lo que se introduce el concepto de poder calorífico neto (QHp), que se obtiene restando al poder calorífico superior el calor de vaporización del vapor de agua, ambos contenidos en la sustancia y se forma durante su combustión. Se gastan 2514 kJ/kg (600 kcal/kg) en la vaporización de 1 kg de vapor de agua. El poder calorífico neto viene determinado por las fórmulas (kJ/kg o kcal/kg):
Q H PAGS = Q segundo PAGS − 2514 ⋅ ((9 H PAGS + W PAGS) / 100) (\displaystyle Q_(H)^(P)=Q_(B)^(P)-2514\cdot ((9H^(P)+W^ (P))/100))(para sólido)
Q H PAGS = Q segundo PAGS − 600 ⋅ ((9 H PAGS + W PAGS) / 100) (\displaystyle Q_(H)^(P)=Q_(B)^(P)-600\cdot ((9H^(P)+W^ (P))/100))(por sustancia liquida), donde:
2514 - calor de vaporización a 0 °C y presión atmosférica, kJ/kg;
H PAGS (\displaystyle H^(P)) y W PAGS (\displaystyle W^(P))- el contenido de hidrógeno y vapor de agua en el combustible de trabajo,%;
9 es un coeficiente que muestra que cuando se quema 1 kg de hidrógeno en combinación con oxígeno, se forman 9 kg de agua.
El calor de combustión es el más característica importante combustible, ya que determina la cantidad de calor que se obtiene al quemar 1 kg de combustible sólido o líquido o 1 m³ de combustible gaseoso en kJ/kg (kcal/kg). 1 kcal = 4,1868 o 4,19 kJ.
El poder calorífico neto se determina experimentalmente para cada sustancia y es un valor de referencia. También se puede determinar para sólidos y materiales líquidos, con una composición elemental conocida, por cálculo de acuerdo con la fórmula de D. I. Mendeleev, kJ / kg o kcal / kg:
Q H PAGS = 339 ⋅ C PAGS + 1256 ⋅ H PAGS − 109 ⋅ (O PAGS − S L PAGS) − 25,14 ⋅ (9 ⋅ H PAGS + W PAGS) (\displaystyle Q_(H)^(P)=339\cdot C^(P)+1256\ cdot H^(P)-109\cdot (O^(P)-S_(L)^(P))-25.14\cdot (9\cdot H^(P)+W^(P)))
Q H PAGS = 81 ⋅ C PAGS + 246 ⋅ H PAGS − 26 ⋅ (O PAGS + S L PAGS) − 6 ⋅ W PAGS (\displaystyle Q_(H)^(P)=81\cdot C^(P)+246\cdot H^(P) -26\cdot (O^(P)+S_(L)^(P))-6\cdot W^(P)), donde:
C PAGS (\displaystyle C_(P)), H PAGS (\displaystyle H_(P)), O PAGS (\displaystyle O_(P)), S L PAG (\displaystyle S_(L)^(P)), W PAGS (\displaystyle W_(P))- el contenido de carbono, hidrógeno, oxígeno, azufre volátil y humedad en la masa de trabajo del combustible en% (en masa).
Para los cálculos comparativos se utiliza el denominado Combustible Convencional, que tiene un calor específico de combustión igual a 29308 kJ/kg (7000 kcal/kg).
En Rusia cálculos térmicos(por ejemplo, cálculo de la carga de calor para determinar la categoría del local para explosión e incendio peligro de incendio) generalmente se llevan a cabo de acuerdo con el valor calorífico más bajo, en los EE. UU., Gran Bretaña, Francia, de acuerdo con el más alto. En el Reino Unido y los Estados Unidos, antes de la introducción del sistema métrico, el poder calorífico se medía en unidades térmicas británicas (BTU) por libra (lb) (1 Btu/lb = 2,326 kJ/kg).
Sustancias y materiales Valor calorífico neto Q H PAGS (\displaystyle Q_(H)^(P)), MJ/kg Gasolina 41,87 Queroseno 43,54 Papel: libros, revistas 13,4 Madera (barras W = 14%) 13,8 Caucho natural 44,73 Linóleo de cloruro de polivinilo 14,31 Caucho 33,52 fibra cortada 13,8 Polietileno 47,14 espuma de poliestireno 41,6 Algodón aflojado 15,7 El plastico 41,87 Clasificación de los gases combustibles
Para el suministro de gas de ciudades y empresas industriales Se utilizan varios gases combustibles, que difieren en origen, composición química y propiedades físicas.
Por origen, los gases combustibles se dividen en naturales, o naturales y artificiales, producidos a partir de combustibles sólidos y líquidos.
gases naturales extraído de pozos de campos de gas puro o campos de petróleo junto con el petróleo. Los gases de los yacimientos petrolíferos se denominan gases asociados.
Los gases de los yacimientos de gas puro consisten principalmente en metano con un pequeño contenido de hidrocarburos pesados. Se caracterizan por la constancia de composición y poder calorífico.
Los gases asociados, junto con el metano, contienen una cantidad importante de hidrocarburos pesados (propano y butano). La composición y el poder calorífico de estos gases varían ampliamente.
Los gases artificiales se producen en especial plantas de gas- u obtenido como subproducto de la combustión del carbón en plantas metalúrgicas, así como en refinerías de petróleo.
Los gases producidos a partir del carbón se utilizan en nuestro país para el suministro de gas urbano en cantidades muy limitadas, y Gravedad específica están disminuyendo todo el tiempo. Al mismo tiempo, crece la producción y el consumo de gases de hidrocarburos licuados, obtenidos a partir de los gases asociados del petróleo en plantas de gas-gasolina y refinerías de petróleo durante la refinación del petróleo. Líquido gases de hidrocarburo utilizados para el suministro de gas urbano, se componen principalmente de propano y butano.
Composición de los gases
El tipo de gas y su composición predeterminan en gran medida el alcance del gas, el esquema y diámetros de la red de gas, Decisiones constructivas quemadores de gas y unidades individuales de gasoductos.
El consumo de gas depende del valor calorífico y, por tanto, de los diámetros de los gasoductos y de las condiciones de combustión del gas. Al usar gas en plantas industriales la temperatura de combustión y la velocidad de propagación de la llama y la constancia de la composición del combustible gaseoso son muy importantes.La composición de los gases, así como sus propiedades físico-químicas, dependen principalmente del tipo y método de obtención de los gases.
Los gases combustibles son mezclas mecanicas varios gases<как горючих, так и негорючих.
La parte combustible del combustible gaseoso incluye: hidrógeno (H 2) - un gas sin color, sabor y olor, su poder calorífico inferior es 2579 kcal / nanómetro 3 \ metano (CH 4) - un gas incoloro, insípido e inodoro, es la principal parte combustible de los gases naturales, su poder calorífico inferior es 8555 kcal/nm 3; monóxido de carbono (CO) - un gas incoloro, insípido e inodoro, obtenido de la combustión incompleta de cualquier combustible, muy tóxico, poder calorífico inferior 3018 kcal/nm 3; hidrocarburos pesados (C p N t), por este titulo<и формулой обозначается целый ряд углеводородов (этан - С2Н 6 , пропан - С 3 Нв, бутан- С4Н 10 и др.), низшая теплотворная способность этих газов колеблется от 15226 до 34890 kcal/nm*.
La parte no combustible del combustible gaseoso incluye: dióxido de carbono (CO 2), oxígeno (O 2) y nitrógeno (N 2).
La parte no combustible de los gases se denomina lastre. Los gases naturales se caracterizan por un alto poder calorífico y ausencia total de monóxido de carbono. Al mismo tiempo, varios campos, principalmente gas y petróleo, contienen un gas muy tóxico (y corrosivo) - sulfuro de hidrógeno (H 2 S). La mayoría de los gases de carbón artificial contienen una cantidad significativa de gas altamente tóxico - monóxido de carbono (CO ).La presencia de óxido en el gas carbónico y otras sustancias tóxicas es altamente indeseable, ya que complican la producción del trabajo operativo y aumentan el peligro al usar gas.Además de los componentes principales, la composición de los gases incluye varias impurezas, el cuyo valor específico es insignificante en términos porcentuales. Sin embargo, dado que miles e incluso millones de metros cúbicos de gas, la cantidad total de impurezas alcanza un valor significativo. Muchas impurezas caen en los gasoductos, lo que finalmente conduce a una disminución de su rendimiento y, a veces, a un cese completo del flujo de gas. Por lo tanto, la presencia de impurezas en el gas debe tenerse en cuenta tanto en el diseño de gasoductos , así como durante la operación.
La cantidad y composición de las impurezas depende del método de producción o extracción del gas y del grado de su purificación. Las impurezas más dañinas son el polvo, el alquitrán, la naftalina, la humedad y los compuestos de azufre.
El polvo aparece en el gas durante la producción (extracción) o durante el transporte de gas a través de tuberías. La resina es un producto de la descomposición térmica del combustible y acompaña a muchos gases artificiales. En presencia de polvo en el gas, la resina contribuye a la formación de tapones de lodo bituminoso y obstrucciones en los gasoductos.
La naftalina se encuentra comúnmente en los gases de carbón artificial. A bajas temperaturas, la naftalina precipita en las tuberías y, junto con otras impurezas sólidas y líquidas, reduce el área de flujo de los gasoductos.
Casi todos los gases naturales y artificiales contienen humedad en forma de vapores. Ingresa a los gases naturales en el propio campo de gas debido a los contactos de los gases con la superficie del agua, y los gases artificiales se saturan con agua durante el proceso de producción.La presencia de humedad en el gas en cantidades significativas es indeseable, ya que reduce el poder calorífico. del gas Además, tiene una alta capacidad calorífica de vaporización, la humedad durante la combustión del gas se lleva una cantidad significativa de calor junto con los productos de combustión a la atmósfera. se enfría durante la "carga de su movimiento a través de las tuberías, puede crear tapones de agua en la tubería de gas (en los puntos inferiores) para ser eliminado. Esto requiere la instalación de colectores de condensados especiales y su bombeo.
Los compuestos de azufre, como ya se señaló, incluyen sulfuro de hidrógeno, así como disulfuro de carbono, mercaptano, etc. Estos compuestos no solo afectan negativamente la salud humana, sino que también causan una corrosión significativa de las tuberías.
Otras impurezas dañinas incluyen amoníaco y compuestos de cianuro, que se encuentran principalmente en los gases de carbón. La presencia de compuestos de amoníaco y cianuro conduce a una mayor corrosión del metal de la tubería.
La presencia de dióxido de carbono y nitrógeno en los gases combustibles tampoco es deseable. Estos gases no participan en el proceso de combustión, siendo un lastre que reduce el poder calorífico, lo que provoca un aumento del diámetro de los gasoductos y una disminución de la eficiencia económica del uso de combustible gaseoso.
La composición de los gases utilizados para el suministro de gas urbano debe cumplir con los requisitos de GOST 6542-50 (Tabla 1).
tabla 1
Los valores promedio de la composición de los gases naturales de los campos más famosos del país se presentan en la Tabla. 2.
De campos de gas (secos)
Ucrania occidental. . . 81,2 7,5 4,5 3,7 2,5 - . 0,1 0,5 0,735 Shebelinskoe ............................... 92,9 4,5 0,8 0,6 0,6 ____ . 0,1 0,5 0,603 región de Stavropol. . 98,6 0,4 0,14 0,06 - 0,1 0,7 0,561 Región de Krasnodar. . 92,9 0,5 - 0,5 _ 0,01 0,09 0,595 Sarátov ............................... 93,4 2,1 0,8 0,4 0,3 huellas 0,3 2,7 0,576 Gazli, región de Bujara 96,7 0,35 0,4" 0,1 0,45 0,575 De campos de petróleo y gas (asociados) Romashkino ............................... 18,5 6,2 4,7 0,1 11,5 1,07 7,4 4,6 ____ huellas 1,112 __ . Tuymazy ............................................. 18,4 6,8 4,6 ____ 0,1 7,1 1,062 - Ceniciento....... 23,5 9,3 3,5 ____ 0,2 4,5 1,132 - Atrevido.......... ............................. . 2,5 . ___ . 1,5 0,721 - Aceite de syzran ............................... 31,9 23,9 - 5,9 2,7 0,8 1,7 1,6 31,5 0,932 - Ishimbay ............................... 42,4 20,5 7,2 3,1 2,8 1,040 _ Andiján. ............................... 66,5 16,6 9,4 3,1 3,1 0,03 0,2 4,17 0,801 ; Poder calorífico de los gases
La cantidad de calor liberado durante la combustión completa de una cantidad unitaria de combustible se denomina valor calorífico (Q) o, como a veces se le llama, valor calorífico o valor calórico, que es una de las principales características del combustible.
El valor calorífico de los gases se suele denominar 1 metro 3, tomado en condiciones normales.
En los cálculos técnicos, se entiende por condiciones normales el estado del gas a una temperatura igual a 0 °C, y, a una presión de 760 mmHg Arte. El volumen de gas en estas condiciones se denota nm 3(metro cúbico normal).
Para mediciones de gases industriales de acuerdo con GOST 2923-45, la temperatura de 20 ° C y la presión de 760 se toman como condiciones normales mmHg Arte. El volumen de gas referido a estas condiciones, en contraste con nm 3 llamaremos metro 3 (metro cúbico).
Poder calorífico de los gases (Q)) Expresado en kcal/nm e o en kcal/m3.
Para gases licuados, el poder calorífico se refiere a 1 kg.
Los hay de mayor (Qin) y de menor (Qn) poder calorífico. El poder calorífico bruto tiene en cuenta el calor de condensación del vapor de agua formado durante la combustión del combustible. El poder calorífico neto no tiene en cuenta el calor contenido en el vapor de agua de los productos de la combustión, ya que el vapor de agua no se condensa, sino que se lleva con los productos de la combustión.
Los conceptos de Qin y Qn se aplican solo a aquellos gases durante cuya combustión se libera vapor de agua (estos conceptos no se aplican al monóxido de carbono, que no da vapor de agua durante la combustión).
Cuando el vapor de agua se condensa, se libera calor igual a 539 kcal/kg. Además, cuando el condensado se enfría a 0 °C (o 20 °C), se libera calor, respectivamente, en la cantidad de 100 u 80 kcal/kg.
En total, debido a la condensación del vapor de agua, se libera calor más de 600 kcal/kg, que es la diferencia entre el valor calorífico bruto y neto del gas. Para la mayoría de los gases utilizados en el suministro de gas urbano, esta diferencia es del 8-10%.
Los valores del poder calorífico de algunos gases se dan en la tabla. 3.
Para el suministro de gas urbano, actualmente se utilizan gases que, por regla general, tienen un poder calorífico de al menos 3500 kcal/nm 3. Esto se explica por el hecho de que, en las condiciones de las ciudades, el gas se suministra a través de tuberías a distancias considerables. Con un poder calorífico bajo, se requiere suministrar una gran cantidad. Esto conduce inevitablemente a un aumento de los diámetros de los gasoductos y, como consecuencia, a un aumento de las inversiones metálicas y de los fondos para la construcción de las redes de gas y, consecuentemente, a un aumento de los costos de operación. Una desventaja importante de los gases hipocalóricos es que en la mayoría de los casos contienen una cantidad importante de monóxido de carbono, lo que aumenta el peligro al usar gas, así como al realizar el mantenimiento de redes e instalaciones.
Gas con poder calorífico inferior a 3500 kcal/nm 3 se utiliza con mayor frecuencia en la industria, donde no es necesario transportarlo largas distancias y es más fácil organizar la incineración. Para el suministro de gas urbano, es deseable tener un poder calorífico de gas constante. Las fluctuaciones, como ya hemos establecido, no se permiten más del 10%. Un cambio mayor en el poder calorífico del gas requiere un nuevo ajuste y, a veces, un cambio en una gran cantidad de quemadores unificados para electrodomésticos, lo que se asocia con dificultades significativas.