Cálculo dos efeitos térmicos das reações químicas. Calor de reação e cálculos termoquímicos
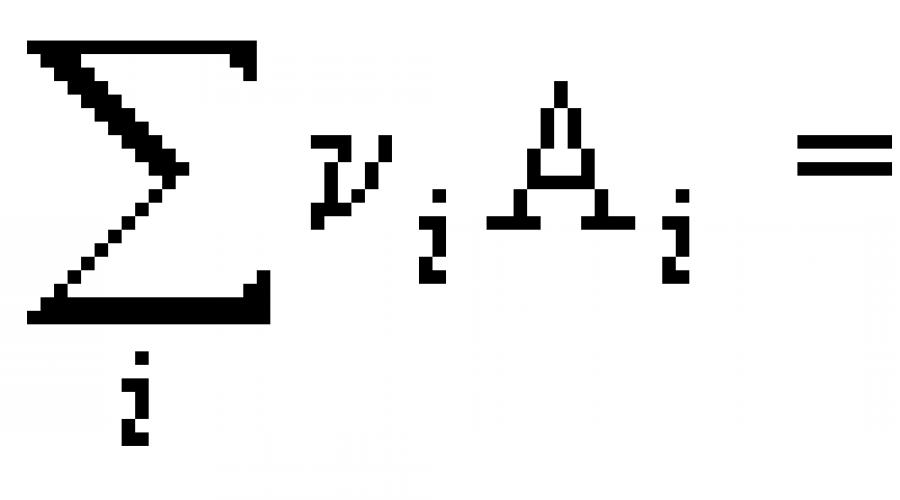
Leia também
Estudos termoquímicos efeitos térmicos reações químicas. Em muitos casos, estas reações ocorrem a volume constante ou pressão constante. Da primeira lei da termodinâmica segue-se que nestas condições o calor é uma função do estado. A volume constante, o calor é igual à variação energia interna:
e a pressão constante - a mudança na entalpia:
Essas igualdades, quando aplicadas às reações químicas, constituem a essência Lei de Hess:
O efeito térmico de uma reação química que ocorre a pressão constante ou volume constante não depende do caminho da reação, mas é determinado apenas pelo estado dos reagentes e produtos da reação.
Em outras palavras, o efeito térmico de uma reação química é igual à mudança na função de estado.
Na termoquímica, ao contrário de outras aplicações da termodinâmica, o calor é considerado positivo se for liberado em ambiente, ou seja Se H < 0 или você
< 0. Под тепловым эффектом химической реакции
понимают значение H(que é simplesmente chamada de "entalpia de reação") ou você reações.
Se a reação ocorrer em solução ou na fase sólida, onde a variação de volume é desprezível, então
H = você + (pV) você. (3.3)
Se gases ideais participam da reação, então a temperatura constante
H = você + (pV) = você+n. TR, (3.4)
onde n é a mudança no número de moles de gases na reação.
Para facilitar a comparação de entalpias de diferentes reações, utiliza-se o conceito de “estado padrão”. O estado padrão é o estado de uma substância pura a uma pressão de 1 bar (= 10 5 Pa) e uma determinada temperatura. Para gases, este é um estado hipotético a uma pressão de 1 bar, tendo as propriedades de um gás infinitamente rarefeito. Entalpia de reação entre substâncias em estados padrão à temperatura T, denotar ( R significa "reação"). As equações termoquímicas indicam não apenas as fórmulas das substâncias, mas também seus estados agregados ou modificações cristalinas.
Da lei de Hess decorrem consequências importantes, que permitem calcular as entalpias das reações químicas.
Corolário 1.
![]()
igual à diferença entre as entalpias padrão de formação dos produtos de reação e reagentes (levando em consideração os coeficientes estequiométricos):
Entalpia padrão (calor) de formação de uma substância (f significa "formação") a uma determinada temperatura é a entalpia da reação de formação de um mol desta substância de elementos, que estão no estado padrão mais estável. De acordo com esta definição, a entalpia de formação do mais estável substâncias simples no estado padrão é igual a 0 em qualquer temperatura. As entalpias padrão de formação de substâncias a uma temperatura de 298 K são fornecidas em livros de referência.
O conceito de “entalpia de formação” é utilizado não apenas para substâncias comuns, mas também para íons em solução. Neste caso, o íon H + é tomado como ponto de referência, para o qual a entalpia padrão de formação em solução aquosa é considerada zero: ![]()
Corolário 2. Entalpia padrão de uma reação química
![]()
igual à diferença entre as entalpias de combustão dos reagentes e produtos de reação (levando em consideração os coeficientes estequiométricos):
(c significa "combustão"). A entalpia padrão (calor) de combustão de uma substância é a entalpia da reação de oxidação completa de um mol de uma substância. Esta consequência é geralmente usada para calcular os efeitos térmicos das reações orgânicas.
Corolário 3. A entalpia de uma reação química é igual à diferença nas energias das ligações químicas que estão sendo quebradas e daquelas formadas.
Energia da comunicação A-B nomeie a energia necessária para quebrar uma ligação e separar as partículas resultantes em uma distância infinita:
AB (g) A (g) + B (g) .
A energia da comunicação é sempre positiva.
A maioria dos dados termoquímicos em livros de referência são fornecidos a uma temperatura de 298 K. Para calcular os efeitos térmicos em outras temperaturas, use Equação de Kirchhoff:
(forma diferencial) (3.7)
 (forma integral) (3.8)
(forma integral) (3.8)
Onde Cp- a diferença nas capacidades térmicas isobáricas dos produtos de reação e materiais iniciais. Se a diferença T 2 - T 1 é pequeno, então você pode aceitar Cp= const. No grande diferença temperaturas devem ser usadas dependência da temperatura Cp(T) tipo:
onde estão os coeficientes a, b, c etc. para substâncias individuais são retiradas do livro de referência e o sinal indica a diferença entre os produtos e os reagentes (levando em consideração os coeficientes).
EXEMPLOS
Exemplo 3-1. As entalpias padrão de formação de água líquida e gasosa a 298 K são -285,8 e -241,8 kJ/mol, respectivamente. Calcule a entalpia de vaporização da água nesta temperatura.
Solução. As entalpias de formação correspondem às seguintes reações:
H 2 (g) + SO 2 (g) = H 2 O (l), H 1 0 = -285.8;
H 2 (g) + SO 2 (g) = H 2 O (g), H 2 0 = -241.8.
A segunda reação pode ser realizada em duas etapas: primeiro, queimar hidrogênio para formar água líquida de acordo com a primeira reação e depois evaporar a água:
H 2 O (l) = H 2 O (g), H 0 isp = ?
Então, de acordo com a lei de Hess,
H 1 0 + H 0 isp = H 2 0 ,
onde H 0 isp = -241,8 - (-285,8) = 44,0 kJ/mol.
Responder. 44,0kJ/mol.
Exemplo 3-2. Calcular a entalpia da reação
6C (g) + 6H (g) = C 6 H 6 (g)
a) por entalpias de formação; b) por energias de ligação, supondo que as ligações duplas na molécula C 6 H 6 sejam fixas.
Solução. a) As entalpias de formação (em kJ/mol) são encontradas no livro de referência (por exemplo, P.W. Atkins, Physical Chemistry, 5ª edição, pp. C9-C15): fH 0 (C 6 H 6 (g)) = 82,93, fH 0 (C (g)) = 716,68, fH 0 (H(g)) = 217,97. A entalpia da reação é:
UR 0 = 82,93 - 6.716,68 - 6.217,97 = -5.525 kJ/mol.
b) Nesta reação ligações químicas não quebre, mas apenas forme. Na aproximação das ligações duplas fixas, a molécula C 6 H 6 contém 6 ligações CH, 3 ligações CC e 3 ligações C=C. Energias de ligação (em kJ/mol) (P.W.Atkins, Physical Chemistry, 5ª edição, p. C7): E(CH) = 412, E(CC) = 348, E(C=C) = 612. A entalpia da reação é:
UR 0 = -(6.412 + 3.348 + 3.612) = -5.352 kJ/mol.
A diferença com o resultado exato -5525 kJ/mol se deve ao fato de que na molécula de benzeno não existem ligações CC simples e ligações duplas C=C, mas existem 6 ligações CC aromáticas.
Responder. a) -5525 kJ/mol; b) -5352kJ/mol.
Exemplo 3-3. Usando dados de referência, calcule a entalpia da reação
3Cu (tv) + 8HNO 3(aq) = 3Cu(NO 3) 2(aq) + 2NO (g) + 4H 2 O (l)
Solução. A equação iônica abreviada para a reação é:
3Cu (s) + 8H + (aq) + 2NO 3 - (aq) = 3Cu 2+ (aq) + 2NO (g) + 4H 2 O (l).
De acordo com a lei de Hess, a entalpia da reação é igual a:
UR 0 = 4fH 0 (H 2 O (l)) + 2 fH 0 (NÃO (g)) + 3 fH 0 (Cu 2+ (aq)) - 2 fH 0 (NÃO 3 - (aq))
(as entalpias de formação do cobre e do íon H + são iguais, por definição, 0). Substituindo os valores das entalpias de formação (P.W.Atkins, Physical Chemistry, 5ª edição, pp. C9-C15), encontramos:
UR 0 = 4 (-285,8) + 2 90,25 + 3 64,77 - 2 (-205,0) = -358,4 kJ
(com base em três moles de cobre).
Responder. -358,4kJ.
Exemplo 3-4. Calcule a entalpia de combustão do metano a 1000 K, se a entalpia de formação a 298 K for dada: fH 0 (CH 4) = -17,9 kcal/mol, fH 0 (CO 2) = -94,1 kcal/mol, fH 0 (H 2 O (g)) = -57,8 kcal/mol. As capacidades caloríficas dos gases (em cal/(mol. K)) na faixa de 298 a 1000 K são iguais a:
C p (CH 4) = 3,422 + 0,0178. T, Cp(O2) = 6,095 + 0,0033. T,
C p (CO 2) = 6,396 + 0,0102. T, Cp(H 2 O (g)) = 7,188 + 0,0024. T.
Solução. Entalpia da reação de combustão do metano
CH 4 (g) + 2O 2 (g) = CO 2 (g) + 2H 2 O (g)
a 298 K é igual a:
94,1 + 2 (-57,8) - (-17,9) = -191,8 kcal/mol.
Vamos encontrar a diferença nas capacidades térmicas em função da temperatura:
Cp = Cp(CO2) + 2 Cp(H 2 O (g)) - Cp(CH 4) - 2 Cp(O2) =
= 5.16 - 0.0094T(cal/(mol K)).
A entalpia da reação a 1000 K é calculada usando a equação de Kirchhoff:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0,0094 (1000 2 -298 2)/2 = -192500 cal/mol.
Responder. -192,5kcal/mol.
TAREFAS
3-1. Quanto calor é necessário para transferir 500 g de Al (p.f. 658 o C, H 0 pl = 92,4 cal/g), tomado em temperatura do quarto, em estado fundido, se Cp(Al TV) = 0,183 + 1,096 10 -4 T cal/(gK)?
3-2. A entalpia padrão da reação CaCO 3 (s) = CaO (s) + CO 2 (g) que ocorre em um recipiente aberto a uma temperatura de 1000 K é 169 kJ/mol. Qual é o calor dessa reação, que ocorre à mesma temperatura, mas em recipiente fechado?
3-3. Calcule a energia interna padrão de formação do benzeno líquido a 298 K se a entalpia padrão de sua formação for 49,0 kJ/mol.
3-4. Calcule a entalpia de formação de N 2 O 5 (g) em T= 298 K com base nos seguintes dados:
2NO(g) + O 2 (g) = 2NO 2 (g), H 1 0 = -114,2 kJ/mol,
4NO 2 (g) + O 2 (g) = 2N 2 O 5 (g), H 2 0 = -110,2 kJ/mol,
N 2 (g) + O 2 (g) = 2NO (g), H 3 0 = 182,6 kJ/mol.
3-5. As entalpias de combustão de -glicose, -frutose e sacarose a 25 o C são iguais a -2802,
-2.810 e -5.644 kJ/mol, respectivamente. Calcule o calor de hidrólise da sacarose.
3-6. Determine a entalpia de formação do diborano B 2 H 6 (g) em T= 298 K a partir dos seguintes dados:
B 2 H 6 (g) + 3O 2 (g) = B 2 O 3 (tv) + 3H 2 O (g), H 1 0 = -2.035,6 kJ/mol,
2B(televisão) + 3/2 O 2 (g) = B 2 O 3 (televisão), H 2 0 = -1273,5 kJ/mol,
H 2 (g) + 1/2 O 2 (g) = H 2 O (g), H 3 0 = -241,8 kJ/mol.
3-7. Calcule o calor de formação do sulfato de zinco a partir de substâncias simples em T= 298 K com base nos seguintes dados.
Qualquer reação química é acompanhada pela liberação ou absorção de energia na forma de calor.
Com base na liberação ou absorção de calor, eles distinguem exotérmico E endotérmico reações.
Exotérmico reações são reações durante as quais o calor é liberado (+Q).
As reações endotérmicas são reações durante as quais o calor é absorvido (-Q).
Efeito térmico da reação (P) é a quantidade de calor liberada ou absorvida durante a interação de uma certa quantidade de reagentes iniciais.
Uma equação termoquímica é uma equação que especifica o efeito térmico de uma reação química. Assim, por exemplo, as equações termoquímicas são:
Deve-se notar também que as equações termoquímicas devem necessariamente incluir informações sobre estados de agregação reagentes e produtos, pois disso depende o valor do efeito térmico.
Cálculos do efeito térmico da reação
Exemplo tarefa típica para encontrar o efeito térmico da reação:
Quando 45 g de glicose reagem com o excesso de oxigênio de acordo com a equação
C 6 H 12 O 6 (sólido) + 6O 2 (g) = 6CO 2 (g) + 6H 2 O (g) + Q
700 kJ de calor foram liberados. Determine o efeito térmico da reação. (Escreva o número até o número inteiro mais próximo.)
Solução:
Vamos calcular a quantidade de glicose:
n(C 6 H 12 O 6) = m(C 6 H 12 O 6) / M(C 6 H 12 O 6) = 45 g / 180 g/mol = 0,25 mol
Aqueles. Quando 0,25 mol de glicose interage com o oxigênio, 700 kJ de calor são liberados. Da equação termoquímica apresentada na condição segue-se que a interação de 1 mol de glicose com oxigênio produz uma quantidade de calor igual a Q (efeito térmico da reação). Então a seguinte proporção está correta:
0,25 mol de glicose - 700 kJ
1 mol de glicose - Q
Desta proporção segue a equação correspondente:
0,25/1 = 700/Q
Resolvendo isso, descobrimos que:
Assim, o efeito térmico da reação é de 2.800 kJ.
Cálculos usando equações termoquímicas
Muito mais frequentemente em Tarefas do Exame Estadual Unificado na termoquímica, o valor do efeito térmico já é conhecido, pois a condição fornece a equação termoquímica completa.
Neste caso, é necessário calcular a quantidade de calor liberada/absorvida com uma quantidade conhecida de reagente ou produto, ou, inversamente, por valor conhecido calor, é necessário determinar a massa, volume ou quantidade de uma substância de qualquer participante da reação.
Exemplo 1
De acordo com a equação da reação termoquímica
3Fe 3 O 4 (televisão) + 8Al (televisão) = 9Fe (televisão) + 4Al 2 O 3 (televisão) + 3330 kJ
Formaram-se 68 g de óxido de alumínio. Quanto calor foi liberado? (Escreva o número até o número inteiro mais próximo.)
Solução
Vamos calcular a quantidade de substância de óxido de alumínio:
n(Al 2 O 3) = m(Al 2 O 3) / M(Al 2 O 3) = 68 g / 102 g/mol = 0,667 mol
De acordo com a equação termoquímica da reação, quando 4 moles de óxido de alumínio são formados, são liberados 3330 kJ. No nosso caso, formam-se 0,6667 mol de óxido de alumínio. Tendo denotado a quantidade de calor liberada neste caso por x kJ, criamos a proporção:
4 mol de Al 2 O 3 - 3330 kJ
0,667 mol Al 2 O 3 - xkJ
Esta proporção corresponde à equação:
4/0,6667 = 3330/x
Resolvendo isso, descobrimos que x = 555 kJ
Aqueles. quando 68 g de óxido de alumínio são formados de acordo com a equação termoquímica da condição, 555 kJ de calor são liberados.
Exemplo 2
Como resultado de uma reação, cuja equação termoquímica
4FeS 2 (tv.) + 11O 2 (g) = 8SO 2 (g) + 2Fe 2 O 3 (tv.) + 3310 kJ
1.655 kJ de calor foram liberados. Determine o volume (l) de dióxido de enxofre liberado (nº). (Escreva o número até o número inteiro mais próximo.)
Solução
De acordo com a equação termoquímica da reação, quando 8 moles de SO 2 são formados, 3.310 kJ de calor são liberados. No nosso caso, foram liberados 1.655 kJ de calor. Deixe a quantidade de SO 2 formada neste caso ser x mol. Então a seguinte proporção é justa:
8 mol de SO 2 - 3310 kJ
x mol SO 2 - 1655 kJ
Da qual segue a equação:
8/x = 3310/1655
Resolvendo isso, descobrimos que:
Assim, a quantidade de substância SO 2 formada neste caso é de 4 mol. Portanto, seu volume é igual a:
V(SO 2) = V m ∙ n(SO 2) = 22,4 l/mol ∙ 4 mol = 89,6 l ≈ 90 l(arredondado para números inteiros, pois isso é obrigatório na condição.)
Problemas mais analisados sobre o efeito térmico de uma reação química podem ser encontrados.
Todos os métodos de cálculo dos efeitos térmicos são baseados na equação de Kirchhoff na forma integral.
Na maioria das vezes, o padrão 298,15K é usado como a primeira temperatura.
Todos os métodos de cálculo dos efeitos térmicos se resumem a métodos de cálculo da integral do lado direito da equação.
Métodos para calcular a integral:
I. Com base nas capacidades térmicas médias. Este métodoé o mais simples e menos preciso. Neste caso, a expressão sob o sinal de integral é substituída pela mudança capacidade térmica média, que não depende da temperatura na faixa selecionada.
As capacidades térmicas médias são tabuladas e medidas para a maioria das reações. Eles são fáceis de calcular usando dados de referência.
II. De acordo com as verdadeiras capacidades de calor. (Usando séries de temperatura)
Neste método, o integrando da capacidade térmica é escrito como uma série de temperaturas:

III. De acordo com componentes de entalpia de alta temperatura. Este método recebeu difundido com o desenvolvimento da tecnologia de foguetes no cálculo dos efeitos térmicos das reações químicas durante temperaturas altas. Baseia-se na definição de capacidade térmica isobárica:

Componente de alta temperatura da entalpia. Mostra o quanto a entalpia de uma substância individual mudará quando ela for aquecida em um certo número de graus.
Para uma reação química escrevemos:

Por isso:
Palestra nº 3.
Esboço da palestra:
1. II lei da termodinâmica, definição, notação matemática.
2. Análise da II lei da termodinâmica
3. Cálculo das mudanças de entropia em alguns processos
O calor da reação (o efeito térmico de uma reação) é a quantidade de calor Q liberado ou absorvido. Se o calor for liberado durante uma reação, a reação é chamada exotérmica; se o calor for absorvido, a reação é chamada endotérmica.
O calor da reação é determinado com base na primeira lei (lei) da termodinâmica, cuja expressão matemática em sua forma mais simples para reações químicas é a equação:
Q = ΔU + рΔV (2.1)
onde Q é o calor da reação, ΔU é a mudança na energia interna, p é a pressão, ΔV é a mudança no volume.
O cálculo termoquímico consiste em determinar o efeito térmico da reação. De acordo com a equação (2.1) valor numérico O calor da reação depende do método de sua implementação. EM processo isocórico, realizado em V = const, calor de reação Q V =Δ Você, em processo isobárico em p = efeito térmico const Q P =Δ H. Assim, o cálculo termoquímico é V determinar a magnitude da mudança na energia interna ou na entalpia durante uma reação. Como a grande maioria das reações ocorre sob condições isobáricas (por exemplo, estas são todas reações em vasos abertos que ocorrem em pressão atmosférica), ao fazer cálculos termoquímicos, o cálculo de ΔH é quase sempre realizado . SeΔ N<0, то реакция экзотермическая, если же Δ H>0, então a reação é endotérmica.
Os cálculos termoquímicos são feitos usando a lei de Hess, segundo a qual o efeito térmico de um processo não depende de seu caminho, mas é determinado apenas pela natureza e estado das substâncias iniciais e produtos do processo, ou, na maioria das vezes, um consequência da lei de Hess: o efeito térmico de uma reação é igual à soma dos calores (entalpias) de formação dos produtos menos a soma dos calores (entalpias) de formação dos reagentes.
Nos cálculos de acordo com a lei de Hess, são utilizadas equações de reações auxiliares cujos efeitos térmicos são conhecidos. A essência das operações nos cálculos de acordo com a lei de Hess é que as operações algébricas são realizadas nas equações de reações auxiliares que levam a uma equação de reação com efeito térmico desconhecido.
Exemplo 2.1. Determinação do calor de reação: 2СО + O 2 = 2СО 2 ΔН - ?
Utilizamos as seguintes reações como auxiliares: 1) C + O 2 = C0 2;Δ H 1 = -393,51 kJ e 2) 2C + O 2 = 2CO;Δ H 2 = -220,1 kJ, ondeΔ N / DΔ H 2 - efeitos térmicos de reações auxiliares. Utilizando as equações dessas reações, é possível obter a equação de uma determinada reação se a equação auxiliar 1) for multiplicada por dois e a equação 2) for subtraída do resultado obtido. Portanto, o calor desconhecido de uma determinada reação é igual a:
Δ H = 2Δ H 1 -Δ H2 = 2(-393,51) - (-220,1) = -566,92 kJ.
Se um corolário da lei de Hess for usado em um cálculo termoquímico, então para a reação expressa pela equação aA+bB=cC+dD, a seguinte relação será usada:
ΔH = (cΔNobr,s + dΔHobr D) - (aΔNobr A + bΔH rev,c) (2.2)
onde ΔН é o calor da reação; ΔН o br - calor (entalpia) de formação, respectivamente, dos produtos de reação C e D e dos reagentes A e B; c, d, a, b - coeficientes estequiométricos.
O calor (entalpia) de formação de um composto é o efeito térmico da reação durante a qual 1 mol deste composto é formado a partir de substâncias simples que estão em fases termodinamicamente estáveis e com modificações 1 *. Por exemplo , o calor de formação da água no estado de vapor é igual à metade do calor de reação, expresso pela equação: 2H 2 (g)+ O 2 (g)= 2H2O(g).A dimensão do calor de formação é kJ/mol.
Nos cálculos termoquímicos, os calores das reações são geralmente determinados para condições padrão, para as quais a fórmula (2.2) assume a forma:
ΔН°298 = (сΔН° 298, arr. C + dΔH° 298, o 6 p , D) - (аΔН° 298, arr. A + bΔН° 298, arr. c)(2.3)
onde ΔН° 298 é o calor padrão de reação em kJ (o valor padrão é indicado pelo sobrescrito “0”) a uma temperatura de 298K, e ΔН° 298,obR são os calores padrão (entalpias) de formação também a uma temperatura de 298K. Valores de ΔН° 298 .obR.são definidos para todas as conexões e são dados tabulares. 2 * - ver tabela em anexo.
Exemplo 2.2. Cálculo calor padrão R e ações expressas pela equação:
4NH 3 (r) + 5O 2 (g) = 4NO (g) + 6H 2 O (g).
De acordo com o corolário da lei de Hess, escrevemos 3*:
Δ N 0 298 = (4Δ N 0 298. o b p . Não+6ΔH0 298. dr.H20) - 4ΔH0 298 arr. NH z. Substituindo valores da tabela calores padrão de formação dos compostos apresentados na equação, obtemos:Δ N °298= (4(90,37) + 6(-241,84)) - 4(-46,19) = - 904,8 kJ.
Um sinal negativo para o calor de reação indica que o processo é exotérmico.
Na termoquímica, os efeitos térmicos são geralmente indicados nas equações de reação. Tal equações com um efeito térmico designado são chamadas termoquímicas. Por exemplo, a equação termoquímica da reação considerada no exemplo 2.2 é escrita:
4NH 3 (g) + 50 2 (g) = 4NO (g) + 6H 2 0 (g);Δ Н° 29 8 = - 904,8 kJ.
Se as condições diferirem das condições padrão, em cálculos termoquímicos práticos isso permite Xia usando zoom:Δ N ≈Δ ° 298 (2.4) A expressão (2.4) reflete a fraca dependência do calor de reação das condições de sua ocorrência.
7. Calcule o efeito térmico da reação sob condições padrão: Fe 2 O 3 (t) + 3 CO (g) = 2 Fe (t) + 3 CO 2 (g), se o calor de formação: Fe 2 O 3 (t) = – 821,3 kJ/mol CO (g; ) = – 110,5 kJ/mol;
CO 2 (g) = – 393,5 kJ/mol.
Fe 2 O 3 (t) + 3 CO (g) = 2 Fe (t) + 3 CO 2 (g),
Conhecendo os efeitos térmicos padrão da combustão de materiais de partida e produtos de reação, calculamos o efeito térmico da reação sob condições padrão:
16. Dependência da taxa de uma reação química da temperatura. Regra de Van't Hoff. Coeficiente de temperatura da reação.
As reações resultam apenas de colisões entre moléculas ativas cuja energia média excede a energia média dos participantes da reação.
Quando as moléculas recebem alguma energia de ativação E (excesso de energia acima da média) diminui energia potencial interações de átomos em moléculas, as ligações dentro das moléculas enfraquecem, as moléculas tornam-se reativas.
A energia de ativação não é necessariamente fornecida de fora; ela pode ser transmitida a alguma parte das moléculas pela redistribuição da energia durante suas colisões; Segundo Boltzmann, entre N moléculas existe próximo número moléculas ativas N com energia aumentada :
N N·e – E / RT (1)
onde E é a energia de ativação, que mostra o excesso de energia necessário, em relação ao nível médio, que as moléculas devem ter para que a reação seja possível; as restantes designações são bem conhecidas.
Com ativação térmica para duas temperaturas T 1 e T 2, a razão das constantes de taxa será:
 , (2)
, (2)
 , (3)
, (3)
o que torna possível determinar a energia de ativação medindo a taxa de reação em dois temperaturas diferentes T 1 e T 2.
Um aumento na temperatura em 10 0 aumenta a taxa de reação em 2–4 vezes (regra aproximada de Van't Hoff). O número que mostra quantas vezes a taxa de reação (e, portanto, a constante de taxa) aumenta quando a temperatura aumenta em 10 0 é chamado de coeficiente de temperatura da reação:
 (4)
(4)
 .(5)
.(5)
Isso significa, por exemplo, que com um aumento na temperatura de 100 0 para um aumento convencionalmente aceito velocidade média em 2 vezes ( = 2) a taxa de reação aumenta em 2 10, ou seja, aproximadamente 1000 vezes, e quando = 4 – 4 10, ou seja, 1000000 de vezes. A regra de Van't Hoff é aplicável para reações que ocorrem em temperaturas relativamente baixas em uma faixa estreita de temperatura. O aumento acentuado na taxa de reação com o aumento da temperatura é explicado pelo fato de que o número de moléculas ativas aumenta exponencialmente.
25. Equação isotérmica da reação química de Van't Hoff.
De acordo com a lei da ação de massa para uma reação arbitrária
e A + bB = cC + dD
a equação da taxa para a reação direta pode ser escrita:
e para a taxa de reação reversa:
À medida que a reação prossegue da esquerda para a direita, as concentrações das substâncias A e B diminuirão e a taxa da reação direta diminuirá. Por outro lado, à medida que os produtos de reação C e D se acumulam, a velocidade da reação da direita para a esquerda aumentará. Chega um momento em que as velocidades υ 1 e υ 2 tornam-se iguais, as concentrações de todas as substâncias permanecem inalteradas, portanto,
,OndeK c = k 1 / k 2 =
O valor constante Kc, igual à razão das constantes de velocidade das reações direta e reversa, descreve quantitativamente o estado de equilíbrio através das concentrações de equilíbrio das substâncias iniciais e dos produtos de sua interação (na medida de seus coeficientes estequiométricos) e é chamada de constante de equilíbrio. A constante de equilíbrio é constante apenas para uma determinada temperatura, ou seja,
Kc=f(T). A constante de equilíbrio de uma reação química é geralmente expressa como uma razão, cujo numerador é o produto das concentrações molares de equilíbrio dos produtos da reação, e o denominador é o produto das concentrações das substâncias iniciais.
Se os componentes da reação são uma mistura de gases ideais, então a constante de equilíbrio (K p) é expressa em termos das pressões parciais dos componentes:
Para passar de K p para K c, usamos a equação de estado P · V = n · R · T. Porque o
, então P = C·R·T. .Da equação segue-se que K p = K c desde que a reação prossiga sem alterar o número de moles na fase gasosa, ou seja, quando (c + d) = (a + b).
Se a reação ocorrer espontaneamente em P e T constantes ou V e T, então os valores de G e F desta reação podem ser obtidos a partir das equações:
 ,
,
onde С А, С В, С С, С D são concentrações fora de equilíbrio de substâncias iniciais e produtos de reação.
,onde Р А, Р В, Р С, Р D são as pressões parciais das substâncias iniciais e produtos de reação.
As duas últimas equações são chamadas de equações isotérmicas de reação química de van't Hoff. Esta relação permite calcular os valores de G e F da reação e determinar sua direção em diferentes concentrações das substâncias iniciais.
Deve-se notar que quanto sistemas de gás, e para soluções, com participação na reação sólidos(ou seja, para sistemas heterogêneos) a concentração da fase sólida não está incluída na expressão da constante de equilíbrio, uma vez que esta concentração é praticamente constante. Sim, para reação
2 CO (g) = CO 2 (g) + C (t)
a constante de equilíbrio é escrita como
.A dependência da constante de equilíbrio com a temperatura (para a temperatura T 2 em relação à temperatura T 1) é expressa pela seguinte equação de van't Hoff:
 ,
,
onde Н 0 é o efeito térmico da reação.
Para uma reação endotérmica (a reação ocorre com absorção de calor), a constante de equilíbrio aumenta com o aumento da temperatura, o sistema parece resistir ao aquecimento.
34. Osmose, pressão osmótica. Equação de Van't Hoff e coeficiente osmótico.
Osmose é o movimento espontâneo de moléculas de solvente através de uma membrana semipermeável que separa soluções de diferentes concentrações, de uma solução de menor concentração para uma solução de maior concentração, o que leva à diluição desta última. Um filme de celofane é frequentemente usado como uma membrana semipermeável, através dos pequenos orifícios pelos quais apenas moléculas de solvente de pequeno volume podem passar seletivamente e moléculas ou íons grandes ou solvatados são retidos - para substâncias de alto peso molecular, e um filme de ferrocianeto de cobre para substâncias de baixo peso molecular. O processo de transferência de solvente (osmose) pode ser evitado aplicando pressão hidrostática externa a uma solução com maior concentração (em condições de equilíbrio esta será a chamada pressão osmótica, indicada pela letra ). Para calcular o valor de em soluções de não eletrólitos, é utilizada a equação empírica de Van't Hoff:
onde C é a concentração molar da substância, mol/kg;
R – constante universal dos gases, J/mol K.
A magnitude da pressão osmótica é proporcional ao número de moléculas (em geral, o número de partículas) de uma ou mais substâncias dissolvidas em um determinado volume de solução, e não depende de sua natureza e da natureza do solvente. Em soluções de eletrólitos fortes ou fracos, o número total de partículas individuais aumenta devido à dissociação das moléculas, portanto, um coeficiente de proporcionalidade apropriado, denominado coeficiente isotônico, deve ser introduzido na equação de cálculo da pressão osmótica.
i C R T,
onde i é o coeficiente isotônico, calculado como a razão entre a soma do número de íons e moléculas de eletrólitos indissociados e o número inicial de moléculas dessa substância.
Então, se o grau de dissociação do eletrólito, ou seja, razão entre o número de moléculas desintegradas em íons e número total moléculas da substância dissolvida é igual a e a molécula do eletrólito se decompõe em n íons, então o coeficiente isotônico é calculado da seguinte forma:
i = 1 + (n – 1) · ,(i > 1).
Para eletrólitos fortes, podemos considerar = 1, então i = n, e o coeficiente i (também maior que 1) é chamado de coeficiente osmótico.
O fenômeno da osmose tem grande importância para organismos vegetais e animais, uma vez que as membranas de suas células em relação às soluções de muitas substâncias possuem propriedades de membrana semipermeável. EM água limpa a célula incha muito, em alguns casos até o ponto de ruptura da membrana, e em soluções com altas concentrações de sal, ao contrário, diminui de tamanho e enruga-se devido à grande perda de água. Portanto, ao enlatar produtos alimentícios adicionado a eles um grande número de sal ou açúcar. As células microbianas sob tais condições perdem uma quantidade significativa de água e morrem.