A distância percorrida pela molécula mudará? Pergunta. O diâmetro efetivo de uma molécula é a distância mínima que os centros de duas moléculas se aproximam durante uma colisão. Velocidade média do movimento térmico das moléculas
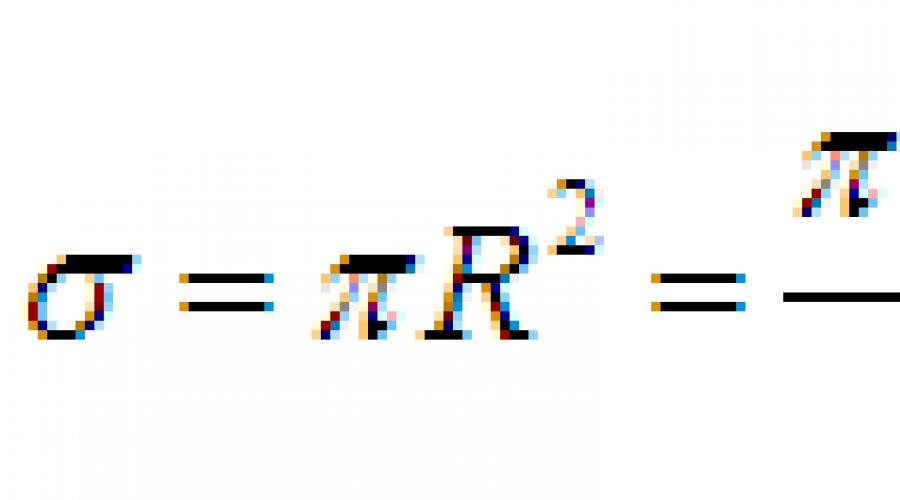
Leia também
Diâmetro molecular efetivo - a distância mínima na qual os centros de duas moléculas se aproximam durante uma colisão.
Número médio de colisões e caminho livre médio de moléculas
As velocidades médias das moléculas e do gás são muito altas - da ordem de centenas de metros por segundo em condições normais. No entanto, o processo de nivelamento de heterogeneidades no gás devido ao movimento molecular prossegue muito lentamente. Isso se deve ao fato de que, ao se mover, as moléculas sofrem colisões com outras moléculas. A cada colisão, a velocidade da molécula muda em magnitude e direção. Como resultado, a velocidade com que uma molécula se difunde de uma parte do gás para outra é muito menor do que a velocidade média do movimento molecular. Para estimar a velocidade de movimento das moléculas, é introduzido o conceito de caminho livre médio. Assim, o caminho livre médio é a distância média que uma molécula percorre de colisão a colisão.
Para determinar, primeiro calculamos o número médio de colisões da molécula selecionada com outras moléculas por unidade de tempo. Assumimos que a molécula após a colisão continua a se mover em linha reta com uma velocidade média de movimento.
As moléculas com as quais a molécula selecionada colide são consideradas imóveis na primeira aproximação e são tomadas como corpos esféricos de raio r. Deixe a molécula selecionada se mover para a direita de uma posição para outra em uma linha reta (Fig. 11.3). Durante seu movimento, ele sofre colisões com aquelas moléculas imóveis cujos centros não estão mais distantes do que 2r da trajetória. Em outras palavras, uma molécula movendo-se a uma velocidade média durante um segundo colidirá com todas as moléculas cujos centros estão em um volume limitado por um cilindro com raio 2r e comprimento , ou seja,
Se a concentração de moléculas é n, então dentro do cilindro considerado existe um número de moléculas igual a
Este número determina o número médio de colisões por unidade de tempo.
A suposição de que todas as moléculas, exceto uma, são imóveis, é claro, não é correta. Na realidade, todas as moléculas estão se movendo, e a possibilidade de duas partículas colidirem depende de sua velocidade relativa. Portanto, em vez da velocidade média aritmética, deve-se incluir a velocidade relativa média das moléculas. Se as velocidades das moléculas são distribuídas de acordo com a lei de Maxwell, então, como pode ser mostrado, a velocidade relativa média de duas moléculas de um gás homogêneo é vezes maior que . Assim, o número médio de colisões deve ser aumentado por um fator
Assim, o caminho livre médio não depende da temperatura do gás, uma vez que com o aumento da temperatura, ambos e , e também aumentam simultaneamente. Ao calcular o número de colisões e o caminho livre médio das moléculas, um corpo elástico esférico foi tomado como modelo da molécula. De fato, cada molécula é um sistema complexo de partículas elementares e, ao considerar a colisão elástica de moléculas, pretendia-se que os centros das moléculas pudessem se aproximar a uma certa distância mínima. Depois, há forças repulsivas que causam uma interação semelhante à interação durante um impacto elástico. A distância média entre os centros das moléculas que interagem, como no impacto elástico, é chamada de diâmetro efetivo. Então
Trabalho de controle sobre o tema "Informações iniciais sobre a estrutura da matéria".
Opção 1
Parte 1.
A1. As menores partículas que compõem várias substâncias são chamadas de ...
A. Átomos B. Moléculas C. Íons
A2. Moléculas de várias substâncias...
B. Uma resposta inequívoca não pode ser dada.
A3. Quando aquecido, o volume do corpo ...
A. Não muda B. Aumenta C. Diminui
A4. Em que estados da matéria pode ocorrer a difusão?
A. Apenas em gases B. Em líquidos e gases
B. Em gases, líquidos e sólidos.
A5. Quais das seguintes propriedades pertencem aos líquidos?
A. Têm forma própria B. Retêm volume
A6. Como se organizam as moléculas dos sólidos?
A7. Em que estado o ar pode estar?
A. Apenas em gasoso B. Apenas em líquido
Parte 2.
EM 1. A distância que uma molécula de gás percorre de uma colisão para a próxima mudará se uma certa quantidade de gás for liberada do cilindro no qual o gás está localizado?
EM 2. O açúcar se dissolve mais rápido em água quente do que em água fria. Por quê?
Parte 3
C1.É preciso muita força para quebrar um pedaço de fio. No entanto, se você aquecer o fio na chama de um queimador, é muito mais fácil quebrá-lo. Por quê?
opção 2
A1. Moléculas da mesma substância...
A. Eles não diferem um do outro B. Eles diferem um do outro
B. Depende do estado da matéria.
A2. Quando resfriado, o volume do corpo ...
A. Aumenta B. Diminui C. Não muda
A3. Como a difusão depende da temperatura?
A. O processo acelera com o aumento da temperatura
B. O processo diminui com o aumento da temperatura
B. O processo é independente das mudanças de temperatura.
A4. Quais das seguintes propriedades pertencem aos gases?
R. Eles têm sua própria forma. B. Manter o volume
B. Não têm forma e volume próprios
A5. Como se organizam as moléculas dos líquidos?
A. A uma grande distância um do outro
B. Não divirja em longas distâncias
B. Organizado em uma determinada ordem.
A6. Qual é o estado do aço?
A. Apenas em sólido B. Apenas em líquido
B. Em sólido, líquido e gasoso.
A7. O gelo derreteu e virou água. As próprias moléculas de gelo mudaram?
R. Não, eles não têm. B. Sim, eles têm. B. Não há uma resposta definitiva.
Parte 2.
EM 1. Uma gota de óleo se espalha sobre a superfície da água, formando uma película fina. Qual pode ser a menor espessura desse filme?
EM 2. Os fios das linhas de energia se esticam da mesma forma quando estão suspensos no verão e no inverno?
Parte 3
C1. Por que é difícil tirar uma meia ou meia molhada?
Respostas.
|
Número de Trabalho | |||||||
Trabalho de teste sobre o tema "Interação de corpos".
Opção 1
Parte 1.
A1. Qual dos seguintes movimentos é uniforme?
A. Movimento da Terra em torno de seu eixo. B. Movimento do pêndulo em horas.
B. O movimento do carro durante a aceleração.
A2. Qual é a trajetória de um esquiador saltando de um salto de esqui?
A. Linha reta B. Linha curva C. Círculo
A3. Qual das seguintes expressões permite calcular a distância percorrida com movimento uniforme?
A. s=v/t B. s=vt C. s=t/v
A4. Um motociclista está se movendo a uma velocidade de 72 km/h e um ônibus está se movendo a uma velocidade de 20 m/s. Qual desses corpos está se movendo mais rápido?
A. Ônibus B. Motociclista C. Eles se movem na mesma direção.
A5. A velocidade de um corpo mudará se a ação de outros corpos sobre ele parar?
R. Não mudará. B. Aumento. B. Diminuir.
A6. A densidade de uma substância mostra...
A. Qual é a massa de uma substância em um volume de 1m 3.
B. Qual é o volume de 1 kg de substância.
Q. Qual é a massa de uma substância em um volume de 1 litro.
A7. As balanças foram equilibradas colocando o corpo em uma balança e todo o conjunto de pesos mostrado na figura na outra. A massa do corpo é...
A. 10,99g B. 11,09g C. 11,90g
Falando de um gás ideal, partimos do fato de que as moléculas não interagem entre si. Na verdade, supunha-se, é claro, que não havia energia potencial de interação entre eles. Colisões elásticas entre moléculas e moléculas com paredes devem necessariamente ocorrer, mesmo porque senão não haverá mecanismo pelo qual uma distribuição igual de energia em graus de liberdade seja estabelecida, caso contrário será impossível falar sobre a temperatura do sistema, pressão nele, etc. As colisões de moléculas acontecem por acaso. Eles levam a uma mudança na direção e magnitude da velocidade da partícula, mas não alteram a distribuição das moléculas sobre as velocidades e coordenadas em sistemas de equilíbrio.
Surge a pergunta: as moléculas sempre colidirão umas com as outras? Afinal, as moléculas são muito pequenas, e as distâncias entre elas em um gás ideal são uma ordem de grandeza maior que suas dimensões lineares. Talvez, para navios de pequeno porte, eles voem sem colisões de parede a parede? Vamos calcular quantas vezes por unidade de tempo uma molécula pode colidir com outras e qual a distância que ela voa em média entre as colisões.
Antes de prosseguir com os cálculos, vamos pegar o modelo mais simples para moléculas. Vamos representá-los na forma de bolas elásticas. Na colisão de moléculas com diâmetros efetivos d1 e d2 seus centros se aproximam (d 1 + d 2)/2(Fig. 4.2).
Arroz. 4.2. A colisão de duas moléculas (1) e a trajetória da molécula de gás selecionada (2): a direção de seu movimento muda quando uma das moléculas do meio cai no raio de interaçãoR = (dt + d 2 )/2
Se imaginarmos que a molécula 1 bater uma molécula 2 , ocorrerá uma colisão; se a primeira molécula cair em uma esfera de raio
descrito em torno da segunda molécula. Área seccional desta esfera

Valor R chamado raio efetivo de interação de moléculas 1 e 2 , uma - seção transversal de interação efetiva essas moléculas. Quando moléculas idênticas colidem d 1 \u003d d 2 \u003d d, R \u003d d e
Durante o tempo entre duas colisões sucessivas, a molécula percorre um certo caminho eu. É, claro, uma questão de puro acaso para cada molécula individual até onde ela pode ir sem colisão. Mas a média do caminho eu sobre todas as moléculas do sistema, obtemos a quantidade física
chamado significa caminho livre moléculas. O significado estatístico desta quantidade é o seguinte: a razão de um pequeno segmento de comprimento dx k dá a probabilidade de uma colisão
em um caminho dx. Deixe ser P(x) - probabilidade de voar sem colisão X. Então
![]()
- probabilidade de voar distância livre de colisão x + dx. O último evento consiste em dois eventos independentes:
A partícula voou sem colisão X(cuja probabilidade é P(x));
a partícula também superou um pequeno segmento do caminho sem colisões dx(cuja probabilidade é 1-dx/). Pelo teorema da multiplicação de probabilidades, temos então

de onde segue a equação para a probabilidade P(x)
Como a probabilidade de superar a distância zero sem colisões é igual a um, temos uma condição inicial adicional P(0) = 1. Integrando a equação diferencial, finalmente encontramos
|
|
Como você pode ver, quanto mais longo o caminho X, menos provável é superá-lo sem colisões.
Vamos agora certificar-nos de que - verdadeiro caminho livre médio. Vamos calcular com que probabilidade a molécula terá um caminho livre médio eu. Isso significa que a partícula percorreu a distância sem colisão. x = l(probabilidade do que é Р(l)) e colidiu com outra partícula diretamente atrás dela - em um pequeno segmento de comprimento dl(cuja probabilidade pode ser encontrada como dl/). Probabilidade dw de tal evento, de acordo com o teorema da multiplicação de probabilidade, é igual a
![]()
Em seguida, encontramos o caminho livre médio
|
|
Não se deve pensar, é claro, que a probabilidade de superar a distância eu sem colisões é zero: algumas das moléculas podem percorrer distâncias muito longas, mas apenas uma parte muito pequena delas. No x = , como segue de (4.1), a probabilidade de passar sem colisões é igual a
![]()
ou seja 63,2 % partículas sofrerão colisões ao longo do caminho. Com um comprimento de caminho x = 2 Nós temos
![]()
ou seja, as colisões já estão destinadas 86,5 % partículas, em x = 3 já envolvido em confrontos 95 % partículas, porque
![]()
Para determinar o número médio de colisões n uma molécula com outras por unidade de tempo, fazemos as seguintes suposições:
todas as moléculas são iguais, ou seja, não consideramos misturas de gases;
todas as moléculas, com exceção da que estamos observando, são imóveis (mais adiante mostraremos como nos livrar dessa suposição obviamente incorreta);
velocidade de colisão v OT molécula não muda (esta suposição é, em essência, o mesmo nível que a anterior: em uma colisão elástica com um obstáculo que permanece imóvel, o módulo de velocidade realmente não muda (o significado do subscrito “de” ficará claro mais tarde)).
O caminho da nossa molécula é o diâmetro d permanece retilíneo até encontrar uma molécula imóvel cujo centro está a uma distância menor que R = d. Depois disso, a molécula mudará a direção do movimento e se moverá em linha reta até uma nova colisão. Por um intervalo de tempo ∆ t a molécula tomará um caminho quebrado vOT ∆ t e colidirá com todas as moléculas que caem em um cilindro quebrado com um raio d e área de base = pd 2(ver figura 4.1). O volume deste cilindro é pd 2 v OT ∆ t. Se um n- concentração de moléculas no sistema (seu número por unidade de volume), é fácil encontrar o número de moléculas imóveis no cilindro, ou seja, o número de colisões DN:
![]()
Isso implica a frequência de colisões (ou seja, o número de colisões por unidade de tempo)
|
|
Vamos agora nos livrar das consequências de nossa suposição de que as moléculas são imóveis. Vamos seguir a molécula 1 , que se move com velocidade v1, e colide com a molécula 2 , que tem velocidade v2. No referencial associado à segunda molécula, ela é estacionária, mas a primeira molécula tem velocidade
Agora está claro que é o valor médio da velocidade relativa das moléculas que desempenha o papel da velocidade v DE, que usamos para derivar a relação (4.3) para a frequência de colisão. Temos então
Onde 𝜃 12 é o ângulo entre as direções do movimento molecular. Devido à aleatoriedade do movimento, esse ângulo tem a mesma probabilidade de assumir qualquer valor, de modo que o valor médio de seu cosseno é zero. E a média dos quadrados das velocidades leva ao aparecimento da velocidade quadrática média das moléculas
![]()
familiar para nós do capítulo anterior. Chegamos no final que
e a fórmula (4.3) é escrita na forma final
Observe que, indo da velocidade da molécula para sua velocidade quadrática média, também nos livramos da terceira suposição, já que vKB constante a uma dada temperatura.
Conhecendo a frequência das colisões, você pode encontrar o caminho livre médio. De fato, o tempo médio entre duas colisões sucessivas = 1/n, e durante este tempo a partícula percorre em média o caminho = vKBt. Assim, o caminho livre médio de uma molécula de gás é
|
|
Como a uma temperatura constante a concentração de partículas é proporcional à pressão, o caminho livre médio diminui com o aumento da pressão. Isso é compreensível, pois a distância média entre as partículas diminui. Na verdade, a molécula não é uma bola sólida. Portanto, seu diâmetro efetivo d- o valor não é muito constante: diminui com o aumento da temperatura, embora apenas ligeiramente. Portanto, o caminho livre médio aumenta ligeiramente com o aumento da temperatura.
Deve-se notar que a distância média entre as partículas está longe de coincidir com o caminho livre médio médio. Anteriormente, estimamos o diâmetro efetivo de uma molécula de vapor de água d=3· 10-10m e a distância média entre as moléculas em condições normais L=3· 10–9 m. A partir daqui encontramos a concentração de moléculas
![]()
Substituindo encontrado n na expressão para o caminho livre médio, encontramos
Vemos que o caminho livre médio em 200 vezes maior que o diâmetro molecular e 20 vezes maior do que a distância média entre as moléculas. Para completar o quadro, também estimamos a frequência de colisões. Energia cinética do movimento de translação de uma molécula
![]()
Conhecendo a massa de uma molécula de água

obtemos uma estimativa da velocidade quadrática média

Por fim, definimos
![]()
Em outras palavras, a molécula experimenta 10 bilhões colisões por segundo! O tamanho linear de um recipiente contendo um litro de gás é l = 10 cm = 0,1 m. Em velocidade 630 m/s a molécula poderia viajar de parede a parede no tempo

mas durante este tempo ela vai experimentar
![]()
colisões com outras moléculas.
Deixamos sem discussão a primeira suposição sobre a identidade de todas as moléculas. Era necessário não por razões fundamentais, mas para simplificar a derivação e as expressões finais. Se não for esse o caso, se considerarmos uma mistura de gases, então os componentes têm diferentes concentrações de partículas, diferentes velocidades quadráticas médias e suas moléculas têm massas diferentes. Como consequência, a fórmula para o caminho livre médio mudará e os resultados serão diferentes para moléculas de vários tipos.
Exemplo. Vamos descobrir como a fórmula (4.6) para o livre caminho médio das moléculas muda se elas são discos planos movendo-se no material de um filme fino, sendo incapazes de voar para fora dele?
Como antes, para uma colisão de moléculas com diâmetros d1 e d2 eles deveriam se aproximar
Portanto, quando uma molécula se move ao longo do plano do filme, ela atingirá todas as outras moléculas que caem em um retângulo quebrado (em contraste com um cilindro no caso tridimensional) com largura 2R e comprimento vOT ∆ t. A área deste retângulo
![]()
Na concentração de superfície n moléculas (neste caso n- seu número por unidade de área) ocorrerá ∆ N=Sn colisões. Assim, para a frequência de colisão, encontramos

onde levamos em conta que, como antes, a velocidade relativa
Portanto, o caminho livre médio para movendo-se em um avião moléculas planares é igual a

Para as mesmas moléculas ( d 1 = d 2 = d)
![]()
Um encontro na floresta, um ouriço no nevoeiro e uma bomba atômica. A ideia de caminho livre médio pode ser usada para estimar a visibilidade em uma floresta, no nevoeiro ou até mesmo uma estimativa aproximada da massa crítica de urânio em uma bomba atômica.
Imagine que você tem um encontro na floresta. Qual é a distância máxima R você notará seu parceiro (e seu parceiro - você)? Digamos que você ligue a lanterna para lhe dar um sinal. Se você não levar em consideração a dispersão da luz, todas as árvores projetam sombras, cujo tamanho linear pode ser considerado aproximadamente igual ao diâmetro dárvores. Na fig. 4.3 sua localização é marcada com um círculo vermelho, um círculo é desenhado em torno dele com um raio R, as árvores são mostradas como círculos verdes e suas sombras no círculo são marcadas com arcos laranja.

Arroz. 4.3. Estimativa de distância máximaR visibilidade na floresta
Vamos determinar qual parte do círculo as sombras cobrem. Deixe ser n densidade de plantio de árvores (seu número por unidade de área). Se um eué a distância média entre as árvores, então
Dentro do círculo está pR2nárvores. O comprimento total da sombra no círculo é, portanto, pr 2º. Vemos que o comprimento total da sombra cresce com o quadrado do raio e em algum valor R ultrapassa a circunferência 2pR. Mas se todo o círculo estiver coberto de sombras, a luz não passará mais. Este valor R e será a distância máxima de visibilidade na floresta. Agora é claro que é determinado a partir da igualdade
![]()
ou seja, recebemos

Para um exemplo numérico, você pode pegar valores com base em sua experiência de vida. Digamos que uma data seja definida entre bétulas com um diâmetro médio de tronco d = 0,25 m e distância média entre as árvores l = 10 m. Então encontramos R = 800 m.
Vamos agora estabelecer uma conexão entre o resultado obtido e a fórmula do caminho livre médio. Temos uma molécula (feixe de luz) não tem tamanho ( d1 = 0), o tamanho das outras moléculas é igual ao diâmetro médio do caule ( d2 = d) e, por fim, as moléculas (troncos) estão em repouso, ou seja, devemos descartar o fator . Obtemos como resultado - em relação à nossa tarefa - a expressão
Assim, o raio de visibilidade que encontramos
A probabilidade da luz percorrer essa distância sem "colisões" com árvores é

Em outras palavras, com probabilidade 86.5 % de luz será bloqueada por árvores.
O encontro na floresta ocorreu em um avião. Agora voltaremos ao mundo volumétrico. A mesma figura agora representa uma esfera com um raio R e obstáculos em forma de bolas de diâmetro d. Por exemplo, queremos avaliar a visibilidade de um ouriço que se perdeu no nevoeiro e agora as gotas de água fazem o papel das árvores. Se a concentração de gotas for P(seu número por unidade de volume), então dentro da esfera está
![]()
Suas sombras na esfera são círculos com área pd 2/4. Na distância máxima de visibilidade, as sombras cobrem toda a esfera:

A partir daqui encontramos a distância de visibilidade no nevoeiro
Vamos novamente comparar este resultado com a fórmula (4.6) para o caminho livre médio de uma molécula em um meio gasoso, onde devemos descartar o fator e tomar

Nós temos
![]()
Probabilidade de superar o caminho R = 3l sem colisão é igual a

Portanto, é provável 95 % uma colisão ocorrerá ao longo do caminho.
Obtemos uma estimativa numérica. Nosso raciocínio é válido se o tamanho das gotículas visivelmente (digamos, em uma ou duas ordens de magnitude) exceder o comprimento de onda da luz. Como a faixa visível tem comprimentos de onda 0,40–0,76 µm, então para o diâmetro da gota tomamos a estimativa d = 10–4 m. Para a concentração de gotas, tomamos o valor n=3· 10 7 m – 3 (Veja abaixo a origem deste número.) Então a visibilidade na neblina será

Estimamos a concentração de gotículas como segue. Pressão de vapor d'água saturada em, digamos, 20°C (T = 293 K) é igual a pH = 2,3· 10 3 Pa. Aplicando a equação de Clapeyron - Mendeleev, encontramos a densidade do vapor de água em 100 % umidade:
Com uma diminuição acentuada da temperatura, todo o vapor se condensa em gotículas do tamanho especificado - uma névoa densa é formada. A massa de uma gota é

O número de gotas formadas no volume V encontramos como a razão entre a massa de vapor mà massa da gota m CAP. Então a concentração de gotas é determinada a partir da relação

No d = 10–4 m obtemos o valor usado acima n=3· 10–7 m–3.
A dependência da distância de visibilidade na neblina do tamanho da gota é dada pela relação

Para gotículas extremamente pequenas com um diâmetro de cerca de dez comprimentos de onda de luz d = 10 - 5 m visibilidade é reduzida a um metro. O que é chamado, "você não pode ver além do seu nariz." Em tamanhos de gotas ainda menores, nosso modelo se torna inválido, pois a luz não pode mais ser considerada simplesmente como uma coleção de partículas com tamanho desprezível. Os efeitos de difração começam a desempenhar um papel, e a expressão para a seção transversal efetiva para a interação da luz com as gotas não será mais determinada pela seção transversal puramente geométrica das gotas.
O problema resolvido também está relacionado à questão da massa crítica de urânio-235 utilizada para a fabricação de bombas atômicas. Em vez de luz neste problema, temos nêutrons e, em vez de gotas, temos núcleos de 235 U. Após a colisão com os núcleos, os nêutrons os dividem em fragmentos e mais 3-4 nêutrons voam. No raio crítico R crítico o número de nêutrons não diminuirá e ocorrerá uma reação em cadeia auto-sustentável - ocorrerá uma explosão atômica. O raio de visibilidade pode ser tomado como base para determinar o raio crítico
e massa crítica Crítico M
Observamos que não divulgamos nenhum segredo da produção de armas nucleares: essas estimativas são muito grosseiras. Nosso único objetivo é demonstrar mais uma vez a unidade das leis da física operando nos mais diversos sistemas.
« Física - 10º ano"
É possível, conhecendo a temperatura, calcular a energia cinética média das moléculas de gás? a velocidade média da molécula?
Essa velocidade pode ser medida?
Velocidade média do movimento térmico das moléculas.
A Equação (9.16) permite encontrar o quadrado médio da velocidade da molécula. Substituindo nesta equação obtemos a expressão para o valor médio do quadrado da velocidade:
A velocidade quadrática média é a quantidade

Calculando pela fórmula (9.19) a velocidade das moléculas, por exemplo nitrogênio em t = 0 °C, obtemos ![]() Moléculas de hidrogênio na mesma temperatura têm uma velocidade quadrática média
Moléculas de hidrogênio na mesma temperatura têm uma velocidade quadrática média ![]() Essas velocidades são altas, mas como as moléculas de gás se movem aleatoriamente, colidindo constantemente umas com as outras, e o tempo entre duas colisões é curto, a distância que as moléculas voam também é pequena. Devido à colisão, a trajetória de cada molécula é uma linha quebrada emaranhada (Fig. 9.6). A molécula tem altas velocidades em segmentos retos da linha quebrada. Como pode ser visto na figura, quando uma molécula se move do ponto A para o ponto B, o caminho percorrido por ela acaba sendo muito maior que a distância AB. À pressão atmosférica, esta distância é de cerca de 10 -5 cm.
Essas velocidades são altas, mas como as moléculas de gás se movem aleatoriamente, colidindo constantemente umas com as outras, e o tempo entre duas colisões é curto, a distância que as moléculas voam também é pequena. Devido à colisão, a trajetória de cada molécula é uma linha quebrada emaranhada (Fig. 9.6). A molécula tem altas velocidades em segmentos retos da linha quebrada. Como pode ser visto na figura, quando uma molécula se move do ponto A para o ponto B, o caminho percorrido por ela acaba sendo muito maior que a distância AB. À pressão atmosférica, esta distância é de cerca de 10 -5 cm.
Quando esses números foram obtidos pela primeira vez (segunda metade do século 19), muitos físicos ficaram surpresos. De acordo com os cálculos, as velocidades das moléculas de gás acabaram sendo maiores do que as velocidades dos projéteis de artilharia! Com base nisso, até mesmo dúvidas foram expressas sobre a validade da teoria cinética. Afinal, sabe-se que os cheiros se espalham bem devagar: leva um tempo da ordem de dezenas de segundos para que o cheiro de perfume derramado em um canto da sala se espalhe para outro canto.
Determinação experimental das velocidades das moléculas. Experimentos para determinar as velocidades das moléculas provaram a validade da fórmula (9.19). Um dos experimentos foi proposto e realizado por O. Stern em 1920.
O que determina a energia cinética média do movimento térmico das moléculas e o que determina a raiz quadrada média da velocidade desse movimento.
O dispositivo Stern consiste em dois cilindros coaxiais A e B, rigidamente conectados um ao outro (Fig. 9.7, a). Os cilindros podem girar a uma velocidade angular constante. Um fino fio de platina C, revestido com uma camada de prata, é esticado ao longo do eixo do pequeno cilindro.
Em 1943, O. Stern recebeu o Prêmio Nobel de Física "por sua contribuição ao desenvolvimento dos métodos de feixes moleculares e à descoberta e medição do momento magnético do próton".
Por que você acha que o fio é feito de platina?

Uma corrente elétrica é passada através do fio. Há uma ranhura estreita O na parede deste cilindro O ar foi evacuado dos cilindros. O cilindro B está à temperatura ambiente. No início, o dispositivo está parado. Quando a corrente passa pelo filamento, ele aquece e a uma temperatura de 1200°C os átomos de prata evaporam. O cilindro interno é preenchido com um gás de átomos de prata. Alguns átomos passam pelo gap O e, tendo atingido a superfície interna do cilindro B, são depositados sobre ele. Como resultado, uma estreita tira D de prata é formada diretamente oposta à fenda (Fig. 9.7, b).
Em seguida, os cilindros são colocados em rotação com um grande número de rotações n por segundo (até 1500 1/c).
Agora, no tempo t necessário para o átomo percorrer um caminho igual à diferença entre os raios dos cilindros R B - RA, os cilindros irão girar em um certo ângulo φ. Como resultado, os átomos que se movem com velocidade constante não atingem a superfície interna do cilindro grande diretamente oposta à folga O (Fig. 9.7, c), mas a uma certa distância s da extremidade do raio que passa pelo meio a lacuna (Fig. 9.7, d): depois que todos os átomos se movem em linha reta.
Se denotarmos por υ B o módulo da velocidade de rotação dos pontos na superfície do cilindro externo, então
s = υ B t = 2 πnR B t. (9.20)
Na realidade, os átomos de prata têm velocidades diferentes. Portanto, as distâncias s para diferentes átomos serão um pouco diferentes. Por s deve-se entender a distância entre as seções das tiras D e D "com a maior espessura da camada de prata. Essa distância corresponderá à velocidade média dos átomos, que é igual a ![]()
Substituindo nesta fórmula o valor do tempo t da expressão (9.20), obtemos
Conhecendo n, RA e RB e medindo o deslocamento médio da tira de prata causado pela rotação do instrumento, pode-se encontrar a velocidade média dos átomos de prata.
Os módulos de velocidade determinados a partir da experiência coincidem com o valor teórico da velocidade quadrática média. Isso serve como prova experimental da validade da fórmula (9.19) e, consequentemente, da fórmula (9.16), segundo a qual a energia cinética média de uma molécula é diretamente proporcional à temperatura absoluta.


