منگنز در جدول تناوبی سیستم تناوبی عناصر شیمیایی
قرن نوزدهم در تاریخ بشر قرنی است که در آن بسیاری از علوم از جمله شیمی اصلاح شدند. در این زمان بود که نظام تناوبی مندلیف و با آن قانون تناوبی ظاهر شد. این او بود که اساس شد شیمی مدرن. سیستم تناوبی D.I. مندلیف یک سیستم سازی عناصر است که وابستگی خواص شیمیایی و فیزیکی را به ساختار و بار اتم یک ماده ایجاد می کند.
داستان
آغاز نشریه با کتاب «همبستگی خواص با وزن اتمی عناصر» که در ربع سوم قرن هفدهم نوشته شده است. مفاهیم اولیه نسبتاً شناخته شده را نشان می دهد عناصر شیمیایی(در آن زمان فقط 63 نفر بودند). علاوه بر این، بسیاری از آنها توده های اتمینادرست تعریف شدند این امر به شدت با کشف D.I. مندلیف تداخل داشت.
دیمیتری ایوانوویچ کار خود را با مقایسه خواص عناصر آغاز کرد. اول از همه، او کلر و پتاسیم را مصرف کرد و تنها پس از آن به کار با فلزات قلیایی پرداخت. مسلح به کارت های ویژه ای که عناصر شیمیایی را نشان می دهد، بارها سعی کرد این "موزاییک" را جمع آوری کند: او آن را در جستجوی ترکیب ها و مسابقات لازم روی میز خود گذاشت.
پس از تلاش زیاد، دیمیتری ایوانوویچ الگوی مورد نظر خود را پیدا کرد و عناصر را در سریال های دوره ای ساخت. پس از دریافت سلول های خالی بین عناصر در نتیجه، دانشمند متوجه شد که همه عناصر شیمیایی برای محققان روسی شناخته شده نبودند و این او بود که باید دانشی را در زمینه شیمی به این جهان بدهد که هنوز توسط او داده نشده بود. پیشینیان

همه این افسانه را می دانند که جدول تناوبی در خواب برای مندلیف ظاهر شد و او عناصر را از حافظه در سیستم واحد. این، به طور کلی، یک دروغ است. واقعیت این است که دیمیتری ایوانوویچ برای مدت طولانی و با تمرکز روی کار خود کار کرد و او را بسیار خسته کرد. در حین کار بر روی سیستم عناصر، مندلیف یک بار به خواب رفت. وقتی از خواب بیدار شد، متوجه شد که میز را تمام نکرده است و به پر کردن سلول های خالی ادامه داد. یکی از آشنایان او، اینوسترانتسف، معلم دانشگاه، به این نتیجه رسید که میز مندلیف یک رویا است و این شایعه را در بین شاگردانش پخش کرد. بنابراین، این فرضیه متولد شد.
شهرت
عناصر شیمیایی مندلیف بازتابی از قانون تناوبی است که توسط دیمیتری ایوانوویچ در ربع سوم قرن نوزدهم (1869) ایجاد شد. در سال 1869 در جلسه انجمن شیمی روسیه بود که اطلاعیه مندلیف در مورد ایجاد یک ساختار خاص قرائت شد. و در همان سال کتاب "مبانی شیمی" منتشر شد که در آن برای اولین بار سیستم تناوبی عناصر شیمیایی مندلیف منتشر شد. و در کتاب سیستم طبیعیعناصر و استفاده از آن برای نشان دادن کیفیت عناصر کشف نشده "D.I. Mendeleev اولین بار مفهوم "قانون دوره ای" را ذکر کرد.

قوانین ساختار و مکان
اولین گام ها در ایجاد قانون تناوبی توسط دیمیتری ایوانوویچ در سال 1869-1871 انجام شد، در آن زمان او سخت کار کرد تا وابستگی خواص این عناصر را به جرم اتم آنها ثابت کند. نسخه مدرنعناصر خلاصه شده در یک جدول دو بعدی را نشان می دهد.
موقعیت یک عنصر در جدول معنای شیمیایی و فیزیکی خاصی دارد. با مکان عنصر در جدول، می توانید میزان ظرفیت آن را دریابید، دیگری را تعیین کنید ویژگی های شیمیایی. دیمیتری ایوانوویچ سعی کرد ارتباطی بین عناصر برقرار کند، هم از نظر خصوصیات مشابه و هم متفاوت.

او ظرفیت و جرم اتمی را مبنای طبقه بندی عناصر شیمیایی شناخته شده در آن زمان قرار داد. مندلیف با مقایسه خواص نسبی عناصر، سعی کرد الگویی را بیابد که همه عناصر شیمیایی شناخته شده را در یک سیستم متحد کند. با مرتب کردن آنها، بر اساس افزایش جرم اتمی، او با این وجود در هر یک از ردیف ها به تناوب رسید.
توسعه بیشتر سیستم
جدول تناوبی که در سال 1969 ظاهر شد، بیش از یک بار اصلاح شده است. با ظهور گازهای نجیب در دهه 1930، می توان جدیدترین وابستگی عناصر را آشکار کرد - نه به جرم، بلکه به شماره سریال. بعداً امکان تعیین تعداد پروتون ها در هسته اتم وجود داشت و معلوم شد که با شماره سریال عنصر مطابقت دارد. دانشمندان قرن بیستم الکترون را مورد مطالعه قرار دادند و معلوم شد که بر تناوب نیز تأثیر می گذارد. این به شدت ایده خواص عناصر را تغییر داد. این نکته در نسخه های بعدی سیستم تناوبی مندلیف منعکس شد. هر کشف جدید از خواص و ویژگی های عناصر به طور ارگانیک در جدول قرار می گیرد.
ویژگی های سیستم تناوبی مندلیف
جدول تناوبی به دوره هایی تقسیم می شود (7 خط به صورت افقی) که به نوبه خود به بزرگ و کوچک تقسیم می شوند. این دوره با یک فلز قلیایی شروع می شود و با عنصری با خواص غیرفلزی پایان می یابد.
به صورت عمودی، جدول دیمیتری ایوانوویچ به گروه ها (8 ستون) تقسیم می شود. هر یک از آنها در سیستم تناوبی از دو زیر گروه به نام های اصلی و فرعی تشکیل شده است. پس از اختلافات طولانی، به پیشنهاد D. I. Mendeleev و همکارش W. Ramsay، تصمیم گرفته شد تا گروه صفر را معرفی کنند. این شامل گازهای بی اثر (نئون، هلیوم، آرگون، رادون، زنون، کریپتون) است. در سال 1911، دانشمندان F. Soddy پیشنهاد کردند که عناصر غیر قابل تشخیص، به اصطلاح ایزوتوپ ها، را در سیستم تناوبی قرار دهند - سلول های جداگانه ای برای آنها اختصاص داده شد.

با وجود وفاداری و دقت سیستم تناوبی، جامعه علمی برای مدت طولانی نمی خواست این کشف را تشخیص دهد. بسیاری از دانشمندان بزرگ فعالیت های D.I. Mendeleev را به سخره گرفتند و معتقد بودند که پیش بینی خواص عنصری که هنوز کشف نشده بود غیرممکن است. اما پس از کشف عناصر شیمیایی ادعایی (و اینها مثلاً اسکاندیم، گالیم و ژرمانیوم بودند)، سیستم مندلیف و قانون تناوبی او به علم شیمی تبدیل شد.
جدول در دوران مدرن
سیستم تناوبی عناصر مندلیف اساس اکثر اکتشافات شیمیایی و فیزیکی مربوط به علوم اتمی و مولکولی است. مفهوم مدرنعنصر فقط به لطف دانشمند بزرگ شکل گرفت. ظهور سیستم تناوبی مندلیف تغییرات اساسی در ایده ها در مورد ترکیبات مختلفو مواد سادهاوه ایجاد یک سیستم تناوبی توسط یک دانشمند تأثیر بسیار زیادی در توسعه شیمی و کلیه علوم مرتبط با آن داشت.
احتمالاً همه شما جدول تناوبی عناصر را دیده اید. این امکان وجود دارد که او تا به امروز شما را در رویاهای شما تعقیب کند، یا شاید او فقط یک پس زمینه بصری برای شما باشد که دیوار را تزئین می کند. کلاس مدرسه. با این حال، در این مجموعه به ظاهر تصادفی از سلول ها بسیار بیشتر از آنچه به نظر می رسد وجود دارد.
جدول تناوبی (یا PT، همانطور که در این مقاله هر از گاهی به آن اشاره خواهیم کرد)، و همچنین عناصر تشکیل دهنده آن، دارای ویژگی هایی هستند که شاید هرگز حدس نمی زنید. در اینجا ده واقعیت، از ایجاد یک جدول گرفته تا افزودن آخرین عناصر به آن، که اکثر مردم نمیدانند، آورده شده است.
10. مندلیف کمک شد
استفاده از جدول تناوبی از سال 1869 شروع شد، زمانی که دیمیتری مندلیف، که بیش از حد با ریش پرپشتی رشد کرده بود، گردآوری شد. اکثر مردم فکر می کنند که مندلیف تنها کسی بود که روی این جدول کار کرد و به همین دلیل او تبدیل به درخشان ترین شیمیدان قرن شد. با این حال، تلاشهای او توسط چندین دانشمند اروپایی که کمکهای مهمی در تکمیل این مجموعه عظیم از عناصر کردند، انجام شد.
مندلیف به طور گسترده ای به عنوان پدر شناخته می شود جدول تناوبی، اما زمانی که او آن را گردآوری کرد، همه عناصر جدول از قبل باز نبودند. چگونه این امر ممکن شد؟ دانشمندان به جنون خود مشهورند...
9. موارد اخیر اضافه شده است

باور کنید یا نه، جدول تناوبی از دهه 1950 تغییر چندانی نکرده است. با این حال، در 2 دسامبر 2016، چهار عنصر جدید به طور همزمان اضافه شد: نیهونیوم (عنصر شماره 113)، موسکوویوم (عنصر شماره 115)، تنسین (عنصر شماره 117) و اوگانسون (عنصر شماره 118). این عناصر جدید تنها در ژوئن 2016 نام خود را دریافت کردند، زیرا پنج ماه تخصص طول کشید تا به طور رسمی به PT اضافه شوند.
سه عنصر به نام شهرها یا ایالت هایی که آنها در آنجا به دست آمدند نامگذاری شدند و اوگانسون به دلیل مشارکت در تولید این عنصر به نام فیزیکدان هسته ای روسی یوری اوگانسیان نامگذاری شد.
8. کدام حرف در جدول نیست؟

در الفبای لاتین 26 حرف وجود دارد و هر کدام از آنها مهم است. با این حال، مندلیف تصمیم گرفت که متوجه این موضوع نشود. به جدول نگاه کنید و بگویید کدام حرف بدشانسی است؟ نکته: به ترتیب جستجو کنید و بعد از هر حرف پیدا شده انگشتان خود را خم کنید. در نتیجه، حرف "از دست رفته" را پیدا خواهید کرد (اگر هر ده انگشت را روی دستان خود داشته باشید). حدس زدید؟ این حرف شماره 10، حرف "ج" است.
می گویند «یک» تعداد افراد تنهاست. بنابراین، شاید باید حرف "ج" را حرف تنهایی بنامیم؟ اما در اینجا یک واقعیت جالب وجود دارد: اکثر پسرانی که در سال 2000 در ایالات متحده به دنیا آمدند، نام هایی داشتند که با آن حرف شروع می شد. بنابراین، این نامه مورد توجه قرار نگرفت.
7. عناصر سنتز شده

همانطور که قبلاً می دانید، امروزه 118 عنصر در جدول تناوبی وجود دارد. آیا می توانید حدس بزنید که چه تعداد از این 118 عنصر در آزمایشگاه به دست آمده است؟ از همه چیز لیست کلیکه در شرایط طبیعیفقط 90 مورد پیدا می شود.
آیا فکر می کنید 28 عنصر ساخته شده مصنوعی زیاد است؟ خوب، فقط حرف من را قبول کن. آنها از سال 1937 سنتز شده اند و امروزه دانشمندان به این کار ادامه می دهند. همه این عناصر را می توان در جدول یافت. به عناصر 95 تا 118 نگاه کنید، همه این عناصر در سیاره ما وجود ندارند و در آزمایشگاه ها سنتز شده اند. همین امر در مورد عناصر شماره 43، 61، 85 و 87 نیز صدق می کند.
6. عنصر 137

در اواسط قرن بیستم، دانشمند مشهوری به نام ریچارد فاینمن بیانیه نسبتاً بلندی بیان کرد که تمام جهان را در شگفتی فرو برد. دنیای علمیسیاره ما. به گفته وی، اگر روزی عنصر 137 را کشف کنیم، نمیتوانیم تعداد پروتونها و نوترونهای موجود در آن را تعیین کنیم. عدد 1/137 از این جهت قابل توجه است که مقدار ثابت ساختار ظریف است که احتمال جذب یا گسیل یک فوتون توسط الکترون را توصیف می کند. از نظر تئوری، عنصر شماره 137 باید 137 الکترون داشته باشد و احتمال 100 درصد جذب فوتون را دارد. الکترون های آن با سرعت نور می چرخند. حتی باورنکردنی تر این است که الکترون های عنصر 139 برای وجود باید سریعتر از سرعت نور بچرخند.
آیا هنوز از فیزیک خسته شده اید؟ شاید برایتان جالب باشد که بدانید عدد 137 سه حوزه مهم فیزیک را متحد می کند: نظریه سرعت نور، مکانیک کوانتومی و الکترومغناطیس. از اوایل دهه 1900، فیزیکدانان حدس می زنند که عدد 137 ممکن است اساس بزرگ باشد. نظریه یکپارچه، که شامل هر سه حوزه فوق خواهد بود. مسلماً این به نظر باورنکردنی به نظر می رسد که افسانه های بشقاب پرنده ها و مثلث برمودا.
5. در مورد اسامی چه می توان گفت؟

تقریباً همه نامهای عناصر دارای معنایی هستند، اگرچه بلافاصله مشخص نیست. نام عناصر جدید دلخواه نیست. نام عنصر را فقط اولین کلمه ای که به ذهنم رسید می گذارم. به عنوان مثال، "kerflump". به نظرم خوبه
به طور معمول، نام عناصر در یکی از پنج دسته اصلی قرار می گیرد. اولین مورد اسامی دانشمندان مشهور است، نسخه کلاسیک- انیشتینیوم علاوه بر این، عناصر بسته به مکان هایی که برای اولین بار در آن ثبت شده اند می توانند نام خود را دریافت کنند، به عنوان مثال، ژرمانیوم، آمریکیوم، گالیوم و غیره. گزینه اضافیاز نام سیارات استفاده می شود. عنصر اورانیوم اولین بار اندکی پس از کشف سیاره اورانوس کشف شد. عناصر می توانند اسامی مرتبط با اساطیر داشته باشند، به عنوان مثال، تیتانیوم وجود دارد که به نام تیتان های یونان باستان نامگذاری شده است، و توریم، به نام خدای رعد و برق اسکاندیناوی (یا ستاره "انتقام جو"، بسته به اینکه شما ترجیح می دهید) وجود دارد.
و در نهایت، نام هایی وجود دارد که ویژگی های عناصر را توصیف می کند. آرگون از کلمه یونانی "argos" گرفته شده است که به معنای "تنبل" یا "کند" است. از این نام دلالت بر این فرض دارد که این گاز فعال نیست. برم عنصر دیگری است که نام آن از یک کلمه یونانی گرفته شده است. "بروموس" به معنای "بوی" است و این بوی برم را کاملاً دقیق توصیف می کند.
4. آیا ایجاد جدول یک "بینش" بود؟

اگر دوست داری بازی های کارتیپس این واقعیت برای شماست. مندلیف باید به نحوی همه عناصر را مرتب می کرد و سیستمی برای این کار پیدا می کرد. به طور طبیعی، برای ایجاد جدول بر اساس دسته، او به بازی یک نفره روی آورد (خب، چه چیز دیگری؟) مندلیف وزن اتمی هر عنصر را روی کارتی جداگانه یادداشت کرد و سپس اقدام به چیدمان یک نفره پیشرفته خود کرد. او عناصر را بر اساس ویژگی های خاص آنها روی هم چید و سپس آنها را در هر ستون با توجه به وزن اتمی آنها مرتب کرد.
بسیاری از مردم حتی نمی توانند یک نفره معمولی انجام دهند، بنابراین این بازی یک نفره چشمگیر است. بعد از این چه خواهد شد؟ شاید کسی با کمک شطرنج انقلابی در اخترفیزیک ایجاد کند یا موشکی بسازد که بتواند به حومه کهکشان پرواز کند. به نظر می رسد که این امر غیرعادی نخواهد بود، با توجه به اینکه مندلیف تنها با یک دسته از کارت های بازی معمولی موفق به کسب چنین نتیجه درخشانی شد.
3. گازهای بی اثر بدشانس

به یاد داشته باشید که چگونه ما آرگون را به عنوان "تنبل ترین" و "کندترین" عنصر در تاریخ جهان خود طبقه بندی کردیم؟ به نظر می رسد مندلیف نیز همین احساسات را داشته است. هنگامی که آرگون خالص برای اولین بار در سال 1894 به دست آمد، در هیچ یک از ستون های جدول قرار نمی گرفت، بنابراین به جای جستجوی راه حل، دانشمند تصمیم گرفت به سادگی وجود آن را انکار کند.
حتی جالب تر، آرگون تنها عنصری نبود که در وهله اول به این سرنوشت دچار شد. علاوه بر آرگون، پنج عنصر دیگر طبقه بندی نشده باقی ماندند. این رادون، نئون، کریپتون، هلیوم و زنون را تحت تأثیر قرار داد - و همه وجود آنها را انکار کردند زیرا مندلیف نتوانست جایی برای آنها در جدول پیدا کند. پس از چندین سال بازآرایی و طبقه بندی مجدد، این عناصر (به نام گازهای بی اثر) هنوز به اندازه کافی خوش شانس بود که به یک باشگاه شایسته ملحق شد که واقعاً موجود است.
2. عشق اتمی

توصیه ای برای همه کسانی که خود را رمانتیک می دانند. یک کپی کاغذی از جدول تناوبی بگیرید و تمام ستون های میانی پیچیده و نسبتا غیر ضروری را از آن جدا کنید تا 8 ستون باقی بماند (شکل "کوتاه" جدول را دریافت خواهید کرد). آن را در وسط گروه IV تا کنید - و خواهید فهمید که کدام عناصر می توانند با یکدیگر ترکیب ایجاد کنند.
عناصری که هنگام تا شدن "بوسند" می توانند اتصالات پایدار ایجاد کنند. این عناصر دارای ساختارهای الکترونیکی مکمل هستند و با یکدیگر ترکیب می شوند. و اگر عشق واقعی نیست، مثل رومئو و ژولیت یا شرک و فیونا، پس من نمی دانم عشق چیست.
1. قوانین کربن

کربن در تلاش است تا در مرکز بازی باشد. فکر میکنید همه چیز را در مورد کربن میدانید، اما نمیدانید، مهمتر از آن چیزی است که فکر میکنید. آیا می دانستید که در بیش از نیمی از ترکیبات شناخته شده وجود دارد؟ و در مورد این واقعیت که 20 درصد وزن همه موجودات زنده کربن است چطور؟ این واقعا عجیب است، اما آماده باشید: هر اتم کربن در بدن شما زمانی بخشی از یک جناح بود دی اکسید کربندر جو کربن نه تنها یک ابر عنصر سیاره ما است، بلکه چهارمین عنصر فراوان در کل جهان است.
اگر جدول تناوبی با یک حزب مقایسه شود، کربن رهبر اصلی آن است. و به نظر می رسد که او تنها کسی است که می داند چگونه همه چیز را به درستی سازماندهی کند. خوب، در میان چیزهای دیگر، عنصر اصلی همه الماس ها است، بنابراین با تمام اهمیتش، آن نیز می درخشد!
کشف جدول تناوبی عناصر شیمیایی توسط دیمیتری مندلیف در مارس 1869 یک پیشرفت واقعی در شیمی بود. دانشمند روسی موفق شد دانش در مورد عناصر شیمیایی را سیستماتیک کند و آنها را در قالب یک جدول ارائه کند که حتی اکنون دانش آموزان مدرسه باید در کلاس های شیمی مطالعه کنند. جدول تناوبی پایه ای برای توسعه سریع این علم پیچیده و جالب شد و تاریخ کشف آن در افسانه ها و افسانه ها پوشیده شده است. برای همه کسانی که به علم علاقه دارند، دانستن حقیقت در مورد چگونگی کشف جدول عناصر تناوبی مندلیف جالب خواهد بود.
تاریخچه جدول تناوبی: چگونه همه چیز شروع شد
تلاشهایی برای طبقهبندی و نظامبندی عناصر شیمیایی شناختهشده مدتها قبل از دیمیتری مندلیف انجام شد. سیستم عناصر آنها توسط دانشمندان مشهوری مانند Debereiner، Newlands، Meyer و دیگران پیشنهاد شد. با این حال، به دلیل کمبود اطلاعات در مورد عناصر شیمیایی و جرم اتمی صحیح آنها، سیستم های پیشنهادی کاملاً قابل اعتماد نبودند.
تاریخچه کشف جدول تناوبی از سال 1869 آغاز می شود، زمانی که یک دانشمند روسی در جلسه انجمن شیمی روسیه به همکاران خود در مورد کشف خود گفت. در جدول ارائه شده توسط دانشمند، عناصر شیمیایی بسته به خواص آنها، که توسط ارزش وزن مولکولی آنها ارائه می شود، مرتب شده اند.
یکی از ویژگی های جالب جدول تناوبی نیز وجود سلول های خالی بود که در آینده با عناصر شیمیایی کشف شده پیش بینی شده توسط دانشمند (ژرمانیوم، گالیوم، اسکاندیم) پر می شد. پس از کشف جدول تناوبی، بارها اضافات و اصلاحاتی در آن صورت گرفت. مندلیف همراه با شیمیدان اسکاتلندی ویلیام رمزی، گروهی از گازهای بی اثر (گروه صفر) را به جدول اضافه کرد.
در آینده، تاریخ جدول تناوبی مندلیف مستقیماً با اکتشافات علم دیگری - فیزیک مرتبط بود. کار بر روی جدول عناصر تناوبی همچنان ادامه دارد و دانشمندان مدرن به هنگام کشف عناصر شیمیایی جدیدی را اضافه می کنند. اهمیت سیستم تناوبی دیمیتری مندلیف به سختی قابل برآورد است، زیرا به لطف آن:
- دانش در مورد خواص عناصر شیمیایی قبلاً کشف شده سیستماتیک شد.
- پیش بینی کشف عناصر شیمیایی جدید ممکن شد.
- شاخه هایی از فیزیک مانند فیزیک اتم و فیزیک هسته شروع به توسعه کردند.
گزینه های زیادی برای به تصویر کشیدن عناصر شیمیایی بر اساس قانون تناوبی وجود دارد، اما معروف ترین و رایج ترین گزینه جدول تناوبی آشنا برای همه است.
افسانه ها و حقایق در مورد ایجاد جدول تناوبی
رایج ترین تصور غلط در تاریخ کشف جدول تناوبی این است که دانشمند آن را در خواب دیده است. در واقع، خود دیمیتری مندلیف این افسانه را رد کرد و اظهار داشت که سال ها به قانون دوره ای فکر می کرده است. برای سیستمبندی عناصر شیمیایی، هر یک از آنها را روی کارتی جداگانه نوشت و بارها آنها را با یکدیگر ترکیب کرد و بسته به خصوصیات مشابه آنها را در ردیفهایی مرتب کرد.
افسانه رؤیای "پیشگویی" دانشمند را می توان با این واقعیت توضیح داد که مندلیف روزها متوالی بر روی سیستم سازی عناصر شیمیایی کار کرد که با یک خواب کوتاه قطع شد. با این حال، تنها کار سخت و استعداد طبیعی دانشمند نتیجه مورد انتظار را داد و شهرت جهانی را برای دیمیتری مندلیف فراهم کرد.
بسیاری از دانشآموزان در مدرسه، و گاهی در دانشگاه، مجبور هستند جدول تناوبی را به خاطر بسپارند یا حداقل بهطور تقریبی پیمایش کنند. برای انجام این کار، یک فرد نه تنها باید داشته باشد خاطرات خوب، بلکه منطقی فکر کنید و عناصر را به گروه ها و طبقات جداگانه پیوند دهید. مطالعه جدول برای آن دسته از افرادی که دائماً با گذراندن دوره های آموزشی بر روی BrainApps مغز خود را در وضعیت خوبی نگه می دارند، ساده تر است.
هرکسی که به مدرسه می رفت به یاد می آورد که یکی از دروس مورد نیاز برای مطالعه، شیمی بود. او می تواند آن را دوست داشته باشد، یا نمی تواند آن را دوست داشته باشد - مهم نیست. و احتمالاً بسیاری از دانش در این رشته قبلاً فراموش شده است و در زندگی به کار نمی رود. با این حال، همه احتمالاً جدول عناصر شیمیایی D.I. Mendeleev را به یاد دارند. برای بسیاری، این یک جدول چند رنگ باقی مانده است که در آن حروف خاصی در هر مربع حک شده است که نام عناصر شیمیایی را نشان می دهد. اما در اینجا ما در مورد شیمی صحبت نخواهیم کرد و صدها مورد را شرح خواهیم داد واکنش های شیمیاییو فرآیندها، اما ما در مورد نحوه ظاهر شدن جدول تناوبی به طور کلی صحبت خواهیم کرد - این داستان برای هر شخص و در واقع برای همه کسانی که تشنه اطلاعات جالب و مفید هستند جالب خواهد بود.
کمی پس زمینه
در سال 1668، رابرت بویل، شیمیدان، فیزیکدان و الهیدان برجسته ایرلندی کتابی منتشر کرد که در آن بسیاری از اسطورههای کیمیاگری رد شد و در آن درباره نیاز به جستجوی عناصر شیمیایی تجزیه ناپذیر صحبت کرد. دانشمند همچنین فهرستی از آنها را ارائه کرد که فقط از 15 عنصر تشکیل شده بود، اما این ایده را مجاز دانست که ممکن است عناصر بیشتری وجود داشته باشد. این نقطه شروع نه تنها در جستجوی عناصر جدید، بلکه در نظامبندی آنها شد.
صد سال بعد، شیمیدان فرانسوی Antoine Lavoisier فهرست جدیدی را تهیه کرد که قبلاً شامل 35 عنصر بود. 23 مورد از آنها بعداً غیرقابل تجزیه بودند. اما جستجو برای عناصر جدید توسط دانشمندان در سراسر جهان ادامه یافت. و نقش رهبریشیمیدان مشهور روسی دیمیتری ایوانوویچ مندلیف در این فرآیند بازی کرد - او اولین کسی بود که این فرضیه را مطرح کرد که می تواند بین جرم اتمی عناصر و مکان آنها در سیستم رابطه وجود داشته باشد.
به لطف کار پر زحمت و مقایسه عناصر شیمیایی، مندلیف توانست رابطه ای بین عناصری را کشف کند که می توانند در آن یکی باشند و خواص آنها چیزی بدیهی نیست، بلکه پدیده ای است که به طور دوره ای تکرار می شود. در نتیجه، در فوریه 1869، مندلیف اولین قانون دوره ای را تدوین کرد و قبلاً در ماه مارس، گزارش او "رابطه خواص با وزن اتمی عناصر" توسط مورخ شیمی N. A. Menshutkin به انجمن شیمی روسیه ارائه شد. سپس در همان سال، نشریه مندلیف در مجله Zeitschrift fur Chemie در آلمان منتشر شد و در سال 1871 یک نشریه گسترده جدید از این دانشمند که به کشف او اختصاص داشت توسط یک مجله آلمانی دیگر Annalen der Chemie منتشر شد.
ایجاد جدول تناوبی

در سال 1869، ایده اصلی قبلاً توسط مندلیف شکل گرفته بود، و در مدت زمان نسبتاً کوتاهی، اما او نتوانست آن را در هیچ نوع سیستم منظمی که به وضوح نشان دهد چه چیزی بود، چه چیزی بود، و برای مدت طولانی نمی توانست رسمیت بخشد. در یکی از مکالمات با همکار خود A. A. Inostrantsev ، او حتی گفت که همه چیز قبلاً در سر او کار کرده است ، اما او نمی تواند همه چیز را روی میز بیاورد. پس از آن، به گفته زندگینامه نویسان مندلیف، او کار پر زحمتی را روی میز خود آغاز کرد که سه روز بدون استراحت برای خواب به طول انجامید. انواع روش ها برای سازماندهی عناصر در یک جدول مرتب شد و کار به دلیل این واقعیت پیچیده بود که در آن زمان علم هنوز در مورد همه عناصر شیمیایی نمی دانست. اما، با وجود این، جدول هنوز ایجاد شد و عناصر سیستماتیک شدند.
افسانه رویای مندلیف
بسیاری این داستان را شنیده اند که D. I. Mendeleev خواب میز خود را دیده است. این نسخه به طور فعال توسط همکار ذکر شده مندلیف A. A. Inostrantsev به عنوان توزیع شده است. داستان خنده دارکه با آن شاگردانش را سرگرم می کرد. او گفت که دمیتری ایوانوویچ به رختخواب رفت و در خواب به وضوح میز خود را دید که در آن همه عناصر شیمیایی چیده شده بودند. نظم درست. پس از آن، دانش آموزان حتی به شوخی گفتند که ودکای 40 درجه به همین ترتیب کشف شده است. اما هنوز پیش نیازهای واقعی برای داستان خواب وجود داشت: همانطور که قبلاً ذکر شد، مندلیف بدون خواب و استراحت روی میز کار می کرد و اینوسترانتسف یک بار او را خسته و خسته یافت. بعد از ظهر، مندلیف تصمیم گرفت استراحت کند و مدتی بعد، ناگهان از خواب بیدار شد، بلافاصله یک تکه کاغذ برداشت و یک میز آماده را روی آن به تصویر کشید. اما خود دانشمند با خواب تمام این داستان را رد کرد و گفت: "شاید بیست سال است که در مورد آن فکر می کنم و شما فکر می کنید: من نشسته بودم و ناگهان ... آماده است." بنابراین افسانه رویا ممکن است بسیار جذاب باشد، اما ایجاد جدول تنها با سخت کوشی امکان پذیر شد.

کار بیشتر
در دوره 1869 تا 1871، مندلیف ایده های تناوب را توسعه داد، که جامعه علمی به آن تمایل داشت. و یکی از نقاط عطف این فرآینداین درک وجود داشت که هر عنصر در سیستم باید بر اساس مجموع ویژگی های آن در مقایسه با ویژگی های عناصر دیگر داشته باشد. بر این اساس و همچنین بر اساس نتایج تحقیقات در مورد تغییر اکسیدهای تشکیل دهنده شیشه، شیمیدان موفق به اصلاح مقادیر جرم اتمی برخی از عناصر از جمله اورانیوم، ایندیم، بریلیم و غیره شد.
البته مندلیف می خواست هرچه زودتر سلول های خالی باقی مانده در جدول را پر کند و در سال 1870 پیش بینی کرد که عناصر شیمیایی ناشناخته برای علم به زودی کشف خواهند شد که جرم و خواص اتمی آن ها را توانست محاسبه کند. اولین آنها گالیم (کشف در 1875)، اسکاندیم (کشف در 1879) و ژرمانیوم (کشف در 1885) بودند. سپس پیشبینیها محقق شد و هشت عنصر جدید دیگر کشف شد، از جمله: پلونیوم (1898)، رنیوم (1925)، تکنسیوم (1937)، فرانسیم (1939) و استاتین (1942-1943). به هر حال، در سال 1900، D.I. مندلیف و شیمیدان اسکاتلندی ویلیام رمزی به این نتیجه رسیدند که عناصر گروه صفر نیز باید در جدول گنجانده شوند - تا سال 1962 آنها را بی اثر، و پس از آن - گازهای نجیب نامیدند.
سازماندهی سیستم دوره ای
عناصر شیمیایی جدول D.I. Mendeleev مطابق با افزایش جرمشان در ردیفهایی قرار گرفتهاند و طول ردیفها بهگونهای انتخاب میشود که عناصر موجود در آنها دارای خواص مشابه باشند. به عنوان مثال گازهای نجیب مانند رادون، زنون، کریپتون، آرگون، نئون و هلیم به راحتی با عناصر دیگر واکنش نشان نمی دهند و همچنین فعالیت شیمیایی پایینی دارند و به همین دلیل در ستون سمت راست قرار دارند. و عناصر ستون سمت چپ (پتاسیم، سدیم، لیتیوم و ...) با عناصر دیگر کاملاً واکنش نشان می دهند و خود واکنش ها انفجاری هستند. به بیان ساده، در هر ستون، عناصر دارای ویژگی های مشابهی هستند که از یک ستون به ستون دیگر متفاوت است. تمام عناصر تا شماره 92 در طبیعت یافت می شوند و با شماره 93 شروع می شوند عناصر مصنوعیکه فقط در آزمایشگاه ایجاد می شود.
در نسخه اصلی خود، سیستم تناوبی تنها به عنوان بازتابی از نظم موجود در طبیعت درک می شد و هیچ توضیحی وجود نداشت که چرا همه چیز باید به این شکل باشد. و تنها زمانی که ظاهر شد مکانیک کوانتومی، معنای واقعی ترتیب عناصر در جدول مشخص شد.
دروس فرآیند خلاق
صحبت در مورد چه درسی فرآیند خلاقمی توان از کل تاریخ ایجاد جدول تناوبی D.I. مندلیف استخراج کرد، می توان به عنوان مثال به ایده های یک محقق انگلیسی در این زمینه اشاره کرد. تفکر خلاقانهگراهام والاس و هانری پوانکاره دانشمند فرانسوی. اجازه دهید آنها را به اختصار بیان کنیم.
طبق نظر پوانکاره (1908) و گراهام والاس (1926)، چهار مرحله اصلی در تفکر خلاق وجود دارد:
- آموزش- مرحله تدوین کار اصلی و اولین تلاش ها برای حل آن.
- دوره نهفتگی یا کمون- مرحله ای که در طی آن حواس پرتی موقت از روند وجود دارد، اما کار برای یافتن راه حلی برای مشکل در سطح ناخودآگاه انجام می شود.
- بینش، بصیرت، درون بینی- مرحله ای که در آن راه حل شهودی پیدا می شود. علاوه بر این، این راه حل را می توان در موقعیتی یافت که مطلقاً به کار مربوط نیست.
- معاینه- مرحله آزمایش و اجرای راه حل که در آن تأیید این راه حل و توسعه احتمالی بعدی آن صورت می گیرد.
همانطور که می بینیم، مندلیف در روند ایجاد جدول خود به طور شهودی این چهار مرحله را دنبال کرد. این که چقدر موثر است را می توان با نتایج قضاوت کرد، یعنی. زیرا جدول ایجاد شده است. و با توجه به اینکه ایجاد آن نه تنها برای علم شیمی، بلکه برای تمام بشریت یک گام بزرگ رو به جلو بود، مراحل چهارگانه فوق را می توان هم برای اجرا به کار برد. پروژه های کوچکو به اجرای طرح های جهانی. مهمترین نکتهای که باید به خاطر بسپاریم این است که هر چقدر بخواهیم آنها را در خواب ببینیم و هر چقدر هم که بخوابیم، یک کشف، هیچ راهحلی برای یک مشکل به تنهایی پیدا نمیشود. برای موفقیت، چه تهیه جدولی از عناصر شیمیایی و چه تدوین یک برنامه بازاریابی جدید، باید دانش و مهارت خاصی داشته باشید و همچنین به طور ماهرانه از پتانسیل خود استفاده کنید و سخت تلاش کنید.
ما برای شما آرزوی موفقیت در تلاش های خود و اجرای موفق برنامه های خود را داریم!
حتی در مدرسه، وقتی در درس شیمی نشسته ایم، همه ما جدول روی دیوار یک کلاس یا آزمایشگاه شیمی را به یاد می آوریم. این جدول شامل طبقه بندی تمام عناصر شیمیایی شناخته شده برای بشر است، آن اجزای اساسی که زمین و کل جهان را تشکیل می دهند. سپس ما حتی نمی توانستیم به این فکر کنیم جدول تناوبیبدون شک یکی از بزرگترین ها اکتشافات علمیکه پایه و اساس ماست دانش مدرندر مورد شیمی
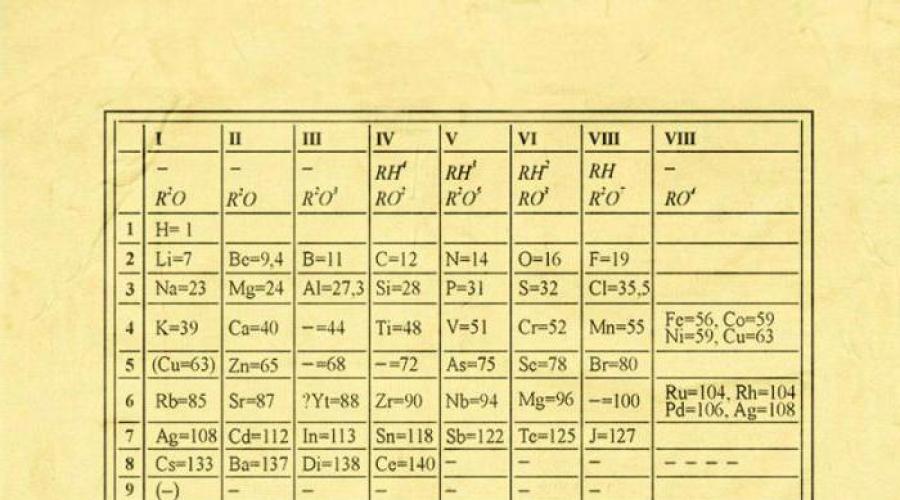
سیستم تناوبی عناصر شیمیایی D.I. مندلیف
در نگاه اول، ایده او به طرز فریبنده ای ساده به نظر می رسد: سازماندهی عناصر شیمیاییبه ترتیب صعودی وزن اتم هایشان. علاوه بر این، در بیشتر موارد معلوم می شود که مواد شیمیایی و مشخصات فیزیکیهر عنصر مشابه عنصر قبل از آن در جدول است. این الگو برای همه به جز تعدادی از عناصر اولیه ظاهر می شود، صرفاً به این دلیل که آنها عناصری ندارند که از نظر وزن اتمی مشابه آنها باشند. به لطف کشف این ویژگی است که میتوانیم دنبالهای خطی از عناصر را در جدولی قرار دهیم که بسیار یادآور تقویم دیواری است و بنابراین تعداد زیادی از انواع عناصر شیمیایی را به روشی واضح و منسجم ترکیب کنیم. البته امروزه از مفهوم عدد اتمی (تعداد پروتون ها) برای نظم بخشیدن به سیستم عناصر استفاده می کنیم. این به حل به اصطلاح کمک کرد مشکل فنیبا این حال، "جفت جایگشت" به تغییر اساسی در ظاهر جدول تناوبی منجر نشد.
AT جدول تناوبی مندلیفهمه عناصر بر اساس عدد اتمی، پیکربندی الکترونیکی و خواص شیمیایی تکرارشونده مرتب شدهاند. سطرهای جدول را نقطه و به ستون ها گروه می گویند. اولین جدول، به تاریخ 1869، تنها شامل 60 عنصر بود، اما اکنون جدول باید بزرگ می شد تا 118 عنصری را که امروز ما می شناسیم، در خود جای دهد.
سیستم تناوبی مندلیفنه تنها عناصر، بلکه متنوع ترین خواص آنها را نیز نظام مند می کند. اغلب برای یک شیمیدان کافی است که جدول تناوبی را جلوی چشمان خود داشته باشد تا به بسیاری از سوالات (نه تنها امتحانات، بلکه سوالات علمی) به درستی پاسخ دهد.
شناسه YouTube 1M7iKKVnPJE نامعتبر است.
قانون دوره ای
دو فرمول وجود دارد قانون دوره ایعناصر شیمیایی: کلاسیک و مدرن.
کلاسیک، همانطور که توسط کاشف آن D.I. مندلیف: خواص اجسام ساده، و همچنین اشکال و خواص ترکیبات عناصر، در یک وابستگی دوره ای به مقادیر وزن اتمی عناصر است.
مدرن: خواص مواد ساده و همچنین خواص و اشکال ترکیبات عناصر در یک وابستگی دوره ای به بار هسته اتم های عناصر (شماره سریال) است.
نمایش گرافیکی قانون تناوبی، سیستم تناوبی عناصر است که می باشد طبقه بندی طبیعیعناصر شیمیایی، بر اساس تغییرات منظم در خواص عناصر از بار اتم های آنها. رایج ترین تصاویر جدول تناوبی عناصر D.I. مندلیف فرم های کوتاه و بلند هستند.

گروه ها و دوره های سیستم تناوبی
گروه هاردیف های عمودی جدول تناوبی نامیده می شود. در گروه ها، عناصر با توجه به ویژگی ترکیب می شوند بالاترین درجهاکسیداسیون در اکسیدها هر گروه از زیر گروه های اصلی و فرعی تشکیل شده است. زیرگروههای اصلی شامل عناصر دورههای کوچک و عناصر دورههای بزرگ هستند که در ویژگیها با آن یکسان هستند. زیرگروه های جانبی فقط از عناصر دوره های بزرگ تشکیل شده اند. خواص شیمیایی عناصر زیر گروه اصلی و فرعی به طور قابل توجهی متفاوت است.
عادت زنانهیک ردیف افقی از عناصر را که به ترتیب صعودی اعداد ترتیبی (اتمی) مرتب شده اند فراخوانی کنید. هفت دوره در سیستم تناوبی وجود دارد: دوره اول، دوم و سوم کوچک نامیده می شود، آنها به ترتیب شامل 2، 8 و 8 عنصر هستند. دوره های باقی مانده بزرگ نامیده می شوند: در دوره های چهارم و پنجم هر کدام 18 عنصر، در ششم - 32 و در دوره هفتم (هنوز ناقص) - 31 عنصر وجود دارد. هر دوره، به جز دوره اول، با یک فلز قلیایی شروع می شود و با یک گاز نجیب پایان می یابد.
معنای فیزیکی شماره سریالعنصر شیمیایی: تعداد پروتون های هسته اتم و تعداد الکترون هایی که به دور آن می چرخند هسته اتمی، برابر با عدد ترتیبی عنصر هستند.
ویژگی های جدول تناوبی
به یاد بیاورید که گروه هاردیف های عمودی جدول تناوبی را نام ببرید و خواص شیمیاییعناصر زیر گروه های اصلی و فرعی به طور قابل توجهی متفاوت هستند.
خواص عناصر در زیر گروه ها به طور طبیعی از بالا به پایین تغییر می کند:
- تشدید شود خواص فلزیو تضعیف غیر فلزی;
- شعاع اتمی افزایش می یابد.
- قدرت بازها و اسیدهای آنوکسیک تشکیل شده توسط عنصر افزایش می یابد.
- الکترونگاتیوی کاهش می یابد
همه عناصر، به جز هلیوم، نئون و آرگون، ترکیبات اکسیژن را تشکیل می دهند، تنها هشت شکل از ترکیبات اکسیژن وجود دارد. آنها اغلب در جدول تناوبی نشان داده می شوند. فرمول های عمومی، در زیر هر گروه به ترتیب صعودی حالت اکسیداسیون عناصر قرار دارد: R 2 O, RO, R 2 O 3, RO 2, R 2 O 5, RO 3, R 2 O 7, RO 4 که نماد R عنصری از این گروه را نشان می دهد. فرمول های اکسیدهای بالاتر برای همه عناصر گروه اعمال می شود، مگر در موارد استثنایی که عناصر حالت اکسیداسیون برابر با عدد گروه را نشان نمی دهند (مثلاً فلوئور).
اکسیدهای ترکیب R 2 O خواص پایه قوی از خود نشان می دهند، و باز بودن آنها با افزایش تعداد سریال افزایش می یابد، اکسیدهای ترکیب RO (به استثنای BeO) خواص اساسی را از خود نشان می دهند. اکسیدهای ترکیب RO 2 , R 2 O 5 , RO 3 , R 2 O 7 خواص اسیدی از خود نشان می دهند و اسیدیته آنها با افزایش شماره سریال افزایش می یابد.
عناصر زیر گروه های اصلی که از گروه IV شروع می شوند، ترکیبات هیدروژنی گازی را تشکیل می دهند. چهار شکل از این ترکیبات وجود دارد. آنها در زیر عناصر زیرگروه های اصلی قرار می گیرند و با فرمول های کلی در دنباله RH 4 , RH 3 , RH 2 , RH نشان داده می شوند.
ترکیبات RH 4 خنثی هستند. RH 3 - ضعیف پایه؛ RH 2 - کمی اسیدی؛ RH به شدت اسیدی است.
به یاد بیاورید که عادت زنانهیک ردیف افقی از عناصر را که به ترتیب صعودی اعداد ترتیبی (اتمی) مرتب شده اند فراخوانی کنید.
در دوره با افزایش شماره سریال عنصر:
- الکترونگاتیوی افزایش می یابد.
- خواص فلزی کاهش می یابد، خواص غیرفلزی افزایش می یابد.
- شعاع اتمی سقوط می کند

عناصر جدول تناوبی
عناصر قلیایی و قلیایی خاکی
این شامل عناصر گروه اول و دوم جدول تناوبی است. فلزات قلیاییاز گروه اول - فلزات نرم، نقره ای، به خوبی با چاقو بریده شده است. همه آنها دارای یک الکترون در لایه بیرونی هستند و کاملاً واکنش نشان می دهند. فلزات قلیایی خاکیاز گروه دوم نیز رنگ نقره ای دارند. دو الکترون در سطح بیرونی قرار می گیرند و بر این اساس، این فلزات تمایل کمتری به تعامل با عناصر دیگر دارند. در مقایسه با فلزات قلیایی، فلزات قلیایی خاکی در دماهای بالاتر ذوب شده و می جوشند.
نمایش / پنهان کردن متن
لانتانیدها (عناصر خاکی کمیاب) و اکتینیدها
لانتانیدهاگروهی از عناصر است که در اصل در مواد معدنی کمیاب یافت می شود. از این رو نام آنها عناصر "خاکی کمیاب" است. متعاقباً مشخص شد که این عناصر به همان اندازه که در ابتدا تصور می کردند کمیاب نیستند و بنابراین نام لانتانیدها به عناصر خاکی کمیاب داده شد. لانتانیدها و اکتینیدهادو بلوک را اشغال کنید که در زیر جدول اصلی عناصر قرار دارند. هر دو گروه شامل فلزات هستند. همه لانتانیدها (به استثنای پرومتیم) غیر رادیواکتیو هستند. از طرف دیگر اکتینیدها رادیواکتیو هستند.
نمایش / پنهان کردن متن
هالوژن ها و گازهای نجیب
هالوژن ها و گازهای نجیب در گروه های 17 و 18 جدول تناوبی دسته بندی می شوند. هالوژن هاعناصر غیر فلزی هستند، همه آنها دارای هفت الکترون در لایه بیرونی خود هستند. AT گازهای نجیبهمه الکترون ها در لایه بیرونی قرار دارند، بنابراین به سختی در تشکیل ترکیبات شرکت می کنند. این گازها "نجیب" نامیده می شوند زیرا به ندرت با عناصر دیگر واکنش نشان می دهند. یعنی به اعضای طبقه نجیب که به طور سنتی از سایر افراد جامعه دوری میکنند، اطلاق میشود.
نمایش / پنهان کردن متن
فلزات واسطه
فلزات واسطهگروه های 3-12 جدول تناوبی را اشغال کنید. اکثر آنها متراکم، جامد، با رسانایی الکتریکی و گرمایی خوب هستند. الکترون های ظرفیت آنها (که از طریق آنها با عناصر دیگر متصل می شوند) در چندین لایه الکترونی قرار دارند.
نمایش / پنهان کردن متن
| فلزات واسطه |
| Scandium Sc 21 |
| Titan Ti 22 |
| وانادیوم V 23 |
| Chrome Cr 24 |
| منگنز منگنز 25 |
| آهن آهن 26 |
| کبالت Co27 |
| نیکل نیکل 28 |
| مس مس 29 |
| روی روی 30 |
| ایتریوم Y 39 |
| زیرکونیوم Zr 40 |
| نیوبیوم Nb 41 |
| Molybdenum Mo 42 |
| تکنتیوم Tc 43 |
| روتنیوم Ru 44 |
| رودیوم Rh 45 |
| پالادیوم Pd 46 |
| نقره نقره 47 |
| کادمیوم سی دی 48 |
| لوتتیوم لو 71 |
| هافنیوم Hf 72 |
| Tantalum Ta 73 |
| تنگستن W 74 |
| Rhenium Re 75 |
| Osmium Os 76 |
| Iridium Ir 77 |
| پلاتین Pt 78 |
| طلای طلا 79 |
| جیوه جیوه 80 |
| Lawrencium Lr 103 |
| رادرفوردیوم Rf 104 |
| Dubnium Db 105 |
| Seaborgium Sg 106 |
| Bory Bh 107 |
| هاسیوم Hs 108 |
| Meitnerium Mt 109 |
| Darmstadtius Ds 110 |
| اشعه ایکس Rg 111 |
| کوپرنیس Cn 112 |
متالوئیدها
متالوئیدهاگروه های 13-16 جدول تناوبی را اشغال کنید. متالوئیدها مانند بور، ژرمانیوم و سیلیکون نیمه رسانا هستند و برای ساخت تراشه های کامپیوتریو تخته ها
نمایش / پنهان کردن متن
فلزات پس از انتقال
عناصر نامیده می شود فلزات پس از انتقال، متعلق به گروه های 13-15 جدول تناوبی است. برخلاف فلزات، درخشندگی ندارند، اما روکش مات دارند. در مقایسه با فلزات واسطه، فلزات پس از انتقال نرم تر هستند، بیشتر هستند دمای پایینذوب و جوش، الکترونگاتیوی بالاتر. الکترون های ظرفیت آنها، که آنها عناصر دیگر را با آنها متصل می کنند، فقط در لایه بیرونی الکترونی قرار دارند. عناصر گروه فلزات پس از انتقال بسیار بیشتر است درجه حرارت بالاجوشش نسبت به متالوئیدها
و اکنون دانش خود را با تماشای ویدیویی در مورد جدول تناوبی و موارد دیگر تثبیت کنید.
عالی، اولین قدم در راه معرفت برداشته شده است. اکنون شما کم و بیش توسط جدول تناوبی هدایت می شوید و این برای شما بسیار مفید خواهد بود، زیرا جدول تناوبی پایه ای است که این علم شگفت انگیز بر روی آن ایستاده است.