Suva galvanska ćelija. Hemijski izvori struje - galvanske ćelije
IN savremenim uslovima Najčešći hemijski izvori struje su galvanske ćelije. Uprkos svojim pojedinačnim nedostacima, oni se široko koriste u elektronici, izvode se Puno radno vrijeme za njihovo unapređenje. Princip rada galvanske ćelije je prilično jednostavan. Ploče od bakra i cinka su uronjene u vodenu otopinu sumporne kiseline, koje tada djeluju kao pozitivni i negativni polovi.
Princip rada galvanske ćelije
Kada su polovi povezani pomoću vodiča, pojavljuje se jednostavan električni krug. Protok struje unutar elementa odvijat će se od negativnog naboja do pozitivnog, odnosno od cinkove ploče do bakrene. Kretanje nabijenih čestica duž vanjskog kola bit će u suprotnom smjeru.
Kada su izloženi električna struja kretanje ostataka sumporne kiseline, kao i jona vodonika, odvijaće se u različitim pravcima. Istovremeno, vodonik prenosi naboj na bakarnu ploču, a preostala kiselina na cink ploču. Tako će se napon održavati na terminalima. U isto vrijeme, mjehurići vodonika se talože na bakrenoj ploči, slabeći ukupni učinak elementa i stvarajući dodatni napon. Ovaj napon je poznat kao elektromotorna sila polarizacije. Da bi se izbjegao ovaj fenomen, u sastav se uvodi tvar koja može apsorbirati atome vodika i izvršiti funkciju depolarizacije.
Galvanske ćelije: prednosti i nedostaci
Za proizvodnju modernih galvanskih ćelija, najviše razni materijali. Najčešći su materijali na bazi ugljenik-cink elemenata koji se koriste za prste.
Njihov glavni pozitivan kvalitet smatrati relativno jeftino. Međutim, takvi elementi imaju malu snagu i kratak vijek trajanja. Većina najbolja opcija služi upotrebi alkalnih elemenata. Ovdje elektrolit nije ugalj, već alkalna otopina. Prilikom pražnjenja ne dolazi do oslobađanja plina, što osigurava potpuno zaptivanje. Alkalni elementi se više razlikuju visoki rok skladištenje

Opšti princip rada galvanske ćelije je potpuno isti za sve tipove. Na primjer, elementi na bazi živinog oksida strukturno su slični alkalnim. Odlikuje ih povećana otpornost na visoke temperature, visoka mehanička čvrstoća i stabilne vrijednosti napona. Nedostatak je toksičnost žive, koja zahtijeva pažljivo rukovanje otpadnim elementima.
Danas su galvanske ćelije jedna od najčešćih hemijskih ćelija.Uprkos svojim nedostacima, aktivno se koriste u elektrotehnici i stalno se usavršavaju.
Princip rada
Najjednostavniji primjer kako funkcionira galvanska ćelija izgleda ovako. Dvije ploče su uronjene u staklenu posudu s vodenim rastvorom sumporne kiseline: jedna je bakar, druga cink. Oni postaju pozitivni i negativni pol elementa. Ako se ovi polovi spoje provodnikom, dobija se najjednostavnije.Unutar elementa struja će teći od cinkove ploče koja ima negativan naboj do bakarne ploče koja je pozitivno nabijena. U vanjskom kolu, kretanje nabijenih čestica odvijat će se u suprotnom smjeru.
Pod uticajem struje ulaziće joni vodonika i kiseli ostatak sumporne kiseline različitim pravcima. Vodik će dati svoje naboje bakrenoj ploči, a kiselinski ostatak će dati svoje naboje ploči cinka. Ovo će održati napon na terminalima elementa. Istovremeno, mjehurići vodonika će se taložiti na površini bakarne ploče, što će oslabiti djelovanje galvanske ćelije. Vodik stvara dodatni napon zajedno s metalom ploče, što se naziva elektromotorna sila polarizacije. Smjer naelektrisanja ovog EMF-a je suprotan smjeru naelektrisanja EMF-a galvanske ćelije. Sami mjehurići stvaraju dodatni otpor u elementu.
Element koji smo pogledali je klasičan primjer. U stvarnosti se takvi galvanski elementi jednostavno ne koriste zbog visoke polarizacije. Kako se to ne bi dogodilo, prilikom proizvodnje elemenata u njihov sastav se uvodi posebna tvar koja apsorbira atome vodika, a koja se naziva depolarizator. U pravilu se radi o preparatima koji sadrže kisik ili klor.
Prednosti i mane modernih galvanskih ćelija
Moderne galvanske ćelije izrađuju se od različitih materijala. Najčešći i poznati tip su ugljenik-cink elementi koji se koriste u AA baterije. Njihove prednosti uključuju relativnu jeftinoću, nedostatke ne dugoročno skladištenje i mala snaga.
Više pogodna opcija- Ovo su alkalne galvanske ćelije. Nazivaju se i mangan-cink. Ovdje elektrolit nije suha tvar kao što je ugalj, već alkalna otopina. Kada se isprazne, takvi elementi praktički ne emituju plin, pa se mogu napraviti hermetički zatvoreni. Rok trajanja takvih elemenata je duži nego kod ugljenik-cink elemenata.
Živi elementi su po dizajnu slični alkalnim elementima. Ovdje se koristi živin oksid. Takvi izvori struje koriste se, na primjer, za medicinsku opremu. Njihove prednosti su otpornost na visoke temperature (do +50, au nekim modelima i do +70 ˚S), stabilan napon, visoka mehanička čvrstoća. Nedostatak su toksična svojstva žive, zbog kojih se istrošenim elementima mora vrlo pažljivo rukovati i slati na reciklažu.
U nekim ćelijama srebrni oksid se koristi za izradu katoda, ali zbog visoke cijene metala njihova upotreba nije ekonomski isplativa. Ćelije sa litijumskim anodama su češće. Oni su također skupi, ali imaju najveći napon među svim vrstama razmatranih galvanskih ćelija.
Druga vrsta galvanskih ćelija su koncentracijske galvanske ćelije. U njima se proces kretanja čestica može odvijati sa ili bez prijenosa jona. Prvi tip je element u koji su dvije identične elektrode uronjene u različitim koncentracijama, razdvojene polupropusnom pregradom. U takvim elementima EMF nastaje zbog činjenice da se ioni prenose u otopinu s nižom koncentracijom. U elementima drugog tipa elektrode su napravljene od različitih metala, a koncentracija se izjednačava zbog hemijskih procesa koji se dešavaju na svakoj od elektroda. ovi elementi su viši od onih prvog tipa.
Galvanske ćelije i baterije G. element, ili galvanski par, je uređaj koji se sastoji od dva metalne ploče(od kojih se jedan može zamijeniti koksom), uronjen u jednu ili dvije različite tekućine i služi kao izvor galvanske struje. Određeni broj naponskih elemenata koji su međusobno povezani na poznat način čine galvansku bateriju. Najjednostavniji element u pogledu strukture čine dvije ploče, uronjene u glineno ili stakleno staklo, u koje se ulijeva tekućina koja odgovara vrsti ploče; ploče ne bi trebale imati metalni kontakt u tečnosti. D. elementi se nazivaju primarni ako su nezavisni izvori struje, i sekundarno ako počnu djelovati tek nakon manje ili više dužeg izlaganja izvorima električne energije koji ih pune. Kada se razmatra porijeklo naponskih elemenata, mora se početi od naponskog stupa, pretka svih kasnijih galvanskih baterija, ili od Voltaic cup baterije. Naponski stupac. Da bi ga sastavio, Volta je uzeo parove različitih metalnih krugova, presavijenih ili čak zalemljenih u osnovi, i kartonske ili platnene krugove navlažene vodom ili otopinom kaustičnog kalija. U početku su se koristile srebrne i bakrene šolje, a zatim obično cink i bakar. Od njih je napravljen stub, kao što je prikazano na dijagramu. 1, i to: prvo se postavlja bakrena ploča i na nju se postavlja cinčana ploča (ili obrnuto), na koju se stavlja navlaženi kartonski krug; ovo je sačinjavalo jedan par, na koji je bio postavljen drugi, opet sastavljen od bakra, cinka i kartona krugova, postavljenih jedan na drugi istim redosledom kao u prvom paru. Nastavljajući da primenjujete sledeće parove istim redosledom, možete kreirati stub; stub prikazan u đavolu. 1, na lijevoj strani, sastoji se od 11 voltnih parova. Ako je stup postavljen na ploču izolacijske, tj. neprovodne tvari, na primjer stakla, tada će, počevši od sredine, jedna polovina stupa (dno na našem crtežu) biti napunjena pozitivan elektricitet, a drugi (vrh na crtežu) - negativan. Intenzitet elektriciteta, neprimjetan u sredini, raste kako se približava krajevima, gdje je najveći. Žice su zalemljene na najnižu i najvišu ploču; dovođenje slobodnih krajeva žica u kontakt dovodi do kretanja pozitivnog elektriciteta od donjeg kraja pola kroz žicu do gornjeg i kretanja negativnog elektriciteta u suprotnom smjeru; formira se električna ili galvanska struja (vidi ovu riječ). Volta je smatrao da su dvije ploče od različitih metala par, a tekućini je pripisivao samo sposobnost da provodi elektricitet (vidi Galvanizam); ali prema kasnije utvrđenom gledištu, par se sastoji od dvije različite ploče i tečnog sloja između njih; stoga se gornja i donja ploča stuba (slika 1 desno) mogu ukloniti. Takav stup će se sastojati od 10 pari, a tada će mu najdonja ploča biti bakrena, a najgornja će biti cink, a smjer kretanja električne energije, odnosno smjer galvanske struje, ostat će isti: od donjeg kraja stuba (sada od cinka) do gornjeg (do bakra). Bakarni kraj pola nazivao se pozitivnim, a cinkovim negativnim polom. Nakon toga, u Faradayevoj terminologiji, naziva se pozitivni pol anoda, negativan - katoda. Voltaični stup se može postaviti vodoravno u korito, prekriveno iznutra izolacijskim slojem voska stopljenog sa harpijem. Danas se voltaični stup ne koristi zbog velikog truda i vremena potrebnog za njegovo sklapanje i rastavljanje; ali u prošlosti su koristili stubove sastavljene od stotina i hiljada parova; Profesor V. Petrov ga je koristio u Sankt Peterburgu 1801-2. Tokom svojih eksperimenata sa stubom, koji se ponekad sastoji od 4200 pari (vidi Galvanizam), Volta je napravio svoj aparat u drugom obliku, koji je oblik kasnijih baterija. Voltina baterija (corona di tazze) sastojala se od čaša koje su se nalazile po obodu kruga, u koje se sipalo toplu vodu ili rastvor soli; u svakoj čaši su bile dvije različite metalne ploče, jedna naspram druge. Svaka ploča je žicom povezana sa različitom pločom susedne šolje, tako da se od jedne čaše do druge po celom obimu neprestano smenjuju ploče: cink, bakar, pa opet cink i bakar itd. Na mestu gde se krug zatvara , u jednoj čaši je cink ploča, u drugoj - bakar; duž žice koja povezuje ove vanjske ploče struja će teći od bakarne ploče (pozitivni pol) do cink ploče (negativni pol). Volta je ovu bateriju smatrao manje zgodnom od stuba, ali zapravo je to bio oblik baterije koji je postao široko rasprostranjen. U stvari, struktura voltaičnog stupa je ubrzo promijenjena (Cruikshank): duguljasta drvena kutija, poprečno podijeljen bakrenim i cink pločama zalemljenim u male pregrade u koje se ulijevala tekućina, bio je praktičniji od konvencionalnog voltaičnog stupa. Još je bolja bila kutija podijeljena na pregrade drvenim poprečnim zidovima; Na obje strane svake pregrade postavljene su bakarne i pocinčane ploče, koje su na vrhu zalemljene, gdje je, osim toga, ostavljena ušica. Drveni štap koji je prolazio kroz sve uši služio je za podizanje svih tanjura iz tečnosti ili za njihovo potapanje. Elementi sa jednom tečnošću. Ubrzo nakon toga, počeli su da se prave pojedinačni parovi ili ćelije koje su se mogle kombinovati u baterije. Različiti putevi. Električna pobudna sila elemenata zavisi od metala i tečnosti i njihovih komponenti, a unutrašnji otpor zavisi od tečnosti i veličine elemenata. Da bi se smanjio otpor i povećao intenzitet struje, potrebno je smanjiti debljinu sloja tekućine između različitih ploča i povećati veličinu uronjene površine metala. Ovo se radi u Wollaston element(Wollaston - prema pravilnijem izgovoru Wulsten). Cink se stavlja unutar savijene bakarne ploče, u koju su umetnuti komadi drveta ili plute kako bi se spriječilo dodirivanje ploča; žica, obično bakarna, zalemljena je na svaku ploču; krajevi ovih žica dovode se u kontakt sa predmetom kroz koji žele da prođu struju koja teče u pravcu od bakra do cinka duž spoljnih provodnika i od cinka do bakra duž unutrašnji delovi element. U principu, struja teče unutar tečnosti od metala na koji tečnost hemijski jače deluje, do drugog na koji deluje slabije. U ovoj ćeliji, obje površine cink ploče služe za protok električne energije; Ova metoda udvostručavanja površine jedne od ploča kasnije je ušla u upotrebu kada se svi elementi slažu jednom tekućinom. Wollaston element koristi razrijeđenu sumpornu kiselinu, koja se raspada tokom djelovanja struje (vidi Galvanska provodljivost); rezultat razgradnje bit će oksidacija cinka i stvaranje cink sulfata, otapanje u vodi, te oslobađanje vodika na bakrenoj ploči, koja na taj način dolazi u polarizirano stanje (vidi Galvanska polarizacija i Galvanska provodljivost), smanjujući struju snagu. Promjenljivost ovog polariziranog stanja je praćena varijabilnošću jačine struje. Od mnogih elemenata sa jednom tečnošću zovemo medijskih elemenata(Smee) i Grene, u prvom - platina ili platinizirano srebro među dvije cink ploče, sve uronjene u razrijeđenu sumpornu kiselinu. Hemijsko djelovanje je isto kao kod Wollastonovog elementa i polarizirano je vodonikom u platini; ali struja je manje varijabilna. Električna pobudna sila je veća nego u bakar-cink. Grenetov element sastoji se od cink ploče postavljene između dvije pločice izrezane od koksa; tečnost za ovaj element priprema se po različitim recepturama, ali uvijek od dikromokalijumove soli, sumporne kiseline i vode. Prema jednom receptu, za 2500 grama vode potrebno je uzeti 340 grama navedene soli i 925 grama sumporne kiseline. Električna pobudna sila je veća nego u Wollaston elementu. Prilikom djelovanja Grenet elementa nastaje cink sulfat, kao iu prethodnim slučajevima; ali vodonik, spajajući se sa kiseonikom hromne kiseline, formira vodu; kromirani alum nastaje u tekućini; polarizacija je smanjena, ali ne i eliminisana. Za Grenet element koristi se staklena posuda sa proširenim donjim dijelom, kao što je prikazano na sl. 7 tabela "Galvanske ćelije i baterije". Toliko tečnosti se sipa tako da se cink ploča Z, koji je kraći od koksa SA, bilo je moguće povlačenjem šipke pričvršćene za nju T, ukloniti iz tekućine za vrijeme kada bi element trebao ostati neaktivan. Stege V, V, spojeno - jedno sa obodom šipke T, i stoga, sa cinkom, a drugi sa obodom od uglja, dodijeljeni su krajevima provodnih žica. Ni ploče ni njihovi okviri nemaju metalni kontakt jedan s drugim; struja teče duž spojnih žica kroz vanjske objekte u smjeru od koksa prema cinku. Ugljično-cink element se može koristiti sa rastvorom kuhinjske soli (u Švajcarskoj, za telegrafe, pozive) i tada važi 9-12 meseci. bez brige. Element Lalandea i Chaperonea, poboljšan od strane Edisona, sastoji se od ploče od cinka i druge presovane od bakrenog oksida. Tečnost je rastvor kaustičnog kalijuma. Hemijsko djelovanje je oksidacija cinka, koji zatim stvara spoj s kalijem; Odvojeni vodik, oksidiran kisikom cink oksida, postaje dio rezultirajuće vode, a bakar se reducira. Unutrašnji otpor je nizak. Ekscitatorna sila nije određena precizno, ali je manja od Danielovog elementa. Elementi sa dve tečnosti. Budući da je oslobađanje vodika na jednom od čvrstih tijela vodikovih elemenata razlog koji smanjuje jačinu struje (zapravo električno uzbudljivu) i čini je nestabilnom, tada se ploča na kojoj se oslobađa vodonik stavlja u tekućinu sposobnu za doniranje. kiseonik da se kombinuje sa vodonikom treba da učini da struja bude konstantna. Becquerel je prvi konstruisao (1829) bakar-cink element sa dve tečnosti za navedenu svrhu, kada elementi Greneta i Lalanda još nisu bili poznati. Kasnije Daniel(1836) dizajnirao je sličan element, ali praktičniji za upotrebu. Za odvajanje tečnosti potrebne su dve posude: jedna staklena ili glačana glinena posuda, koja sadrži cilindričnu, glinenu, blago pečenu, a samim tim i poroznu posudu u koju se sipa jedna od tečnosti i stavlja jedan od metala; u prstenasti prostor između dvije posude ulijeva se druga tekućina u koju je uronjena ploča od drugog metala. U Danielovom elementu, cink je uronjen u slabu sumpornu kiselinu, a bakar je uronjen u vodeni rastvor bakar (plavog) sulfata. Fig. 1 u tabeli prikazuje 3 Daniela elementa spojena u bateriju; cilindri savijeni od cinka stavljaju se u vanjske staklene čaše, bakrene ploče, također u obliku cilindra ili savijene kao slovo S, stavljaju se u unutrašnje glinene cilindre. Možete ga postaviti i obrnuto, odnosno bakar u vanjskim posudama. Struja teče od bakra do cinka kroz vanjske provodnike i od cinka do bakra kroz tekućinu u samoj ćeliji ili bateriji, a obje tekućine se istovremeno razgrađuju: u posudi sa sumpornom kiselinom nastaje cink sulfat, a vodik odlazi na bakarnu ploču, istovremeno se bakar sulfat (CuSO 4) razlaže u bakar (Cu), taložen na bakarnoj ploči, a ne odvojeno postojeća veza(SO 4), koji hemijskim procesom formira vodu sa vodonikom pre nego što stigne da se oslobodi u obliku mehurića na bakru. Porozna glina, koja se lako vlaže sa obe tečnosti, omogućava da se hemijski procesi prenesu sa čestice na česticu kroz obe tečnosti od jednog metala do drugog. Nakon djelovanja struje, čije trajanje ovisi o njenoj jačini (a ovo posljednje dijelom i o vanjskim otporima), kao i o količini tekućine koja se nalazi u posudama, sav bakar sulfat se troši, na što ukazuje promjena boje njegovo rješenje; tada počinje odvajanje vodoničnih mjehurića na bakru, a ujedno i polarizacija ovog metala. Ovaj element se naziva konstantnim, što se, međutim, mora razumjeti relativno: prvo, čak i kod zasićenog vitriola postoji slaba polarizacija, ali glavna stvar je da se unutarnji otpor elementa prvo smanjuje, a zatim povećava. Prema ovom drugom i glavni razlog Na početku djelovanja elementa primjećuje se postupno povećanje struje, što je značajnije, to je jačina struje manje oslabljena vanjskim ili unutarnjim otporima. Nakon pola sata, sat ili više (trajanje se povećava sa količinom tekućine sa cinkom), struja počinje slabije sporije nego što je rasla, a nakon još nekoliko sati dostiže svoju prvobitnu snagu, postepeno dalje slabeći. Ako se zaliha ove soli u neotopljenom obliku stavi u posudu s otopinom bakar sulfata, onda se time nastavlja postojanje struje, kao i zamjena rezultirajuće otopine cink sulfata svježom razrijeđenom sumpornom kiselinom. Međutim, sa zatvorenim elementom, nivo tečnosti sa cinkom postepeno se smanjuje, a sa bakrom se povećava - okolnost koja sama po sebi slabi struju (od povećanja otpora iz tog razloga) i, štaviše, ukazuje na prelazak tečnosti iz jednog posudu u drugu (transfer jona, vidi Galvanska provodljivost, galvanska osmoza). Bakar sulfat prodire u posudu s cinkom, iz kojeg cink oslobađa bakar čisto hemijski, uzrokujući da se taloži dijelom na cink, a dijelom na stijenkama glinene posude. Iz tih razloga postoji veliki otpad cinka i bakar sulfata koji je beskorisan za struju. Međutim, Danielov element je i dalje jedan od najkonstantnijih. Glineno staklo, iako navlaženo tečnošću, predstavlja veliku otpornost na struju; korištenjem pergamenta umjesto gline, struja se može značajno povećati smanjenjem otpora (Carré element); pergament se može zamijeniti životinjskim mjehurićima. Umjesto razrijeđene sumporne kiseline, možete koristiti otopinu stolnog ili morska so; ekscitaciona sila ostaje skoro ista. Hemijski efekti nisu proučavani. Meidinger element. Za čestu i kontinuiranu i, osim toga, prilično konstantnu, ali slabu struju, može se koristiti Meidingerov element (slika 2 u tabeli), koji je modifikacija Danielovog elementa. Vanjsko staklo ima produžetak na vrhu, gdje je na unutrašnjoj ivici postavljen cilindar; Na dno čaše stavlja se još jedna manja, u koju se stavlja cilindar umotan od bakarnog lima, ili se na dno unutrašnje posude stavlja bakreni krug koji se zatim puni rastvorom bakar sulfata. Nakon toga pažljivo sipajte rastvor magnezijum sulfata na vrh, koji sve ispunjava slobodan prostor spoljni sud i ne istiskuje rastvor vitriola, jer ima veći specifična gravitacija. Ipak, difuzijom tečnosti, vitriol polako stiže do cinka, gde odustaje od svog bakra. Da bi se održala zasićenost ove otopine, unutar elementa se stavlja prevrnuta staklena tikvica s komadićima bakrenog sulfata i vode. Provodnici idu prema van od metala; njihovi dijelovi u tečnosti imaju ljusku od gutaperke. Odsustvo glinene posude u elementu omogućava vam da je koristite dugo vremena bez mijenjanja njegovih dijelova; ali njegov unutrašnji otpor je visok, mora se vrlo pažljivo premještati s mjesta na mjesto, a sadrži puno bakarnog sulfata, koji je beskorisan za struju; u tikvicu čak i malog elementa stavlja se oko 1/2 kilograma vitriola. Vrlo je pogodan za telegrafe, električne pozive i druge slične slučajeve i može stajati mjesecima. Callot i Trouvé-Callot elementi slični Meidingerovim elementima, ali jednostavniji od ovih potonjih. Kresten u Sankt Peterburgu je također dogovorio korisnu modifikaciju Meidingerovog elementa. Thomson element u obliku posude ili poslužavnika postoji modificirani Daniel's; porozne ravne membrane od pergamentnog papira odvajaju jednu tečnost od druge, ali možete i bez membrana. Siemens element I Halske takođe pripada kategoriji Danielovih. Element Minotto. Bakarni krug na dnu staklena tegla, na koji se sipaju kristali bakrenog sulfata, a na vrhu je debeli sloj silicijumskog peska, na koji je postavljen cinkov krug. Sve je napunjeno vodom. Traje 1 1/2 do 2 godine na telegrafskim linijama. Umjesto pijeska možete uzeti životinjski ugalj u prahu (Darsonval). Trouvé element. Bakarni krug na kojem se nalazi stup krugova od prolaznog papira, impregniranog bakrenim sulfatom na dnu i cink sulfatom na vrhu. Mala količina vode koja vlaže papir aktivira element. Otpor je prilično visok, djelovanje je dugo i konstantno. Grove element, platina-cink; platina je uronjena u jaku azotnu kiselinu, cink u slabu sumpornu kiselinu. Vodik koji se oslobađa djelovanjem struje oksidira se kisikom dušične kiseline (NHO 2), koja se pretvara u dušični anhidrid (N 2 O 4), čije isparene crveno-narandžaste pare su štetne za disanje i kvare sav bakar. dijelovi aparata, koji su stoga bolje napravljeni od olova. Ovi elementi se mogu koristiti samo u laboratorijama gdje ih ima nape, i u obicna soba mora se staviti u peć ili kamin; imaju veliku ekscitatornu silu i mali unutrašnji otpor - sve su uslovi za veliku jačinu struje, koja je konstantnija što je veća zapremina tečnosti sadržana u elementu. Fig. 6 u tabeli prikazuje takav element ravnog oblika; izvan njega na desnoj strani nalazi se savijena cink ploča povezana sa platinskim limom elementa Z drugi element, u čijem se pregibu nalazi ravna glinena posuda V za platinu. Na lijevoj strani je platinasti lim pričvršćen za cink element i pripada trećem elementu. Kod ovog oblika elemenata unutrašnji otpor je vrlo mali, ali jako dejstvo struje ne traje dugo zbog male količine tečnosti. Struja teče od platine kroz vanjske provodnike do cinka, u skladu s gore navedenim općim pravilom. Bunsen element(1843), ugljen-cink, u potpunosti zamjenjuje prethodni i jeftiniji je od njega, jer je skupa platina zamijenjena koksnim pločicama. Tečnosti su iste kao u Grove elementu, električna pobudna sila i otpor su približno isti; smjer struje je isti. Sličan element je prikazan na sl. 3 stola; ugljena pločica označena slovom SA, sa metalnom stezaljkom sa znakom +; ovo je pozitivni pol, ili anoda, elementa. Iz cilindara Z sa stezaljkom (negativnim pol, ili katodom) nalazi se ploča sa drugom stezaljkom, nanesena na karbonsku ploču drugog elementa u slučaju baterije. Grove je bio prvi koji je platinu u svom elementu zamijenio ugljem, ali su njegovi eksperimenti zaboravljeni. Darsonval element, ugljik-cink; sa ugljem mješavinom dušika i hlorovodonične kiseline Po 1 zapreminu sa 2 zapremine vode koja sadrži 1/20 sumporne kiseline. Fora element.- Umjesto koksa, koristi se boca od grafita i gline; Tu se sipa dušična kiselina. Ova naizgled vanjska promjena Bunsenovog elementa čini upotrebu dušične kiseline potpunijom. Sosnovsky element.- Cink u rastvoru natrijum hidroksida ili kalijum hidroksida; ugljen u tečnosti koja se sastoji od 1 zapremine azotne kiseline, 1 zapremine sumporne kiseline, 1 zapremine hlorovodonične kiseline, 1 zapremine vode. Izvanredan po svojoj vrlo velikoj električnoj pobudnoj snazi. Callan element.- Ugljenik Bunsenovih elemenata je zamijenjen željezom; ekscitatorna sila ostaje ista kao kod upotrebe uglja. Gvožđe nije izloženo dušičnoj kiselini, budući da je u pasivnom stanju. Umjesto gvožđa može se korisno koristiti liveno gvožđe sa malo silicijuma. Poggendorffov element razlikuje se od Bunsenovog elementa zamjenom dušične kiseline tekućinom sličnom onoj koja se koristi u Grenet elementu. Za 12 težinskih dijelova kalij-dihromata otopljenog u 100 dijelova vode dodajte 25 dijelova jake sumporne kiseline. Ekscitatorna sila je ista kao kod Bunsenovog elementa; ali je unutrašnji otpor veći. Kiseonik u navedenoj tečnosti koji se daje za oksidaciju vodonika je manji nego u azotnoj kiselini pri istoj zapremini. Odsustvo mirisa pri korištenju ovih elemenata, u kombinaciji s drugim prednostima, učinilo ga je najprikladnijim za korištenje. Međutim, polarizacija nije u potpunosti eliminirana. Imšenecki element, ugljik-cink. Grafitna (ugljena) ploča u rastvoru hromne kiseline, cink u rastvoru soli natrijum sulfida. Velika ekscitatorna sila, mali unutrašnji otpor, skoro potpuna iskorišćenost cinka i veoma dobra upotreba hromne kiseline. Leclanche element, ugljik-cink; umjesto oksidirajuće tekućine, sadrži prah (veliki) mangan peroksida na ploči uglja, pomiješan sa koksom u prahu (slika 5. tabela) u unutrašnjoj glinenoj posudi koja propušta tekućinu; Cink štapić se stavlja izvana u jedan od uglova posebno oblikovane tikvice. Tečnost - vodeni rastvor amonijaka - izliva se izvana i prodire u glinenu teglu do uglja (koksa), vlažeći manganov peroksid; vrh tegle je obično napunjen smolom; ostave se rupe za izlazak gasova. Ekscitatorna sila je prosečna između Danielovih i Bunsenovih elemenata, otpor je visok. Ovaj element, ostavljen zatvoren, daje struju brzo opadajuće snage, ali za telegrafe i kućnu upotrebu traje jednu do dvije godine kada se dodaje tekućina. Kada se amonijak (NH 4 Cl) razgradi, hlor se oslobađa u cink, stvarajući cink hlorid i amonijak s ugljem. Manganov peroksid, bogat kiseonikom, prelazi malo po malo u jedinjenje nižeg oksidacionog stanja, ali ne u svim delovima mase koja ispunjava glinenu posudu. Za potpuniju upotrebu mangan peroksida i redukciju unutrašnji otpor ovi elementi su raspoređeni bez glinene posude, a pločice su presovane od mangan peroksida i uglja, između kojih se stavlja koks, kao što je prikazano na sl. 4 stola. Ove vrste elemenata mogu biti zatvorene i lake za nošenje; staklo je zamijenjeno rog gumom. Geff je također modificirao ovaj element, zamijenivši otopinu amonijaka otopinom cink klorida. Element Marie-Devi, ugljen-cink, sa ugljem sadrži testastu masu živinog sulfata (Hg 2 SO 4), navlaženu vodom, smeštenu u poroznu glinenu teglu. Na cink se sipa slaba sumporna kiselina ili čak voda, jer će se ova već osloboditi iz živine soli djelovanjem struje, u kojoj se oksidira vodik, a s ugljem oslobađa metalna živa, tako da se nakon nekog vremena element postaje cink-živa. Električna ekscitatorna sila se ne mijenja upotrebom čiste žive umjesto uglja; nešto je veći nego kod Leclanche elementa, unutrašnji otpor je veliki. Pogodan za telegrafe i općenito za povremeno djelovanje struje. Ovi elementi se koriste i u medicinske svrhe, a radije se pune živin sulfat oksidom (HgSO 4). Oblik ovog elementa, pogodnog za medicinske i druge svrhe, je visoki cilindar od rogove gume, čija gornja polovina sadrži cink i ugljen, a donja polovina sadrži vodu i živin sulfat. Ako je element okrenut naopako, on djeluje, ali u prvom položaju ne stvara struju. Warren Delarue element- cink-srebro. Uska srebrna traka viri iz cilindra topljenog srebrnog klorida (AgCl) postavljenog u cijev od pergamentnog papira; cink ima oblik tanke šipke. Oba metala se stavljaju u staklenu epruvetu zatvorenu parafinskim čepom. Tečnost je rastvor amonijaka (23 dela soli na 1 litar vode). Električna pobudna sila je skoro ista (malo više) kao u Daniel elementu. Srebrni metal se taloži iz srebrnog hlorida na srebrnu traku elementa i ne dolazi do polarizacije. Baterije napravljene od njih korištene su za eksperimente na prolasku svjetlosti u razrijeđenim plinovima (V, Warren Delarue). Geff dao je ovim elementima uređaj koji ih čini zgodnim za nošenje; koristi se za medicinske indukcijske zavojnice i za jednosmjerne struje. Elementi Duchaumina, Partz, Figier. Prvi je cink-ugljik; cink u slaboj otopini kuhinjske soli, ugalj - u otopini željeznog klorida. Nestabilan i malo istražen. Partz je zamenio cink gvožđem; rastvor kuhinjske soli ima gustinu 1,15, rastvor gvožđe hlorida ima gustinu 1,26. Bolji od prethodnog, iako je električna pobudna sila manja. Figier koristi jednu tečnost u elementu gvožđe-ugalj, dobijenu propuštanjem struje hlora kroz zasićeni rastvor željeznog sulfata. Nyode element, ugljik-cink. Cink je oblikovan kao cilindar koji okružuje porozni glineni cilindar koji sadrži koksnu ploču prekrivenu bjelilom. Element je zapečaćen čepom punjenim voskom; rastvor kuhinjske soli (24 dijela na 100 dijelova vode) se sipa kroz rupu u njoj. Električna ekscitatorna sila je velika; uz stalno, donekle produženo djelovanje na vanjski mali otpor, ubrzo slabi, ali nakon sat-dva neaktivnosti elementa dostiže svoju prethodnu vrijednost. Suvi elementi. Ovo ime se može dati elementima u kojima prisustvo tečnosti nije vidljivo kada se uvuče u porozna tijela elementa; bilo bi bolje da ih pozovem mokro. To uključuje gore opisani bakar-cink Trouvé element i Leclanche element, koji je modificirao Germain. Ovo posljednje koristi vlakna ekstrahirana iz kokosa; od nje se priprema masa koja jako upija tečnost i gasove, deluje suvo i samo pod pritiskom poprima mokri izgled. Lako prenosiv i pogodan za putovanja telegrafskih i telefonskih stanica. Gasner elementi (ugljik-cink), koji sadrže gips, vjerovatno impregnirani cink hloridom ili amonijakom (čuva se u tajnosti). Ekscitatorna sila je približno ista kao u Leclanche elementu, neko vrijeme nakon početka djelovanja potonjeg; unutrašnji otpor je manji od Leclancheovog. U suvoj ćeliji Leclanche-Barbier, prostor između vanjskog cinkovog cilindra i unutrašnjeg šupljeg cilindra od aglomerata, koji uključuje mangan peroksid, ispunjen je gipsom, zasićenom otopinom nepoznatog sastava. Prvi, prilično dugi testovi ovih elemenata bili su za njih povoljni. Element želatina-glicerin Kuznetsova ima bakar-cink; sastoji se od kartonske kutije impregnirane parafinom sa dnom oblijepljenim limom iznutra i izvana. Na lim se izlije sloj usitnjenog bakar sulfata na koji se izlije želatinsko-glicerinska masa koja sadrži sumpornu kiselinu. Kada se ova masa stvrdne, ulije se sloj usitnjenog amalgamiranog cinka, ponovo napunjen istom masom. Ovi elementi čine bateriju poput naponskog stupa. Dizajniran za pozive, telegrafe i telefone. Općenito, broj različitih suhih elemenata je vrlo značajan; ali u većini, zbog tajnog sastava tečnosti i aglomerata, sud o njima je moguć samo praktičan, ali ne i naučni. Elementi velike površine i niskog otpora. U slučajevima kada je potrebno usijati kratke, prilično debele žice ili ploče, kao što je, na primjer, prilikom nekih hirurških operacija (vidi Galvanokaustika), koriste se elementi s velikim metalnim površinama uronjenim u tekućinu, što smanjuje unutrašnji otpor i time povećava struja. Wollastonova metoda udvostručavanja površine primjenjuje se na kompoziciju površina iz velikog broja ploča, kao što je prikazano na sl. 2, gdje y, y, y- ploče od istog metala se postavljaju u prostore između ploča ts, ts, ts, ts drugi metal. Sve ploče su paralelne jedna s drugom i ne dodiruju se, već su sve istoimene spojene vanjskim žicama u jednu cjelinu. Čitav ovaj sistem je uniformni element od dvije ploče, od kojih svaka ima površinu šest puta veću od prikazane, sa debljinom sloja tekućine između ploča jednakom udaljenosti između svake dvije ploče prikazane na crtežu. Već početkom ovog stoljeća (1822.) postavljeni su uređaji velike metalne površine. To uključuje veliki Gare element, nazvan deflagrator. Limovi od cinka i bakra duga dužina, odvojeni flanelom ili drvenim štapićima, smotaju se u valjak u kojem listovi ne dolaze u metalni dodir jedan s drugim. Ovaj valjak je uronjen u kadu s tekućinom i proizvodi vrlo veliku struju kada djeluje na vrlo mali vanjski otpor. Površina svakog lista je oko 50 kvadratnih metara. stopa (4 kvadratnih metara). Danas, općenito, pokušavaju smanjiti unutarnji otpor elemenata, ali im daju posebno veliku površinu za neke posebne primjene, na primjer, u hirurgiji za odsecanje bolnih izraslina vrućom žicom ili pločom, za kauterizaciju (vidi Galvanokaustika ). Budući da se provodnici malog otpora zagrijavaju, struja se može dobiti upravo smanjenjem unutrašnjeg otpora. Stoga se postavljaju u galvanokautičke elemente veliki broj ploče raspoređene slično onima prikazanim na sl. 2 teksta. Uređaj nema nikakve posebne karakteristike, ali je prilagođen za praktičnu upotrebu; kao što su, na primer, ugljenično-cink ćelije ili Chardin baterije sa hromom tečnosti, koje se koriste u Parizu, Lionu, Monpeljeu i Briselu. Operatere treba upozoriti na potrebu da koriste mjerač struje vrlo malog otpora (ampermetar ili ampermetar) kako bi se osiguralo da je baterija u dobrom stanju prije rada. Normalni elementi moraju zadržati svoju električnu uzbudljivu silu ili imati konstantnu potencijalnu razliku što je duže moguće kada se drže otvorenim kako bi služile kao normalna jedinica mjere prilikom međusobnog poređenja električnih pobudnih sila. U tu svrhu Rainier je predložio par bakar-cink, u kojem je površina bakra vrlo velika u odnosu na cink. Tečnost je rastvor od 200 delova suve kuhinjske soli u 1000 delova vode. Pod ovim uslovom, polarizacija bakra je vrlo slaba ako se ovaj element uvede u strujno kolo sa visokim otporom i za kratko vreme. Normalni element Latimer Clark sastoji se od cinka u rastvoru cink sulfata, žive i živine sulfidne soli (Hg 2 SO 4). Normalni element Fleming, bakar-cink, sa rastvorima bakar sulfata i cink sulfata određene, uvek konstantne gustine. Normalni element London Post and Telegraph Office, bakar-cink, sa rastvorom cink sulfata i kristala bakar sulfata sa bakrom je veoma pogodan. Za električnu ekscitatornu silu Flemingovog elementa, pogledajte ploču na kraju članka. Sekundarni elementi, ili baterije, potiču od sekundarnih Riterovih stubova (vidi Galvanizam), koji su ostali bez posebne pažnje 50 godina. Ritterov stup, koji se sastoji od bakarnih ploča uronjenih u neku tekućinu, polarizirao se nakon djelovanja naponskog stupa na njega, a nakon toga je mogao sam generirati struju čiji je smjer bio suprotan primarnoj struji. Godine 1859. Plante je konstruisao element koji se sastojao od dva olovna lista, umotana u spiralu kao Gare deflagrator, bez međusobnog metalnog kontakta, i uronjena u slabu sumpornu kiselinu. Povezivanjem jednog olovnog lista na anodu (pozitivni pol), a drugog na katodu baterije od najmanje 2 Bunsenove ili Poggendorffove ćelije povezane u seriju, i na taj način propuštajući struju koja teče u tekućini od olova do olova, uzrokujući razdvajanje kisika na olovnoj ploči, spojenoj na anodu, i vodika na listu spojenom na katodu. Na anodnoj ploči se formira sloj olovnog peroksida, dok je katodna ploča potpuno očišćena od oksida. Zbog heterogenosti ploča, one formiraju parove s velikom električnom ekscitatornom silom, dajući struju u smjeru suprotnom od prethodnog. Velika ekscitatorna sila koja se razvija u sekundarnom elementu i usmjerena je suprotno ekscitatornoj sili primarne baterije razlog je zahtjeva da potonja bude veća od prve. Dva Poggendorffova elementa povezana u seriju imaju uzbudljivu silu od oko 4 volta, ali Planteov element samo oko 2 1/2. Za punjenje 3 ili 4 Plante ćelije povezane paralelno (vidi. Galvanske baterije), u stvari, prethodna 2 Poggendorffova elementa bila bi dovoljna, ali bi njihovo djelovanje bilo vrlo sporo da oksidira tako veliku površinu olova; stoga, da biste istovremeno napunili, na primjer, 12 Planteovih elemenata povezanih paralelno, potrebno vam je djelovanje 3-4 Bunsenova elementa uz uzbudljivu silu od 6-8 volti nekoliko sati. Napunjene Plante ćelije povezane u seriju razvijaju električnu uzbudljivu silu od 24 volta i proizvode više žarenja, na primjer, nego baterija koja se puni, ali će učinak sekundarne baterije biti kraći. Količina električne energije koju pokreće sekundarna baterija nije veća od količine električne energije koja je prošla kroz nju iz primarne baterije, ali se, prolazeći kroz vanjske vodiče pri većoj naponskoj ili potencijalnoj razlici, troši za kraće vrijeme. Plante ćelije, nakon raznih praktičnih poboljšanja, nazvane su baterije. Godine 1880. Faure je došao na ideju da se olovne ploče prekriju slojem crvenog olova, odnosno gotovim olovnim oksidom, koji se djelovanjem primarne struje dalje oksidira na jednoj ploči i deoksidira na drugi. Ali način pričvršćivanja crvenog olova zahtijevao je tehnička poboljšanja, koja su se u suštini sastojala u korištenju olovne rešetke, u kojoj se prazne ćelije pune tijestom od crvenog olova i praha u slaboj sumpornoj kiselini. Fitz-Gerald baterija koristi pločice od olovnog oksida bez ikakve metalne osnove; Općenito, postoji mnogo baterijskih sistema i evo slike samo jednog od najboljih (slika 8 u tabeli). Hagen olovna rešetka se sastoji od dvije izbočine okrenute jedna prema drugoj, što sprječava ispadanje komada olovnog oksida iz okvira; posebno prikazani rezovi duž linija ab I CD Glavni crtež objašnjava strukturu ovog okvira. Jedan okvir je punjen crvenim olovom, a drugi litargom (najniže oksidaciono stanje olova). Neparan broj, obično pet ili sedam, ploče su povezane na isti način kao što je objašnjeno u đavolu. 2; u prvom slučaju 3, u drugom 4 su prekrivene glinom. Od ruskih tehničara, Jabločkov i Khotinski su imali koristi od dizajna baterija. Ovi sekundarni elementi, koji predstavljaju jednu tehničku neugodnost, su veoma teška težina, primio raznovrsnost tehničke primjene, usput, na kućnu električnu rasvjetu u slučajevima kada je nemoguće koristiti jednosmjernu struju iz dinamo za ovu svrhu. Baterije napunjene na jednom mjestu mogu se prenijeti na drugo. Oni se sada ne naplaćuju primarnim elementima, već dinamima, u skladu sa nekim posebnim pravilima (vidi Dinamo, Električno osvjetljenje). Sastav galvanskih baterija. Baterija je sastavljena od elemenata na tri načina: 1) serijska veza, 2) paralelna veza, 3) kombinovana od oba prethodna. Na sl. Tabela 1 prikazuje serijski spoj 3 Danielova elementa: spojen je cink prvog para, računajući s desne strane bakarna traka sa bakrom drugog para, cinkom drugog para - sa bakrom trećeg. Slobodni kraj bakra prvog para je anoda, odnosno pozitivni terminal baterije; slobodni kraj trećeg para je katoda, odnosno negativni terminal baterije. Za paralelno povezivanje ovih istih elemenata svi cinkovi moraju biti međusobno povezani metalnim trakama i svi bakarni limovi moraju biti povezani trakama ili žicama u jednu celinu odvojenu od cinka; složena površina cinka će biti katoda, kompleksna površina bakra će biti anoda. Djelovanje takve baterije je isto kao djelovanje jedne ćelije, koja bi imala površinu tri puta veću od jedne ćelije baterije. Konačno, treći način povezivanja može se primijeniti na najmanje 4 elementa. Spajanjem njih dva paralelno dobijamo dve složene anode i iste dve katode; Povezivanjem prve kompleksne anode sa drugom kompleksnom katodom dobijamo bateriju od dva elementa sa dvostrukom površinom. Jebi ga. 3 teksta koji prikazuju dva različita složene veze od 8 elemenata, svaki predstavljen sa dva koncentrična prstena odvojena crnim prazninama. Ne ulazeći u detalje, napominjemo da prema izgled način sastavljanja ovih baterija se razlikuje od upravo opisanih. U (I) 4 elementa su povezana u seriju, ali su na jednom kraju dva vanjska cinka povezana metalnom trakom KK, a na suprotnoj strani dvije vanjske bakrene ploče su povezane pločom AA, koja je anoda, dok QC -
katoda složene baterije, ekvivalentna 4 elementa dvostruke površine spojena u seriju. Crtež 3 (II) prikazuje bateriju ekvivalentnu dvama serijski povezanim elementima četvorostruke površine. Slučajevi kada su potrebne baterije, sastavljene na određeni način, potpuno su razjašnjene Ohmovom formulom (galvanska struja), uz pridržavanje pravila koje iz nje proizlazi, da bi se dobilo najbolja akcija Za svaki vodič sa zadatim brojem galvanskih ćelija potrebno je od njih konstruirati bateriju na način da njegov unutarnji otpor bude jednak otporu vanjskog vodiča ili mu barem što je moguće bliži. Ovome moramo dodati i da se kod serijske veze unutarnji otpor povećava proporcionalno broju spojenih parova, a kod paralelne veze, naprotiv, otpor se smanjuje proporcionalno ovom broju. Dakle, na telegrafskim vodovima, koji imaju veliku otpornost na galvansku struju, baterije se sastoje od elemenata povezanih u seriju; kod hirurških operacija (galvanokaustika) potrebna je baterija paralelno spojenih elemenata. Prikazana u paklu. 3 (I) baterija predstavlja najbolja veza od 8 elemenata za djelovanje na vanjski otpor, koji je dvostruko veći od unutrašnjeg otpora jednog elementa. Ako bi vanjski otpor bio četiri puta manji nego u prvom slučaju, tada bateriji treba dati izgled pakla. 3 (II). Ovo proizilazi iz proračuna koji koriste Ohmovu formulu. [O elementima i baterijama pogledajte rad Niodeta (u ruskom prijevodu D. Golova - " Električni elementi" 1891.); manje detalja: "Die galvanischen Batterien", Hauck, 1883. Članci u časopisu "Electricity", 1891. i 1892.] Poređenje galvanskih ćelija između sebe. Napomene u vezi s tim dijelom su date u opisu elemenata. Vrijednost galvanske ćelije mjeri se jačinom struje koju razvija i trajanjem njenog djelovanja, odnosno proizvodom prve količine na drugu. Ako uzmemo amper kao jedinicu struje (vidi Galvanska struja), a sat kao jedinicu vremena, onda možemo izmjeriti performanse galvanske ćelije u amper-satima. Na primjer, baterije, ovisno o veličini, mogu osigurati od 40 do 90 amper-sati. Za metode mjerenja rada koji se isporučuje električnom strujom, ekvivalentnog radu takozvanog parnog konja u trajanju od jednog sata, pogledajte Rad, Energija električne struje.


Galvanska ćelija
Dijagram Daniel-Jacobijeve galvanske ćelije
Galvanska ćelija- zasnovano na interakciji dva metala i (ili) njihovih oksida u elektrolitu, što dovodi do pojave električne struje u zatvorenom kolu. Ime je dobio po Luiđiju Galvaniju.
Fenomen pojave električne struje kada različiti metali dođu u kontakt otkrio je italijanski fiziolog, profesor medicine na Univerzitetu u Bolonji, Luigi Galvani 1786. godine. Galvani je opisao kontrakciju mišića stražnjih nogu svježe secirane žabe, pričvršćene za bakrene kuke, kada se dodirne čeličnim skalpelom. Zapažanja je pronalazač protumačio kao manifestaciju "životinjskog elektriciteta".
Elektrohemijski generatori (gorive ćelije)- to su elementi u kojima dolazi do pretvaranja hemijske energije u električnu energiju. Oksidacijsko sredstvo i redukcijsko sredstvo se čuvaju izvan ćelije i kontinuirano i odvojeno se dovode do elektroda tokom rada. Tokom rada gorivne ćelije, elektrode se ne troše. Redukciono sredstvo je vodonik (H 2), metanol (CH 3 OH), metan (CH 4) u tečnom ili gasovitom stanju. Oksidacijsko sredstvo je obično kisik zraka ili čisti kisik. U kiseonik-vodonik gorivne ćelije Sa alkalnim elektrolitom, hemijska energija se pretvara u električnu energiju. Elektrane se koriste na svemirskim letjelicama; one obezbjeđuju energiju letjelici i astronautima.
Aplikacija
- Baterije Koristi se u alarmnim sistemima, baterijskim lampama, satovima, kalkulatorima, audio sistemima, igračkama, radijima, auto opremi, daljinskim upravljačima.
- Baterije Koriste se za pokretanje motora automobila, a mogu se koristiti i kao privremeni izvori električne energije na mjestima udaljenim od naseljenih mjesta.
- Gorivne ćelije koristi se u proizvodnji električne energije (za elektrane), izvori energije za hitne slučajeve, autonomno napajanje, transport, brodsko napajanje, mobilni uređaji.
vidi takođe
Književnost
- Ahmetov N.S. Opća i neorganska hemija
- Aksenovich L. A. Fizika u srednja škola: Theory. Zadaci.
Linkovi
| Galvanska ćelija | Galvanska ćelija Daniel | Alkalni element | | Suhi element | Element koncentracije | Cink vazdušni element | Weston normalni element |
|---|---|
| Električne baterije | Olovna kiselina | Srebro-cink | Nikl-kadmijum | Nikl metal hidrid | Nikl-cink baterija | Litijum-jonski | Litijum polimer | Litijum gvožđe sulfid | Litijum gvožđe fosfat | Litijum titanat | Vanadijum | Gvožđe-nikl |
| Gorivne ćelije | Direktni metanol | Čvrsti oksid | Alkalna |
| Modeli | Baterija | Električna baterija | Gorivna ćelija |
| Uređaj | Anoda | Katoda | Elektrolit |
1. Galvanska ćelija
Galvanska ćelija je hemijski izvor električne struje, nazvan po Luigiju Galvaniju. Princip rada galvanske ćelije zasniva se na interakciji dva metala kroz elektrolit, što dovodi do stvaranja električne struje u zatvorenom kolu. EMF galvanske ćelije ovisi o materijalu elektroda i sastavu elektrolita. To su primarni CIT-i, koji se zbog nepovratnosti reakcija koje se u njima dešavaju ne mogu ponovo napuniti.
Galvanske ćelije su jednokratni izvori električne energije. Reagensi (oksidaciono sredstvo i redukciono sredstvo) su direktno uključeni u sastav galvanske ćelije i troše se tokom njenog rada. Galvanski element karakteriziraju emf, napon, snaga, kapacitet i energija koja se prenosi na vanjsko kolo, kao i mogućnost skladištenja i sigurnost okoliša.
EMF je određen prirodom procesa koji se odvijaju u galvanskom elementu. Napon galvanske ćelije U uvijek je manji od EMF-a zbog polarizacije elektroda i gubitaka otpora:
U = Ee – I(r1–r2) – ΔE,
gdje je Ee EMF elementa; I – jačina struje u režimu rada elementa; r1 i r2 – otpor provodnika prve i druge vrste unutar galvanske ćelije; ΔE je polarizacija galvanske ćelije, koja se sastoji od polarizacije njegovih elektroda (anode i katode). Polarizacija se povećava sa povećanjem gustoće struje (i), određenom formulom i = I/S, gdje je S površina poprečnog presjeka elektrode, i povećanjem otpora sistema.
Tijekom rada galvanske ćelije, njen EMF i, shodno tome, napon postupno se smanjuju zbog smanjenja koncentracije reagensa i povećanja koncentracije proizvoda redoks procesa na elektrodama (sjetite se Nernstove jednadžbe). Međutim, što sporije opada napon tokom pražnjenja galvanskog ćelije, to su veće mogućnosti za njegovu upotrebu u praksi. Kapacitet elementa je ukupna količina električne energije Q koju je galvanska ćelija sposobna da isporuči tokom rada (tokom pražnjenja). Kapacitet je određen masom reagensa pohranjenih u galvanskoj ćeliji i stepenom njihove konverzije. Sa povećanjem struje pražnjenja i smanjenjem radne temperature elementa, posebno ispod 00C, smanjuje se stepen konverzije reagensa i kapacitet elementa.
Energija galvanske ćelije jednaka je proizvodu njenog kapacitivnosti i napona: ΔN = Q.U. Elementi visoke EMF vrijednosti, male mase i visok stepen transformacija reagensa.
Skladivost je dužina perioda skladištenja elementa tokom kojeg njegove karakteristike ostaju unutar specificiranih parametara. Kako temperatura skladištenja i rada elementa raste, njegov rok trajanja se smanjuje.
Sastav galvanske ćelije: redukcioni agensi (anode) u prenosivim galvanskim ćelijama su po pravilu cink Zn, litijum Li, magnezijum Mg; oksidanti (katode) - oksidi mangana MnO2, bakra CuO, srebra Ag2O, sumpora SO2, kao i soli CuCl2, PbCl2, FeS i kiseonika O2.
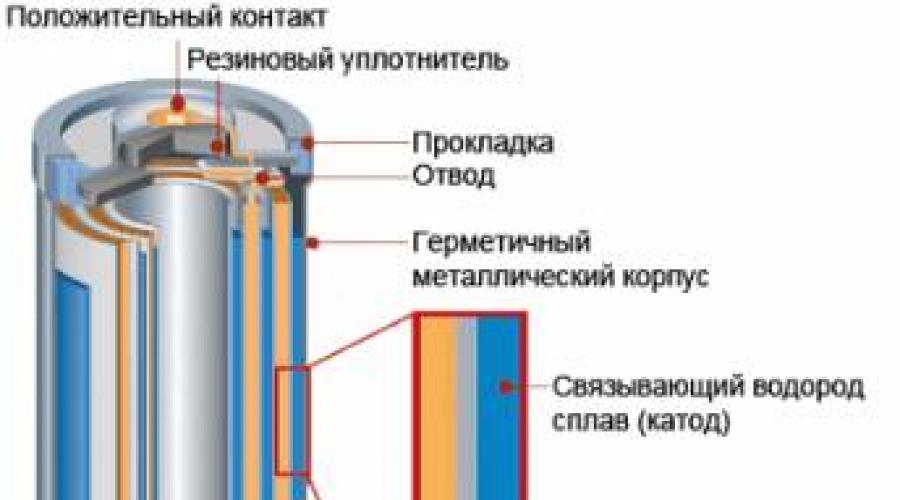
Najrasprostranjenija proizvodnja u svijetu ostaje proizvodnja mangan-cink elemenata Mn-Zn, koji se široko koriste za napajanje radio opreme, komunikacionih uređaja, magnetofona, baterijskih lampi itd. Dizajn takve galvanske ćelije prikazan je na slici.
Reakcije koje stvaraju struju u ovom elementu su:
Na anodi (–): Zn – 2ē → Zn2+ (u praksi se cink omotač tijela elementa postepeno rastvara);
Na katodi (+): 2MnO2 + 2NH4+ + 2ē → Mn2O3 + 2NH3 + H2O.
U elektrolitskom prostoru se odvijaju i sljedeći procesi:
Na anodi Zn2+ + 2NH3 →2+;
Na katodi Mn2O3 + H2O → ili 2.
U molekularnom obliku, hemijska strana rada galvanske ćelije može se predstaviti ukupnom reakcijom:
Zn + 2MnO2 + 2NH4Cl → Cl2 + 2.
Dijagram galvanske ćelije:
(–) Zn|Zn(NH3)2]2+|||MnO2 (C) (+).
EMF takvog sistema je E = 1,25 ÷ 1,50 V.
Galvanske ćelije sa sličnim sastavom reagensa u alkalnom elektrolitu (KOH) imaju bolje izlazne karakteristike, ali nisu primjenjive u prenosivi uređaji zbog opasnosti po životnu sredinu. Ag-Zn srebro-cink ćelije imaju još povoljnije karakteristike, ali su izuzetno skupe i stoga nisu isplative. Trenutno je poznato više od 40 različitih tipova prenosivih galvanskih ćelija, koje se obično nazivaju "suhe baterije".
2. Električne baterije
Električne baterije (sekundarne HIT) su punjive galvanske ćelije koje koriste eksterni izvor struje ( punjač) može se puniti.
Baterije su uređaji u kojima se pod uticajem eksternog izvora struje sistem akumulira (akumulira) hemijsku energiju(proces punjenja baterije), a zatim kada uređaj radi (pražnjenje), hemijska energija se ponovo pretvara u električnu. Dakle, pri punjenju baterija djeluje kao elektrolizator, a pri pražnjenju djeluje kao galvanska ćelija.
U pojednostavljenom obliku, baterija se sastoji od dvije elektrode (anode i katode) i ionskog vodiča između njih - elektrolita. Reakcije oksidacije se javljaju na anodi, kako za vrijeme pražnjenja tako i za vrijeme punjenja, a reakcije redukcije se javljaju na katodi.
Do nedavno su kisele olovne i alkalne nikl-kadmijum i nikl-gvozdene baterije ostale najčešće u Rusiji, pa čak i u Pridnjestrovlju.

Elektrode u njemu su olovne rešetke, od kojih je jedna u pore ispunjena prahom olovnog oksida IV - PbO2. Elektrode su povezane sa elektrolitom preko poroznog separatora. Cijela baterija je smještena u spremnik od ebonita ili polipropilena.
Kada takav uređaj radi, u njemu se javljaju sljedeći elektrodni procesi:
A). Pražnjenje ili rad baterije kao izvora električne energije.
Na anodi: (–) Pb – 2ē → Pb2+;
na katodi: (+) PbO2 + 4H+ + 2ē → Pb2+ + 2H2O.
Kationi olova formirani na elektrodama stupaju u interakciju s anionima elektrolita i oslobađaju bijeli talog olovnog sulfata
Pb2+ + SO42– = ↓PbSO4.
Ukupna reakcija koja stvara struju u procesu pražnjenja baterije:
Pb + PbO2 + 2H2SO4 = 2PbSO4↓ + 2H2O,
a kolo radne baterije kao galvanske ćelije ima oblik (–) Pb|PbSO4||PbO2 (+).
Napon na terminalima ispravne baterije dostiže 2,0÷2,5V. Tokom rada uređaja, elektrolit se troši, a talog se akumulira u sistemu. Kada koncentracija aktivnih vodikovih jona [H+] postane kritična za reakciju na katodi, baterija prestaje da radi.
B). Punjenje ili obnavljanje hemijskog potencijala baterije za njeno naknadno pretvaranje u električna energija. Da bi se to postiglo, baterija je spojena na vanjski izvor struje na način da se negativni pol napaja na terminal "anode", a pozitivni pol na "katodni" terminal. U ovom slučaju na elektrodama se javljaju obrnuti procesi pod utjecajem vanjskog napona, vraćajući ih u prvobitno stanje.
Metalno olovo obnavlja površinu elektrode (–): PbSO4 + 2ē → Pb + SO42;
Dobijeni olovni oksid IV ispunjava pore olovne rešetke (+): PbSO4 + 2H2O – 2ē → ↓PbO2 + 4H+ + SO42.
Ukupna reakcija redukcije: 2PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4.
Možete odrediti kada je proces punjenja baterije završen po pojavljivanju mjehurića plina iznad njegovih terminala („ključanje“). To je zbog pojave sporednih procesa redukcije vodikovih katjona i oksidacije vode s povećanjem napona tijekom redukcije elektrolita:
2N+ + 2ē → N2; 2H2O – 4ē → O2 + 2H2.
Efikasnost baterije dostiže 80% i radni napon dugo vrijeme zadržava svoje značenje.
EMF baterije može se izračunati pomoću jednadžbe:
RT α4(H+) α2(SO42–)
EE = EE0 + –––– ℓn ––––––––––––––– (čvrste faze u Comp.
2F α2(H2O) se uzimaju u obzir).
Treba napomenuti da se koncentrovana sumporna kiselina (ω(H2SO4) > 30%) ne može koristiti u akumulatoru, jer istovremeno se smanjuje njegova električna provodljivost i povećava rastvorljivost metalnog olova. Olovne baterije se široko koriste u drumski transport svih vrsta, na telefonskim i električnim stanicama. Međutim, zbog visoke toksičnosti olova i njegovih proizvoda, olovne baterije zahtijevaju hermetički zatvorenu ambalažu i potpunu automatizaciju procesa njihovog rada.
A) U alkalnim baterijama, pozitivna elektroda je napravljena od nikalne rešetke impregnisane gel nikl hidroksidom II Ni(OH)2; i negativan - od kadmijuma ili željeza. Jonski provodnik je 20% rastvor kalijum hidroksida KOH. Ukupne reakcije stvaranja i generiranja struje u takvim baterijama imaju oblik:
2NiOOH + Cd + 2H2O ◄====== 2Ni(OH)2 + Cd(OH)2; EE0 = 1,45 V.
2NiOOH + Fe + 2H2O ◄====== 2Ni(OH)2 + Fe(OH)2; EE0 = 1,48V.
Prednosti ovih baterija su dug radni vek (do 10 godina) i visoka mehanička čvrstoća, dok su nedostaci niska efikasnost i radni napon. Alkalne baterije se koriste za napajanje električnih automobila, utovarivača, rudarskih električnih lokomotiva, komunikacione i elektronske opreme i radija. Podsjetimo i da je kadmij vrlo toksičan metal, koji zahtijeva poštivanje sigurnosnih pravila prilikom odlaganja korištenih uređaja.
EMF i struja. Treba imati na umu da baterija mora sadržavati elemente s istim karakteristikama. Plan rada Nacrtajte ekvivalentna kola: Priključna kola reostata Priključna kola potenciometra Priključna kola galvanskih elemenata. Zaključak Iz konstruisanih kola i uslova, svako kolo ima svoju EMF vrednost, na svakom kolu je drugačije određeno. Odgovori na...
Razvoj tehnologije galvanizacije u 19. – 20. veku. ostaje uglavnom otvorena. Čini se da se to može riješiti na osnovu rekonstrukcije procesa stvaranja galvanske proizvodnje; praćenje kojim oblastima nauke i tehnologije, njihovim specifičnim dostignućima, duguje svoje formiranje; razmatranje socio-ekonomskih preduslova za nastanak i razvoj tehnologije galvanizacije. ...
Struja je manja nego u galvanostegiji; u gvozdenim galvanoplastičnim kupkama ne prelazi 10-30 a/m2, dok kod gvožđa (galvanizacije) gustina struje dostiže 2000-4000 a/m2. Galvanski premazi moraju imati fino-kristalnu strukturu i ujednačenu debljinu na različitim područjima obloženih proizvoda - izbočinama i udubljenjima. Ovaj zahtjev je posebno važan kod galvanizacije...