Jaka jest liczba masowa atomu. Masa atomowa
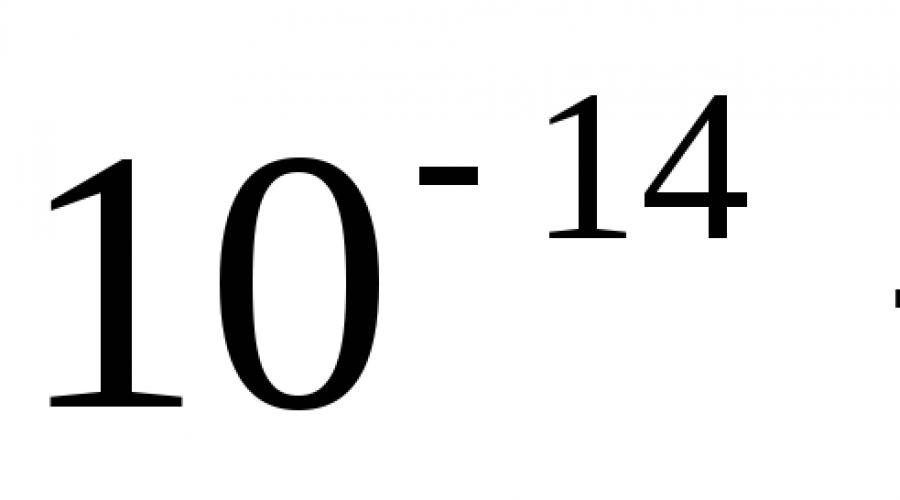
Przeczytaj także
") w rdzeniu. Zwykle oznaczane literą A. Liczba masowa jest zbliżona do masy atomowej izotopu, wyrażonej w atomowych jednostkach masy, ale pokrywa się z nią tylko w przypadku węgla-12, ponieważ atomowa jednostka masy (a.m.u.) jest obecnie definiowana jako 1/12 masy atomu 12 C. We wszystkich pozostałych przypadkach masa atomowa nie jest liczbą całkowitą, w przeciwieństwie do liczby masowej. Zatem liczba masowa izotopu chloru 35 Cl wynosi 35, a jego masa atomowa wynosi 34,96885 amu.
Liczbę masową w oznaczeniu konkretnego nuklidu (rodzaju jąder atomowych) zapisuje się lewym górnym indeksem, na przykład 232 Th. Nuklidy o tej samej liczbie masowej nazywane są izobarami (na przykład nuklidy 14 C i 14 N są izobarami).
Znajomość liczby masowej pozwala oszacować masę jądra i atomu. Jeśli znana jest liczba masowa, to masa M atom i jego jądro szacuje się z następującej zależności M ≈ Jestem N, Gdzie M N ≈ 1,67·10 −27 kg – masa nukleonu, czyli protonu lub neutronu. Na przykład atom glinu-27 i jego jądro zawierają 27 nukleonów (13 protonów i 14 neutronów). Jego masa wynosi w przybliżeniu 27·1,67·10−27 kg ≈ 4,5·10−26 kg. Jeżeli konieczne jest uzyskanie masy jądra z większą dokładnością, należy wziąć pod uwagę, że nukleony w jądrze są powiązane siłami przyciągania jądrowego, a zatem zgodnie z zależnością E=mc 2 masa jądra maleje. Do masy atomu należy również dodać całkowitą masę elektronów na orbitach wokół jądra. Wszystkie te korekty nie przekraczają jednak 1%.
| 238 92 U | → | 234 90 Cz | + | 4 2 On |
po lewej stronie liczba masowa jądra początkowego wynosi 238, po prawej stronie reakcji znajdują się dwa jądra o liczbach masowych 234 i 4, co w sumie daje 238. Biorąc pod uwagę fakt, że liczba masowa alfa cząstka (jądro helu-4) wynosi 4, rozpad alfa zmniejsza liczbę masową rozpadającego się jądra o 4 jednostki. Wszelkie rodzaje rozpadu beta (rozpad beta minus, rozpad pozytonów, wychwyt elektronów, wszystkie rodzaje podwójnego rozpadu beta) nie zmieniają liczby masowej, ponieważ w tym procesie tylko niektóre nukleony jądra przekształcają się z jednego typu na drugi (protony na neutrony lub z powrotem). Przejście izomeryczne również nie zmienia liczby masowej jądra.
Notatki
Zobacz też
Fundacja Wikimedia. 2010.
Zobacz, co oznacza „liczba mszalna” w innych słownikach:
- (liczba nukleonów, symbol A), Łączna NUKLEONY (NEUTRONY i PROTONY) w JĄDRZE ATOMOWYM. Zwykle jest zapisywany jako indeks górny przed symbolem chemicznym pierwiastka. Zatem najlżejszy pierwiastek, wodór, ma tylko jeden proton w swoim jądrze i... ... Naukowe i techniczne słownik encyklopedyczny
Całkowita liczba nukleonów (neutronów i protonów) w at. rdzeń. Różne dla izotopów tej samej substancji chemicznej. element. Fizyczny słownik encyklopedyczny. M.: Encyklopedia radziecka. Redaktor naczelny A. M. Prochorow. 1983. LICZBA MASOWA... Encyklopedia fizyczna
Liczba nukleonów w jądrze atomowym. Zwykle wskazane w lewym górnym rogu symbolu pierwiastek chemiczny(np. 10 V)… Wielki słownik encyklopedyczny
LICZBA MASOWA- całkowita liczba nukleonów (protonów i neutronów) w jądrze atomowym, oznaczona na przykład literą A i oznaczona indeksem w lewym górnym rogu symbolu odpowiedniego pierwiastka. 32S oznacza izotop siarki o liczbie masowej 32 (A = 32). Numer części izotopu jest równy całości... ... Wielka encyklopedia politechniczna
Liczba masowa- - [Ya.N.Luginsky, M.S.Fezi Zhilinskaya, Yu.S.Kabirov. Angielsko-rosyjski słownik elektrotechniki i energetyki, Moskwa] Tematyka elektrotechniki, podstawowe pojęcia EN liczba masowa ... Przewodnik tłumacza technicznego
Liczba nukleonów w jądrze atomowym. Zwykle wskazany w lewym górnym rogu symbolu pierwiastka chemicznego (na przykład 10B). * * * LICZBA MASY LICZBA MASY, liczba nukleonów w jądrze atomowym. Zwykle wskazany w lewym górnym rogu symbolu pierwiastka chemicznego... ... słownik encyklopedyczny
Liczba masowa- masės skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: pol. Liczba masowa; liczba jądrowa; liczba nukleonów vok. Massenzahl, f; Nukleonenzahl, f rus. liczba masowa, n; numer… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Liczba masowa- masės skaičius statusas T sritis chemija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: pol. Liczba masowa; liczba jądrowa; liczba nukleonowa rus. Liczba masowa... Chemijos terminų aiškinamasis žodynas
Liczba masowa- masės skaičius statusas T sritis fizika atitikmenys: engl. Liczba masowa; liczba jądrowa; liczba nukleonów vok. Massenzahl, f; Massezahl, f; Nukleonenzahl, f rus. liczba masowa, n pranc. nazwa masowa, m; nombre de nucléons, m … Fizikos terminų žodynas
Liczba nukleonów (protonów i neutronów) w jądrze atomowym; oznaczony literą A i zwykle jest oznaczony w lewym górnym rogu obok symbolu pierwiastka, np. 32S oznacza izotop siarki o A = 32. T.t. i ładunek jądrowy Z, wyrażony w jednostkach elementarnych ... Wielka encyklopedia radziecka
Książki
- Niekompetentny menadżer. Niekompetencja jako masowe szaleństwo, Farnham Adrian. Zaskakująca liczba osób pracuje pod kierownictwem menedżerów, którzy są wyraźnie niekompetentni. Część ekspertów uważa, że w niektórych sektorach gospodarki liczba niekompetentnych pracowników...
Środek atomu zawiera większość jego masy i cały jego ładunek dodatni. Ten obszar atomu nazywany jest jądrem.
Wymiary atomu wynoszą m, a wymiary jądra wynoszą  m masa jądra stanowi 99,95% masy atomu. W neutralnym atomie Z elektrony. Ładunek jądrowy jest dodatni i stanowi wielokrotność ładunku elementarnego
m masa jądra stanowi 99,95% masy atomu. W neutralnym atomie Z elektrony. Ładunek jądrowy jest dodatni i stanowi wielokrotność ładunku elementarnego  kl. Ładunek jądrowy można przedstawić jako
kl. Ładunek jądrowy można przedstawić jako  , Gdzie Z- liczba ładunku, pokrywa się z liczbą chemiczną układu okresowego i jest równa liczbie protonów zawartych w jądrze.
, Gdzie Z- liczba ładunku, pokrywa się z liczbą chemiczną układu okresowego i jest równa liczbie protonów zawartych w jądrze.
Drugą najważniejszą cechą jądra jest jego masa. Masa jądra okazała się większa niż suma mas protonów zawartych w jądrze.
Założono, że jądro zawiera cząstki obojętne. W 1932 roku Chadwig odkrył neutrony. Ivanenko i Heisenberg zaproponowali teorię jądra protonowo-neutronowego. Jądro rozpada się na protony i neutrony. Nazywa się je nukleonami. Całkowita liczba nukleonów w jądrze zwana liczbą masowąA
.
Całkowita liczba neutronów wynosi N=A-Z. Masa spoczynkowa protonu wynosi  kg, masa neutronu wynosi
kg, masa neutronu wynosi  kg.
kg.
Jądro pierwiastka chemicznego jest oznaczone tym samym symbolem, co atom obojętny  , Gdzie Z- liczba atomowa (ładunek jądrowy), A- liczba masowa (liczba nukleonów w jądrze). Jądra o tej samej liczbie ładunków, ale różnych masach, nazywane są izotopami (izotopy różnią się liczbą neutronów). Jądra o tej samej liczbie masowej, ale różnych liczbach ładunku, nazywane są izobarami.
, Gdzie Z- liczba atomowa (ładunek jądrowy), A- liczba masowa (liczba nukleonów w jądrze). Jądra o tej samej liczbie ładunków, ale różnych masach, nazywane są izotopami (izotopy różnią się liczbą neutronów). Jądra o tej samej liczbie masowej, ale różnych liczbach ładunku, nazywane są izobarami.
28. Właściwości sił nuklearnych.
Cechy sił nuklearnych:

29. Radioaktywność. Rozpad alfa i beta. Zasady offsetu.
Nazywa się radioaktywnością przemiana niestabilnych izotopów jednego pierwiastka chemicznego w izotopy innego pierwiastka, której towarzyszy emisja części cząstek. Radioaktywność naturalna to radioaktywność obserwowana w niestabilnych izotopach występujących w przyrodzie. Sztuczna radioaktywność to radioaktywność izotopów uzyskana w wyniku reakcji jądrowych.
Promieniowanie radioaktywne ma złożony skład. W polu magnetycznym wąska wiązka promieniowania radioaktywnego rozdziela się na trzy składowe:

 -cząsteczki –
przepływ jąder helu z ładunkiem Z=2
mi i liczba masowa A=4
(
-cząsteczki –
przepływ jąder helu z ładunkiem Z=2
mi i liczba masowa A=4
( ). Prędkość
). Prędkość  -cząstki są równe
-cząstki są równe  SM. Wejście w substancję
SM. Wejście w substancję  -cząsteczki aktywnie oddziałują z atomami i cząsteczkami, jonizują je i wzbudzają. Kiedy energia
-cząsteczki aktywnie oddziałują z atomami i cząsteczkami, jonizują je i wzbudzają. Kiedy energia  -cząsteczki redukują się do ruch termiczny, wychwytuje dwa elektrony i zamienia się w atom helu ( On). Wcześniej przebiega ścieżką zwaną biegiem. Ze względu na silne oddziaływanie z materią zasięg jest krótki. Kawałek papieru lub ubrania się przytrzymuje
-cząsteczki redukują się do ruch termiczny, wychwytuje dwa elektrony i zamienia się w atom helu ( On). Wcześniej przebiega ścieżką zwaną biegiem. Ze względu na silne oddziaływanie z materią zasięg jest krótki. Kawałek papieru lub ubrania się przytrzymuje  -cząstki. Blacha aluminiowa o grubości 0,05 mm również opóźnia
-cząstki. Blacha aluminiowa o grubości 0,05 mm również opóźnia  -cząstki. Moc jonizująca
-cząstki. Moc jonizująca  -cząstki są duże i równe
-cząstki są duże i równe  parę na całej długości.
parę na całej długości.
 -cząstki
to strumień elektronów uciekających z jąder z dużą prędkością
-cząstki
to strumień elektronów uciekających z jąder z dużą prędkością  SM. Jądro emituje elektron, gdy neutron zamienia się w proton:
SM. Jądro emituje elektron, gdy neutron zamienia się w proton:
![]()
Gdzie  - oznaczenie elektronu,
- oznaczenie elektronu,  - antyneutrino elektronowe.
- antyneutrino elektronowe.
Moc jonizująca  - cząstki są setki razy mniejsze niż cząsteczki
- cząstki są setki razy mniejsze niż cząsteczki  -cząstki, a siła penetracji jest większa.
-cząstki, a siła penetracji jest większa.  -promieniowanie jest opóźniane przez warstwę aluminium o grubości 2mm.
-promieniowanie jest opóźniane przez warstwę aluminium o grubości 2mm.
Co to jest liczba masowa jądro atomowe? Liczba masowa jest liczbowo równa sumie neutronów i protonów jądra. Jest on oznaczony literą A. Pojęcie „liczby masowej” pojawiło się w związku z tym, że o masie jądra decyduje liczba cząstek jądrowych. W jaki sposób masa jądra jest powiązana z liczbą cząstek? Dowiedzmy Się.
Struktura atomowa
Każdy atom składa się z jądra i elektronów. Z wyjątkiem atomu wodoru, ponieważ ma on tylko jeden elektron. Jądro jest naładowane dodatnio. Elektrony mają ładunek ujemny. Przyjmuje się, że ładunek każdego elektronu wynosi -1. Atom jako całość jest elektrycznie obojętny, to znaczy nie ma ładunku. Oznacza to, że liczba cząstek niosących ładunek ujemny, czyli elektronów, jest równa dodatniemu ładunkowi jądra. Na przykład w atomie tlenu ładunek jądrowy wynosi +8 i jest 8 elektronów; w atomie wapnia ładunek jądrowy wynosi +20 i jest 20 elektronów.
Struktura rdzenia
Jądro składa się z dwóch rodzajów cząstek - protonów i neutronów. Protony są naładowane dodatnio, neutrony nie mają ładunku. W ten sposób protony nadają jądru ładunek. Przyjmuje się, że ładunek każdego protonu wynosi +1. Oznacza to, ile protonów znajduje się w jądrze, będzie to ładunek całego jądra. Na przykład w jądrze węgla znajduje się 6 protonów, ładunek jądra wynosi +6.
W układzie okresowym pierwiastków Mendelejewa wszystkie pierwiastki są ułożone według rosnącego ładunku jądrowego. Wodór ma ładunek jądrowy +1 i znajduje się na pierwszym miejscu; hel ma +2, jest drugi w tabeli; lit ma +3, jest trzeci i tak dalej. Oznacza to, że ładunek jądra odpowiada numerowi seryjnemu (atomowemu) pierwiastka w tabeli.
Ogólnie rzecz biorąc, każdy atom jest elektrycznie obojętny. Oznacza to, że liczba elektronów jest równa ładunkowi jądra, czyli liczbie protonów. A ponieważ liczba protonów określa liczbę atomową pierwiastka, znając tę liczbę atomową, znamy w ten sposób liczbę elektronów, liczbę protonów i ładunek jądra.
Masa atomowa
Masę atomu (M) określa masa jego części składowych, czyli elektronów i jądra. Elektrony są bardzo lekkie w porównaniu do jądra i prawie nie wnoszą żadnego wkładu w masę całego atomu. Oznacza to, że masa atomu zależy od masy jądra. Co to jest liczba masowa? Masę jądra określa liczba cząstek wchodzących w jego skład - protonów i neutronów. Zatem liczba masowa to masa jądra wyrażona nie w jednostkach masy (gramach), ale w liczbie cząstek. Oczywiście znana jest bezwzględna masa jąder (m), wyrażona w gramach. Są to jednak bardzo małe liczby wyrażone w potęgach ujemnych. Na przykład masa atomu węgla m (C) = 1,99 ∙ 10 -23 g Stosowanie takich liczb jest niewygodne. A jeśli nie ma takiej potrzeby Wartości bezwzględne masy, ale wystarczy porównać masy pierwiastków lub cząstek, a następnie użyć względnych mas atomów (A r), wyrażonych w amu. Względna masa atomu jest podana w układzie okresowym, na przykład azot ma 14,007. Względna masa atomu, zaokrąglona do najbliższej liczby całkowitej, to liczba masowa jądra pierwiastka (A). Liczby masowe są takie, że są wygodne w użyciu - zawsze są liczbami całkowitymi: 1, 2, 3 i tak dalej. Na przykład azot ma 14, węgiel ma 12. Są one zapisane z lewym górnym indeksem, na przykład 14 N lub 12 C.

Kiedy musisz znać liczbę masową?
Znając liczbę masową (A) i liczbę atomową pierwiastka w układzie okresowym (Z), można określić liczbę neutronów. Aby to zrobić, musisz odjąć protony od liczby masowej.
Znając liczbę masową, możesz obliczyć masę jądra lub całego atomu. Ponieważ masę jądra określa masa cząstek tworzących jego skład, jest ona równa iloczynowi liczby tych cząstek i masy tych cząstek, to znaczy iloczynowi masy neutronu i liczba masowa. Masa neutronu jest równa masie protonu; na ogół określa się je jako masę nukleonu (cząstki jądrowej).
Na przykład obliczmy masę atomu aluminium. Jak widać z układu okresowego pierwiastków Mendelejewa, względna masa atomowa aluminium wynosi 26,992. Zaokrąglając, otrzymujemy liczbę masową jądra aluminium wynoszącą 27. Oznacza to, że jego jądro składa się z 27 cząstek. Masa jednej cząstki jest stałą wartością równą 1,67 ∙ 10 -24 g. Zatem masa rdzenia aluminiowego wynosi: 27 ∙ 1,67 ∙ 10 -24 g = 4,5 ∙ 10 -23 g.

Jaka jest liczba masowa jąder pierwiastków, którą musisz znać, przygotowując reakcje rozpadu promieniotwórczego lub reakcje jądrowe. Na przykład, gdy uran 235 U wychwytuje jeden neutron 1 n, powstają jądra baru 141 Ba i kryptonu 92 Kr, a także trzy wolne neutrony 1 n. Przy układaniu takich reakcji stosuje się zasadę: suma liczb masowych po prawej i lewej stronie równania nie ulega zmianie. 235+1 = 92+141+3.
Liczba masowa to całkowita liczba protonów i neutronów w jądrze atomu. Jest on oznaczony symbolem A.
Mówiąc o konkretnym jądrze atomowym, zwykle używa się terminu nuklid, a cząstki jądrowe, protony i neutrony, nazywane są zbiorczo nukleonami.
Liczba atomowa.
Liczba atomowa pierwiastka to liczba protonów w jądrze jego atomu. Oznacza się ją symbolem Z. Liczba atomowa jest powiązana z liczbą masową zależnością:
gdzie N jest liczbą neutronów w jądrze atomu.
Każdy pierwiastek chemiczny charakteryzuje się określoną liczbą atomową. Innymi słowy, żadne dwa pierwiastki nie mogą mieć tej samej liczby atomowej. Liczba atomowa nie jest równa tylko liczbie protonów w jądrze atomu tego elementu, ale jest również równa liczbie elektronów otaczających jądro atomu. Wyjaśnia to fakt, że atom jako całość jest cząstką elektrycznie obojętną. Zatem liczba protonów w jądrze atomu jest równa liczbie elektronów otaczających jądro. To stwierdzenie nie dotyczy jonów, które oczywiście są cząstkami naładowanymi.
Pierwszy eksperymentalny dowód liczby atomowej pierwiastków uzyskał w 1913 roku Henry Moseley, pracujący w Oksfordzie. Bombardował cele z litego metalu promieniami katodowymi. (Barkla i Kayi wykazali już w 1909 r., że każdy pierwiastek stały bombardowany szybką wiązką promieni katodowych emituje charakterystyczne dla tego pierwiastka promieniowanie rentgenowskie). Moseley przeanalizował charakterystyczne promienie rentgenowskie, stosując technikę zapisu fotograficznego. Odkrył, że długość fali charakterystycznego promieniowania rentgenowskiego rośnie wraz ze wzrostem masy atomowej metalu i wykazał to Pierwiastek kwadratowy częstotliwość tego promieniowania rentgenowskiego jest wprost proporcjonalna do pewnej liczby całkowitej, którą oznaczył symbolem
![]()
Moseley stwierdził, że liczba ta stanowiła w przybliżeniu połowę wartości masy atomowej. Doszedł do wniosku, że ta liczba – liczba atomowa pierwiastka – wynosi podstawowa właściwość jego atomy. Okazało się, że jest równa liczbie protonów w atomie danego pierwiastka. Zatem Moseley powiązał częstotliwość charakterystycznego promieniowania rentgenowskiego z numerem seryjnym elementu emitującego (prawo Moseleya). To prawo miało bardzo ważne ustalić prawo okresowości pierwiastków chemicznych i ustalić fizyczne znaczenie liczby atomowej pierwiastków.
Badania Moseleya pozwoliły mu przewidzieć istnienie trzech zaginionych do tego czasu układ okresowy pierwiastki o liczbach atomowych 43, 61 i 75. Pierwiastki te odkryto później i nazwano je odpowiednio technetem, prometem i renem.
Moseley zginął w bitwach I wojny światowej.
Symbole nuklidów.
Liczba masowa nuklidu jest zwykle oznaczana jako indeks górny, a liczba atomowa jako indeks dolny po lewej stronie symbolu pierwiastka. Na przykład zapis oznacza, że ten nuklid węgla (jak wszystkie inne nuklidy węgla) ma liczbę atomową 6. Ten konkretny nuklid ma liczbę masową 12. Inny nuklid węgla otrzymuje symbol Ponieważ wszystkie nuklidy węgla mają liczbę atomową 6, określona nuklid jest często zapisywany po prostu jako lub węgiel-14.
Izotopy.
Izotopy to atomowe odmiany jednego pierwiastka o różnych właściwościach. Różnią się liczbą neutronów w jądrze. Zatem izotopy tego samego pierwiastka mają tę samą liczbę atomową, ale różne liczby masowe. W tabeli Tabela 1.1 pokazuje wartości liczby masowej A, liczby atomowej Z i liczby neutronów N w jądrze atomów każdego z trzech izotopów węgla.
Tabela 1.1. Izotopy węgla

Zawartość izotopowa pierwiastków.
W większości przypadków każdy pierwiastek jest mieszaniną różnych izotopów. Zawartość każdego izotopu w takiej mieszaninie nazywa się obfitością izotopową. Na przykład krzem występuje w związkach występujących w przyrodzie, o następujących naturalnych liczebnościach izotopowych: . Należy pamiętać, że całkowita liczebność izotopowa pierwiastka musi wynosić dokładnie 100%. Względna zawartość izotopowa każdego z tych izotopów wynosi odpowiednio 0,9228, 0,0467 i 0,0305. Suma tych liczb wynosi dokładnie 1,0000.
Jednostka masy atomowej (a.m.u.).
Masa nuklidu jest obecnie akceptowana jako standard definiowania jednostki masy atomowej. Nuklidowi przypisuje się masę 12,0000 amu. Zatem jednostka masy atomowej jest równa jednej dwunastej masy tego nuklidu. Prawdziwa wartość jednostki masy atomowej to kg. Trzy cząstki podstawowe, które są składniki atom ma następujące masy:
masa protonu = 1,007277 amu
masa neutronu = 1,008 665 amu
masa elektronu = 0,000 548 6 a. jeść.
Korzystając z tych wartości, można obliczyć masę izotopową każdego konkretnego nuklidu. Na przykład masa izotopowa nuklidu jest sumą mas 17 protonów, 18 neutronów i 17 elektronów:
Jednak dokładne dane eksperymentalne wskazują, że masa izotopu ma wartość 34,968 · 85 a. e.m. Rozbieżność między wartościami obliczonymi i stwierdzonymi eksperymentalnie Nazywa się to defektem masy, przyczynę wystąpienia defektu masy wyjaśniono w sekcji. 1.3.
Na względnej skali mas atomowych masy izotopów wyraża się w wyniku podzielenia ich przez jedną dwunastą masy nuklidu. Zatem względna masa izotopowa izotopu wynosi

Należy zauważyć, że względne masy izotopowe wyrażane są w jednostkach bezwymiarowych.
Względna masa atomowa W pierwiastka chemicznego jest średnią arytmetyczną względnych mas izotopowych, biorąc pod uwagę zawartość izotopową. Oblicza się go poprzez zsumowanie iloczynów względnej masy izotopowej każdego izotopu i jego względnej liczebności.
Obliczmy względną masę atomową chloru, korzystając z następujących danych:

(zwany termin ogólny„nukleony”) w jądrze. Zwykle oznaczane literą A. Liczba masowa jest zbliżona do masy atomowej izotopu, wyrażonej w atomowych jednostkach masy, ale jest taka sama tylko dla węgla-12, ponieważ jednostka masy atomowej (a.m.u.) jest obecnie definiowana jako 1 ⁄ 12 masa atomu wynosi 12 C. We wszystkich pozostałych przypadkach masa atomowa nie jest liczbą całkowitą, w przeciwieństwie do liczby masowej. Zatem liczba masowa izotopu chloru 35 Cl wynosi 35, a jego masa atomowa wynosi 34,96885 amu.
Liczbę masową w oznaczeniu konkretnego nuklidu (rodzaju jąder atomowych) zapisuje się lewym górnym indeksem, na przykład 232 Th. Nuklidy o tej samej liczbie masowej nazywane są izobarami (na przykład nuklidy 14 C i 14 N są izobarami).
Znajomość liczby masowej pozwala oszacować masę jądra i atomu. Jeśli znana jest liczba masowa, to masa M atom i jego jądro szacuje się z następującej zależności M ≈ Jestem N, Gdzie M N ≈ 1,67·10 −27 kg – masa nukleonu, czyli protonu lub neutronu. Na przykład atom glinu-27 i jego jądro zawierają 27 nukleonów (13 protonów i 14 neutronów). Jego masa wynosi w przybliżeniu 27·1,67·10−27 kg ≈ 4,5·10−26 kg. Jeżeli konieczne jest uzyskanie masy jądra z większą dokładnością, należy wziąć pod uwagę, że nukleony w jądrze są powiązane siłami przyciągania jądrowego, a zatem zgodnie z zależnością E=mc 2 masa jądra maleje. Do masy atomu należy również dodać całkowitą masę elektronów na orbitach wokół jądra. Wszystkie te korekty nie przekraczają jednak 1%.
| 238 92 U | → | 234 90 Cz | + | 4 2 On |
po lewej stronie liczba masowa jądra początkowego wynosi 238, po prawej stronie reakcji znajdują się dwa jądra o liczbach masowych 234 i 4, co w sumie daje 238. Biorąc pod uwagę fakt, że liczba masowa alfa cząstka (jądro helu-4) wynosi 4, rozpad alfa zmniejsza liczbę masową rozpadającego się jądra o 4 jednostki. Wszelkie rodzaje rozpadu beta (rozpad beta minus, rozpad pozytonów, wychwyt elektronów, wszystkie rodzaje podwójnego rozpadu beta) nie zmieniają liczby masowej, ponieważ w tym procesie tylko niektóre nukleony jądra przekształcają się z jednego typu na drugi (protony na neutrony lub z powrotem). Przejście izomeryczne również nie zmienia liczby masowej jądra.
Napisz recenzję o artykule "Liczba mszalna"
Notatki
Zobacz też
Wyciąg charakteryzujący numer mszy
– Powiedz mi, czy nie wiedziałeś o śmierci hrabiny, kiedy przebywałeś w Moskwie? - powiedziała księżniczka Marya i natychmiast się zarumieniła, zauważając, że zadając to pytanie po jego słowach, że jest wolny, przypisała jego słowom znaczenie, którego być może nie miały.„Nie” – odpowiedział Pierre, najwyraźniej nie uznając interpretacji, jaką księżna Marya nadała jego wzmiance o jej wolności, za niezręczną. „Nauczyłem się tego w Orelu i nie możesz sobie wyobrazić, jak mnie to uderzyło”. Nie byliśmy wzorowymi małżonkami – powiedział szybko, patrząc na Nataszę i zauważając na jej twarzy ciekawość, jak zareaguje na swoją żonę. „Ale ta śmierć strasznie mnie poruszyła”. Kiedy dwie osoby się kłócą, zawsze winni są oboje. A własna wina nagle staje się strasznie ciężka w obliczu osoby, której już nie ma. A potem taka śmierć... bez przyjaciół, bez pocieszenia. „Bardzo, bardzo mi jej szkoda” – dokończył i z przyjemnością zauważył radosną aprobatę na twarzy Nataszy.
„Tak, znowu jesteście kawalerem i panem młodym” – powiedziała księżniczka Marya.
Pierre nagle zarumienił się szkarłatem i przez długi czas starał się nie patrzeć na Nataszę. Kiedy zdecydował się na nią spojrzeć, jej twarz była zimna, surowa, a nawet pogardliwa, jak mu się wydawało.
– Ale czy naprawdę widziałeś i rozmawiałeś z Napoleonem, jak nam powiedziano? - powiedziała księżniczka Marya.
Pierre roześmiał się.
- Nigdy nigdy. Każdemu zawsze się wydaje, że bycie więźniem oznacza bycie gościem Napoleona. Nie tylko go nie widziałem, ale i o nim nie słyszałem. Znalazłem się w dużo gorszym towarzystwie.
Kolacja dobiegła końca, a Pierre, który początkowo nie chciał rozmawiać o swojej niewoli, stopniowo wciągnął się w tę historię.
- Ale czy to prawda, że zostałeś, żeby zabić Napoleona? – zapytała go Natasza, uśmiechając się lekko. „Domyśliłem się, kiedy spotkaliśmy cię w Wieży Suchariewa; Pamiętać?
Pierre przyznał, że to prawda i od tego pytania, stopniowo kierując się pytaniami księżnej Marii, a zwłaszcza Nataszy, wciągnął się w szczegółowa historia o swoich przygodach.
Z początku mówił z tym drwiącym, łagodnym spojrzeniem, jakim teraz patrzył na ludzi, a zwłaszcza na siebie; ale potem, kiedy doszedł do historii o okropnościach i cierpieniach, które widział, nie zauważając tego, dał się ponieść i zaczął mówić z powściągliwą ekscytacją osoby przeżywającej silne wrażenia w swojej pamięci.