Podstawowe własności elektronu. Z czego zrobiony jest elektron? Masa i ładunek elektronu. Podstawowe i kwantowe własności elektronu
Elektron to cząstka elementarna, która jest jedną z głównych jednostek w strukturze materii. Ładunek elektronu jest ujemny. Najdokładniejsze pomiary wykonali na początku XX wieku Millikan i Ioffe.
Ładunek elektronu wynosi minus 1,602176487 (40) * 10 -19 C.
Dzięki tej wartości mierzony jest ładunek elektryczny innych najmniejszych cząstek.
Ogólna koncepcja elektronu
W fizyce cząstek mówi się, że elektron jest niepodzielny i nie ma struktury. Bierze udział w procesach elektromagnetycznych i grawitacyjnych, należy do grupy leptonów, podobnie jak jego antycząstka – pozyton. Spośród innych leptonów ma najlżejszą wagę. Jeśli zderzają się elektrony i pozytony, prowadzi to do ich anihilacji. Taka para może powstać z kwantu gamma cząstek.
Zanim zmierzono neutrino, to elektron był uważany za najlżejszą cząstkę. W mechanice kwantowej określa się ją mianem fermionów. Elektron ma również moment magnetyczny. Jeśli nazywamy go również pozytonem, to pozyton jest rozdzielany jako cząstka naładowana dodatnio, a elektron nazywa się negatronem, jako cząstka z ładunkiem ujemnym.

Indywidualne właściwości elektronów
Elektrony należą do pierwszej generacji leptonów o właściwościach cząstek i fal. Każdy z nich posiada stan kwantowy, który jest określany poprzez pomiar energii, orientacji spinu i innych parametrów. Ujawnia swoją przynależność do fermionów poprzez niemożność posiadania dwóch elektronów w tym samym stanie kwantowym w tym samym czasie (zgodnie z zasadą Pauliego).
Bada się ją w taki sam sposób jak quasicząstkę w okresowym potencjale kryształu, w którym masa efektywna może znacznie różnić się od masy w spoczynku.
Poprzez ruch elektronów powstaje prąd elektryczny, magnetyzm i termoelektroniczne pole elektromagnetyczne. Ładunek elektronu w ruchu tworzy pole magnetyczne. Jednak zewnętrzne pole magnetyczne odchyla cząstkę z kierunku prostego. Przyspieszony elektron nabywa zdolność do pochłaniania lub emitowania energii w postaci fotonu. Jego zestaw składa się z elektronowych powłok atomowych, których liczba i położenie określają właściwości chemiczne.
Masa atomowa składa się głównie z jądrowych protonów i neutronów, podczas gdy masa elektronów stanowi około 0,06% całkowitej masy atomowej. Siła Coulomba jest jedną z głównych sił, które mogą utrzymywać elektron blisko jądra. Ale kiedy cząsteczki są tworzone z atomów i powstają wiązania chemiczne, elektrony są redystrybuowane w nowej utworzonej przestrzeni.
Nukleony i hadrony biorą udział w powstawaniu elektronów. Izotopy o właściwościach radioaktywnych są zdolne do emitowania elektronów. W warunkach laboratoryjnych cząstki te można badać w specjalnych instrumentach, a np. teleskopy mogą wykrywać z nich promieniowanie w obłokach plazmy.

Otwarcie
Elektron odkryli niemieccy fizycy w XIX wieku, kiedy badali katodowe właściwości promieni. Następnie inni naukowcy zaczęli go bardziej szczegółowo badać, podnosząc go do rangi osobnej cząstki. Zbadano promieniowanie i inne powiązane zjawiska fizyczne.
Na przykład grupa kierowana przez Thomsona oszacowała ładunek elektronu i masę promieni katodowych, których stosunki, jak odkryli, nie zależą od źródła materiału.
Becquerel odkrył, że minerały same emitują promieniowanie, a ich promienie beta mogą być odchylane przez działanie pola elektrycznego, podczas gdy masa i ładunek zachowują ten sam stosunek, co promienie katodowe.

Teoria atomowa
Zgodnie z tą teorią atom składa się z jądra i elektronów wokół niego, ułożonych w formie chmury. Znajdują się one w pewnych skwantowanych stanach energetycznych, których zmianie towarzyszy proces absorpcji lub emisji fotonów.
Mechanika kwantowa
Na początku XX wieku sformułowano hipotezę, zgodnie z którą cząstki materialne mają właściwości zarówno cząstek właściwych, jak i fal. Światło może również przejawiać się w postaci fali (nazywa się to falą de Broglie) i cząstek (fotonów).
W rezultacie sformułowano słynne równanie Schrödingera, opisujące propagację fal elektronowych. Takie podejście nazywa się mechaniką kwantową. Wykorzystano go do obliczenia stanów elektronowych energii w atomie wodoru.
Podstawowe i kwantowe własności elektronu
Cząstka wykazuje właściwości fundamentalne i kwantowe.
Do podstawowych należą masa (9,109 * 10 -31 kilogramów), elementarny ładunek elektryczny (czyli minimalna część ładunku). Zgodnie z dotychczasowymi pomiarami w elektronie nie znaleziono żadnych pierwiastków, które mogłyby ujawnić jego podstrukturę. Ale niektórzy naukowcy są zdania, że jest to cząstka naładowana punktowo. Jak wskazano na początku artykułu, elektroniczny ładunek elektryczny wynosi -1,602 * 10 -19 C.

Będąc cząstką, elektron może być jednocześnie falą. Eksperyment z dwiema szczelinami potwierdza możliwość jego jednoczesnego przejścia przez obie. Jest to sprzeczne z właściwościami cząstki, gdzie za każdym razem można przejść tylko przez jedną szczelinę.
Uważa się, że elektrony mają te same właściwości fizyczne. Dlatego ich permutacja, z punktu widzenia mechaniki kwantowej, nie prowadzi do zmiany stanu układu. Funkcja falowa elektronów jest antysymetryczna. Dlatego jego rozwiązania znikają, gdy identyczne elektrony wchodzą w ten sam stan kwantowy (zasada Pauliego).
Ładunek właściwy elektronu (tj. stosunek) został po raz pierwszy zmierzony przez Thomsona w 1897 roku przy użyciu rury wyładowczej pokazanej na ryc. 74.1. Wiązka elektronów wychodząca z otworu w anodzie A (promienie katodowe; patrz § 85) przechodziła między płytami płaskiego kondensatora i padała na ekran fluorescencyjny, tworząc na nim świecącą plamę.
Poprzez przyłożenie napięcia do płytek kondensatora możliwe było oddziaływanie na wiązkę prawie jednorodnym polem elektrycznym. Rurka została umieszczona między biegunami elektromagnesu, za pomocą którego możliwe było wytworzenie jednolitego pola magnetycznego prostopadłego do elektrycznego na tym samym odcinku ścieżki elektronów (obszar tego pola jest zakreślone na ryc. 74.1 z kropkowanym okręgiem). Przy wyłączonych polach wiązka trafiała na ekran w punkcie O. Każde z pól z osobna powodowało przesunięcie wiązki w pionie. Wartości przemieszczeń są określone wzorami (73.3) i (73.4) uzyskanymi w poprzednim akapicie.
Włączenie pola magnetycznego i pomiar spowodowanego nim przesunięcia śladu wiązki
![]()
Thomson włączył także pole elektryczne i dobrał jego wartość tak, aby wiązka ponownie trafiła w punkt O. W tym przypadku pola elektryczne i magnetyczne działały na elektrony wiązki jednocześnie z tą samą wielkością, ale przeciwnie skierowanymi siłami. W tym przypadku warunek
Rozwiązując równania (74.1) i (74.2) razem, Thomson obliczył .
Bush wykorzystał metodę ogniskowania magnetycznego do określenia ładunku właściwego elektronów. Istota tej metody jest następująca. Załóżmy, że w jednorodnym polu magnetycznym z pewnego punktu wylatuje nieco rozbieżna wiązka elektronów symetryczna względem kierunku pola, mająca tę samą prędkość v. Kierunki, wzdłuż których wylatują elektrony, tworzą małe kąty a z kierunkiem B. W § 72 stwierdzono, że elektrony poruszają się w tym przypadku po trajektoriach spiralnych, wykonując w tym samym czasie
![]()
pełny obrót i przesunięcie wzdłuż kierunku pola na odległość równą
![]()

Ze względu na mały kąt a odległości (74,3) dla różnych elektronów okazują się praktycznie takie same i równe (dla małych kątów ). W konsekwencji lekko rozbieżna wiązka zostanie skupiona w punkcie oddalonym o odległość od punktu emisji elektronów
![]()
W eksperymencie Busha elektrony emitowane przez gorącą katodę K (rys. 74.2) są przyspieszane, przechodząc przez różnicę potencjałów U przyłożoną między katodą K i anodą A. W rezultacie uzyskują one prędkość u, wartość które można znaleźć w relacji
Po wylocie z otworu w anodzie elektrony tworzą wąską wiązkę skierowaną wzdłuż osi opróżnionej rurki umieszczonej wewnątrz elektrozaworu. Na wejściu elektromagnesu umieszczony jest kondensator, do którego doprowadzane jest napięcie przemienne. Pole wytworzone przez kondensator odchyla elektrony wiązki od osi instrumentu pod małymi kątami, które zmieniają się w czasie. Prowadzi to do „wirowania” wiązki – elektrony zaczynają poruszać się po różnych trajektoriach spiralnych. Na wyjściu elektrozaworu umieszczony jest ekran fluorescencyjny. Jeśli tak dobierzemy indukcję magnetyczną B, aby odległość Г od kondensatora do ekranu spełniała warunek
(l jest skokiem helisy, jest liczbą całkowitą), wtedy punkt przecięcia trajektorii elektronów uderzy w ekran - wiązka elektronów zostanie skupiona w tym punkcie i wzbudzi na ekranie ostrą plamę świetlną. Jeśli warunek (74.6) nie jest spełniony, punkt świetlny na ekranie będzie rozmyty. Rozwiązując równania (74,4), (74,5) i (74,6) razem, możemy znaleźć
Najdokładniejsza wartość ładunku właściwego elektronu, ustalona na podstawie wyników uzyskanych różnymi metodami, wynosi
Wartość (74,7) podaje stosunek ładunku elektronu do jego masy spoczynkowej. W eksperymentach Thomsona, Busha i innych podobnych eksperymentach wyznaczono stosunek ładunku do masy relatywistycznej, równy
![]()

W eksperymentach Thomsona prędkość elektronów wynosiła około 0,1 sekundy. Przy tej prędkości masa relatywistyczna przekracza masę spoczynkową o 0,5%. W kolejnych eksperymentach prędkość elektronów osiągała bardzo wysokie wartości. We wszystkich przypadkach stwierdzono spadek wartości mierzonych wraz ze wzrostem v, co nastąpiło dokładnie zgodnie ze wzorem (74,8).
Ładunek elektronu został określony z dużą dokładnością przez Millikana w 1909 roku. Millikan wprowadził maleńkie kropelki oleju do zamkniętej przestrzeni pomiędzy poziomo umieszczonymi płytami kondensatora (ryc. 74.3). Podczas rozpylania kropelki były naelektryzowane i można je było instalować nieruchomo, wybierając wartość i znak napięcia na kondensatorze.
Równowaga znalazła się pod warunkiem
tutaj jest ładunek kropli, P jest wypadkową siłą grawitacji i siłą Archimedesa, równą
![]() (74.10)
(74.10)
( - gęstość kropel, - jej promień, - gęstość powietrza).
Ze wzorów (74.9) i (74.10), znając , można było znaleźć . Aby określić promień, mierzono szybkość równomiernego opadania kropli przy braku pola. Jednostajny ruch kropli ustala się pod warunkiem zrównoważenia siły P przez siłę oporu (patrz wzór (78.1) 1. objętości; - lepkość powietrza):
![]() (74.11)
(74.11)
Ruch kropli obserwowano pod mikroskopem. Pomiar determinowany był czasem, w którym kropla przebyła odległość pomiędzy dwoma włóknami widocznymi w polu widzenia mikroskopu.
Bardzo trudno jest precyzyjnie ustalić równowagę kropli. Dlatego zamiast pola odpowiadającego warunkowi (74,9) włączono takie pole, pod działaniem którego kropla zaczęła poruszać się w górę z małą prędkością. Stała prędkość wznoszenia jest wyznaczana z warunku, że siła P i siła w sumie równoważą siłę
Eliminując z równania (74.10), (74.11) i (74.12) P i , otrzymujemy wyrażenie na
![]()
(Milliken wprowadził poprawkę do tego wzoru, biorąc pod uwagę, że rozmiary kropel były porównywalne ze średnią drogą swobodną cząsteczek powietrza).

Tak więc mierząc prędkość swobodnego spadania kropli i prędkość jej wznoszenia się w znanym polu elektrycznym, można było znaleźć ładunek kropli e. Mierząc prędkość przy określonej wartości ładunku, Millikan spowodował jonizacja powietrza poprzez napromieniowanie przestrzeni między płytami promieniami rentgenowskimi. Oddzielne jony przywierające do kropelki zmieniały jej ładunek, w wyniku czego zmieniała się również prędkość. Po zmierzeniu nowej wartości prędkości ponownie napromieniowano przestrzeń między płytami itp.
Zmiany ładunku kropli mierzone przez Millikana i sam ładunek za każdym razem okazywały się być całkowitymi wielokrotnościami tej samej wartości. W ten sposób eksperymentalnie udowodniono dyskretność ładunku elektrycznego, tj. fakt, że każdy ładunek składa się z ładunków elementarnych tej samej wielkości.
Wartość ładunku elementarnego, ustalona na podstawie pomiarów Millikana i danych uzyskanych innymi metodami, jest równa
FIZYCZNE PODSTAWY DZIAŁANIA IONIC |
|||
I URZĄDZENIA PÓŁPRZEWODNIKOWE |
|||
1.1. Właściwości elektronów |
|||
Pole elektryczne w urządzeniach elektronicznych przyspiesza lub tor- |
|||
powoduje ruch elektronów. Niech elektron e znajdujący się w |
|||
natężenie pola elektrycznego E , działa siła F (rys. 1.1) |
|||
F = −eE, |
|||
skierowane przeciwko sile pola. |
|||
Zgodnie z drugim prawem Newtona siła F jest równa iloczynowi |
|||
masa elektronu m przez przyspieszenie a , nadawane elektronowi przez siłę F |
|||
w polu o natężeniu E: |
|||
F = ma. |
|||
Od (1.1) i (1.2) przyspieszenie elektryczne |
|||
a = E e , |
|||
z równania (1.3) widać, że c |
|||
zmieniając napięcie elektryczne |
Ryż. 1.1. Elektron w jednorodnym |
||
zmiany pola przyspiesza |
pole elektryczne |
||
nieelektron. Dodatkowo dołącz- |
|||
na zbiegu siły pola w kierunku prędkości początkowej v 0 |
elektron |
||
porusza się szybko i uzyskuje najwyższą prędkość i kinetykę |
|||
energia na końcu swojej drogi. |
|||
Znajdujemy prędkość v elektronu na podstawie znanych pozycji |
|||
fizyka. Po pierwsze, praca sił pola na ruch elektryczności |
|||

ron od punktu A do punktu B jest iloczynem ładunku |
|||
elektron e na różnicy potencjałów tych punktów: |
|||
W e \u003d (− e) (U A − U B ). |
|||
Ponieważ U B > U A, to |
|||
U A − U B = − U . |
|||
Dlatego pracuj |
|||
We = (e)(− U ) = eU. |
|||
Po drugie, zgodnie z prawem zachowania energii, praca, którą wydaliśmy |
|||
pole ruchu elektronu jest równe przyrostowi kinetyki |
|||
energia netto elektronu poruszającego się w polu elektrycznym: |
|||
W = m (v 2 − v 2 ) / 2 . |
|||
Biorąc prędkość początkową v 0 = 0, z (5) znajdujemy wartość |
|||
końcowa prędkość elektronu |
|||
2 My = |
2 U e . |
||
Prędkość elektronu w urządzeniach elektronicznych jest znacznie mniejsza |
|||
mniejsza niż prędkość światła, czyli stosunek wartości e/m ≈ e /m 0 |
|||
v ≈ 600 |
|||
Z (1.9) widać, że prędkość elektronu w elektrycznym |
|||
pole (km/s) zależy tylko od różnicy potencjałów między |
|||
punkt początkowy i końcowy ścieżki, którą przemierza elektron, oraz |
|||
nie zależy od kształtu ścieżki. Czasami prędkość elektronu jest mierzona w |
|||
wolty. Na przykład: prędkość elektronu wynosi 100 V. Oznacza to, że elektryczność |
|||
tron uzyskał tę prędkość, przechodząc przez różnicę potencjałów 100 V. |
|||
Jeśli elektron rozpoczyna swój ruch ze stanu spoczynku, to |
|||
porusza się równomiernie przyspieszony, prostoliniowo wbrew sile |
|||
linie pola elektrycznego, pochłaniające energię z pola. Elektryczny |
|||
Pole magnetyczne elektronu przyspiesza. |
|||
Jeżeli prędkość początkowa pokrywa się z kierunkiem siły |
|||
linie pola elektrycznego, takie pole dla elektronu to a |
|||
beczenie. Prędkość elektronu zmniejszy się, energia elektryczna |
|||
rona również zmniejszy się (powróci na pole). Jeśli |
|||

pozwolić na wielkość pola, elektron zatrzyma się, a następnie zacznie poruszać się wbrew liniom siły tego pola.
Jeżeli prędkość początkowa jest skierowana przeciw liniom siły pola elektrycznego, to takie pole dla elektronu przyspiesza. Pole elektryczne przesuwa ładunki dodatnie w kierunku linii sił pola.
1.2. Rodzaje emisji elektronicznej
Zjawisko emisji elektronów z powierzchni ciała stałego nazywamy emisją elektronów, a źródło elektronów nazywamy emiterem. W zależności od metod oddziaływania energii zewnętrznej na elektrony, które powodują ich opuszczenie emitera, rozróżnia się kilka rodzajów emisji elektronów.
Emisja termionowa powstaje w wyniku nagrzania emitera. Wraz ze wzrostem temperatury pojawiają się drgania cieplne stałej sieci. Dzięki tej termicznej energii wzbudzenia część elektronów opuszcza emiter, tworząc prąd emisyjny. Im wyższa temperatura emitera, tym więcej elektronów pozyskuje taką energię, w wyniku czego wzrasta prąd emisji termoelektrycznej. Minimalna temperatura, w której pojawia się prąd emisyjny, nazywana jest krytyczną. To zależy od materiału emitera.
Wtórna emisja elektronów - emisja wtórnego zelektryfikowanego
elektrony z powierzchni emitera, gdy jest on napromieniowany strumieniem elektronów pierwotnych. Pierwotny strumień elektronów padający na emiter wtórny częściowo odbija się od jego powierzchni, a częściowo wnika głęboko w nią. Tutaj elektrony pierwotne zderzają się z elektronami sieci krystalicznej emitera, oddając im część ich energii, wzbudzając je. Część wzbudzonych elektronów trafia do środowiska zewnętrznego, elektrony te są wtórne.
Emisja elektronów elektrostatycznych (autoelektronika)
powstaje z powierzchni ciała stałego lub ciekłego pod działaniem zewnętrznego, przyspieszającego pola elektrycznego o dużym natężeniu (107 V/m). Im większe natężenie pola, tym większy prąd emisji pola.
Emisja fotoelektroniczna występuje, gdy emiter jest napromieniowany strumieniem światła. Wydajność tego typu emisji zależy od długości fali (zależność odwrotna) oraz od wielkości strumienia świetlnego (zależność bezpośrednia).
Elektron jest podstawową cząstką, jedną z tych, które są strukturalnymi jednostkami materii. Według klasyfikacji jest to fermion (cząstka o spinie połówkowym, nazwana na cześć fizyka E. Fermiego) i lepton (cząstki o spinie połówkowym, które nie uczestniczą w oddziaływaniu silnym, jedna z czterech główne w fizyce). Barion wynosi zero, podobnie jak inne leptony.
Do niedawna uważano, że elektron jest cząstką elementarną, czyli niepodzielną, bezstrukturalną cząstką, ale teraz naukowcy mają inne zdanie. Z czego składa się elektron według współczesnych fizyków?
Historia nazw
Już w starożytnej Grecji przyrodnicy zauważyli, że bursztyn, wcześniej nacierany wełną, przyciąga do siebie drobne przedmioty, czyli wykazuje właściwości elektromagnetyczne. Elektron otrzymał swoją nazwę od greckiego ἤλεκτρον, co oznacza „bursztyn”. Termin został zaproponowany przez J. Stoneya w 1894 roku, chociaż sama cząstka została odkryta przez J. Thompsona w 1897 roku. Trudno było to wykryć, powodem tego jest niewielka masa, a ładunek elektronu stał się decydujący w eksperymencie. Pierwsze zdjęcia cząstki wykonał Charles Wilson za pomocą specjalnego aparatu, który jest używany nawet we współczesnych eksperymentach i nosi jego imię.
Ciekawostką jest to, że jednym z warunków wstępnych odkrycia elektronu jest wypowiedź Benjamina Franklina. W 1749 wysunął hipotezę, że elektryczność jest substancją materialną. To właśnie w jego pracach po raz pierwszy użyto takich określeń jak ładunki dodatnie i ujemne, kondensator, rozładowanie, bateria i cząsteczka prądu. Uważa się, że ładunek właściwy elektronu jest ujemny, a protonu dodatni.
Odkrycie elektronu
W 1846 roku pojęcie „atom elektryczności” zaczął być stosowany w jego pracy przez niemieckiego fizyka Wilhelma Webera. Michael Faraday odkrył termin „jon”, który jest chyba jeszcze znany ze szkoły. Wielu wybitnych naukowców zajmowało się naturą elektryczności, jak niemiecki fizyk i matematyk Julius Plücker, Jean Perrin, angielski fizyk William Crookes, Ernst Rutherford i inni.
Tak więc, zanim Joseph Thompson pomyślnie zakończył swój słynny eksperyment i udowodnił istnienie cząstki mniejszej od atomu, wielu naukowców pracowało w tej dziedzinie, a odkrycie nie byłoby możliwe, gdyby nie wykonali tej kolosalnej pracy.

W 1906 roku Joseph Thompson otrzymał Nagrodę Nobla. Eksperyment wyglądał następująco: wiązki promieni katodowych przepuszczano przez równoległe metalowe płytki, które wytwarzały pole elektryczne. Potem musieli zrobić to samo, ale za pomocą systemu cewek, które wytworzyły pole magnetyczne. Thompson stwierdził, że pod działaniem pola elektrycznego promienie ulegają odchyleniu i to samo zaobserwowano z efektem magnetycznym, ale wiązki promieni katodowych nie zmieniają swoich trajektorii, jeśli oba te pola działają na nie w określonych proporcjach zależnych od prędkość cząstek.
Po obliczeniach Thompson dowiedział się, że prędkość tych cząstek jest znacznie mniejsza niż prędkość światła, co oznaczało, że mają one masę. Od tego momentu fizycy zaczęli wierzyć, że otwarte cząstki materii są częścią atomu, co zostało później potwierdzone. Nazwał to „planetarnym modelem atomu”.
Paradoksy kwantowego świata
Pytanie, z czego składa się elektron, jest dość skomplikowane, przynajmniej na tym etapie rozwoju nauki. Zanim się nad tym zastanowimy, trzeba odnieść się do jednego z paradoksów fizyki kwantowej, którego nawet sami naukowcy nie potrafią wyjaśnić. To słynny eksperyment z podwójną szczeliną, który wyjaśnia podwójną naturę elektronu.
Jego istotą jest to, że przed „działem” strzelającym cząstkami zainstalowano ramę z pionowym prostokątnym otworem. Za nią jest ściana, na której będą widoczne ślady trafień. Więc najpierw musisz dowiedzieć się, jak zachowuje się materia. Najprościej jest wyobrazić sobie, jak maszyna wyrzuca piłki tenisowe. Część kulek wpada do dołka, a ślady po uderzeniach w ścianę tworzą jeden pionowy pasek. Jeśli w pewnej odległości zostanie dodany jeszcze jeden podobny otwór, ślady utworzą odpowiednio dwa paski.
W tej sytuacji fale zachowują się inaczej. Jeżeli na ścianie wyświetlą się ślady po zderzeniu z falą, to w przypadku pojedynczego otworu, pasek też będzie jednym. W przypadku dwóch szczelin wszystko się jednak zmienia. Fala przechodząca przez otwory jest podzielona na pół. Jeśli górna część jednej z fal styka się z dolną częścią drugiej, znoszą się one nawzajem, a na ścianie pojawi się wzór interferencji (kilka pionowych pasów). Miejsca na przecięciu fal zostawią ślad, ale miejsca, w których wystąpiło wzajemne tłumienie, już nie.

Niesamowite odkrycie
Za pomocą opisanego powyżej eksperymentu naukowcy mogą wyraźnie pokazać światu różnicę między fizyką kwantową a klasyczną. Kiedy zbombardowali ścianę elektronami, pojawił się na niej zwykły pionowy tor: niektóre cząstki, podobnie jak piłki tenisowe, wpadły w szczelinę, a niektóre nie. Ale wszystko się zmieniło, gdy pojawiła się druga dziura. Pojawił się na ścianie Najpierw fizycy uznali, że elektrony przeszkadzają sobie nawzajem i postanowili wpuścić je jeden po drugim. Jednak już po kilku godzinach (prędkość poruszających się elektronów jest wciąż znacznie mniejsza niż prędkość światła) wzór interferencyjny zaczął się ponownie pojawiać.
Nieoczekiwany zwrot
Elektron, wraz z niektórymi innymi cząsteczkami, takimi jak fotony, wykazuje dualizm falowo-cząsteczkowy (używany jest również termin „dualizm fal kwantowych”). Podobnie jak żywy i martwy w tym samym czasie, stan elektronu może być zarówno korpuskularny, jak i falowy.
Jednak kolejny krok w tym eksperymencie zrodził jeszcze więcej tajemnic: fundamentalna cząstka, o której wydawało się, że wszystko jest znane, stanowiła niesamowitą niespodziankę. Fizycy postanowili zainstalować w otworach urządzenie obserwacyjne, aby dokładnie ustalić, przez którą szczelinę przechodzą cząstki i jak manifestują się jako fala. Ale gdy tylko mechanizm obserwacyjny został umieszczony, na ścianie pojawiły się tylko dwa paski, odpowiadające dwóm otworom, i żadnego wzoru interferencyjnego! Gdy tylko „nadzór” został usunięty, cząsteczka ponownie zaczęła wykazywać właściwości falowe, jakby wiedziała, że nikt już jej nie obserwuje.
Inna teoria
Fizyk Born zasugerował, że cząstka nie zamienia się w falę w dosłownym tego słowa znaczeniu. Elektron „zawiera” falę prawdopodobieństwa, to ta fala daje wzór interferencji. Cząstki te mają właściwość superpozycji, to znaczy mogą znajdować się w dowolnym miejscu z pewnym prawdopodobieństwem, a zatem może im towarzyszyć taka „fala”.
Niemniej wynik jest oczywisty: sam fakt obecności obserwatora wpływa na wynik eksperymentu. Wydaje się to niewiarygodne, ale to nie jedyny tego typu przykład. Fizycy przeprowadzali eksperymenty na większych partiach materii, kiedyś obiekt był najcieńszym kawałkiem folii aluminiowej. Naukowcy zauważyli, że sam fakt wykonania pewnych pomiarów wpływał na temperaturę obiektu. Nie potrafią jeszcze wyjaśnić natury takich zjawisk.

Struktura
Ale z czego zrobiony jest elektron? W tej chwili współczesna nauka nie może odpowiedzieć na to pytanie. Do niedawna uważano ją za niepodzielną cząstkę fundamentalną, ale teraz naukowcy są skłonni wierzyć, że składa się ona z jeszcze mniejszych struktur.
Ładunek właściwy elektronu również uznano za elementarny, ale teraz odkryto kwarki, które mają ładunek ułamkowy. Istnieje kilka teorii na temat tego, z czego zbudowany jest elektron.
Dziś można zobaczyć artykuły, które twierdzą, że naukowcom udało się rozszczepić elektron. Jest to jednak tylko częściowo prawda.
Nowe eksperymenty
W latach 80. radzieccy naukowcy sugerowali, że elektron można podzielić na trzy quasi-cząstki. W 1996 roku udało się ją rozszczepić na spinon i holon, a ostatnio fizyk Van den Brink i jego zespół podzielił cząstkę na spinon i orbiton. Jednak podział można osiągnąć tylko w specjalnych warunkach. Eksperyment można przeprowadzić w ekstremalnie niskich temperaturach.
Kiedy elektrony „schładzają się” do zera absolutnego, czyli około -275 stopni Celsjusza, praktycznie zatrzymują się i tworzą między sobą coś w rodzaju materii, jakby zlewały się w jedną cząsteczkę. W takich warunkach fizykom udaje się zaobserwować kwazicząstki, z których składa się elektron.

Nośniki informacji
Promień elektronu jest bardzo mały, wynosi 2,81794. 10 -13 cm okazuje się jednak, że jego elementy są znacznie mniejsze. Każda z trzech części, na które można było „podzielić” elektron, niesie o sobie informację. Orbiton, jak sama nazwa wskazuje, zawiera dane o fali orbitalnej cząstki. Spinon odpowiada za spin elektronu, a holon mówi nam o ładunku. W ten sposób fizycy mogą oddzielnie obserwować różne stany elektronów w silnie schłodzonej substancji. Byli w stanie prześledzić pary holon-spinon i spinon-orbiton, ale nie wszystkie trzy razem.
Nowe technologie
Fizycy, którzy odkryli elektron, musieli poczekać kilkadziesiąt lat, aż ich odkrycie zostanie wprowadzone w życie. W naszych czasach technologie znajdują zastosowanie za kilka lat, wystarczy przypomnieć grafen – niesamowity materiał składający się z atomów węgla w jednej warstwie. Jaka jest korzyść z rozszczepienia elektronu? Naukowcy przewidują powstanie prędkości, która ich zdaniem jest kilkadziesiąt razy większa niż w przypadku najpotężniejszych współczesnych komputerów.
Jaki jest sekret technologii komputerów kwantowych? Można to nazwać prostą optymalizacją. W znajomym komputerze najmniejszą, niepodzielną informacją jest trochę. A jeśli uważamy, że dane są czymś wizualnym, to dla maszyny są tylko dwie możliwości. Bit może zawierać zero lub jeden, czyli części kodu binarnego.
Nowa metoda
Teraz wyobraźmy sobie, że bit zawiera zarówno zero, jak i jedynkę – to jest „bit kwantowy” lub „kubit”. Rolę prostych zmiennych będzie pełnić spin elektronu (może on obracać się zarówno zgodnie z ruchem wskazówek zegara, jak i przeciwnie do ruchu wskazówek zegara). W przeciwieństwie do zwykłego bitu, kubit może pełnić kilka funkcji jednocześnie, dzięki temu nastąpi wzrost szybkości pracy, niewielka masa i ładunek elektronu nie mają tu znaczenia.
Można to wyjaśnić na przykładzie labiryntu. Aby się z tego wydostać, musisz wypróbować wiele różnych opcji, z których tylko jedna będzie poprawna. Tradycyjny komputer, chociaż szybko rozwiązuje problemy, nadal może pracować tylko nad jednym problemem na raz. Przejdzie przez wszystkie opcje ścieżki pojedynczo i ostatecznie znajdzie wyjście. Komputer kwantowy, dzięki dwoistości kubitu, może jednocześnie rozwiązać wiele problemów. Przejrzy wszystkie możliwe opcje nie po kolei, ale w jednym momencie, a także rozwiąże problem. Jak dotąd trudność polega tylko na tym, aby wiele kwantów pracowało nad jednym zadaniem - to będzie podstawa nowej generacji komputerów.

Podanie
Większość ludzi korzysta z komputerów w gospodarstwie domowym. Zwykłe komputery jak dotąd radzą sobie dobrze, ale aby przewidzieć zdarzenia, które zależą od tysięcy, może setek tysięcy zmiennych, maszyna musi być po prostu ogromna. z łatwością poradzi sobie z przewidywaniem pogody przez miesiąc, przetwarzaniem danych o klęskach żywiołowych i ich przewidywaniem, a także wykona skomplikowane obliczenia matematyczne z wieloma zmiennymi w ułamku sekundy, a wszystko to za pomocą procesora wielkości kilku atomów. Więc być może już niedługo nasze najpotężniejsze komputery będą cienkie jak papier.

Ochrona zdrowia
Technologie obliczeń kwantowych wniosą ogromny wkład w medycynę. Ludzkość będzie miała możliwość tworzenia nanomechanizmów o najpotężniejszym potencjale, z ich pomocą będzie można nie tylko diagnozować choroby poprzez samo spojrzenie na całe ciało od środka, ale także zapewnić opiekę medyczną bez interwencji chirurgicznej: najmniejsze roboty z „mózgiem” doskonałego komputera będzie w stanie wykonywać wszystkie operacje.
Rewolucja jest również nieunikniona w dziedzinie gier komputerowych. Potężne maszyny, które mogą natychmiast rozwiązywać problemy, będą mogły grać w gry z niesamowicie realistyczną grafiką, a wciągające światy komputerowe są tuż za rogiem.
Struktura materii.
Budowa atomu.
Atom jest najmniejszą cząstką pierwiastka chemicznego, nośnikiem wszystkich jego właściwości chemicznych. Atom jest chemicznie niepodzielny. Atomy mogą istnieć zarówno w stanie wolnym, jak iw połączeniu z atomami tego samego pierwiastka lub innego pierwiastka.
Jednostką masy atomowej i cząsteczkowej jest obecnie 1/12 masy atomu węgla o masie atomowej równej 12 (izotop). Ta jednostka nazywana jest jednostką węglową.
Masa i wielkość atomów. Numer Avogadro.
Gram-atom, podobnie jak gram-cząsteczka dowolnej substancji, zawiera odpowiednio 6 023 10^23 atomów lub cząsteczek. Ten numer nazywa się numerem Avogadro (N0). Tak więc w 55,85 g żelaza, 63,54 g miedzi, 29,98 g aluminium itp. Liczba atomów jest równa liczbie Avogadro.
Znając liczbę Avogadro, łatwo obliczyć masę jednego atomu dowolnego pierwiastka. Aby to zrobić, gramo-masę jednego atomu należy podzielić przez 6,023 10^23. Zatem masa atomu wodoru (1) i masa atomu węgla (2) są odpowiednio równe: 
Na podstawie liczby Avogadro można również oszacować objętość atomu. Na przykład gęstość miedzi wynosi 8,92 g / cm ^ 3, a gramo-atomowa masa wynosi 63,54 g. Dlatego jeden gram-atom miedzi zajmuje objętość  , a jeden atom miedzi ma objętość
, a jeden atom miedzi ma objętość  .
.
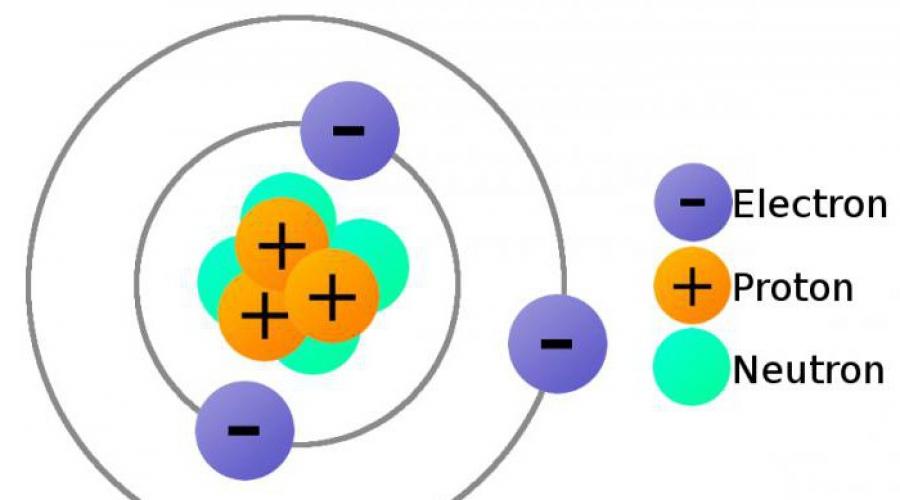
Budowa atomów.
Atom jest formacją złożoną i składa się z wielu mniejszych cząstek. Atomy wszystkich pierwiastków składają się z dodatnio naładowanego jądra i elektronów - ujemnie naładowanych cząstek o bardzo małej masie. Jądro zajmuje znikomą część całkowitej objętości atomu. Średnica atomu to cm, a średnica jądra to cm.
Chociaż średnica jądra atomu jest 100 000 razy mniejsza niż średnica samego atomu, to praktycznie cała masa atomu jest skoncentrowana w jego jądrze. Wynika z tego, że gęstość jąder atomowych jest bardzo duża. Gdyby udało się zebrać 1 cm3 jądra atomowego, to jego masa wyniosłaby około 116 milionów ton.
Jądro składa się z protonów i neutronów. Cząstki te mają wspólną nazwę - nukleony.
Proton- - stabilna cząstka elementarna o masie zbliżonej do jednostki węglowej. Ładunek protonu jest równy ładunkowi elektrody, ale ma przeciwny znak. Jeśli przyjmiemy, że ładunek elektronu wynosi -1, to ładunek protonu wynosi +1. Proton to atom wodoru bez elektronu.
Neutron- powłoka atomowa, której ładunek ujemny kompensuje dodatni ładunek jądra, ze względu na obecność w nim protonów.
Tak więc liczba elektronów w atomie jest równa liczbie protonów w jego jądrze.
Zależność między liczbą protonów, liczbą neutronów i liczbą masową atomu wyraża równanie: N=A-Z
Stąd liczba neutronów w jądrze atomu dowolnego pierwiastka jest równa różnicy między jego liczbą masową a liczbą protonów.
Czyli liczba neutronów w jądrze atomu radu o masie 226 N=A-Z=226-88=138
Masa i ładunek elektronu.
Wszystkie procesy chemiczne powstawania i niszczenia związków chemicznych zachodzą bez zmiany jąder atomów pierwiastków tworzących te związki. Zmianom ulegają tylko powłoki elektronowe. Energia chemiczna jest więc powiązana z energią elektronów. Aby zrozumieć procesy powstawania i niszczenia związków chemicznych, należy ogólnie rozumieć właściwości elektronu, a zwłaszcza właściwości i zachowanie elektronu w atomie.
Elektron- jest to cząstka elementarna, która ma elementarny ujemny ładunek elektryczny, czyli najmniejszą ilość energii elektrycznej, jaka może istnieć. Ładunek elektronu jest równy el. Sztuka. jednostki lub wisiorek. Masa spoczynkowa elektronu jest równa r, tj. 1837,14 razy mniej niż masa atomu wodoru. Masa elektronu to jednostka węgla.
Model atomu Bohra.
Na początku XX wieku M. Planck A. Einstein stworzył kwantową teorię światła, według której światło jest strumieniem pojedynczych kwantów energii niesionymi przez cząstki światła - fotony.
Wartość kwantu energii(E) jest różny dla różnych promieniowań i jest proporcjonalny do częstotliwości oscylacji:
,
gdzie h jest stałą Plancka.
M. Planck wykazał, że atomy pochłaniają lub emitują energię promieniowania tylko w oddzielnych, dobrze określonych porcjach - ilość.
Próbując powiązać prawo mechaniki klasycznej z teorią kwantową, duński naukowiec N. Bohr uważał, że elektron w atomie wodoru może znajdować się tylko w pewnych - stałych orbitach, których promienie są powiązane ze sobą jako kwadraty liczb całkowitych ![]() Orbity te zostały nazwane stacjonarnymi przez N. Bohra.
Orbity te zostały nazwane stacjonarnymi przez N. Bohra.
Promieniowanie energii zachodzi tylko wtedy, gdy elektron przemieszcza się z bardziej odległej orbity na orbitę bliższą jądru. Kiedy elektron przechodzi z bliskiej orbity na bardziej odległą, energia jest pochłaniana przez atom. ![]() , gdzie są energie elektronów w stanach stacjonarnych.
, gdzie są energie elektronów w stanach stacjonarnych.
Kiedy Ei > Ek, energia jest uwalniana.
Dla Ei< Ек энергия поглощается.
Rozwiązanie problemu rozkładu elektronów w atomie opiera się na badaniu widm liniowych pierwiastków i ich właściwości chemicznych. Widmo atomu wodoru prawie całkowicie potwierdziło teorię N. Bohra. Jednak obserwowanego rozszczepienia linii widmowych w atomach wieloelektronowych i wzmocnienia tego rozszczepienia w polach magnetycznych i elektrycznych nie można wyjaśnić teorią N. Bohra.
Właściwości falowe elektronu.
Prawa fizyki klasycznej przeciwstawiają się pojęciom „cząstki” i „fali”. Współczesna teoria fizyczna, zwana kwantem, lub mechanika falowa wykazali, że ruch i oddziaływanie cząstek o małej masie - mikrocząstki zachodzą zgodnie z prawami odmiennymi od praw mechaniki klasycznej. Mikrocząstka ma jednocześnie pewne właściwości ciałek (cząstek) i pewne właściwości fal. Z jednej strony elektron, proton lub inna mikrocząstka porusza się i zachowuje się jak korpuskuła, na przykład zderzając się z inną mikrocząstką. Z drugiej strony, gdy mikrocząstka się porusza, wykrywane są zjawiska interferencji i dyfrakcji typowe dla fal elektromagnetycznych.
Tak więc we właściwościach elektronu (jak i innych mikrocząstek), w prawach jego ruchu przejawia się ciągłość i połączenie dwóch jakościowo różnych form istnienia materii, substancji i pola. Mikrocząstki nie można uznać ani za zwykłą cząstkę, ani za zwykłą falę. Mikrocząstka ma dualizm korpuskularno-falowy.
Mówiąc o relacji między materią a polem, można dojść do wniosku, że jeśli każda cząsteczka materialna ma określoną masę, to najwyraźniej tej samej cząstce musi odpowiadać również pewna długość, fala. Pojawia się pytanie o związek między masą a falą. W 1924 roku francuski fizyk Louis de Broglie zasugerował, że z każdym poruszającym się elektronem (i ogólnie z każdą poruszającą się cząsteczką materiału) związany jest proces falowy, którego długość fali wynosi , gdzie jest długością fali w cm (m), h jest długością fali Plancka. stała, równa ![]() erg. sec (), m - masa cząstki w g (kg), - prędkość cząstki, w cm / sek.
erg. sec (), m - masa cząstki w g (kg), - prędkość cząstki, w cm / sek.
Z tego równania widać, że cząstka w spoczynku musi mieć nieskończenie długą falę i że długość fali maleje wraz ze wzrostem prędkości cząstki. Długość fali poruszającej się cząstki o dużej masie jest bardzo mała i nie można jej jeszcze określić doświadczalnie. Dlatego mówimy o właściwościach falowych tylko mikrocząstek. Elektron ma właściwości falowe. Oznacza to, że jego ruch w atomie można opisać równaniem falowym.
Planetarny model budowy atomu wodoru, stworzony przez N. Bohra, który wyszedł z koncepcji elektronu tylko jako klasycznej cząstki, nie może wyjaśnić wielu właściwości elektronu. Mechanika kwantowa pokazała, że pomysł ruchu elektronu wokół jądra na określonych orbitach, jak ruch planet wokół Słońca, należy uznać za nie do utrzymania.
Elektron, mając właściwości fali, porusza się po całej objętości, tworząc chmurę elektronową, która dla elektronów w jednym atomie może mieć inny kształt. gęstość tej chmury elektronów w tej lub innej części objętości atomowej nie jest taka sama.
Charakteryzacja elektronu czterema liczbami kwantowymi.
Główną cechą determinującą ruch elektronu w polu jądra jest jego energia. Energia elektronu, podobnie jak energia cząstki strumienia świetlnego - fotonu, nie przyjmuje żadnych, a jedynie pewne wartości dyskretne, nieciągłe lub, jak mówią, skwantowane.
Poruszający się elektron ma trzy stopnie swobody ruchu w przestrzeni (odpowiadające trzem osiom współrzędnych) oraz jeden dodatkowy stopień swobody ze względu na obecność własnych momentów mechanicznych i magnetycznych elektronu, które uwzględniają obrót elektronu wokół własnej osi . Dlatego dla pełnej charakterystyki energetycznej stanu elektronu w atomie konieczne i wystarczające jest posiadanie czterech parametrów. Te parametry są nazywane liczby kwantowe. Liczby kwantowe, podobnie jak energia elektronu, mogą przyjmować nie wszystkie, a jedynie pewne wartości. Sąsiednie wartości liczb kwantowych różnią się o jeden.
Główna liczba kwantowa n charakteryzuje całkowitą energię elektronu lub jego poziom energetyczny. Główna liczba kwantowa może przyjmować wartości liczb całkowitych od 1 do . Dla elektronu znajdującego się w polu jądra główna liczba kwantowa może przyjmować wartości od 1 do 7 (odpowiadające liczbie okresu w układzie okresowym, w którym znajduje się pierwiastek). Poziomy energii są oznaczone liczbami zgodnie z wartościami głównej liczby kwantowej lub literami:
P | |||||||
Oznaczenie poziomu |
Jeśli np. n=4, to elektron znajduje się na czwartym poziomie energetycznym licząc od jądra atomu, czyli na poziomie N.
Orbitalna liczba kwantowa l, nazywana czasem boczną liczbą kwantową, charakteryzuje różny stan energetyczny elektronu na danym poziomie. Delikatna struktura linii widmowych wskazuje, że elektrony każdego poziomu energii są pogrupowane w podpoziomy. Orbitalna liczba kwantowa jest związana z momentem pędu elektronu, gdy porusza się on względem jądra atomu. Orbitalna liczba kwantowa określa również kształt chmury elektronowej, a liczba kwantowa l może przyjmować wszystkie wartości całkowite od 0 do (n-1). Na przykład, gdy n=4, l=0, 1, 2, 3. Każda wartość l odpowiada pewnemu podpoziomowi. Litery są używane do podpoziomów. Tak więc przy l=0, 1, 2, 3 elektrony znajdują się odpowiednio na podpoziomach s-, p-, d-, f-. Elektrony z różnych podpoziomów są odpowiednio nazywane s-, p-, d-, f - elektronami. Możliwa liczba podpoziomów dla każdego poziomu energii jest równa liczbie tego poziomu, ale nie przekracza czterech. Pierwszy poziom energii (n=1) składa się z jednego podpoziomu s, drugi (n=2), trzeci (n=3) i czwarty (n=4) poziomy energii składają się odpowiednio z dwóch (s, p), trzech (s , p, d) i cztery (s, p, d, f) podpoziomy. Nie może być więcej niż cztery podpoziomy, ponieważ wartości l=0, 1, 2, 3 opisują elektrony atomów wszystkich 104 obecnie znanych pierwiastków.
Jeśli l=0 (s-elektrony), to moment pędu elektronu względem jądra atomu jest równy zero. Może się to zdarzyć tylko wtedy, gdy elektron nie porusza się translacyjnie do przodu wokół jądra, ale od jądra na obrzeże iz powrotem. Chmura elektronów s-elektronu ma kształt kulisty.
Magnetyczna liczba kwantowa- jego moment magnetyczny jest również związany z momentem pędu elektronu. Magnetyczna liczba kwantowa charakteryzuje moment magnetyczny elektronu. magnetyczna liczba kwantowa charakteryzuje moment magnetyczny elektronu i wskazuje orientację chmury elektronów względem wybranego kierunku lub względem kierunku pola magnetycznego. Magnetyczna liczba kwantowa może przyjmować dowolne całkowite wartości dodatnie i ujemne, w tym zero, w zakresie od – l do + l. Na przykład, jeśli l=2, to ma 2 l+1=5 wartości (-2, -1, 0, +1, +2). Przy l=3 liczba wartości wynosi 2 l+1=7 (-3, -2, -1, 0, +1, +2, +3). Liczba wartości magnetycznej liczby kwantowej, która jest równa 2 l + 1, to liczba stanów energetycznych, w których mogą znajdować się elektrony danego podpoziomu. Zatem s-elektrony mają tylko jeden stan (2 l+1=1), p-elektrony mają 3 stany (2 l+1=3), d-, f-elektrony mają odpowiednio 5 i 7 stanów. Stany energetyczne są zwykle oznaczane schematycznie przez komórki energetyczne, przedstawiając je jako prostokąty, a elektrony jako strzałki w tych komórkach.
Zakręć liczbę kwantową- charakteryzuje ruch wewnętrzny elektronu - spin. Jest to związane z własnym momentem magnetycznym elektronu, ze względu na jego ruch wokół własnej osi. Ta liczba kwantowa może przyjmować tylko dwie wartości: + 1/2 i -1/2, w zależności od tego, czy pole magnetyczne spinu elektronu jest zorientowane równolegle czy przeciwnie do pola magnetycznego z powodu ruchu elektronu wokół jądra.
Dwa elektrony (para) o tych samych wartościach liczb kwantowych: n, I, ale o przeciwnie skierowanych spinach ( ↓) nazywane są sparowaną lub samotną parą elektronów. Elektrony o nienasyconych spinach () nazywane są niesparowanymi.
Zasada Pauliego, zasada najmniejszej energii, zasada Hunda.
O rozkładzie elektronów w atomach pierwiastków decydują trzy główne przepisy: zasada Pauliego, zasada najmniejszej energii oraz zasada Hunda.
Zasada Pauliego. Badając liczne widma atomów, szwajcarski fizyk W. Pauli w 1925 roku doszedł do wniosku, który nazwano zasadą lub zakazem Pauliego: może nawet dwa elektrony o tych samych wartościach wszystkich czterech liczb kwantowych. Stany energetyczne elektronów, charakteryzujące się tymi samymi wartościami trzech liczb kwantowych: n, I i m1, są zwykle oznaczane przez ogniwo energetyczne.
Zgodnie z zasadą Pauliego w ogniwie energetycznym mogą znajdować się tylko dwa elektrony o przeciwnych spinach
Obecność trzeciego elektronu w jednym ogniwie energetycznym oznaczałaby, że dwa z nich mają wszystkie cztery takie same liczby kwantowe. Liczba możliwych stanów elektronów (ryc. .4) na danym podpoziomie jest równa liczbie wartości magnetycznej liczby kwantowej dla tego podpoziomu, tj. 21 + 1. Maksymalna liczba elektronów na tym podpoziomie, zgodnie z zgodnie z zasadą Pauliego wyniesie 2 (21 + 1). Zatem na podpoziomie s możliwe są 2 elektrony; p-podpoziom 6 elektronów; na podpoziomie d 10 elektronów; na podpoziomie f znajduje się 14 elektronów. Liczba możliwych stanów elektronów na dowolnym poziomie jest równa kwadratowi głównej liczby kwantowej, a maksymalna liczba elektronów na tym poziomie
Zasada najmniejszej energii.
Kolejność rozmieszczenia elektronów w atomie musi odpowiadać ich największemu połączeniu z jądrem, tj. elektron musi mieć najniższą energię. Dlatego nie jest konieczne, aby elektron zajmował wyższy poziom energii, jeśli na niższym poziomie znajdują się miejsca, w których elektron będzie miał niższą energię.
Ponieważ o energii elektronu decydują głównie wartości liczby głównej n oraz liczby orbitalnej/kwantowej, w pierwszej kolejności wypełniane są te podpoziomy, dla których suma wartości liczb kwantowych n i/ jest mniejsza. Na przykład rezerwa energii na podpoziomie 4s(n +/ = 4 +0 = 4) jest mniejsza niż 3d(n + /= 3 + 2 = 5); 5s (n + / = 5 + 0 = 5) mniej niż 4d (n + / = 4 + 2 = 6); 5p(n+/=5+1=6) mniej niż 4f(n+1=4+3=7). Jeżeli dla dwóch poziomów sumy wartości n i / są równe, to najpierw wypełniany jest podpoziom o mniejszej wartości n. n, czyli w następującej kolejności: 3d-4p-5s.
Kiedy energie bliskich podpoziomów różnią się od siebie bardzo niewiele, istnieją pewne wyjątki od tej reguły. Zatem podpoziom 5d jest wypełniony jednym elektronem 5dl przed 4f; 6d1-2 przed 5f.
Wypełnianie poziomów i podpoziomów energii przebiega w następującej kolejności: ls→2s→2p→3s→3p→4s→ 3d → 4р→ 5s → 4d → 5р→ 6s →(5dl) →4f→ 5d→6p→ 7s→ ( 6d1-2 )→5f→ 6d→7p
Zasada Gunda.
Elektrony w danym podpoziomie są najpierw umieszczone w oddzielnej komórce w postaci niesparowanych „nieaktywnych” elektronów.Innymi słowy, dla danej wartości I elektrony w atomie są ułożone tak, aby ich całkowita liczba spinów była maksymalna Na przykład, jeśli trzy elektrony, to każdy z nich zostanie umieszczony w osobnej komórce w ten sposób:
Wzory elektronowe atomów i schematów.
Biorąc pod uwagę powyższe zapisy, łatwo wyobrazić sobie rozkład elektronów na poziomach energetycznych i podpoziomach w atomach dowolnego pierwiastka. Ten rozkład elektronów w atomie jest zapisany w postaci tak zwanych wzorów elektronicznych. We wzorach elektronicznych litery s, p, d, f oznaczają podpoziomy energii elektronów; liczby przed literami oznaczają poziom energii, w którym znajduje się dany elektron, a indeks w prawym górnym rogu to liczba elektronów w tym podpoziomie. Na przykład pisanie 5p3 oznacza, że 3 elektrony znajdują się na podpoziomie p piątego poziomu energii.
Aby skomponować wzór elektronowy atomu dowolnego pierwiastka, wystarczy znać liczbę tego pierwiastka w układzie okresowym i spełnić podstawowe postanowienia rządzące rozkładem elektronów w atomie.
Niech na przykład trzeba zrobić wzory elektroniczne dla atomów siarki, wapnia, skandu, żelaza i lantanu. Z układu okresowego określamy liczby tych pierwiastków, które są odpowiednio równe 16, 20, 21, 26. Oznacza to, że na poziomach energetycznych i podpoziomach atomy tych pierwiastków zawierają odpowiednio 16, 20, 21, 26, 57 elektronów. Obserwując zasadę Pauliego oraz zasadę najmniejszej energii, czyli kolejność wypełniania poziomów energetycznych i podpoziomów, można układać wzory elektroniczne atomów tych pierwiastków:

Strukturę powłoki elektronowej atomu można również przedstawić w postaci układu elektronów w ogniwach energetycznych.
W przypadku atomów żelaza taki schemat ma następującą postać:

Ten diagram wyraźnie pokazuje realizację reguły Hunda. Na podpoziomie 3d maksymalna liczba komórek (cztery) jest wypełniona niesparowanymi elektronami. Obraz struktury powłoki elektronowej w atomie w postaci wzorów elektronowych oraz w postaci diagramów nie oddaje wyraźnie właściwości falowych elektronu. Należy jednak pamiętać, że każdy s-, p-, d-, f-elektron ma swoją własną chmurę elektronową. Odmienny kształt chmury elektronowej wskazuje, że elektron ma różne prawdopodobieństwo przebywania w danym obszarze przestrzeni atomowej. W zależności od wartości magnetycznej liczby kwantowej m1 orientacja chmury elektronowej w przestrzeni również będzie inna.