Коллоидная химия. Физическая и коллоидная химия. Поверхностные явления и адсорбция
Читайте также
План:
Дисперсные системы.
Строение коллоидной мицеллы.
Методы получения лиофобных коллоидов (СР).
Предмет и значение коллоидной химии.
Коллоидная химия – это наука о дисперсных системах и поверхностных явлениях , возникающих на границах раздела фаз .
Коллоидная химия является химией реальных тел , поскольку реальные объекты живой и неживой природы, продукты и материалы, создаваемые и используемые человеком, практически всегда находятся в дисперсном состоянии , т. е. содержат в своем составе малые частицы, тонкие пленки, мембраны, волокна с четко выраженными поверхностями раздела. При этом поверхностные явления и дисперсные системы встречаются и далеко пределами Земли. Например, межзвездная материя – это газопылевые облака. Метеорологические явления – грозовые разряды, дождь, снег, град, туман и другие – являются коллоидными процессами.
Коллоидная химия составляет научную основу производства пластических масс , резины, синтетических волокон, клеев, лакокрасочных и строительных материалов, продуктов питания, лекарств и т.п. Практически нет ни одной области промышленности, которая в той или иной степени не имела бы дела с коллоидными системами.
Велика роль коллоидной химии и в решении комплекса задач охраны окружающей среды , включая очистку сточных вод, водоподготовку, улавливание аэрозолей , борьбу с эрозией почв и др.
Коллоидная химия открывает новые подходы к изучению истории земной коры, установлению связей между коллоидно-химическими свойствами почвы и ее плодородием, выяснению условий возникновения жизни, механизмов жизнедеятельности; она является одной из ведущих основ современной биологии , почвоведения, геологии, метеорологии. Вместе с биохимией и физикохимией полимеров она составляет основу учения о возникновении и развитии жизни на Земле . Тот факт, что все живые системы являются высокодисперсными, подчеркивает значение коллоидной химии для развития современной в целом.
Огромно значение коллоидных процессов в сельском хозяйстве (создание дымов и туманов для борьбы с вредителями сельского хозяйства , грануляция удобрений, улучшение структуры почв и т.д.). Кулинарные процессы: старение студней (черствление хлеба, отделение жидкости от киселей, желе и т.п.), адсорбции (осветление бульонов) относятся к коллоидным процессам, которые лежат в основе хлебопечения, виноделия, пивоварения и других пищевых производств.
2. Дисперсные системы.
Дисперсные системы – это такие системы, в которых одно вещество в виде частиц различной величины распределено в другом веществе.
В дисперсных системах различают дисперсную фазу (ДФ) – мелкораздробленное вещество и дисперсионную среду (ДС) – однородное вещество , в котором распределена дисперсная фаза (в мутной воде, содержащей глину, ДФ являются твердые частички глины, а ДС – вода).
Важной характеристикой дисперсных систем является степень дисперсности – средний размер частиц дисперсной фазы.
По степени дисперсности выделяют обычно следующие классы дисперсных систем:
Грубодисперсные системы – системы, размер частиц дисперсной фазы в которых превышает 10 -7 м (суспензии и эмульсии).
Коллоидные системы – системы, размер частиц дисперсной фазы в которых составляет 10 -7 – 10 -9 м. Это микрогетерогенные системы с хорошо развитой поверхностью раздела между фазами. Их частицы не оседают под действием силы тяжести, проходят через бумажные фильтры, но задерживаются растительными и животными мембранами. Например, растворы белков , почвенные коллоиды и т.д.
Иногда выделяют молекулярно(ионно)-дисперсные системы, которые, строго говоря, являются истинными растворами , т.е. гомогенными системами, поскольку в них нет поверхностей раздела фаз. Размер частиц дисперсной фазы менее 10 -9 м. Растворенное вещество находится в виде молекул или ионов. Например, растворы электролитов, сахара.
Коллоидные системы, в свою очередь , подразделяются на две группы, резко отличные по характеру взаимодействий между частицами дисперсной фазы и дисперсионной среды – лиофобные коллоидные растворы (золи) и растворы высокомолекулярных соединений (ВМС), которые ранее называли лиофильными коллоидами .
К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой; эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
Растворы ВМС образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов.
Лиофобные коллоиды и растворы ВМС различаются , составляющих дисперсную фазу. Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного состава – мицелла , для растворов ВМС – макромолекула .
Дисперсные системы разделяют на группы, различающиеся по природе и агрегатному состоянию дисперсной фазы и дисперсионной среды:
Если дисперсионной средой является жидкость, а дисперсной фазой – твердые частицы, система называется взвесью или суспензией ;
Если дисперсная фаза представляет собой капельки жидкости , то систему называют эмульсией . Эмульсии, в свою очередь, подразделяют на два типа: прямые , или "масло в воде" (когда дисперсная фаза – неполярная жидкость, а дисперсионная среда – полярная жидкость) и обратные , или "вода в масле" (когда полярная жидкость диспергирована в неполярной).
Среди дисперсных систем выделяют также пены (газ диспергирован в жидкости) и пористые тела (твердая фаза, в которой диспергированы газ либо жидкость). Основные типы дисперсных систем приведены в таблице.
3.Строение коллоидной мицеллы.
Частицы ДФ в лиофобных коллоидах имеют сложную структуру, зависящую от состава ДФ , ДС и условий получения коллоидного раствора. Необходимым условием получения устойчивых золей является присутствие 3-го компонента, играющего роль стабилизатора.
Дисперсная частица – мицелла состоит из:
ядра , находящегося в кристаллическом или жидком состоянии;
мономолекулярного адсорбционного слоя потенциалопределяющих ионов ;
жидкостной оболочки, более уплотненной у поверхности частицы и постепенно переходящей в обыкновенную дисперсионную среду;
прочно связанного слоя противоионов , т.е. ионов несущих заряд противоположный знаку заряда потенциалопределяющих ионов ;
диффузионного слоя противоионов, свободно сдвигающихся при электрофорезе или электроосмосе.
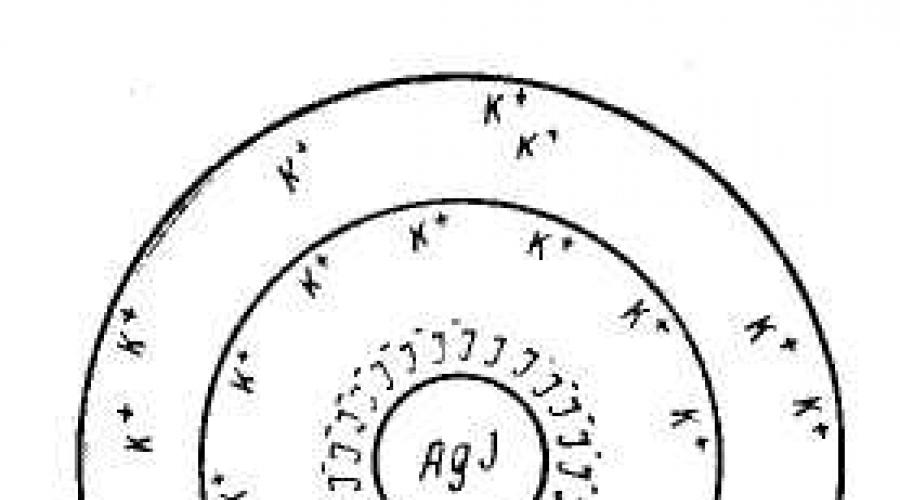
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра , получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO 3 + KI ––> AgI + KNO 3
Коллоидная мицелла золя иодида серебра образована микрокристаллом AgI , который способен к избирательной адсорбции из окружающей среды катионов Ag + или I - . Для получения устойчивого золя необходимо, чтобы один из электролитов AgNO 3 или KI присутствовали в избытке в качестве стабилизатора.
Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать I - ; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag + . В результате этого микрокристалл приобретает отрицательный либо положительный заряд.
1. Избыток KI
Нерастворимые молекулы AgI образуют ядро коллоидной частицы (мицеллы) m [ AgI ].
На поверхности ядра адсорбируются ионы I - (обычно адсорбируются те ионы, которые входят в состав ядра, т.е. в данном случае Ag + или I -), сообщающие ему отрицательный заряд. Они достраивают кристаллическую решетку ядра, прочно входя в его структуру , образуя адсорбционный слой m [ AgI ] · nI – . Ионы, адсорбирующиеся на поверхности ядра и придающие ему соответствующий заряд, называются потенциалопределяющими ионами.
Адсорбированные потенциалопределяющие ионы притягивают из раствора ионы противоположного знака противоионы (К +), причем часть их (n-x) адсорбируется на частице { m [ AgI ] · nI – · (n - x ) K + } x – . Ядро + адсорбционный слой = гранула .
Оставшаяся часть противоионов образует диффузный слой ионов.
Ядро с адсорбционным и диффузными слоями представляет мицеллу.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I – , противоионы – ионы К +) может быть изображена следующим образом:
{m · nI – · (n-x)K + } x– · xK +

2. При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
{m · nAg + · (n-x)NO 3 – } x+ · x NO 3 –


С. В. Егоров, Е. С. Оробейко, Е. С. Мухачева
Коллоидальная химия, шпаргалка
1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
Возникновение науки коллоидной химии связано с исследованиями английского химика Т. Грэма . После пионерских исследований М. Фарадея (1857 г.), когда впервые были получены устойчивые коллоидные растворы высокодисперсного золота, в 1861 г. Грэм изучал диффузию разных веществ в водных растворах и обнаружил, что некоторые из них (желатин, агар-агар и т. п.) диффундируют в воде намного медленнее, чем, например, соли и кислоты. Также эти вещества при пересыщении растворов не кристаллизовались, а формировали студнеобразную, клейкую массу. Эти вещества Т. Грэм назвал коллоидами (от греч. kolla – «клей», eidos – «вид»). Так появилось название науки – «коллоидная химия» . Т. Грэм выдвинул гипотезу о существовании в природе двух противоположных классов химических веществ – кристаллоидов и коллоидов. Эта идея заинтересовала многих ученых, и во второй половине XIX в. началось бурное развитие коллоидной химии. В России в это время коллоидной химии также уделялось большое внимание, во многом под влиянием Д. И. Менделеева . Исследования температурной зависимости поверхностного натяжения органических жидкостей (1861 г.) привели Менделеева к открытию понятия критической температуры веществ. Менделеев высказал также идею о связи между поверхностным натяжением и другими свойствами вещества. В эти годы были открыты многие вещества с коллоидными свойствами, разработаны различные методы очистки и стабилизации коллоидов, созданы методы их исследования. По мере открытия новых коллоидов на смену гипотезе Т. Грэма в первой половине XX в. пришла концепция универсальности коллоидного (дисперсного) состояния вещества: «Коллоидное состояние не является обусловленным особенностями состава вещества. При определенных условиях каждое вещество может находиться в коллоидном состоянии». Эту концепцию сформулировал профессор Санкт-Петербургского горного института П. П. Веймарн в 1906–1910 гг . Он показал, что типичные коллоиды (например, желатин) можно выделить в кристаллическом виде и, напротив, из кристаллоидных веществ можно приготовить коллоидный раствор (например, поваренной соли в бензоле). Произошло смещение приоритетов коллоидной химии. Главным направлением стало изучение дисперсного (коллоидного) состояния веществ. Примерно к 1920-м гг. фундаментальные проблемы коллоидной химии условно разделили на три группы: состав, строение и свойства коллоидных частиц; взаимодействие частиц с дисперсной средой; контактные взаимодействия частиц друг с другом, приводящие к образованию коллоидных структур. В этот период были открыты основные законы коллоидной химии – закон броуновского движения и диффузии коллоидных частиц (А. Эйнштейн) , гетерогенной природы коллоидных растворов (Р. Зигмонди) , седиментационно-диффузионного равновесия дисперсий в поле силы тяжести (Ж. Перрен) и в центрифуге (Т. Сведберг) , светорассеяния (Дж. Рэлей) , коагуляции золей электролитами (Г. Шульце и В. Гарди) . Появление во второй половине XX в. высокоразрешающих методов изучения строения веществ (ЯМР, электронной и атомно силовой микроскопии, компьютерного моделирования, фотон-корреляционной спектроскопии и др.) позволило перейти к систематическому исследованию строения и свойств коллоидных систем. Современное определение данной науки гласит: коллоидная химия – это учение о свойствах и превращениях веществ в дисперсном и ультрадисперсном состояниях и поверхностных явлениях в дисперсных системах. Объекты исследования коллоидной химии имеют высокоразвитую поверхность и представляют собой различные золи, суспензии, эмульсии, пены, поверхностные пленки, мембраны и пористые тела, наноструктурированные системы (нанотрубки, пленки Ленгмюра-Блоджетт, гибридные органо-неорганические композиционные материалы, нанокомпозиты).
2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
Дисперсные системы образованы из двух или более фаз с сильно развитой поверхностью раздела между ними, причем хотя бы одна из фаз – дисперсная фаза – распределена в виде мелких частиц (кристалликов, капель, пузырьков и т. п.) в другой, сплошной фазе – дисперсионной среде . Примерами являются горные породы, грунты, почвы, дымы, облака, атмосферные осадки, растительные и животные ткани и др. Важнейшей особенностью дисперсных систем является гетерогенность . Характерная особенность дисперсных систем – сильно развитая межфазная поверхность и, как следствие, высокая свободная энергия, поэтому обычно дисперсные системы (кроме лиофильных) термодинамически неустойчивы. Они обладают повышенной адсорбционной способностью, химической, а иногда и биологической активностью. Для дисперсных систем характерно увеличение поверхности с ростом дисперсности и возрастание роли поверхностных явлений. Дисперсные системы характеризуются очень большой удельной поверхностью W дисперсной фазы.
W < K / d r ,
где K – безразмерный коэффициент (для сферических и кубических частиц K = 6); r – плотность дисперсной фазы.
Другие важнейшие термодинамические параметры, характеризующие коллоидные системы, это удельная свободная поверхностная энергия σ (поверхностное натяжение), поверхностная энтропия h и удельная адсорбция Г . Важная особенность дисперсных систем заключается в том, что значительная доля всей массы и свободной энергии системы сосредоточены в межфазных поверхностных слоях. С этой особенностью связаны свойства – невоспроизводимость (или индивидуальность) системы в связи с неодинаковой поверхностью частиц дисперсной фазы, обладающих разной поверхностной энергией даже при одинаковой удельной поверхности; структурообразование , связанное с тенденцией к термодинамической неустойчивости. Фундаментальным свойством дисперсных систем является их способность к постепенной эволюции, которая связана с природой дисперсного состояния вещества, в первую очередь с термодинамической неравновесностью. Избыток свободной энергии, обусловленной наличием высокоразвитой поверхности раздела между дисперсной фазой и дисперсионной средой, стимулирует протекание различных процессов (физических, физико-химических), приводящих к уменьшению свободной энергии Гельмгольца F. Такой признак, как лабильность , является следствием термодинамической неустойчивости и склонности к уменьшению свободной энергии путем образования менее дисперсных структур. Основная характеристика дисперсных систем – размеры частиц (или дисперсность ), что определяется отношением общей площади межфазной поверхности к объему дисперсной фазы. По этому признаку выделяют грубодисперсные (низкодисперсные) (частицы имеют размер от 10–4 см и выше) и тонкодисперсные (высокодисперсные) (частицы имеют размер от 10–4 до 10–5–10–7 см), или коллоидные системы (коллоиды). Предельная степень дисперсности, при которой коллоидная система сохраняет главное свойство – гетерогенность, лежит в интервале от 1 до 100 нм. Ультрадисперсные частицы занимают промежуточное положение между молекулами (атомами, ионами) и макроскопическими телами (фазами). Размер дисперсной фазы частицы d близок к предельно возможному, тем сильнее будут сказываться масштабные эффекты – зависимость свойств от размера частиц. Если у систем со средней степенью дисперсности поверхностное натяжение s определяется только химическим составом, то для наносистем уже необходимо учитывать зависимость поверхностного натяжения от размеров дисперсных частиц.
3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
Дисперсные системы гетерогенны и состоят из двух фаз, одна из которых (дисперсная фаза) в виде частиц различной величины распределена в другой фазе – сплошной дисперсионной среде . Дисперсные системы классифицируют прежде всего по размеру частиц дисперсной фазы (или по степени дисперсности). Кроме того, их разделяют на группы, различающиеся по природе и агрегатному состоянию дисперсной фазы и дисперсионной среды (могут быть твердыми, жидкими и газообразными), по структуре и по характеру межфазных взаимодействий. Если дисперсионной средой является жидкость, а дисперсной фазой – твердые частицы, система называется взвесью, или суспензией; если дисперсная фаза представляет собой капельки жидкости, то систему называют эмульсией. Среди дисперсных систем выделяют также пены (газ диспергирован в жидкости), аэрозоли (жидкость – в газе) и пористые тела (твердая фаза, в которой диспергированы газ либо жидкость). Сокращенно тип дисперсной системы в зависимости от агрегатного состояния записывают в виде дроби, где дисперсная фаза находится в числителе, а дисперсионная среда – в знаменателе (например, Т/Т (твердые коллоидные растворы – минералы, сплавы), Т/Ж (золи – суспензии), Т/Г (аэрозоли – пыли, дымы); Ж/Т (пористые тела – гели), Ж/Ж (эмульсии), Ж/Г (аэрозоли – туманы); Г/Т (пористые и капиллярные системы), Г/Ж (пены – газовые эмульсии)). Системы Г/Г обычно не фигурируют в классификации, т. к. необходимое условие образования дисперсной системы – ограниченная растворимость вещества в среде.
Коллоидная химия – это наука о физико-химических свойствах дисперсных систем и поверхностных явлениях.
Дисперсная система (ДС) – это система, в которой хотя бы одно вещество в более или менее раздробленном (диспергированном) состоянии равномерно распределено в массе другого вещества. ДС гетерогенна, она состоит как минимум из двух фаз. Раздробленную фазу называют дисперсной фазой. Сплошную среду, в которой раздроблена дисперсная фаза, называют дисперсионной средой. Характерным свойством ДС является наличие большой межфазной поверхности. В связи с этим определяющими являются свойства поверхности, а не частиц в целом. Для ДС характерны процессы, протекающие на поверхности, а не внутри фазы.
Поверхностные явления и адсорбция
Поверхностные явления ─ это явления, протекающие на поверхности раздела фаз дисперсных систем. К ним относятся: поверхностное натяжение, смачивание, адсорбция и др. На поверхностных явлениях основаны важнейшие технические процессы: очистка воздуха и сточных вод от вредных примесей, обогащение руд полезных ископаемых (флотация), сварка металлов, чистка, смазка, окрашивание различных поверхностей и многие другие.
Поверхностное натяжение
Любая поверхность раздела фаз имеет особые свойства, отличающиеся от свойств внутренних частей граничащих фаз. Это обусловлено тем, что поверхностные слои обладают избытком свободной энергии. Рассмотрим систему, состоящую из жидкости и газа (рис.1).
На молекулу А , находящуюся внутри жидкости, действуют силы взаимного притяжения со стороны всех окружающих ее соседних молекул. Равнодействующая этих сил равна нулю. Для молекулы В , находящейся на поверхности жидкости, будут скомпенсированы не все силы молекулярного притяжения. Это вызвано тем, что в газе молекулы удалены друг от друга на большие расстояния, силы притяжения между ними ничтожны. Следовательно, молекулы В испытывают притяжение только со стороны жидкости. Для них равнодействующая сил молекулярного притяжения не равна нулю и направлена вглубь жидкой фазы. Эту силу называют внутренним давлением. Такое давление стремится затянуть все молекулы с поверхности вглубь жидкости. Под действием этого давления жидкость сжимается и ведет себя так, как будто у нее есть «кожа». Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше внутреннее давление.
Для того чтобы создать новую поверхность раздела фаз, например, растянуть жидкость в пленку, надо затратить работу против сил внутреннего давления. Чем больше внутреннее давление, тем большую энергию требуется затратить. Эта энергия сосредоточивается в молекулах, находящихся на поверхности, и называется свободной поверхностной энергией.
Работу, затраченную на образование 1см 2 поверхности раздела фаз, или эквивалентную ей свободную поверхностную энергию, называют поверхностным натяжением и обозначают , Дж/м 2 . Тогда запас свободной энергии, (F s) cконцентрированной на поверхности раздела фаз (S) равен: F s = S. Следовательно, чем меньше размер частиц, тем больше поверхность S, и тем большим запасом свободной поверхностной энергии обладает данная дисперсная система по сравнению с обычными массивными телами.
Из термодинамики известно, что условием устойчивого равновесия системы является минимум свободной энергии. В связи с этим, дисперсные системы термодинамически неустойчивы: в них самопроизвольно протекают процессы , связанные с уменьшением поверхности раздела фаз за счет укрупнения частиц. Очевидно, что состоянию равновесия отвечает расслоение системы (например, эмульсия разделяется на две жидкости, а суспензия ─ на жидкость и осадок). Кроме того, так как величина стремится к минимуму, жидкость в свободном состоянии принимает форму сферы, (капли жидкости). Это объясняется тем, что поверхность шара является минимальной для данного объема вещества.
Минимум величины F s , то есть состояние равновесия системы, может быть достигнуто также за счет стремления к минимуму величины . Таким образом, самопроизвольными в дисперсных системах являются также процессы, связанные с уменьшением величины поверхностного натяжения. Для твердых тел , которые не могут изменять свою форму также легко, как жидкости, свободная поверхностная энергия F s может уменьшаться только одним путем ─ за счет уменьшения величины поверхностного натяжения . Это происходит так: молекулы, лежащие в поверхностном слое, способны притягивать и иногда очень прочно удерживать другие молекулы из среды, окружающей твердое тело. Это явление носит название сорбции.
На величину поверхностного натяжения оказывают влияние:
1. Природа вещества . Величина определяется строением конденсированной фазы, то есть природой сил, действующих между частицами. Чем больше полярность химических связей в веществе, тем более высокие величины характерны для этого вещества. Среди жидкостей (на границе с воздухом) наибольшую величину имеет вода. Еще более высокие величины наблюдают в расплавах ионных кристаллов и в твердых металлах.
2.Температура. При повышении температуры величина уменьшается, так как тепловое движение частиц при нагревании ослабляет действие межчастичных сил в веществе.
3.Концентрации вводимых добавок. Величина зависит от концентрации веществ, растворенных в исследуемой жидкости. Различают два вида веществ. Поверхностно ─ инактивные вещества (ПИВ) , повышающие поверхностное натяжение раствора по сравнению с чистым растворителем. К ним относятся большинство сильных электролитов.
Поверхностно − активные вещества (ПАВ), сильно понижающие поверхностное натяжение образовавшегося раствора. С увеличением концентрации ПАВ в растворе величина резко уменьшается, так как вещество концентрируется (сорбируется) в поверхностном слое раствора, а не распределяется равномерно в объеме раствора. В водных растворах поверхностную активность проявляют полярные органические соединения ─ спирты, кислоты, соли и др. В молекулы таких соединений одновременно входят и полярные группы (О, ОН, СООН, NH 2) и неполярная углеводородная цепь. Схематично молекулу ПАВ условно обозначают так: «О────». Типичным примером ПАВ является натриевая соль стеариновой кислоты С 17 Н 35 СООNа (твердое мыло).
Предмет коллоидной химии
Коллоидные системы и предмет коллоидной химии
Коллоидные системы
Первоначально коллоидная химия была лишь главой физической химии. Теперь это самостоятельная дисциплина со своим кругом идей. Были разработаны специальные специфические коллоидно-химические методы исследования: ультрамикроскопия, электронная микроскопия, ультрацентрифугирование, электрофорез и т.д. Практика показала огромное значение коллоидной химии для современной техники. Невозможно указать отрасль народного хозяйства, в которой не использовались бы коллоидные системы и коллоидные процессы. С коллоидными системами человек имел дело с незапамятных времен. Однако изучение их началось сравнительно недавно.
Обычно считают, что основателем коллоидной химии является английский ученый Томас Грэм (*) (1805-1869), который в 50-60-е годы позапрошлого столетия ввел в обращение основные коллоидно-химические понятия. Однако не следует забывать, что у него имелись предшественники, и прежде всего – Яков Берцелиус (*) и итальянский химик Франческо Сельми (*) . В 30-е годы XIX века Берцелиус описал ряд осадков, проходящих при промывании через фильтр (кремниевая и ванадиевая кислоты, хлористое серебро, берлинская лазурь и др.). Эти проходящие через фильтр осадки Берцелиус назвал «растворами», но в то же время он указал на их близкое сродство с эмульсиями и суспензиями, со свойствами которых он был хорошо знаком. Франческо Сельми в 50-е годы XIX века продолжил работы в этом направлении, ища физико-химические различия между системами, образованными осадками, проходящими через фильтр (он назвал их «псевдорастворами») и обычными истинными растворами.
Английский ученый Майкл Фарадей (*) в 1857 г. синтезировал коллоидные растворы золота – взвесь Au в воде размерами частиц от 1 до 10 нм. и разработал методы их стабилизации.
Эти «псевдорастворы» рассеивают свет, растворенные в них вещества выпадают в осадок при добавлении небольших количеств солей, переход вещества в раствор и осаждение из него не сопровождаются изменением температуры и объема системы, что обычно наблюдается при растворении кристаллических веществ.
Томас Грэм развил эти представления о различии между «псевдорастворами» и истинными растворами и ввел понятие «коллоид». Грэм обнаружил, что вещества, способные к образованию студнеобразных аморфных осадков, такие как гидроокись алюминия, альбумин, желатина, диффундируют в воде с малой скоростью по сравнению с кристаллическими веществами (NaCl, сахароза). В то же время кристаллические вещества легко проходят в растворе через пергаментные оболочки («диализируют»), а студнеобразные вещества не проходят через эти оболочки. Принимая клей за типичный представитель студнеобразных не диффундирующих и не диализирующих веществ, Грэм дал им общее название «коллоид», т.е. клееобразный (от греческого слова колла – клей). Кристаллические вещества и вещества, хороши диффундирующие и диализирующие он назвал «кристаллоидами».
Перечислим аномальные свойства некоторых растворов, которые мы называем теперь коллоидными системами.
Свойства коллоидных систем:
1. рассеивание света (опалесценция) (указывает на неоднородность, многофазность системы).
Опалесценция становится особенно заметной, если, как это делал Тиндаль (*) через коллоидный раствор пропускать пучок сходящихся лучей, поставив между источником света и кюветой с раствором линзу. При этом растворы, прозрачные в проходящем свете, в боковом освещении проявляют все свойства мутных сред. В коллоидной жидкости, наблюдаемой сбоку, образуется яркий светящийся конус (конус Тиндаля).
2. медленная диффузия
3. малое осмотическое давление
(пп. 2 и 3 говорят о наличии в системе крупных частиц)
4. коллоидные растворы способны к диализу, т.е. с помощью мембраны могут быть отделены от примесей
5. способны к коагуляции (разрушению) системы при: добавлении примесей, изменении Т, перемешивании и т.д.
6. иногда обнаруживают явление электрофореза, открытое Рейссом (6) в России в 1808 г., т.е. частицы в системе могут обладать зарядом.
Чтобы представить, чем занимается наука «Коллоидная химия», надо ответить на вопрос, что такое коллоиды или коллоидные системы?
Предмет коллоидной химии
Коллоидная химия – наука о поверхностных явлениях и дисперсных системах.
К поверхностным явлениям относятся процессы, идущие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряженных фаз.
Напомним, что фазой называется часть термодинамической системы, обладающая определенными физическими и химическими свойствами и отделенная от других частей системы поверхностью раздела.
В истинных растворах вещество раздроблено до молекулярного состояния и между растворенным веществом и растворителем нет границы раздела.
Причиной поверхностных явлений является существование на границе раздела контактирующих фаз ненасыщенного поля межатомных, межмолекулярных сил, которое возникает из-за разного состава и строения соприкасающихся фаз и различия в связях их поверхностных атомов и молекул.
Поверхностные слои жидких и твердых тел, прилегающих к поверхности раздела фаз, резко отличаются по многим физико-химическим показателям от свойств фаз в глубине их объема (уд.энергия, плотность, вязкость, уд. электропроводность и др.). Отличия связаны и c определенной ориентацией молекул в поверхностных слоях и иным энергетическим состоянием их в сравнении с молекулами в объеме. Кроме того, в многокомпонентных системах (растворах) состав поверхностного слоя не совпадает с составом объемных фаз.
Особенности поверхностных слоев обусловлены наличием избытка поверхностной энергии. Свойства поверхности раздела тем сильнее влияют на поведение системы в целом, чем больше площадь поверхности (S уд). Этим объясняется доминирующая роль поверхностных явлений в свойствах высокодисперсных систем, S уд которых достигает огромных величин.
Наличие избыточной энергии в поверхностном слое молекул обусловлено неполной скомпенсированностью межмолекулярных сил притяжения у молекул поверхностного слоя вследствие их слабого взаимодействия с граничащей фазой.
Коллоидная химия изучает дисперсные системы – гетерогенные системы, состоящие из двух и более фаз, одна из которых дисперсная фаза – раздроблена (прерывна), а другая - дисперсионная среда - является непрерывной частью системы.
Положение о микрогетерогенной природе коллоидных растворов и других дисперсных систем имеет фундаментальное значение. За его открытие австрийский ученый Зигмонди (*) стал лауреатом Нобелевской премии по химии в 1925 г.
Выделение в особую группу дисперсных частиц вызвано отличием их по физическим и химическим свойствам от аналогичных свойств крупных объектов одного и того же вещества. К числу таких свойств относятся прочность, теплоемкость, Т пл, магнитные и электрические характеристики, реакционная способность.
Эти различия вызваны размерными эффектами. Особые свойства выражены тем сильнее, чем меньше размер частиц, особенно это проявляется у наночастиц. Эти свойства открывают принципиально новые практические приложения химии, физики, биологии. Изучение свойств дисперсных частиц (методов получения, структуры, физики и химии) относятся к наиболее актуальным и перспективным задачам ряда дисциплин.
Дисперсные частицы могут иметь самую различную форму : цилиндрическую, сферическую, прямоугольную, неправильную. Например, к дисперсным частицам относятся:
системы с частицами кубической, шарообразной формой – золи, эмульсии, взвеси, пасты;
нитевидные – волокна нервных клеток, 2-х - мерные мышечные волокна, капилляры, поры (древесина, ткани, волосы, кожа),
плёнки – поверхностные слои на границах раздела в эмульсиях, пенах, в порах катализаторов и адсорбентов, мембран.
Таким образом, 1 м 3 исходного вещества можно раздробить на кубики с длиной ребра а , вытянуть в нить с сечением а или расплющить в пленку толщиной а.
Если частицы имеют неправильную форму, то для использования понятия «поперечный размер», их форму приравнивают к сферической с эквивалентным диаметром.
Количественные характеристики дисперсной системы :
1. Размер частиц d ср, d min , d max
2. Концентрация частиц ν = n d /V, где n d – число частиц дисперсной фазы в единице объема дисперсионной среды V
3. Раздробленность системы характеризуется дисперсностью D и величиной удельной поверхности дисперсной фазы S уд :
Первый вариант количественной оценки - основной
D= 1/d и S уд = S /V , (1.1)
где d – минимальный размер частицы, S – суммарная площадь межфазной поверхности, V- объем тела.
Современная коллоидная химия - это наука на стыке химии, физики, биологии. Особое междисциплинарное положение коллоидной химии подчёркивается тем, что в англоязычной литературе часто используют название «коллоидная наука» (англ. colloid science ).
История коллоидной химии
Коллоидная химия как наука имеет небольшую историю, однако свойства коллоидных систем и коллоидно-химические процессы человек использовал с давних времён. Это, например, такие ремёсла, как получение красок, керамики, глазури, прядение льна, хлопка, шерсти, выделывание кож.
Начиная с XVIII века появляются описания отдельных исследований, позже вошедшие в соответствующие разделы коллоидной химии. К ним относят работы М. В. Ломоносова по кристаллизации, получению цветных стёкол с применением дисперсии металлов (1745-1755 гг.). В г. К. Шееле и Ф. Фонтана независимо друг от друга обнаружили явление адсорбции газов углём. В г. Т. Е. Ловиц обнаружил явление адсорбции из растворов. П. Лаплас в г. получил первые количественные отношения для капиллярного давления. В 1808 г. Ф. Ф. Рейсс, проводя опыты с элементом Вольта, открыл явления электрофорез и электроосмос .
Одни из наиболее ранних исследований коллоидных систем выполнены итальянцем Ф. Сельми в 1845 году. Он изучал системы, представляющие собой хлорид серебра, серу , берлинскую лазурь , распределенную в объёме воды. Эти системы, полученные Сельми, очень похожи на истинные растворы , однако Сельми полагал, что ни изученные им, ни другие подобные вещества не могут находиться в воде в виде таких же мелких частиц, как и образующиеся в истинных растворах , то есть в виде отдельных молекул или ионов .
Взгляды, близкие к Сельми, высказывал К. Нэгели, считавший, что в таких системах частицы серы , хлорида серебра и других веществ - более крупные агрегаты, чем отдельные молекулы . Для полимолекулярных агрегатов он ввел понятие «мицелла ». Чтобы отличать системы, содержащие мицеллы , от растворов , где растворенное вещество находится в виде отдельных молекул , Нэгели назвал мицеллосодержащие системы «золями ». Термины «мицелла », «золь » стали общепринятыми.
Современное состояние
Основные направления современной коллоидной химии:
- Термодинамика поверхностных явлений.
- Изучение адсорбции ПАВ .
- Изучение образования и устойчивости дисперсных систем , их молекулярно-кинетических, оптических и электрических свойств.
- Физико-химическая механика дисперсных структур.
- Разработка теории и молекулярных механизмов процессов, происходящих в дисперсных системах под влиянием ПАВ , электрических зарядов, механического воздействия и т. п.
Поскольку дисперсное состояние материи универсально и объекты изучения коллоидной химии весьма разнообразны, коллоидная химия тесно связана с физикой, биологией, геологией, почвоведением, медициной и др.
Существует Институт коллоидной химии и химии воды им. А. В. Думанского НАНУ (Киев).
Выпускается научный «Коллоидный журнал».
Литература
- Handbook of Surface and Colloid Chemistry / Ed. K .S. Birdi. - 2nd ed. - N.Y.: CRC Press, 2003. - 765 p.
- Аблесимов Н. Е. Синопсис химии: Справочно-учебное пособие по общей химии - Хабаровск: Изд-во ДВГУПС, 2005. - 84 с.
- Аблесимов Н. Е. Сколько химий на свете? ч. 1. // Химия и жизнь - XXI век. - 2009. - № 5. - С. 49-52.
- Сумм Б. Д. Основы коллоидной химии: учеб. пособие для студ. высш. учеб. заведений / Б. Д. Сумм. - 2-е изд., стер. - М. : Издательский центр «Академия», 2007. - 240 с.
- Химическая энциклопедия. - М.: «БРЭ», 1998.
- Фридрихсберг Д. А. Курс коллоидной химии. Л.: Химия, 1984. - 352 с.
- Захарченко В. Н. Коллоидная химия: Учеб. для для медико-биолог. спец. вузов.-2-е изд., перераб. и доп.-М.: Высш.шк., 1989.-238 с.: ил.
Wikimedia Foundation . 2010 .
Смотреть что такое "Коллоидная химия" в других словарях:
КОЛЛОИДНАЯ ХИМИЯ, изучает дисперсные системы, обладающие высокой степенью раздробленности (размер частиц от 10 2 до 10 7 см) и огромной поверхностью (например, у активного угля удельная поверхность достигает тысяч м2/г), что и определяет их… … Современная энциклопедия
Большой Энциклопедический словарь
коллоидная химия - – раздел химии, имеющий своим предметом высокодисперсные системы и протекающие в них системы. Словарь по аналитической химии … Химические термины
КОЛЛОИДНАЯ ХИМИЯ - наука, изучающая физ. хим. свойства дисперсных систем и некоторых высокомолекулярных продуктов, а также поверхностные явления физ. хим. процессы, протекающие на границе раздела (см.) … Большая политехническая энциклопедия
Традиционное название физической химии дисперсных систем (См. Дисперсные системы) и поверхностных явлений (См. Поверхностные явления). К. х. как самостоятельная наука возникла в 60 е годы 19 в. С тех пор её предмет и методы существенно… … Большая советская энциклопедия
Термин коллоидная химия Термин на английском colloid chemistry Синонимы colloid science Аббревиатуры Связанные термины адгезия, адсорбция, двойной электрический слой, дисперсность, золь, коллоидный раствор, критическая концентрация… … Энциклопедический словарь нанотехнологий
Область химии, изучающая дисперсные системы и поверхностные явления, возникающие на границе раздела фаз. Поскольку частицы дисперсной фазы и окружающая их дисперсионная среда имеют очень большую пов сть раздела фаз (в высокодисперсных системах… … Химическая энциклопедия
Традиционное название науки о дисперсных системах и поверхностных явлениях. Изучает такие процессы и явления, как адгезия, адсорбция, смачивание, коагуляция, электрофорез. Разрабатывает научные принципы технологии строительных материалов, бурения … Энциклопедический словарь
коллоидная химия - koloidų chemija statusas T sritis chemija apibrėžtis Dispersinių sistemų ir paviršinių reiškinių chemija. atitikmenys: angl. colloid chemistry rus. коллоидная химия … Chemijos terminų aiškinamasis žodynas
Наука о поверхностных явлениях и дисперсных системах. Вся природа земная кора и недра, атмосфера и гидросфера, организмы животных и растении сложная совокупность разнообразных дисперсных систем. Универсальность дисперсного состояния определяет… … Большой энциклопедический политехнический словарь
Книги
- Коллоидная химия. Физическая химия дисперсных систем. Учебник для студентов учреждений высшего профессионального образования. Гриф МО РФ , Ершов Юрий Алексеевич. В учебнике изложены основы физической химии дисперсных систем (коллоидной химии) в соответствии с примерной программой по дисциплине "Физическая и коллоидная химия" для специальности 060301…