Изменится ли расстояние которое проходит молекула. Вопрос. Эффективный диаметр молекулы — минимальное расстояние, на которое сближаются центры двух молекул при столкновении. Средняя скорость теплового движения молекул
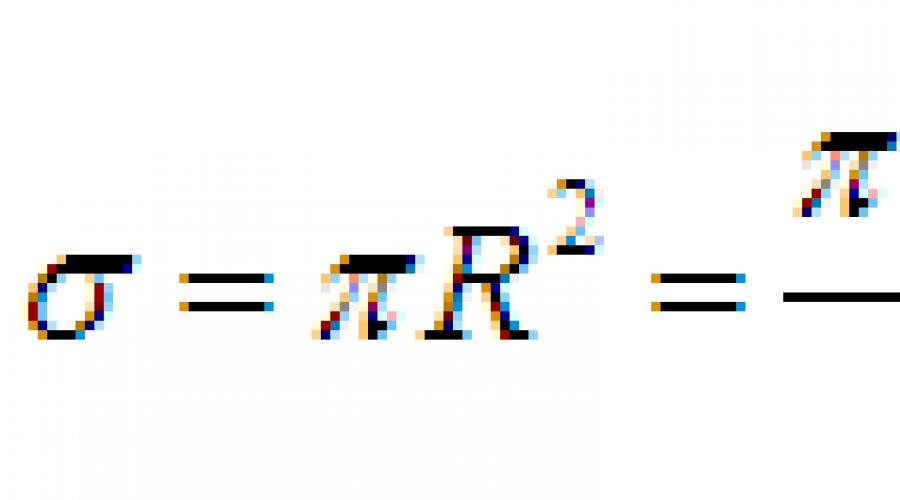
Читайте также
Эффективный диаметр молекулы - минимальное расстояние, на которое сближаются центры двух молекул при столкновении.
Среднее число столкновений и средняя длина свободного пробега молекул
Средние скорости молекул, газа очень велики - порядка сотен метров в секунду при обычных условиях. Однако процесс выравнивая неоднородности в газе вследствие молекулярного движения протекает весьма медленно. Это объясняется тем, что молекулы при перемещении испытывают соударения с другими молекулами. При каждом соударении скорость молекулы изменяется по величине и направлению. Вследствие этого, скорость, с которой молекула диффундирует из одной части газа в другую, значительно меньше средней скорости молекулярного движения. Для оценки скорости движения молекул вводится понятие средней длины свободного пробега. Таким образом, средняя дли свободного пробега - это среднее расстояние, которое проходит молекула от столкновения до столкновения.
Для определения вычислим сначала среднее число соударений выбранной молекулы с другими молекулами за единицу времени. Будем считать, что молекула после соударения продолжает двигаться по прямой со средней скоростью движения .
Молекулы, с которыми соударяется выбранная молекула, в первом приближении считаем неподвижными и принимаем их за сферические тела радиуса r. Пусть выбранная молекула движется вправо из положения в положение по прямой (рис.11.3). При своем движении она испытывает соударения с теми неподвижными молекулами, центры которых лежат не дальше чем 2r от траектории . Иными словами, движущаяся со средней скоростью молекула в течении одной секунды столкнется со всеми молекулами, центры которых находятся в объеме ограниченном цилиндром с радиусом 2r и длиной , т.е.
Если концентрация молекул n , то внутри рассмотренного цилиндра находится число молекул, равное
Это число и определяет среднее число соударений за единицу времени.
Предположение о том, что все молекулы, кроме одной, неподвижны, является, конечно не верным. В действительности все молекулы движутся, и возможность соударения двух частиц зависит от их относительной скорости. Поэтому вместо среднеарифметической скорости должны входить средняя относительная скорость молекул . Если скорости молекул распределены по закону Максвелла, то, как можно показать, средняя относительная скорость двух молекул однородного газа в раз превышает . Таким образом, среднее число соударений должно быть увеличено в раз
Таким образом, средняя длина свободного пробега не зависит от температуры газа, т.к. с ростом температуры одновременно возрастают и , и . При подсчете числа соударений и средней длины свободного пробега молекул за модель молекулы было принято шарообразное упругое тело. В действительности каждая молекула представляет собой сложную систему элементарных частиц и при рассмотрении упругого соударения молекул имелось в виду, что центры молекул могут сблизиться до некоторого наименьшего расстояния. Затем возникает силы отталкивания которые вызывают взаимодействие, подобное взаимодействию при упругом ударе. Среднее расстояние между центрами молекул, взаимодействующих, как при упругом ударе, называют эффективным диаметром . Тогда
Контрольная работа по теме «Первоначальные сведения о строении вещества».
Вариант 1
Часть 1.
А1. Мельчайшие частицы, из которых состоят различные вещества, называются…
А. Атомами Б. Молекулами В. Ионами
А2 . Молекулы различных веществ…
В. Однозначного ответа дать нельзя.
А3. При нагревании объём тела…
А. Не изменяется Б. Увеличивается В. Уменьшается
А4. В каких состояниях вещества может происходить процесс диффузии?
А. Только в газах Б. В жидкостях и газах
В. В газах, жидкостях и твердых телах.
А5. Какие из указанных свойств, принадлежат жидкостям?
А. Имеют собственную форму Б. Сохраняют объём
А6. Как расположены молекулы твердых тел?
А7. В каком состоянии может находиться воздух?
А. Только в газообразном Б. Только в жидком
Часть 2.
В1. Измениться ли расстояние, которое проходит молекула газа от одного столкновения до другого, если из баллона, в котором находится газ, выпустить некоторое его количество?
В2. В горячей воде сахар растворяется быстрее, чем в холодной. Почему?
Часть 3.
С1. Чтобы разорвать кусок проволоки, требуется значительное усилие. Однако если раскалить проволоку в пламени горелки, то разорвать ее намного легче. Почему?
Вариант 2
А1. Молекулы одного и того же вещества…
А. Не отличаются друг от друга Б. Отличаются друг от друга
В. Зависит от состояния вещества.
А2. При охлаждении объём тела…
А. Увеличивается Б. Уменьшается В. Не изменяется
А3. Как зависит процесс диффузии от температуры?
А. Процесс ускоряется с ростом температуры
Б. Процесс замедляется с ростом температуры
В. Процесс не зависит от изменения температуры.
А4. Какие из указанных свойств, принадлежат газам?
А. Имеют собственную форму. Б. Сохраняют объём
В. Не имеют собственной формы и объёма
А5. Как расположены молекулы жидкостей?
А. На большом расстоянии друг от друга
Б. Не расходятся на большие расстояния
В. Расположены в определенном порядке.
А6. В каком состоянии может находиться сталь?
А. Только в твердом Б. Только в жидком
В. В твердом, жидком и газообразном.
А7. Лед растаял и превратился в воду. Изменились ли сами молекулы льда?
А. Нет, не изменились. Б. Да, изменились. В. Нет определенного ответа.
Часть 2.
В1. Капля нефти растекается по поверхности воды, образуя тонкую пленку. Какой может быть наименьшая толщина этой пленки?
В2. Одинаково ли натягивают провода линии электропередач при их подвешивании летом и зимой?
Часть 3.
С1. Почему трудно снять с ноги мокрый чулок или носок?
Ответы.
|
Номер задания | |||||||
Контрольная работа по теме «Взаимодействие тел».
Вариант 1
Часть 1.
А1. Какое из перечисленных движений равномерное?
А. Движение Земли вокруг своей оси. Б. Движение маятника в часах.
В. Движение автомобиля при разгоне.
А2. Какова траектория лыжника, прыгающего с трамплина?
А. Прямая линия Б. Кривая линия В. Окружность
А3. Какое из приведенных ниже выражений позволяет рассчитать пройденный путь при равномерном движении?
А. s=v/t Б. s=vt В. s=t/v
А4. Мотоциклист движется со скоростью 72км/ч, а автобус со скоростью 20м/с. Какое из этих тел движется с большей скоростью?
А. Автобус Б. Мотоциклист В. Движутся одинаково.
А5. Изменится ли скорость движения тела, если действие других тел на него прекратится?
А. Не изменится. Б. Увеличится. В. Уменьшится.
А6. Плотность вещества показывает…
А. Чему равна масса вещества в объёме 1м 3 .
Б. Чему равен объём 1кг вещества.
В. Чему равна масса вещества в объёме 1л.
А7. Весы уравновесили, расположив на одной чаше весов тело, а на другой - весь набор гирь, изображенных на рисунке. Масса тела равна....
А. 10,99г Б. 11,09г В. 11,90г
Говоря об идеальном газе, мы исходили из того, что молекулы не взаимодействуют между собой. На самом деле предполагалось, конечно, отсутствие потенциальной энергии взаимодействия между ними. Упругие столкновения между молекулами и молекул со стенками обязательно должны происходить хотя бы потому, что иначе будет отсутствовать механизм, с помощью которого устанавливается равное распределение энергии по степеням свободы, иначе нельзя будет говорить о температуре системы, давлении в ней и т. п. Столкновения молекул происходят случайно. Они приводят к изменению направления и величины скорости частиц, но не меняют распределения молекул по скоростям и координатам в равновесных системах.
Возникает вопрос: а всегда ли молекулы будут сталкиваться друг с другом? Ведь молекулы очень малы, а расстояния между ними в идеальном газе на порядок больше их линейных размеров. Быть может, для сосудов малых размеров они летят без соударений от стенки к стенке? Подсчитаем, сколько раз в единицу времени одна молекула может столкнуться с другими и какое расстояние она пролетает в среднем между столкновениями.
Прежде чем перейти к вычислениям, примем простейшую модель для молекул. Будем представлять их в виде упругих шариков. При столкновении молекул с эффективными диаметрами d 1 и d 2 их центры сближаются на расстояние (d 1 + d 2)/2 (рис. 4.2).
Рис. 4.2. Столкновение двух молекул (1) и траектория движения выделенной молекулы газа (2): направление ее движения меняется, когда какая-то из молекул среды попадает в радиус взаимодействия R = (d t + d 2 )/2
Если представить себе, что молекула 1 налетает на молекулу 2 , то столкновение произойдет; если первая молекула попадет в сферу радиусом
описанную вокруг второй молекулы. Площадь сечения этой сферы

Величина R называется эффективным радиусом взаимодействия молекул 1 и 2 , а - эффективным сечением взаимодействия этих молекул. При столкновении одинаковых молекул d 1 = d 2 = d, R = d и
За время между двумя последовательными столкновениями молекула пролетает некоторый путь l . Разумеется, для каждой отдельной молекулы дело чистой случайности, сколь далеко ей удастся продвинуться без столкновений. Но усредняя путь l по всем молекулам системы, получим физическую величину
называемую средней длиной свободного пробега молекул. Статистический смысл этой величины таков: отношение малого отрезка длиной dx к дает вероятность столкновения
на пути dx . Пусть Р(х) - вероятность пролететь без столкновений расстояние х. Тогда
![]()
- вероятность, пролететь без столкновений расстояние х + dx. Последнее событие складывается из двух независимых событий:
Частица пролетела без столкновений расстояние х (вероятность чего равна Р(х));
частица также без столкновений преодолела еще и маленький отрезок пути dx (вероятность чего равна 1 – dx/ ). По теореме об умножении вероятностей имеем тогда

откуда следует уравнение для вероятности Р(х)
Поскольку вероятность преодолеть нулевое расстояние без столкновений равна единице, имеем дополнительно начальное условие Р(0) = 1 . Интегрируя дифференциальное уравнение, находим окончательно
|
|
Как видно, чем больше путь х, тем меньше вероятность преодолеть его без столкновений.
Убедимся теперь, что - действительно средняя длина свободного пробега. Вычислим, с какой вероятностью молекула будет иметь длину свободного пробега l . Это значит, что частица пролетела без столкновений расстояние х = l (вероятность чего есть Р(l) ) и столкнулась с другой частицей непосредственно за этим - на малом отрезке длиной dl (вероятность чего можно найти как dl/ ). Вероятность dw такого события по теореме умножения вероятностей равна
![]()
Находим тогда среднюю длину свободного пробега
|
|
He следует думать, конечно, что вероятность преодолеть расстояние l без столкновений равна нулю: часть молекул может пролететь очень большие расстояния, но лишь крайне небольшая их часть. При х = , как следует из (4.1), вероятность пролета без столкновений равна
![]()
то есть 63,2 % частиц испытают столкновения на этом пути. При длине пути х = 2 получаем
![]()
то есть столкновения суждены уже 86,5 % частиц, при х = 3 в столкновениях участвует уже 95 % частиц, поскольку
![]()
Чтобы определить среднее число столкновений n одной молекулы с другими в единицу времени, сделаем следующие допущения:
все молекулы одинаковы, то есть мы не рассматриваем смеси газов;
все молекулы, за исключением той, за которой мы наблюдаем, неподвижны (в дальнейшем мы покажем, как избавиться от этого заведомо неверного предположения);
при столкновениях скорость v ОT молекулы не меняется (это предположение, в сущности, того же уровня, что и предыдущее: при упругом столкновении с препятствием, которое остается неподвижным, модуль скорости действительно не меняется (смысл подстрочного индекса «от» станет ясным в дальнейшем)).
Путь нашей молекулы диаметром d остается прямолинейным до тех пор, пока ей не встретится неподвижная молекула, чей центр окажется от линии движения на расстоянии, меньшем R = d. После этого молекула сменит направление движения и будет двигаться прямолинейно до нового соударения. За интервал времени ∆ t молекула пройдет ломаный путь v OT ∆ t и столкнется со всеми молекулами, попавшими в ломаный цилиндр радиусом d и площадью основания = pd 2 (см. рис. 4.1). Объем этого цилиндра равен pd 2 v OT ∆ t. Если n- концентрация молекул в системе (их число в единице объема), то легко найти количество неподвижных молекул в цилиндре, то есть число столкновений DN:
![]()
Отсюда следует частота столкновений (то есть число столкновений в единицу времени)
|
|
Избавимся теперь от последствий нашего предположения о неподвижности молекул. Пусть мы следим за молекулой 1 , которая движется со скоростью v 1 , и она сталкивается с молекулой 2 , имеющей скорость v 2 . В системе отсчета, связанной со второй молекулой, она неподвижна, зато первая молекула имеет скорость
Ясно теперь, что именно среднее значение относительной скорости молекул играет роль скорости v ОТ , использованной нами при выводе соотношения (4.3) для частоты столкновений. Имеем тогда
где 𝜃 12 - угол между направлениями движения молекул. Из-за хаотичности движения этот угол равновероятно принимает любые значения, так что среднее значение его косинуса равно нулю. А усреднение квадратов скоростей приводит к появлению среднеквадратичной скорости молекул
![]()
знакомой нам по предыдущей главе. Получаем в итоге, что
и формула (4.3) записывается в окончательном виде
Заметим, что, перейдя от скорости молекулы к ее среднеквадратичной скорости, мы на самом деле избавились и от третьего допущения, поскольку v KB постоянна при заданной температуре.
Зная частоту столкновений, можно найти среднюю длину свободного пробега. Действительно, среднее время между двумя последовательными соударениями = 1/n , и за это время частица в среднем проходит путь = vKB t . Таким образом, средняя длина свободного пробега молекулы газа равна
|
|
Поскольку при постоянной температуре концентрация частиц пропорциональна давлению, то с ростом давления длина свободного пробега уменьшается. Это и понятно, так как уменьшается среднее расстояние между частицами. На самом деле молекула не является твердым шариком. Поэтому ее эффективный диаметр d- величина не совсем постоянная: он уменьшается при увеличении температуры, хотя и незначительно. Поэтому средняя длина свободного пробега слегка растет с повышением температуры.
Следует отметить, что среднее расстояние между частицами далеко не совпадает со средней длиной свободного пробега. Ранее мы оценили эффективный диаметр молекулы водяного пара d = 3 ·10 –10 м и среднее расстояние между молекулами при нормальных условиях L = 3 ·10 –9 м . Отсюда находим концентрацию молекул
![]()
Подставляя найденное n в выражение для длины свободного пробега, находим
Мы видим, что длина свободного пробега в 200 раз больше диаметра молекулы и в 20 раз больше среднего расстояния между молекулами. Для полноты картины оценим также частоту столкновений. Кинетическая энергия поступательного движения молекулы
![]()
Зная массу молекулы воды

получаем оценку среднеквадратичной скорости

Наконец, определяем
![]()
Иначе говоря, молекула испытывает 10 млрд соударений в секунду! Линейный размер сосуда, содержащего один литр газа, равен l = 10 см = 0,1 м . При скорости 630 м/с молекула могла бы пролететь путь от стенки до стенки за время

но за это время она испытает
![]()
столкновений с другими молекулами.
У нас осталось без обсуждения первое допущение об одинаковости всех молекул. Оно было нужно не по принципиальным соображениям, а для упрощения вывода и окончательных выражений. Если это не так, если мы рассматриваем смесь газов, то компоненты имеют разные концентрации частиц, различные среднеквадратичные скорости, а их молекулы - разные массы. Как следствие, изменится формула для средней длины свободного пробега, причем результаты будут отличаться для молекул различных сортов .
Пример. Найдем, как изменится формула (4.6) для средней длины свободного пробега молекул, если они представляют собой плоские диски, двигающиеся в материале тонкой пленки, будучи не в состоянии из нее вылететь?
Как и прежде, для столкновения молекул диаметрами d 1 и d 2 они должны сблизиться на расстояние
Поэтому при движении молекулы по плоскости пленки она заденет все другие молекулы, которые попадут в ломаный прямоугольник (в отличие от цилиндра в трехмерном случае) шириной 2R и длиной v OT ∆ t. Площадь этого прямоугольника
![]()
При поверхностной концентрации n молекул (в этом случае n - их число на единицу площади) произойдет ∆ N = Sn столкновений. Отсюда для частоты столкновений находим

где мы учли, что, как и прежде, относительная скорость
Отсюда длина свободного пробега для движущихся в плоскости плоских молекул получается равной

При одинаковых молекулах (d 1 = d 2 = d )
![]()
Свидание в лесу, ежик в тумане и атомная бомба. Идея длины свободного пробега может быть использована для оценки видимости в лесу, в тумане или даже для грубой оценки критической массы урана в атомной бомбе.
Представьте себе, что у вас назначено свидание в лесу. С какого максимального расстояния R вы заметите своего партнера (а партнер - вас)? Положим, вы включаете фонарик, чтобы подать ему/ей сигнал. Если не учитывать рассеяние света, то все деревья отбрасывают тени, линейный размер которых можно считать примерно равным диаметру d деревьев. На рис. 4.3 ваше место нахождения отмечено красным кружком, вокруг проведена окружность радиусом R, деревья показаны зелеными кружками, а их тени на окружности отмечены оранжевыми дугами.

Рис. 4.3. Оценка максимального расстояния R видимости в лесу
Определим, какую часть окружности покрывают тени. Пусть n плотность посадки деревьев (их число на единицу площади). Если l - среднее расстояние между деревьями, то
Внутрь окружности попадает pR 2 n деревьев. Полная длина тени на окружности равна поэтому pR 2 nd. Мы видим, что полная длина тени растет как квадрат радиуса и при каком-то значении R превысит длину окружности 2pR. Но если вся окружность покрыта тенями, то свет дальше не пройдет. Это значение R и будет максимальным расстоянием видимости в лесу. Теперь понятно, что оно определяется из равенства
![]()
то есть мы получили оценку

Для численного примера можно взять значения, исходя из своего жизненного опыта. Скажем, свидание назначено среди березок со средним диаметром ствола d = 0,25 м и средним расстоянием между деревьями l = 10 м . Тогда находим R = 800 м .
Установим теперь связь полученного результата с формулой для средней длины свободного пробега. У нас одна молекула (световой луч) не имеет размера (d 1 = 0 ), размер прочих молекул равен среднему диаметру ствола (d 2 = d ) и, наконец, молекулы (стволы) - покоятся, то есть надо отбросить множитель . Получаем в результате - применительно к нашей задаче - выражение
Таким образом, найденный нами радиус видимости
Вероятность свету преодолеть это расстояние без «столкновений» с деревьями равна

Иными словами, с вероятностью 86.5 % свет будет задержан деревьями.
Свидание в лесу происходило на плоскости. Сейчас мы вернемся в объемный мир. Тот же рисунок изображает теперь сферу радиусом R и препятствия в виде шариков диаметром d. Например, мы хотим оценить видимость для ежика, заблудившегося в тумане, и роль деревьев теперь исполняют водяные капли. Если концентрация капель равна п (их число в единице объема), то внутри сферы находится
![]()
Их тени на сфере представляют собой окружности площадью pd 2 /4. При максимальном расстоянии видимости тени покрывают всю сферу:

Отсюда находим расстояние видимости в тумане
Снова сравним этот результат с формулой (4.6) для длины свободного пробега молекулы в газовой среде, где надо отбросить фактор и взять

Получаем
![]()
Вероятность преодолеть путь R = 3l без столкновений равна

Стало быть, с вероятностью 95 % столкновение на этом пути произойдет.
Получим численную оценку. Наши рассуждения годятся, если размер капель заметно (скажем, на один-два порядка) превышает длину световой волны. Так как видимый диапазон имеет длины волн 0,40–0,76 мкм , то для диаметра капель примем оценку d = 10 –4 м . Для концентрации капель возьмем значение n = 3 ·10 7 м – 3 (о происхождении этого числа см. чуть ниже). Тогда видимость в тумане будет

Концентрацию капель мы оценили следующим образом. Давление насыщенного водяного пара при, скажем, 20 °С (Т = 293 К ) равно р Н = 2,3 ·10 3 Па . Применяя уравнение Клапейрона - Менделеева, находим плотность водяного пара при 100 % влажности:
При резком понижении температуры весь пар конденсируется в капли указанного размера - образуется густой туман. Масса одной капли равна

Количество образовавшихся капель в объеме V находим как отношение массы пара m к массе капли m КАП. Тогда концентрация капель определится из соотношения

При d = 10 –4 м получаем использованное выше значение n = 3 ·10 –7 м –3 .
Зависимость расстояния видимости в тумане от размера капель дается, таким образом, соотношением

При предельно малых капельках с диаметром порядка десяти длин световой волны d = 10 – 5 м видимость сокращается до одного метра. Что называется, «не видно дальше своего носа». При еще меньших размерах капель наша модель становится неверной, так как свет уже нельзя рассматривать просто как совокупность частиц с ничтожно малым размером. Начинают играть роль эффекты дифракции, и выражение для эффективного сечения взаимодействия света с каплями уже не будет определяться чисто геометрическим сечением капель.
Решенная задача имеет также отношение к вопросу о критической массе урана-235, применяемого для изготовления атомных бомб. Вместо света в этой задаче мы имеем нейтроны, а вместо капель - ядра 235 U. При столкновении с ядрами нейтроны расщепляют их на осколки, и при этом вылетает еще 3–4 нейтрона. При критическом радиусе R крит количество нейтронов не будет уменьшаться и возникнет самоподдерживающаяся цепная реакция - произойдет атомный взрыв. За основу определения критического радиуса можно взять радиус видимости
и критическую массу М крит
Отметим, что никаких секретов производства ядерного оружия мы не выдаем: слишком грубы эти оценки. Единственная наша цель - продемонстрировать еще раз единство законов физики, действующих в самых разнообразных системах.
«Физика - 10 класс»
Можно ли, зная температуру, вычислить среднюю кинетическую энергию молекул газа? среднюю скорость молекулы?
А можно ли эту скорость измерить?
Средняя скорость теплового движения молекул.
Уравнение (9.16) даёт возможность найти средний квадрат скорости движения молекулы. Подставив в это уравнение получим выражение для среднего значения квадрата скорости:
Средней квадратичной скоростью называется величина

Вычисляя по формуле (9.19) скорость молекул, например азота при t = 0 °С, получаем ![]() Молекулы водорода при той же температуре имеют среднюю квадратичную скорость
Молекулы водорода при той же температуре имеют среднюю квадратичную скорость ![]() Эти скорости велики, но так как молекулы газа движутся хаотично, непрерывно сталкиваясь друг с другом, и время между двумя столкновениями мало, то расстояние, которое пролетают молекулы также невелико. Из-за столкновения траектория каждой молекулы представляет собой запутанную ломаную линию (рис. 9.6). Большие скорости молекула имеет на прямолинейных отрезках ломаной. Как видно из рисунка, при перемещении молекулы из точки А в точку В пройденный ею путь оказывается гораздо больше расстояния АВ. При атмосферном давлении это расстояние порядка 10 -5 см.
Эти скорости велики, но так как молекулы газа движутся хаотично, непрерывно сталкиваясь друг с другом, и время между двумя столкновениями мало, то расстояние, которое пролетают молекулы также невелико. Из-за столкновения траектория каждой молекулы представляет собой запутанную ломаную линию (рис. 9.6). Большие скорости молекула имеет на прямолинейных отрезках ломаной. Как видно из рисунка, при перемещении молекулы из точки А в точку В пройденный ею путь оказывается гораздо больше расстояния АВ. При атмосферном давлении это расстояние порядка 10 -5 см.
Когда впервые были получены эти числа (вторая половина XIX в.), многие физики были ошеломлены. Скорости молекул газа по расчётам оказались больше, чем скорости артиллерийских снарядов! На этом основании высказывали даже сомнения в справедливости кинетической теории. Ведь известно, что запахи распространяются довольно медленно: нужно время порядка десятков секунд, чтобы запах духов, пролитых в одном углу комнаты, распространился до другого угла.
Экспериментальное определение скоростей молекул. Опыты по определению скоростей молекул доказали справедливость формулы (9.19). Один из опытов был предложен и осуществлён О. Штерном в 1920 г.
Что определяет среднюю кинетическую энергию теплового движения молекул и от чего зависит средняя квадратичная скорость этого движения.
Прибор Штерна состоит из двух коаксиальных цилиндров А и В, жёстко связанных друг с другом (рис. 9.7, а). Цилиндры могут вращаться с постоянной угловой скоростью. Вдоль оси малого цилиндра натянута тонкая платиновая проволочка С, покрытая слоем серебра.
В 1943 г. О. Штерн был удостоен Нобелевской премии по физике «за вклад в развитие методов молекулярных пучков и открытие и измерение магнитного момента протона».
Как вы думаете, почему проволочка сделана из платины?

По проволочке пропускают электрический ток. В стенке этого цилиндра имеется узкая щель О. Воздух из цилиндров откачан. Цилиндр В находится при комнатной температуре. Вначале прибор неподвижен. При прохождении тока по нити она нагревается и при температуре 1200 °С атомы серебра испаряются. Внутренний цилиндр заполняется газом из атомов серебра. Некоторые атомы пролетают через щель О и, достигнув внутренней поверхности цилиндра В, осаждаются на ней. В результате прямо против щели образуется узкая полоска D серебра (рис. 9.7, б).
Затем цилиндры приводят во вращение с большим числом оборотов n в секунду (до 1500 1/c).
Теперь за время t, необходимое атому для прохождения пути, равного разности радиусов цилиндров R B - R А, цилиндры повернутся на некоторый угол φ. В результате атомы, движущиеся с постоянной скоростью, попадают на внутреннюю поверхность большого цилиндра не прямо против щели О (рис. 9.7, в), а на некотором расстоянии s от конца радиуса, проходящего через середину щели (рис. 9.7, г): ведь атомы движутся прямолинейно.
Если через υ B обозначить модуль скорости вращения точек поверхности внешнего цилиндра, то
s = υ B t = 2 πnR B t. (9.20)
В действительности атомы серебра имеют разные скорости. Поэтому расстояния s для различных атомов будут несколько различаться. Под s следует понимать расстояние между участками на полосках D и D" с наибольшей толщиной слоя серебра. Этому расстоянию будет соответствовать средняя скорость атомов, которая равна![]()
Подставляя в эту формулу значение времени t из выражения (9.20), получаем
Зная n, R A и R B и измеряя среднее смещение полоски серебра, вызванное вращением прибора, можно найти среднюю скорость атомов серебра.
Модули скоростей, определённые из опыта, совпадают с теоретическим значением средней квадратичной скорости. Это служит экспериментальным доказательством справедливости формулы (9.19), а следовательно, и формулы (9.16) согласно которой средняя кинетическая энергия молекулы прямо пропорциональна абсолютной температуре.


