Mn في الجدول الدوري. النظام الدوري للعناصر الكيميائية
القرن التاسع عشر في تاريخ البشرية هو قرن تم فيه إصلاح العديد من العلوم ، بما في ذلك الكيمياء. في هذا الوقت ظهر النظام الدوري لمندليف ومعه القانون الدوري. كان هو الذي أصبح الأساس الكيمياء الحديثة. النظام الدوري لـ D.I Mendeleev هو تنظيم من العناصر ، والذي يحدد اعتماد الخواص الكيميائية والفيزيائية على بنية وشحنة ذرة مادة ما.
قصة
تم وضع بداية الدورية في كتاب "ارتباط الخصائص بالوزن الذري للعناصر" ، الذي كتب في الربع الثالث من القرن السابع عشر. عرض المفاهيم الأساسية المعروفة نسبيًا العناصر الكيميائية(في ذلك الوقت كان هناك 63 منهم فقط). علاوة على ذلك ، كثير منهم الكتل الذريةتم تعريفها بشكل غير صحيح. وقد تداخل هذا بشكل كبير مع اكتشاف D.I Mendeleev.
بدأ ديمتري إيفانوفيتش عمله بمقارنة خصائص العناصر. بادئ ذي بدء ، تناول الكلور والبوتاسيوم ، وبعد ذلك فقط انتقل للعمل مع الفلزات القلوية. مسلحًا ببطاقات خاصة تصور عناصر كيميائية ، حاول مرارًا وتكرارًا تجميع هذه "الفسيفساء": وضعه على مكتبه بحثًا عن التركيبات والمباريات الضرورية.
بعد بذل الكثير من الجهد ، وجد ديمتري إيفانوفيتش مع ذلك الانتظام الذي كان يبحث عنه ، وقام ببناء العناصر في سلسلة دورية. بعد أن تلقى خلايا فارغة بين العناصر نتيجة لذلك ، أدرك العالم أنه لم تكن جميع العناصر الكيميائية معروفة للباحثين الروس ، وأنه هو الذي يجب أن يمنح هذا العالم المعرفة في مجال الكيمياء التي لم يعطها بعد من قبله. سلف.

يعلم الجميع الأسطورة القائلة بأن الجدول الدوري ظهر لمندليف في المنام ، وقد جمع العناصر من الذاكرة فيه نظام واحد. هذه ، تقريبًا ، كذبة. الحقيقة هي أن ديمتري إيفانوفيتش عمل في عمله لفترة طويلة وبتركيز ، وقد استنفده كثيرًا. أثناء العمل على نظام العناصر ، نام منديليف ذات مرة. عندما استيقظ ، أدرك أنه لم ينته من المائدة ، واستمر في ملء الزنازين الفارغة. قرر أحد معارفه ، وهو مدرس جامعي يدعى Inostrantev ، أن طاولة منديليف كانت حلماً ونشر هذه الشائعات بين طلابه. وهكذا ولدت هذه الفرضية.
شهرة
العناصر الكيميائية لمندليف هي انعكاس للقانون الدوري الذي وضعه ديمتري إيفانوفيتش في الربع الثالث من القرن التاسع عشر (1869). في عام 1869 في اجتماع للمجتمع الكيميائي الروسي تمت قراءة إخطار منديليف حول إنشاء هيكل معين. وفي العام نفسه ، نُشر كتاب "أساسيات الكيمياء" ، والذي نُشر فيه لأول مرة نظام مندليف الدوري للعناصر الكيميائية. وفي الكتاب النظام الطبيعيالعناصر واستخدامها للإشارة إلى صفات العناصر غير المكتشفة "ذكر D. I. Mendeleev أولاً مفهوم" القانون الدوري ".

قواعد الهيكل والتنسيب
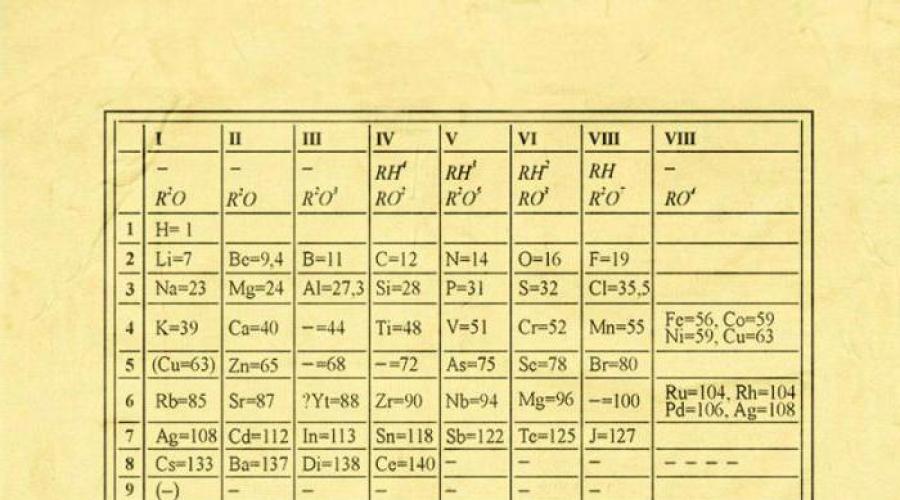
اتخذ ديمتري إيفانوفيتش الخطوات الأولى في وضع القانون الدوري في عام 1869-1871 ، وفي ذلك الوقت عمل بجد لإثبات اعتماد خصائص هذه العناصر على كتلة ذرتها. نسخة حديثةيمثل العناصر الملخصة في جدول ثنائي الأبعاد.
موضع عنصر في الجدول له معنى كيميائي وفيزيائي معين. من خلال موقع العنصر في الجدول ، يمكنك معرفة ما هو التكافؤ وتحديد الآخر السمات الكيميائية. حاول ديمتري إيفانوفيتش إنشاء علاقة بين العناصر ، المتشابهة في الخصائص والمختلفة.

لقد وضع التكافؤ والكتلة الذرية كأساس لتصنيف العناصر الكيميائية المعروفة في ذلك الوقت. بمقارنة الخصائص النسبية للعناصر ، حاول Mendeleev إيجاد نمط من شأنه أن يوحد جميع العناصر الكيميائية المعروفة في نظام واحد. بعد أن رتبهم ، بناءً على الزيادة في الكتل الذرية ، حقق مع ذلك تواترًا في كل من الصفوف.
مزيد من تطوير النظام
تم تنقيح الجدول الدوري ، الذي ظهر عام 1969 ، أكثر من مرة. مع ظهور الغازات النبيلة في الثلاثينيات ، كان من الممكن الكشف عن أحدث اعتماد للعناصر - ليس على الكتلة ، ولكن على الرقم التسلسلي. في وقت لاحق ، كان من الممكن تحديد عدد البروتونات في النوى الذرية ، واتضح أنه يتزامن مع الرقم التسلسلي للعنصر. درس علماء القرن العشرين الإلكترون ، واتضح أنه يؤثر أيضًا على تواتر الإلكترون. هذا غيّر بشكل كبير فكرة خصائص العناصر. انعكست هذه النقطة في الإصدارات اللاحقة من نظام مندليف الدوري. كل اكتشاف جديد لخصائص وميزات العناصر يتناسب عضوياً مع الجدول.
خصائص النظام الدوري لمندليف
ينقسم الجدول الدوري إلى فترات (7 أسطر مرتبة أفقيًا) ، والتي بدورها تنقسم إلى كبيرة وصغيرة. تبدأ الفترة بمعدن قلوي ، وتنتهي بعنصر له خصائص غير معدنية.
عموديًا ، ينقسم جدول ديمتري إيفانوفيتش إلى مجموعات (8 أعمدة). يتكون كل واحد منهم في النظام الدوري من مجموعتين فرعيتين ، وهما الرئيسية والثانوية. بعد نزاعات طويلة ، بناء على اقتراح من دي آي مينديليف وزميله دبليو رامزي ، تقرر تقديم ما يسمى بالمجموعة الصفرية. ويشمل الغازات الخاملة (النيون ، الهيليوم ، الأرجون ، الرادون ، الزينون ، الكريبتون). في عام 1911 ، اقترح العلماء F. Soddy وضع عناصر لا يمكن تمييزها ، ما يسمى بالنظائر ، في النظام الدوري - تم تخصيص خلايا منفصلة لها.

على الرغم من دقة ودقة النظام الدوري ، لم يرغب المجتمع العلمي في التعرف على هذا الاكتشاف لفترة طويلة. سخر العديد من العلماء العظماء من أنشطة D.I Mendeleev واعتقدوا أنه من المستحيل التنبؤ بخصائص عنصر لم يتم اكتشافه بعد. ولكن بعد اكتشاف العناصر الكيميائية المزعومة (والتي كانت ، على سبيل المثال ، سكانديوم وغاليوم وجرمانيوم) ، أصبح نظام مندليف وقانونه الدوري علم الكيمياء.
الجدول في العصر الحديث
نظام عناصر مندليف الدوري هو أساس معظم الاكتشافات الكيميائية والفيزيائية المتعلقة بالعلوم الذرية والجزيئية. المفهوم الحديثتم تشكيل العنصر فقط بفضل العالم العظيم. أدى ظهور النظام الدوري لمندليف إلى تغييرات جوهرية في الأفكار المتعلقة به مركبات مختلفةو مواد بسيطةأوه. كان لإنشاء نظام دوري من قبل عالم تأثير كبير على تطور الكيمياء وجميع العلوم المتعلقة بها.
ربما شاهدتم جميعًا الجدول الدوري للعناصر. من المحتمل أنها ما زالت تطاردك في أحلامك حتى يومنا هذا ، أو ربما تكون مجرد خلفية بصرية لك تزين الحائط. صف مدرسي. ومع ذلك ، هناك الكثير لهذه المجموعة العشوائية من الخلايا أكثر مما تراه العين.
يحتوي الجدول الدوري (أو PT ، كما سنشير إليه من وقت لآخر في هذه المقالة) ، بالإضافة إلى العناصر التي يحتويها ، على سمات ربما لم تكن قد خمنتها على الإطلاق. فيما يلي عشر حقائق ، من إنشاء الجدول إلى إضافة العناصر الأخيرة إليه ، والتي لا يعرفها معظم الناس.
10. تم مساعدة مندليف
بدأ استخدام الجدول الدوري اعتبارًا من عام 1869 ، عندما قام بتجميعه ديميتري مينديليف ، الذي كان ينمو بلحية كثيفة. يعتقد معظم الناس أن منديليف هو الوحيد الذي عمل على هذه الطاولة ، ولهذا السبب أصبح أكثر علماء الكيمياء ذكاءً في هذا القرن. ومع ذلك ، فقد ساعد في جهوده العديد من العلماء الأوروبيين الذين قدموا مساهمات مهمة في إكمال هذه المجموعة الهائلة من العناصر.
يُعرف منديليف على نطاق واسع بأنه الأب الجدول الدوري، ولكن عندما قام بتجميعها ، لم تكن كل عناصر الجدول مفتوحة بالفعل. كيف أصبح هذا ممكنا؟ اشتهر العلماء بجنونهم ...
9. العناصر المضافة مؤخرا

صدق أو لا تصدق ، الجدول الدوري لم يتغير كثيرًا منذ الخمسينيات. ومع ذلك ، في 2 ديسمبر 2016 ، تمت إضافة أربعة عناصر جديدة دفعة واحدة: nihonium (العنصر رقم 113) ، moscovium (العنصر رقم 115) ، tennessine (العنصر رقم 117) و oganesson (العنصر رقم 118). لم تتلق هذه العناصر الجديدة أسماءها إلا في يونيو 2016 ، حيث استغرق الأمر خمسة أشهر من الخبرة قبل إضافتها رسميًا إلى حزب العمال.
تم تسمية ثلاثة عناصر على اسم المدن أو الدول التي تم الحصول عليها منها ، وسُميت أوغانيسون على اسم الفيزيائي النووي الروسي يوري أوجانيسيان لمساهمته في إنتاج هذا العنصر.
8. ما هو الحرف غير الموجود في الجدول؟

يوجد 26 حرفًا في الأبجدية اللاتينية وكل واحد منهم مهم. ومع ذلك ، قرر مندليف عدم ملاحظة ذلك. انظر إلى الطاولة وأخبرني أي حرف سيئ الحظ؟ تلميح: ابحث بالترتيب وثني أصابعك بعد كل حرف تم العثور عليه. نتيجة لذلك ، ستجد الحرف "المفقود" (إذا كان لديك أصابعك العشرة على يديك). خمن؟ هذا هو الحرف رقم 10 ، الحرف "J".
يقولون أن "واحد" هو عدد الأشخاص الوحيدين. لذا ، ربما يجب أن نطلق على الحرف "J" حرف الوحيد؟ ولكن إليكم حقيقة ممتعة: معظم الأولاد المولودين في الولايات المتحدة عام 2000 تم تسميتهم بأسماء تبدأ بهذا الحرف. وهكذا ، فإن هذه الرسالة لم تمر مرور الكرام.
7. العناصر المركبة

كما تعلم بالفعل ، هناك 118 عنصرًا في الجدول الدوري اليوم. هل يمكنك تخمين عدد العناصر الـ 118 التي تم الحصول عليها في المختبر؟ من كل شيء القائمة العامةفي الظروف الطبيعيةيمكن العثور على 90 عنصرًا فقط.
هل تعتقد أن 28 عنصرًا مصطنعًا هي الكثير؟ حسنًا ، فقط خذ كلامي على محمل الجد. لقد تم تصنيعها منذ عام 1937 ، وما زال العلماء يفعلون ذلك حتى يومنا هذا. يمكن العثور على كل هذه العناصر في الجدول. انظر إلى العناصر 95 إلى 118 ، كل هذه العناصر غائبة عن كوكبنا وتم تصنيعها في المختبرات. الأمر نفسه ينطبق على العناصر المرقمة 43 و 61 و 85 و 87.
6. العنصر 137

في منتصف القرن العشرين ، أدلى عالم مشهور يدعى ريتشارد فاينمان ببيان صاخب أغرق العالم كله في ذهول. عالم علميكوكبنا. وفقًا له ، إذا اكتشفنا العنصر 137 ، فلن نتمكن من تحديد عدد البروتونات والنيوترونات الموجودة فيه. يعتبر الرقم 1/137 رائعًا من حيث أنه قيمة ثابت البنية الدقيقة ، والتي تصف احتمالية امتصاص الإلكترون أو إصداره للفوتون. من الناحية النظرية ، يجب أن يحتوي العنصر # 137 على 137 إلكترونًا واحتمال امتصاص فوتون بنسبة 100٪. ستدور إلكتروناتها بسرعة الضوء. الأمر الأكثر إثارة للإعجاب هو أن إلكترونات العنصر 139 يجب أن تدور أسرع من سرعة الضوء من أجل الوجود.
هل تعبت من الفيزياء بعد؟ قد تكون مهتمًا بمعرفة أن الرقم 137 يوحد ثلاثة مجالات مهمة في الفيزياء: نظرية سرعة الضوء وميكانيكا الكم والكهرومغناطيسية. منذ أوائل القرن العشرين ، توقع الفيزيائيون أن الرقم 137 قد يكون أساس العظيم نظرية موحدة، والتي ستشمل المجالات الثلاثة المذكورة أعلاه. من المسلم به أن هذا يبدو مذهلاً مثل أساطير الأجسام الطائرة المجهولة ومثلث برمودا.
5. ماذا يمكن أن يقال عن الأسماء؟

تحتوي جميع أسماء العناصر تقريبًا على بعض المعاني ، على الرغم من عدم وضوحها على الفور. أسماء العناصر الجديدة ليست عشوائية. أود تسمية العنصر بالكلمة الأولى التي تتبادر إلى ذهني. على سبيل المثال ، "kerflump". اعتقد انه جيد.
عادةً ما تندرج أسماء العناصر في واحدة من خمس فئات رئيسية. الأول هو أسماء مشاهير العلماء ، النسخة الكلاسيكية- اينشتينيوم. بالإضافة إلى ذلك ، يمكن أن تحصل العناصر على أسمائها اعتمادًا على الأماكن التي تم تسجيلها فيها لأول مرة ، على سبيل المثال ، الجرمانيوم ، والأمريسيوم ، والغاليوم ، وما إلى ذلك. خيار إضافييتم استخدام أسماء الكواكب. تم اكتشاف عنصر اليورانيوم لأول مرة بعد وقت قصير من اكتشاف كوكب أورانوس. يمكن أن يكون للعناصر أسماء مرتبطة بالأساطير ، على سبيل المثال ، هناك التيتانيوم ، الذي سمي على اسم جبابرة اليونان القديمة ، والثوريوم ، الذي سمي على اسم إله الرعد الاسكندنافي (أو النجم "المنتقم" ، حسب ما تفضله).
وأخيرًا ، هناك أسماء تصف خصائص العناصر. يأتي Argon من الكلمة اليونانية "argos" ، والتي تعني "كسول" أو "بطيء". يشير الاسم إلى افتراض أن هذا الغاز غير نشط. البروم هو عنصر آخر يأتي اسمه من كلمة يونانية. "البروموس" تعني "الرائحة الكريهة" وهذا يصف رائحة البروم بدقة تامة.
4. هل كان إنشاء الجدول بمثابة "نظرة ثاقبة"

إذا كنت تحب لعب الورقثم هذه الحقيقة لك. احتاج Mendeleev إلى ترتيب جميع العناصر بطريقة ما وإيجاد نظام لذلك. بطبيعة الحال ، لإنشاء جدول حسب الفئة ، لجأ إلى سوليتير (حسنًا ، ماذا أيضًا؟) كتب منديليف الوزن الذري لكل عنصر على بطاقة منفصلة ، ثم شرع في وضع سوليتير المتقدم. قام بتكديس العناصر وفقًا لخصائصها المحددة ثم رتبها في كل عمود وفقًا لوزنها الذري.
لا يستطيع الكثير من الناس حتى عمل لعبة سوليتير عادية ، لذا فإن هذا السوليتير مثير للإعجاب. ماذا سيحدث بعد؟ ربما يقوم شخص ما بمساعدة الشطرنج بإحداث ثورة في الفيزياء الفلكية أو يصنع صاروخًا قادرًا على الطيران إلى أطراف المجرة. يبدو أن هذا لن يكون غير عادي ، بالنظر إلى أن Mendeleev تمكن من الحصول على مثل هذه النتيجة الرائعة من خلال مجموعة أوراق اللعب العادية فقط.
3. غازات خاملة سيئة الحظ

هل تتذكر كيف صنفنا الأرجون على أنه العنصر "الأكثر كسلاً" و "الأبطأ" في تاريخ كوننا؟ يبدو أن مندليف كان لديه نفس المشاعر. عندما تم الحصول على الأرجون النقي لأول مرة في عام 1894 ، لم يكن مناسبًا لأي من أعمدة الجدول ، لذلك بدلاً من البحث عن حل ، قرر العالم ببساطة إنكار وجوده.
والأكثر إثارة للدهشة أن الأرجون لم يكن العنصر الوحيد الذي عانى من هذا المصير في المقام الأول. بالإضافة إلى الأرجون ، ظلت خمسة عناصر أخرى غير مصنفة. أثر هذا على الرادون والنيون والكريبتون والهيليوم والزينون - ونفى الجميع وجودهم لمجرد أن مندليف لم يجد مكانًا لهم في الجدول. بعد عدة سنوات من إعادة الترتيب وإعادة التصنيف ، هذه العناصر (المسماة الغازات الخاملة) كان لا يزال محظوظًا بما يكفي للانضمام إلى نادٍ جدير معترف به على أنه موجود بالفعل.
2. الحب الذري

نصيحة لكل من يعتبرون أنفسهم رومانسيين. خذ نسخة ورقية من الجدول الدوري واقطع منه كل الأعمدة الوسطى المعقدة وغير الضرورية نسبيًا بحيث يتبقى لديك 8 أعمدة (ستحصل على الشكل "القصير" للجدول). قم بطيه في منتصف المجموعة IV - وستكتشف العناصر التي يمكن أن تشكل مركبات مع بعضها البعض.
العناصر التي "تقبل" عند طيها تكون قادرة على تكوين روابط مستقرة. هذه العناصر لها هياكل إلكترونية مكملة وسوف تتحد مع بعضها البعض. وإذا لم يكن الحب الحقيقي ، مثل روميو وجولييت أو شريك وفيونا ، فأنا لا أعرف ما هو الحب.
1. قواعد الكربون

يحاول كربون أن يكون في قلب اللعبة. تعتقد أنك تعرف كل شيء عن الكربون ، لكنك لا تعرفه ، فهو أهم بكثير مما تدرك. هل تعلم أنه موجود في أكثر من نصف المركبات المعروفة؟ وماذا عن حقيقة أن 20 في المائة من وزن جميع الكائنات الحية هو الكربون؟ هذا غريب حقًا ، لكن استعد: كل ذرة كربون في جسمك كانت ذات يوم جزءًا من فصيل نشبعفي الغلاف الجوي. الكربون ليس فقط عنصرًا فائقًا لكوكبنا ، فهو رابع أكثر العناصر وفرة في الكون بأسره.
إذا تمت مقارنة الجدول الدوري بحزب ، فإن الكربون هو قائده الرئيسي. ويبدو أنه الوحيد الذي يعرف كيف ينظم كل شيء بشكل صحيح. حسنًا ، من بين أشياء أخرى ، فهو العنصر الرئيسي لجميع أنواع الماس ، لذلك على الرغم من أهميته ، فهو يلمع أيضًا!
كان اكتشاف ديمتري مندليف للجدول الدوري للعناصر الكيميائية في مارس 1869 بمثابة اختراق حقيقي في الكيمياء. تمكن العالم الروسي من تنظيم المعرفة حول العناصر الكيميائية وتقديمها في شكل طاولة ، والتي يجب على أطفال المدارس الآن دراستها في فصول الكيمياء. أصبح الجدول الدوري أساس التطور السريع لهذا العلم المعقد والمثير للاهتمام ، وتاريخ اكتشافه محاط بالأساطير والأساطير. بالنسبة لكل مغرم بالعلوم ، سيكون من المثير للاهتمام معرفة الحقيقة حول كيفية اكتشاف مندليف لجدول العناصر الدورية.
تاريخ الجدول الدوري: كيف بدأ كل شيء
بذلت محاولات لتصنيف العناصر الكيميائية المعروفة وتنظيمها قبل فترة طويلة من ديمتري مندليف. تم اقتراح أنظمة العناصر الخاصة بهم من قبل علماء مشهورين مثل Debereiner و Newlands و Meyer وغيرهم. ومع ذلك ، نظرًا لعدم وجود بيانات عن العناصر الكيميائية وكتلها الذرية الصحيحة ، لم تكن الأنظمة المقترحة موثوقة تمامًا.
بدأ تاريخ اكتشاف الجدول الدوري في عام 1869 ، عندما أخبر عالم روسي في اجتماع للجمعية الكيميائية الروسية زملائه عن اكتشافه. في الجدول الذي اقترحه العالم ، تم ترتيب العناصر الكيميائية اعتمادًا على خصائصها ، بشرط أن تكون قيمة وزنها الجزيئي.
ومن السمات المثيرة للاهتمام في الجدول الدوري أيضًا وجود خلايا فارغة ، والتي كانت في المستقبل مليئة بالعناصر الكيميائية المكتشفة التي تنبأ بها العالم (الجرمانيوم ، الغاليوم ، سكانديوم). بعد اكتشاف الجدول الدوري ، تم إجراء الإضافات والتعديلات عليه عدة مرات. جنبا إلى جنب مع الكيميائي الاسكتلندي ويليام رامزي ، أضاف مندليف مجموعة من الغازات الخاملة (المجموعة الصفرية) إلى الجدول.
في المستقبل ، ارتبط تاريخ الجدول الدوري لمندليف ارتباطًا مباشرًا بالاكتشافات في علم آخر - الفيزياء. لا يزال العمل على جدول العناصر الدورية مستمراً ، حيث يضيف العلماء المعاصرون عناصر كيميائية جديدة عند اكتشافها. من الصعب المبالغة في تقدير أهمية النظام الدوري لـ Dmitri Mendeleev ، لأنه بفضل:
- تم تنظيم المعرفة بخصائص العناصر الكيميائية المكتشفة بالفعل ؛
- أصبح من الممكن التنبؤ باكتشاف عناصر كيميائية جديدة ؛
- بدأت فروع الفيزياء في التطور مثل فيزياء الذرة وفيزياء النواة ؛
هناك العديد من الخيارات لتصوير العناصر الكيميائية وفقًا للقانون الدوري ، لكن الخيار الأكثر شهرة وشائعًا هو الجدول الدوري المألوف للجميع.
أساطير وحقائق حول إنشاء الجدول الدوري
أكثر المفاهيم الخاطئة شيوعًا في تاريخ اكتشاف الجدول الدوري هي أن العالم رآه في المنام. في الواقع ، دحض ديمتري مندليف نفسه هذه الأسطورة وذكر أنه كان يفكر في القانون الدوري لسنوات عديدة. لتنظيم العناصر الكيميائية ، كتب كل منها على بطاقة منفصلة ودمجها مع بعضها مرارًا وتكرارًا ، ورتبها في صفوف اعتمادًا على خصائصها المتشابهة.
يمكن تفسير أسطورة الحلم "النبوي" للعالم من خلال حقيقة أن مندليف عمل على تنظيم العناصر الكيميائية لأيام متتالية ، متقطعًا بنوم قصير. ومع ذلك ، فإن العمل الجاد والموهبة الطبيعية للعالم فقط هي التي أعطت النتيجة التي طال انتظارها ومنحت ديمتري مندليف شهرة عالمية.
يضطر العديد من الطلاب في المدرسة ، وأحيانًا في الجامعة ، إلى حفظ الجدول الدوري أو التنقل فيه تقريبًا. للقيام بذلك ، يجب ألا يمتلك الشخص فقط ذاكرة جيدة، ولكن أيضًا للتفكير المنطقي ، وربط العناصر في مجموعات وفئات منفصلة. تعتبر دراسة الجدول أسهل بالنسبة لأولئك الأشخاص الذين يحافظون باستمرار على دماغهم في حالة جيدة من خلال تلقي التدريبات على BrainApps.
يتذكر كل من ذهب إلى المدرسة أن الكيمياء هي أحد المواد المطلوبة للدراسة. قد تعجبها ، أو لم تعجبها - لا يهم. ومن المحتمل أن يكون قد تم بالفعل نسيان الكثير من المعرفة في هذا التخصص ولم يتم تطبيقه في الحياة. ومع ذلك ، ربما يتذكر الجميع جدول العناصر الكيميائية لـ D. I. Mendeleev. بالنسبة للكثيرين ، ظل جدولًا متعدد الألوان ، حيث نُقشت أحرف معينة في كل مربع ، للإشارة إلى أسماء العناصر الكيميائية. لكننا هنا لن نتحدث عن الكيمياء على هذا النحو ، وسنصف المئات منها تفاعلات كيميائيةوالعمليات ، لكننا سنتحدث عن كيفية ظهور الجدول الدوري بشكل عام - ستكون هذه القصة موضع اهتمام أي شخص ، وفي الواقع لجميع أولئك الجياع للحصول على معلومات شيقة ومفيدة.
القليل من الخلفية
في عام 1668 ، نشر الكيميائي والفيزيائي واللاهوتي الأيرلندي روبرت بويل كتابًا تم فيه فضح العديد من الأساطير حول الكيمياء ، وتحدث فيه عن الحاجة إلى البحث عن عناصر كيميائية غير قابلة للتحلل. قدم العالم أيضًا قائمة بها ، تتكون من 15 عنصرًا فقط ، لكنه سمح بفكرة أنه قد يكون هناك المزيد من العناصر. أصبحت هذه نقطة البداية ليس فقط في البحث عن عناصر جديدة ، ولكن أيضًا في تنظيمها.
بعد مائة عام ، قام الكيميائي الفرنسي أنطوان لافوازييه بتجميع قائمة جديدة تضمنت بالفعل 35 عنصرًا. تم العثور على 23 منهم في وقت لاحق لتكون غير قابلة للتحلل. لكن البحث عن عناصر جديدة استمر من قبل العلماء في جميع أنحاء العالم. و دور قياديلعب الكيميائي الروسي الشهير ديمتري إيفانوفيتش مينديليف في هذه العملية - كان أول من طرح فرضية أنه يمكن أن تكون هناك علاقة بين الكتلة الذرية للعناصر وموقعها في النظام.
بفضل العمل الجاد ومقارنة العناصر الكيميائية ، تمكن منديليف من اكتشاف العلاقة بين العناصر التي يمكن أن تكون واحدة فيها ، وخصائصها ليست شيئًا مفروغًا منه ، ولكنها ظاهرة تتكرر بشكل دوري. نتيجة لذلك ، في فبراير 1869 ، صاغ مندليف القانون الدوري الأول ، وفي مارس بالفعل ، تم تقديم تقريره "علاقة الخصائص بالوزن الذري للعناصر" إلى الجمعية الكيميائية الروسية من قبل مؤرخ الكيمياء ن. أ. مينشوتكين. ثم في نفس العام ، نُشر منشور منديليف في مجلة Zeitschrift fur Chemie في ألمانيا ، وفي عام 1871 تم نشر منشور جديد واسع النطاق للعالم مكرس لاكتشافه في مجلة ألمانية أخرى Annalen der Chemie.
إنشاء جدول دوري

بحلول عام 1869 ، كانت الفكرة الرئيسية قد تشكلت بالفعل من قبل مندليف ، وفي وقت قصير إلى حد ما ، لكنه لم يستطع إضفاء الطابع الرسمي عليها في أي نوع من النظام المنظم الذي يعرض بوضوح ما كان ، لفترة طويلة لم يستطع. في إحدى المحادثات التي أجراها مع زميله أ. إينوستريستيف ، قال حتى إن كل شيء قد نجح بالفعل في رأسه ، لكنه لم يستطع إحضار كل شيء إلى الطاولة. بعد ذلك ، وفقًا لسيرة منديليف ، بدأ العمل الشاق على طاولته ، والتي استمرت ثلاثة أيام دون استراحة للنوم. تم فرز جميع أنواع الطرق لتنظيم العناصر في الجدول ، وكان العمل معقدًا بسبب حقيقة أن العلم في ذلك الوقت لم يكن يعرف بعد عن جميع العناصر الكيميائية. لكن ، على الرغم من ذلك ، كان الجدول لا يزال يُنشأ ، وتم تنظيم العناصر.
أسطورة حلم مندليف
لقد سمع الكثيرون القصة التي كان يحلم بها دي آي مينديليف على طاولته. تم توزيع هذه النسخة بنشاط من قبل الزميل المذكور أعلاه من Mendeleev A. A. Inostrantsev as قصة مضحكةالذي كان يرفه عن طلابه. قال إن ديمتري إيفانوفيتش ذهب إلى الفراش وفي المنام رأى بوضوح طاولته ، حيث تم ترتيب جميع العناصر الكيميائية فيها النظام الصحيح. بعد ذلك ، قال الطلاب مازحين أنه تم اكتشاف 40 درجة من الفودكا بنفس الطريقة. لكن لا تزال هناك شروط مسبقة حقيقية لقصة النوم: كما ذكرنا سابقًا ، عمل مندليف على الطاولة بدون نوم وراحة ، ووجده إينوستريستيف ذات مرة متعبًا ومرهقًا. في فترة ما بعد الظهر ، قرر مندليف أخذ قسط من الراحة ، وبعد فترة من الوقت ، استيقظ فجأة ، وأخذ على الفور قطعة من الورق ورسم طاولة جاهزة عليها. لكن العالم نفسه دحض هذه القصة برمتها بحلم ، قائلاً: "لقد كنت أفكر في الأمر منذ عشرين عامًا ، وأنت تعتقد: كنت جالسًا وفجأة ... أصبحت جاهزة." لذلك قد تكون أسطورة الحلم جذابة للغاية ، لكن إنشاء الطاولة لم يكن ممكنًا إلا من خلال العمل الجاد.

مزيد من العمل
في الفترة من 1869 إلى 1871 ، طور مندليف أفكار الدورية التي كان المجتمع العلمي يميل إليها. وواحد من معالم هذه العمليةكان هناك تفاهم على أن أي عنصر في النظام يجب أن يكون ، بناءً على مجموع خصائصه مقارنةً بخصائص العناصر الأخرى. بناءً على ذلك ، وبناءً على نتائج البحث في تغيير الأكاسيد المكونة للزجاج ، تمكن الكيميائي من تعديل قيم الكتل الذرية لبعض العناصر ، من بينها اليورانيوم والإنديوم والبريليوم وغيرها.
بالطبع ، أراد Mendeleev ملء الخلايا الفارغة التي بقيت في الجدول في أسرع وقت ممكن ، وفي عام 1870 توقع أنه سيتم قريبًا اكتشاف عناصر كيميائية غير معروفة للعلم ، والكتل الذرية وخصائصها التي تمكن من حسابها. كان أولها الغاليوم (اكتشف عام 1875) ، سكانديوم (اكتشف عام 1879) والجرمانيوم (اكتشف عام 1885). ثم استمرت التوقعات في تحقيقها ، وتم اكتشاف ثمانية عناصر جديدة أخرى ، بما في ذلك: البولونيوم (1898) ، والرينيوم (1925) ، والتكنيشيوم (1937) ، والفرانسيوم (1939) ، والأستاتين (1942-1943). بالمناسبة ، في عام 1900 ، توصل D.I Mendeleev والكيميائي الاسكتلندي William Ramsay إلى استنتاج مفاده أنه يجب أيضًا تضمين عناصر المجموعة الصفرية في الجدول - حتى عام 1962 كانت تسمى غازات خاملة ، وبعدها - غازات نبيلة.
تنظيم النظام الدوري
يتم ترتيب العناصر الكيميائية في جدول D.I Mendeleev في صفوف ، وفقًا للزيادة في كتلتها ، ويتم اختيار طول الصفوف بحيث يكون للعناصر الموجودة فيها خصائص متشابهة. على سبيل المثال ، لا تتفاعل الغازات النبيلة مثل الرادون والزينون والكريبتون والأرجون والنيون والهيليوم بسهولة مع العناصر الأخرى ، كما أن لها نشاطًا كيميائيًا منخفضًا ، وهذا هو سبب وجودها في العمود الأيمن الأقصى. وتتفاعل عناصر العمود الأيسر (البوتاسيوم ، الصوديوم ، الليثيوم ، إلخ) بشكل مثالي مع العناصر الأخرى ، وتكون التفاعلات نفسها متفجرة. لوضعها ببساطة ، داخل كل عمود ، العناصر لها خصائص متشابهة ، تختلف من عمود إلى آخر. تم العثور على جميع العناصر حتى رقم 92 في الطبيعة ، ويبدأ الرقم 93 عناصر اصطناعيةلا يمكن إنشاؤه إلا في المختبر.
في نسخته الأصلية ، لم يُفهم النظام الدوري إلا على أنه انعكاس للترتيب الموجود في الطبيعة ، ولم تكن هناك تفسيرات لماذا يجب أن يكون كل شيء على هذا النحو. وفقط عندما ظهر ميكانيكا الكمأصبح المعنى الحقيقي لترتيب العناصر في الجدول واضحًا.
دروس العملية الإبداعية
نتحدث عن الدروس ما عملية إبداعيةيمكن استخلاصها من التاريخ الكامل لإنشاء الجدول الدوري لـ D. I. Mendeleev ، يمكننا أن نذكر على سبيل المثال أفكار باحث إنجليزي في هذا المجال تفكير ابداعىجراهام والاس والعالم الفرنسي هنري بوانكاريه. لنأخذها بإيجاز.
وفقًا لـ Poincaré (1908) و Graham Wallace (1926) ، هناك أربع مراحل رئيسية في التفكير الإبداعي:
- تمرين- مرحلة صياغة المهمة الرئيسية والمحاولات الأولى لحلها ؛
- حضانة- المرحلة التي يوجد فيها إلهاء مؤقت عن العملية ، ولكن يتم العمل على إيجاد حل للمشكلة على مستوى اللاوعي ؛
- تبصر- المرحلة التي يتم فيها إيجاد الحل البديهي. علاوة على ذلك ، يمكن العثور على هذا الحل في موقف لا علاقة له بالمهمة على الإطلاق ؛
- فحص- مرحلة اختبار الحل وتنفيذه ، حيث يتم التحقق من هذا الحل وإمكانية تطويره.
كما نرى ، في عملية إنشاء طاولته ، اتبع Mendeleev بشكل حدسي هذه المراحل الأربع. ما مدى فعالية هذا يمكن الحكم عليه من خلال النتائج ، أي لأن الجدول قد تم إنشاؤه. وبالنظر إلى أن إنشائها كان خطوة كبيرة إلى الأمام ليس فقط في مجال العلوم الكيميائية ، ولكن بالنسبة للبشرية جمعاء ، يمكن تطبيق المراحل الأربع المذكورة أعلاه على كل من التنفيذ. مشاريع صغيرةوتنفيذ الخطط العالمية. الشيء الرئيسي الذي يجب تذكره هو أنه لا يمكن العثور على اكتشاف واحد أو حل واحد لمشكلة ما بمفرده ، بغض النظر عن مدى رغبتنا في رؤيتهم في المنام وبغض النظر عن مقدار نومنا. لكي تنجح ، سواء كان ذلك في إنشاء جدول للعناصر الكيميائية أو تطوير خطة تسويق جديدة ، فأنت بحاجة إلى معرفة ومهارات معينة ، وكذلك استخدام إمكاناتك بمهارة والعمل الجاد.
نتمنى لكم التوفيق في مساعيكم والتنفيذ الناجح لخططكم!
حتى في المدرسة ، أثناء الجلوس في دروس الكيمياء ، نتذكر جميعًا الطاولة على جدار الفصل الدراسي أو مختبر كيميائي. يحتوي هذا الجدول على تصنيف لجميع العناصر الكيميائية المعروفة للبشرية ، تلك المكونات الأساسية التي تتكون منها الأرض والكون بأكمله. ثم لا يمكننا حتى التفكير في ذلك الجدول الدوريبلا شك واحدة من أعظم اكتشافات علميةالذي هو أساس لدينا المعرفة الحديثةعن الكيمياء.
النظام الدوري للعناصر الكيميائية لـ D. I. Mendeleev
للوهلة الأولى ، تبدو فكرتها بسيطة بشكل مخادع: التنظيم العناصر الكيميائيةبترتيب تصاعدي لوزن ذراتهم. علاوة على ذلك ، في معظم الحالات اتضح أن تلك المادة الكيميائية و الخصائص الفيزيائيةكل عنصر مشابه للعنصر الذي يسبقه في الجدول. يتجلى هذا النمط لجميع العناصر ، باستثناء العناصر القليلة الأولى ، وذلك ببساطة لأنه لا يوجد أمامها عناصر مشابهة لها في الوزن الذري. بفضل اكتشاف هذه الخاصية ، يمكننا وضع تسلسل خطي للعناصر في جدول يذكرنا جدًا بتقويم الحائط ، وبالتالي نجمع عددًا كبيرًا من أنواع العناصر الكيميائية بطريقة واضحة ومتماسكة. بالطبع ، نستخدم اليوم مفهوم العدد الذري (عدد البروتونات) من أجل ترتيب نظام العناصر. هذا ساعد في حل ما يسمى ب مشكلة فنيةومع ذلك ، لم تؤد "أزواج التباديل" إلى تغيير جوهري في مظهر الجدول الدوري.
في الجدول الدوري لمندليفيتم ترتيب جميع العناصر وفقًا للعدد الذري والتكوين الإلكتروني والخصائص الكيميائية المتكررة. تسمى الصفوف في الجدول فترات ، وتسمى الأعمدة مجموعات. الجدول الأول ، بتاريخ 1869 ، احتوى على 60 عنصرًا فقط ، ولكن يجب الآن توسيع الجدول لاستيعاب 118 عنصرًا معروفًا لنا اليوم.
نظام مندليف الدوريلا ينظم العناصر فحسب ، بل ينظم أيضًا خصائصها الأكثر تنوعًا. غالبًا ما يكون كافيًا أن يضع الكيميائي الجدول الدوري أمام عينيه من أجل الإجابة بشكل صحيح على العديد من الأسئلة (ليس فقط الاختبارات ، ولكن أيضًا الأسئلة العلمية).
معرف YouTube لـ 1M7iKKVnPJE غير صالح.
القانون الدوري
هناك نوعان من الصيغ قانون دوريالعناصر الكيميائية: الكلاسيكية والحديثة.
الكلاسيكية ، كما قدمها مكتشفها د. منديليف: خصائص الأجسام البسيطة ، وكذلك أشكال وخصائص مركبات العناصر ، تعتمد بشكل دوري على قيم الأوزان الذرية للعناصر.
الحديث: خصائص المواد البسيطة ، وكذلك خصائص وأشكال مركبات العناصر ، هي في الاعتماد الدوري على شحنة نواة ذرات العناصر (الرقم التسلسلي).
التمثيل البياني للقانون الدوري هو النظام الدوري للعناصر ، وهو التصنيف الطبيعيالعناصر الكيميائية ، بناءً على التغييرات المنتظمة في خصائص العناصر من شحنات ذراتها. الصور الأكثر شيوعًا للجدول الدوري للعناصر D.I. Mendeleev هي أشكال قصيرة وطويلة.

مجموعات وفترات النظام الدوري
مجموعاتتسمى الصفوف الرأسية في الجدول الدوري. في مجموعات ، يتم دمج العناصر وفقًا للسمة أعلى درجةأكسدة في أكاسيد. تتكون كل مجموعة من المجموعات الفرعية الرئيسية والثانوية. تشمل المجموعات الفرعية الرئيسية عناصر الفترات الصغيرة وعناصر الفترات الكبيرة المتطابقة معها في الخصائص. تتكون المجموعات الفرعية الجانبية فقط من عناصر ذات فترات كبيرة. تختلف الخصائص الكيميائية لعناصر المجموعات الفرعية الرئيسية والثانوية بشكل كبير.
فترةقم باستدعاء صف أفقي من العناصر مرتبة بترتيب تصاعدي للأرقام (الذرية) الترتيبية. هناك سبع فترات في النظام الدوري: تسمى الفترات الأولى والثانية والثالثة صغيرة ، وتحتوي على 2 و 8 و 8 عناصر على التوالي ؛ تسمى الفترات المتبقية كبيرة: في الفترتين الرابعة والخامسة ، يوجد 18 عنصرًا لكل منهما ، في الفترة السادسة - 32 ، وفي الفترة السابعة (لا تزال غير مكتملة) - 31 عنصرًا. تبدأ كل فترة ، باستثناء الأولى ، بمعدن قلوي وتنتهي بغاز نبيل.
المعنى المادي للرقم التسلسليالعنصر الكيميائي: عدد البروتونات في نواة الذرة وعدد الإلكترونات التي تدور حولها نواة ذرية، تساوي الرقم الترتيبي للعنصر.
خصائص الجدول الدوري
أذكر ذلك مجموعاتاسم الصفوف العمودية في الجدول الدوري و الخواص الكيميائيةتختلف عناصر المجموعات الفرعية الرئيسية والثانوية اختلافًا كبيرًا.
تتغير خصائص العناصر في المجموعات الفرعية بشكل طبيعي من أعلى إلى أسفل:
- تكثيف الخصائص المعدنيةويضعف غير المعدنية.
- يزيد نصف القطر الذري.
- تزداد قوة القواعد وأحماض الأكسجة التي يتكون منها العنصر ؛
- قطرات الكهربية.
تشكل جميع العناصر ، باستثناء الهيليوم والنيون والأرجون ، مركبات أكسجين ، ولا يوجد سوى ثمانية أشكال من مركبات الأكسجين. غالبًا ما يتم تصويرهم في الجدول الدوري. الصيغ العامة، تقع تحت كل مجموعة بترتيب تصاعدي لحالة أكسدة العناصر: R 2 O ، RO ، R 2 O 3 ، RO 2 ، R 2 O 5 ، RO 3 ، R 2 O 7 ، RO 4 ، حيث الرمز R يدل على عنصر من هذه المجموعة. تنطبق صيغ الأكاسيد الأعلى على جميع عناصر المجموعة ، إلا في حالات استثنائية عندما لا تُظهر العناصر حالة أكسدة مساوية لرقم المجموعة (على سبيل المثال ، الفلور).
تظهر أكاسيد التركيب R 2 O خصائص أساسية قوية ، وتزداد قاعدتها مع زيادة الرقم التسلسلي ، وتظهر أكاسيد التكوين RO (باستثناء BeO) الخصائص الأساسية. تظهر أكاسيد التركيبة RO 2 ، R 2 O 5 ، RO 3 ، R 2 O 7 خواص حمضية ، وتزداد حموضتها مع زيادة الرقم التسلسلي.
تشكل عناصر المجموعات الفرعية الرئيسية ، بدءًا من المجموعة الرابعة ، مركبات الهيدروجين الغازية. هناك أربعة أشكال من هذه المركبات. يتم وضعها تحت عناصر المجموعات الفرعية الرئيسية ويتم تمثيلها بواسطة الصيغ العامة في التسلسل RH 4 ، RH 3 ، RH 2 ، RH.
مركبات RH 4 محايدة ؛ RH 3 - قاعدي ضعيف ؛ RH 2 - حمضي قليلاً ؛ RH حمضي بقوة.
أذكر ذلك فترةقم باستدعاء صف أفقي من العناصر مرتبة بترتيب تصاعدي للأرقام (الذرية) الترتيبية.
خلال الفترة التي حدثت فيها زيادة في الرقم التسلسلي للعنصر:
- يزيد الكهربية.
- تنخفض الخصائص المعدنية ، تزداد الخصائص غير المعدنية ؛
- يقع نصف القطر الذري.

عناصر الجدول الدوري
العناصر الأرضية القلوية والقلوية
وتشمل هذه العناصر من المجموعتين الأولى والثانية من الجدول الدوري. الفلزات القلويةمن المجموعة الأولى - معادن ناعمة ، فضية ، مقطوعة جيدًا بسكين. كل منهم لديه إلكترون واحد في الغلاف الخارجي ويتفاعل بشكل مثالي. المعادن الأرضية القلويةمن المجموعة الثانية لها أيضًا صبغة فضية. يتم وضع إلكترونين في المستوى الخارجي ، وبالتالي فإن هذه المعادن أقل رغبة في التفاعل مع العناصر الأخرى. مقارنة بالمعادن القلوية ، تذوب معادن الأرض القلوية وتغلي عند درجات حرارة أعلى.
إظهار / إخفاء النص
اللانثانيدات (العناصر الأرضية النادرة) والأكتينيدات
اللانثانيداتهي مجموعة من العناصر الموجودة أصلاً في المعادن النادرة ؛ ومن هنا جاء اسمها عناصر "الأرض النادرة". بعد ذلك ، اتضح أن هذه العناصر ليست نادرة كما اعتقدوا في البداية ، وبالتالي تم إعطاء اسم اللانثانيدات لعناصر الأرض النادرة. اللانثانيدات و الأكتينيداتتشغل كتلتين تقعان تحت الجدول الرئيسي للعناصر. كلا المجموعتين تشمل المعادن. جميع اللانثانيدات (باستثناء البروميثيوم) غير مشعة ؛ الأكتينيدات ، من ناحية أخرى ، مشعة.
إظهار / إخفاء النص
الهالوجينات والغازات النبيلة
تم تصنيف الهالوجينات والغازات النبيلة في مجموعات 17 و 18 من الجدول الدوري. الهالوجيناتهي عناصر غير معدنية ، وكلها تحتوي على سبعة إلكترونات في غلافها الخارجي. في غازات نبيلةجميع الإلكترونات موجودة في الغلاف الخارجي ، وبالتالي بالكاد تشارك في تكوين المركبات. تسمى هذه الغازات "نبيلة" لأنها نادراً ما تتفاعل مع العناصر الأخرى ؛ أي تشير إلى أعضاء الطبقة النبيلة الذين يتجنبون تقليديًا الآخرين في المجتمع.
إظهار / إخفاء النص
معادن انتقالية
معادن انتقاليةتشغل المجموعات 3-12 في الجدول الدوري. معظمها كثيفة وصلبة وذات موصلية كهربائية وحرارية جيدة. توجد إلكترونات التكافؤ (التي تتصل من خلالها بعناصر أخرى) في عدة أغلفة إلكترونية.
إظهار / إخفاء النص
| معادن انتقالية |
| سكانديوم الشوري 21 |
| تيتان تي 22 |
| الفاناديوم الخامس 23 |
| الكروم Cr 24 |
| المنغنيز Mn 25 |
| الحديد Fe 26 |
| شركة الكوبالت 27 |
| نيكل ني 28 |
| النحاس النحاس 29 |
| الزنك الزنك 30 |
| الإيتريوم Y 39 |
| الزركونيوم Zr 40 |
| النيوبيوم ملحوظة 41 |
| الموليبدينوم مو 42 |
| التكنيتيوم Tc 43 |
| روثينيوم رو 44 |
| Rh 45 روديوم |
| البلاديوم Pd 46 |
| الفضة Ag 47 |
| الكادميوم Cd 48 |
| لوتيتيوم لو 71 |
| الهافنيوم Hf 72 |
| تانتالوم تا 73 |
| تنجستن دبليو 74 |
| رينيوم رد 75 |
| Osmium Os 76 |
| إيريديوم إر 77 |
| البلاتين نقطة 78 |
| الذهب Au 79 |
| الزئبق Hg 80 |
| 103 |
| رذرفورديوم RF 104 |
| دوبنيوم ديسيبل 105 |
| سيبورجيوم Sg 106 |
| بوري Bh 107 |
| 108 |
| Meitnerium جبل 109 |
| 110- دارمشتاتيوس |
| الأشعة السينية Rg 111 |
| كوبرنيسيوس سي إن 112 |
الفلزات
الفلزاتتحتل المجموعات 13-16 من الجدول الدوري. الفلزات مثل البورون والجرمانيوم والسيليكون هي أشباه موصلات وتستخدم في صنعها شرائح الكمبيوتروالمجالس.
إظهار / إخفاء النص
معادن ما بعد الانتقال
تسمى العناصر معادن ما بعد الانتقال، تنتمي إلى المجموعات 13-15 من الجدول الدوري. على عكس المعادن ، ليس لها لمعان ، ولكن لها لمسة نهائية غير لامعة. بالمقارنة مع المعادن الانتقالية ، فإن معادن ما بعد التحول أكثر ليونة ، ولديها المزيد درجة حرارة منخفضةالذوبان والغليان ، كهرسلبية أعلى. توجد إلكترونات التكافؤ ، التي تربط بها عناصر أخرى ، فقط على غلاف الإلكترون الخارجي. تحتوي عناصر مجموعة معادن ما بعد الانتقال على أكثر من ذلك بكثير درجة حرارة عاليةالغليان من أشباه الفلزات.
والآن عزز معرفتك من خلال مشاهدة فيديو حول الجدول الدوري والمزيد.
رائع ، لقد تم اتخاذ الخطوة الأولى على طريق المعرفة. أنت الآن تسترشد بشكل أو بآخر بالجدول الدوري وسيكون هذا مفيدًا جدًا لك ، لأن الجدول الدوري هو الأساس الذي يقوم عليه هذا العلم المذهل.