Wiadomość na temat związków halogenowych. Halogeny i ich związki. Biologiczne znaczenie halogenów i ich związków
Przeczytaj także
Halogeny (z greckiego. aureole - sól i geny - generator) - elementy głównej podgrupy VII grupy układ okresowy: fluor, chlor, brom, jod, astat.
W stanie wolnym halogeny tworzą substancje składające się z cząsteczek dwuatomowych F 2, Cl 2, Br 2, I 2.
BYĆ W NATURZE
Halogeny występują w przyrodzie wyłącznie w postaci związków.
Fluor występuje wyłącznie w postaci soli rozproszonych w różnych postaciach skały. Całkowita zawartość fluoru w skorupie ziemskiej wynosi 0,02% atomów. Praktyczne znaczenie mają minerały fluorowe: CaF 2 - fluoryt, Na 2 AlF 6 - kriolit, Ca 5 F(PO 4) 3 - fluoroapatyt.
Najważniejsze naturalny związek chlor
jest chlorek sodu (halit), który służy jako główny surowiec do produkcji innych związków chloru. Główna masa chlorku sodu znajduje się w wodach mórz i oceanów. Wody wielu jezior zawierają również znaczne ilości NaCl – np. jeziora Elton i Baskunchak. Istnieją inne związki chloru, np. KCl – sylwinit, MgCl2*KCl*6HO – karnalit, KCl*NaCl – sylwinit.
Brom występuje w przyrodzie w postaci soli sodowych i potasowych oraz soli chlorowych, a także w wodzie słonych jezior i mórz. Bromki metali znajdują się w woda morska. W podziemnych wodach wiertniczych o znaczeniu przemysłowym zawartość bromu waha się od 170 do 700 mg/l. Całkowita zawartość bromu w skorupa Ziemska 3*10-5% atomów.
Znajomości jod
występują w wodzie morskiej, ale w tak małych ilościach, że ich bezpośrednie odizolowanie od wody jest bardzo trudne. Istnieją jednak glony, które gromadzą jod w swoich tkankach, takie jak wodorosty. Popiół tych alg służy jako surowiec do produkcji jodu. Znaczna ilość jodu (od 10 do 50 mg/l.) zawarta jest w podziemnych wodach wiertniczych. Zawartość jodu w skorupie ziemskiej wynosi 4*10-6% atomów. Niewielkie złoża soli jodu – KIO 3 i KIO 4 – występują w Chile i Boliwii.
waga całkowita astat NA glob szacuje się, że nie przekracza 30 g.
Tabela. Budowa elektronowa i niektóre właściwości atomów i cząsteczek halogenów
|
Symbol element |
|||||
|
Porządkowy Numer |
|||||
|
Struktura zewnętrzny elektroniczny warstwa |
2s 2 2p 5 |
3s 2 3p 5 |
4s 2 4p 5 |
5 s 2 5 s 5 |
6 s 2 6 s 5 |
|
Względne elektro negatywność (EO) |
4,0 |
3,0 |
2,8 |
2,5 |
~2,2 |
|
Promień atomowy, nm |
0,064 |
0,099 |
0,114 |
0,133 |
– |
|
Stopni utlenianie |
1, +1, +3, |
– |
|||
|
Stan skupienia |
Bladozielony |
Zielony żółty. |
Buraja |
Ciemny fiolet |
Czarny |
|
t °pl.(°С) |
219 |
101 |
114 |
227 |
|
|
t °wrzenia (°C) |
183 |
185 |
317 |
||
|
ρ (g/cm3) |
1,51 |
1,57 |
3,14 |
4,93 |
– |
|
Rozpuszczalność w wodzie (g/100g wody) |
reaguje |
2,5: 1 |
3,5 |
0,02 |
– |
|
Nazwa |
Schemat budowy atomu |
Formuła elektroniczna |
|
Fluor |
F +9) 2) 7 |
… 2s 2 2p 5 |
|
Chlor |
Cl +17) 2) 8) 7 |
… 3s 2 3p 5 |
|
Brom |
Br +35) 2) 8) 18) 7 |
…4s 2 4p 5 |
|
Jod |
I +53) 2) 8) 18) 18) 7 |
…5s 2 5p 5 |
1) Ogólna konfiguracja elektroniczna zewnętrznego poziomu energii jest następująca nS 2 nP 5 .
2) Wraz ze wzrostem liczby atomowej pierwiastków zwiększają się promienie atomów, zmniejsza się elektroujemność i właściwości metaliczne(wzrost właściwości metalicznych); halogeny są silnymi utleniaczami, zdolność utleniająca pierwiastków maleje wraz ze wzrostem masa atomowa.
3) Wraz ze wzrostem masy atomowej kolor staje się ciemniejszy, wzrasta temperatura topnienia i wrzenia oraz gęstość.
UZYSKANIE HALOGENÓW
1. Elektroliza roztworów i stopów halogenków:
2NaCl + 2H 2 O = Cl 2 + H 2 + 2 NaOH
2 KF = 2 K + F 2 (jedyny sposób, aby uzyskać F 2)
2. Utlenianie halogenowodorów:
2 KMnO 4 +16 HCl =2 KCl +2 MnCl 2 +5 Cl 2 +8 H 2 O – Laboratoryjna metoda wytwarzania chloru
14HBr+K2Cr2O7 =2KBr+2CrBr3+3Br2+7H2O
MnO 2 + 4 HHal = MnHal 2 + Hal 2 + 2 H 2 O – Laboratorium - (Do produkcji chloru, bromu, jodu)
3. Metoda przemysłowa - utlenianie chlorem (dla bromu i jodu):
2KBr+Cl2 = 2KCl+Br2
2KI + Cl2 = 2KCl + I2
Właściwości chemiczne
Przyjrzyjmy się właściwościom halogenów na przykładzie chloru:
|
1. Oddziaływanie z metalami |
Eksperyment 2K + Cl 2 →2KCl Mg + Cl 2 → MgCl 2 |
|
2.Reakcje z niemetalami |
H2 + Cl2 → 2HCl |
|
3. Interakcja z alkaliami na zimno |
2NaOH + Cl 2 → NaCl + NaClO + H 2 O |
|
4. Interakcja z alkaliami po podgrzaniu |
6NaOH + 3Cl 2 → 5NaCl + NaClO 3 + 3H 2 O |
|
5. Wypieranie mniej aktywnych halogenów z halogenków |
2KBr + Cl2 → 2KCl + Br2 |
|
6. Z wodą |
H 2 O + Cl 2 ↔ HCl + HClO (woda chlorowana) |
ZASTOSOWANIE HALOGENÓW
|
Fluor |
jest szeroko stosowany jako środek fluorujący do produkcji różnych fluorków (SF 6, BF 3, WF 6 i innych), w tym związków gazów szlachetnych ksenonu (Xe) i kryptonu (Kr). Sześciofluorek uranu UF 6 służy do oddzielania izotopów uranu (U). Fluor wykorzystywany jest do produkcji teflonu, innych fluoroplastików, kauczuku fluorowego, tworzyw zawierających fluor materia organiczna i materiałów powszechnie stosowanych w technologii, zwłaszcza tam, gdzie wymagana jest odporność na działanie środowiska agresywnego, wysoka temperatura i tak dalej. |
|
Chlor |
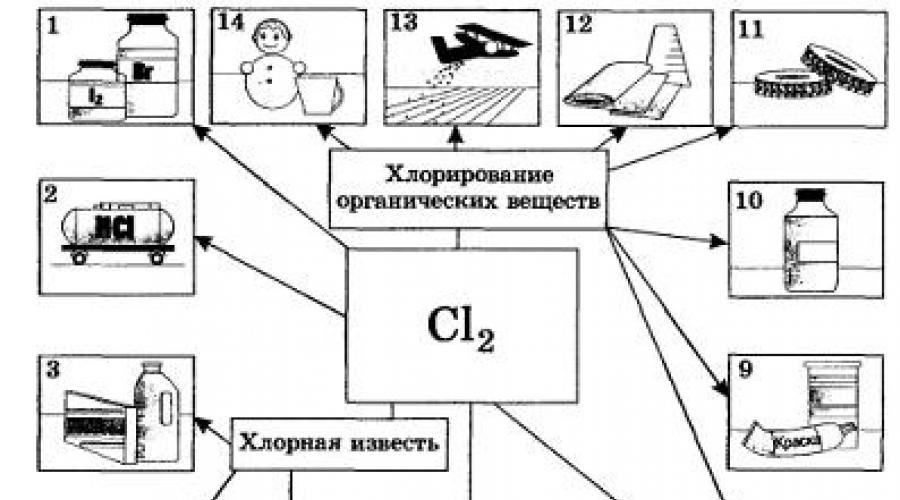
stosowany do produkcji związków organicznych zawierających chlor (60-75%), substancje nieorganiczne(10-20%), do wybielania celulozy i tkanin (5-15%), na potrzeby sanitarne i do dezynfekcji (chlorowania) wody. |
|
Brom |
brom stosuje się do wytwarzania szeregu substancji nieorganicznych i organicznych w chemii analitycznej. Związki bromu są stosowane jako dodatki do paliw, pestycydy, środki zmniejszające palność i w fotografii. Powszechnie wiadomo, że zawiera brom leki. Należy zaznaczyć, że potoczne sformułowanie: „lekarz przepisał brom łyżkę po posiłku” oznacza oczywiście tylko tyle, że przepisano wodny roztwór bromku sodu (lub potasu), a nie czysty brom. Uspokajające działanie leków bromkowych opiera się na ich zdolności do wzmacniania procesów hamowania w ośrodkowym układzie nerwowym. |
|
Jod |
Jod służy do produkcji tytanu (Ti), cyrkonu (Zr), hafnu (Hf), niobu (Nb) i innych metali (tzw. rafinacja jodkowa metali). Podczas rafinacji jodku pierwotny metal wraz z zanieczyszczeniami przekształca się w postać lotnych jodków, a następnie powstałe jodki rozkładają się na gorącej cienkiej nitce. Gwint wykonany jest ze wstępnie oczyszczonego metalu, który poddawany jest uszlachetnieniu. Jego temperaturę dobiera się tak, aby na żarniku mógł rozłożyć się jedynie jodek oczyszczanego metalu, natomiast pozostałe jodki pozostają w fazie gazowej. |
DEFINICJA
Halogeny– pierwiastki z grupy VII A – fluor (F), chlor (Cl), brom (Br) i jod (I).
Elektroniczna konfiguracja zewnętrznego poziomu energii halogenów ns 2 np 5. Ponieważ halogenom brakuje tylko jednego elektronu przed osiągnięciem poziomu energetycznego, w ORR najczęściej wykazują właściwości utleniaczy. Stany utlenienia halogenów: od „-1” do „+7”. Jedyny pierwiastek z grupy halogenowej, fluor, wykazuje tylko jeden stopień utlenienia „-1” i jest pierwiastkiem najbardziej elektroujemnym. Cząsteczki halogenu są dwuatomowe: F 2, Cl 2, Br 2, I 2.
Właściwości chemiczne halogenów
Wraz ze wzrostem ładunku jądra atomu pierwiastka chemicznego, tj. przy przejściu od fluoru do jodu zmniejsza się zdolność utleniająca halogenów, co potwierdza zdolność do wypierania niższych halogenów przez wyższe z kwasów halogenowodorowych i ich soli:
Br2+2HI = I2+2HBr;
Cl2 + 2KBr = Br2 + 2KCl.
Fluor ma największą aktywność chemiczną. Większość pierwiastków chemicznych nawet z temperatura pokojowa oddziałuje z fluorem, uwalniając duża liczba ciepło. Nawet woda spala się fluorem:
2H 2O + 2F 2 = 4HF + O 2.
Wolny chlor jest mniej reaktywny niż fluor. Nie reaguje bezpośrednio z tlenem, azotem i gazami szlachetnymi. Oddziałuje ze wszystkimi innymi substancjami, takimi jak fluor:
2Fe + Cl2 = 2FeCl3;
2P + 5Cl2 = 2PCl5.
Kiedy chlor wchodzi w interakcję z zimną wodą, zachodzi odwracalna reakcja:
Cl2 + H2O↔HCl +HClO.
Mieszaninę produktów reakcji nazywa się wodą chlorowaną.
Kiedy chlor oddziałuje z zasadami na zimno, powstają mieszaniny chlorków i podchlorynów:
Cl2 + Ca(OH)2 = Ca(Cl)OCl + H2O.
Po rozpuszczeniu chloru w gorącym roztworze alkalicznym zachodzi następująca reakcja:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O.
Brom, podobnie jak chlor, rozpuszcza się w wodzie i częściowo reagując z nią tworzy tzw. „wodę bromową”, natomiast jod jest w wodzie praktycznie nierozpuszczalny.
Jod znacznie różni się aktywnością chemiczną od innych halogenów. Nie reaguje z większością niemetali i reaguje powoli z metalami dopiero po podgrzaniu. Oddziaływanie jodu z wodorem zachodzi tylko przy silnym ogrzewaniu, reakcja jest endotermiczna i wysoce odwracalna:
H 2 + I 2 = 2HI - 53 kJ.
Właściwości fizyczne halogenów
Pod nr. fluor jest jasnożółtym gazem o ostrym zapachu. Trujący. Chlor jest jasnozielonym gazem, podobnie jak fluor ma ostry zapach. Silnie trujący. Na wysokie ciśnienie krwi a temperatura pokojowa łatwo się zmienia stan ciekły. Brom jest ciężką cieczą o czerwonobrązowej barwie i charakterystycznym nieprzyjemnym, ostrym zapachu. Ciekły brom i jego opary są silnie toksyczne. Brom jest słabo rozpuszczalny w wodzie i dobrze w rozpuszczalnikach niepolarnych. Jod jest ciemnoszarą substancją stałą o metalicznym połysku. Opary jodu są fioletowe. Jod łatwo sublimuje, tj. przechodzi ze stanu stałego w stan gazowy z pominięciem stanu ciekłego.
Produkcja halogenów
Halogeny można otrzymać przez elektrolizę roztworów lub stopów halogenków:
MgCl2 = Mg + Cl2 (stop).
Najczęściej halogeny otrzymuje się w reakcji utleniania kwasów halogenowodorowych:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O;
K 2 Cr 2 O 7 + 14HCl \u003d 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O;
2KMnO4 +16HCl = 2MnCl2+5Cl2+8H2O +2KCl.
Zastosowanie halogenów
Halogeny są wykorzystywane jako surowce do produkcji różnych produktów. Zatem fluor i chlor stosuje się do syntezy różnych materiały polimerowe, chlor jest również surowcem do produkcji kwasu solnego. Znaleziono brom i jod szerokie zastosowanie w medycynie brom wykorzystuje się także w przemyśle farb i lakierów.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenia | Oblicz objętość chloru (liczba), która przereagowała z jodkiem potasu, jeśli powstał jod o masie 508 g | ||||
| Rozwiązanie | Zapiszmy równanie reakcji chloru z jodkiem potasu: Cl2 + 2KI = I2 + 2KCl Masa molowa jodu, obliczona na podstawie tabeli pierwiastków chemicznych D.I. Mendelejewa, równa – 254 g/mol. Znajdźmy ilość utworzonego jodu: v(I 2) = m(I 2)/M(I 2) Halogeny znajdują się po lewej stronie gazów szlachetnych w układzie okresowym. Te pięć toksycznych pierwiastków niemetalicznych znajduje się w grupie 7 układu okresowego. Należą do nich fluor, chlor, brom, jod i astat. Chociaż astat jest radioaktywny i ma tylko krótkotrwałe izotopy, zachowuje się jak jod i często jest klasyfikowany jako halogen. Ponieważ pierwiastki halogenowe mają siedem elektronów walencyjnych, do utworzenia pełnego oktetu potrzebny jest tylko jeden dodatkowy elektron. Ta cecha czyni je bardziej reaktywnymi niż inne grupy niemetali. ogólna charakterystykaHalogeny tworzą cząsteczki dwuatomowe (typ X2, gdzie X oznacza atom halogenu) - stabilną formę istnienia halogenów w postaci wolnych pierwiastków. Wiązania tych cząsteczek dwuatomowych są niepolarne, kowalencyjne i pojedyncze. Właściwości chemiczne halogenów pozwalają im łatwo łączyć się z większością pierwiastków, dlatego nigdy nie występują w przyrodzie w postaci niezwiązanej. Fluor jest najbardziej aktywnym halogenem, a astat najmniej. Wszystkie halogeny tworzą sole grupy I o podobnych właściwościach. W tych związkach halogeny występują jako aniony halogenkowe z ładunkiem -1 (na przykład Cl-, Br-). Końcówka -id wskazuje na obecność anionów halogenkowych; na przykład Cl- nazywany jest „chlorkiem”. Oprócz, Właściwości chemiczne halogeny pozwalają im działać jako środki utleniające - utleniające metale. Większość reakcje chemiczne, w którym biorą udział halogeny - redoks w roztworze wodnym. Halogeny tworzą wiązania pojedyncze z węglem lub azotem w związkach organicznych, gdzie ich stopień utlenienia (CO) wynosi -1. Kiedy atom halogenu zostaje zastąpiony kowalencyjnie związanym atomem wodoru w związek organiczny, przedrostek halo- może być używany w sensie ogólnym, a przedrostki fluoro-, chloro-, bromo-, jod- w przypadku określonych halogenów. Elementy halogenowe mogą sieciować, tworząc cząsteczki dwuatomowe z polarnymi kowalencyjnymi wiązaniami pojedynczymi. Chlor (Cl2) był pierwszym halogenem odkrytym w 1774 r., następnie jod (I2), brom (Br2), fluor (F2) i astat (At, odkryty ostatnio w 1940 r.). Nazwa „halogen” pochodzi od greckich słów hal- („sól”) i -gen („tworzyć”). Razem te słowa oznaczają „tworzący sól”, podkreślając fakt, że halogeny reagują z metalami, tworząc sole. Halit to nazwa soli kamiennej, naturalnie występującego minerału składającego się z chlorku sodu (NaCl). I wreszcie halogeny są stosowane w życiu codziennym - fluor znajduje się w pastach do zębów, chlor dezynfekuje woda pitna, a jod wspomaga produkcję hormonów tarczycy. Pierwiastki chemiczneFluor jest pierwiastkiem o liczbie atomowej 9 i jest oznaczony symbolem F. Fluor pierwiastkowy został po raz pierwszy odkryty w 1886 roku poprzez wyizolowanie go z kwasu fluorowodorowego. W stanie wolnym fluor występuje w postaci cząsteczki dwuatomowej (F2) i jest najobficiej występującym halogenem w skorupie ziemskiej. Fluor jest najbardziej elektroujemnym pierwiastkiem w układzie okresowym. W temperaturze pokojowej jest to bladożółty gaz. Fluor ma również stosunkowo mały promień atomowy. Jego CO wynosi -1, z wyjątkiem elementarnego stanu dwuatomowego, w którym jego stopień utlenienia wynosi zero. Fluor jest niezwykle reaktywny i reaguje bezpośrednio ze wszystkimi pierwiastkami z wyjątkiem helu (He), neonu (Ne) i argonu (Ar). W roztworze H2O kwas fluorowodorowy (HF) jest słabym kwasem. Chociaż fluor jest wysoce elektroujemny, jego elektroujemność nie determinuje kwasowości; HF jest słabym kwasem ze względu na to, że jon fluorkowy jest zasadowy (pH > 7). Ponadto fluor wytwarza bardzo silne środki utleniające. Na przykład fluor może reagować z gaz obojętny ksenon i tworzy silny utleniacz difluorek ksenonu (XeF2). Fluor ma wiele zastosowań. Chlor jest pierwiastkiem o liczbie atomowej 17 i symbolu chemicznym Cl. Odkryty w 1774 roku poprzez wyizolowanie go z kwasu solnego. W stanie elementarnym tworzy dwuatomową cząsteczkę Cl2. Chlor ma kilka CO: -1, +1, 3, 5 i 7. W temperaturze pokojowej jest jasnozielonym gazem. Ponieważ wiązanie powstające pomiędzy dwoma atomami chloru jest słabe, cząsteczka Cl2 ma bardzo dużą zdolność tworzenia związków. Chlor reaguje z metalami tworząc sole zwane chlorkami. Jony chloru są najczęstszymi jonami występującymi w wodzie morskiej. Chlor ma również dwa izotopy: 35Cl i 37Cl. Chlorek sodu jest najpowszechniejszym związkiem spośród wszystkich chlorków. Brom – pierwiastek chemiczny o liczbie atomowej 35 i symbolu Br. Po raz pierwszy odkryto go w 1826 r. W swojej postaci pierwiastkowej brom jest dwuatomową cząsteczką Br2. W temperaturze pokojowej jest czerwono-brązową cieczą. Jego CO to -1, + 1, 3, 4 i 5. Brom jest bardziej aktywny niż jod, ale mniej aktywny niż chlor. Ponadto brom ma dwa izotopy: 79Br i 81Br. Brom występuje w postaci soli bromkowych rozpuszczonych w wodzie morskiej. Za ostatnie lataŚwiatowa produkcja bromku znacznie wzrosła ze względu na jego dostępność i długi okres przydatności do spożycia. Podobnie jak inne halogeny, brom jest środkiem utleniającym i jest bardzo toksyczny. Jod jest pierwiastkiem chemicznym o liczbie atomowej 53 i symbolu I. Jod ma stopnie utlenienia: -1, +1, +5 i +7. Występuje jako cząsteczka dwuatomowa I2. W temperaturze pokojowej tak solidny fioletowy. Jod ma jeden stabilny izotop – 127I. Po raz pierwszy odkryty w 1811 roku przy użyciu wodorostów i kwasu siarkowego. Obecnie jony jodu można izolować z wody morskiej. Chociaż jod nie jest dobrze rozpuszczalny w wodzie, jego rozpuszczalność można zwiększyć poprzez zastosowanie pojedynczych jodków. Jod pełni ważną rolę w organizmie, uczestnicząc w produkcji hormonów tarczycy. Astat jest pierwiastkiem radioaktywnym o liczbie atomowej 85 i symbolu At. Jego możliwe stopnie utlenienia to -1, +1, 3, 5 i 7. Jedyny halogen, który nie jest cząsteczką dwuatomową. W normalnych warunkach jest to czarne, metaliczne ciało stałe. Astat jest pierwiastkiem bardzo rzadkim, dlatego niewiele o nim wiadomo. Ponadto astat ma bardzo krótki okres okres półtrwania nie dłuższy niż kilka godzin. Otrzymany w 1940 roku w wyniku syntezy. Uważa się, że astat jest podobny do jodu. Różni się właściwościami metalicznymi. Poniższa tabela przedstawia strukturę atomów halogenu i strukturę zewnętrznej warstwy elektronów. Taka struktura zewnętrznej warstwy elektronów powoduje, że właściwości fizyczne i chemiczne halogenów są podobne. Jednak porównując te elementy, zauważa się także różnice. Właściwości okresowe w grupie halogenowejWłaściwości fizyczne proste substancje halogeny zmieniają się wraz ze wzrostem liczby atomowej pierwiastka. Dla lepszego zrozumienia i większej przejrzystości oferujemy Państwu kilka tabel. Temperatury topnienia i wrzenia grupy rosną wraz ze wzrostem rozmiaru cząsteczki (F Tabela 1. Halogeny. Właściwości fizyczne: temperatura topnienia i wrzenia Zwiększa się rozmiar jądra (F< Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома. Tabela 2. Halogeny. Właściwości fizyczne: promienie atomowe Jeśli zewnętrzne elektrony walencyjne nie znajdują się w pobliżu jądra, wówczas usunięcie ich z niego nie zajmie dużo energii. Zatem energia potrzebna do wybicia zewnętrznego elektronu nie jest tak wysoka w dolnej części grupy pierwiastków, ponieważ tam jest więcej poziomów energii. Dodatkowo wysoka energia jonizacji powoduje, że pierwiastek wykazuje właściwości niemetaliczne. Jod i astat wykazują właściwości metaliczne, ponieważ energia jonizacji jest zmniejszona (At< I < Br < Cl < F). Tabela 3. Halogeny. Właściwości fizyczne: energia jonizacji Liczba elektronów walencyjnych w atomie wzrasta wraz ze wzrostem poziomu energii na stopniowo niższych poziomach. Elektrony stopniowo oddalają się od jądra; Zatem jądro i elektrony nie są przyciągane. Obserwuje się wzrost ekranowania. Dlatego elektroujemność maleje wraz ze wzrostem okresu (At< I < Br < Cl < F). Tabela 4. Halogeny. Właściwości fizyczne: elektroujemność Wraz ze wzrostem rozmiaru atomu wraz ze wzrostem okresu powinowactwo elektronowe ma tendencję do zmniejszania się (B< I < Br < F < Cl). Исключение – фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором. Tabela 5. Powinowactwo elektronowe halogenów Reaktywność halogenów maleje wraz ze wzrostem okresu (At Halogenek powstaje, gdy halogen reaguje z innym, mniej elektroujemnym pierwiastkiem, tworząc związek binarny. Wodór reaguje z halogenami, tworząc halogenki w postaci HX: Halogenowodory łatwo rozpuszczają się w wodzie, tworząc kwas fluorowodorowy (fluorowy, solny, bromowodorowy, jodowodorowy). Poniżej podano właściwości tych kwasów. Kwasy powstają w wyniku reakcji: HX (aq) + H2O (l) → X- (aq) + H3O+ (aq). Wszystkie halogenowodory tworzą mocne kwasy, z wyjątkiem HF. Zwiększa się kwasowość kwasów halogenowodorowych: HF Kwas fluorowodorowy może trawić szkło i niektóre nieorganiczne fluorki przez długi czas. Może wydawać się sprzeczne z intuicją, że HF jest najsłabszym kwasem halogenowodorowym, ponieważ fluor ma najwyższą elektroujemność. Jednakże wiązanie HF jest bardzo silne, co daje bardzo słaby kwas. O silnym wiązaniu decyduje krótka długość wiązania i wysoka energia dysocjacji. Ze wszystkich halogenowodorów HF ma najkrótszą długość wiązania i najwyższą energię dysocjacji wiązania. Halogenoksokwasy to kwasy zawierające atomy wodoru, tlenu i halogenu. Ich kwasowość można określić na podstawie analizy strukturalnej. Poniżej podano halogenowe kwasy okso: W każdym z tych kwasów proton jest związany z atomem tlenu, więc porównywanie długości wiązań protonowych nie jest tutaj przydatne. Dominującą rolę odgrywa tutaj elektroujemność. Aktywność kwasu wzrasta wraz z liczbą atomów tlenu związanych z atomem centralnym. Podstawowe właściwości fizyczne halogenów można podsumować w poniższej tabeli. Barwa halogenów wynika z absorpcji światła widzialnego przez cząsteczki, co powoduje wzbudzenie elektronów. Fluor pochłania światło fioletowe i dlatego wydaje się jasnożółty. Jod natomiast pochłania żółte światło i wydaje się fioletowy (żółty i fioletowy to kolory uzupełniające). Kolor halogenów staje się ciemniejszy wraz ze wzrostem okresu. W zamkniętych pojemnikach ciekły brom i stały jod znajdują się w równowadze z ich oparami, co można zaobserwować w postaci kolorowego gazu. Chociaż kolor astatu nie jest znany, zgodnie z zaobserwowanym wzorem przyjmuje się, że jest on ciemniejszy niż jod (tj. czarny). Teraz, jeśli zostaniesz zapytany: „Scharakteryzuj właściwości fizyczne halogenów”, będziesz miał coś do powiedzenia. Zamiast pojęcia wartościowości halogenu często stosuje się liczbę utlenienia. Zazwyczaj stopień utlenienia wynosi -1. Ale jeśli halogen jest związany z tlenem lub innym halogenem, może przyjmować inne stany: tlen CO -2 ma pierwszeństwo. W przypadku dwóch różnych atomów halogenu związanych razem, atom bardziej elektroujemny przeważa i przyjmuje CO -1. Na przykład w chlorku jodu (ICl) chlor ma CO -1, a jod +1. Chlor jest bardziej elektroujemny niż jod, więc jego CO wynosi -1. W kwasie bromowym (HBrO4) tlen ma CO -8 (-2 x 4 atomy = -8). Wodór ma ogólny stopień utlenienia +1. Dodanie tych wartości daje CO wynoszący -7. Ponieważ końcowy CO związku musi wynosić zero, CO bromu wynosi +7. Trzecim wyjątkiem od reguły jest stopień utlenienia halogenu w postaci pierwiastkowej (X2), gdzie jego CO wynosi zero. Elektroujemność wzrasta wraz ze wzrostem okresu. Fluor ma zatem najwyższą elektroujemność ze wszystkich pierwiastków, o czym świadczy jego położenie w układzie okresowym. Jego konfiguracja elektronowa to 1s2 2s2 2p5. Jeśli fluor zdobędzie kolejny elektron, najbardziej zewnętrzne orbitale p zostaną całkowicie wypełnione i utworzą pełny oktet. Ponieważ fluor ma wysoką elektroujemność, może z łatwością pobrać elektron z sąsiedniego atomu. Fluor w tym przypadku jest izoelektroniczny w stosunku do gazu obojętnego (z ośmioma elektronami walencyjnymi), wszystkie jego zewnętrzne orbitale są wypełnione. W tym stanie fluor jest znacznie bardziej stabilny. W naturze halogeny występują w stanie anionowym, zatem wolne halogeny otrzymuje się poprzez utlenianie poprzez elektrolizę lub przy użyciu środków utleniających. Na przykład chlor wytwarza się w wyniku hydrolizy roztworu soli kuchennej. Zastosowanie halogenów i ich związków jest różnorodne. DEFINICJA Halogeny– Pierwiastki z grupy VIIA – fluor (F), chlor (Cl), brom (Br) i jod (I). Elektroniczna konfiguracja zewnętrznego poziomu energii halogenów ns 2 np 5. Ponieważ halogenom brakuje tylko jednego elektronu przed osiągnięciem poziomu energetycznego, w ORR najczęściej wykazują właściwości utleniaczy. Stany utlenienia halogenów: od „-1” do „+7”. Jedyny pierwiastek z grupy halogenowej, fluor, wykazuje tylko jeden stopień utlenienia „-1” i jest pierwiastkiem najbardziej elektroujemnym. Cząsteczki halogenu są dwuatomowe: F 2, Cl 2, Br 2, I 2. Wraz ze wzrostem ładunku jądra atomu pierwiastka chemicznego, tj. przy przejściu od fluoru do jodu zmniejsza się zdolność utleniająca halogenów, co potwierdza zdolność do wypierania niższych halogenów przez wyższe z kwasów halogenowodorowych i ich soli: Br2 + 2HI = I2 + 2HBr Cl2 + 2KBr = Br2 + 2KCl Pod nr. fluor jest jasnożółtym gazem o ostrym zapachu. Trujący. Chlor jest jasnozielonym gazem, podobnie jak fluor ma ostry zapach. Silnie trujący. Pod podwyższonym ciśnieniem i w temperaturze pokojowej łatwo przechodzi w stan ciekły. Brom jest ciężką cieczą o czerwonobrązowej barwie i charakterystycznym nieprzyjemnym, ostrym zapachu. Ciekły brom i jego opary są silnie toksyczne. Brom jest słabo rozpuszczalny w wodzie i dobrze w rozpuszczalnikach niepolarnych. Jod jest ciemnoszarą substancją stałą o metalicznym połysku. Opary jodu są fioletowe. Jod łatwo sublimuje, tj. przechodzi ze stanu stałego w stan gazowy z pominięciem stanu ciekłego. Halogeny można otrzymać przez elektrolizę roztworów lub stopów halogenków: MgCl2 = Mg + Cl2 (stop) Najczęściej halogeny otrzymuje się w reakcji utleniania kwasów halogenowodorowych: MnO2 + 4HCl = MnCl2 + Cl2 +2H2O K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O 2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2O +2KCl Fluor ma największą aktywność chemiczną. Większość pierwiastków chemicznych, nawet w temperaturze pokojowej, wchodzi w interakcję z fluorem, wydzielając dużą ilość ciepła. Nawet woda spala się fluorem: 2H 2O + 2F 2 = 4HF + O 2 Wolny chlor jest mniej reaktywny niż fluor. Nie reaguje bezpośrednio z tlenem, azotem i gazami szlachetnymi. Oddziałuje ze wszystkimi innymi substancjami, takimi jak fluor: 2Fe + Cl 2 = 2FeCl 3 2P + 5Cl2 = 2PCl5 Kiedy chlor wchodzi w interakcję z zimną wodą, zachodzi odwracalna reakcja: Cl2 + H2O↔HCl +HClO Mieszaninę produktów reakcji nazywa się wodą chlorowaną. Kiedy chlor oddziałuje z zasadami na zimno, powstają mieszaniny chlorków i podchlorynów: Cl2 + Ca(OH)2 = Ca(Cl)OCl + H2O Po rozpuszczeniu chloru w gorącym roztworze alkalicznym zachodzi następująca reakcja: 3Cl2 + 6KOH=5KCl +KClO3 +3H2O Brom, podobnie jak chlor, rozpuszcza się w wodzie i częściowo reagując z nią tworzy tzw. „wodę bromową”, natomiast jod jest w wodzie praktycznie nierozpuszczalny. Jod znacznie różni się aktywnością chemiczną od innych halogenów. Nie reaguje z większością niemetali i reaguje powoli z metalami dopiero po podgrzaniu. Oddziaływanie jodu z wodorem zachodzi tylko przy silnym ogrzewaniu, reakcja jest endotermiczna i wysoce odwracalna: H 2 + I 2 = 2HI - 53 kJ. PRZYKŁAD 1 Cl2 + 2KI = I2 + 2KCl Znajdźmy ilość utworzonego jodu: v(I 2)=m(I 2)/M(I 2) v(I2)=508/254=2 mol Zgodnie z równaniem reakcji ilość substancji chlorowej. >> Chemia: Produkcja halogenów. Znaczenie biologiczne i zastosowanie halogenów i ich związków Produkcja halogenów
. Fluor i chlor otrzymuje się przez elektrolizę stopów lub roztworów ich soli. Na przykład proces elektryczny | Trolizę stopionego chlorku sodu można wyrazić równaniem: Ale jeśli wodór można otrzymać innymi, wygodniejszymi i tańszymi sposobami, na przykład z gazu ziemnego, to wodorotlenek sodu otrzymuje się prawie wyłącznie w drodze elektrolizy roztworu soli kuchennej, takiej jak chlor. Brom i jod są produkowane na skalę przemysłową w wyniku reakcji ich wyparcia odpowiednio z bromków i jodków. Biologiczne znaczenie halogenów.
Ich zastosowanie. Nie można było nie zauważyć, że etykiety wielu marek past do zębów wskazują na zawartość w nich fluoru – oczywiście nie wolnego fluoru, ale jego związków. Dzięki temu ważnemu składnikowi, który bierze udział w budowie szkliwa zębów i kości, zapobiega się chorobom takim jak próchnica. Ponadto fluor jest pierwiastkiem niezbędnym w procesach metabolicznych zachodzących w gruczołach, mięśniach i komórkach nerwowych. Fluor ma także znaczenie w produkcji przemysłowej, gdzie jego głównymi odbiorcami są przemysł nuklearny i elektrotechnika. Jego związek Na3AlF6 (jak się nazywa?) służy do produkcji aluminium. W życiu codziennym coraz częściej stosuje się naczynia teflonowe, których nazwa pochodzi od plastiku zawierającego fluor - Teflon. Chlor- jeden z pierwiastków chemicznych, bez którego istnienie organizmów żywych jest nie do pomyślenia. Jego podstawowa forma. dostający się do organizmu chlorek sodu. Pobudza metabolizm, porost włosów, dodaje wigoru i siły. Większość NaCl znajduje się w osoczu krwi. Szczególną rolę w trawieniu odgrywa kwas solny HC1, będący częścią soku żołądkowego. Bez 0,2% HCl proces trawienia pokarmu praktycznie się zatrzymuje. I choć prawie wszystkie produkty spożywcze zawierają pewną ilość soli kuchennej, człowiek zmuszony jest codziennie dodawać do pożywienia około 20 g soli. Pod względem zastosowań przemysłowych chlor znacznie przewyższa wszystkie halogeny. Chlor i jego związki są niezbędne do bielenia tkanin lnianych, bawełnianych, papieru itp. Szczególnie dużo go zużywa się w syntezach organicznych do produkcji tworzyw sztucznych, gumy, barwników i rozpuszczalników (ryc. 20). Do zwalczania szkodników rolniczych stosuje się wiele związków zawierających chlor. Chlor zużywa się w dużych ilościach do dezynfekcji wody pitnej, choć nie bez negatywnych konsekwencji (którą substancję bezpieczniej zastosować do tego celu?). W metalurgii metali nieżelaznych niektóre metale (tytan, niob, tantal) ekstrahuje się z rud poprzez chlorowanie. Chlor znalazł również zastosowanie do celów wojskowych jako chemiczny środek bojowy. Później zastąpiono go innymi, skuteczniejszymi substancjami toksycznymi zawierającymi chlor, takimi jak fosgen COCl2. Chlor zawarty jest w substancji bardzo niebezpiecznej dla życia i zdrowia – dioksynach. Związki chloru są jedną z przyczyn niszczenia warstwy ozonowej Ziemi. Bardzo ważny dla organizmu człowieka jest także inny halogen, brom. Związki tego pierwiastka regulują procesy pobudzenia i hamowania ośrodkowego układu nerwowego, dlatego w leczeniu chorób nerwowych (bezsenność, histeria, neurastenia itp.) Lekarze przepisują „brom” - leki zawierające brom. Brom jest aktywnie akumulowany przez niektóre rośliny, w tym wodorosty. To w morzu koncentruje się większość bromu na naszej planecie, a morze jest głównym dostawcą bromu. Szacuje się, że co roku wraz z wodą morską do powietrza przedostaje się około 4 miliony ton bromu. Oczywiste jest, że jego zawartość w powietrzu obszarów przybrzeżnych jest zawsze wyższa niż na obszarach oddalonych od morza. Jest to jeden z powodów, dla których oddychanie morskim powietrzem jest tak korzystne. Brom, a dokładniej bromek srebra AgBr, odgrywa w fotografii równie ważną rolę. Osoby zajmujące się fotografią zapewne od razu zapamiętają nazwy rodzajów papieru fotograficznego - „Uni-brom”, „Brom-portret” itp. Papier fotograficzny zawiera warstwę bromku srebra nałożoną za pomocą żelatyny, która łatwo rozkłada się pod wpływem wpływ światła: 2AgBr = 2Ag + Br2 I wreszcie ostatni z rozważanych przez nas halogenów - jod - jest pierwiastkiem, bez którego człowiek nie może żyć: jego brak w wodzie i pożywieniu zmniejsza produkcję hormonu tarczycy i prowadzi do wola endemicznego. Regulacyjne działanie hormonu tarczycy obejmuje pobudzenie mięśni, bicie serca, apetyt, trawienie, funkcjonowanie mózgu i ludzki temperament. Jod dostaje się do organizmu wraz z pożywieniem: chlebem, jajkami, mlekiem, wodą, wodorostami oraz z powietrzem (zwłaszcza morskim) podczas oddychania. Do leczenia ran stosuje się alkoholowy roztwór jodu (5-10%), zwany nalewką jodową. Jod jest zawarty w wielu lekach. Głównymi odbiorcami jodu jest przemysł farmaceutyczny i chemiczny oraz produkcja światłoczułych materiałów fotograficznych. 1. Produkcja halogenów metodą elektrolizy stopów i roztworów soli. 2. Biologiczne znaczenie halogenów. 3. Zastosowanie chloru i związków fluoru, chloru i jodu. Jaką objętość chloru (nr) i jaką masę sodu można otrzymać w wyniku elektrolizy 585 g chlorku sodu zawierającego 2% zanieczyszczeń? Oblicz, ile gramów 40% roztworu alkalicznego można otrzymać z sodu, którego masę obliczyłeś w poprzednim zadaniu. Francuski chemik Scheele otrzymał chlor w reakcji tlenku manganu(IV) z kwasem solnym. W wyniku tej reakcji powstaje także chlorek manganu(II) i woda. Napisz równanie tej reakcji, rozważ procesy redoks i oblicz masę tlenku manganu(IV) oraz ilość chlorowodoru potrzebną do wytworzenia 100 litrów chloru (n.o), jeśli jego wydajność wynosi 95% teoretycznie możliwej. Przygotuj przekaz na temat pozytywnego i negatywnego znaczenia halogenów w życiu człowieka. |
