Układ współczynników w przykładach równań chemicznych. Chemia w szkole. Przygotowanie do jednolitego egzaminu państwowego. Jekaterynburg

Istnieje kilka metod wyznaczania współczynników w równaniach reakcji redoks. Stosujemy metodę wagi elektronicznej, w której zestawienie pełnego równania OVR przeprowadza się w następującej kolejności:
1. Sporządź diagram reakcji, wskazując substancje, które przereagowały oraz substancje powstałe w wyniku reakcji, np.:
2. Określ stopień utlenienia atomów i zapisz jego znak oraz wartość nad symbolami pierwiastków, zwracając uwagę na pierwiastki, których stopień utlenienia uległ zmianie:
3. Zapisz równania elektroniczne reakcji utleniania i redukcji, określ liczbę elektronów oddanych przez reduktor i przyjętych przez utleniacz, a następnie wyrównaj je, mnożąc przez odpowiednie współczynniki:
4. Otrzymane współczynniki odpowiadające wadze elektronicznej przenosimy do równania głównego:
5. Wyrównaj liczbę atomów i jonów, które nie zmieniają stopnia utlenienia (w kolejności: metale, niemetale, wodór):
6.Sprawdź poprawność doboru współczynników na podstawie liczby atomów tlenu po lewej i prawej stronie równania reakcji - powinny być one równe (w tym równaniu 24 = 18 + 2 + 4, 24 = 24).
Spójrzmy na bardziej złożony przykład:
Określmy stopnie utlenienia atomów w cząsteczkach:
Utwórzmy równania elektroniczne dla reakcji utleniania i redukcji i zrównajmy liczbę podanych i przyjętych elektronów:
Przenosimy współczynniki do równania głównego:
Wyrównajmy liczbę atomów, które nie zmieniają stopnia utlenienia:
Licząc liczbę atomów tlenu po prawej i lewej stronie równania, upewnimy się, że współczynniki zostały dobrane prawidłowo.
Najważniejsze utleniacze i reduktory
Właściwości redoks pierwiastków zależą od budowy powłoki elektronowej atomów i są określone przez ich położenie w układzie okresowym Mendelejewa.
Metale posiadające 1-3 elektrony na zewnętrznym poziomie energii łatwo je oddają i wykazują jedynie właściwości redukujące. Niemetale (pierwiastki z grup IV-VII) mogą zarówno oddawać, jak i przyjmować elektrony, mogą więc wykazywać zarówno właściwości redukujące, jak i utleniające. W okresach wzrostu liczby atomowej pierwiastka właściwości redukcyjne prostych substancji słabną, a właściwości utleniające rosną. W grupach ze wzrostem liczby porządkowej zwiększają się właściwości redukujące, a właściwości utleniające słabną. Zatem, z substancji prostych najlepszymi reduktorami są metale alkaliczne, glin, wodór, węgiel; najlepszymi utleniaczami są halogeny i tlen.
Właściwości redoks substancji złożonych zależą od stopnia utlenienia tworzących je atomów. Substancje zawierające atomy o najniższym stopniu utlenienia wykazują właściwości redukujące. Najważniejszymi czynnikami redukującymi są tlenek węgla  , siarkowodór
, siarkowodór  , siarczan żelaza (II).
, siarczan żelaza (II).  .Substancje zawierające atomy o najwyższym stopniu utlenienia wykazują właściwości utleniające. Najważniejszymi utleniaczami są nadmanganian potasu
.Substancje zawierające atomy o najwyższym stopniu utlenienia wykazują właściwości utleniające. Najważniejszymi utleniaczami są nadmanganian potasu  , dwuchromian potasu
, dwuchromian potasu  , nadtlenek wodoru
, nadtlenek wodoru  , Kwas azotowy
, Kwas azotowy  , stężony kwas siarkowy
, stężony kwas siarkowy  .
.
Substancje zawierające atomy o pośrednich stopniach utlenienia mogą zachowywać się jak środki utleniające lub redukujące w zależności od właściwości substancji, z którymi wchodzą w interakcję i warunków reakcji. Zatem w reakcji z  kwas siarkowy wykazuje właściwości redukujące:
kwas siarkowy wykazuje właściwości redukujące:
a podczas interakcji z siarkowodorem jest środkiem utleniającym:

Ponadto dla takich substancji możliwe są reakcje samoutleniania-samoredukcji, zachodzące przy jednoczesnym wzroście i spadku stopnia utlenienia atomów tego samego pierwiastka, na przykład:
Siła wielu środków utleniających i redukujących zależy od pH ośrodka. Na przykład, 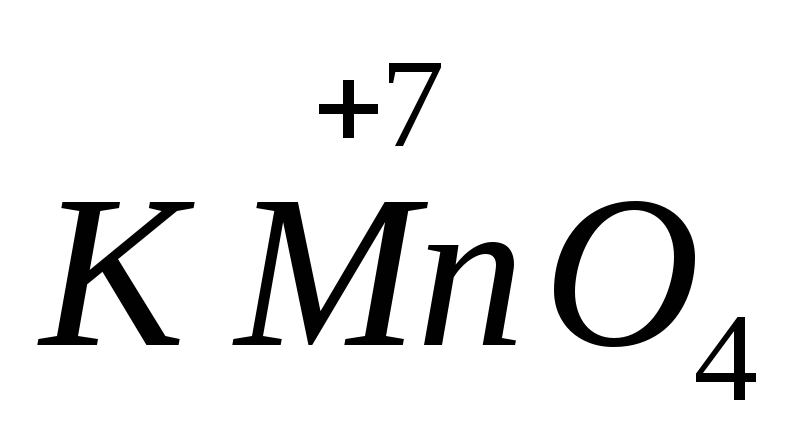 w środowisku zasadowym ulega redukcji do
w środowisku zasadowym ulega redukcji do  , w neutralnym do
, w neutralnym do  , w obecności kwasu siarkowego - do
, w obecności kwasu siarkowego - do  .
.
L  Czy łatwo jest umieścić współczynniki w równaniach chemicznych?
Czy łatwo jest umieścić współczynniki w równaniach chemicznych?
Tak więc moje dzieci dorosły do chemii (I nauczyciel klasowy w klasie 8 „B”). Chemii najczęściej uczy się dzieci na pierwszej lekcji, ale w czwartek nie miałam pierwszej lekcji i poprosiłam, abym poszła na lekcję Walentyny Iwanowny, aby „popatrzyć na dzieci” i sprawdzić pamiętniki. Temat mnie zafascynował, w szkole uwielbiałam chemię i nie sprawdzałam pamiętników. Po raz kolejny przekonałam się, że uczniowie najczęściej doświadczają trudności z powodu tego, że nie widzą powiązania interdyscyplinarne. Na tej lekcji chemii uczniowie mieli za zadanie utworzyć równania chemiczne w oparciu o wartościowość substancji chemicznych. Wielu uczniów miało trudności z określeniem współczynników liczbowych. W sobotę Walentyna Iwanowna i ja mieliśmy kolejną lekcję chemii.
Ćwiczenie 1.
Zapisz poniższe zdania w postaci równań chemicznych:
A) „Podczas wypalania węglanu wapnia powstaje tlenek wapnia i tlenek węgla (IV)”; b) „W reakcji tlenku fosforu (V) z wodą powstaje kwas fosforowy.”
Rozwiązanie:
A) CaCO 3 = CaO + CO 2 - reakcja jest endotermiczna. Z tym zadaniem nie było żadnych trudności, gdyż nie było potrzeby szukania współczynników liczbowych. Początkowo lewa i prawa strona równania zawierają jeden atom wapnia, jeden atom węgla i trzy atomy tlenu.
B) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - reakcja jest egzotermiczna. Wystąpiły problemy z drugim równaniem; bez współczynników liczbowych poprawna równość nie zadziałała: P 2 O 5 + H 2 O → H 3 PO 4 . Oczywiście, aby sporządzić poprawną równość, należy wybrać współczynniki liczbowe. Jeśli wybierzesz, możesz zacząć od fosforu: po lewej stronie są dwa atomy, a po prawej jeden, więc przed wzorem kwasu azotowego stawiamy współczynnik liczbowy równy dwa i otrzymujemy: P 2 O 5 + H 2O → 2H3PO4. Ale teraz pozostaje wyrównać liczbę atomów tlenu i wodoru: po lewej stronie są dwa atomy wodoru, a po prawej sześć, więc przed wzorem na wodę stawiamy współczynnik liczbowy równy trzy i wtedy otrzymujemy: P 2O 5 + 3H 2O → 2H 3PO 4. Teraz łatwo sprawdzić, że w każdej części równania znajdują się równe ilości atomów fosforu, atomów wodoru i atomów tlenu, dlatego otrzymaliśmy prawidłowe równanie reakcji chemicznej: P 2 O 5 + 3H 2 O = 2H 3 PO 4.
Drugi sposób: algebraiczny. Załóżmy, że do równania umieścimy trzy współczynniki a, b, c , że otrzymano prawidłowe równanie reakcji chemicznej: A P2O5+ V H2O= Z H3PO4. Ponieważ równanie wykorzystuje atomy trzy typy, wówczas utworzymy system trzech równania liniowe z trzema niewiadomymi a, c I Z .
Substancje użyte w reakcji chemicznej: P – fosfor; O 2 – tlen; P 2 O 5 – tlenek fosforu (V).
B) Fe 2 (SO 4) 3 + KOH → Fe (OH) 3 + K 2 SO 4.
Substancje użyte w reakcji chemicznej: Fe 2 (SO 4) 3 – siarczan żelaza (III); KOH – wodorotlenek potasu; Fe(OH) 3 – wodorotlenek żelaza (III); K 2 SO 4 – siarczan potasu.
D) CuOH → Cu 2 O + H 2 O.
Rozwiązanie: 2CuOH = Cu 2 O + H 2 O. Problem wyznaczenia współczynników liczbowych rozwiązano poprzez ułożenie układu równań: 
Substancje użyte w reakcji chemicznej: CuOH – wodorotlenek miedzi(I); Cu 2 O – tlenek miedzi (I); H2O – woda.
D) CS 2 + O 2 → CO 2 + SO 2.
Rozwiązanie: CS 2 + 3O 2 = CO 2 + 2SO 2. Rozwiązaliśmy dobierając współczynniki: wyrównaliśmy liczbę atomów siarki (2); wyrównała liczbę atomów tlenu (3).
Substancje użyte w reakcji chemicznej: CS 2 – siarczek siarki (IV); O 2 –
Substancje użyte w reakcji chemicznej: FeS 2 – piryt; O 2 – tlen; Fe 2 O 3 – tlenek żelaza (III); SO 2 - tlenek siarki (IV).
Ćwiczenie 3.
(Proponowano rozwiązanie jako odrębną pracę).
Stan : schorzenie:
Zapisz równania reakcje chemiczne według następujących schematów:
A) kwas fosforowy + wodorotlenek sodu → fosforan sodu + woda;
B) tlenek sodu + woda → wodorotlenek sodu;
B) tlenek żelaza (II) + glin → tlenek glinu + żelazo;
D) wodorotlenek miedzi (II) → tlenek miedzi (II) + woda.
Odpowiedź:
A) 2H3PO4 + 6NaOH = 2Na3PO4 + 6H2O;
B) Na2O + H2O = 2NaOH;
B) 3FeO + 2Al = Al 2O 3 + 3Fe;
D) Cu(OH) 2 = CuO + H 2 O.
W ciągu 10 minut 85% uczniów wykonało zadanie „doskonale”, co mile zaskoczyło Walentinę Iwanownę.
ZAKRES WSPÓŁCZYNNIKÓW
Liczba atomów jednego pierwiastka po lewej stronie równania musi być równa liczbie atomów tego pierwiastka po prawej stronie równania.
Zadanie 1 (dla grup).Określ liczbę atomów każdego pierwiastka chemicznego biorącego udział w reakcji.
1. Oblicz liczbę atomów:
a) wodór: 8NH3, NaOH, 6NaOH, 2NaOH, H3PO4, 2H2SO4, 3H2S04, 8H2SO4;
6) tlen: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Oblicz liczbę atomów: a)wodór:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
b) tlen:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Algorytm porządkowania współczynników w równaniach reakcji chemicznych
А1 + О2 → А12О3A1-1 atom A1-2
Atom O-2 O-3
2. Wśród elementów z różne liczby atomy po lewej i prawej stronie diagramu, wybierz ten, którego liczba atomów jest większa
Atomy O-2 po lewej stronie
Atomy O-3 po prawej stronie
3. Znajdź najmniejszą wspólną wielokrotność (LCM) liczby atomów tego pierwiastka po lewej stronie równania i liczbę atomów tego pierwiastka po prawej stronie równania
LCM = 6
4. Podziel LCM przez liczbę atomów tego pierwiastka po lewej stronie równania, uzyskaj współczynnik dla lewej strony równania
6:2 = 3
Al + ZO 2 →Al 2 O 3
5. Podziel LCM przez liczbę atomów tego pierwiastka po prawej stronie równania, uzyskaj współczynnik dla prawej strony równania
6:3 = 2
A1+ O 2 →2A1 2 O3
6. Jeżeli ustawiony współczynnik zmienił liczbę atomów innego pierwiastka, powtórz ponownie kroki 3, 4, 5.
A1 + ZO 2 → →2А1 2 O 3
A1 -1 atom A1 - 4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → →2A1 2 O 3
. Podstawowy test przyswajania wiedzy (8-10 min .).
Po lewej stronie diagramu znajdują się dwa atomy tlenu, a po prawej jeden. Liczbę atomów należy wyrównać za pomocą współczynników.
1)2Mg+O2 →2MgO
2) CaCO33 + 2HCl → CaCl2 + N2 O + CO2
Zadanie 2 Umieść współczynniki w równaniach reakcji chemicznych (zwróć uwagę, że współczynnik zmienia liczbę atomów tylko jednego pierwiastka):
1. Fe 2 O 3 + A l → A l 2 O 3 + Fe; Mg+N 2 → Mg 3 N 2 ;
2. Al + S → Glin 2 S 3 ; A1+ Z → Glin 4 C 3 ;
3. Al + Cr 2 O 3 → Cr+Al 2 O 3 ; Ca+P → Ok 3 P 2 ;
4. C + H 2 → CH 4 ; Ok + C → SaS 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
6/.Na+S → Nie 2 S; CaO+ Z → CaC 2 + CO;
7.Ca+N 2 → C A 3 N 2 ; Si+Cl 2 → SiCl 4 ;
8. Ag+S → Ag 2 S; N 2 + Z l 2 → NS l;
9.N 2 + O 2 → NIE; WSPÓŁ 2 + Z → WSPÓŁ ;
10. Cześć → N 2 → + 1 2 ; Mg+ NS l → MgCl 2 + N 2 ;
11. FeS+ NS 1 → FeCl 2 +H 2 S; Zn+HCl → ZnCl 2 +H 2 ;
12. Fr 2 +KI → KBr+I 2 ; Si+HF (R) → SiF 4 +H 2 ;
1./HCl+Na 2 WSPÓŁ 3 → WSPÓŁ 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+ SO 2 ;
14. kl 2 + KBr → KCl + Br 2 ; SiO 2 + Z → Si + CO;
15. SiO2 2 + Z → SiC + CO; Mg + SiO2 2 → Mg 2 Si + MgO
16 .
3.Co oznacza znak „+” w równaniu?
4. Dlaczego w równaniach chemicznych umieszcza się współczynniki?
W lekcji 13 „” z kursu ” Chemia dla opornych» rozważyć, dlaczego potrzebne są równania chemiczne; nauczmy się wyrównywać reakcje chemiczne przez prawidłowe umiejscowienie współczynniki Ta lekcja będzie wymagała od ciebie wiedzy zasady chemiczne z poprzednich lekcji. Koniecznie przeczytaj o analizie elementarnej, aby uzyskać szczegółowe spojrzenie na wzory empiryczne i analizę chemiczną.
W wyniku reakcji spalania metanu CH 4 w tlenie O 2 powstają dwutlenek węgla CO 2 i woda H 2 O. Reakcję tę można opisać równanie chemiczne:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Spróbujmy wydobyć więcej informacji z równania chemicznego niż tylko wskazanie produkty i odczynniki reakcje. Równanie chemiczne (1) jest NIEkompletne i dlatego nie dostarcza informacji o tym, ile cząsteczek O 2 zużywa się na 1 cząsteczkę CH 4 i ile cząsteczek CO 2 i H2 O powstaje w rezultacie. Ale jeśli zapiszemy współczynniki liczbowe przed odpowiednimi wzorami cząsteczkowymi, które wskazują, ile cząsteczek każdego typu bierze udział w reakcji, wówczas otrzymamy pełne równanie chemiczne reakcje.
Aby uzupełnić skład równania chemicznego (1), należy pamiętać o jednej prostej zasadzie: lewa i prawa strona równania muszą zawierać ten sam numer atomy każdego rodzaju, ponieważ podczas reakcji chemicznej nie powstają nowe atomy, a istniejące nie ulegają zniszczeniu. Ta reguła opiera się na prawie zachowania masy, któremu przyjrzeliśmy się na początku rozdziału.
Jest to konieczne, aby uzyskać pełne równanie z prostego równania chemicznego. Przejdźmy więc do właściwego równania reakcji (1): spójrzmy jeszcze raz na równanie chemiczne, dokładnie na atomy i cząsteczki po prawej i lewej stronie. Łatwo zauważyć, że w reakcji biorą udział trzy rodzaje atomów: węgiel C, wodór H i tlen O. Policzmy i porównajmy liczbę atomów każdego rodzaju po prawej i lewej stronie równania chemicznego.

Zacznijmy od węgla. Po lewej stronie jeden atom C jest częścią cząsteczki CH4, a po prawej stronie jeden atom C jest częścią CO2. Zatem po lewej i prawej stronie liczba atomów węgla jest taka sama, więc zostawiamy to w spokoju. Ale dla jasności postawmy współczynnik 1 przed cząsteczkami z węglem, chociaż nie jest to konieczne:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Następnie przechodzimy do liczenia atomów wodoru H. Po lewej stronie w cząsteczce CH 4 znajdują się 4 atomy H (w sensie ilościowym H 4 = 4H), a po prawej stronie są tylko 2 atomy H w cząsteczce Cząsteczka H 2 O, której jest dwa razy mniej niż po lewej stronie równania chemicznego (2). Wyrównajmy! Aby to zrobić, umieśćmy współczynnik 2 przed cząsteczką H 2 O. Teraz będziemy mieć 4 cząsteczki wodoru H zarówno w reagentach, jak i produktach:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Należy pamiętać, że współczynnik 2, który zapisaliśmy przed cząsteczką wody H 2 O w celu wyrównania wodoru H, zwiększa 2-krotnie wszystkie atomy zawarte w jej składzie, tj. 2H 2 O oznacza 4H i 2O. OK, wydaje się, że już to wyjaśniliśmy, pozostaje tylko policzyć i porównać liczbę atomów tlenu O w równaniu chemicznym (3). Od razu rzuca się w oczy fakt, że po lewej stronie jest dokładnie 2 razy mniej atomów O niż po prawej. Teraz już wiesz, jak samodzielnie bilansować równania chemiczne, więc od razu napiszę wynik końcowy:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O lub CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Jak widać, wyrównywanie reakcji chemicznych nie jest taką trudną sprawą i nie chemia jest tu istotna, ale matematyka. Równanie (4) nazywa się pełne równanie reakcja chemiczna, gdyż podlega prawu zachowania masy, tj. liczba atomów każdego typu wchodzących w reakcję dokładnie pokrywa się z liczbą atomów tego typu po zakończeniu reakcji. Każda strona tego pełnego równania chemicznego zawiera 1 atom węgla, 4 atomy wodoru i 4 atomy tlenu. Warto jednak zrozumieć parę ważne punkty: reakcja chemiczna złożona sekwencja oddzielnych etapów pośrednich i dlatego nie można np. interpretować równania (4) w tym sensie, że 1 cząsteczka metanu musi jednocześnie zderzyć się z 2 cząsteczkami tlenu. Procesy zachodzące podczas powstawania produktów reakcji są znacznie bardziej złożone. Drugi punkt: pełne równanie reakcja nie mówi nam nic o jej mechanizmie molekularnym, czyli o sekwencji zdarzeń zachodzących na poziomie molekularnym podczas jej występowania.
Współczynniki w równaniach reakcji chemicznych
Inny jasny przykład jak go poprawnie umieścić szanse w równaniach reakcji chemicznych: Trinitrotoluen (TNT) C 7 H 5 N 3 O 6 łączy się energicznie z tlenem, tworząc H 2 O, CO 2 i N 2. Zapiszmy równanie reakcji, które wyrównamy:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Łatwiej jest skonstruować pełne równanie w oparciu o dwie cząsteczki TNT, ponieważ lewa strona zawiera liczba nieparzysta atomy wodoru i azotu, a po prawej - nawet:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Wtedy jest jasne, że 14 atomów węgla, 10 atomów wodoru i 6 atomów azotu musi przekształcić się w 14 cząsteczek dwutlenku węgla, 5 cząsteczek wody i 3 cząsteczki azotu:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Teraz obie części zawierają tę samą liczbę wszystkich atomów z wyjątkiem tlenu. Z 33 atomów tlenu znajdujących się po prawej stronie równania, 12 jest dostarczanych przez dwie pierwotne cząsteczki TNT, a pozostałe 21 musi być dostarczane przez 10,5 cząsteczek O2. Zatem pełne równanie chemiczne będzie wyglądać następująco:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Możesz pomnożyć obie strony przez 2 i pozbyć się niecałkowitego współczynnika 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Ale nie musisz tego robić, ponieważ wszystkie współczynniki równania nie muszą być liczbami całkowitymi. Jeszcze bardziej poprawne byłoby utworzenie równania opartego na jednej cząsteczce TNT:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Pełne równanie chemiczne (9) zawiera wiele informacji. Przede wszystkim wskazuje substancje wyjściowe - odczynniki, I produkty reakcje. Ponadto pokazuje, że podczas reakcji wszystkie atomy każdego typu są indywidualnie zachowywane. Jeśli pomnożymy obie strony równania (9) przez liczbę Avogadro N A = 6,022 10 23, możemy stwierdzić, że 4 mole TNT reagują z 21 molami O 2, tworząc 28 moli CO 2, 10 moli H 2 O i 6 mole N2.
Jest jeszcze jeden trik. Korzystając z układu okresowego określamy masy cząsteczkowe wszystkie te substancje:
- C 7 H 5 N 3 O 6 = 227,13 g/mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Teraz równanie 9 wskaże również, że 4 227,13 g = 908,52 g TNT wymaga 21 31,999 g = 671,98 g tlenu do zakończenia reakcji i w rezultacie powstaje 28 44,010 g = 1232,3 g CO 2, 10·18,015 g = 180,15 g H2O i 6,28,013 g = 168,08 g N2. Sprawdźmy, czy w tej reakcji jest spełniona zasada zachowania masy:
| Odczynniki | Produkty | |
| 908,52 g trotylu | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Całkowity | 1580,5 g | 1580,5 g |
Jednak poszczególne cząsteczki niekoniecznie muszą brać udział w reakcji chemicznej. Na przykład reakcja wapienia CaCO3 i kwasu solnego HCl, z wytworzeniem wodnego roztworu chlorku wapnia CaCl2 i dwutlenku węgla CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Równanie chemiczne (11) opisuje reakcję węglanu wapnia CaCO 3 (wapień) i kwasu solnego HCl, w wyniku której powstaje wodny roztwór chlorku wapnia CaCl 2 i dwutlenku węgla CO 2. To równanie jest kompletne, ponieważ liczba atomów każdego typu po jego lewej i prawej stronie jest taka sama.
Znaczenie tego równania jest takie poziom makroskopowy (molowy). jest następująca: 1 mol lub 100,09 g CaCO3 wymaga 2 moli, czyli 72,92 g HCl, aby zakończyć reakcję, w wyniku czego powstaje 1 mol CaCl2 (110,99 g/mol), CO2 (44,01 g/mol) i H2 O (18,02 g/mol). Na podstawie tych danych liczbowych łatwo jest sprawdzić, czy w tej reakcji spełniona jest zasada zachowania masy.
Interpretacja równania (11) na poziomie mikroskopowym (molekularnym). nie jest to takie oczywiste, ponieważ węglan wapnia jest solą, a nie związkiem molekularnym, dlatego równania chemicznego (11) nie można rozumieć w tym sensie, że 1 cząsteczka węglanu wapnia CaCO 3 reaguje z 2 cząsteczkami HCl. Co więcej, cząsteczka HCl w roztworze na ogół dysocjuje (rozpada się) na jony H + i Cl -. Więc więcej poprawny opis tego, co dzieje się w tej reakcji na poziomie molekularnym, opisuje równanie:
- CaCO 3 (roztwór) + 2H + (wodny) → Ca 2+ (wodny) + CO 2 (g.) + H 2 O (l.) (12)
Tutaj stan fizyczny każdego rodzaju cząstek jest krótko wskazany w nawiasach ( telewizja- twardy, woda- jon uwodniony w roztworze wodnym, G.- gaz, I.- płyn).
Równanie (12) pokazuje, że stały CaCO 3 reaguje z dwoma uwodnionymi jonami H +, tworząc jon dodatni Ca 2+, CO 2 i H 2 O. Równanie (12), podobnie jak inne kompletne równania chemiczne, nie daje wyobrażenia o mechanizm molekularny reaguje i jest mniej wygodny do liczenia ilości substancji, jednak daje najlepszy opis dzieje się na poziomie mikroskopowym.
Wzmocnij swoją wiedzę na temat tworzenia równań chemicznych, samodzielnie przepracowując przykład z rozwiązaniem:
Mam nadzieję, że z lekcji 13” Pisanie równań chemicznych„Nauczyłeś się czegoś nowego dla siebie. Jeśli masz jakieś pytania, napisz je w komentarzach.
Instrukcje
Przed rozpoczęciem samego zadania musisz zrozumieć, że liczba umieszczona z przodu pierwiastek chemiczny lub cały wzór na współczynnik. A liczba ta jest warta (i nieco) indeksu. Oprócz tego, że:
Współczynnik dotyczy wszystkich symboli chemicznych występujących po nim we wzorze
Współczynnik mnoży się przez indeks (nie sumuje się!)
Liczba atomów każdego pierwiastka substancji wchodzących w reakcję musi pokrywać się z liczbą atomów tych pierwiastków zawartych w produktach reakcji.
Na przykład zapisanie wzoru 2H2SO4 oznacza 4 atomy H (wodoru), 2 atomy S (siarki) i 8 atomów O (tlenu).
1. Przykład nr 1. Rozważmy spalanie etylenu.
Po spaleniu materia organiczna powstaje tlenek węgla (IV) ( dwutlenek węgla) i woda. Wypróbujmy współczynniki po kolei.
C2H4 + O2 => CO2 + H2O
Zacznijmy analizować. Do reakcji weszły 2 atomy C (węgla), ale otrzymano tylko 1 atom, co oznacza, że umieściliśmy 2 przed CO2. Teraz ich liczba jest taka sama.
C2H4 + O2 => 2CO2+ H2O
Teraz spójrzmy na H (wodór). Do reakcji weszły 4 atomy wodoru, ale w rezultacie wyszły tylko 2 atomy, dlatego stawiamy 2 przed H2O (wodą) - teraz otrzymujemy również 4
C2H4 + O2 => 2CO2+ 2H2O
Liczymy wszystkie atomy O (tlenu) powstałe w wyniku reakcji (czyli po równości). 4 atomy w 2CO2 i 2 atomy w 2H2O - łącznie 6 atomów. A przed reakcją są tylko 2 atomy, czyli stawiamy 3 przed cząsteczką tlenu O2, czyli jest ich też 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Zatem wynikiem jest taka sama liczba atomów każdego pierwiastka przed i po znaku równości.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Przykład nr 2. Rozważ reakcję glinu z rozcieńczonym kwasem siarkowym.
Al + H2SO4 => Al2 (SO4) 3 + H2
Patrzymy na atomy S zawarte w Al2 (SO4) 3 - jest ich 3, ale w H2SO4 (kwasie siarkowym) jest tylko 1, dlatego też stawiamy 3 przed kwasem siarkowym.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Ale teraz przed reakcją jest 6 atomów H (wodoru), a po reakcji tylko 2, co oznacza, że przed cząsteczką H2 (wodoru) również umieszczamy 3, więc w sumie otrzymamy 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Na koniec przyglądamy się. Ponieważ w Al2 (SO4) 3 (siarczan glinu) są tylko 2 atomy glinu, przed reakcją umieściliśmy 2 przed Al (aluminium).
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Teraz liczba wszystkich atomów przed i po reakcji jest taka sama. Okazało się, że uporządkowanie współczynników w równaniach chemicznych nie jest takie trudne. Po prostu ćwicz i wszystko się ułoży.
Pamiętaj, że współczynnik mnoży się przez indeks, a nie dodaje.
Źródła:
- jak reagują elementy
- Test na ten temat” Równania chemiczne»
Dla wielu uczniów napisz równania reakcji chemicznych i umieść je poprawnie szanse nie jest to łatwe zadanie. Co więcej, z jakiegoś powodu główną trudnością jest dla nich właśnie druga część. Wydawać by się mogło, że nie ma w tym nic skomplikowanego, jednak czasami studenci poddają się, popadając w kompletny zamęt. Ale wystarczy pamiętać o kilku proste zasady, a zadanie nie będzie już sprawiać trudności.
Instrukcje
Współczynnik, czyli liczba przed wzorem cząsteczki substancja chemiczna, do wszystkich symboli i pomnożone przez każdy symbol! To mnożenie, a nie dodawanie! Może się to wydawać niewiarygodne, ale niektórzy uczniowie dodają dwie liczby zamiast je mnożyć.
Liczba atomów każdego pierwiastka substancji wyjściowych (to znaczy znajdujących się po lewej stronie równania) musi pokrywać się z liczbą atomów każdego pierwiastka produktów reakcji (odpowiednio znajdujących się po jego prawej stronie).