Model związku chemicznego. Nowoczesne wysokie technologie
Przeczytaj także
ADNOTACJA
Artykuł dotyczy kwantowo-chemicznych modeli atomów, cząsteczek, które pozwalają zrozumieć istotę przemian chemicznych materii na poziomie atomowym i molekularnym jej organizacji.
ABSTRAKCYJNY
Artykuł poświęcony jest szczegółowemu omówieniu graficznych modeli kwantowo-chemicznych atomów, cząsteczek i wiązań chemicznych. Takie podejście pozwala zrozumieć naturę procesów chemicznych i prawa ich przebiegu.
Współczesne idee dotyczące budowy atomów i cząsteczek, rozumienia przemian chemicznych materii na poziomie atomowym i molekularnym jej organizacji ujawnia chemia kwantowa.
Z punktu widzenia chemii kwantowej atom jest mikroukładem składającym się z jądra i elektronów poruszających się w polu elektromagnetycznym jądra. Na ryc. Na rysunku 1 przedstawiono modele orbitalne, elektronowe i dyfrakcyjne elektronów atomów pierwszego i drugiego okresu, zbudowane z wykorzystaniem zasad kwantowych i reguł wypełniania poziomów energetycznych w atomach elektronami. Cztery liczby kwantowe n, ja, m ja, SM w pełni scharakteryzować ruch elektronów w polu jądra. Główna liczba kwantowa n charakteryzuje energię elektronu, jego odległość od jądra i odpowiada liczbie poziomu energii, na którym znajduje się elektron. Orbitalna liczba kwantowa ja określa kształt orbity i energię podpoziomów o tym samym poziomie energetycznym. Pojęcie „orbital” oznacza najbardziej prawdopodobny obszar ruchu elektronu w atomie. Magnetyczna liczba kwantowa m ja określa liczbę orbitali i ich orientację przestrzenną. Co najważniejsze, orbitalna i magnetyczna liczba kwantowa są ze sobą powiązane. Orbitalna liczba kwantowa ja przyjmuje wartości o jeden mniej niż główna liczba kwantowa n. Jeśli n= 1, to ja= 0, a w kształcie jest kulisty 1 s-orbitalny. Jeśli n= 2, to orbitalna liczba kwantowa przyjmuje dwie wartości: ja= 0, 1, wskazując na obecność dwóch podpoziomów. Jest sferyczny 2 s- orbitalny ( ja= 0) i trzy 2 p-orbitale przypominające kształtem hantle gimnastyczne, umieszczone pod kątem 90 ° wzdłuż osi kartezjańskiego układu współrzędnych.
Rysunek 1. Dyfrakcja kwantowo-chemiczna, elektronowa i elektronowa modele atomów pierwszego i drugiego okresu
Numer i układ przestrzenny 2 p-orbitale wyznaczają magnetyczną liczbę kwantową m ja, który przyjmuje wartości w ramach orbitalnej liczby kwantowej od – ja do + ja. Jeśli ja= 0, to m ja= 0 (jeden s- orbitalny). Jeśli ja= 1, to m ja przyjmuje trzy wartości - 1 , 0, +1 (trzy R-orbitale).
Orbitalne modele atomów pokazują przestrzenny układ i kształt orbitali, a na modelach dyfrakcji elektronów w postaci symbolicznych komórek kwantowych podano obraz orbitali oraz położenie poziomów i podpoziomów na diagramie energetycznym. Zwróć uwagę na wielkość atomów. Ta sama prawidłowość powtarza się w okresach - wraz ze wzrostem ładunku jądra następuje narastająca deformacja (ściskanie) orbitali pod wpływem elektromagnetycznego przyciągania elektronów przez jądro (ryc. 1).
Umieszczanie elektronów na orbitalach podlega jednej z najważniejszych zasad mechanika kwantowa(zasada Pauliego): nie więcej niż dwa elektrony mogą znajdować się na jednym orbicie i muszą różnić się własnym momentem pędu - spinem (angielski obrót spinu). Elektrony o różnych spinach są zwykle przedstawiane za pomocą strzałek i ¯. Gdy dwa elektrony znajdują się na tym samym orbicie, mają antyrównoległe spiny i nie przeszkadzają sobie nawzajem w poruszaniu się w polu jądra.
Ta właściwość przypomina obrót w zazębieniu dwóch kół zębatych. Po włączeniu jeden bieg obraca się zgodnie z ruchem wskazówek zegara, drugi przeciwnie do ruchu wskazówek zegara. Trzeci bieg zazębiony z pozostałymi dwoma zatrzymuje obrót. Jest zbędna. Tak więc na jednym orbicie mogą być tylko 2 elektrony, trzeci jest zbędny.
Kiedy poziomy i podpoziomy energetyczne są wypełnione elektronami, zasada kwantowa minimalna energia (reguła Klechkowskiego) . Elektrony wypełniają orbitale od najniższego do najwyższego poziomu energii. Zasada minimum energii jest jak wypełnianie podłóg wieżowiec w okresie powodzi. Woda unosi się i wypełnia wszystkie podłogi od dołu do góry, nie tracąc ani jednego.
Zgodnie z zasadą Hunda wszyscy R-orbitale wypełnione są najpierw jednym elektronem, a dopiero potem drugim o spinie antyrównoległym.
Modele kwantowo-chemiczne atomów umożliwiają wyjaśnienie właściwości atomów do wymiany energii, oddawania i odbierania elektronów, zmiany konfiguracji geometrycznej oraz tworzenia wiązań chemicznych.
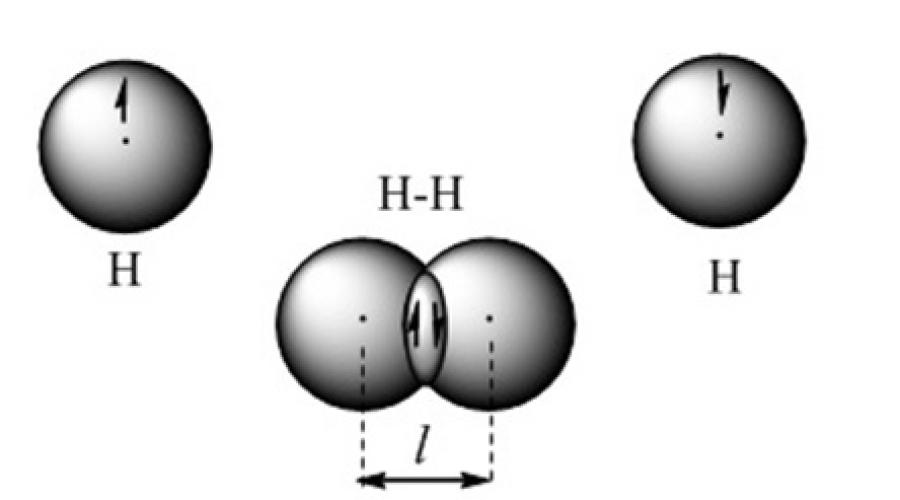
Kowalencyjne wiązanie chemiczne powstaje, gdy chmury elektronów walencyjnych nakładają się na siebie. Na przykład takie wiązanie jest reprezentowane w modelu orbitalnym cząsteczki wodoru (ryc. 2).
/Zakharova.files/image002.jpg)
Rysunek 2. Model wiązania kowalencyjnego w cząsteczce wodoru
Zastosowanie kwantowochemicznej metody wiązań walencyjnych opiera się na założeniu, że każda para atomów w cząsteczce jest utrzymywana razem przez jedną lub więcej par elektronów o antyrównoległych spinach. Z punktu widzenia metody wiązań walencyjnych cząsteczka jest mikroukładem składającym się z dwóch lub więcej atomów związanych kowalencyjnie. Dodatnio naładowane jądra atomów są utrzymywane przez ładunek ujemny skoncentrowany w obszarze nakładających się orbitali atomowych. Przyciąganie jąder atomów do zwiększonej gęstości elektronowej między nimi jest równoważone siłą odpychania jąder między sobą. Powstaje stabilny mikrosystem, w którym długość wiązania kowalencyjnego jest równa odległości między jądrami.
W cząsteczce fluoru, jak również w cząsteczce wodoru, występuje niepolarne wiązanie kowalencyjne. Nakładanie 2 R 1 orbitali, para elektronów tworzy zwiększoną gęstość elektronów między jądrami atomów i utrzymuje cząsteczkę w stanie stabilnym (rys. 3).
/Zakharova.files/image003.jpg)
Rysunek 3. Model wiązania kowalencyjnego w cząsteczce fluoru
Niepolarne wiązanie kowalencyjne oznacza takie nakładanie się orbitali walencyjnych, w wyniku którego zbiegają się środki ciężkości ładunków dodatnich i ujemnych.
Możliwe jest utworzenie polarnego wiązania kowalencyjnego podczas nakładania 1 s 1 - i 2 R 1 orbitale. Na ryc. 4 przedstawia model fluorowodoru z polarnym wiązaniem kowalencyjnym. Gęstość elektronowa między atomami związanymi kowalencyjnie przesuwa się do atomu fluoru, którego ładunek jądrowy (+9) wywiera większe przyciąganie elektromagnetyczne w porównaniu do jądra atomu wodoru z ładunkiem (+1).
/Zakharova.files/image004.jpg)
Rysunek 4. Model polarnego wiązania kowalencyjnego w cząsteczce fluorowodoru
Wiązanie jonowe wynika z przyciągania elektrycznie naładowanych cząstek - jonów. Na ryc. 5 przedstawia model tworzenia wiązania jonowego we fluorku litu. Silne pole elektromagnetyczne wytworzone przez jądro atomu fluoru wychwytuje i utrzymuje R-orbitale elektronu należącego do atomu litu. Pozbawiony elektronu atom litu zmienia swoją konfigurację geometryczną (2 s-orbitalny), staje się jonem naładowanym dodatnio i jest przyciągany do ujemnie naładowanego jonu fluoru, który nabył dodatkowy elektron na R-orbitalny.
/Zakharova.files/image005.jpg)
Rysunek 5. Model pary jonowej Li + F - fluorek litu
Siły przyciągania elektrostatycznego przeciwnie naładowanych jonów i odpychania powłok elektronowych jonów litu i fluoru są zrównoważone i utrzymują jony w odległości odpowiadającej długości wiązania jonowego. Nakładanie się orbit w związkach związanych jonowo praktycznie nie istnieje.
W atomach metali przejawia się szczególny rodzaj wiązania chemicznego. Kryształ metalu (rys. 6) składa się z dodatnio naładowanych jonów, w polu których elektrony walencyjne poruszają się swobodnie („obłok elektronów”).
/Zakharova.files/image006.jpg)
Rysunek 6. Model kryształu litowo-metalowego
Jony i „chmura elektronów” utrzymują się wzajemnie w stanie stabilnym. Ze względu na dużą ruchliwość elektronów metale mają przewodnictwo elektronowe.
W cząsteczkach atomy połączone kilkoma wiązaniami kowalencyjnymi zmieniają swoją konfigurację geometryczną. Rozważ przejaw tej właściwości na przykładzie atomu węgla (1 s 2-orbital nie jest pokazany w modelach atomu węgla, ponieważ nie uczestniczy w tworzeniu wiązań chemicznych).
Doświadczalnie ustalono, że atom węgla w cząsteczce CH4 tworzy cztery identyczne wiązania kowalencyjne z atomami wodoru, które są równoważne pod względem energetycznym i przestrzennym. Trudno sobie wyobrazić cztery identyczne wiązania kowalencyjne, jeśli weźmiemy pod uwagę, że w węglu elektrony walencyjne znajdują się na dwóch energiach 2 s i 2 p podpoziomy:
/Zakharova.files/image007.jpg)
W stanie podstawowym (niewzbudzonym) węgiel tworzy tylko dwa wiązania kowalencyjne. W stanie wzbudzonym jeden elektron z podpoziomu 2 s przechodzi na wyższy podpoziom energetyczny 2 p. W wyniku takiego przeskoku elektronu całkowita energia 2 s- i 2 p-orbitale i wartościowość atomu węgla zmienia się na cztery:
/Zakharova.files/image008.jpg)
A jednak to nie wystarczy, aby wyjaśnić cztery równoważne wiązania kowalencyjne w cząsteczce CH 4, ponieważ 2 s- i 2 p-orbitale mają inny kształt i układ przestrzenny. Problem rozwiązano, wprowadzając hipotezę hybrydyzacja - mieszanie elektronów walencyjnych na podpoziomach o tym samym poziomie energetycznym. W cząsteczce metanu jest jeden 2 s- i trzy 2 R-orbitale atomu węgla w wyniku hybrydyzacji zamieniają się w cztery ekwiwalenty sp Orbitale 3-hybrydowe:
/Zakharova.files/image009.jpg)
W przeciwieństwie do stanu niewzbudzonego (podstawowego) atomu węgla, w którym trzy 2 R-orbitale atomu znajdują się pod kątem 90o (rys. 7, a), w cząsteczce metanu (rys. 7, b) są równoważne pod względem kształtu i rozmiaru sp 3-hybrydowe atomy węgla znajdują się pod kątem 109 około 28".
/Zakharova.files/image010.jpg)
Rysunek 7. Model cząsteczki metanu
W cząsteczce etylenu C 2 H 4 (ryc. 8, a) atomy węgla są w sR 2 - stan hybrydowy. 2 są zaangażowane w hybrydyzację s-orbitalny i dwa 2 R-orbitale. W wyniku hybrydyzacji atomy węgla tworzą trzy równoważniki sp 2 -orbitale hybrydowe umieszczone pod kątem około 120 w płaszczyźnie; 2 pz-orbital nie uczestniczy w hybrydyzacji.
/Zakharova.files/image011.jpg)
Rysunek 8. Model cząsteczki etylenu
W cząsteczce etylenu atomy węgla są połączone nie tylko wiązaniem s, ale także wiązaniem p. Powstaje w wyniku nakładania się Rz-orbitale z utworzeniem dwóch obszarów nakładania się powyżej i poniżej osi łączącej jądra, po obu stronach osi wiązania s (ryc. 8).
Model wiązania potrójnego przedstawiono w cząsteczce acetylenu (rys. 9). Podczas mieszania jednego 2 s- i jeden 2 px- powstają dwa orbitale atomu węgla sp-orbitale hybrydowe, które znajdują się na linii łączącej jądra atomów (kąt 180 o). Niehybrydowy 2 RU- oraz 2Rz-orbitale o różnych atomach węgla zachodzą na siebie, tworząc dwa wiązania p we wzajemnie prostopadłych płaszczyznach (ryc. 9).
/Zakharova.files/image012.jpg)
Rysunek 9. Model cząsteczki acetylenu
Cząsteczki, podobnie jak atomy, wykazują zdolność do zrywania i tworzenia wiązań chemicznych, zmiany konfiguracji geometrycznej oraz przejścia od stanu elektrycznie obojętnego do stanu jonowego. Właściwości te przedstawiono w reakcji między cząsteczkami amoniaku NH 3 i fluorowodoru HF (rys. 10). Wiązanie kowalencyjne w cząsteczce fluorowodoru zostaje zerwane i powstaje kowalencyjne wiązanie donor-akceptor pomiędzy azotem i wodorem w cząsteczce amoniaku. Donorem jest samotna para elektronów atomu azotu, akceptorem jest wolny orbital atomu wodoru (ryc. 10). Konfiguracja geometryczna cząsteczki NH 3 (ostrosłup trójkątny, kąt wiązania 107 o 18") zmienia się w konfigurację czworościenną jonu NH 4 + (109 o 28"). Ostatnim procesem jest tworzenie wiązania jonowego w strukturze krystalicznej fluorku amonu. Modele orbitalne cząsteczek umożliwiają ukazanie wszystkich wymienionych wyżej właściwości w jednej reakcji: zerwania i tworzenia wiązań chemicznych, zmiany konfiguracji geometrycznej, przejścia ze stanu elektrycznie obojętnego do stanu jonowego.
/Zakharova.files/image013.jpg)
Ryż. 10. Model powstawania pary jonowej krystalicznego NH 4 + F -
Reakcja chemiczna za pomocą symboli pierwiastki chemiczne:
NH 3 + HF → NH 4 F,
daje uogólnioną ekspresję tego, co ujawniają się w orbitalnych modelach molekuł. Reakcje chemiczne reprezentowane przez modele orbitalne i symbole pierwiastków chemicznych wzajemnie się uzupełniają. To jest ich zasługa. Opanowanie elementarnej wiedzy na temat kwantowo-chemicznej ekspresji budowy i składu atomów i cząsteczek prowadzi do zrozumienia kluczowych pojęć chemicznych: kowalencyjne wiązania polarne i niepolarne, wiązania donor-akceptor, wiązania jonowe, konfiguracja geometryczna atomów i cząsteczek, Reakcja chemiczna. I na fundamencie tej wiedzy można śmiało posługiwać się symboliką pierwiastków i związków chemicznych dla krótki opis stany chemiczne i przemiany materii.
Podajmy inny przykład reakcji rozpatrywanej z punktu widzenia chemii kwantowej. Woda wykazuje właściwości słabego elektrolitu. Dysocjacja elektrolityczna jest zwykle reprezentowana przez równanie:
H 2 O ⇄H + + OH -
H2O + H2O H3O + + OH -.
O podziale cząsteczek wody na jony naładowane dodatnio i ujemnie świadczy kwantowo-chemiczny model reakcji dysocjacji elektrolitycznej (rys. 11).
/Zakharova.files/image014.jpg)
Rysunek 11. Model dysocjacji elektrolitycznej wody
Cząsteczka wody jest zniekształconą piramidą (kąt walencyjny 104 o 30 "). Dwa sR Orbitale 3-hybrydowe atomu tlenu tworzą wiązania s z atomami wodoru. Dwóch innych sR Orbitale 3-hybrydowe mają wolne pary elektronów z antyrównoległymi spinami. Zerwanie kowalencyjnego wiązania H–O w jednej z cząsteczek prowadzi do powstania kowalencyjnego wiązania chemicznego na sąsiedniej cząsteczce zgodnie z mechanizmem donor-akceptor. Jon wodoru, który ma wolny orbital, działa jako akceptor pary elektronowej atomu tlenu sąsiedniej cząsteczki wody. W tym przykładzie, podobnie jak w poprzednim, podejście kwantowo-chemiczne pozwala zrozumieć fizykochemiczne znaczenie procesu elektrolitycznej dysocjacji wody.
Myślenie to proces, dzięki któremu możemy pośrednio ocenić to, co jest ukryte przed naszą percepcją zmysłową. Chemia kwantowa daje wizualny obraz procesów chemicznych i stanów materii, ujawnia to, co ukryte przed naszą percepcją zmysłową, zachęca do uczenia się i myślenia.
Bibliografia:
1. Wygotski L.S. Myślenie i mowa. – M.: Labirynt, 1999. – 352 s.
2. Zagaszew I.O., Zair-Bek S.I. Krytyczne myślenie: technologia rozwoju. - Petersburg: Sojusz „Delta”, 2003. - 284 s.
3. Krasnov K.S. Cząsteczki i wiązania chemiczne. - M.: Szkoła podyplomowa, 1984r. - 295 s.
4. Leontiev A.N. Wykłady z psychologii ogólnej. – M.: Sens, 2000. – 512 s.
5. Peregudov F.I., Tarasenko F.P. Wprowadzenie do Analiza systemu. - M.: Szkoła Wyższa, 1989r. - 367 s.
6. Prokofiew W.F. Człowiek - sterowany biokomputer? // Biuletyn Międzynarodowej Akademii Nauk (sekcja rosyjska). - 2008r. - nr 1. - S. 1-21.
7. Yablokov V.A., Zacharova O.M. Systemowa organizacja treści nauczania chemii // Universum: Psychologia i edukacja: elektron. naukowy czasopismo 2016. nr 5(23) / [ Zasób elektroniczny]. - Tryb dostępu:
URL://website/ru/psy/archiv/item/2505 (dostęp 2.04.2017)
1.4.1 Modele chemiczne
Oprócz obserwacji i eksperymentowania, modelowanie odgrywa ważną rolę w poznawaniu świata przyrody i chemii. Jednym z głównych celów obserwacji jest poszukiwanie wzorców w wynikach eksperymentów. Jednak niektóre obserwacje są niewygodne lub niemożliwe do przeprowadzenia bezpośrednio w przyrodzie. środowisko naturalne odtwarzać w warunkach laboratoryjnych za pomocą specjalnych urządzeń, instalacji, obiektów tj. modeli. Modele kopiują tylko najważniejsze cechy i właściwości obiektu, pomijają te, które nie są istotne dla badań. Tak więc w chemii modele można warunkowo podzielić na dwie grupy: materiał i kultowy.
Modele aparatury chemicznej i przemysłowej
Modele materiałowe atomów, cząsteczek, kryształów, przemysłu chemicznego są używane przez chemików dla większej przejrzystości.
Najpopularniejszą reprezentacją atomu jest model przypominający strukturę Układu Słonecznego.
Często używany do modelowania cząsteczek substancji. piłka-i-kij modele. Modele tego typu są składane z kolorowych kulek, które reprezentują atomy tworzące cząsteczkę. Kulki połączone są prętami, symbolizującymi wiązania chemiczne. Za pomocą modeli kulkowych i sztyftowych kąty wiązań w cząsteczce są dość dokładnie odwzorowywane, ale odległości międzyjądrowe są odzwierciedlane tylko w przybliżeniu, ponieważ długości prętów łączących kulki nie są proporcjonalne do długości wiązań.
Modele do pogłębiania dość dokładnie przekazują kąty wiązań i stosunek długości wiązań w cząsteczkach. Jądra atomów w nich, w przeciwieństwie do modeli kulowych i prętowych, są oznaczone nie kulkami, ale punktami łączenia prętów.
modele półkuliste, zwane również modelami Stewart-Brigleb, są składane z kulek z wyciętymi segmentami. Modele atomów są połączone płaszczyznami przekroju za pomocą przycisków. Modele półkuliste dokładnie oddają zarówno stosunek długości wiązań i kątów wiązań, jak i wypełnienie przestrzeni międzyjądrowej w cząsteczkach. Jednak to obłożenie nie zawsze pozwala uzyskać wizualną reprezentację względne położenie jądra.
Modele kryształów przypominają kulkowe modele cząsteczek, jednak nie przedstawiają pojedynczych cząsteczek substancji, ale pokazują wzajemne ułożenie cząsteczek substancji w stanie krystalicznym.
Częściej jednak chemicy używają nie materiału, ale kultowe modele - są to symbole chemiczne, wzory chemiczne, równania reakcje chemiczne. Za pomocą symboli pierwiastków chemicznych i indeksów zapisuje się wzory substancji. Indeks pokazuje, ile atomów danego pierwiastka zawiera się w cząsteczce substancji. Jest napisany po prawej stronie znaku pierwiastka chemicznego.
Wzór chemiczny jest głównym ikonicznym modelem w chemii. Pokazuje: określoną substancję; jedna cząsteczka tej substancji; skład jakościowy substancje, tj. atomy, których pierwiastki są częścią tej substancji; skład ilościowy, tj. ile atomów każdego pierwiastka wchodzi w skład cząsteczki substancji.
Wszystkie powyższe modele są szeroko wykorzystywane w tworzeniu interaktywne modele komputerowe.
1.4.2 Klasyfikacja modeli komputerowych
Wśród różnych typów oprogramowania pedagogicznego wyróżnia się te, które wykorzystują modele komputerowe. Wykorzystanie modeli komputerowych pozwala nie tylko zwiększyć widoczność procesu uczenia się i zintensyfikować go, ale także radykalnie ten proces zmienić. W ostatnie lata komputery rozwijają się w szybkim tempie, a ich możliwości modelowania stały się niemal nieograniczone, więc znaczenie modeli komputerowych w badaniu dyscyplin szkolnych może znacznie wzrosnąć. E.E. Nifantiev, A.K. Achlebinin, V.N. Lichaczow zauważa, że główną zaletą modeli komputerowych jest możliwość modelowania niemal dowolnych procesów i zjawisk, interaktywna interakcja użytkownika z modelem, a także implementacja problematycznych podejść badawczych w procesie uczenia się.
V. N. Likhachev proponuje klasyfikację edukacyjnych modeli komputerowych według szeregu kryteriów, z których główne to obecność animacji podczas wyświetlania modelu, metoda kontroli, metoda wizualnego wyświetlania modelu. Dzięki obecności animacji UKM może być dynamiczny i statyczny. Dynamiczne zawierają fragmenty animacji do wyświetlania symulowanych obiektów i procesów, nie ma ich w statycznych. Zgodnie z metodą kontroli, RCM może być zarządzany, co pozwala na zmianę parametrów modelu, oraz niezarządzany, który takiej możliwości nie daje.

Wśród modeli demonstracyjnych (niezarządzanych) można wyróżnić jeszcze dwie grupy ze względu na możliwość interakcji z użytkownikiem: interaktywną i nieinteraktywną. Interaktywne pozwalają na zmianę sposobu wyświetlania modelu lub punktu obserwacji na modelu bez zmiany jego parametrów. Takie nieinteraktywne możliwości nie dają.
E.E. Nifantiev, A.K. Achlebinina i V.N. Lichaczow jest uważany za najbardziej użyteczny z metodologicznego punktu widzenia klasyfikacja według obiektu modelowania. W zależności od poziomu reprezentowanych obiektów modele stosowane w nauczaniu chemii można podzielić na dwie grupy : modele makroświata, które odzwierciedlają zewnętrzne właściwości symulowanych obiektów i ich zmianę oraz modele mikroświata, które odzwierciedlają strukturę obiektów i zachodzące w nich zmiany na poziomie ich atomowej i molekularnej reprezentacji. A modele takich obiektów jak chemikalia, reakcje chemiczne i procesy fizykochemiczne można tworzyć zarówno na poziomie mikroświata, jak i na poziomie makrokosmosu.

Dla większej przejrzystości klasyfikację UKM można przedstawić w formie wykresu.
1.4.3 Komputerowe modele mikroświata
Obiektami do modelowania na poziomie mikrokosmosu są atomy, jony, cząsteczki, sieci krystaliczne, elementy strukturalne atomów. Na poziomie mikrokosmosu modelowane są cechy struktury materii, wzajemne oddziaływanie cząstek tworzących materię. W przypadku modelowania reakcji chemicznych na poziomie mikroświata duże znaczenie mają mechanizmy procesów chemicznych. A w modelach procesów fizycznych i chemicznych brane są pod uwagę procesy zachodzące na poziomie elektronowym lub atomowo-molekularnym.
Oczywiste jest, że CCM symulujące modele mikroświata stają się doskonałymi pomocnikami w badaniu struktury atomów, rodzajów wiązań chemicznych, struktury materii itp.
W programie zaimplementowano modele atomów 1 - 3 okresy układu okresowego Mendelejewa " 1C: Nauczyciel. Chemia» w postaci modeli atomu Bohra. W programie realizowane są bardziej nowoczesne pomysły dotyczące budowy atomu Chemland, gdzie rozważany jest rozkład elektronów na podpoziomach energetycznych atomów pierwiastków oraz kształt poszczególnych orbitali na różnych poziomach energetycznych.
Szczególnie interesujący jest program HyperChem. Jest to jeden z głównych profesjonalnych programów do teoretycznego obliczania różnych parametrów termodynamicznych i elektronowych cząsteczek. Za jego pomocą można budować modele przestrzenne różnych związków, badać cechy ich struktury geometrycznej, określać kształt i energię orbitali molekularnych, charakter rozkładu gęstości elektronowej, momentu dipolowego itp. Wszystkie dane wyjściowe są dostarczane w postaci kolorowych rysunków, które następnie można wydrukować na drukarce, uzyskując wysokiej jakości obraz związków chemicznych pod wymaganymi kątami i rzutami. Zaletą programu jest możliwość rozważenia cząsteczki z różne imprezy zapoznać się z cechami jego struktury przestrzennej. Wydaje się to niezwykle ważne, ponieważ, jak pokazuje praktyka dydaktyczna, uczniowie zwykle nie formułują wyobrażeń o cząsteczkach jako strukturach przestrzennych. Tradycyjny obraz związków chemicznych w jednej płaszczyźnie prowadzi do utraty całego wymiaru i nie stymuluje rozwoju wyobraźni przestrzennej.
W kursie multimedialnym Chemia dla każdego» Wykorzystywany jest program - stereo demonstrator cząsteczek. Umożliwia dostarczanie obrazów wolumetrycznych cząsteczek składających się z atomów wodoru, tlenu, węgla i azotu. Do demonstracji wykorzystywane są modele szkieletowe cząsteczek. Modele można przesuwać, obracać, wyświetlać obrazy kilku różnych cząsteczek jednocześnie. Program pozwala na samodzielne tworzenie nowych modeli cząsteczek. W sumie podano modele 25 cząsteczek organicznych, jednak wartość dydaktyczna tych modeli jest niska, ponieważ modele są dostarczane wystarczająco proste połączenia, które każdy uczeń może zebrać za pomocą plasteliny i zapałek.
W programie zaimplementowano demonstracyjne modele orbitalno-łopatkowe 3D niektórych cząsteczek” Metoda wiązań walencyjnych: hybrydyzacja orbitali atomowych. A w programie Charakter wiązania chemicznego» wyjaśnia przyczyny powstania wiązania chemicznego na przykładzie powstawania cząsteczki wodoru z atomów. Oba te programy są zawarte w zestawie programów szkoleniowych” Chemia dla wszystkich - 2000».
Interaktywne makiety demonstracyjne wykorzystywane w programach ChemLand- 115 cząsteczek głównie związków organicznych, oraz " Chemia dla każdego”. Te dwa programy mają swoje plusy i minusy: w programie Chemistry for All modele mogą być wyświetlane na pełnym ekranie monitora, natomiast w programie ChemLand nie ma takiej funkcji, jednak program zawiera dużą liczbę cząsteczek. W ChemLand wykorzystywane są modele dynamiczne, które demonstrują przestrzenną strukturę cząsteczek z możliwością pomiaru kątów i długości wiązań, który pozwala nam prześledzić zmianę polaryzacji trójkątnej cząsteczki w zależności od rodzaju atomów.
Przy badaniu struktury molekuł i kryształów przydatne mogą być programy zaprojektowane bardziej do celów badawczych. To jest na przykład program CS Chem3D Pro, co pozwala tworzyć, modyfikować i wyświetlać trójwymiarową strukturę różnych cząsteczek. Również przydatny program Projektant kryształów, który ma na celu wizualizację trójwymiarowej struktury sieci krystalicznej. Programy te mogą być przydatne do tworzenia trójwymiarowych obrazów cząsteczek i kryształów oraz do demonstrowania ich w klasie przy użyciu komputera.
Program " złożyć molekułę”, choć gorsze w swoich możliwościach od powyższych programów, może być skutecznie wykorzystywane w indywidualnej pracy uczniów.
W programie zaimplementowano modele procesów i mechanizmów fizycznych i chemicznych” Chemia dla każdego”. Przedstawiono tutaj nieinteraktywne modele na temat „Dysocjacja elektrolityczna”: dysocjacja soli, kwasów, zasad, hydroliza soli. W tym samym programie zaimplementowano niektóre modele mechanizmów reakcji organicznych: bromowanie alkanów, estryfikacja, ogólny mechanizm reakcji polimeryzacji itp. Wszystkie modele mechanizmów reakcji są nieinteraktywne, wyświetlane na pełnym ekranie, posiadają dźwięk, brak jest natomiast tekstowego opisu zachodzących zjawisk, co znacznie ogranicza korzystanie z programu.
W wersji online interaktywnego podręcznika dla szkoły średniej z chemii organicznej dla klas X - XI, pod redakcją G. I. Deryabina, A. V. Solovov mechanizm wymiany i donor-akceptor tworzenia wiązań kowalencyjnych, mechanizmy homolityczne i heterolityczne rozszczepiania wiązania kowalencyjnego przedstawiono na przykładzie abstrakcji atomu wodoru z cząsteczki metanu, procesu hybrydyzacji sp. Bardzo interesujące są interaktywne modele demonstracyjne 3D cząsteczek organicznych oraz mechanizmy reakcji chemicznych: chlorowanie metanu i ogólny mechanizm substytucji nukleofilowej. Bardzo ważne jest, że podczas pracy z modelami można zmieniać ich położenie w przestrzeni, a dla mechanizmu reakcji można zmienić położenie punktu obserwacyjnego.
Kolejny program demonstrujący mechanizmy reakcji chemicznych, program Animacje reakcji organicznych. Zawiera 34 mechanizmy reakcji organicznych. Ponadto każdy mechanizm przedstawiony jest w postaci czterech wariantów modeli molekularnych: kulkowo-kijowego, trójwymiarowego oraz dwóch wariantów modeli orbitalno-łopatkowych. Jeden z wariantów modeli orbital-blade pokazuje zmianę orbitali zewnętrznych substratu w trakcie reakcji, a drugi substratu. Ułatwia to obserwowanie zmiany zewnętrznych orbitali reagentów podczas przebiegu reakcji. W razie potrzeby możesz skorzystać z materiału teoretycznego interaktywnego wielokanałowego narzędzia poznawczego. Rozwój studenci własnych...
Testy komputerowe
Testy >> Informatyka... metodologie ... uczenie się literatura... rozwój testy i testy. Skomputeryzowana technologia testowania powinna mieć następujące główne cechy: interaktywny ... mikroświaty); ... (szkoła ... ich stosowanie w ... modele / Instruktaż do Kurs wymiany ...
Filozofia i metodologia nauki
Przewodnik do nauki >> FilozofiaW dziedzinie biologii w uczenie się koewolucja różnych gatunek, ich struktury i poziomy organizacji... i ustalone. Stosowanie metody opierają się zewnętrznym ograniczeniom nałożonym na parametry badania. Modele realizacja...
Działalność społeczna i kulturalna (2)
Podręcznik >> Socjologia... ich nauka konserwacja, produkcja, rozwój, posługiwać się a w konsekwencji rozwój ... . Na uczenie się kurs, ... mikroświat ... modele i zakończenie Model ... interaktywny metody i technologie pedagogiczne. Wśród nich są prywatne metody... przedszkole, szkoła (...
Wysyłanie dobrej pracy do bazy wiedzy jest proste. Skorzystaj z poniższego formularza
Studenci, doktoranci, młodzi naukowcy korzystający z bazy wiedzy w swoich studiach i pracy będą Ci bardzo wdzięczni.
Nie ma jeszcze wersji HTML pracy.
Możesz pobrać archiwum pracy, klikając poniższy link.
Podobne dokumenty
Homologiczne serie metanu. Budowa cząsteczki metanu. Kąty między wszystkimi linkami. Właściwości fizyczne alkany. Laboratoryjne metody otrzymywania. Pozyskiwanie z soli kwasy karboksylowe. Rodzaje hybrydyzacji atomów węgla w alkanach. Izomeria strukturalna alkanów.
prezentacja, dodana 10.08.2014
Elektroniczny model cząsteczki. Teoria odpychania par elektronowych powłoki walencyjnej. Reaktywność cząsteczek. Klasyfikacja reakcji chemicznych. Stopnie swobody cząsteczki, ich ruch obrotowy. Opis symetrii oscylacji, ich wzajemne oddziaływanie.
prezentacja, dodano 15.10.2013
Charakterystyka budowy atomu. Wyznaczanie liczby protonów, elektronów, neutronów. Uwzględnienie wiązania chemicznego i polarności cząsteczki jako całości. Równania dysocjacji i stałe dysocjacji dla słabych elektrolitów. Reakcje redoks.
test, dodano 11.09.2015
Budowa cząsteczki, wiązania atomów i właściwości acetylenów jako substancje chemiczne. Specyfika otrzymywania alkinów metodą termolizy metanu i uwodornienia węgla w przemyśle oraz reakcji eliminacji w laboratorium. Reakcje alkinów z udziałem wiązania potrójnego.
prace kontrolne, dodane 08.05.2013
Główne postanowienia teoria klasyczna struktura chemiczna cząsteczki. Cechy decydujące o jego reaktywności. Homologiczny rad alkanów. Nomenklatura i izometria węglowodorów. Klasyfikacja związków organicznych zawierających tlen.
prezentacja, dodano 25.01.2017
Pierwiastek chemiczny to zbiór atomów tego samego typu. Odkrycie pierwiastków chemicznych. Rozmiary atomów i cząsteczek. Formy istnienia pierwiastków chemicznych. Trochę informacji o molekularnej i niemolekularnej budowie substancji. Doktryna atomowo-molekularna.
prezentacja, dodano 15.04.2012
Ogólna sekwencja obliczania struktury elektronowej cząsteczki metodą MO LCAO. Prosta metoda Hückla. Przykłady struktury molekularne dla metody MOX. Allil w metodzie MOX. Ogólne właściwości dystrybucja elektroniczna w systemie węglowodorowym Hückel.
Fizyczno-chemiczny model procesów zachodzących w mikrowyładowaniach anodowych
V.F. Borbat, Stany Zjednoczone Golovanova, AM Sizikow, Omsk Uniwersytet stanowy, Katedra Chemii Nieorganicznej
Warstwy tlenków powstające na anodach z aluminium, tytanu, tantalu i niektórych innych metali podczas przejścia prąd elektryczny pomiędzy elektrodami zanurzonymi w elektrolicie, w niektórych przypadkach mają wysokie właściwości ochronne i dielektryczne. Obecnie laboratoria w różnych krajach prowadzą znaczną ilość badań mających na celu stworzenie możliwości poprawy właściwości ochronnych i elektrycznych powłok anodowych, poszukiwanie optymalnych składów elektrolitów, poprawę technologiczności procesu i tak dalej. Praktyczne doświadczenie zgromadzone w ostatnim czasie w stosowaniu plazmowo-elektrolitowej obróbki anod do tworzenia powłok ochronnych znacznie przewyższyło teoretyczne koncepcje dostępne w tej dziedzinie.
W oparciu o literaturę i nasze dane eksperymentalne możemy przyjąć fizyczny model mikrowyładowania anodowego, którego główną ideą jest to, że mikrowyładowanie anodowe jest kombinacją przebicia iskrowego części barierowej warstwy tlenkowej i gazu wyładowanie w bańce gazowo-plazmowej, która pojawiła się po awarii. Rozważ zgodność proponowanego modelu wyniki eksperymentalne z uwzględnieniem sekwencji procesów.
Utlenianie. Podczas utleniania (przy stałym napięciu na elektrodach) powstają warstwy o grubości do setek mikronów. Wraz z powstawaniem nowych warstw tlenkowych zachodzi również proces ich rozpuszczania. Szereg badań wykazało, że w okresie przediskrowym narastania filmu tlenkowego aniony elektrolitu, takie jak jony siarczanowe, są zawarte w objętości tlenku. W filmach porowatych aniony pojawiają się w tlenku anodowym w wyniku mechanicznego „osadzenia” składników roztworu. O zawartości anionów zawartych w tlenku decyduje ich zdolność do adsorpcji na powierzchni osadu, a nawet tworzenia związków o składzie niestechiometrycznym.
Badając skład fazowy i pierwiastkowy powłok otrzymanych metodą obróbki plazmowo-elektrolitycznej stwierdzono, że tą metodą otrzymywania powłok do błony wprowadzane są jony siarczanowe. Ponadto rodzaj rejestrogramów sugeruje, że „zarabianie” składników elektrolitu następuje w miejscach, w których występują mikrowyładowania anodowe w czasie ich „gojenia”, dlatego rozkład składników elektrolitu na warstwie nie jest równomierny i różni się od rozkład w foliach otrzymanych metodą konwencjonalnego anodowania.
Przebicie jest złożonym procesem probabilistycznym, który może wystąpić w danym punkcie dielektryka w dość szerokim zakresie napięć i czasów. Najważniejszymi procesami początku rozpadu są zmiana ładunku kosmicznego w pobliżu katody (roztwór elektrolitu) i zwiększenie objętości wtrysku elektronów do pasma przewodnictwa warstewki dielektrycznej. Procesy te przyczyniają się do rozwoju awarii. Początek rozpadu związany jest z rozwojem lawin elektronowych. Jest całkiem prawdopodobne, że źródłem jonów pierwotnych mogą być poziomy zanieczyszczeń w tlenku. Taki mechanizm sugeruje szczególną rolę składników elektrolitu wprowadzanych do tlenku, głównie anionów. Dlatego możliwość uzyskania anodowych powłok iskrowych w dużej mierze zależy od składu roztworu. Elektrony, które wchodzą w pasmo przewodnictwa i są przyspieszane przez pole, uzyskują energię wystarczającą do wywołania uderzeniowej jonizacji atomów w tlenku. To ostatnie prowadzi do powstania lawin, które docierając do powierzchni metalu tworzą kanały rozpadu. Istnienie zależność liniowa Różnica między napięciem przebicia a grubością wskazuje na równomierność pola podczas przebicia i elektryczną naturę przebicia.
Zniszczenie powłoki tlenkowej - pod wpływem mikrowyładowań anodowych na roztworach kwasu siarkowego działanie przyspieszone pole elektryczne elektrony będą wystawione na działanie cząsteczek wody i kwasu siarkowego. W literaturze dostępne są dane dotyczące jonizacji tych roztworów. Na ich podstawie najbardziej prawdopodobnymi jonami w plazmie mikrowyładowań będą najprawdopodobniej jony o najniższych potencjałach wyglądu, tj. H2O+ należy spodziewać się w przypadku cząsteczek wody, H2SO4+ w przypadku kwasu siarkowego, a rzadziej HSO4+.
Tak więc procesy jonizacji i dysocjacyjnego przyłączania elektronów dają następujące jony pod działaniem mikrowyładowań na roztworach kwasu siarkowego (reakcje 1-5). e + H2O H2O+ + 2e (1), e + H2SO4 H2SO4+ + 2e (2), lub HSO4 + H+ + 2e (3), e + H2O OH + H- (4), e + H2SO4 H + HSO4- (5).
Jony dodatnie i ujemne powstałe w wyniku tych reakcji mają dwa różne sposoby przekształcania: 1) neutralizacja ładunków; 2) reakcje jonowo-cząsteczkowe. Rodniki powstałe w wyniku dysocjacji wzbudzonych cząstek i reakcji jonowo-molekularnych wchodzą w reakcje oderwania atomu H z cząsteczek w pęcherzyku gazu i w reakcję rekombinacji.
Po powstaniu rodników zachodzą reakcje oderwania atomu H: H(OH, HSO4) + H2SO4 H2(H2O, H2SO4) + HSO4 (6), H(HSO3) + H2O H2(H2SO3) + OH (7) oraz reakcje rekombinacji rodników : HSO4 + OH H2SO4 (8), HSO4 + HSO4 H2S2O8 (9), OH + OH H2O2 (10), H + HSO4 H2SO4 (11).
Powstawanie dwutlenku siarki jest możliwe w wyniku oddziaływania cząsteczek kwasu siarkowego wzbudzonych przez plazmę mikrowyładowania z sąsiednimi cząsteczkami: H2SO4* + H2SO4 H2SO3 + H2SO5 (12) lub możliwy jest również mechanizm: H2SO4* H2SO3 + O (13). Powstałe H2SO3 i H2SO5 pod wpływem wysokiej temperatury w strefie mikrowyładowania dysocjują termicznie według równań:
H2SO3 H2O + SO2 (14), 2H2SO5 2H2SO4 + 0,5 O2 (15).
Niektóre rodniki wychodzą poza pęcherzyk gazu mikrowyładowania do otaczającej go cieczy, gdzie wchodzą ze sobą w reakcje rekombinacji i reagują ze składnikami elektrolitu. Wydajność produktów w wyniku procesów zachodzących w warstwie przypęcherzykowej elektrolitu będzie zależeć od stężenia kwasu siarkowego (tj. od proporcji jonów obecnych w roztworach kwasu siarkowego o różnym stężeniu).
Zgodnie z zaproponowanym mechanizmem przemian chemicznych kwasu siarkowego, wraz ze wzrostem jego stężenia w roztworze, w przeciwnym razie, wraz ze wzrostem jego stężenia w pęcherzyku gazu mikrowyładowania, wzrasta liczba bezpośrednio zjonizowanych i wzbudzanych przez uderzenie elektronów siarki pojawią się cząsteczki kwasu. Ponieważ ze względu na niską jonizację przy energiach elektronów typowych dla wyładowania gazowego przemiany chemiczne substancji odbywają się głównie poprzez stany wzbudzone, to w przypadku narażenia na mikrowyładowania ze wzrostem stężenia kwasu siarkowego należy spodziewać się wzrostu w wydajności produktów, dla których prekursorem są wzbudzone cząstki.
Wraz ze wzrostem stężenia kwasu siarkowego (ponad 14M) proporcja cząsteczek kwasu siarkowego w pęcherzyku gazowo-plazmowym wzrasta odpowiednio, rozkład rozpuszczonej substancji następuje z powodu akcja bezpośrednia mikrowyładowania plazmowe. W przypadku roztworów kwasu siarkowego poniżej 14 M konwersja substancji rozpuszczonej następuje głównie w wyniku działania plazmy na rozpuszczalnik - działanie pośrednie. Zwiększa to prawdopodobieństwo reakcji 9,10,11,13 prowadzących do powstania stabilnej produkty molekularne: dwutlenek siarki i związki nadtlenkowe.
„Gojenie” porów - dalsze rozszerzanie się formacji plazmy dość szybko prowadzi do znacznego obniżenia temperatury tego ostatniego, a w konsekwencji do zmniejszenia stężenia nośników wyładowań, przerwania prądu i szybkiego ochłodzenia kanału . Zniknięcie pęcherzyka gazowo-plazmowego nastąpi po zgaszeniu wyładowania w nim gazu. Wiadomo, że wyładowanie gazowe zostanie wygaszone, gdy gęstość prądu w nim spadnie poniżej minimalnego dopuszczalnego poziomu dla samopodtrzymania wyładowania. W przypadku mikrowyładowań przyczyną spadku gęstości prądu wyładowania gazowego mogą być: 1) z czasem wyczerpywanie się warstwy przypęcherzykowej elektrolitu nośnikami prądu, przez co elektrolit nie jest w stanie zapewnić minimalna gęstość prądu pozwoliła na samopodtrzymanie wyładowania, a wyładowanie gazowe zanika; 2) wzrost wielkości pęcherzyka mikrowyładowania z powodu parowania otaczającej go cieczy; 3) topienie lub „gojenie” (poprzez anodowanie w plazmie gazowej) kanału przebicia w części barierowej warstewki tlenkowej. Krater powstały podczas pierwszego rozpadu zwykle dociera do powierzchni metalu. W tym momencie gęstość prądu staje się maksymalna ze względu na stosunkowo niską rezystancję elektrolitu w kraterze, co zapewnia szybki wygląd film tlenkowy (produkt reakcji plazmowo-chemicznej MexOy). Następuje „gojenie” miejsca przebicia, zwiększa się grubość warstwy tlenku, głównie w głębokości materiału podłoża.
Zatem na podstawie wyników eksperymentu i danych literaturowych zaproponowano mechanizm wpływu mikrowyładowania anodowego na roztwory kwasu siarkowego, który obejmuje następujące etapy:
Powstawanie wzbudzonych i zjonizowanych cząsteczek w bańce mikrowyładowania w wyniku przepływającego w nim wyładowania gazowego;
Przebieg reakcji z powstawaniem rodników i produktów molekularnych, których reakcje ze sobą iz materiałami wyjściowymi dają większość produktów końcowych;
Usuwanie dyfuzyjne powstałych rodników i innych cząstek poza pęcherzykiem gazu, których reakcje prowadzą do końcowych produktów molekularnych w warstwie bliskiej pęcherzyka elektrolitu.
Bibliografia
Bakovets V.V., Polyakov O.V., Dolgovesova I.P. Plazmowo-elektrolityczna obróbka anodowa metali // Nowosybirsk: Nauka, 1991. P.63-68.
Nagatant T., Yashinara S.T. Badania rozkładu jonów fragmentów i ich reakcji za pomocą spektrometru ładunku // J. Bull. chem. soc. Japonia, 1973. V.46. nr 5. P.1450-1454.
Mann M., Hastrulid A., Tate J. Jonizacja i dysocjacja pary wodnej i amoniaku przez uderzenie elektronów // J. Phys. Obrót silnika. 1980. V.58. s.340-347.
Iwanow Yu.A., Polak L.S. Rozkład energii elektronów w plazmie niskotemperaturowej // Chemia plazmy, Moskwa: Atomizdat, 1975. Wydanie. 2. C.161-198.
Do przygotowania tej pracy materiały ze strony http://www.omsu.omskreg.ru/