Mn u periodnom sistemu. Periodični sistem hemijskih elemenata
Pročitajte također
Devetnaesti vek u istoriji čovečanstva je vek u kome su reformisane mnoge nauke, uključujući i hemiju. U to vrijeme se pojavio Mendeljejevljev periodični sistem, a sa njim i periodični zakon. On je bio taj koji je postao osnova moderna hemija. Periodični sistem D.I. Mendeljejeva je sistematizacija elemenata koja utvrđuje zavisnost hemijskih i fizičkih svojstava o strukturi i naboju atoma supstance.
Priča
Početak periodičnog perioda dala je knjiga „Korelacija svojstava sa atomskom težinom elemenata“, napisana u trećoj četvrtini 17. veka. Prikazao je osnovne koncepte relativno dobro poznatih hemijski elementi(u to vrijeme bilo ih je samo 63). Štaviše, mnogi od njih atomske mase bili pogrešno definisani. To je uvelike ometalo otkriće D.I.
Dmitrij Ivanovič je započeo svoj rad upoređivanjem svojstava elemenata. Prije svega, radio je na hloru i kalijumu, a tek onda prešao na rad sa alkalnim metalima. Naoružan posebnim kartama na kojima su prikazani hemijski elementi, on je više puta pokušavao da sastavi ovaj "mozaik": polažući ga na svoj sto u potrazi za potrebnim kombinacijama i šibicama.
Nakon mnogo truda, Dmitrij Ivanovič je konačno pronašao obrazac koji je tražio i rasporedio elemente u periodične redove. Dobivši kao rezultat prazne ćelije između elemenata, naučnik je shvatio da ruskim istraživačima nisu poznati svi hemijski elementi i da je on taj koji ovom svetu mora dati znanje iz oblasti hemije koje mu još nije dao. prethodnici.

Svima je poznat mit da se periodni sistem Mendeljejevu pojavio u snu, a on je sakupio elemente iz sjećanja. unificirani sistem. Ovo je, grubo rečeno, laž. Činjenica je da je Dmitrij Ivanovič radio dosta dugo i koncentriran na svoj posao, i to ga je jako iscrpilo. Dok je radio na sistemu elemenata, Mendeljejev je jednom zaspao. Kada se probudio, shvatio je da nije završio sto i radije je nastavio da popunjava prazne ćelije. Njegov poznanik, izvjesni Inostrantsev, univerzitetski nastavnik, odlučio je da je periodni sistem sanjao Mendeljejev i proširio ovu glasinu među svojim studentima. Ovako je nastala ova hipoteza.
poznat
Mendeljejevljevi hemijski elementi su odraz periodičnog zakona koji je stvorio Dmitrij Ivanovič još u trećoj četvrtini 19. veka (1869). Godine 1869. na sastanku ruske hemijske zajednice pročitano je obaveštenje Mendeljejeva o stvaranju određene strukture. Iste godine objavljena je knjiga „Osnove hemije“, u kojoj je po prvi put objavljen Mendeljejevljev periodični sistem hemijskih elemenata. I u knjizi" Prirodni sistem elemente i njegovu upotrebu za označavanje kvaliteta neotkrivenih elemenata” D.I.

Struktura i pravila za postavljanje elemenata
Prve korake u stvaranju periodičnog zakona poduzeo je Dmitrij Ivanovič još 1869-1871. godine, tada je naporno radio na utvrđivanju ovisnosti svojstava ovih elemenata od mase njihovog atoma. Moderna verzija predstavlja elemente sažete u dvodimenzionalnoj tabeli.
Položaj elementa u tabeli nosi određeno hemijsko i fizičko značenje. Po lokaciji elementa u tabeli možete saznati koja je njegova valencija i odrediti druge hemijske karakteristike. Dmitrij Ivanovič je pokušao uspostaviti vezu između elemenata, kako sličnih svojstava tako i različitih.

Klasifikaciju tada poznatih hemijskih elemenata zasnovao je na valenciji i atomskoj masi. Upoređujući relativna svojstva elemenata, Mendeljejev je pokušao da pronađe obrazac koji bi ujedinio sve poznate hemijske elemente u jedan sistem. Raspoređujući ih na osnovu povećanja atomskih masa, on je ipak postigao periodičnost u svakom od redova.
Dalji razvoj sistema
Periodični sistem, koji se pojavio 1969. godine, dorađen je više puta. Sa pojavom plemenitih plinova 1930-ih, bilo je moguće otkriti novu ovisnost elemenata - ne o masi, već o atomskom broju. Kasnije je bilo moguće utvrditi broj protona u atomskim jezgrama, a pokazalo se da se poklapa sa atomskim brojem elementa. Naučnici 20. veka proučavali su elektronsku energiju. Ispostavilo se da i ona utiče na periodičnost. Ovo je uvelike promijenilo ideje o svojstvima elemenata. Ova se tačka odrazila u kasnijim izdanjima Mendeljejevljevog periodnog sistema. Svako novo otkriće svojstava i karakteristika elemenata organski se uklapa u tabelu.
Karakteristike Mendeljejevljevog periodnog sistema
Periodični sistem je podijeljen na periode (7 redova raspoređenih vodoravno), koji su, pak, podijeljeni na velike i male. Period počinje alkalnim metalom i završava se elementom nemetalnih svojstava.
Tabela Dmitrija Ivanoviča je vertikalno podijeljena u grupe (8 kolona). Svaki od njih u periodnom sistemu sastoji se od dvije podgrupe, i to glavne i sekundarne. Nakon duge rasprave, na prijedlog D.I.Mendeleeva i njegovog kolege U.Ramsaya, odlučeno je da se uvede tzv. Uključuje inertne gasove (neon, helijum, argon, radon, ksenon, kripton). Godine 1911. od naučnika F. Soddyja je zatraženo da stave nerazlučive elemente, takozvane izotope, u periodni sistem - za njih su dodijeljene zasebne ćelije.

Uprkos ispravnosti i tačnosti periodnog sistema, naučna zajednica dugo nije želela da prizna ovo otkriće. Mnogi veliki naučnici ismijavali su rad D.I. Mendeljejeva i vjerovali da je nemoguće predvidjeti svojstva elementa koji još nije bio otkriven. Ali nakon što su otkriveni navodni hemijski elementi (a to su bili, na primer, skandijum, galijum i germanijum), sistem Mendeljejeva i njegov periodični zakon postali su nauka o hemiji.
Sto u moderno doba
Mendeljejevljev periodni sistem elemenata je osnova većine hemijskih i fizičkih otkrića vezanih za atomsko-molekularnu nauku. Moderan koncept element je nastao upravo zahvaljujući velikom naučniku. Pojava Mendeljejevljevog periodičnog sistema uvela je fundamentalne promjene u ideje o razne veze I jednostavne supstance Oh. Stvaranje periodnog sistema od strane naučnika imalo je ogroman uticaj na razvoj hemije i svih nauka povezanih sa njom.
Verovatno ste svi videli periodni sistem elemenata. Moguće je da vas još uvijek proganja u snovima, ili je možda za sada samo vizualna pozadina koja ukrašava zid školski razred. Međutim, u ovoj naizgled nasumičnoj zbirci ćelija postoji mnogo više nego što se na prvi pogled čini.
Periodični sistem (ili PT, kako ćemo ga s vremena na vreme zvati u ovom članku), i elementi koji ga čine, imaju karakteristike koje možda nikada niste pretpostavili. Od kreiranja tabele do dodavanja konačnih elemenata u nju, evo deset činjenica koje većina ljudi ne zna.
10. Mendeljejev je dobio pomoć
Periodični sistem je u upotrebi od 1869. godine, kada ga je sastavio debelo bradati Dimitri Mendeljejev. Većina ljudi misli da je Mendeljejev bio jedini koji je radio na ovom stolu, i zahvaljujući tome postao je najsjajniji hemičar veka. Međutim, njegove napore je pomoglo nekoliko evropskih naučnika koji su dali važan doprinos upotpunjavanju ovog kolosalnog skupa elemenata.
Mendeljejev je nadaleko poznat kao otac periodni sistem, ali kada ga je sastavio, nisu svi elementi tabele već bili otvoreni. Kako je to postalo moguće? Naučnici su poznati po svom ludilu...
9. Najnovije dodate stavke

Vjerovali ili ne, periodni sistem se nije mnogo promijenio od 1950-ih. Međutim, 2. decembra 2016. dodana su četiri nova elementa odjednom: nihonijum (element br. 113), moscovium (element br. 115), tenesin (element br. 117) i oganeson (element br. 118). Ovi novi elementi dobili su imena tek u junu 2016. godine, jer je bio potreban petomjesečni pregled prije nego što su službeno dodani u PT.
Tri elementa su nazvana po gradovima ili državama u kojima su dobijeni, a Oganeson je dobio ime po ruskom nuklearnom fizičaru Juriju Oganesijanu za doprinos dobijanju ovog elementa.
8. Kojeg slova nema u tabeli?

Latinica ima 26 slova i svako od njih je važno. Međutim, Mendeljejev je odlučio da to ne primijeti. Pogledajte tabelu i recite mi koje je slovo nesretno? Savjet: tražite redom i savijte prste nakon svakog slova koje pronađete. Kao rezultat toga, naći ćete slovo „nedostaje“ (ako imate svih deset prstiju na rukama). Jeste li pogodili? Ovo je slovo broj 10, slovo "J".
Kažu da je „jedan“ broj usamljenih ljudi. Dakle, možda bismo slovo “J” trebali nazvati slovom samaca? Ali evo zabavne činjenice: većina dječaka rođenih u Sjedinjenim Državama 2000. godine dobila je imena koja počinju ovim slovom. Dakle, ovo pismo nije ostalo bez dužne pažnje.
7. Sintetizirani elementi

Kao što možda već znate, trenutno postoji 118 elemenata u periodnom sistemu. Možete li pogoditi koliko je od ovih 118 elemenata dobijeno u laboratoriji? Od svega opšta lista V prirodni uslovi može se pronaći samo 90 elemenata.
Mislite li da je 28 umjetno stvorenih elemenata puno? Pa, samo mi vjeruj na riječ. Sintetiziraju se od 1937. godine, a naučnici to rade i danas. Sve ove elemente možete pronaći u tabeli. Pogledajte elemente od 95 do 118, svi ovi elementi se ne nalaze na našoj planeti i sintetizirani su u laboratorijama. Isto važi i za elemente označene brojevima 43, 61, 85 i 87.
6. 137. element

Sredinom 20. vijeka, poznati naučnik po imenu Richard Feynman dao je prilično glasnu izjavu koja je šokirala sve. naučni svet naše planete. Prema njegovim riječima, ako ikada otkrijemo element 137, nećemo moći odrediti broj protona i neutrona u njemu. Broj 1/137 je značajan jer je vrijednost konstante fine strukture, koja opisuje vjerovatnoću da elektron apsorbira ili emituje foton. Teoretski, element #137 bi trebao imati 137 elektrona i 100 posto šanse da apsorbira foton. Njegovi elektroni će se rotirati brzinom svjetlosti. Još nevjerovatnije, elektroni elementa 139 moraju se okretati brže od brzine svjetlosti da bi postojali.
Jeste li umorni od fizike? Možda će vas zanimati da broj 137 spaja tri važna područja fizike: teoriju brzine svjetlosti, kvantnu mehaniku i elektromagnetizam. Od ranih 1900-ih, fizičari su spekulisali da bi broj 137 mogao biti osnova Velikog unificirana teorija, koji će obuhvatiti sve tri gore navedene oblasti. Doduše, ovo zvuči nevjerovatno kao i legende o NLO-ima i Bermudskom trouglu.
5. Šta možete reći o imenima?

Gotovo svi nazivi elemenata imaju neko značenje, iako nije odmah jasno. Imena novih elemenata se ne daju proizvoljno. Ja bih samo nazvao element prvom riječju koja mi je pala na pamet. Na primjer, "kerflump". Mislim da nije loše.
Tipično, nazivi elemenata spadaju u jednu od pet glavnih kategorija. Prva su imena poznatih naučnika, klasična verzija- einsteinium. Osim toga, elementi mogu dobiti svoja imena u zavisnosti od mjesta gdje su prvi put zabilježeni, na primjer germanij, americij, galijum, itd. dodatna opcija koriste se nazivi planeta. Element uranijum je prvi put otkriven ubrzo nakon što je otkriven planet Uran. Elementi mogu imati imena povezana s mitologijom, na primjer postoji titanijum, nazvan po drevnim grčkim titanima, i torijum, nazvan po nordijskom bogu groma (ili zvijezda "osvetnik", ovisno o tome šta više volite).
I na kraju, tu su imena koja opisuju svojstva elemenata. Argon dolazi od grčke riječi "argos", što znači "lijeni" ili "spori". Ime sugerira da ovaj plin nije aktivan. Brom je još jedan element čije ime dolazi od grčke riječi. "Bromos" znači "smrad" i prilično opisuje miris broma.
4. Da li je kreiranje tabele bio “eureka trenutak”?

ako voliš kartaške igre, onda je ova činjenica za vas. Mendeljejev je morao nekako urediti sve elemente i pronaći sistem za to. Naravno, da bi napravio tabelu kategorija, okrenuo se pasijansu (pa, šta još?) Mendeljejev je zapisao atomsku težinu svakog elementa na zasebnoj kartici, a zatim počeo da izlaže svoju naprednu igru pasijansa. On je rasporedio elemente prema njihovim specifičnim svojstvima, a zatim ih rasporedio u svaki stupac prema njihovoj atomskoj težini.
Mnogi ljudi ne mogu igrati obične pasijanse, tako da je ova igra pasijansa impresivna. Šta će se dalje dogoditi? Vjerovatno će neko uz pomoć šaha revolucionirati astrofiziku ili stvoriti raketu sposobnu da stigne do predgrađa galaksije. Čini se da u tome neće biti ništa neobično, s obzirom na to da je Mendeljejev mogao postići tako genijalan rezultat samo sa špilom običnih igraćih karata.
3. Nesretni plemeniti gasovi

Sjećate se kako smo argon klasifikovali kao najlijeniji i najsporiji element u istoriji našeg svemira? Čini se da su i Mendeljejeva obuzela ista osjećanja. Kada je 1894. prvi put dobijen čisti argon, on se nije uklapao ni u jednu kolonu tabele, pa je naučnik, umesto da traži rešenje, odlučio da jednostavno negira njegovo postojanje.
Što je još upečatljivije, argon nije bio jedini element koji je u početku doživio ovu sudbinu. Osim argona, pet drugih elemenata ostalo je neklasifikovano. To je uticalo na radon, neon, kripton, helijum i ksenon - i svi su poricali njihovo postojanje samo zato što Mendeljejev nije mogao da nađe mesto za njih u tabeli. Nakon nekoliko godina pregrupisavanja i reklasifikacije, ovi elementi (tzv inertnih gasova) je ipak imao dovoljno sreće da se pridruži dostojnom klubu koji je prepoznat kao stvarno postojeći.
2. Atomska ljubav

Savjet za sve one koji sebe smatraju romantičarima. Uzmite papirnu kopiju periodnog sistema i isecite sve komplikovane i relativno nepotrebne srednje kolone tako da vam ostane 8 kolona (imaćete "kratku" formu tabele). Presavijte ga u sredinu grupe IV - i saznat ćete koji elementi mogu formirati spojeve jedni s drugima.
Elementi koji se "ljube" kada su presavijeni mogu formirati stabilna jedinjenja. Ovi elementi imaju komplementarne elektronske strukture i kombinuju se jedni s drugima. A ako ovo nije prava ljubav, kao Romeo i Julija ili Šrek i Fiona, onda ne znam šta je ljubav.
1. Pravila ugljika

Carbon pokušava biti u centru igre. Mislite da znate sve o ugljiku, ali nije mnogo važnije nego što mislite. Jeste li znali da je prisutan u više od polovine svih poznatih jedinjenja? A šta je sa činjenicom da 20 posto težine svih živih organizama čini ugljik? Zaista je čudno, ali pripremite se: svaki atom ugljika u vašem tijelu nekada je bio dio frakcije ugljen-dioksid u atmosferi. Ugljik nije samo superelement naše planete, on je četvrti najzastupljeniji element u cijelom Univerzumu.
Ako je periodni sistem kao zabava, onda je ugljenik glavni domaćin. I čini se da je on jedini koji zna da sve pravilno organizuje. Pa, između ostalog, ovo je glavni element svih dijamanata, pa uz svu svoju nametljivost, i blista!
Otkriće periodnog sistema hemijskih elemenata od strane Dmitrija Mendeljejeva u martu 1869. bio je pravi proboj u hemiji. Ruski naučnik uspeo je da sistematizuje znanje o hemijskim elementima i predstavi ih u obliku tabele, koju školarci još uvek moraju da uče na časovima hemije. Periodični sistem je postao temelj za brzi razvoj ove složene i zanimljive nauke, a istorija njegovog otkrića obavijena je legendama i mitovima. Za sve one koji se zanimaju za nauku, bit će zanimljivo saznati istinu o tome kako je Mendeljejev otkrio tablicu periodičnih elemenata.
Istorija periodnog sistema: kako je sve počelo
Pokušaji klasifikacije i sistematizacije poznatih hemijskih elemenata učinjeni su mnogo prije Dmitrija Mendeljejeva. Takvi poznati naučnici kao što su Döbereiner, Newlands, Meyer i drugi predložili su svoje sisteme elemenata. Međutim, zbog nedostatka podataka o hemijskim elementima i njihovim tačnim atomskim masama, predloženi sistemi nisu bili sasvim pouzdani.
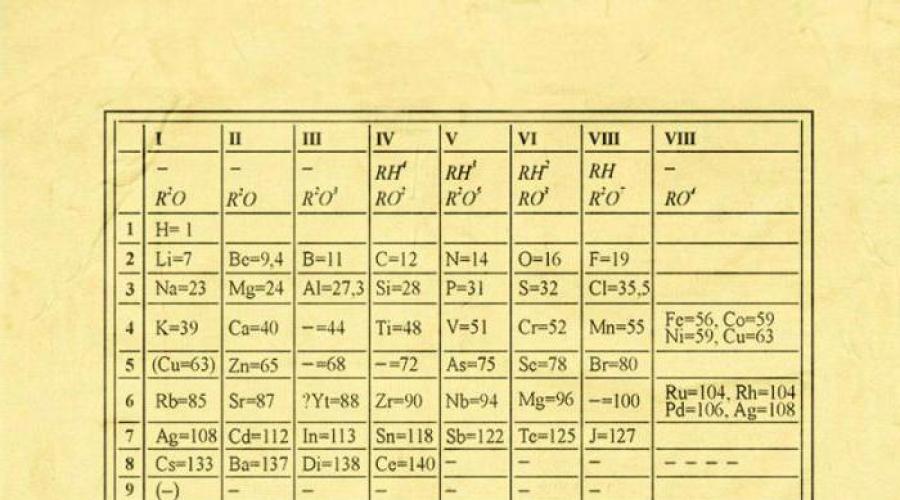
Istorija otkrića periodnog sistema počinje 1869. godine, kada je ruski naučnik na sastanku Ruskog hemijskog društva rekao svojim kolegama o svom otkriću. U tabeli koju je predložio naučnik, hemijski elementi su raspoređeni u zavisnosti od njihovih svojstava, obezbeđenih veličinom njihove molekularne težine.
Zanimljiva karakteristika periodnog sistema je i prisustvo praznih ćelija, koje su u budućnosti bile ispunjene otvorenim hemijskim elementima koje je naučnik predvideo (germanijum, galijum, skandijum). Od otkrića periodnog sistema, dodaci i amandmani su u njega učinjeni mnogo puta. Zajedno sa škotskim hemičarem Williamom Ramsayem, Mendeljejev je dodao grupu inertnih gasova (nulta grupa) na sto.
Nakon toga, istorija Mendeljejevljevog periodnog sistema bila je direktno povezana sa otkrićima u drugoj nauci - fizici. Rad na tabeli periodičnih elemenata nastavlja se do danas, a savremeni naučnici dodaju nove hemijske elemente kako budu otkriveni. Važnost periodnog sistema Dmitrija Mendeljejeva teško je precijeniti, jer zahvaljujući njemu:
- Sistematizovana su znanja o svojstvima već otkrivenih hemijskih elemenata;
- Postalo je moguće predvidjeti otkriće novih hemijskih elemenata;
- Počele su se razvijati grane fizike kao što su atomska fizika i nuklearna fizika;
Postoji mnogo opcija za prikazivanje hemijskih elemenata prema periodičnom zakonu, ali najpoznatija i najčešća opcija je periodična tablica poznata svima.
Mitovi i činjenice o stvaranju periodnog sistema
Najčešća zabluda u istoriji otkrića periodnog sistema je da ga je naučnik video u snu. Zapravo, sam Dmitrij Mendeljejev je opovrgao ovaj mit i izjavio da je godinama razmišljao o periodičnom zakonu. Da bi sistematizovao hemijske elemente, napisao je svaki od njih na posebnoj kartici i više puta ih kombinovao jedan s drugim, ređajući ih u redove u zavisnosti od njihovih sličnih svojstava.
Mit o „proročkom“ snu naučnika može se objasniti činjenicom da je Mendeljejev danima radio na sistematizaciji hemijskih elemenata, prekidan kratkim snom. Međutim, samo naporan rad i prirodni talenat naučnika dali su dugo očekivani rezultat i omogućili Dmitriju Mendeljejevu svjetsku slavu.
Mnogi učenici u školi, a ponekad i na fakultetu, primorani su da pamte ili barem grubo kreću po periodnom sistemu. Da bi to uradio, osoba ne samo da mora imati dobro pamćenje, ali i da razmišljaju logično, povezujući elemente u zasebne grupe i klase. Proučavanje tablice je najlakše za one ljude koji svoj mozak stalno održavaju u dobroj formi prolazeći obuku na BrainApps.
Svako ko je išao u školu sjeća se da je jedan od obaveznih predmeta za učenje bila hemija. Možda ti se sviđa, a možda i ne sviđa - nije važno. I vjerovatno je da je mnogo znanja iz ove discipline već zaboravljeno i ne koristi se u životu. Međutim, svi se vjerojatno sjećaju tabele hemijskih elemenata D.I. Za mnoge je to ostala raznobojna tablica, gdje su u svakom kvadratu ispisana određena slova koja označavaju nazive kemijskih elemenata. Ali ovdje nećemo govoriti o hemiji kao takvoj, već opisivati stotine hemijske reakcije i procese, ali mi ćemo vam reći kako se uopće pojavio periodni sistem - ova će priča biti zanimljiva svakoj osobi, a i svima onima koji su gladni zanimljivih i korisnih informacija.
Malo pozadine
Davne 1668. godine, izvanredni irski hemičar, fizičar i teolog Robert Boyle objavio je knjigu u kojoj su razobličeni mnogi mitovi o alhemiji iu kojoj je govorio o potrebi traženja nerazgradivih hemijskih elemenata. Naučnik je dao i njihovu listu, koja se sastojala od samo 15 elemenata, ali je priznao ideju da bi elemenata moglo biti više. To je postalo polazna tačka ne samo u potrazi za novim elementima, već i u njihovoj sistematizaciji.
Stotinu godina kasnije, francuski hemičar Antoine Lavoisier sastavio je novu listu koja je već uključivala 35 elemenata. Kasnije je utvrđeno da su njih 23 nerazgradiva. Ali potragu za novim elementima nastavili su naučnici širom svijeta. I glavna ulogaČuveni ruski hemičar Dmitrij Ivanovič Mendeljejev odigrao je ulogu u ovom procesu - on je bio prvi koji je iznio hipotezu da bi mogla postojati veza između atomske mase elemenata i njihove lokacije u sistemu.
Zahvaljujući mukotrpnom radu i poređenju hemijskih elemenata, Mendeljejev je uspeo da otkrije vezu između elemenata u kojoj oni mogu biti jedno, a njihova svojstva nisu nešto što se podrazumeva, već predstavljaju fenomen koji se periodično ponavlja. Kao rezultat toga, u februaru 1869. Mendeljejev je formulisao prvi periodični zakon, a već u martu njegov izveštaj „Odnos svojstava sa atomskom težinom elemenata“ predstavio je Ruskom hemijskom društvu istoričar hemije N. A. Menšutkin. Potom je iste godine objavljena Mendeljejevljeva publikacija u časopisu “Zeitschrift fur Chemie” u Njemačkoj, a 1871. drugi njemački časopis “Annalen der Chemie” objavio je novu obimnu publikaciju naučnika posvećenu njegovom otkriću.
Kreiranje periodnog sistema

Do 1869. Mendeljejev je već formirao glavnu ideju i to za prilično kratko vrijeme, ali dugo vremena nije mogao da je formalizira u bilo koji uređeni sistem koji bi jasno pokazao šta je šta. U jednom od razgovora sa kolegom A.A.Inostrancevom, čak je rekao da mu je sve već urađeno u glavi, ali nije mogao sve da složi. Nakon toga, prema Mendeljejevljevim biografima, počeo je mukotrpan rad na svom stolu, koji je trajao tri dana bez pauze za spavanje. Pokušavali su na razne načine da organizuju elemente u tabelu, a posao je bio komplikovan i činjenicom da u to vreme nauka još nije znala za sve hemijske elemente. Ali, uprkos tome, tabela je ipak kreirana, a elementi sistematizovani.
Legenda o snu Mendeljejeva
Mnogi su čuli priču da je D.I. Mendeljejev sanjao o svom stolu. Ovu verziju je aktivno širio pomenuti Mendeljejevljev saradnik A. A. Inostrantsev kao smijesna prica kojim je zabavljao svoje učenike. Rekao je da je Dmitrij Ivanovič otišao u krevet i u snu jasno vidio svoj sto, u kojem su raspoređeni svi hemijski elementi. u pravom redosledu. Nakon toga, studenti su se čak našalili da je na isti način otkrivena i votka od 40°. Ali još su postojali stvarni preduslovi za priču sa snom: kao što je već pomenuto, Mendeljejev je radio za stolom bez sna i odmora, a Inostrancev ga je jednom zatekao umornog i iscrpljenog. Tokom dana, Mendeljejev je odlučio da se nakratko odmori, a nešto kasnije se naglo probudio, odmah uzeo komad papira i nacrtao na njemu gotov sto. Ali sam naučnik je opovrgao cijelu ovu priču sa snom, rekavši: „Razmišljao sam o tome, možda dvadeset godina, a vi mislite: sjedio sam i odjednom je... spremno je.” Dakle, legenda o snu može biti vrlo privlačna, ali stvaranje stola bilo je moguće samo napornim radom.

Dalji rad
Između 1869. i 1871. Mendeljejev je razvio ideje periodičnosti kojima je naučna zajednica bila sklona. I jedan od važne faze ovaj proces postojalo je shvatanje koje svaki element u sistemu treba da ima, na osnovu ukupnosti njegovih svojstava u poređenju sa svojstvima drugih elemenata. Na osnovu toga, a također i oslanjajući se na rezultate istraživanja promjena u oksidima koji stvaraju staklo, kemičar je uspio izvršiti korekcije vrijednosti atomskih masa nekih elemenata, uključujući uran, indijum, berilijum i druge.
Mendeljejev je, naravno, želeo brzo da popuni prazne ćelije koje su ostale u tabeli, a 1870. je predvideo da će uskoro biti otkriveni hemijski elementi nepoznati nauci, čije je atomske mase i svojstva mogao da izračuna. Prvi od njih bili su galijum (otkriven 1875.), skandij (otkriven 1879.) i germanijum (otkriven 1885.). Tada su predviđanja nastavljena da se ostvaruju, a otkriveno je još osam novih elemenata, uključujući: polonijum (1898), renijum (1925), tehnecijum (1937), francijum (1939) i astatin (1942-1943). Inače, 1900. godine D.I. Mendelejev i škotski hemičar William Ramsay su došli do zaključka da bi tabela trebala uključivati i elemente nulte grupe - do 1962. zvali su se inertni plinovi, a nakon toga - plemeniti plinovi.
Organizacija periodnog sistema
Hemijski elementi u tabeli D.I. Mendeljejeva su raspoređeni u redove, u skladu sa povećanjem njihove mase, a dužina redova je odabrana tako da elementi u njima imaju slična svojstva. Na primjer, plemeniti gasovi kao što su radon, ksenon, kripton, argon, neon i helijum teško reaguju sa drugim elementima i takođe imaju nisku hemijsku reaktivnost, zbog čega se nalaze u krajnjem desnom stubu. I elementi u lijevom stupcu (kalijum, natrijum, litijum, itd.) dobro reaguju sa drugim elementima, a same reakcije su eksplozivne. Jednostavno rečeno, unutar svake kolone elementi imaju slična svojstva koja variraju od kolone do kolone. Svi elementi do br. 92 nalaze se u prirodi, a od br. 93. počinju vještačkih elemenata, koji se može stvoriti samo u laboratorijskim uslovima.
U svojoj originalnoj verziji periodični sistem je shvaćen samo kao odraz poretka koji postoji u prirodi i nije bilo objašnjenja zašto bi sve tako trebalo da bude. I to tek kada se pojavila kvantna mehanika, pravo značenje redosleda elemenata u tabeli postalo je jasno.
Lekcije u kreativnom procesu
Pričamo o tome koje lekcije kreativni proces može izvući iz čitave istorije stvaranja periodnog sistema od strane D.I. Mendeljejeva, možemo navesti kao primer ideje engleskog istraživača u ovoj oblasti kreativno razmišljanje Graham Wallace i francuski naučnik Henri Poincaré. Recimo ih ukratko.
Prema studijama Poincaréa (1908) i Grahama Wallacea (1926), postoje četiri glavne faze kreativnog mišljenja:
- Priprema– faza formulisanja glavnog problema i prvi pokušaji njegovog rješavanja;
- Inkubacija– faza tokom koje dolazi do privremenog odvraćanja od procesa, ali se rad na pronalaženju rješenja problema odvija na podsvjesnom nivou;
- Insight– faza u kojoj se nalazi intuitivno rješenje. Štaviše, ovo rješenje se može naći u situaciji koja nije u potpunosti povezana s problemom;
- Ispitivanje– faza testiranja i implementacije rješenja, u kojoj se ovo rješenje testira i mogući dalji razvoj.
Kao što vidimo, Mendeljejev je u procesu kreiranja svoje tabele intuitivno pratio upravo ove četiri faze. Koliko je to efektivno može se suditi po rezultatima, tj. činjenicom da je tabela kreirana. A s obzirom da je njegovo stvaranje predstavljalo ogroman korak naprijed ne samo za kemijsku nauku, već i za cijelo čovječanstvo, gore navedene četiri faze mogu se primijeniti i na implementaciju mali projekti, te implementaciji globalnih planova. Glavna stvar koju treba zapamtiti je da se ni jedno otkriće, niti jedno rješenje problema ne može pronaći samo po sebi, ma koliko željeli da ih vidimo u snu i koliko god spavali. Da bi nešto uspjelo, bez obzira radi li se o izradi tablice kemijskih elemenata ili izradi novog marketinškog plana, potrebno je imati određena znanja i vještine, kao i vješto koristiti svoj potencijal i vrijedno raditi.
Želimo Vam uspjeh u Vašim nastojanjima i uspješnu realizaciju Vaših planova!
Čak i u školi, sjedeći na časovima hemije, svi se sjećamo stola na zidu učionice ili hemijske laboratorije. Ova tabela sadržavala je klasifikaciju svih hemijskih elemenata poznatih čovečanstvu, onih osnovnih komponenti koje čine Zemlju i ceo Univerzum. Tada to nismo mogli ni pomisliti Tabela Mendeljejeva je nesumnjivo jedan od najvećih naučnim otkrićima, koji je temelj našeg savremeno znanje o hemiji.
Periodni sistem hemijskih elemenata D. I. Mendeljejeva
Na prvi pogled njena ideja izgleda varljivo jednostavno: organizirati hemijski elementi redoslijedom povećanja težine njihovih atoma. Štoviše, u većini slučajeva ispada da su kemijski i fizička svojstva svaki element je sličan svom prethodnom elementu u tabeli. Ovaj obrazac se pojavljuje za sve elemente osim prvih nekoliko, jednostavno zato što ispred sebe nemaju elemente slične sebi po atomskoj težini. Zahvaljujući otkriću ove osobine možemo postaviti linearni niz elemenata u tabelu slično zidnom kalendaru i tako kombinovati ogroman broj vrsta hemijskih elemenata u jasnom i koherentnom obliku. Naravno, danas koristimo koncept atomskog broja (broj protona) kako bismo uredili sistem elemenata. To je pomoglo u rješavanju tzv tehnički problem“par permutacija”, međutim, nije doveo do fundamentalne promjene u izgledu periodnog sistema.
IN periodni sistem svi elementi su poredani na osnovu njihovog atomskog broja, elektronske konfiguracije i ponavljajućih hemijskih svojstava. Redovi u tabeli se zovu periodi, a kolone grupe. Prva tabela, koja datira iz 1869. godine, sadržavala je samo 60 elemenata, ali je sada ta tabela morala biti proširena kako bi primila 118 elemenata koje danas poznajemo.
Mendeljejevljev periodni sistem sistematizira ne samo elemente, već i njihova najrazličitija svojstva. Hemičaru je često dovoljno da ima periodni sistem pred očima kako bi tačno odgovorio na mnoga pitanja (ne samo ispitna, već i naučna).
YouTube ID 1M7iKKVnPJE je nevažeći.
Periodični zakon
Postoje dvije formulacije periodični zakon hemijski elementi: klasični i moderni.
Klasični, kako ga je predstavio njegov otkrivač D.I. Mendeljejev: svojstva jednostavnih tijela, kao i oblici i svojstva spojeva elemenata, periodično ovise o vrijednostima atomskih težina elemenata.
Moderno: svojstva jednostavnih supstanci, kao i svojstva i oblici spojeva elemenata, periodično ovise o naboju jezgra atoma elemenata (redni broj).
Grafički prikaz periodnog zakona je periodični sistem elemenata, koji predstavlja prirodna klasifikacija hemijskih elemenata, zasnovanih na redovnim promenama svojstava elemenata u zavisnosti od naelektrisanja njihovih atoma. Najčešće slike periodnog sistema elemenata su D.I. Mendeljejevljevi oblici su kratki i dugi.

Grupe i periodi periodnog sistema
U grupama nazivaju se vertikalni redovi u periodnom sistemu. U grupama, elementi se kombinuju po atributima najviši stepen oksidacija u oksidima. Svaka grupa se sastoji od glavne i sekundarne podgrupe. Glavne podgrupe uključuju elemente malih perioda i elemente velikih perioda sa istim svojstvima. Bočne podgrupe se sastoje samo od elemenata velikih perioda. Hemijska svojstva elemenata glavne i sekundarne podgrupe značajno se razlikuju.
Period naziva se horizontalni red elemenata raspoređenih u rastućem redoslijedu atomskih (atomskih) brojeva. U periodičnom sistemu postoji sedam perioda: prvi, drugi i treći period se nazivaju malim, sadrže 2, 8 i 8 elemenata; preostali periodi se nazivaju velikim: u četvrtom i petom periodu ima 18 elemenata, u šestom - 32, au sedmom (još nije završeno) - 31 element. Svaki period, osim prvog, počinje alkalnim metalom i završava se plemenitim gasom.
Fizičko značenje serijskog broja hemijski element: broj protona u atomskom jezgru i broj elektrona koji kruže oko atomsko jezgro, jednaki su rednom broju elementa.
Osobine periodnog sistema
Podsjetimo to grupe nazivaju se vertikalni redovi u periodnom sistemu i Hemijska svojstva elementi glavne i sekundarne podgrupe značajno se razlikuju.
Svojstva elemenata u podgrupama prirodno se mijenjaju od vrha do dna:
- se intenziviraju metalna svojstva a nemetalne slabe;
- atomski radijus se povećava;
- povećava se snaga baza i kiselina bez kisika koje stvara element;
- elektronegativnost se smanjuje.
Svi elementi osim helijuma, neona i argona formiraju jedinjenja kiseonika; U periodnom sistemu su često prikazani opšte formule, koji se nalazi ispod svake grupe u rastućem redosledu oksidacionog stanja elemenata: R 2 O, RO, R 2 O 3, RO 2, R 2 O 5, RO 3, R 2 O 7, RO 4, gde je simbol R označava element ove grupe. Formule viših oksida primjenjuju se na sve elemente grupe, osim u izuzetnim slučajevima kada elementi ne pokazuju oksidacijsko stanje jednako broju grupe (na primjer, fluor).
Oksidi sastava R 2 O pokazuju jaka bazična svojstva, a njihova bazičnost raste sa povećanjem atomskog broja oksidi sastava RO (sa izuzetkom BeO) pokazuju bazna svojstva. Oksidi sastava RO 2, R 2 O 5, RO 3, R 2 O 7 pokazuju kisela svojstva, a njihova kiselost raste sa povećanjem atomskog broja.
Elementi glavnih podgrupa, počevši od grupe IV, formiraju gasovita vodonikova jedinjenja. Postoje četiri oblika takvih spojeva. Oni se nalaze ispod elemenata glavnih podgrupa i predstavljeni su opštim formulama u nizu RH 4, RH 3, RH 2, RH.
RH 4 jedinjenja su neutralna po prirodi; RH 3 - slabo bazičan; RH 2 - blago kiselo; RH - jako kiselog karaktera.
Podsjetimo to period naziva se horizontalni red elemenata raspoređenih u rastućem redoslijedu atomskih (atomskih) brojeva.
U periodu sa povećanjem serijskog broja elementa:
- povećava se elektronegativnost;
- metalna svojstva se smanjuju, nemetalna svojstva se povećavaju;
- atomski radijus se smanjuje.

Elementi periodnog sistema
Alkalni i zemnoalkalni elementi
To uključuje elemente iz prve i druge grupe periodnog sistema. Alkalni metali iz prve grupe - meki metali, srebrne boje, lako se režu nožem. Svi oni imaju jedan elektron u svojoj vanjskoj ljusci i savršeno reagiraju. Zemnoalkalni metali iz druge grupe takođe imaju srebrnastu nijansu. Dva elektrona su postavljena na vanjskom nivou, i, shodno tome, ovi metali manje reagiraju s drugim elementima. U poređenju sa alkalnim metalima, zemnoalkalni metali se tope i ključaju na višim temperaturama.
Prikaži/sakrij tekst
Lantanidi (retkozemni elementi) i aktinidi
Lantanidi- grupa elemenata izvorno pronađenih u rijetkim mineralima; otuda njihov naziv "retki zemljani" elementi. Kasnije se ispostavilo da ovi elementi nisu tako rijetki kao što se u početku mislilo, pa je ime lantanidi dato rijetkim zemnim elementima. Lantanidi i aktinidi zauzimaju dva bloka, koji se nalaze ispod glavne tabele elemenata. Obje grupe uključuju metale; svi lantanidi (osim prometija) su neradioaktivni; aktinidi su, naprotiv, radioaktivni.
Prikaži/sakrij tekst
Halogeni i plemeniti gasovi
Halogeni i plemeniti gasovi su grupisani u grupe 17 i 18 periodnog sistema. Halogeni su nemetalni elementi, svi imaju sedam elektrona u svojoj vanjskoj ljusci. IN plemenitih gasova Svi elektroni se nalaze u vanjskoj ljusci, tako da jedva učestvuju u formiranju spojeva. Ovi gasovi se nazivaju „plemenitim“ gasovima jer retko reaguju sa drugim elementima; to jest, oni se odnose na pripadnike plemićke kaste koji su tradicionalno izbjegavali druge ljude u društvu.
Prikaži/sakrij tekst
Prijelazni metali
Prijelazni metali zauzimaju grupe 3-12 u periodnom sistemu. Većina njih je gusta, tvrda, sa dobrom električnom i toplotnom provodljivošću. Njihovi valentni elektroni (uz pomoć kojih su povezani sa drugim elementima) nalaze se u nekoliko elektronskih ljuski.
Prikaži/sakrij tekst
| Prijelazni metali |
| Scandium Sc 21 |
| Titan Ti 22 |
| Vanadijum V 23 |
| Chrome Cr 24 |
| Mangan Mn 25 |
| Gvožđe Fe 26 |
| Cobalt Co 27 |
| Nikl Ni 28 |
| Bakar Cu 29 |
| Cink Zn 30 |
| Itrijum Y 39 |
| Cirkonijum Zr 40 |
| Niobijum Nb 41 |
| Molibden Mo 42 |
| Tehnecij Tc 43 |
| Rutenijum Ru 44 |
| Rodijum Rh 45 |
| Paladij Pd 46 |
| Srebro Ag 47 |
| Kadmijum Cd 48 |
| Lutecij Lu 71 |
| Hafnij Hf 72 |
| Tantal Ta 73 |
| Tungsten W 74 |
| Renijum Re 75 |
| Osmijum Os 76 |
| Iridijum Ir 77 |
| Platinum Pt 78 |
| Zlato Au 79 |
| Merkur Hg 80 |
| Lawrence Lr 103 |
| Rutherfordium Rf 104 |
| Dubnium Db 105 |
| Seaborgium Sg 106 |
| Borijum Bh 107 |
| Hassiy Hs 108 |
| Meitnerium Mt 109 |
| Darmstadt Ds 110 |
| Rendgen Rg 111 |
| Copernicium Cn 112 |
Metaloidi
Metaloidi zauzimaju grupe 13-16 periodnog sistema. Metaloidi kao što su bor, germanijum i silicijum su poluprovodnici i koriste se za proizvodnju kompjuterski čipovi i naknade.
Prikaži/sakrij tekst
Post-tranzicijski metali
Elementi pozvani post-tranzicijskih metala, pripadaju grupama 13-15 periodnog sistema. Za razliku od metala, nemaju sjaj, već imaju mat boju. U poređenju sa prelaznim metalima, metali posle tranzicije su mekši i imaju više niske temperature topljenje i ključanje, veća elektronegativnost. Njihovi valentni elektroni, kojima pričvršćuju druge elemente, nalaze se samo na vanjskoj elektronskoj ljusci. Elementi post-tranzicijske metal grupe imaju mnogo više visoke temperature tačka ključanja od metaloida.
Sada konsolidirajte svoje znanje gledajući video o periodnom sistemu i još mnogo toga.
Odlično, prvi korak na putu ka znanju je napravljen. Sada ste manje-više orijentisani u periodnom sistemu i ovo će vam biti od velike koristi, jer je periodični sistem Mendeljejeva osnova na kojoj stoji ova neverovatna nauka.