Mga probisyon sa impormasyon at pamamaraan para sa pagpapabuti ng pamamahala ng mga makabagong aktibidad. Pagpapabuti ng pamamahala ng mga makabagong aktibidad ng organisasyon. pang-organisasyon at pang-ekonomiya - naglalaman ng mga isyung nauugnay sa pagpaplano ng headcount at
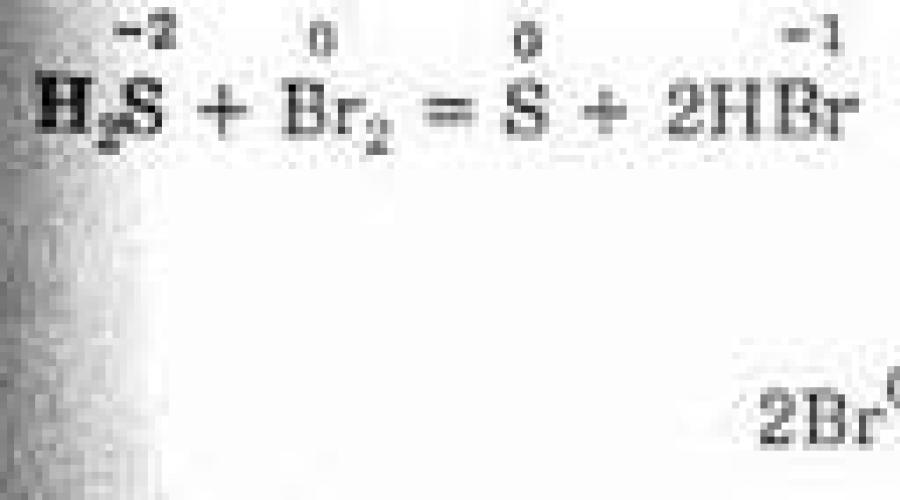
Basahin din
Ang fluorine ay maaari lamang maging isang oxidizing agent, na madaling ipinaliwanag sa pamamagitan ng posisyon nito sa periodic system ng mga elemento ng kemikal ng D. I. Mendeleev. Ito ang pinakamalakas na ahente ng oxidizing, na nag-o-oxidize kahit na ilang mga marangal na gas:
2F 2 +Xe=XeF 4
Ang mataas na aktibidad ng kemikal ng fluorine ay dapat ipaliwanag
Ngunit ang pagkasira ng isang molekula ng fluorine ay nangangailangan ng mas kaunting enerhiya kaysa sa inilabas nito sa panahon ng pagbuo ng mga bagong bono.
Kaya, dahil sa maliit na radius ng fluorine atom, ang hindi nakabahaging mga pares ng electron sa fluorine molecule ay nagbanggaan at humihina.
Ang mga halogens ay nakikipag-ugnayan sa halos lahat ng mga simpleng sangkap.
1. Ang reaksyon sa mga metal ay nagpapatuloy nang mas masigla. Kapag pinainit, nakikipag-ugnayan ang fluorine sa lahat ng metal (kabilang ang ginto at platinum); sa malamig ay tumutugon sa mga alkali na metal, tingga, bakal. Sa tanso, nikel, ang reaksyon ay hindi nagpapatuloy sa malamig, dahil ang isang proteksiyon na layer ng fluoride ay nabuo sa ibabaw ng metal, na nagpoprotekta sa metal mula sa karagdagang oksihenasyon.
Masiglang tumutugon ang klorin sa mga metal na alkali, at sa tanso, bakal at lata, nagpapatuloy ang reaksyon kapag pinainit. Ang bromine at yodo ay kumikilos nang magkatulad.
Ang pakikipag-ugnayan ng mga halogens sa mga metal ay isang exothermic na proseso at maaaring ipahayag sa pamamagitan ng equation:
2M + nHaI 2 \u003d 2MHaI DH<0
Ang mga metal halides ay karaniwang mga asin.
Ang mga halogen sa reaksyong ito ay nagpapakita ng malakas na mga katangian ng pag-oxidizing. Sa kasong ito, ang mga metal na atom ay nagbibigay ng mga electron, at ang mga halogen atom ay tumatanggap, halimbawa:
2. Sa ilalim ng normal na mga kondisyon, ang fluorine ay tumutugon sa hydrogen sa dilim na may isang pagsabog. Ang pakikipag-ugnayan ng chlorine sa hydrogen ay nagpapatuloy sa maliwanag na sikat ng araw.
Ang bromine at hydrogen ay nakikipag-ugnayan lamang kapag pinainit, at ang iodine at hydrogen ay tumutugon kapag pinainit nang malakas (hanggang sa 350°C), ngunit ang prosesong ito ay nababaligtad.
H 2 + Cl 2 \u003d 2HCl H 2 + Br 2 \u003d 2HBr
H 2 + I 2 "350 ° 2HI
Ang halogen sa reaksyong ito ay ang oxidizing agent.
Ipinakita ng mga pag-aaral na ang reaksyon ng pakikipag-ugnayan ng hydrogen sa chlorine sa liwanag ay may sumusunod na mekanismo.
Ang molekula ng Cl 2 ay sumisipsip ng isang light quantum hv at nabubulok sa mga di-organikong radikal na Cl . . Ito ang nagsisilbing simula ng reaksyon (ang unang paggulo ng reaksyon). Pagkatapos ay nagpatuloy ito sa sarili. Ang chlorine radical na Cl. tumutugon sa isang molekula ng hydrogen. Sa kasong ito, isang hydrogen radical H. at HCl ay nabuo. Sa turn, ang hydrogen radical na H. ay tumutugon sa molekula ng Cl 2, na bumubuo ng Hcl at Cl. atbp.
Cl 2 +hv=Cl. +Cl.
Cl. + H 2 \u003d Hcl + H.
N. + Cl 2 \u003d Hcl + C1.
Ang paunang paggulo ay nagdulot ng sunud-sunod na reaksyon. Ang ganitong mga reaksyon ay tinatawag na chain reactions. Ang resulta ay hydrogen chloride.
3. Ang mga halogen ay hindi direktang nakikipag-ugnayan sa oxygen at nitrogen.
4. Ang mga halogen ay mahusay na tumutugon sa iba pang hindi metal, halimbawa:
2P + 3Cl 2 \u003d 2PCl 3 2P + 5Cl 2 \u003d 2PCl 5 Si + 2F 2 \u003d SiF 4
Ang mga halogens (maliban sa fluorine) ay hindi tumutugon sa mga inert na gas. Ang aktibidad ng kemikal ng bromine at yodo na may paggalang sa mga di-metal ay hindi gaanong binibigkas kaysa sa fluorine at chlorine.
Sa lahat ng mga reaksyon sa itaas, ang mga halogens ay nagpapakita ng mga katangian ng oxidizing.
Pakikipag-ugnayan ng mga halogens sa mga kumplikadong sangkap. 5. Sa tubig.
Ang fluorine ay sumasabog na tumutugon sa tubig upang bumuo ng atomic oxygen:
H 2 O + F 2 \u003d 2HF + O
Ang natitirang mga halogens ay tumutugon sa tubig ayon sa sumusunod na pamamaraan:
Gal 0 2 + H 2 O "NGal -1 + NGal +1 O
Ang reaksyong ito ay isang disproportionation reaction kapag ang halogen ay parehong reducing agent at oxidizing agent, halimbawa:
Cl 2 + H 2 O "HCl + HClO
Cl 2 + H 2 O "H + + Cl - + HClO
Сl°+1e - ®Сl - Cl°-1e - ®Сl +
kung saan ang HCl ay isang malakas na hydrochloric acid; HClO - mahina hypochlorous acid
6. Ang mga halogen ay nakakakuha ng hydrogen mula sa iba pang mga sangkap, turpentine + C1 2 = HC1 + carbon

Pinapalitan ng klorin ang hydrogen sa mga saturated hydrocarbon: CH 4 + Cl 2 \u003d CH 3 Cl + HCl
at pinagsasama ang mga unsaturated compound:
C 2 H 4 + Cl 2 \u003d C 2 H 4 Cl 2
7. Ang reaktibiti ng mga halogens ay bumababa sa seryeng F-Cl - Br - I. Samakatuwid, ang nakaraang elemento ay inilipat ang susunod mula sa mga acid ng uri ng NG (G - halogen) at ang kanilang mga asing-gamot. Sa kasong ito, bumababa ang aktibidad: F 2 > Cl 2 > Br 2 > I 2

Aplikasyon
Ang chlorine ay ginagamit upang disimpektahin ang inuming tubig, pagpapaputi ng mga tela at pulp ng papel. Ang malalaking halaga nito ay natupok upang makagawa ng hydrochloric acid, bleach, atbp. Ang Fluorine ay natagpuan ang malawak na aplikasyon sa synthesis ng mga polymer na materyales - fluoroplastics, na may mataas na paglaban sa kemikal, at bilang isang oxidizer para sa rocket fuel. Ang ilang mga fluorine compound ay ginagamit sa gamot. Ang bromine at yodo ay malakas na ahente ng oxidizing at ginagamit sa iba't ibang synthesis at pagsusuri ng mga sangkap.
Malaking dami ng bromine at yodo ang ginagamit sa paggawa ng mga gamot.
Hydrogen halides
Ang mga compound ng mga halogen na may hydrogen HX, kung saan ang X ay anumang halogen, ay tinatawag na hydrogen halides. Dahil sa mataas na electronegativity ng mga halogens, ang nagbubuklod na pares ng elektron ay inilipat patungo sa kanila, kaya ang mga molekula ng mga compound na ito ay polar.
Ang hydrogen halides ay mga walang kulay na gas na may masangsang na amoy at madaling natutunaw sa tubig. Sa 0°C, i-dissolve ang 500 volume ng HCl, 600 volume ng HBr, at 450 volume ng HI sa 1 volume ng tubig. Ang hydrogen fluoride ay nahahalo sa tubig sa anumang ratio. Ang mataas na solubility ng mga compound na ito sa tubig ay ginagawang posible upang makakuha ng puro
Talahanayan 16. Degrees ng dissociation ng hydrohalic acids
mga solusyon sa paliguan. Kapag natunaw sa tubig, ang hydrogen halides ay naghihiwalay bilang mga acid. Ang HF ay kabilang sa mga mahinang dissociated compound, na ipinaliwanag ng espesyal na lakas ng bono sa malamig. Ang natitirang mga solusyon ng hydrogen halides ay kabilang sa mga malakas na acid.
HF - hydrofluoric (hydrofluoric) acid HC1 - hydrochloric (hydrochloric) acid HBr - hydrobromic acid HI - hydroiodic acid
Ang lakas ng mga acid sa seryeng HF - HCl - HBr - HI ay tumataas, na ipinaliwanag sa pamamagitan ng pagbaba sa parehong direksyon ng nagbubuklod na enerhiya at pagtaas sa internuclear na distansya. Ang HI ay ang pinakamalakas na acid sa mga hydrohalic acid (tingnan ang Talahanayan 16).
![]()
Ang polarizability ay tumataas dahil sa ang katunayan na ang tubig ay nag-polarize
higit pa ang koneksyon, na ang haba ay mas mahaba. I Ang mga asin ng hydrohalic acid ay may mga sumusunod na pangalan, ayon sa pagkakabanggit: fluoride, chlorides, bromides, iodide.
Mga kemikal na katangian ng mga hydrohalic acid
Sa dry form, ang hydrogen halides ay hindi kumikilos sa karamihan ng mga metal.
1. Ang mga may tubig na solusyon ng hydrogen halides ay may mga katangian ng oxygen-free acids. Masiglang nakikipag-ugnayan sa maraming mga metal, ang kanilang mga oxide at hydroxides; ang mga metal na nasa electrochemical series ng mga boltahe ng mga metal pagkatapos ng hydrogen ay hindi apektado. Makipag-ugnayan sa ilang mga asin at gas.

Ang hydrofluoric acid ay sumisira sa salamin at silicates:
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Samakatuwid, hindi ito maiimbak sa mga babasagin.
2. Sa mga reaksiyong redox, ang mga hydrohalic acid ay kumikilos bilang mga ahente ng pagbabawas, at ang aktibidad ng pagbabawas sa seryeng Cl - , Br - , I - ay tumataas.

Resibo
Ang hydrogen fluoride ay ginawa sa pamamagitan ng pagkilos ng concentrated sulfuric acid sa fluorspar:
CaF 2 + H 2 SO 4 \u003d CaSO 4 + 2HF
Ang hydrogen chloride ay nakuha sa pamamagitan ng direktang pakikipag-ugnayan ng hydrogen sa chlorine:
H 2 + Cl 2 \u003d 2HCl
Ito ay isang sintetikong paraan upang makakuha.
Ang paraan ng sulfate ay batay sa reaksyon ng puro
sulfuric acid na may NaCl.
Sa bahagyang pag-init, ang reaksyon ay nagpapatuloy sa pagbuo ng HCl at NaHSO 4 .
NaCl + H 2 SO 4 \u003d NaHSO 4 + HCl
Sa isang mas mataas na temperatura, ang pangalawang yugto ng reaksyon ay nagpapatuloy:
NaCl + NaHSO 4 \u003d Na 2 SO 4 + HCl
Ngunit ang HBr at HI ay hindi maaaring makuha sa katulad na paraan, dahil ang kanilang mga compound na may mga metal kapag nakikipag-ugnayan sa concentrating
oxidized na may sulfuric acid, dahil. I - at Br - ay malakas na mga ahente ng pagbabawas.
2NaBr -1 + 2H 2 S +6 O 4 (k) \u003dBr 0 2 + S +4 O 2 + Na 2 SO 4 + 2H 2 O
![]()
Ang hydrogen bromide at hydrogen iodide ay nakuha sa pamamagitan ng hydrolysis ng PBr 3 at PI 3: PBr 3 + 3H 2 O \u003d 3HBr + H 3 PO 3 PI 3 + 3H 2 O \u003d 3HI + H 3 PO 3
Halides
Ang mga metal halides ay karaniwang mga asin. Ang mga ito ay nailalarawan sa pamamagitan ng isang ionic na uri ng bono, kung saan ang mga metal ions ay may positibong singil, at ang mga halogen ions ay may negatibong singil. Mayroon silang isang kristal na sala-sala.
Ang pagbabawas ng kakayahan ng halides ay tumataas sa serye Cl - , Br - , I - (tingnan ang § 2.2).
Ang solubility ng matipid na natutunaw na mga asin ay bumababa sa seryeng AgCl - AgBr - AgI; sa kaibahan, ang AgF salt ay lubos na natutunaw sa tubig. Karamihan sa mga asin ng hydrohalic acid ay lubos na natutunaw sa tubig.
DEPINISYON
Halogens- mga elemento ng pangkat VIIA - fluorine (F), chlorine (Cl), bromine (Br) at iodine (I).
Electronic na pagsasaayos ng panlabas na antas ng enerhiya ng mga halogens ns 2 np 5 . Dahil, bago ang pagkumpleto ng antas ng enerhiya, ang mga halogens ay kulang lamang ng isang elektron, sa OVR madalas nilang ipinapakita ang mga katangian ng mga ahente ng oxidizing. Ang halogen oxidation ay nagsasaad: mula "-1" hanggang "+7". Ang tanging elemento ng pangkat ng halogen - fluorine - ay nagpapakita lamang ng isang estado ng oksihenasyon na "-1" at ito ang pinaka-electronegative na elemento.
Ang mga molekula ng halogen ay diatomic: F 2 , Cl 2 , Br 2 , I 2 . Sa pagtaas ng singil ng nucleus ng isang atom ng isang elemento ng kemikal, i.e. kapag lumilipat mula sa fluorine hanggang sa yodo, bumababa ang kakayahang mag-oxidize ng mga halogens, na kinumpirma ng kakayahang ilipat ang mas mababang mga halogens ng mas mataas mula sa mga hydrohalic acid at kanilang mga asin:
Br 2 + 2HI \u003d I 2 + 2HBr
Cl 2 + 2KBr = Br 2 + 2KCl
Mga pisikal na katangian ng mga halogens
Sa n.o. Ang fluorine ay isang mapusyaw na dilaw na gas na may masangsang na amoy. nakakalason. Ang chlorine ay isang light green na gas, tulad ng fluorine, mayroon itong masangsang na amoy. Malakas na nakakalason. Sa mataas na presyon at temperatura ng silid, madali itong nagiging likido. Ang bromine ay isang mabigat na pula-kayumangging likido na may katangian na hindi kanais-nais na masangsang na amoy. Ang likidong bromine, gayundin ang mga singaw nito, ay lubhang nakakalason. Ang bromine ay hindi gaanong natutunaw sa tubig at mabuti sa mga non-polar solvents. Ang yodo ay isang madilim na kulay-abo na solid na may metal na kinang. Ang mga singaw ng yodo ay kulay lila. Ang Iodine ay madaling sumikat, i.e. nagiging gaseous state mula sa solid, habang nilalampasan ang liquid state.
Pagkuha ng mga halogens
Ang mga halogen ay maaaring makuha sa pamamagitan ng electrolysis ng mga solusyon o pagkatunaw ng mga halides:
MgCl 2 \u003d Mg + Cl 2 (matunaw)
Kadalasan, ang mga halogens ay nakuha sa pamamagitan ng reaksyon ng oksihenasyon ng mga hydrohalic acid:
MnO 2 + 4HCl \u003d MnCl 2 + Cl 2 + 2H 2 O
K 2 Cr 2 O 7 + 14HCl \u003d 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O
2KMnO 4 + 16HCl \u003d 2MnCl 2 + 5Cl 2 + 8H 2 O + 2KCl
Mga kemikal na katangian ng mga halogens
Ang fluorine ay may pinakamataas na aktibidad ng kemikal. Karamihan sa mga elemento ng kemikal kahit na sa temperatura ng silid ay nakikipag-ugnayan sa fluorine, na naglalabas ng malaking halaga ng init. Kahit na ang tubig ay nasusunog sa fluorine:
2H 2 O + 2F 2 \u003d 4HF + O 2
Ang libreng chlorine ay hindi gaanong reaktibo kaysa sa fluorine. Hindi ito direktang tumutugon sa oxygen, nitrogen at noble gas. Nakikipag-ugnayan ito sa lahat ng iba pang mga sangkap tulad ng fluorine:
2Fe + Cl 2 = 2FeCl 3
2P + 5Cl 2 = 2PCl 5
Kapag ang chlorine ay nakikipag-ugnayan sa tubig sa lamig, nangyayari ang isang reversible reaction:
Cl 2 + H 2 O↔HCl + HClO
Ang pinaghalong, na siyang mga produkto ng reaksyon, ay tinatawag na chlorine water.
Kapag ang chlorine ay nakikipag-ugnayan sa alkalis sa malamig, ang mga pinaghalong chlorides at hypochlorite ay nabuo:
Cl 2 + Ca (OH) 2 \u003d Ca (Cl) OCl + H 2 O
Kapag ang chlorine ay natunaw sa isang mainit na solusyon sa alkali, ang sumusunod na reaksyon ay nangyayari:
3Cl 2 + 6KOH \u003d 5KCl + KClO 3 + 3H 2 O
Ang bromine, tulad ng chlorine, ay natutunaw sa tubig at, bahagyang tumutugon dito, ay bumubuo ng tinatawag na "bromine water", habang ang iodine ay halos hindi matutunaw sa tubig.
Malaki ang pagkakaiba ng yodo sa aktibidad ng kemikal mula sa iba pang mga halogens. Hindi ito tumutugon sa karamihan ng mga hindi metal, at mabagal na tumutugon sa mga metal kapag pinainit lamang. Ang pakikipag-ugnayan ng yodo sa hydrogen ay nangyayari lamang sa malakas na pag-init, ang reaksyon ay endothermic at lubos na nababaligtad:
H 2 + I 2 \u003d 2HI - 53 kJ.
Mga halimbawa ng paglutas ng problema
HALIMBAWA 1
| Mag-ehersisyo | Kalkulahin ang dami ng chlorine (n.a.) na nag-react sa potassium iodide kung ang yodo ay nabuo na may mass na 508 g | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Desisyon | Isulat natin ang equation ng reaksyon: Cl 2 + 2KI \u003d I 2 + 2KCl Hanapin ang dami ng sangkap na nabuong yodo: v(I 2)=m(I 2)/M(I 2) v (I 2) \u003d 508/254 \u003d 2 mol Ayon sa equation ng reaksyon, ang halaga ng chlorine substance. Ang hydrogen atom ay mayroong electronic formula ng panlabas (at tanging) electronic level 1 s isa. Sa isang banda, sa pagkakaroon ng isang electron sa panlabas na antas ng elektroniko, ang hydrogen atom ay katulad ng alkali metal atoms. Gayunpaman, tulad ng mga halogens, kulang lamang ito ng isang elektron upang punan ang panlabas na antas ng elektroniko, dahil hindi hihigit sa 2 mga electron ang matatagpuan sa unang antas ng elektroniko. Lumalabas na ang hydrogen ay maaaring mailagay nang sabay-sabay sa una at sa penultimate (ikapitong) pangkat ng periodic table, na kung minsan ay ginagawa sa iba't ibang mga bersyon ng periodic system: Mula sa punto ng view ng mga katangian ng hydrogen bilang isang simpleng sangkap, gayunpaman ito ay may higit na karaniwan sa mga halogens. Ang hydrogen, pati na rin ang mga halogens, ay isang non-metal at bumubuo ng mga diatomic molecule (H 2) na katulad sa kanila. Sa ilalim ng normal na mga kondisyon, ang hydrogen ay isang gas, hindi aktibong sangkap. Ang mababang aktibidad ng hydrogen ay ipinaliwanag sa pamamagitan ng mataas na lakas ng bono sa pagitan ng mga atomo ng hydrogen sa molekula, na nangangailangan ng alinman sa malakas na pag-init o paggamit ng mga catalyst, o pareho sa parehong oras, upang masira ito. Pakikipag-ugnayan ng hydrogen sa mga simpleng sangkapmay mga metalSa mga metal, ang hydrogen ay tumutugon lamang sa alkali at alkaline na lupa! Kabilang sa mga alkali na metal ang mga metal ng pangunahing subgroup ng pangkat I (Li, Na, K, Rb, Cs, Fr), at ang mga alkaline earth metal ay mga metal ng pangunahing subgroup ng pangkat II, maliban sa beryllium at magnesium (Ca, Sr, Ba , Ra) Kapag nakikipag-ugnayan sa mga aktibong metal, ang hydrogen ay nagpapakita ng mga katangian ng oxidizing, i.e. nagpapababa ng estado ng oksihenasyon nito. Sa kasong ito, ang mga hydride ng alkali at alkaline na mga metal na lupa ay nabuo, na may isang ionic na istraktura. Ang reaksyon ay nagpapatuloy kapag pinainit: Dapat pansinin na ang pakikipag-ugnayan sa mga aktibong metal ay ang tanging kaso kapag ang molecular hydrogen H2 ay isang oxidizing agent. na may mga di-metalSa mga hindi metal, ang hydrogen ay tumutugon lamang sa carbon, nitrogen, oxygen, sulfur, selenium at halogens! Ang carbon ay dapat na maunawaan bilang graphite o amorphous na carbon, dahil ang brilyante ay isang sobrang inert allotropic modification ng carbon. Kapag nakikipag-ugnayan sa mga di-metal, ang hydrogen ay maaari lamang magsagawa ng pag-andar ng isang ahente ng pagbabawas, iyon ay, maaari lamang nitong mapataas ang estado ng oksihenasyon nito: Pakikipag-ugnayan ng hydrogen sa mga kumplikadong sangkapna may mga metal oxideAng hydrogen ay hindi tumutugon sa mga metal oxide na nasa serye ng aktibidad ng mga metal hanggang sa aluminyo (kasama), gayunpaman, nagagawa nitong bawasan ang maraming mga metal oxide sa kanan ng aluminyo kapag pinainit: na may mga non-metal oxidesSa mga non-metal oxide, ang hydrogen ay tumutugon kapag pinainit ng mga oxide ng nitrogen, halogens, at carbon. Sa lahat ng pakikipag-ugnayan ng hydrogen sa mga non-metal oxides, ang reaksyon nito sa carbon monoxide CO ay dapat bigyang pansin. Ang pinaghalong CO at H 2 ay mayroon ding sariling pangalan - "synthesis gas", dahil, depende sa mga kondisyon, ang mga hinihiling na produktong pang-industriya tulad ng methanol, formaldehyde at kahit na sintetikong hydrocarbon ay maaaring makuha mula dito: may mga acidAng hydrogen ay hindi tumutugon sa mga inorganic acid! Sa mga organic na acid, ang hydrogen ay tumutugon lamang sa mga unsaturated acid, gayundin sa mga acid na naglalaman ng mga functional na grupo na may kakayahang mabawasan ng hydrogen, sa partikular na aldehyde, keto o nitro group. may mga asinSa kaso ng mga may tubig na solusyon ng mga asing-gamot, ang kanilang pakikipag-ugnayan sa hydrogen ay hindi nangyayari. Gayunpaman, kapag ang hydrogen ay ipinapasa sa mga solidong asing-gamot ng ilang mga metal na katamtaman at mababang aktibidad, posible ang bahagyang o kumpletong pagbawas ng mga ito, halimbawa: Mga kemikal na katangian ng mga halogensAng mga halogens ay ang mga kemikal na elemento ng pangkat VIIA (F, Cl, Br, I, At), pati na rin ang mga simpleng sangkap na kanilang nabuo. Pagkatapos nito, maliban kung iba ang sinabi, ang mga halogens ay mauunawaan bilang mga simpleng sangkap. Ang lahat ng mga halogens ay may molekular na istraktura, na humahantong sa mababang pagkatunaw at pagkulo ng mga sangkap na ito. Ang mga molekula ng halogen ay diatomic, i.e. ang kanilang pormula ay maaaring isulat sa pangkalahatang anyo bilang Hal 2 . Ito ay dapat na nabanggit tulad ng isang tiyak na pisikal na ari-arian ng yodo bilang kanyang kakayahan pangingimbabaw o, sa madaling salita, pangingimbabaw. pangingimbabaw, tinatawag nila ang kababalaghan kung saan ang isang sangkap sa solidong estado ay hindi natutunaw kapag pinainit, ngunit, sa pamamagitan ng pag-bypass sa likidong bahagi, agad na pumasa sa gas na estado. Ang elektronikong istraktura ng panlabas na antas ng enerhiya ng isang atom ng anumang halogen ay may anyo na ns 2 np 5, kung saan ang n ay ang period number ng periodic table kung saan matatagpuan ang halogen. Tulad ng nakikita mo, isang elektron lamang ang nawawala mula sa walong elektron na panlabas na shell ng mga atomo ng halogen. Mula dito ay lohikal na ipagpalagay ang nakararami na pag-oxidizing na mga katangian ng mga libreng halogens, na nakumpirma rin sa pagsasanay. Tulad ng alam mo, ang electronegativity ng mga non-metal ay bumababa kapag lumilipat pababa sa subgroup, at samakatuwid ang aktibidad ng mga halogens ay bumababa sa serye: F 2 > Cl 2 > Br 2 > I 2 Pakikipag-ugnayan ng mga halogens sa mga simpleng sangkapAng lahat ng mga halogen ay lubos na reaktibo at tumutugon sa karamihan ng mga simpleng sangkap. Gayunpaman, dapat tandaan na ang fluorine, dahil sa sobrang mataas na reaktibiti nito, ay maaaring tumugon kahit na sa mga simpleng sangkap na hindi maaaring tumugon sa ibang mga halogens. Ang mga simpleng sangkap na ito ay kinabibilangan ng oxygen, carbon (diamond), nitrogen, platinum, ginto, at ilang marangal na gas (xenon at krypton). Yung. sa totoo lang, Ang fluorine ay hindi tumutugon lamang sa ilang mga marangal na gas. Ang natitirang mga halogens, i.e. Ang klorin, bromine at yodo ay mga aktibong sangkap din, ngunit hindi gaanong aktibo kaysa sa fluorine. Ang mga ito ay tumutugon sa halos lahat ng mga simpleng sangkap maliban sa oxygen, nitrogen, carbon sa anyo ng brilyante, platinum, ginto at mga marangal na gas. Pakikipag-ugnayan ng mga halogens sa mga di-metalhydrogenAng lahat ng mga halogens ay tumutugon sa hydrogen upang mabuo hydrogen halides na may pangkalahatang formula na HHal. Kasabay nito, ang reaksyon ng fluorine na may hydrogen ay nagsisimula nang kusang kahit na sa dilim at nagpapatuloy sa isang pagsabog alinsunod sa equation: Ang reaksyon ng chlorine na may hydrogen ay maaaring simulan sa pamamagitan ng matinding ultraviolet irradiation o pag-init. Tumutulo din na may pagsabog: Ang bromine at yodo ay tumutugon lamang sa hydrogen kapag pinainit, at sa parehong oras, ang reaksyon sa yodo ay nababaligtad: posporusAng pakikipag-ugnayan ng fluorine na may posporus ay humahantong sa oksihenasyon ng posporus sa pinakamataas na estado ng oksihenasyon (+5). Sa kasong ito, ang pagbuo ng phosphorus pentafluoride ay nangyayari: Kapag ang chlorine at bromine ay nakikipag-ugnayan sa phosphorus, posible na makakuha ng phosphorus halides pareho sa + 3 oxidation state at sa + 5 oxidation state, na nakasalalay sa mga proporsyon ng mga reactant: Sa kaso ng puting phosphorus sa isang kapaligiran ng fluorine, chlorine o likidong bromine, ang reaksyon ay nagsisimula nang kusang. Ang pakikipag-ugnayan ng phosphorus na may yodo ay maaaring humantong sa pagbuo ng phosphorus triiodide lamang dahil sa isang makabuluhang mas mababang kakayahang mag-oxidizing kaysa sa iba pang mga halogens: kulay-aboAng fluorine ay nag-oxidize ng sulfur sa pinakamataas na estado ng oksihenasyon +6, na bumubuo ng sulfur hexafluoride: Ang klorin at bromine ay tumutugon sa sulfur, na bumubuo ng mga compound na naglalaman ng sulfur sa mga estado ng oksihenasyon na lubhang hindi karaniwan para dito +1 at +2. Napakaspesipiko ng mga pakikipag-ugnayang ito, at upang makapasa sa pagsusulit sa kimika, hindi kinakailangan ang kakayahang isulat ang mga equation ng mga pakikipag-ugnayang ito. Samakatuwid, ang sumusunod na tatlong equation ay ibinigay sa halip para sa gabay: Pakikipag-ugnayan ng mga halogens sa mga metalTulad ng nabanggit sa itaas, ang fluorine ay may kakayahang tumugon sa lahat ng mga metal, kahit na ang mga hindi aktibo tulad ng platinum at ginto: Ang natitirang mga halogen ay tumutugon sa lahat ng mga metal maliban sa platinum at ginto: Mga reaksyon ng mga halogens na may mga kumplikadong sangkapMga reaksyon ng pagpapalit sa mga halogenMas aktibong halogens, i.e. na ang mga elemento ng kemikal ay mas mataas sa periodic table, nagagawang ilipat ang hindi gaanong aktibong mga halogens mula sa mga hydrohalic acid at metal halides na kanilang nabuo: Katulad nito, pinapalitan ng bromine at iodine ang sulfur mula sa mga solusyon ng sulfides at o hydrogen sulfide: Ang chlorine ay isang mas malakas na oxidizing agent at nag-oxidize ng hydrogen sulfide sa may tubig na solusyon nito hindi sa sulfur, ngunit sa sulfuric acid: Pakikipag-ugnayan ng mga halogens sa tubigNasusunog ang tubig sa fluorine na may asul na apoy alinsunod sa equation ng reaksyon: Iba ang reaksyon ng bromine at chlorine sa tubig kaysa sa fluorine. Kung ang fluorine ay kumilos bilang isang oxidizing agent, kung gayon ang chlorine at bromine ay hindi katimbang sa tubig, na bumubuo ng isang halo ng mga acid. Sa kasong ito, ang mga reaksyon ay mababaligtad: Ang pakikipag-ugnayan ng yodo sa tubig ay nagpapatuloy sa isang hindi gaanong halaga na maaari itong mapabayaan at isaalang-alang na ang reaksyon ay hindi nagpapatuloy sa lahat. Pakikipag-ugnayan ng mga halogens sa mga solusyon sa alkaliAng fluorine, kapag nakikipag-ugnayan sa isang may tubig na solusyon ng alkali, ay muling gumaganap bilang isang ahente ng oxidizing: Ang kakayahang isulat ang equation na ito ay hindi kinakailangan upang makapasa sa pagsusulit. Sapat na malaman ang katotohanan tungkol sa posibilidad ng gayong pakikipag-ugnayan at ang oxidizing role ng fluorine sa reaksyong ito. Hindi tulad ng fluorine, ang iba pang mga halogens ay hindi katimbang sa mga solusyon sa alkali, iyon ay, sabay-sabay nilang pinapataas at binabawasan ang kanilang estado ng oksihenasyon. Kasabay nito, sa kaso ng chlorine at bromine, depende sa temperatura, ang daloy sa dalawang magkaibang direksyon ay posible. Sa partikular, sa malamig, ang mga reaksyon ay nagpapatuloy tulad ng sumusunod: at kapag pinainit: Ang Iodine ay tumutugon sa alkalis na eksklusibo ayon sa pangalawang opsyon, i.e. sa pagbuo ng iodate, dahil Ang hypoiodite ay hindi matatag hindi lamang kapag pinainit, kundi pati na rin sa mga ordinaryong temperatura at kahit na sa malamig. Chemistry ng mga Elemento Nonmetals ng VIIA-subgroup Ang mga elemento ng VIIA-subgroup ay tipikal na di-metal na may mataas electronegativity, mayroon silang pangalan ng grupo - "halogens". Mga Pangunahing Isyu na Tinalakay sa Lektura Pangkalahatang katangian ng mga di-metal ng VIIA-subgroup. Elektronikong istraktura, ang pinakamahalagang katangian ng mga atomo. Ang pinaka katangian foam ng oksihenasyon. Mga tampok ng kimika ng mga halogens. mga simpleng sangkap. mga likas na compound. Mga halogen compound Mga hydrohalic acid at ang kanilang mga asin. Salt at hydrofluoric acid mga puwang, pagtanggap at pag-aaplay. mga halide complex. Binary oxygen compounds ng mga halogens. kawalang-tatag ok- Ang redox na katangian ng mga simpleng substance at co- pagkakaisa. Mga reaksyon ng di-proporsyon. Mga diagram ng Latimer.
Chemistry ng mga elemento ng VIIA-subgroup pangkalahatang katangian
Ang pangkat ng VIIA ay nabuo ng mga p-elemento: fluorine F, chlorine Cl, bromine Br, iodine I at astatine At. Ang pangkalahatang formula para sa valence electron ay ns 2 np 5. Ang lahat ng mga elemento ng pangkat VIIA ay karaniwang hindi metal.
upang bumuo ng isang matatag na walong elektron lochki, kaya mayroon sila isang malakas na ugali patungo sa ang pagdaragdag ng isang elektron. Ang lahat ng mga elemento ay madaling bumuo ng simpleng isa-isang sinisingil nye anions Г – . Sa anyo ng mga simpleng anion, ang mga elemento ng pangkat VIIA ay matatagpuan sa natural na tubig at sa mga kristal ng natural na asin, halimbawa, halite NaCl, sylvin KCl, fluorite CaF2. Karaniwang pangalan ng pangkat ng mga elemento VIIA- pangkat na "halogens", i.e. "pagsilang ng mga asin", dahil sa katotohanan na karamihan sa kanilang mga compound na may mga metal ay nauna nang ay isang tipikal na asin (CaF2, NaCl, MgBr2, KI), na na maaaring makuha sa pamamagitan ng direktang mutual pakikipag-ugnayan ng isang metal na may halogen. Ang mga libreng halogen ay nakuha mula sa mga natural na asin, kaya ang pangalang "halogens" ay isinalin din bilang "ipinanganak mula sa mga asing-gamot."
Ang pinakamababang estado ng oksihenasyon (–1) ay ang pinaka-stable lahat ng halogens. Ang ilang mga katangian ng mga atomo ng mga elemento ng pangkat VIIA ay ibinigay sa Ang pinakamahalagang katangian ng mga atomo ng mga elemento ng pangkat ng VIIA
Ang mga halogens ay may mataas na electron affinity (maximum para sa Cl) at isang napakataas na enerhiya ng ionization (maximum para sa F) at maximum posibleng electronegativity sa bawat isa sa mga panahon. Ang fluorine ay ang pinaka electronegative ng lahat ng elemento ng kemikal. Ang pagkakaroon ng isang hindi magkapares na elektron sa mga atomo ng halogen ay sanhi humahantong sa pagsasama-sama ng mga atomo sa mga simpleng sangkap sa mga diatomic na molekula Г2. Para sa mga simpleng sangkap ng halogen, ang mga ahente ng oxidizing ay pinaka-katangian. mga katangian na pinakamalakas para sa F2 at humina sa pagpasa sa I2. Ang mga halogens ay nailalarawan sa pamamagitan ng pinakadakilang reaktibiti ng lahat ng di-metal na elemento. Ang fluorine, kahit na sa mga halogens, ay nakahiwalay ay lubhang aktibo. Ang elemento ng ikalawang yugto, fluorine, ay higit na naiiba sa iba. ilang elemento ng subgroup. Ito ay isang pangkalahatang pattern para sa lahat ng hindi metal.
Fluorine, bilang pinaka-electronegative na elemento, hindi nagpapakita ng kasarian nabubuhay na estado ng oksihenasyon. Sa anumang koneksyon, kasama ang Ki- oxygen, ang fluorine ay nasa estado ng oksihenasyon (-1). Ang lahat ng iba pang mga halogen ay nagpapakita ng positibong estado ng oksihenasyon. hanggang sa maximum na +7. Ang pinaka-katangian na mga estado ng oksihenasyon ng mga halogens: F: -1, 0; Cl, Br, I: -1, 0, +1, +3, +5, +7. Ang mga oxide ay kilala para sa Cl, kung saan ito ay nasa mga estado ng oksihenasyon: +4 at +6. Ang pinakamahalagang halogen compound, sa positibo Ang mga oxidation foam ay mga acid na naglalaman ng oxygen at ang kanilang mga asin. Ang lahat ng mga halogen compound sa positibong estado ng oksihenasyon ay ay malakas na oxidizing agent. kakila-kilabot na estado ng oksihenasyon. Ang disproporsyon ay itinataguyod ng isang alkaline na kapaligiran. Praktikal na aplikasyon ng mga simpleng sangkap at oxygen compound Ang mga halogens ay higit sa lahat dahil sa kanilang oxidizing effect. Ang mga simpleng sangkap na Cl2 ay nakakahanap ng pinakamalawak na praktikal na aplikasyon. at F2. Ang pinakamalaking halaga ng chlorine at fluorine ay natupok sa industriyal na or- ganic synthesis: sa paggawa ng mga plastik, nagpapalamig, solvents, pestisidyo, droga. Ang isang malaking halaga ng chlorine at yodo ay ginagamit upang makakuha ng mga metal at para sa kanilang pagdadalisay. Ginagamit din ang chlorine para sa pagpapaputi ng selulusa, para sa pagdidisimpekta ng inuming tubig at sa paggawa ng tubig ng bleach at hydrochloric acid. Ang mga asin ng oxo acid ay ginagamit sa paggawa ng mga pampasabog.
Ang mga acid ay malawakang ginagamit sa pagsasanay - hydrochloric at natutunaw Ang fluorine at chlorine ay kabilang sa dalawampung pinakakaraniwang elemento doon, mas mababa ang bromine at yodo sa kalikasan. Ang lahat ng mga halogens ay matatagpuan sa kalikasan sa estado ng oksihenasyon(-isa). Ang yodo lamang ang matatagpuan sa anyo ng asin KIO3, na, bilang isang karumihan, ay kasama sa Chilean saltpeter (KNO3). Ang Astatine ay isang artipisyal na nakuhang radioactive na elemento (hindi ito umiiral sa kalikasan). Ang kawalang-tatag ng At ay makikita sa pangalan, na nagmula sa Griyego. "astatos" - "hindi matatag". Ang Astatine ay isang maginhawang emitter para sa radiotherapy ng mga cancerous na tumor. Mga simpleng sangkap Ang mga simpleng sangkap ng mga halogens ay nabuo ng mga diatomic na molekula na G2. Sa mga simpleng sangkap, sa panahon ng paglipat mula sa F2 hanggang I2 na may pagtaas sa bilang ng mga electron mga layer ng elektron at isang pagtaas sa polarizability ng mga atom, mayroong isang pagtaas intermolecular interaction, na humahantong sa isang pagbabago sa pinagsama-samang nakatayo sa ilalim ng karaniwang mga kondisyon. Ang fluorine (sa normal na kondisyon) ay isang dilaw na gas, sa -181 ° C ito ay nagiging estado ng likido. Ang klorin ay isang dilaw-berdeng gas, ito ay nagiging likido sa -34 ° C. Na may kulay na ha- ang pangalan Cl ay nauugnay dito, ito ay nagmula sa Greek na "chloros" - "dilaw- berde". Isang matalim na pagtaas sa kumukulong punto ng Cl2 kumpara sa F2, nagpapahiwatig ng pagtaas ng intermolecular interaction. Ang bromine ay isang maitim na pula, napakadalisay na likido, kumukulo sa 58.8 ° C. Sa- ang pamagat ng elemento ay nauugnay sa isang matalim na hindi kanais-nais na amoy ng gas at nabuo mula sa "bromos" - "mabaho". Iodine - madilim na lilang kristal, na may bahagyang "metal" na kinang skom, kung saan, kapag pinainit, madaling sublimes, na bumubuo ng violet vapors;
ang boiling point ng iodine ay 183o C. Ang pangalan nito ay nagmula sa kulay ng yodo vapor - "iodos" - "violet". Ang lahat ng mga simpleng sangkap ay may masangsang na amoy at nakakalason. Ang paglanghap ng kanilang mga singaw ay nagiging sanhi ng pangangati ng mga mucous membrane at respiratory organ, at sa mataas na konsentrasyon - inis. Noong Unang Digmaang Pandaigdig, ginamit ang chlorine bilang lason. Ang gaseous fluorine at liquid bromine ay nagdudulot ng paso sa balat. Nagtatrabaho sa ha- logens, pag-iingat ay dapat gawin. Dahil ang mga simpleng sangkap ng mga halogens ay nabuo ng mga non-polar molecule lumalamig, mahusay silang natutunaw sa mga non-polar na organikong solvent: alkohol, benzene, carbon tetrachloride, atbp. Sa tubig, ang chlorine, bromine at iodine ay bahagyang natutunaw, ang kanilang mga may tubig na solusyon ay tinatawag na chlorine, bromine at iodine na tubig. Ang Br2 ay natutunaw nang mas mahusay kaysa sa iba, ang konsentrasyon ng bromine sa sat- ang brine solution ay umabot sa 0.2 mol/l, at chlorine - 0.1 mol/l. Ang fluorine ay nabubulok ang tubig: 2F2 + 2H2O = O2 + 4HF Ang mga halogens ay nagpapakita ng mataas na aktibidad ng oxidative at paglipat dyat sa halide anion. Г2 + 2e– 2Г– Ang fluorine ay may partikular na mataas na aktibidad ng oxidative. Ang fluorine ay nag-oxidize ng mga marangal na metal (Au, Pt). Pt + 3F2 = PtF6 Nakikipag-ugnayan pa ito sa ilang inert gas (krypton, xenon at radon), halimbawa, Xe + 2F2 = XeF4 Maraming napaka-matatag na compound ang nasusunog sa isang F2 na kapaligiran, halimbawa, tubig, kuwarts (SiO2). SiO2 + 2F2 = SiF4 + O2
Sa mga reaksyon sa fluorine, kahit na tulad ng malakas na oxidizing agent tulad ng nitric at sulfur acid, kumikilos bilang mga ahente ng pagbabawas, habang ang fluorine ay nag-oxidize kasama sa kanilang komposisyon O(–2). 2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2 SO4 + 4F2 = SF6 + 2HF + 2O2 Ang mataas na reaktibiti ng F2 ay lumilikha ng mga kahirapan sa pagpili ng koneksyon. mga materyales sa istruktura para sa pagtatrabaho dito. Karaniwan, para sa mga layuning ito, Naglalaman ang mga ito ng nickel at tanso, na, kapag na-oxidize, ay bumubuo ng mga siksik na proteksiyon na pelikula ng mga fluoride sa kanilang ibabaw. Ang pangalang F ay nauugnay sa agresibong pagkilos nito. I mean, galing sa Greek. "Ftoros" - "pagsira". Sa seryeng F2, Cl2, Br2, I2, humihina ang kakayahang mag-oxidize dahil sa pagtaas ng pagbabago ng laki ng mga atomo at pagbabawas ng electronegativity. Sa may tubig solusyon, ang oxidizing at pagbabawas ng mga katangian ng Ang mga sangkap ay karaniwang nailalarawan gamit ang mga potensyal na elektrod. Ipinapakita ng talahanayan ang karaniwang mga potensyal na elektrod (Eo, V) para sa kalahating reaksyon ng pagbuo ng mga halogens. Para sa paghahambing, ang halaga ng Eo para sa ki- oxygen ay ang pinaka-karaniwang oxidizing agent. Mga karaniwang potensyal ng elektrod para sa mga simpleng sangkap na halogens
Nabawasan ang aktibidad ng oxidative Tulad ng makikita sa talahanayan, F2 - ang ahente ng oxidizing ay mas malakas, kaysa sa O2, samakatuwid ang F2 ay hindi umiiral sa may tubig na mga solusyon , ito ay nag-oxidize ng tubig, bumabawi sa F–. Sa paghusga sa halaga ng Eo, ang kakayahang mag-oxidizing ng Cl2
mas mataas din kaysa sa O2. Sa katunayan, sa pangmatagalang pag-iimbak ng chlorine na tubig, ito ay nabubulok sa paglabas ng oxygen at sa pagbuo ng HCl. Ngunit ang reaksyon ay mabagal (ang Cl2 molecule ay kapansin-pansing mas malakas kaysa sa F2 molecule at activation energy para sa mga reaksyon na may chlorine ay mas mataas), dipro- paghahati-hati: Cl2 + H2 O HCl + HOCl Sa tubig, hindi ito umabot sa dulo (K = 3.9.10–4), samakatuwid ang Cl2 ay umiiral sa mga may tubig na solusyon. Ang Br2 at I2 ay mas matatag sa tubig. Ang disproporsyon ay isang napaka katangiang oxidative pagbabawas ng reaksyon para sa mga halogens. Ang disproporsyon ng ibinuhos sa isang alkaline na kapaligiran. Ang disproporsyon ng Cl2 sa alkali ay humahantong sa pagbuo ng mga anion Cl– at ClO– . Ang disproportionation constant ay 7.5. 1015 . Cl2 + 2NaOH = NaCl + NaClO + H2O Kapag ang iodine ay hindi proporsyonado sa alkali, ang I– at IO3 – ay nabuo. Ana- Ang Br2 ay lohikal na hindi katumbas ng yodo. Ang pagbabago sa produkto ay hindi katimbang Ang ionization ay dahil sa ang katunayan na ang mga anion GO– at GO2 – sa Br at ako ay hindi matatag. Ang disproportionation reaction ng chlorine ay ginagamit sa pang-industriya sti upang makakuha ng isang malakas at mabilis na kumikilos na hypochlorite oxidizing agent, bleaching lime, bartholite salt. 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Pakikipag-ugnayan ng mga halogens sa mga metal Masiglang nakikipag-ugnayan ang mga halogen sa maraming metal, halimbawa: Mg + Cl2 = MgCl2 Ti + 2I2 TiI4 Na + halides, kung saan ang metal ay may mababang estado ng oksihenasyon (+1, +2), ay mga compound na parang asin na may nakararami na ionic bond. Paano- narito, ang mga ionic halides ay mga solido na may mataas na punto ng pagkatunaw Metal halides, kung saan ang metal ay may mataas na estado ng oksihenasyon niya, ay mga compound na may nakararami na covalent bond. Marami sa kanila sa ilalim ng normal na mga kondisyon ay mga gas, likido o fusible solids. Halimbawa, ang WF6 ay isang gas, ang MoF6 ay isang likido, Ang TiCl4 ay isang likido. Pakikipag-ugnayan ng mga halogens sa mga di-metal Direktang nakikipag-ugnayan ang mga halogens sa maraming hindi metal: hydrogen, phosphorus, sulfur, atbp. Halimbawa: H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6 Ang bono sa non-metal halides ay nakararami sa covalent. Ang mga compound na ito ay karaniwang may mababang mga punto ng pagkatunaw at pagkulo. Sa paglipat mula sa fluorine hanggang sa yodo, ang covalent na katangian ng mga halides ay pinahusay. Ang mga covalent halides ng tipikal na di-metal ay mga acidic compound; kapag nakikipag-ugnayan sa tubig, nag-hydrolyze sila upang bumuo ng mga acid. Halimbawa: PBr3 + 3H2O = 3HBr + H3PO3 PI3 + 3H2O = 3HI + H3PO3 PCl5 + 4H2O = 5HCl + H3PO4
Ang unang dalawang reaksyon ay ginagamit upang makakuha ng bromine at hydrogen iodide noic acid. Interhalides. Ang mga halogen, na pinagsama sa isa't isa, ay bumubuo ng isang inter- nangunguna. Sa mga compound na ito, ang mas magaan at mas electronegative na halogen ay nasa estado ng oksihenasyon (–1), at ang mas mabigat ay nasa positibong estado. foam ng oksihenasyon. Dahil sa direktang pakikipag-ugnayan ng mga halogens kapag pinainit, ang mga sumusunod ay nakuha: ClF, BrF, BrCl, ICl. Mayroon ding mga mas kumplikadong interhalide: ClF3 , BrF3 , BrF5 , IF5 , IF7 , ICl3 . Ang lahat ng interhalides sa ilalim ng normal na mga kondisyon ay mga likidong sangkap na may mababang mga punto ng kumukulo. Ang mga interhalides ay may mataas na oxidizing aktibidad. Halimbawa, ang mga kemikal na matatag na sangkap tulad ng SiO2, Al2 O3, MgO, atbp. ay nasusunog sa mga singaw ng ClF3. 2Al2O3 + 4ClF3 = 4AlF3 + 3O2 + 2Cl2 Ang Fluoride ClF 3 ay isang agresibong fluorinating reagent na mabilis na kumikilos bakuran F2 . Ginagamit ito sa mga organikong synthese at upang makakuha ng mga proteksiyon na pelikula sa ibabaw ng kagamitan sa nikel para sa pagtatrabaho sa fluorine. Sa tubig, ang mga interhalide ay na-hydrolyzed upang bumuo ng mga acid. Halimbawa, ClF5 + 3H2O = HClO3 + 5HF Halogens sa kalikasan. Pagkuha ng mga simpleng sangkap Sa industriya, ang mga halogens ay nakuha mula sa kanilang mga natural na compound. Lahat ang mga proseso para sa pagkuha ng mga libreng halogen ay batay sa oksihenasyon ng halo- nid ions. 2D – Г2 + 2e– Ang isang makabuluhang halaga ng mga halogens ay matatagpuan sa natural na tubig sa anyo ng mga anion: Cl–, F–, Br–, I–. Ang tubig sa dagat ay maaaring maglaman ng hanggang 2.5% NaCl. Ang bromine at yodo ay nakukuha mula sa tubig ng balon ng langis at tubig sa dagat.
DEPINISYON Halogens- mga elemento ng VII A group - fluorine (F), chlorine (Cl), bromine (Br) at iodine (I). Electronic na pagsasaayos ng panlabas na antas ng enerhiya ng mga halogens ns 2 np 5 . Dahil, bago ang pagkumpleto ng antas ng enerhiya, ang mga halogens ay kulang lamang ng isang elektron, sa OVR madalas nilang ipinapakita ang mga katangian ng mga ahente ng oxidizing. Ang halogen oxidation ay nagsasaad: mula "-1" hanggang "+7". Ang tanging elemento ng pangkat ng halogen - fluorine - ay nagpapakita lamang ng isang estado ng oksihenasyon na "-1" at ito ang pinaka-electronegative na elemento. Ang mga molekula ng halogen ay diatomic: F 2 , Cl 2 , Br 2 , I 2 . Mga kemikal na katangian ng mga halogensSa pagtaas ng singil ng nucleus ng isang atom ng isang elemento ng kemikal, i.e. kapag lumilipat mula sa fluorine hanggang sa yodo, bumababa ang kakayahang mag-oxidize ng mga halogens, na kinumpirma ng kakayahang ilipat ang mas mababang mga halogens ng mas mataas mula sa mga hydrohalic acid at kanilang mga asin: Br 2 + 2HI = I 2 + 2HBr; Cl 2 + 2KBr = Br 2 + 2KCl. Ang fluorine ay may pinakamataas na aktibidad ng kemikal. Karamihan sa mga elemento ng kemikal kahit na sa temperatura ng silid ay nakikipag-ugnayan sa fluorine, na naglalabas ng malaking halaga ng init. Kahit na ang tubig ay nasusunog sa fluorine: 2H 2 O + 2F 2 \u003d 4HF + O 2. Ang libreng chlorine ay hindi gaanong reaktibo kaysa sa fluorine. Hindi ito direktang tumutugon sa oxygen, nitrogen at noble gas. Nakikipag-ugnayan ito sa lahat ng iba pang mga sangkap tulad ng fluorine: 2Fe + Cl 2 = 2FeCl 3; 2P + 5Cl 2 = 2PCl 5 . Kapag ang chlorine ay nakikipag-ugnayan sa tubig sa lamig, nangyayari ang isang reversible reaction: Cl 2 + H 2 O↔HCl + HClO. Ang pinaghalong, na siyang mga produkto ng reaksyon, ay tinatawag na chlorine water. Kapag ang chlorine ay nakikipag-ugnayan sa alkalis sa malamig, ang mga pinaghalong chlorides at hypochlorite ay nabuo: Cl 2 + Ca (OH) 2 \u003d Ca (Cl) OCl + H 2 O. Kapag ang chlorine ay natunaw sa isang mainit na solusyon sa alkali, ang sumusunod na reaksyon ay nangyayari: 3Cl 2 + 6KOH \u003d 5KCl + KClO 3 + 3H 2 O. Ang bromine, tulad ng chlorine, ay natutunaw sa tubig at, bahagyang tumutugon dito, ay bumubuo ng tinatawag na "bromine water", habang ang iodine ay halos hindi matutunaw sa tubig. Malaki ang pagkakaiba ng yodo sa aktibidad ng kemikal mula sa iba pang mga halogens. Hindi ito tumutugon sa karamihan ng mga hindi metal, at mabagal na tumutugon sa mga metal kapag pinainit lamang. Ang pakikipag-ugnayan ng yodo sa hydrogen ay nangyayari lamang sa malakas na pag-init, ang reaksyon ay endothermic at lubos na nababaligtad: H 2 + I 2 \u003d 2HI - 53 kJ. Mga pisikal na katangian ng mga halogensSa n.o. Ang fluorine ay isang mapusyaw na dilaw na gas na may masangsang na amoy. nakakalason. Ang chlorine ay isang light green na gas, tulad ng fluorine, mayroon itong masangsang na amoy. Malakas na nakakalason. Sa mataas na presyon at temperatura ng silid, madali itong nagiging likido. Ang bromine ay isang mabigat na pula-kayumangging likido na may katangian na hindi kanais-nais na masangsang na amoy. Ang likidong bromine, gayundin ang mga singaw nito, ay lubhang nakakalason. Ang bromine ay hindi gaanong natutunaw sa tubig at madaling natutunaw sa mga non-polar solvents. Ang yodo ay isang madilim na kulay-abo na solid na may metal na kinang. Ang mga singaw ng yodo ay kulay lila. Ang Iodine ay madaling sumikat, i.e. nagiging gaseous state mula sa solid, habang nilalampasan ang liquid state. Pagkuha ng mga halogensAng mga halogen ay maaaring makuha sa pamamagitan ng electrolysis ng mga solusyon o pagkatunaw ng mga halides: MgCl 2 = Mg + Cl 2 (matunaw). Kadalasan, ang mga halogens ay nakuha sa pamamagitan ng reaksyon ng oksihenasyon ng mga hydrohalic acid: MnO 2 + 4HCl \u003d MnCl 2 + Cl 2 + 2H 2 O; K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O; 2KMnO 4 + 16HCl \u003d 2MnCl 2 + 5Cl 2 + 8H 2 O + 2KCl. Paglalapat ng mga halogensAng mga halogen ay ginagamit bilang hilaw na materyales para sa iba't ibang produkto. Kaya, ang fluorine at chlorine ay ginagamit para sa synthesis ng iba't ibang polymeric na materyales, ang chlorine ay isa ring hilaw na materyal sa produksyon ng hydrochloric acid. Ang bromine at yodo ay malawakang ginagamit sa gamot, ang bromine ay ginagamit din sa industriya ng pintura. Mga halimbawa ng paglutas ng problemaHALIMBAWA 1
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




