Mn na tabela periódica. Tabela Periódica de Elementos Químicos
Leia também
O século XIX na história da humanidade é um século em que muitas ciências foram reformadas, incluindo a química. Foi nessa época que surgiu o sistema periódico de Mendeleev e, com ele, a lei periódica. Foi ele quem se tornou a base química moderna. O sistema periódico de D.I. Mendeleev é uma sistematização de elementos que estabelece a dependência das propriedades químicas e físicas da estrutura e carga do átomo de uma substância.
História
O início do período periódico foi marcado pelo livro “A Correlação das Propriedades com o Peso Atômico dos Elementos”, escrito no terceiro quartel do século XVII. Ele exibiu os conceitos básicos de relativamente bem conhecidos elementos químicos(naquela época havia apenas 63 deles). Além disso, muitos deles massas atômicas foram definidos incorretamente. Isso interferiu muito na descoberta de D.I.
Dmitry Ivanovich começou seu trabalho comparando as propriedades dos elementos. Primeiro trabalhou com cloro e potássio, só depois passou a trabalhar com metais alcalinos. Munido de cartões especiais nos quais estavam representados elementos químicos, ele tentou repetidamente montar esse “mosaico”: colocando-o sobre a mesa em busca das combinações e combinações necessárias.
Depois de muito esforço, Dmitry Ivanovich finalmente encontrou o padrão que procurava e organizou os elementos em linhas periódicas. Tendo recebido como resultado células vazias entre os elementos, o cientista percebeu que nem todos os elementos químicos eram conhecidos pelos pesquisadores russos, e que era ele quem deveria dar a este mundo o conhecimento no campo da química que ainda não havia sido dado por seu antecessores.

Todo mundo conhece o mito de que a tabela periódica apareceu a Mendeleev em sonho e ele coletou os elementos de memória. sistema unificado. Isso é, grosso modo, uma mentira. O fato é que Dmitry Ivanovich trabalhou por muito tempo e se concentrou no trabalho, o que o exauriu muito. Enquanto trabalhava no sistema de elementos, Mendeleev adormeceu uma vez. Ao acordar, percebeu que não havia terminado a mesa e continuou preenchendo as células vazias. Seu conhecido, um certo Inostrantsev, professor universitário, decidiu que a tabela periódica havia sido sonhada por Mendeleev e espalhou o boato entre seus alunos. Foi assim que surgiu esta hipótese.
Fama
Os elementos químicos de Mendeleev são um reflexo da lei periódica criada por Dmitry Ivanovich no terceiro quartel do século XIX (1869). Foi em 1869 que a notificação de Mendeleev sobre a criação de uma determinada estrutura foi lida numa reunião da comunidade química russa. E no mesmo ano foi publicado o livro “Fundamentos da Química”, no qual foi publicado pela primeira vez o sistema periódico de elementos químicos de Mendeleev. E no livro " Sistema natural elementos e seu uso para indicar as qualidades de elementos não descobertos” D.I. Mendeleev mencionou pela primeira vez o conceito de “lei periódica”.

Estrutura e regras para colocação de elementos
Os primeiros passos na criação da lei periódica foram dados por Dmitry Ivanovich em 1869-1871, naquela época ele trabalhou arduamente para estabelecer a dependência das propriedades desses elementos da massa de seu átomo. Versão moderna representa elementos resumidos em uma tabela bidimensional.
A posição de um elemento na tabela carrega um certo significado químico e físico. Pela localização de um elemento na tabela, você pode descobrir qual é sua valência e determinar outras características químicas. Dmitry Ivanovich tentou estabelecer uma conexão entre elementos, tanto semelhantes em propriedades quanto diferentes.

Ele baseou a classificação dos elementos químicos conhecidos na época na valência e na massa atômica. Ao comparar as propriedades relativas dos elementos, Mendeleev tentou encontrar um padrão que unisse todos os elementos químicos conhecidos em um sistema. Ao organizá-los com base no aumento das massas atômicas, ele ainda conseguiu periodicidade em cada uma das linhas.
Desenvolvimento adicional do sistema
A tabela periódica, que surgiu em 1969, foi refinada mais de uma vez. Com o advento dos gases nobres na década de 1930, foi possível revelar uma nova dependência dos elementos - não da massa, mas do número atômico. Posteriormente, foi possível estabelecer o número de prótons nos núcleos atômicos, e descobriu-se que coincide com o número atômico do elemento. Os cientistas do século 20 estudaram a energia eletrônica. Descobriu-se que ela também afeta a periodicidade. Isso mudou muito as ideias sobre as propriedades dos elementos. Este ponto foi refletido em edições posteriores da tabela periódica de Mendeleev. Cada nova descoberta das propriedades e características dos elementos cabe organicamente na tabela.
Características do sistema periódico de Mendeleev
A tabela periódica é dividida em períodos (7 linhas dispostas horizontalmente), que, por sua vez, são divididos em grandes e pequenos. O período começa com um metal alcalino e termina com um elemento com propriedades não metálicas.
A tabela de Dmitry Ivanovich é dividida verticalmente em grupos (8 colunas). Cada um deles na tabela periódica é composto por dois subgrupos, nomeadamente os principais e os secundários. Depois de muito debate, por sugestão de D.I. Mendeleev e seu colega U. Ramsay, decidiu-se introduzir o chamado grupo zero. Inclui gases inertes (néon, hélio, argônio, radônio, xenônio, criptônio). Em 1911, os cientistas F. Soddy foram solicitados a colocar elementos indistinguíveis, os chamados isótopos, na tabela periódica - células separadas foram alocadas para eles.

Apesar da exatidão e precisão do sistema periódico, a comunidade científica há muito não quis reconhecer esta descoberta. Muitos grandes cientistas ridicularizaram o trabalho de D.I. Mendeleev e acreditaram que era impossível prever as propriedades de um elemento que ainda não havia sido descoberto. Mas depois que os supostos elementos químicos foram descobertos (e estes eram, por exemplo, escândio, gálio e germânio), o sistema Mendeleev e sua lei periódica tornaram-se a ciência da química.
Mesa nos tempos modernos
A tabela periódica dos elementos de Mendeleev é a base da maioria das descobertas químicas e físicas relacionadas à ciência atômico-molecular. Conceito moderno elemento foi formado precisamente graças ao grande cientista. O surgimento do sistema periódico de Mendeleev introduziu mudanças fundamentais nas ideias sobre várias conexões E substâncias simples Oh. A criação da tabela periódica pelos cientistas teve um enorme impacto no desenvolvimento da química e de todas as ciências a ela relacionadas.
Provavelmente todos vocês já viram a tabela periódica dos elementos. É possível que ela ainda te assombre em seus sonhos, ou talvez por enquanto ela seja apenas um fundo visual decorando a parede classe de escola. No entanto, há muito mais nesta coleção aparentemente aleatória de células do que aparenta.
A tabela periódica (ou PT, como a chamaremos de vez em quando ao longo deste artigo), e os elementos que a compõem, possuem características que você talvez nunca tenha adivinhado. Desde a criação da tabela até a adição dos elementos finais a ela, aqui estão dez fatos que a maioria das pessoas não conhece.
10. Mendeleev recebeu ajuda
A tabela periódica está em uso desde 1869, quando foi compilada pelo barbudo Dimitri Mendeleev. A maioria das pessoas pensa que Mendeleev foi o único que trabalhou nesta mesa e, graças a isso, tornou-se o químico mais brilhante do século. No entanto, os seus esforços foram auxiliados por vários cientistas europeus que deram contribuições importantes para a conclusão deste colossal conjunto de elementos.
Mendeleev é amplamente conhecido como o pai tabela periódica, mas quando ele compilou, nem todos os elementos da tabela já estavam abertos. Como isso se tornou possível? Os cientistas são famosos pela sua loucura...
9. Últimos itens adicionados

Acredite ou não, a tabela periódica não mudou muito desde a década de 1950. Porém, em 2 de dezembro de 2016, quatro novos elementos foram adicionados de uma só vez: nihonium (elemento nº 113), moscovium (elemento nº 115), tennessine (elemento nº 117) e oganesson (elemento nº 118). Esses novos elementos só receberam seus nomes em junho de 2016, pois foi necessária uma revisão de cinco meses antes de serem oficialmente adicionados ao PT.
Três elementos receberam o nome das cidades ou estados em que foram obtidos, e Oganesson recebeu o nome do físico nuclear russo Yuri Oganesyan por sua contribuição na obtenção deste elemento.
8. Qual letra não está na tabela?

Existem 26 letras no alfabeto latino e cada uma delas é importante. No entanto, Mendeleev decidiu não perceber isso. Dê uma olhada na mesa e me diga qual carta dá azar? Dica: pesquise na ordem e dobre os dedos após cada letra que encontrar. Como resultado, você encontrará a letra “ausente” (se tiver todos os dez dedos nas mãos). Você adivinhou? Esta é a letra número 10, a letra "J".
Dizem que “um” é o número de pessoas solitárias. Então, talvez devêssemos chamar a letra “J” de letra dos singles? Mas aqui está uma curiosidade: a maioria dos meninos nascidos nos Estados Unidos em 2000 receberam nomes que começam com esta letra. Assim, esta carta não ficou sem a devida atenção.
7. Elementos sintetizados

Como você já deve saber, existem atualmente 118 elementos na tabela periódica. Você consegue adivinhar quantos desses 118 elementos foram obtidos em laboratório? De tudo lista geral V condições naturais apenas 90 elementos podem ser encontrados.
Você acha que 28 elementos criados artificialmente são muito? Bem, acredite apenas na minha palavra. Eles foram sintetizados desde 1937 e os cientistas continuam a fazê-lo até hoje. Você pode encontrar todos esses elementos na tabela. Vejam os elementos 95 a 118, todos esses elementos não são encontrados em nosso planeta e foram sintetizados em laboratórios. O mesmo se aplica aos elementos numerados 43, 61, 85 e 87.
6. 137º elemento

Em meados do século 20, um famoso cientista chamado Richard Feynman fez uma declaração bastante ruidosa que chocou a todos. mundo científico do nosso planeta. Segundo ele, se algum dia descobrirmos o elemento 137, não conseguiremos determinar o número de prótons e nêutrons nele. O número 1/137 é notável porque é o valor da constante de estrutura fina, que descreve a probabilidade de um elétron absorver ou emitir um fóton. Teoricamente, o elemento nº 137 deveria ter 137 elétrons e 100% de chance de absorver um fóton. Seus elétrons girarão na velocidade da luz. Ainda mais incrível, os elétrons do elemento 139 devem girar mais rápido que a velocidade da luz para existir.
Você já está cansado de física? Talvez você se interesse em saber que o número 137 reúne três importantes áreas da física: a teoria da velocidade da luz, a mecânica quântica e o eletromagnetismo. Desde o início de 1900, os físicos especulam que o número 137 pode ser a base do Grande teoria unificada, que incluirá todas as três áreas acima. É certo que isto parece tão incrível quanto as lendas dos OVNIs e do Triângulo das Bermudas.
5. O que você pode dizer sobre os nomes?

Quase todos os nomes dos elementos têm algum significado, embora não seja imediatamente claro. Os nomes dos novos elementos não são dados arbitrariamente. Eu apenas nomearia o elemento com a primeira palavra que me ocorresse. Por exemplo, "kerflump". Eu acho que não é ruim.
Normalmente, os nomes dos elementos se enquadram em uma das cinco categorias principais. O primeiro são os nomes de cientistas famosos, versão clássica- einstênio. Além disso, os elementos podem receber seus nomes dependendo dos locais onde foram registrados pela primeira vez, por exemplo, germânio, amerício, gálio, etc. opção adicional os nomes dos planetas são usados. O elemento urânio foi descoberto pela primeira vez logo após a descoberta do planeta Urano. Os elementos podem ter nomes associados à mitologia, por exemplo, há titânio, em homenagem aos antigos titãs gregos, e tório, em homenagem ao deus nórdico do trovão (ou estrela “vingadora”, dependendo de sua preferência).
E, finalmente, existem nomes que descrevem as propriedades dos elementos. Argônio vem da palavra grega “argos”, que significa “preguiçoso” ou “lento”. O nome sugere que este gás não está ativo. O bromo é outro elemento cujo nome vem de uma palavra grega. "Bromos" significa "fedor" e descreve basicamente o cheiro do bromo.
4. Criar a mesa foi um “momento eureka”?

se você ama jogos de cartas, então esse fato é para você. Mendeleev precisava ordenar de alguma forma todos os elementos e encontrar um sistema para isso. Naturalmente, para criar uma tabela de categorias, ele recorreu à paciência (bem, o que mais?) Mendeleev anotou o peso atômico de cada elemento em um cartão separado e então começou a expor seu jogo de paciência avançado. Ele organizou os elementos de acordo com suas propriedades específicas e depois os organizou em cada coluna de acordo com seu peso atômico.
Muitas pessoas não conseguem jogar paciência normal, então este jogo de paciência é impressionante. O que vai acontecer à seguir? Provavelmente alguém, com a ajuda do xadrez, revolucionará a astrofísica ou criará um foguete capaz de atingir os arredores da galáxia. Parece que não haverá nada de incomum nisso, considerando que Mendeleev conseguiu obter um resultado tão engenhoso apenas com um baralho de cartas comuns.
3. Gases nobres azarados

Lembra como classificamos o argônio como o elemento mais preguiçoso e lento da história do nosso universo? Parece que Mendeleev foi dominado pelos mesmos sentimentos. Quando o argônio puro foi obtido pela primeira vez em 1894, ele não cabia em nenhuma das colunas da tabela, então, em vez de buscar uma solução, o cientista decidiu simplesmente negar sua existência.
Ainda mais surpreendente é que o argônio não foi o único elemento que inicialmente sofreu esse destino. Além do argônio, cinco outros elementos permaneceram não classificados. Isso afetou o radônio, o néon, o criptônio, o hélio e o xenônio - e todos negaram sua existência simplesmente porque Mendeleev não conseguiu encontrar um lugar para eles na mesa. Após vários anos de reagrupamento e reclassificação, estes elementos (chamados gases inertes) ainda teve a sorte de ingressar em um clube digno e reconhecido como realmente existente.
2. Amor atômico

Conselhos para todos aqueles que se consideram românticos. Pegue uma cópia em papel da tabela periódica e corte todas as colunas intermediárias complicadas e relativamente desnecessárias, de modo que você fique com 8 colunas (você terá uma forma "curta" da tabela). Dobre-o no meio do grupo IV - e você descobrirá quais elementos podem formar compostos entre si.
Elementos que “se beijam” quando dobrados são capazes de formar compostos estáveis. Esses elementos possuem estruturas eletrônicas complementares e se combinam entre si. E se isso não for amor verdadeiro, como Romeu e Julieta ou Shrek e Fiona, então não sei o que é amor.
1. Regras de carbono

Carbon está tentando estar no centro do jogo. Você acha que sabe tudo sobre carbono, mas isso não é muito mais importante do que você imagina. Você sabia que está presente em mais da metade de todos os compostos conhecidos? E o que dizer do facto de 20% do peso de todos os organismos vivos ser carbono? É muito estranho, mas prepare-se: cada átomo de carbono do seu corpo já fez parte de uma facção dióxido de carbono na atmosfera. O carbono não é apenas o superelemento do nosso planeta, é o quarto elemento mais abundante em todo o Universo.
Se a tabela periódica é como uma festa, então o carbono é o hospedeiro principal. E parece que ele é o único que sabe organizar tudo corretamente. Bem, entre outras coisas, este é o elemento principal de todos os diamantes, por isso, apesar de toda a sua intrusividade, também brilha!
A descoberta da tabela periódica dos elementos químicos por Dmitri Mendeleev em março de 1869 foi um verdadeiro avanço na química. O cientista russo conseguiu sistematizar o conhecimento sobre os elementos químicos e apresentá-los em forma de tabela, que os alunos ainda são obrigados a estudar nas aulas de química. A tabela periódica tornou-se a base para o rápido desenvolvimento desta ciência complexa e interessante, e a história de sua descoberta está envolta em lendas e mitos. Para todos os interessados em ciência, será interessante saber a verdade sobre como Mendeleev descobriu a tabela dos elementos periódicos.
História da tabela periódica: como tudo começou
As tentativas de classificar e sistematizar elementos químicos conhecidos foram feitas muito antes de Dmitry Mendeleev. Cientistas famosos como Döbereiner, Newlands, Meyer e outros propuseram seus próprios sistemas de elementos. No entanto, devido à falta de dados sobre os elementos químicos e suas massas atômicas corretas, os sistemas propostos não eram totalmente confiáveis.
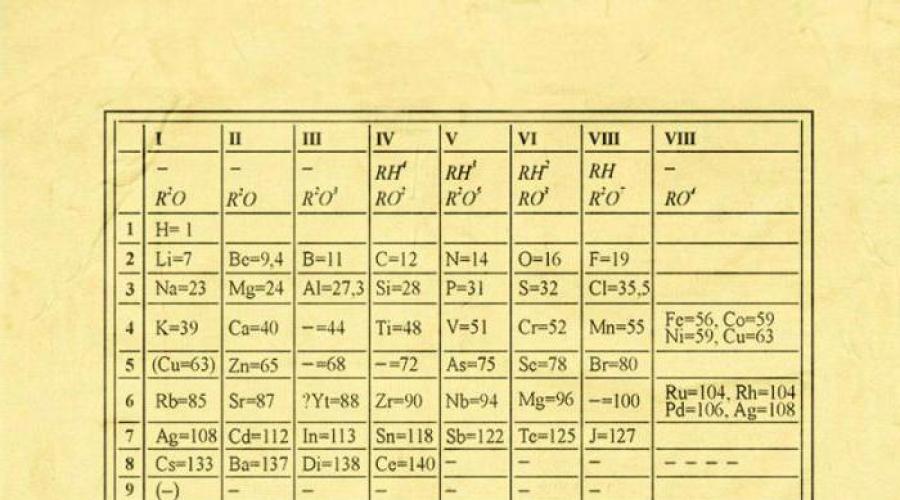
A história da descoberta da tabela periódica começa em 1869, quando um cientista russo, em uma reunião da Sociedade Química Russa, contou a seus colegas sobre sua descoberta. Na tabela proposta pelo cientista, os elementos químicos foram organizados de acordo com suas propriedades, garantidas pelo tamanho do seu peso molecular.
Uma característica interessante da tabela periódica foi também a presença de células vazias, que futuramente foram preenchidas com elementos químicos abertos previstos pelo cientista (germânio, gálio, escândio). Desde a descoberta da tabela periódica, muitas vezes foram feitas adições e alterações. Juntamente com o químico escocês William Ramsay, Mendeleev adicionou um grupo de gases inertes (grupo zero) à mesa.
Posteriormente, a história da tabela periódica de Mendeleev esteve diretamente relacionada às descobertas em outra ciência - a física. O trabalho na tabela dos elementos periódicos continua até hoje, e os cientistas modernos acrescentam novos elementos químicos à medida que são descobertos. É difícil superestimar a importância do sistema periódico de Dmitry Mendeleev, pois graças a ele:
- Foi sistematizado o conhecimento sobre as propriedades dos elementos químicos já descobertos;
- Tornou-se possível prever a descoberta de novos elementos químicos;
- Ramos da física como a física atômica e a física nuclear começaram a se desenvolver;
Existem muitas opções para representar os elementos químicos de acordo com a lei periódica, mas a opção mais famosa e comum é a tabela periódica familiar a todos.
Mitos e fatos sobre a criação da tabela periódica
O equívoco mais comum na história da descoberta da tabela periódica é que o cientista a viu em sonho. Na verdade, o próprio Dmitri Mendeleev refutou esse mito e afirmou que vinha refletindo sobre a lei periódica há muitos anos. Para sistematizar os elementos químicos, ele escreveu cada um deles em um cartão separado e combinou-os repetidamente, organizando-os em fileiras dependendo de suas propriedades semelhantes.
O mito sobre o sonho “profético” do cientista pode ser explicado pelo fato de Mendeleev ter trabalhado na sistematização dos elementos químicos durante dias a fio, interrompidos por um sono curto. Porém, somente o trabalho árduo e o talento natural do cientista deram o tão esperado resultado e proporcionaram fama mundial a Dmitry Mendeleev.
Muitos estudantes na escola, e às vezes na universidade, são forçados a memorizar ou pelo menos navegar aproximadamente na tabela periódica. Para fazer isso, uma pessoa não deve apenas ter boa memória, mas também pensar logicamente, ligando elementos em grupos e classes separados. Estudar a mesa é mais fácil para aquelas pessoas que mantêm constantemente o cérebro em boa forma fazendo treinamento no BrainApps.
Quem frequentou a escola lembra que uma das disciplinas obrigatórias de estudo era química. Você pode gostar dela ou não gostar dela - não importa. E é provável que muito conhecimento desta disciplina já tenha sido esquecido e não seja aproveitado na vida. No entanto, todos provavelmente se lembram da tabela de elementos químicos de D.I. Para muitos, permaneceu uma tabela multicolorida, onde certas letras são escritas em cada quadrado, indicando os nomes dos elementos químicos. Mas aqui não falaremos sobre química como tal, mas descreveremos centenas reações químicas e processos, mas contaremos como a tabela periódica apareceu em primeiro lugar - esta história será interessante para qualquer pessoa e, na verdade, para todos aqueles que estão famintos por informações interessantes e úteis.
Um pouco de fundo
Em 1668, o notável químico, físico e teólogo irlandês Robert Boyle publicou um livro no qual muitos mitos sobre a alquimia foram desmascarados e no qual discutiu a necessidade de procurar elementos químicos indecomponíveis. O cientista também deu uma lista deles, composta por apenas 15 elementos, mas admitiu a ideia de que pode haver mais elementos. Este se tornou o ponto de partida não só na busca de novos elementos, mas também na sua sistematização.
Cem anos depois, o químico francês Antoine Lavoisier compilou uma nova lista, que já incluía 35 elementos. Mais tarde, 23 deles foram considerados indecomponíveis. Mas a busca por novos elementos continuou por cientistas de todo o mundo. E papel principal O famoso químico russo Dmitry Ivanovich Mendeleev desempenhou um papel neste processo - foi o primeiro a propor a hipótese de que poderia haver uma relação entre a massa atômica dos elementos e sua localização no sistema.
Graças ao trabalho árduo e à comparação de elementos químicos, Mendeleev conseguiu descobrir a ligação entre os elementos, em que podem ser um, e as suas propriedades não são algo dado como certo, mas representam um fenómeno que se repete periodicamente. Como resultado, em fevereiro de 1869, Mendeleev formulou a primeira lei periódica, e já em março seu relatório “Relação das propriedades com o peso atômico dos elementos” foi apresentado à Sociedade Química Russa pelo historiador da química N. A. Menshutkin. Então, no mesmo ano, a publicação de Mendeleev foi publicada na revista “Zeitschrift fur Chemie” na Alemanha, e em 1871, outra revista alemã “Annalen der Chemie” publicou uma nova e extensa publicação do cientista dedicada à sua descoberta.
Criando a tabela periódica

Em 1869, a ideia principal já havia sido formada por Mendeleev, e em um tempo bastante curto, mas por muito tempo ele não conseguiu formalizá-la em nenhum sistema ordenado que mostrasse claramente o que era o quê. Em uma das conversas com seu colega A.A. Inostrantsev, ele até disse que já tinha tudo planejado na cabeça, mas não conseguia colocar tudo em uma mesa. Depois disso, segundo os biógrafos de Mendeleev, ele começou a trabalhar meticulosamente em sua mesa, que durou três dias sem pausas para dormir. Eles tentaram de todas as maneiras organizar os elementos em uma tabela, e o trabalho também foi complicado pelo fato de que naquela época a ciência ainda não conhecia todos os elementos químicos. Mas, apesar disso, a tabela ainda foi criada e os elementos sistematizados.
A lenda do sonho de Mendeleev
Muitos já ouviram a história de que D.I. Mendeleev sonhou com sua mesa. Esta versão foi ativamente divulgada pelo já mencionado associado de Mendeleev, A. A. Inostrantsev, como estória engraçada com o qual ele entretinha seus alunos. Ele disse que Dmitry Ivanovich foi para a cama e em sonho viu claramente sua mesa, na qual todos os elementos químicos estavam dispostos em na ordem certa. Depois disso, os alunos até brincaram que a vodca 40° foi descoberta da mesma forma. Mas ainda havia pré-requisitos reais para a história do sono: como já mencionado, Mendeleev trabalhava na mesa sem dormir nem descansar, e Inostrantsev certa vez o encontrou cansado e exausto. Durante o dia, Mendeleev decidiu fazer um breve descanso e, algum tempo depois, acordou abruptamente, imediatamente pegou um pedaço de papel e desenhou nele uma mesa pronta. Mas o próprio cientista refutou toda essa história com o sonho, dizendo: “Estou pensando nisso, talvez há vinte anos, e você pensa: eu estava sentado e de repente... está pronto”. Então a lenda do sonho pode ser muito atrativa, mas a criação da mesa só foi possível com muito trabalho.

Trabalho adicional
Entre 1869 e 1871, Mendeleev desenvolveu as ideias de periodicidade para as quais a comunidade científica estava inclinada. E um dos etapas importantes Este processo houve um entendimento que qualquer elemento do sistema deveria ter, com base na totalidade de suas propriedades em comparação com as propriedades de outros elementos. Com base nisso, e também com base nos resultados de pesquisas sobre alterações nos óxidos formadores de vidro, o químico conseguiu fazer correções nos valores das massas atômicas de alguns elementos, incluindo urânio, índio, berílio e outros.
Mendeleev, é claro, queria preencher rapidamente as células vazias que restavam na tabela e, em 1870, previu que em breve seriam descobertos elementos químicos desconhecidos pela ciência, cujas massas atômicas e propriedades ele foi capaz de calcular. Os primeiros foram o gálio (descoberto em 1875), o escândio (descoberto em 1879) e o germânio (descoberto em 1885). Depois as previsões continuaram a ser concretizadas e mais oito novos elementos foram descobertos, incluindo: polônio (1898), rênio (1925), tecnécio (1937), frâncio (1939) e astato (1942-1943). Aliás, em 1900, D.I. Mendeleev e o químico escocês William Ramsay chegaram à conclusão de que a tabela também deveria incluir elementos do grupo zero - até 1962 eram chamados de gases inertes, e depois disso - gases nobres.
Organização da tabela periódica
Os elementos químicos na tabela de D.I. Mendeleev são organizados em linhas, de acordo com o aumento de sua massa, e o comprimento das linhas é selecionado para que os elementos nelas contidos tenham propriedades semelhantes. Por exemplo, gases nobres como radônio, xenônio, criptônio, argônio, néon e hélio são difíceis de reagir com outros elementos e também possuem baixa reatividade química, por isso estão localizados na coluna da extrema direita. E os elementos da coluna da esquerda (potássio, sódio, lítio, etc.) reagem bem com outros elementos, e as próprias reações são explosivas. Simplificando, dentro de cada coluna, os elementos têm propriedades semelhantes que variam de uma coluna para outra. Todos os elementos até o nº 92 são encontrados na natureza, e a partir do nº 93 eles começam elementos artificiais, que só pode ser criado em condições de laboratório.
Em sua versão original, o sistema periódico era entendido apenas como um reflexo da ordem existente na natureza, e não havia explicações sobre por que tudo deveria ser assim. E só quando ela apareceu mecânica quântica, o verdadeiro significado da ordem dos elementos na tabela ficou claro.
Lições do processo criativo
Falando sobre quais lições processo criativo pode ser extraído de toda a história da criação da tabela periódica por D.I. Mendeleev, podemos citar como exemplo as ideias de um pesquisador inglês da área. pensamento criativo Graham Wallace e o cientista francês Henri Poincaré. Vamos apresentá-los brevemente.
De acordo com os estudos de Poincaré (1908) e Graham Wallace (1926), existem quatro fases principais do pensamento criativo:
- Preparação– a fase de formulação do problema principal e as primeiras tentativas de resolvê-lo;
- Incubação– uma fase durante a qual há uma distração temporária do processo, mas o trabalho para encontrar uma solução para o problema é realizado em um nível subconsciente;
- Entendimento– o estágio em que a solução intuitiva está localizada. Além disso, esta solução pode ser encontrada numa situação completamente alheia ao problema;
- Exame– a fase de teste e implementação de uma solução, na qual esta solução é testada e o seu possível desenvolvimento posterior.
Como podemos ver, no processo de criação de sua tabela, Mendeleev seguiu intuitivamente precisamente essas quatro etapas. A eficácia disso pode ser avaliada pelos resultados, ou seja, pelo fato de a tabela ter sido criada. E dado que a sua criação foi um enorme avanço não só para a ciência química, mas também para toda a humanidade, as quatro etapas acima podem ser aplicadas tanto à implementação pequenos projetos e à implementação de planos globais. A principal coisa a lembrar é que nem uma única descoberta, nem uma única solução para um problema pode ser encontrada por si só, por mais que queiramos vê-las em um sonho e por mais que durmamos. Para que algo dê certo, não importa se é criar uma tabela de elementos químicos ou desenvolver um novo plano de marketing, você precisa ter certos conhecimentos e habilidades, além de usar com habilidade seu potencial e trabalhar duro.
Desejamos-lhe sucesso em seus empreendimentos e na implementação bem-sucedida de seus planos!
Mesmo na escola, sentados nas aulas de química, todos nos lembramos da mesa na parede da sala de aula ou do laboratório químico. Esta tabela continha uma classificação de todos os elementos químicos conhecidos pela humanidade, aqueles componentes fundamentais que constituem a Terra e todo o Universo. Então não poderíamos nem pensar nisso Tabela Mendeleievé sem dúvida um dos maiores descobertas científicas, que é a base da nossa conhecimento moderno sobre química.
Tabela periódica de elementos químicos por D. I. Mendeleev
À primeira vista, a ideia dela parece enganosamente simples: organizar elementos químicos em ordem crescente de peso de seus átomos. Além disso, na maioria dos casos verifica-se que produtos químicos e propriedades físicas cada elemento é semelhante ao seu elemento anterior na tabela. Este padrão aparece para todos os elementos, exceto os primeiros, simplesmente porque eles não têm à sua frente elementos semelhantes a eles em peso atômico. É graças à descoberta desta propriedade que podemos colocar uma sequência linear de elementos numa tabela, tal como um calendário de parede, e assim combinar um grande número de tipos de elementos químicos de uma forma clara e coerente. Claro, hoje usamos o conceito de número atômico (o número de prótons) para ordenar o sistema de elementos. Isso ajudou a resolver o chamado problema técnico“um par de permutações”, entretanto, não levou a uma mudança fundamental na aparência da tabela periódica.
EM tabela periódica todos os elementos são ordenados com base em seu número atômico, configuração eletrônica e propriedades químicas repetidas. As linhas da tabela são chamadas de períodos e as colunas são chamadas de grupos. A primeira tabela, datada de 1869, continha apenas 60 elementos, mas agora a tabela teve que ser ampliada para acomodar os 118 elementos que conhecemos hoje.
Tabela periódica de Mendeleev sistematiza não apenas os elementos, mas também suas mais diversas propriedades. Muitas vezes é suficiente para um químico ter a Tabela Periódica diante dos olhos para responder corretamente a muitas questões (não apenas questões de exames, mas também científicas).
O ID do YouTube de 1M7iKKVnPJE é inválido.
Lei periódica
Existem duas formulações lei periódica elementos químicos: clássicos e modernos.
Clássico, apresentado por seu descobridor D.I. Mendeleev: as propriedades dos corpos simples, bem como as formas e propriedades dos compostos dos elementos, dependem periodicamente dos valores dos pesos atômicos dos elementos.
Moderno: as propriedades das substâncias simples, bem como as propriedades e formas dos compostos dos elementos, dependem periodicamente da carga do núcleo dos átomos dos elementos (número ordinal).
Uma representação gráfica da lei periódica é o sistema periódico de elementos, que representa classificação natural elementos químicos, com base em mudanças regulares nas propriedades dos elementos dependendo das cargas de seus átomos. As imagens mais comuns da tabela periódica de elementos são D.I. As formas de Mendeleev são curtas e longas.

Grupos e períodos da Tabela Periódica
Em grupos são chamadas de linhas verticais na tabela periódica. Em grupos, os elementos são combinados por atributo mais elevado grau oxidação em óxidos. Cada grupo consiste em um subgrupo principal e um subgrupo secundário. Os principais subgrupos incluem elementos de pequenos períodos e elementos de grandes períodos com as mesmas propriedades. Os subgrupos laterais consistem apenas em elementos de grandes períodos. As propriedades químicas dos elementos dos subgrupos principal e secundário diferem significativamente.
Período chamada de linha horizontal de elementos dispostos em ordem crescente de números atômicos (atômicos). Existem sete períodos no sistema periódico: o primeiro, o segundo e o terceiro períodos são chamados de pequenos, contêm 2, 8 e 8 elementos, respectivamente; os demais períodos são chamados de grandes: no quarto e quinto períodos há 18 elementos, no sexto - 32, e no sétimo (ainda não concluído) - 31 elementos. Cada período, exceto o primeiro, começa com um metal alcalino e termina com um gás nobre.
Significado físico do número de série elemento químico: o número de prótons no núcleo atômico e o número de elétrons orbitando ao redor núcleo atômico, são iguais ao número ordinal do elemento.
Propriedades da tabela periódica
Lembremos que grupos são chamadas de linhas verticais na tabela periódica e Propriedades quimicas os elementos dos subgrupos principal e secundário diferem significativamente.
As propriedades dos elementos nos subgrupos mudam naturalmente de cima para baixo:
- estão se intensificando propriedades metálicas e os não metálicos enfraquecem;
- o raio atômico aumenta;
- a força das bases e dos ácidos isentos de oxigênio formados pelo elemento aumenta;
- a eletronegatividade diminui.
Todos os elementos, exceto hélio, néon e argônio, formam compostos de oxigênio; existem apenas oito formas de compostos de oxigênio; Na tabela periódica eles são frequentemente representados fórmulas gerais, localizado sob cada grupo em ordem crescente do estado de oxidação dos elementos: R 2 O, RO, R 2 O 3, RO 2, R 2 O 5, RO 3, R 2 O 7, RO 4, onde o símbolo R denota um elemento deste grupo. As fórmulas dos óxidos superiores aplicam-se a todos os elementos do grupo, exceto em casos excepcionais em que os elementos não apresentem estado de oxidação igual ao número do grupo (por exemplo, flúor).
Os óxidos da composição R 2 O exibem fortes propriedades básicas, e sua basicidade aumenta com o aumento do número atômico. Os óxidos da composição RO (com exceção de BeO) exibem propriedades básicas; Os óxidos da composição RO 2, R 2 O 5, RO 3, R 2 O 7 apresentam propriedades ácidas e sua acidez aumenta com o aumento do número atômico.
Os elementos dos subgrupos principais, a partir do grupo IV, formam compostos gasosos de hidrogênio. Existem quatro formas de tais compostos. Eles estão localizados sob os elementos dos subgrupos principais e são representados por fórmulas gerais na sequência RH 4, RH 3, RH 2, RH.
Os compostos RH 4 são de natureza neutra; RH 3 - fracamente básico; RH 2 – levemente ácido; RH - caráter fortemente ácido.
Lembremos que período chamada de linha horizontal de elementos dispostos em ordem crescente de números atômicos (atômicos).
Dentro de um período com número de série do elemento crescente:
- a eletronegatividade aumenta;
- as propriedades metálicas diminuem, as propriedades não metálicas aumentam;
- o raio atômico diminui.

Elementos da tabela periódica
Elementos alcalinos e alcalino-terrosos
Estes incluem elementos do primeiro e segundo grupos da tabela periódica. Metais alcalinos do primeiro grupo - metais macios, de cor prateada, fáceis de cortar com faca. Todos eles têm um único elétron em sua camada externa e reagem perfeitamente. Metais alcalinos terrestres do segundo grupo também apresentam tonalidade prateada. Dois elétrons são colocados no nível externo e, conseqüentemente, esses metais interagem menos prontamente com outros elementos. Comparados aos metais alcalinos, os metais alcalino-terrosos derretem e fervem em temperaturas mais altas.
Mostrar/ocultar texto
Lantanídeos (elementos de terras raras) e actinídeos
Lantanídeos- um grupo de elementos originalmente encontrados em minerais raros; daí o seu nome de elementos de "terras raras". Posteriormente, descobriu-se que esses elementos não são tão raros como se pensava inicialmente e, portanto, o nome lantanídeos foi dado aos elementos de terras raras. Lantanídeos e actinídeos ocupam dois blocos, localizados sob a tabela principal de elementos. Ambos os grupos incluem metais; todos os lantanídeos (exceto o promécio) são não radioativos; os actinídeos, pelo contrário, são radioativos.
Mostrar/ocultar texto
Halogênios e gases nobres
Os halogênios e gases nobres estão agrupados nos grupos 17 e 18 da tabela periódica. Halogênios são elementos não metálicos, todos possuem sete elétrons em sua camada externa. EM gases nobres Todos os elétrons estão na camada externa, portanto dificilmente participam da formação de compostos. Esses gases são chamados de gases “nobres” porque raramente reagem com outros elementos; isto é, referem-se a membros da casta nobre que tradicionalmente evitam outras pessoas na sociedade.
Mostrar/ocultar texto
Metais de transição
Metais de transição ocupam os grupos 3-12 na tabela periódica. A maioria deles é densa, dura e com boa condutividade elétrica e térmica. Seus elétrons de valência (com a ajuda dos quais estão conectados a outros elementos) estão localizados em várias camadas eletrônicas.
Mostrar/ocultar texto
| Metais de transição |
| Escândio Sc 21 |
| Titã Ti 22 |
| Vanádio V 23 |
| Cromo Cr 24 |
| Manganês Mn 25 |
| Ferro Fe 26 |
| Cobalto Co27 |
| Níquel Ni 28 |
| Cobre Cu 29 |
| Zinco Zn 30 |
| Ítrio Y 39 |
| Zircônio Zr 40 |
| Nióbio Nb 41 |
| Molibdênio Mo 42 |
| Tecnécio Tc 43 |
| Rutênio Ru 44 |
| Ródio Rh 45 |
| Paládio Pd 46 |
| Prata Ag 47 |
| Cádmio Cd 48 |
| Lutécio Lu 71 |
| Háfnio Hf 72 |
| Tântalo Ta 73 |
| Tungstênio W 74 |
| Rênio Re 75 |
| Ósmio Os 76 |
| Irídio Ir 77 |
| Platina Pt 78 |
| Ouro Au 79 |
| Mercúrio Hg 80 |
| Lourenço Lr 103 |
| Rutherfórdio Rf 104 |
| Dúbnio Db 105 |
| Seabórgio Sg 106 |
| Bório Bh 107 |
| Hassiy Hs 108 |
| Meitnério Monte 109 |
| Darmstadt Ds 110 |
| Raio X Rg 111 |
| Copérnico Cn 112 |
Metalóides
Metalóides ocupam os grupos 13-16 da tabela periódica. Metalóides como boro, germânio e silício são semicondutores e são usados para fazer chips de computador e taxas.
Mostrar/ocultar texto
Metais pós-transição
Os elementos chamados metais pós-transição, pertencem aos grupos 13-15 da tabela periódica. Ao contrário dos metais, eles não possuem brilho, mas possuem uma cor fosca. Comparados aos metais de transição, os metais pós-transição são mais macios e têm mais temperatura baixa fusão e ebulição, maior eletronegatividade. Seus elétrons de valência, com os quais se ligam a outros elementos, estão localizados apenas na camada externa de elétrons. Os elementos do grupo metal pós-transição têm muito mais Temperatura alta ponto de ebulição do que os metalóides.
Agora consolide seu conhecimento assistindo a um vídeo sobre a tabela periódica e muito mais.
Ótimo, o primeiro passo no caminho do conhecimento foi dado. Agora você está mais ou menos familiarizado com a tabela periódica e isso será muito útil para você, porque o Sistema Periódico de Mendeleev é a base sobre a qual se baseia esta ciência incrível.