Doskonalenie zarządzania innowacjami. Innowacyjne technologie jako przedmiot doskonalenia zarządzania przedsiębiorstwem na przykładzie SMZ. · kulturę organizacyjną firmy, a także relacje interpersonalne pomiędzy pracownikami, administracją i
Przeczytaj także
>> Chemia: Produkcja halogenów. Znaczenie biologiczne oraz zastosowanie halogenów i ich związków
Produkcja halogenów . Fluor i chlor otrzymuje się przez elektrolizę stopów lub roztworów ich soli. Na przykład proces elektryczny | Trolizę stopionego chlorku sodu można wyrazić równaniem:
Ale jeśli wodór można pozyskać innymi, wygodniejszymi i tańszymi sposobami, np gazu ziemnego, wówczas wodorotlenek sodu otrzymuje się prawie wyłącznie przez elektrolizę roztworu soli kuchennej, takiej jak chlor.
Brom i jod są produkowane na skalę przemysłową w wyniku reakcji ich wyparcia odpowiednio z bromków i jodków.
Biologiczne znaczenie halogenów. Ich zastosowanie. Nie można było nie zauważyć, że etykiety wielu marek past do zębów wskazują na zawartość w nich fluoru – oczywiście nie wolnego fluoru, ale jego związków. Dzięki temu ważnemu składnikowi, który bierze udział w budowie szkliwa zębów i kości, zapobiega się chorobom takim jak próchnica. Ponadto fluor jest niezbędny element w procesach metabolicznych w gruczołach, mięśniach i komórkach nerwowych.
Fluor jest ważny w produkcja przemysłowa, gdzie jego głównymi odbiorcami są przemysł nuklearny i elektrotechnika. Jego związek Na3AlF6 (jak się nazywa?) służy do produkcji aluminium. A w życiu codziennym coraz częściej szerokie zastosowanie znajduje teflonowe naczynia kuchenne, których nazwę zawdzięcza tworzywu zawierającemu fluor – Teflon.
Chlor- jeden z pierwiastki chemiczne, bez których istnienie organizmów żywych jest nie do pomyślenia. Jego podstawowa forma. dostający się do organizmu chlorek sodu. Pobudza metabolizm, porost włosów, dodaje wigoru i siły. Większość NaCl znajduje się w osoczu krwi.
Szczególną rolę w trawieniu odgrywa kwas solny HC1, będący częścią soku żołądkowego. Bez 0,2% HCl proces trawienia pokarmu praktycznie się zatrzymuje. I chociaż prawie wszystko produkty żywieniowe zawierają pewną ilość soli kuchennej, człowiek zmuszony jest dodawać do pożywienia około 20 g soli dziennie.
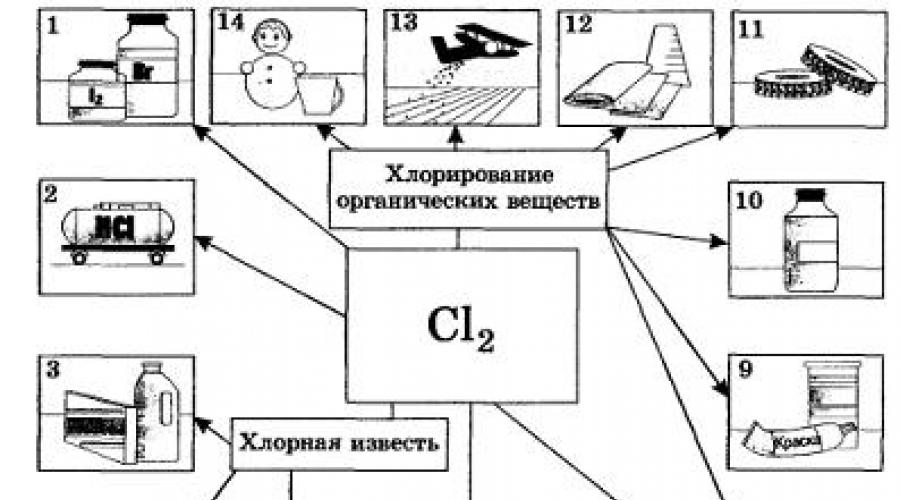
Według skali zastosowań przemysłowych Chlor jest znacznie lepszy od wszystkich halogenów. Chlor i jego związki są niezbędne do bielenia tkanin lnianych, bawełnianych, papieru itp. Szczególnie dużo go zużywa się w syntezach organicznych do produkcji tworzyw sztucznych, gumy, barwników i rozpuszczalników (ryc. 20).

Do zwalczania szkodników stosuje się wiele związków zawierających chlor Rolnictwo. W duże ilości chlor służy do dezynfekcji woda pitna nie obyło się jednak bez negatywnych konsekwencji (którą substancję bezpieczniej zastosować w tym celu?). W metalurgii metali nieżelaznych niektóre metale (tytan, niob, tantal) ekstrahuje się z rud poprzez chlorowanie. Chlor znalazł również zastosowanie do celów wojskowych jako chemiczny środek bojowy. Później zastąpiono go innymi, skuteczniejszymi substancjami toksycznymi zawierającymi chlor, takimi jak fosgen COCl2.
Chlor zawarty jest w substancji bardzo niebezpiecznej dla życia i zdrowia – dioksynach. Związki chloru są jedną z przyczyn niszczenia warstwy ozonowej Ziemi.
Bardzo ważny dla organizmu człowieka jest także inny halogen, brom. Związki tego pierwiastka regulują procesy wzbudzenia i hamowania ośrodkowego system nerwowy Dlatego w leczeniu chorób nerwowych (bezsenność, histeria, neurastenia itp.) Lekarze przepisują „brom” - leki zawierające brom.
Brom jest aktywnie akumulowany przez niektóre rośliny, w tym wodorosty. To w morzu koncentruje się większość bromu na naszej planecie, a morze jest głównym dostawcą bromu. Szacuje się, że co roku wraz z wodą morską do powietrza przedostaje się około 4 miliony ton bromu. Oczywiste jest, że jego zawartość w powietrzu obszarów przybrzeżnych jest zawsze wyższa niż na obszarach oddalonych od morza. Jest to jeden z powodów, dla których oddychanie morskim powietrzem jest tak korzystne.
Brom, a dokładniej bromek srebra AgBr, odgrywa w fotografii równie ważną rolę. Osoby zajmujące się fotografią zapewne od razu zapamiętają nazwy rodzajów papieru fotograficznego - „Uni-brom”, „Bromineportrait” itp. Papier fotograficzny zawiera warstwę bromku srebra naniesioną za pomocą żelatyny, która łatwo rozkłada się pod wpływem światła:
2AgBr = 2Ag + Br2
I wreszcie ostatni z rozważanych przez nas halogenów - jod - jest pierwiastkiem, bez którego człowiek nie może żyć: jego brak w wodzie i pożywieniu zmniejsza produkcję hormonu tarczycy i prowadzi do wola endemicznego. Regulacyjne działanie hormonu tarczycy obejmuje pobudzenie mięśni, bicie serca, apetyt, trawienie, funkcjonowanie mózgu i ludzki temperament. Jod dostaje się do organizmu wraz z pożywieniem: pieczywem, jajami, mlekiem, wodą, wodorost oraz powietrzem (zwłaszcza morskim) podczas oddychania.
Do leczenia ran stosuje się alkoholowy roztwór jodu (5-10%), zwany nalewką jodową. Jod jest zawarty w wielu lekach.
Głównymi odbiorcami jodu jest przemysł farmaceutyczny i chemiczny oraz produkcja światłoczułych materiałów fotograficznych.
1. Produkcja halogenów metodą elektrolizy stopów i roztworów soli.
2. Biologiczne znaczenie halogenów.
3. Zastosowanie chloru i związków fluoru, chloru i jodu.
Jaką objętość chloru (nr) i jaką masę sodu można otrzymać w wyniku elektrolizy 585 g chlorku sodu zawierającego 2% zanieczyszczeń?
Oblicz, ile gramów 40% roztworu alkalicznego można otrzymać z sodu, którego masę obliczyłeś w poprzednim zadaniu.
Francuski chemik Scheele otrzymał chlor w reakcji tlenku manganu(IV) z kwasem solnym. W wyniku tej reakcji powstaje także chlorek manganu(II) i woda. Napisz równanie tej reakcji, rozważ procesy redoks i oblicz masę tlenku manganu(IV) oraz ilość chlorowodoru potrzebną do wytworzenia 100 litrów chloru (n.o), jeśli jego wydajność wynosi 95% teoretycznie możliwej.
Przygotuj przekaz na temat pozytywnego i negatywnego znaczenia halogenów w życiu człowieka.
Treść lekcji notatki z lekcji rama nośna metody przyspieszania prezentacji lekcji technologie interaktywne Ćwiczyć zadania i ćwiczenia autotest warsztaty, szkolenia, case'y, zadania prace domowe dyskusja pytania retoryczne pytania uczniów Ilustracje pliki audio, wideo i multimedia fotografie, obrazy, grafiki, tabele, diagramy, humor, anegdoty, dowcipy, komiksy, przypowieści, powiedzenia, krzyżówki, cytaty Dodatki streszczenia artykuły sztuczki dla ciekawskich szopki podręczniki podstawowy i dodatkowy słownik terminów inne Udoskonalanie podręczników i lekcjipoprawianie błędów w podręczniku aktualizacja fragmentu podręcznika, elementy innowacji na lekcji, wymiana przestarzałej wiedzy na nową Tylko dla nauczycieli doskonałe lekcje planie kalendarza przez rok wytyczne programy dyskusyjne Zintegrowane LekcjeDEFINICJA
Halogeny– Pierwiastki z grupy VIIA – fluor (F), chlor (Cl), brom (Br) i jod (I). Elektroniczna konfiguracja zewnętrznego poziomu energii halogenów ns 2 np 5.
Ponieważ halogenom brakuje tylko jednego elektronu przed osiągnięciem poziomu energetycznego, w ORR najczęściej wykazują właściwości utleniaczy. Stany utlenienia halogenów: od „-1” do „+7”. Jedyny pierwiastek z grupy halogenowej, fluor, wykazuje tylko jeden stopień utlenienia „-1” i jest pierwiastkiem najbardziej elektroujemnym.
Wytwarzanie halogenów i ich związków
Halogeny można otrzymać przez elektrolizę roztworów lub stopów halogenków:
MgCl2 = Mg + Cl2 (stop)
Najczęściej halogeny otrzymuje się w reakcji utleniania kwasów halogenowodorowych:
MnO2 + 4HCl = MnCl2 + Cl2 +2H2O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2O +2KCl
HF i HCl wytwarza się w reakcji ich stałych soli ze stężonym kwasem siarkowym podczas ogrzewania:
CaCl2 + H2SO4 = CaSO4 + 2HCl
W ten sposób nie można otrzymać HBr i HI, ponieważ substancje te są silnymi środkami redukującymi i są utleniane przez kwas siarkowy:
2KBr + 2H 2 SO 4 = K 2 SO 4 + Br 2 + 2H 2 O + SO 2
8KI + 5H 2 SO 4 = 4K 2 SO 4 +4I 2 +4H 2 O + H 2 S
Dlatego HBr i HI otrzymuje się przez hydrolizę odpowiednich halogenków fosforu:
PBr 3 + 3H 2 O = 3HBr + H 3 PO 3
Wśród związki zawierające tlen halogeny najwyższa wartość zawierają kwasy zawierające tlen i ich sole. Zatem HClO jest jednym z kwasów chloru zawierających tlen - kwas podchlorawy otrzymuje się w wodnych roztworach chloru jako produkt hydrolizy:
Cl2 + H2O ↔ HClO + HCl
Sole kwasu podchlorawego - podchloryny powstają podczas przepuszczania chloru przez zimne roztwory alkaliczne, na przykład:
Cl2 + 2KOH = KClO + KCl + H2O
Kwas podchlorawy (HClO 3) otrzymuje się przez działanie soli kwasowych (chloranów) stężonym kwasem siarkowym:
Ba(ClO 3) 2 + H 2 SO 4 = BaSO 4 + 2HClO 3
Sole kwasu podchlorawego - chlorany otrzymuje się przez przepuszczenie Cl2 do gorącego roztworu alkalicznego:
3Cl 2 + 6KOH = 5 KCl + KClO 3 + 3H 2 O
HClO 4 to kwas nadchlorowy, który można otrzymać przez działanie nadchloranu potasu stężonym kwasem siarkowym:
2 KClO 4 + H 2 SO 4 = K 2 SO 4 +2 HClO 4
Roztwory kwasów podbromowego (HOBr) i podjodowego (HOI), takie jak HClO, można przygotować w reakcji odpowiednich halogenów z wodą.
Br2 + H2O = HBr + HOBr
Ja 2 + H 2 O = HI + HOI
Kwasy bromowy (HBrO 3) i jodowy (HIO 3) można otrzymać przez utlenienie wody bromowej lub jodowanej chlorem:
Br 2 + 5Cl 2 + 6H 2 O = 2HBrO 3 + 10 HCl
Biologiczne znaczenie halogenów i ich związków
Chlor - jeden niezbędne elementy które są częścią organizmów żywych. Organizm zawiera ją w postaci soli – chlorku sodu. Chlor pobudza metabolizm, porost włosów, dodaje wigoru i siły. Większość NaCl znajduje się w osoczu krwi.
HCl, będący częścią soku żołądkowego, reguluje procesy trawienia. W przypadku braku 0,2% HCl proces trawienia pokarmu praktycznie się zatrzymuje.
Glony, podobnie jak niektóre inne rośliny, aktywnie gromadzą brom. Woda morska zawiera najwięcej duża liczba brom, który może przedostawać się do powietrza, dlatego jego zawartość w powietrzu obszarów przybrzeżnych jest zawsze wyższa niż na obszarach oddalonych od morza.
Jod, podobnie jak chlor, jest jednym z najważniejszych pierwiastków tworzących organizmy żywe. Brak jodu w wodzie i jedzeniu zmniejsza produkcję hormonu tarczycy i prowadzi do wola endemicznego. Jod dostaje się do organizmu wraz z pożywieniem: chlebem, jajkami, mlekiem, wodą, wodorostami oraz z powietrzem (zwłaszcza morskim) podczas oddychania.
Zastosowanie halogenów i ich związków
Halogeny są szeroko stosowane w przemyśle. Zatem fluor służy do produkcji smarów, które są w stanie wytrzymać wysoka temperatura, teflon, freony itp. Do produkcji wykorzystuje się chlor kwasu solnego, wybielacze, podchloryn i chlorany, do wybielania tkanin i celulozy stosowanej do produkcji papieru, do sterylizacji wody pitnej i dezynfekcji Ścieki itp.
Brom jest niezbędny do produkcji różnych substancji leczniczych, niektórych barwników, a także bromku srebra, który wykorzystuje się do produkcji materiałów fotograficznych.
Jod stosowany jest w medycynie w postaci 10% roztworu w etanolu jako środek antyseptyczny i hemostatyczny. Jod jest zawarty w wielu środkach farmaceutycznych.
Kwas fluorowodorowy (HF) stosuje się do produkcji fluorków, trawienia szkła, usuwania piasku z odlewów metalowych i analizy minerałów.
Kwas solny (HCl) jest szeroko stosowany w praktyce chemicznej, podobnie jak jego sole. Na przykład chlorek sodu ( sól) służy jako surowiec do produkcji chloru, kwasu solnego, sody kaustycznej i jest stosowany w farbiarstwie, mydlarstwie i innych gałęziach przemysłu.
Przykłady rozwiązań poprzez zadawanie pytań
PRZYKŁAD 1
| Ćwiczenia | Zapisz równania następujących reakcji: 1) FeSO 4 + KClO 3 + H 2 SO 4 → ... 2) FeSO 4 + KClO 3 + KOH → ... 3) Ja 2 + Ba(OH) 2 → … 4) KBr + KVrO 3 + H 2 SO 4 → ... |
| Odpowiedź | a) W tej reakcji żelazo zwiększa swój stopień utlenienia z „+2” do „+3”, tj. FeSO 4 jest środkiem redukującym, a chlor obniża stopień utlenienia z „+5” do „1”, tj. KClO 3 jest utleniaczem: 6FeSO 4 + KClO 3 + 3H 2 SO 4 = 3Fe 2 (SO 4) 3 + KCl + 3H 2 O b) W tej reakcji żelazo zwiększa swój stopień utlenienia z „+2” do „+3”, tj. FeSO 4 jest środkiem redukującym, a chlor obniża stopień utlenienia z „+5” do „1”, tj. KClO 3 jest utleniaczem: 6FeSO 4 + KClO 3 + 12KOH + 3H 2 O = 6Fe(OH) 3 ↓ + KCl + 6K 2 SO 4 c) W tej reakcji jod zarówno zwiększa, jak i zmniejsza stopień utlenienia od „0” do „+5” i od „0” do „-1”, tj. I 2 jest zarówno środkiem redukującym, jak i utleniającym - zachodzi reakcja dysproporcjonowania: 6I 2 + 6Ba(OH) 2 = 5BaI 2 + Ba(IO 3) 2 + 6H 2 O d) W tej reakcji brom zarówno zwiększa, jak i zmniejsza stopień utlenienia z „-1” do „0” i od „+5” do „0”, tj. KBr jest środkiem redukującym, a KBrO 3 jest środkiem utleniającym: 5КВr + КВrО 3 + 3Н 2 SO 4 = 3Вr 2 + 3К 2 SO 4 + 3Н 2 О |
1. Ogólna charakterystyka halogenów . Budowa atomowa i stopnie utlenienia halogenów w związkach. Charakter zmian promieni atomowych, energii jonizacji, powinowactwa elektronowego i elektroujemności w szeregu F - At. Charakter wiązań chemicznych halogenów z metalami i niemetalami. Stabilność wyższych stanów wartościowości halogenów. Cechy fluoru.
1. Z. 367-371; 2. Z. 338-347; 3. Z. 415-416; 4. Z. 270-271; 7. Z. 340-345.
2. Budowa molekularna i właściwości fizyczne prostych substancji halogenowych . Postać wiązanie chemiczne w cząsteczkach halogenów. Właściwości fizyczne halogeny: stan skupienia, temperatury topnienia i wrzenia w szeregu fluorowo-astatynowym, rozpuszczalność w wodzie i rozpuszczalnikach organicznych.
1. Z. 370-372; 2. Z. 340-347; 3. Z. 415-416; 4. Z. 271-287; 8. Z. 367-370.
3. Właściwości chemiczne halogenów . Przyczyny wysokiej aktywności chemicznej halogenów i jej zmiany według grup. Związek z wodą, roztworami alkalicznymi, metalami i niemetalami. Wpływ temperatury na skład produktów dysproporcjonowania halogenów w roztworach alkalicznych. Cechy chemii fluoru. Naturalne związki halogenowe. Zasady przemysłowych i laboratoryjnych metod wytwarzania halogenów. Zastosowanie halogenów. Fizjologiczne i farmakologiczne oddziaływanie halogenów i ich związków na organizmy żywe. Toksyczność halogenów i środki ostrożności podczas pracy z nimi.
1. Z. 372-374, s. 372-374. 387-388; 2. Z. 342-347; 3. Z. 416-419; 4. Z. 276-287; 7. s. 340-345, s. 340-345 355; 8. Z. 380-382.
Substancje proste, halogeny, w przeciwieństwie do wodoru, są bardzo aktywne. Najbardziej charakteryzują się właściwościami utleniającymi, które stopniowo słabną w szeregu F 2 – At 2. Najbardziej aktywnym z halogenów jest fluor: nawet woda i piasek w jego atmosferze zapalają się samoistnie! Halogeny reagują energicznie z większością metali, niemetali i substancji złożonych.
4. Produkcja i zastosowanie halogenów .
1. Z. 371-372; 2. Z. 345-347; 3. Z. 416-419; 4. Z. 275-287; 7. s. 340-345; 8. Z. 380-382.
Wszystkie metody wytwarzania halogenów opierają się na reakcjach utleniania anionów halogenkowych różnymi utleniaczami: 2Gal -1 -2e - = Gal
W przemyśle halogeny otrzymuje się przez elektrolizę stopów (F2 i Cl2) lub wodnych roztworów (Cl2) halogenków; zastąpienie mniej aktywnych halogenów przez bardziej aktywne z odpowiednich halogenków (I 2 - brom; I 2 lub Br 2 - chlor)
Halogeny w laboratorium otrzymuje się przez utlenianie halogenowodorów (HCl, HBr) w roztworach silnymi utleniaczami (KMnO 4, K 2 Cr 2 O 7, PbO 2, MnO 2, KClO 3); utlenianie halogenków (NaBr, KI) wskazanymi utleniaczami w środowisku kwaśnym (H 2 SO 4).
Binarne związki halogenowe
1. Związki wodoru (halogenowodory) . Charakter wiązań chemicznych w cząsteczkach. Polaryzacja cząsteczek. Właściwości fizyczne, stan skupienia, rozpuszczalność w wodzie. Charakter zmian temperatur topnienia i wrzenia w szeregu HF – HI. Stowarzyszenie cząsteczek fluorowodoru. Stabilność termiczna halogenowodorów. Reaktywność. Właściwości kwasów, cechy kwasu fluorowodorowego. Właściwości regenerujące. Ogólne zasady otrzymywanie halogenowodorów: synteza z proste substancje i z halogenków. Chlorowodór i kwas solny. Fizyczne i Właściwości chemiczne. Metody uzyskiwania. Zastosowanie kwasu solnego. Rola kwasu solnego i chlorków w procesach życiowych. Halogenki.
1. Z. 375-382; 2. Z. 347-353; 3. Z. 419-420; 4. Z. 272-275, s. 272-275. 289-292; 7. s. 354–545; 8. Z. 370-373, s. 370-373. 374-375.
2 . Związki halogenów z tlenem.
1. Z. 377-380; 2. Z. 353-359; 3. Z. 420-423; 4. Z. 292-296; 7. s. 350-354; 8. Z. 375-376, s. 375-376. 379.
3. Związki z innymi niemetalami.
1. Z. 375-381; 2. Z. 342-345; 4. Z. 292-296; 7. s. 350-355.
4 . Połączenia z metalami .
2. Z. 342; 4. Z. 292-296; 7. s. 350-355.
Wieloelementowe związki halogenowe
1. Kwasy chlorowe zawierające tlen i ich sole. Kwasy podchlorawy, chlorowy, nadchlorowy i nadchlorowy. Zmiany właściwości kwasowych, stabilności i właściwości utleniających w szeregu HClO – HClO 4 . Zasady otrzymywania tych kwasów. Podchloryny, chloryny, chlorany i nadchlorany. Stabilność termiczna i właściwości utleniające. Ogólne zasady otrzymywania soli. Stosowanie soli. Proszek wybielający. sól Berthollet’a. Nadchloran amonu.
1. Z. 382-387; 2. Z. 353-359; 3. Z. 423; 4. Z. 292-296; 7. s. 350-354; 8. Z. 375-378.
2 . Zawierające tlen kwasy bromowe i jodowe oraz ich sole .
1. Z. 382-387; 2. Z. 353-359; 3. Z. 423; 4. Z. 292-296; 7. s. 350-354; 8. Z. 379-380.
3 . Zastosowanie halogenów i ich najważniejszych związków
1. Z. 387-388; 2. Z. 345-347; 3. Z. 419-423; 4. Z. 272-296; 8. Z. 380-382.
4 . Biologiczna rola związków halogenowych
1. Z. 387-388; 2. Z. 340-347; 3. Z. 419-423; 4. Z. 272-296; 8. Z. 380-382.
Relacjanajważniejsze związki chloru:
