Модель химического соединения. Современные наукоемкие технологии
АННОТАЦИЯ
В статье рассматриваются квантово-химические модели атомов, молекул, позволяющие понять сущность химических превращений вещества на атомном и молекулярном уровне его организации.
ABSTRACT
The article is devoted to a detailed consideration of graphic quantum-chemical models of atoms, molecules and chemical bonds. This approach allows understanding the nature of the chemical processes and the laws of their proceeding.
Современные представления о строении атомов и молекул, понимание химических превращений вещества на атомном и молекулярном уровне его организации раскрывает квантовая химия.
С позиции квантовой химии атом – это микросистема, состоящая из ядра и электронов, движущихся в электромагнитном поле ядра. На рис. 1 представлены орбитальные, электронные и электронографические модели атомов первого и второго периодов, построенные с использованием квантовых принципов и правил заполнения электронами энергетических уровней в атомах. Четыре квантовых числа n , l , m l , m s полностью характеризуют движение электронов в поле ядра. Главное квантовое число n характеризует энергию электрона, его удалённость от ядра и соответствует номеру энергетического уровня, на котором находится электрон. Орбитальное квантовое число l определяет форму орбитали и энергию подуровней одного и того же энергетического уровня. Понятие «орбиталь» означает наиболее вероятную область движения электрона в атоме. Магнитное квантовое число m l определяет число орбиталей и их пространственную ориентацию. Главное, орбитальное и магнитное квантовые числа взаимосвязаны. Орбитальное квантовое число l принимает значения на единицу меньше, чем главное квантовое число n . Если n = 1, то l = 0, и по форме это сферическая 1s -орбиталь. Если n = 2, то орбитальное квантовое число принимает два значения: l = 0, 1, указывающие на наличие двух подуровней. Это сферическая 2s - орбиталь (l = 0) и три 2p -орбитали, напоминающие по форме гимнастические гантели, расположенные под углом 90 о по осям декартовой системы координат.
Рисунок 1. Квантово-химические, электронные и электронографические модели атомов первого и второго периодов
Число и пространственное расположение 2p -орбиталей определяет магнитное квантовое число m l , которое принимает значения в пределах изменения орбитального квантового числа от –l до +l . Если l = 0, то m l = 0 (одна s - орбиталь). Если l = 1, то m l принимает три значения –1 , 0, +1 (три р -орбитали).
Орбитальные модели атомов показывают пространственное расположение и форму орбиталей, а на электронографических моделях в виде символических квантовых ячеек дано изображение орбиталей и положение уровней и подуровней на энергетической диаграмме. Следует обратить внимание на размеры атомов. В периодах повторяется одна и та же закономерность – по мере увеличения заряда ядра происходит возрастающая деформация (сжатие) орбиталей под действием электромагнитного притяжения электронов ядром (рис. 1).
Размещение электронов на орбиталях подчиняется одному из важнейших принципов квантовой механики (принцип Паули): на одной орбитали может находиться не больше двух электронов, причем они должны различаться собственным моментом количества движения – спином (англ. spin вращение). Электроны, различающиеся спинами, условно изображают стрелками и ¯. Когда на одной орбитали находятся два электрона, они имеют антипараллельные спины и не мешают друг другу двигаться в поле ядра.
Это свойство напоминает вращение в зацеплении двух шестеренок. Находясь в зацеплении, одна шестеренка вращается по часовой стрелке, другая – против часовой стрелки. Третья шестеренка в зацеплении с двумя другими останавливает вращение. Она лишняя. Так и на одной орбитали может находиться лишь 2 электрона, третий – лишний.
При заполнении электронами энергетических уровней и подуровней в действие вступает квантовый принцип минимума энергии (правило Клечковского). Электроны заполняют орбитали от низшего к высшему энергетическому уровню. Принцип минимума энергии напоминает заполнение этажей многоэтажного дома в период наводнения. Вода поднимается и заполняет все этажи снизу вверх, не пропуская ни одного.
В соответствии с правилом Хунда все р -орбитали заполняются сначала одним электроном и только затем вторым с антипараллельным спином.
Квантовохимические модели атомов позволяют объяснить свойства атомов обмениваться энергией, отдавать и присоединять электроны, изменять геометрическую конфигурацию, образовывать химические связи.
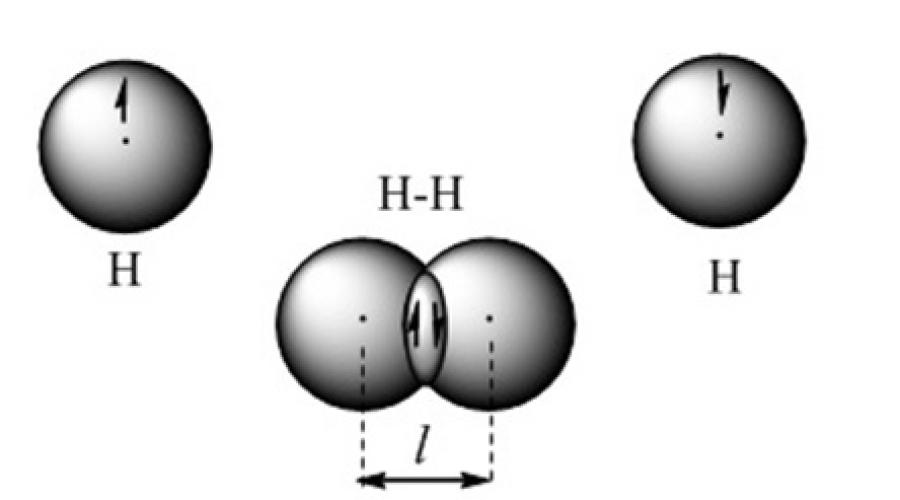
Ковалентная химическая связь образуется при перекрывании валентных электронных облаков. Например, такая связь представлена в орбитальной модели молекулы водорода (рис. 2).
/Zakharova.files/image002.jpg)
Рисунок 2. Модель ковалентной связи в молекуле водорода
Использование квантовохимического метода валентных связей основано на представлении, о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких электронных пар с антпараллельными спинами. С позиции метода валентных связей молекула – это микросистема, состоящая из двух или большего числа ковалентно связанных атомов. Положительно заряженные ядра атомов удерживаются отрицательным зарядом, сосредоточенным в области перекрывания атомных орбиталей. Притяжение ядер атомов к повышенной электронной плотности между ними уравновешивается силой отталкивания ядер между собой. Образуется устойчивая микросистема, в которой длина ковалентной связи равна расстоянию между ядрами.
В молекуле фтора так же, как и в молекуле водорода, имеется неполярная ковалентная связь. При перекрывании 2р 1 -орбиталей электронная пара создает между ядрами атомов повышенную электронную плотность и удерживает молекулу в устойчивом состоянии (рис. 3).
/Zakharova.files/image003.jpg)
Рисунок 3. Модель ковалентной связи в молекуле фтора
Под неполярной ковалентной связью подразумевается такое перекрывание валентных орбиталей, в результате которого совпадают центры тяжести положительных и отрицательных зарядов.
Возможно образование полярной ковалентной связи при перекрывании 1s 1 - и 2р 1 -орбиталей. На рис. 4 представлена модель фтороводорода с полярной ковалентной связью. Электронная плотность между ковалентно связанными атомами смещается к атому фтора, заряд ядра которого (+9) оказывает большее электромагнитное притяжение по сравнению с ядром атома водорода с зарядом (+1).
/Zakharova.files/image004.jpg)
Рисунок 4. Модель полярной ковалентной связи в молекуле фтороводорода
Ионная связь обусловлена притяжением электрически заряженных частиц – ионов. На рис. 5 представлена модель образования ионной связи во фториде лития. Сильное электромагнитное поле, создаваемое ядром атома фтора, захватывает и удерживает на р -орбитали электрон, принадлежавший атому лития. Атом лития, лишенный электрона, изменяет геометрическую конфигурацию (исчезла 2s -орбиталь), становится положительно заряженным ионом и притягивается к отрицательно заряженному иону фтора, который приобрел лишний электрон на р -орбиталь.
/Zakharova.files/image005.jpg)
Рисунок 5. Модель ионной пары Li + F - фторида лития
Силы электростатического притяжения противоположно заряженных ионов и отталкивания электронных оболочек ионов лития и фтора уравновешены и удерживают ионы на расстоянии, соответствующем длине ионной связи. Перекрывание орбиталей в соединениях с ионной связью практически отсутствует.
Особый вид химической связи проявляется в атомах металлов. Кристалл металла (рис. 6) состоит из положительно заряженных ионов, в поле которых свободно движутся валентные электроны («электронное облако»).
/Zakharova.files/image006.jpg)
Рисунок 6. Модель кристалла металлического лития
Ионы и «электронное облако» взаимно удерживают друг друга в устойчивом состоянии. Благодаря высокой подвижности электронов металлы обладают электронной проводимостью.
В молекулах атомы, связанные несколькими ковалентными связями, изменяют геометрическую конфигурацию. Рассмотрим проявление этого свойства на примере атома углерода (1s 2 -орбиталь в моделях атома углерода не изображена, т.к. не участвует в образовании химической связи).
Экспериментально установлено, что в молекуле СН 4 атом углерода образует с атомами водорода четыре одинаковые ковалентные связи, эквивалентные по своим энергетическим и пространственным характеристикам. Трудно представить четыре одинаковые ковалентные связи, если иметь в виду, что в углероде валентные электроны располагаются на двух энергетических 2s и 2p подуровнях:
/Zakharova.files/image007.jpg)
В основном (невозбужденном) состоянии углерод образует лишь две ковалентные связи. В возбужденном состоянии один электрон с подуровня 2s переходит на более высокий энергетический подуровень 2p . В результате такого перескока электрона увеличивается суммарная энергия 2s - и 2p -орбиталей и валентность атома углерода изменяется до четырех:
/Zakharova.files/image008.jpg)
И все же этого недостаточно, чтобы объяснить четыре равноценные ковалентные связи в молекуле СН 4 , т.к. 2s - и 2p -орбитали имеют разную форму и пространственное расположение. Проблема была решена введением гипотезы о гибридизации – смешении валентных электронов в подуровнях одного и того же энергетического уровня. В молекуле метана одна 2s - и три 2р -орбитали атома углерода в результате гибридизации превращаются в четыре равноценные sp 3 -гибридные орбитали:
/Zakharova.files/image009.jpg)
В отличие от невозбужденного (основного) состояния атома углерода, в котором три 2р -орбитали атома расположены под углом 90 о (рис. 7,а ), в молекуле метана (рис. 7,b ) равноценные по форме и размерам sp 3 -гибридные атома углерода расположены под углом 109 о 28 " .
/Zakharova.files/image010.jpg)
Рисунок 7. Модель молекулы метана
В молекуле этилена С 2 Н 4 (рис. 8,а ) атомы углерода находятся в s р 2 -гибридном состоянии. В гибридизации участвует 2s -орбиталь и две 2р -орбитали. В результате гибридизации атомы углерода образуют три равноценные sp 2 -гибридные орбитали, расположенные под углом 120 о на плоскости; 2p z -орбиталь не участвует в гибридизации.
/Zakharova.files/image011.jpg)
Рисунок 8. Модель молекулы этилена
В молекуле этилена атомы углерода связаны не только s-связью, но и p-связью. Она образуется в результате перекрывания р z -орбиталей с образованием двух областей перекрывания над и под осью, соединяющей ядра, по обе стороны от оси s-связи (рис.8).
Модель тройной связи представлена в молекуле ацетилена (рис. 9). При смешении одной 2s - и одной 2р х - орбитали атома углерода образуются две sp -гибридные орбитали, которые располагаются на линии, соединяющей ядра атомов (угол 180 о). Негибридные 2р у - и 2р z -орбитали разных атомов углерода перекрываются, образуя две p-связи во взаимно перпендикулярных плоскостях (рис. 9).
/Zakharova.files/image012.jpg)
Рисунок 9. Модель молекулы ацетилена
Молекулы, подобно атомам, проявляют свойство разрывать и образовывать химические связи, изменять геометрическую конфигурацию, переходить из электронейтрального в ионное состояние. Указанные свойства представлены в реакции между молекулами аммиака NН 3 и фтороводорода HF (рис. 10). Разрывается ковалентная связь в молекуле фтороводорода, и образуется ковалентная донорно-акцепторная связь между азотом и водородом в молекуле аммиака. Донором выступает неподелённая пара электронов атома азота, акцептором – вакантная орбиталь атома водорода (рис. 10). Геометрическая конфигурация молекулы NН 3 (тригональная пирамида, валентный угол 107 о 18") изменяется на тетраэдрическую конфигурацию иона NН 4 + (109 о 28"). Завершающим процессом является образование ионной связи в кристаллической структуре фторида аммония. Орбитальные модели молекул позволяют показать все перечисленные выше свойства в одной реакции: разрывать и образовывать химические связи, изменять геометрическую конфигурацию, переходить из электронейтрального в ионное состояние.
/Zakharova.files/image013.jpg)
Рис. 10. Модель образования ионной пары кристаллического NH 4 + F -
Химическая реакция с использованием символов химических элементов:
NН 3 + HF → NН 4 F,
дает обобщенное выражение того, что раскрыто в орбитальных моделях молекул. Химические реакции, представленные орбитальными моделями и символами химических элементов, взаимно дополняют друг друга. В этом их достоинство. Овладение элементарными знаниями квантово-химического выражения структуры и состава атомов и молекул ведет к пониманию ключевых химических понятий: ковалентная полярная и неполярная связь, донорно-акцепторная связь, ионная связь, геометрическая конфигурация атомов и молекул, химическая реакция. И на фундаменте этих знаний можно уверенно использовать символику химических элементов и соединений для краткого описания химических состояний и превращений вещества.
Приведем ещё пример реакции, рассматриваемой с позиций квантовой химии. Вода проявляет свойства слабого электролита. Электролитическую диссоциацию обычно представляют уравнением:
Н 2 О ⇄Н + + ОН -
Н 2 О + Н 2 О ⇄Н 3 О + + ОН - .
Деление молекул воды на положительно и отрицательно заряженные ионы раскрывает квантовохимическая модель реакции электролитической диссоциации (рис. 11).
/Zakharova.files/image014.jpg)
Рисунок 11. Модель электролитической диссоциации воды
Молекула воды представляет собой искаженную пирамиду (валентный угол 104 о 30"). Две s р 3 -гибридные орбитали атома кислорода образуют s-связи с атомами водорода. Две другие s р 3 -гибридные орбитали располагают свободными парами электронов с антипараллельными спинами. Разрыв ковалентной Н−О связи в одной из молекул приводит к образованию на соседней молекуле ковалентной химической связи по донорно-акцепторному механизму. Ион водорода, располагающий вакантной орбиталью, выступает в роли акцептора электронной пары атома кислорода соседней молекулы воды. В этом примере, как и в предыдущем, квантово-химический подход позволяет понять физико-химический смысл процесса электролитической диссоциации воды.
Мышление – это процесс, с помощью которого мы опосредствованно можем судить о том, что скрыто от нашего чувственного восприятия. Квантовая химия дает зрительный образ химических процессов и состояний вещества, раскрывает то, что скрыто от нашего чувственного восприятия, побуждает учиться и размышлять.
Список литературы:
1. Выготский Л.С. Мышление и речь. – М.: Лабиринт, 1999. – 352 с.
2. Загашев И.О., Заир-Бек С.И. Критическое мышление: технология раз-вития. – СПб: Альянс «Дельта, 2003. – 284 с.
3. Краснов К.С. Молекулы и химическая связь. – М.: Высшая школа, 1984. – 295 с.
4. Леонтьев А.Н. Лекции по общей психологии. – М.: Смысл, 2000. – 512 с.
5. Перегудов Ф.И., Тарасенко Ф.П. Введение в системный анализ. – М.: Высшая школа, 1989. – 367 с.
6. Прокофьев В.Ф. Человек – управляемый биокомпьютер? // Вестник международной академии наук (русская секция). – 2008. – №1. – С. 1-21.
7. Яблоков В.А., Захарова О.М. Системная организация содержания обу-чения химии // Universum: Психология и образование: электрон. научн. журн. 2016. №5(23) / [Электронный ресурс]. – Режим доступа:
URL://сайт/ru/psy/archiv/item/2505 (дата обращения 2.04.2017)
1.4.1 Химические модели
Кроме наблюдения и эксперимента в познании естественного мира и химии большую роль играет моделирование. Одна из главных целей наблюдения – поиск закономерностей в результатах экспериментов. Однако некоторые наблюдения неудобно или невозможно проводить непосредственно в природе. Естественную среду воссоздают в лабораторных условиях с помощью особых приборов, установок, предметов, т.е., моделей. В моделях копируются только самые важные признаки и свойства объекта и опускаются несущественные для изучения. Так в химии модели условно можно разделить на две группы: материальные и знаковые .
Модели химических и промышленных аппаратов
Материальные модели атомов, молекул, кристаллов, химических производств химики используют для большей наглядности.
Наиболее распространенным изображением атома является модель, напоминающая строение Солнечной системы.
Для моделирования молекул веществ часто используют шаростержневые модели. Модели этого типа собирают из цветных шариков, обозначающих входящие в состав молекулы атомы. Шарики содиняют стержнями, символизирующие химические связи. С помощью шаростержневых моделей довольно точно воспроизводятся валентные углы в молекуле, но межъядерные расстояния отражаются лишь приблизительно, поскольку длины стержней, соединяющих шарики, не пропорциональны длинам связей.
Модели Дрединга достаточно точно передают валентные углы и соотношение длин связей в молекулах. Ядра атомов в них, в отличие от шаростержневых моделей, обозначаются не шариками, а точками соединения стержней.
Полусферические модели, называемые также моделями Стюарта – Бриглеба, собирают из шаров со срезанными сегментами. Модели атомов соединяют между собой плоскостями срезов с помощью кнопок. Полусферические модели точно передают как соотношение длин связей и валентных углов, так и заполненность межъядерного пространства в молекулах. Однако эта заполненность не всегда позволяет получить наглядное представление о взаимном расположении ядер.
Модели кристаллов напоминают шаростержневые модели молекул, однако изображают не отдельные молекулы вещества, а показывают взаимное расположение частиц вещества в кристаллическом состоянии.
Однако чаще химики пользуются не материальными, а знаковыми моделями – это химические символы, химические формулы, уравнения химических реакций. С помощью символов химических элементов и индексов записываются формулы веществ. Индекс показывает, сколько атомов данного элемента входит в состав молекулы вещества. Он записывается справа от знака химического элемента.
Химическая формула – основная знаковая модель в химии. Она показывает: конкретное вещество; одну частицу этого вещества; качественный состав вещества, т.е., атомы каких элементов входят в состав данного вещества; количественный состав, т.е., сколько атомов каждого элемента входит в состав молекулы вещества.
Все вышеприведенные модели широко используются при создании интерактивных компьютерных моделей .
1.4.2 Классификация компьютерных моделей
Среди различных типов педагогических программных средств особо выделяют те, в которых используются компьютерные модели. Применение компьютерных моделей позволяет не только повысить наглядность процесса обучения и интенсифицировать его, но и кардинально изменить этот процесс. В последние годы совершенствование компьютеров проходит бурными темпами, и их возможности для моделирования стали практически безграничными, поэтому значение компьютерных моделей при изучении школьных дисциплин может существенно возрасти. Э.Е. Нифантьев, А.К. Ахлебинин, В.Н. Лихачев отмечают, что основное преимущество компьютерных моделей – возможность моделирования практически любых процессов и явлений, интерактивного взаимодействия пользователя с моделью, а также осуществления проблемного, исследовательского подходов в процессе обучения .
В. Н. Лихачев предлагает классифицировать учебные компьютерные модели по ряду критериев, основными среди которых являются наличие анимации при отображении модели, способ управления, способ визуального отображения модели. По наличию анимации УКМ могут быть динамическими и статическими. Динамические содержат анимационные фрагменты для отображения моделируемых объектов и процессов, в статических они отсутствуют. По способу управления УКМ могут быть управляемые, которые позволяют изменять параметры модели, и неуправляемые, которые такой возможности не предоставляют.

Среди демонстрационных (неуправляемых) моделей можно выделить еще две группы по возможности взаимодействия с пользователем: интерактивные и неинтерактивные. Интерактивные позволяют изменять вид отображения модели или точку наблюдения на модель, не изменяя при этом ее параметров. Неинтерактивные таких возможностей не предоставляют.
Э.Е. Нифантьев, А.К. Ахлебинин и В.Н. Лихачев считают наиболее полезной с методической точки зрения классификацию по моделирующему объекту. По уровню представляемых объектов модели, используемые в преподавании химии, можно разделить на две группы: модели макромира , которые отражают внешние свойства моделируемых объектов и их изменение и модели микромира , которые отражают строение объектов и происходящие в них изменения на уровне их атомно-молекулярного представления. А модели таких объектов, как химические вещества, химические реакции и физико – химические процессы, могут быть созданы как на уровне микромира, так и на уровне макромира.

Классификацию УКМ можно представить в виде схемы для большей наглядности.
1.4.3 Компьютерные модели микромира
Объектами для моделирования на уровне микромира являются атомы, ионы, молекулы, кристаллические решетки, структурные элементы атомов. На уровне микромира моделируются особенности строения вещества, взаимодействия частиц, из которых состоит вещество. Для моделирования химических реакций на уровне микромира большой интерес представляют механизмы протекания химических процессов. А в моделях физико-химических процессов рассматриваются процессы, происходящие на электронном или атомно-молекулярном уровне.
Понятно, что УКМ, моделирующие модели микромира, становятся отличными помощниками при изучении строения атомов, типов химической связи, строения вещества и т.д..
Модели атомов 1 – 3 периодов периодической таблицы Менделеева реализованы в программе «1С: Репетитор. Химия » в виде моделей атома Бора. Более современные представления о строении атома реализованы в программе ChemLand, где рассматривается распределение электронов по энергетическим подуровням атомов элементов и вид отдельных орбиталей на различных энергетических уровнях.
Особый интерес представляет программа HyperChem . Она представляет собой одну из основных профессиональных программ для теоретического расчета различных термодинамических и электронных параметров молекул. С ее помощью оказывается возможным строить пространственные модели различных соединений, изучать особенности их геометрического строения, определять форму и энергию молекулярных орбиталей, характер распределения электронной плотности, дипольный момент и т. д. Все выходные данные предоставляются в виде цветных рисунков, которые затем можно распечатать на принтере, получая качественное изображение химических соединений в требуемых ракурсах и проекциях. Достоинством программы является возможность рассмотреть молекулу с разных сторон, ознакомиться с особенностями ее пространственного строения. Это представляется чрезвычайно важным, поскольку, как показывает практика преподавания, у учеников обычно не формируется представления о молекулах как о пространственных структурах. Традиционное изображение химических веществ в одной плоскости приводит к потере целого измерения и не стимулирует развития пространственного воображения.
В мультимедийном курсе «Химия для всех » используется программа – стереодемонстратор молекул. Она позволяет предоставлять объемные изображения молекул, состоящих из атомов водорода, кислорода, углерода и азота. Для демонстрации используют каркасные модели молекул. Модели можно перемещать, поворачивать, демонстрировать одновременно изображения нескольких различных молекул. Программа позволяет создавать новые модели молекул самостоятельно. Всего приведены модели 25 органических молекул, однако дидактическая ценность этих моделей невелика, так как предоставлены модели достаточно простых соединений, которые каждый школьник сможет собрать, используя пластилин и спички.
Демонстрационные орбитально-лопастные трехмерные модели некоторых молекул реализованы в программе «Метод валентных связей: гибридизация атомных орбиталей». А в программе «Природа химической связи » объясняются причины возникновения химической связи на примере образования молекулы водорода из атомов. Обе указанные программы входят в комплект обучающих программ «Химия для всех – 2000 ».
Интерактивные демонстрационные каркасные модели используются в программах ChemLand – 115 молекул преимущественно органических соединений, и «Химия для всех ». У этих двух программ есть свои плюсы и минусы: в программе «Химия для всех» модели можно демонстрировать на полный экран монитора, а в программе ChemLand такой функции нет, однако, в программе представлено большое количество молекул. В программе ChemLand используются динамические модели, демонстрирующие пространственное строение молекул с возможностью измерения валентных углов и длин связей , что позволяет проследить изменение полярности треугольной молекулы в зависимости от типа атомов.
При изучении строения молекул и кристаллов могут быть полезны программы, больше предназначенные для исследовательских целей. Это, например, программа CS Chem3D Pro, которая позволяет создавать, изменять и отображать трехмерную структуру различных молекул. Также полезна программа Crystal Designer, которая предназначена для визуализации трехмерной структуры кристаллической решетки. Эти программы могут быть полезны при создании трехмерных изображений молекул и кристаллов и для их демонстрации на уроках с помощью компьютера.
Программа «Собери молекулу », хотя и уступает по своим возможностям вышеназванным программам, может эффективно использоваться при индивидуальной работе школьников.
Модели физико – химических процессов и механизмов реализованы в программе «Химия для всех ». Здесь продемонстрированы неинтерактивные модели по теме «Электролитическая диссоциация»: диссоциация солей, кислот, щелочей, гидролиз солей. В этой же программе реализованы некоторые модели механизмов органических реакций: бромирование алканов, этерификация, общий механизм реакций полимеризации и т.д. Все модели механизмов реакций неинтерактивные, демонстрируются на полный экран, имеют звуковое сопровождение, однако отсутствует текстовое описание происходящих явлений, что существенно ограничивает использование программы.
В онлайновой версии интерактивного учебника для средней школы по органической химии для X – XI классов под редакцией Г. И. Дерябиной, А. В. Соловова представлены обменный и донорно-акцепторный механизмы образования ковалентной связи, гомолитический и гетеролитический механизмы разрыва ковалентной связи на примере отрыва атома водорода от молекулы метана, процесс sp – гибридизации. Большой интерес представляют интерактивные трехмерные демонстрационные модели органических молекул и механизмов химических реакций: хлорирование метана и общий механизм нуклеофильного замещения. Очень важно, что при работе с моделями можно изменять их положение в пространстве, а для механизма реакции – изменять положение точки наблюдения.
Еще одна программа, демонстрирующая механизмы химических реакций, программа Organic Reaction Animations. Она содержит 34 механизма органических реакций. Причем, каждый механизм представлен в виде четырех вариантов молекулярных моделей: шаростержневой, объемной и двух вариантов орбитально-лопастных моделей. Один из вариантов орбитально-лопастных моделей демонстрирует изменение в ходе реакции внешних орбиталей субстрата, а другой – реагента. Это облегчает наблюдение за изменением внешних орбиталей реагентов в ходе реакции. При необходимости можно воспользоваться теоретическим материалом .интерактивного многоканального инструмента познания. Разработка учащимися собственных...
Компьютерные тестирования
Тесты >> Информатика... методик ... изучению литературы... разработки тестов и тестирования. Технология компьютеризированного тестирования должна обладать основными характеристиками: наличие интерактивной ... микромиров ); ... (школьный ... их использование при ... модели / Учебное пособие к курсу ...
Философия и методология науки
Учебное пособие >> ФилософияВ области биологии при изучении совместной эволюции различных биологических видов, их структур и уровней организации... и устоявшихся. Использование методов сопротивляется внешним ограничениям, накладываемым на параметры исследования. Модели осуществления...
Социально-культурная деятельность (2)
Учебное пособие >> Социология... их изучения , сохранения, производства, освоения, использования и, как следствие, разработки ... . При изучении курса , ... микромиром ... модели и кончая моделью ... интерактивные педагогические методы и технологии. Среди них - частные методики ... дошкольные, школьные (...
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
HTML-версии работы пока нет.
Cкачать архив работы можно перейдя по ссылке, которая находятся ниже.
Подобные документы
Гомологический ряд метана. Строение молекулы метана. Углы между всеми связями. Физические свойства алканов. Лабораторные способы получения. Получение из солей карбоновых кислот. Тип гибридизации атомов углерода в алканах. Структурная изомерия алканов.
презентация , добавлен 08.10.2014
Электронная модель молекулы. Теория отталкивания электронных пар валентной оболочки. Реакционная способность молекул. Классификация химических реакций. Степени свободы молекулы, их вращательное движение. Описание симметрии колебаний, их взаимодействие.
презентация , добавлен 15.10.2013
Характеристика строения атома. Определение числа протонов, электронов, нейтронов. Рассмотрение химической связи и полярности молекулы в целом. Уравнения диссоциации и константы диссоциации для слабых электролитов. Окислительно-восстановительные реакции.
контрольная работа , добавлен 09.11.2015
Структура молекулы, связи атомов и свойства ацетиленов как химических веществ. Особенности получения алкинов термолизом метана и гидрированием углерода в промышленности и реакцией элиминирования в лаборатории. Реакции алкинов с участием тройной связи.
контрольная работа , добавлен 05.08.2013
Главные положения классической теории химического строения молекулы. Характеристики, определяющие ее реакционную способность. Гомологический рад алканов. Номенклатура и изометрия углеводородов. Классификация кислородосодержащих органических соединений.
презентация , добавлен 25.01.2017
Химический элемент - совокупность атомов одного вида. Открытие химических элементов. Размеры атомов и молекул. Формы существования химических элементов. Некоторые сведения о молекулярном и немолекулярном строении веществ. Атомно-молекулярное учение.
презентация , добавлен 15.04.2012
Общая последовательность расчёта электронного строения молекулы по методу МО ЛКАО. Простой метод Хюккеля. Примеры молекулярных структур для метода МОХ. Аллил в методе МОХ. Общие свойства электронного распределения в системе хюккелевского углеводорода.
Физико-химическая модель процессов в анодном микроразряде
В.Ф. Борбат, О.А. Голованова, А.М. Сизиков, Омский государственный университет, кафедра неорганической химии
Oксидные слои, образующиеся на анодах из алюминия, титана, тантала и некоторых других металлов при прохождении электрического тока между электродами, погруженными в электролит, обладают в ряде случаев высокими защитными и диэлектрическими свойствами. В настоящее время лабораториями различных стран проводится значительный объем исследований, направленных на установление возможностей улучшения защитных и электрических свойств анодных покрытий, поиск оптимальных составов электролитов, повышение технологичности процесса и так далее. Накопленный в последнее время практический опыт использования плазменно-электролитической анодной обработки для создания защитных покрытий значительно опередил имеющиеся в указанной области теоретические представления.
Исходя из литературных и наших экспериментальных данных можно принять физическую модель анодного микроразряда, основная идея которой состоит в том, что анодный микроразряд есть сочетание искрового пробоя барьерной части оксидной пленки и газового разряда в возникшем после пробоя газо-плазменном пузырьке. Рассмотрим соответствие предлагаемой модели экспериментальным результатам с учётом последовательности процессов.
Оксидирование. При оксидировании (при постоянном напряжении на электродах) образуются слои толщиной до сотен микрон. Наряду с образованием новых слоев оксида, идет и процесс их растворения. В ряде работ показано, что в доискровой период роста оксидной пленки происходит включение в объем оксида анионов электролита, например, сульфат-ионов . В пористых пленках анионы появляются в анодном оксиде за счет механического "встраивания" компонентов раствора. Содержание включенных в оксид анионов определяется их способностью адсорбироваться на поверхности осадка или даже образовывать соединения нестехиометрического состава.
При изучении фазового и элементного состава покрытий, получаемых плазменно-электролитической обработкой, было установлено, что при данном способе получения покрытий происходит внедрение сульфат-ионов в пленку. Причем вид регистрограмм дает основание предположить, что "заработка" компонентов электролита происходит в местах возникновения анодных микроразрядов в момент их "залечивания", поэтому распределение компонентов электролита по пленке является не равномерным и отличается от распределения в пленках, полученных обычным анодированием.
Пробой - сложный вероятностный процесс, который может происходить в данной точке диэлектрика в достаточно широком диапазоне напряжений и времени. Важнейшими процессами для начала пробоя являются изменение объемного заряда около катода (раствора электролита) и увеличение объемной инжекции электронов в зону проводимости диэлектрической пленки. Эти процессы способствуют развитию пробоя. Начало пробоя связано с развитием электронных лавин. Вполне вероятно, что источником первичных ионов могут быть примесные уровни в оксиде. Такой механизм предполагает особую роль компонентов электролита, внедренных в оксид, в первую очередь анионов. Именно поэтому возможность получения анодно-искровых покрытий во многом определяется составом раствора. Электроны, попавшие в зону проводимости и ускоренные под действием поля, приобретают энергию, достаточную для того, чтобы вызвать ударную ионизацию атомов в оксиде. Последняя приводит к возникновению лавин, которые, достигая поверхности металла, образуют каналы пробоя. Существование линейной зависимости пробивного напряжения от толщины указывает на однородность поля при пробое и на электрический характер пробоя.
Разрушение оксидной пленки - при воздействии анодных микроразрядов на растворы серной кислоты действию ускоренных в электрическом поле электронов будут подвергаться молекулы воды и серной кислоты. Данные об ионизации этих растворов имеются в литературе . Исходя из них, наиболее вероятными ионами в плазме микроразрядов, скорее всего, будут ионы с наименьшими потенциалами появления, т.е. для молекул воды следует ожидать H2O+, для серной кислоты H2SO4+ и менее вероятно HSO4+.
Итак, процессы ионизации и диссоциативного прилипания электронов дают следующие ионы при воздействии микроразрядов на растворы серной кислоты (реакции 1-5). е + Н2О Н2О+ + 2е (1), е + Н2SO4 H2SO4+ + 2e (2), или HSO4 + H+ + 2e (3), e + H2O OH + H- (4), e + H2SO4 H + HSO4- (5).
Образующиеся по этим реакциям положительные и отрицательные ионы имеют два различных пути своих превращений: 1) нейтрализация зарядов; 2) ион-молекулярные реакции. Образующиеся в результате диссоциации возбужденных частиц и по ион-молекулярным реакциям радикалы вступают в реакции отрыва атома Н от молекул, находящихся в газовом пузырьке, и в реакции рекомбинации.
После образования радикалов идут реакции отрыва атома Н: H(OH, HSO4) + H2SO4 H2(H2O, H2SO4) + HSO4 (6), H(HSO3) + H2O H2(H2SO3) + OH (7) и реакции рекомбинации радикалов: HSO4 + OH H2SO4 (8), HSO4 + HSO4 H2S2O8 (9), OH + OH H2O2 (10), H + HSO4 H2SO4 (11).
Образование диоксида серы возможно в результате взаимодействия возбужденных плазмой микроразрядов молекул серной кислоты с соседними молекулами: H2SO4* + H2SO4 H2SO3 + H2SO5 (12), или также возможен механизм: H2SO4* H2SO3 + O (13). Образующиеся H2SO3 и H2SO5 из-за высокой температуры в зоне микроразрядов термически диссоциируют по уравнениям:
H2SO3 H2O + SO2 (14), 2H2SO5 2H2SO4 + 0,5 O2 (15).
Часть радикалов выходят за пределы газового пузырька микроразряда в окружающую его жидкость, где вступают в реакции рекомбинации друг с другом и реагируют с компонентами электролита. Выход продуктов в результате процессов, протекающих в припузырьковом слое электролита, будет зависеть от концентрации серной кислоты (т.е. от доли ионов, присутствующих в растворах серной кислоты разной концентрации).
Согласно предлагаемому механизму химических превращений серной кислоты при увеличении ее концентрации в растворе, иначе - при возрастании ее концентрации в газовом пузырке микроразряда произойдет увеличение количества впрямую ионизованных и возбуженных электронным ударом молекул серной кислоты. Так как из-за малой ионизации при обычных для газового разряда энергиях электрона химические превращения веществ осуществляются в основном через возбужденные состояния, то в случае воздействия микроразрядов при возрастании концентрации серной кислоты следует ожидать увеличения выхода продуктов, для которых предшественником являются возбужденные частицы.
При увеличении концентрации серной кислоты (более 14М) доля молекул серной кислоты в газоплазменном пузырьке возрастает, соответственно происходит разложение растворенного вещества за счет прямого действия плазмы микроразрядов. Для растворов серной кислоты менее 14 М превращение растворенного вещества в основном происходит за счет действия плазмы на растворитель - косвенное действие. Благодаря этому возрастает вероятность протекания реакций 9,10,11,13, приводящих к образованию стабильных молекулярных продуктов: диоксида серы и перекисных соединений.
"Залечивание" поры - дальнейшее расширение плазменного образования достаточно быстро приводит к значительному снижению температуры последнего и, как следствие, к уменьшению концентрации носителей разряда, обрыву тока и стремительному охлаждению канала. Исчезновение газо-плазменного пузырька будет происходить после погашения газового разряда в нем. Погашение газового разряда, как известно, произойдет при снижении плотности тока в нем ниже минимально допустимой для самоподдержания разряда. В случае микроразрядов причинами уменьшения плотности тока газового разряда могут являться: 1) обеднение со временем припузырькового слоя электролита переносчиками тока, из-за чего электролит становится неспособным обеспечивать минимально допустимую для самоподдержания разряда плотность тока, и газовый разряд гаснет; 2) увеличение размеров пузырька микроразряда из-за испарения в него окружающей его жидкости; 3) заплавление или "залечивание" (путем анодирования в газовой плазме) канала пробоя в барьерной части оксидной пленки. Образовавшийся при первом пробое кратер обычно достигает поверхности металла. В этом месте плотность тока становится максимальной благодаря относительно малому сопротивлению электролита в кратере, что обеспечивает быстрое появление оксидной пленки (продукта плазмо-химической реакции МеxОy). Происходит "залечивание" места пробоя, нарастает толщина оксидной пленки, причем преимущественно в глубь материала подложки.
Таким образом, в работе на основании результатов эксперимента и литературных данных предложен механизм воздействия анодного микроразряда на растворы серной кислоты, включающий следующие стадии:
Образование возбужденных и ионизированных молекул в пузырьке микроразряда из-за протекания в нем газового разряда;
Протекание реакций с образованием радикалов и молекулярных продуктов, реакции которых друг с другом и исходными веществами дают основную массу конечных продуктов;
Диффузионный вынос образующихся радикалов и других частиц за пределы газового пузырька, реакции которых приводят к конечным молекулярным продуктам в припузырьковом слое электролита.
Список литературы
Баковец В.В., Поляков О.В., Долговесова И.П. Плазменно-электролитическая анодная обработка металлов // Новосибирск: Наука, 1991. С.63-68.
Nagatant T.,Yashinara S.T. Studies on the fragment ion distribution and their reaction by the of a charge spectrometer // J. Bull. chem. Soc. Jap., 1973. V.46. N 5. P.1450-1454.
Mann M., Hastrulid A., Tate J. Ionization and dissociation of water vapor and ammonia by electron impact // J. Phys. Rev. 1980. V.58. P.340-347.
Иванов Ю.А., Полак Л.С. Энергетическое рапределение электронов в низкотемпературной плазме // Химия плазмы М.: Атомиздат, 1975. Вып. 2. C.161-198.
Для подготовки данной работы были использованы материалы с сайта http://www.omsu.omskreg.ru/