مدل یک ترکیب شیمیایی فن آوری های پیشرفته مدرن
حاشیه نویسی
این مقاله به مدلهای کوانتومی-شیمیایی اتمها، مولکولها میپردازد که امکان درک ماهیت تبدیلهای شیمیایی ماده را در سطح اتمی و مولکولی سازمان آن فراهم میکند.
چکیده
این مقاله به بررسی دقیق مدلهای کوانتومی-شیمیایی گرافیکی اتمها، مولکولها و پیوندهای شیمیایی اختصاص دارد. این رویکرد امکان درک ماهیت فرآیندهای شیمیایی و قوانین روند آنها را فراهم می کند.
ایده های مدرن در مورد ساختار اتم ها و مولکول ها، درک تحولات شیمیایی ماده در سطح اتمی و مولکولی سازمان آن توسط شیمی کوانتومی آشکار می شود.
از دیدگاه شیمی کوانتومی، اتم یک میکروسیستم متشکل از یک هسته و الکترون هایی است که در میدان الکترومغناطیسی هسته حرکت می کنند. روی انجیر شکل 1 مدلهای پراش مداری، الکترونیکی و الکترونی اتمهای دوره اول و دوم را نشان میدهد که با استفاده از اصول و قوانین کوانتومی برای پر کردن سطوح انرژی در اتمها با الکترون ساخته شدهاند. چهار عدد کوانتومی n, ل, m l, اماسبه طور کامل حرکت الکترون ها در میدان هسته را مشخص کنید. عدد کوانتومی اصلی nانرژی الکترون، فاصله آن از هسته را مشخص می کند و با تعداد سطح انرژی که الکترون در آن قرار دارد مطابقت دارد. عدد کوانتومی مداری لشکل مدار و انرژی سطوح فرعی هم سطح انرژی را تعیین می کند. مفهوم "اوربیتال" به معنای محتمل ترین ناحیه حرکت یک الکترون در یک اتم است. عدد کوانتومی مغناطیسی m lتعداد اوربیتال ها و جهت گیری فضایی آنها را تعیین می کند. مهمتر از همه، اعداد کوانتومی مداری و مغناطیسی به هم مرتبط هستند. عدد کوانتومی مداری لمقادیر یک کمتر از عدد کوانتومی اصلی را می گیرد n. اگر یک n= 1، پس ل= 0 و از نظر شکل کروی 1 است س- مداری اگر یک n= 2، سپس عدد کوانتومی مداری دو مقدار می گیرد: ل= 0، 1 که نشان دهنده وجود دو سطح فرعی است. کروی است 2 س- مداری ( ل= 0) و سه 2 پ-اوربیتال هایی شبیه دمبل های ژیمناستیک که در زاویه 90 درجه در امتداد محورهای سیستم مختصات دکارتی قرار دارند.
شکل 1. پراش کوانتومی-شیمیایی، الکترونیکی و الکترونی مدل های اتم های دوره اول و دوم
شماره و آرایش فضایی 2 پ-اوربیتال ها عدد کوانتومی مغناطیسی را تعیین می کند m l, که مقادیر درون عدد کوانتومی مداری را می گیرد از - لبه + ل. اگر یک ل= 0، سپس m l= 0 (یک س- مداری). اگر یک ل= 1، پس m lسه مقدار می گیرد - 1 , 0, +1 (سه آر-اوربیتال ها).
مدلهای مداری اتمها آرایش فضایی و شکل اوربیتالها را نشان میدهند و در مدلهای پراش الکترونی به شکل سلولهای کوانتومی نمادین، تصویری از اوربیتالها و موقعیت سطوح و سطوح فرعی در نمودار انرژی آورده شده است. به اندازه اتم ها توجه کنید. همان نظم در دوره ها تکرار می شود - با افزایش بار هسته، تغییر شکل (فشرده شدن) فزاینده اوربیتال ها تحت تأثیر جاذبه الکترومغناطیسی الکترون ها توسط هسته رخ می دهد (شکل 1).
قرار گرفتن الکترون ها در اوربیتال ها تابع یکی از مهم ترین اصول است مکانیک کوانتومی(اصل پائولی): بیش از دو الکترون نمی توانند در یک مدار باشند، و آنها باید در لحظه تکانه خود - اسپین (چرخش اسپین انگلیسی) متفاوت باشند. الکترونها با اسپینهای مختلف معمولاً با فلشها و ¯ نشان داده میشوند. وقتی دو الکترون در یک مدار قرار می گیرند، اسپین های ضد موازی دارند و مانع حرکت یکدیگر در میدان هسته نمی شوند.
این خاصیت شبیه چرخش در مش بندی دو چرخ دنده است. هنگامی که درگیر است، یک دنده در جهت عقربه های ساعت و دیگری در خلاف جهت عقربه های ساعت می چرخد. دنده سوم مشبک شده با دو دنده دیگر چرخش را متوقف می کند. او اضافی است. بنابراین در یک اوربیتال فقط 2 الکترون می تواند وجود داشته باشد، سومی اضافی است.
هنگامی که سطوح انرژی و سطوح فرعی با الکترون پر می شوند، اصل کوانتومیحداقل انرژی (قانون کلچکوفسکی) . الکترون ها اوربیتال ها را از پایین ترین تا بالاترین سطح انرژی پر می کنند. اصل حداقل انرژی مانند پر کردن طبقات است ساختمان بلنددر دوره سیل آب بالا می رود و تمام طبقات را از پایین به بالا پر می کند، حتی یک طبقه را از دست نمی دهد.
طبق قاعده هوند، همه آر-اوربیتال ها ابتدا با یک الکترون و تنها سپس با الکترون دوم با اسپین ضد موازی پر می شوند.
مدلهای شیمیایی کوانتومی اتمها، توضیح خواص اتمها برای تبادل انرژی، دادن و گرفتن الکترون، تغییر پیکربندی هندسی و تشکیل پیوندهای شیمیایی را ممکن میسازد.
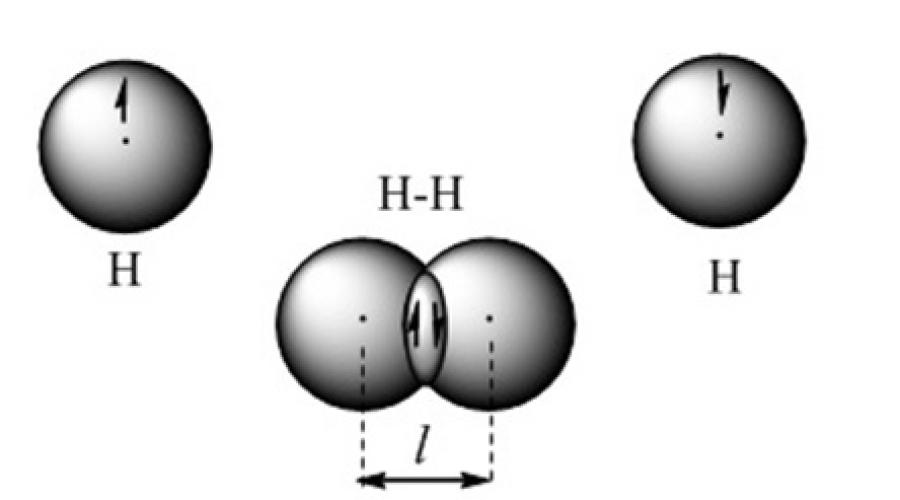
یک پیوند شیمیایی کووالانسی زمانی تشکیل می شود که ابرهای الکترونی ظرفیتی روی هم قرار می گیرند. برای مثال، چنین پیوندی در مدل مداری مولکول هیدروژن نشان داده شده است (شکل 2).
/Zakharova.files/image002.jpg)
شکل 2. مدل پیوند کووالانسی در یک مولکول هیدروژن
استفاده از روش شیمیایی کوانتومی پیوندهای ظرفیتی مبتنی بر این ایده است که هر جفت اتم در یک مولکول توسط یک یا چند جفت الکترون با اسپین های ضد موازی در کنار هم نگه داشته می شود. از دیدگاه روش پیوندهای ظرفیتی، یک مولکول یک میکروسیستم متشکل از دو یا چند اتم با پیوند کووالانسی است. هسته های با بار مثبت اتم ها توسط بار منفی متمرکز در ناحیه اوربیتال های اتمی روی هم قرار می گیرند. جاذبه هسته اتم ها به افزایش چگالی الکترون بین آنها توسط نیروی دافعه هسته ها بین خود متعادل می شود. یک میکروسیستم پایدار تشکیل می شود که در آن طول پیوند کووالانسی برابر با فاصله بین هسته ها است.
در مولکول فلوئور و همچنین در مولکول هیدروژن یک پیوند کووالانسی غیر قطبی وجود دارد. همپوشانی 2 آر 1 اوربیتال، یک جفت الکترون چگالی الکترونی افزایش یافته بین هسته اتم ها ایجاد می کند و مولکول را در حالت پایدار نگه می دارد (شکل 3).
/Zakharova.files/image003.jpg)
شکل 3. مدل پیوند کووالانسی در یک مولکول فلوئور
پیوند کووالانسی غیر قطبی به معنای چنین همپوشانی اوربیتال های ظرفیتی است که در نتیجه مراکز ثقل بارهای مثبت و منفی با هم مطابقت دارند.
امکان تشکیل پیوند کووالانسی قطبی هنگام همپوشانی 1 وجود دارد س 1 - و 2 آر 1 اوربیتال. روی انجیر شکل 4 مدلی از هیدروژن فلوراید با پیوند کووالانسی قطبی را نشان می دهد. چگالی الکترون بین اتم های پیوند کووالانسی به اتم فلوئور تغییر می کند که بار هسته ای آن (9+) در مقایسه با هسته اتم هیدروژن با بار (1+) جاذبه الکترومغناطیسی بیشتری اعمال می کند.
/Zakharova.files/image004.jpg)
شکل 4. مدل پیوند کووالانسی قطبی در یک مولکول هیدروژن فلوراید
پیوند یونی به دلیل جذب ذرات باردار الکتریکی - یون ها است. روی انجیر شکل 5 مدلی برای تشکیل پیوند یونی در لیتیوم فلوراید نشان می دهد. میدان الکترومغناطیسی قوی که توسط هسته اتم فلوئور ایجاد می شود، می گیرد و باقی می ماند. آر-اوربیتال های یک الکترون متعلق به اتم لیتیوم. اتم لیتیوم که از الکترون محروم است، پیکربندی هندسی خود را تغییر می دهد (2 ساوربیتال)، تبدیل به یونی با بار مثبت می شود و به یون فلوئور با بار منفی جذب می شود که یک الکترون اضافی در آن به دست آورده است. آر- مداری
/Zakharova.files/image005.jpg)
شکل 5. مدل جفت یون Li + F - لیتیوم فلوراید
نیروهای جاذبه الکترواستاتیکی یونهای با بار مخالف و دفع لایههای الکترونی یونهای لیتیوم و فلوئور متعادل هستند و یونها را در فاصلهای متناسب با طول پیوند یونی نگه میدارند. همپوشانی مداری در ترکیبات پیوند یونی عملاً وجود ندارد.
نوع خاصی از پیوند شیمیایی در اتم های فلزات ظاهر می شود. یک کریستال فلزی (شکل 6) از یون هایی با بار مثبت تشکیل شده است که در میدان آن الکترون های ظرفیت آزادانه حرکت می کنند ("ابر الکترونی").
/Zakharova.files/image006.jpg)
شکل 6. مدل کریستال فلز لیتیوم
یون ها و "ابر الکترونی" به طور متقابل یکدیگر را در یک حالت پایدار نگه می دارند. به دلیل تحرک زیاد الکترون ها، فلزات دارای رسانایی الکترونیکی هستند.
در مولکول ها، اتم هایی که توسط چندین پیوند کووالانسی به هم متصل شده اند، پیکربندی هندسی خود را تغییر می دهند. تجلی این ویژگی را در مثال یک اتم کربن در نظر بگیرید (1 ساوربیتال 2 در مدل های اتم کربن نشان داده نمی شود، زیرا در تشکیل پیوندهای شیمیایی شرکت نمی کند).
به طور تجربی ثابت شده است که در مولکول CH 4، اتم کربن چهار پیوند کووالانسی یکسان با اتم های هیدروژن تشکیل می دهد که از نظر انرژی و ویژگی های فضایی معادل هستند. تصور چهار پیوند کووالانسی یکسان دشوار است، اگر در نظر داشته باشیم که در کربن، الکترونهای ظرفیت روی دو انرژی قرار دارند. سو 2 پسطوح فرعی:
/Zakharova.files/image007.jpg)
در حالت زمین (تحریک نشده)، کربن تنها دو پیوند کووالانسی را تشکیل می دهد. در حالت برانگیخته، یک الکترون از سطح فرعی 2 سبه زیرسطح انرژی بالاتر 2 می رود پ. در نتیجه چنین پرش الکترونی، انرژی کل 2 می شود س- و 2 پ-اوربیتال ها و ظرفیت اتم کربن به چهار تغییر می کند:
/Zakharova.files/image008.jpg)
و با این حال این برای توضیح چهار پیوند کووالانسی معادل در مولکول CH 4 کافی نیست، زیرا 2 س- و 2 پ-اوربیتال ها دارند شکل متفاوتو آرایش فضایی مشکل با ارائه فرضیه حل شد هیبریداسیون - اختلاط الکترونهای ظرفیت در سطوح فرعی با همان سطح انرژی. در مولکول متان یک 2 وجود دارد س- و سه 2 آر-اوربیتال های اتم کربن در نتیجه هیبریداسیون به چهار معادل تبدیل می شوند sp 3-اوربیتال های هیبریدی:
/Zakharova.files/image009.jpg)
برخلاف حالت برانگیخته (زمینی) اتم کربن که در آن سه 2 آراوربیتال های اتم در زاویه 90 درجه قرار دارند (شکل 7، آ، در یک مولکول متان (شکل 7، ب) از نظر شکل و اندازه معادل هستند spاتم های کربن 3 هیبریدی در زاویه 109 حدود 28 اینچ قرار دارند.
/Zakharova.files/image010.jpg)
شکل 7. مدل مولکول متان
در مولکول اتیلن C 2 H 4 (شکل 8، آ) اتم های کربن در هستند سآر 2 - حالت هیبرید. 2 در هیبریداسیون نقش دارند س- مداری و دو 2 آر-اوربیتال ها در نتیجه هیبریداسیون، اتم های کربن سه معادل تشکیل می دهند sp 2 اوربیتال های هیبریدی که در زاویه 120 در حدود روی هواپیما قرار دارند. 2 pz-اوربیتال در هیبریداسیون شرکت نمی کند.
/Zakharova.files/image011.jpg)
شکل 8. مدل مولکول اتیلن
در مولکول اتیلن، اتمهای کربن نه تنها با پیوند s، بلکه با پیوند p نیز به هم متصل میشوند. در نتیجه همپوشانی تشکیل می شود آرz-اوربیتالها با تشکیل دو ناحیه همپوشانی در بالا و پایین محور اتصال هستهها، در دو طرف محور s-bond (شکل 8).
مدل پیوند سه گانه در مولکول استیلن ارائه شده است (شکل 9). هنگام مخلوط کردن یکی 2 س- و یک 2 p x -دو اوربیتال از یک اتم کربن تشکیل می شود sp-اوربیتال های ترکیبی که روی خط اتصال هسته اتم ها قرار دارند (زاویه 180 درجه). غیر هیبریدی 2 RU- و 2آرz-اوربیتال های اتم های کربن مختلف با هم همپوشانی دارند و دو پیوند p را در صفحات متقابل عمود بر هم تشکیل می دهند (شکل 9).
/Zakharova.files/image012.jpg)
شکل 9. مدل مولکول استیلن
مولکولها مانند اتمها توانایی شکستن و تشکیل پیوندهای شیمیایی، تغییر پیکربندی هندسی و حرکت از حالت خنثی الکتریکی به حالت یونی را از خود نشان میدهند. این خواص در واکنش بین مولکول های آمونیاک NH 3 و هیدروژن فلوراید HF ارائه شده است (شکل 10). پیوند کووالانسی در مولکول هیدروژن فلوراید شکسته می شود و یک پیوند دهنده کووالانسی گیرنده بین نیتروژن و هیدروژن در مولکول آمونیاک تشکیل می شود. دهنده تنها جفت الکترون اتم نیتروژن است، گیرنده اوربیتال خالی اتم هیدروژن است (شکل 10). پیکربندی هندسی مولکول NH 3 (هرم مثلثی، زاویه پیوند 107 o 18 اینچ) به پیکربندی چهار وجهی یون NH 4 + (109 o 28 اینچ) تغییر می کند. فرآیند نهایی تشکیل یک پیوند یونی در ساختار بلوری فلوراید آمونیوم است. مدلهای مداری مولکولها نشان دادن تمام ویژگیهای ذکر شده در بالا را در یک واکنش ممکن میسازد: شکستن و تشکیل پیوندهای شیمیایی، تغییر پیکربندی هندسی، حرکت از حالت خنثی الکتریکی به حالت یونی.
/Zakharova.files/image013.jpg)
برنج. 10. مدل تشکیل یک جفت یونی کریستالی NH 4 + F -
واکنش شیمیایی با استفاده از نمادها عناصر شیمیایی:
NH 3 + HF → NH 4 F،
بیان کلی از آنچه در مدلهای مداری مولکولها آشکار میشود را ارائه میدهد. واکنش های شیمیایی که با مدل های مداری و نمادهای عناصر شیمیایی نشان داده می شوند، یکدیگر را تکمیل می کنند. این شایستگی آنهاست. تسلط بر دانش ابتدایی بیان کوانتومی-شیمیایی ساختار و ترکیب اتم ها و مولکول ها منجر به درک مفاهیم کلیدی شیمیایی می شود: پیوندهای قطبی و غیر قطبی کووالانسی، پیوندهای دهنده-پذیرنده، پیوندهای یونی، پیکربندی هندسی اتم ها و مولکول ها، واکنش شیمیایی. و بر اساس این دانش، می توان با اطمینان از نمادگرایی عناصر و ترکیبات شیمیایی استفاده کرد توضیح کوتاهحالات شیمیایی و تبدیل ماده
اجازه دهید مثال دیگری از واکنشی را که از دیدگاه شیمی کوانتومی در نظر گرفته شده است، بیاوریم. آب خواص یک الکترولیت ضعیف را نشان می دهد. تفکیک الکترولیتی معمولاً با معادله نشان داده می شود:
H 2 O ⇄H + + OH -
H 2 O + H 2 O ⇄H 3 O + + OH -.
تقسیم مولکول های آب به یون های دارای بار مثبت و منفی توسط مدل شیمیایی کوانتومی واکنش تفکیک الکترولیتی آشکار می شود (شکل 11).
/Zakharova.files/image014.jpg)
شکل 11. مدل تفکیک الکترولیتی آب
مولکول آب یک هرم تحریف شده است (زاویه ظرفیت 104 o 30 "). سآراوربیتال های 3 هیبریدی اتم اکسیژن با اتم های هیدروژن پیوند s تشکیل می دهند. دو نفر دیگر سآراوربیتال های 3 هیبریدی دارای جفت الکترون های آزاد با اسپین های ضد موازی هستند. شکسته شدن پیوند کووالانسی H-O در یکی از مولکول ها منجر به تشکیل یک پیوند شیمیایی کووالانسی بر روی مولکول همسایه بر اساس مکانیسم دهنده-گیرنده می شود. یون هیدروژن که دارای یک اوربیتال خالی است، به عنوان پذیرنده جفت الکترون اتم اکسیژن مولکول آب همسایه عمل می کند. در این مثال، مانند نمونه قبلی، رویکرد کوانتومی-شیمیایی درک معنای فیزیکوشیمیایی فرآیند تفکیک الکترولیتی آب را ممکن میسازد.
تفکر فرآیندی است که در آن میتوانیم بهطور غیرمستقیم درباره آنچه از ادراک حسی ما پنهان است قضاوت کنیم. شیمی کوانتومی تصویری بصری از فرآیندهای شیمیایی و حالات ماده می دهد، آنچه را که از ادراک حسی ما پنهان است آشکار می کند، یادگیری و تفکر را تشویق می کند.
کتابشناسی - فهرست کتب:
1. ویگوتسکی ال.اس. تفکر و گفتار. – M.: Labyrinth, 1999. – 352 p.
2. Zagashev I.O., Zair-Bek S.I. تفکر انتقادی: فناوری توسعه - سنت پترزبورگ: اتحاد "دلتا"، 2003. - 284 ص.
3. Krasnov K.S. مولکول ها و پیوندهای شیمیایی - م.: دانشکده تحصیلات تکمیلی، 1984. - 295 ص.
4. لئونتیف A.N. سخنرانی در مورد روانشناسی عمومی. – م.: معنی، 2000. – 512 ص.
5. Peregudov F.I., Tarasenko F.P. مقدمه ای بر تحلیل سیستم. - م.: دبیرستان، 1989. - 367 ص.
6. پروکوفیف V.F. مرد - یک بیوکمپیوتر کنترل شده؟ // بولتن آکادمی بین المللی علوم (بخش روسی). - 2008. - شماره 1. - S. 1-21.
7. Yablokov V.A., Zakharova O.M. سازماندهی سیستم محتوای تدریس شیمی // دانشگاه: روانشناسی و آموزش: الکترون. علمی مجله 2016. شماره 5 (23) / [ منبع الکترونیکی]. - حالت دسترسی:
URL://website/ru/psy/archiv/item/2505 (دسترسی در 2017/04/2)
1.4.1 مدل های شیمیایی
علاوه بر مشاهده و آزمایش، مدل سازی نقش مهمی در دانش جهان طبیعی و شیمی دارد. یکی از اهداف اصلی مشاهده، جستجوی الگوها در نتایج آزمایشات است. با این حال، انجام برخی مشاهدات به طور مستقیم در طبیعت ناخوشایند یا غیرممکن است. محیط طبیعیبازآفرینی در شرایط آزمایشگاهی با کمک دستگاه ها، تاسیسات، اشیاء خاص، یعنی مدل ها. مدلها فقط مهمترین ویژگیها و ویژگیهای شی را کپی میکنند و آنهایی را که برای مطالعه ضروری نیستند حذف میکنند. بنابراین در شیمی، مدل ها را می توان به طور مشروط به دو گروه تقسیم کرد: مادی و نمادین.
مدل های دستگاه های شیمیایی و صنعتی
مدل های مواد اتم ها، مولکول ها، کریستال ها، صنایع شیمیایی توسط شیمیدان ها برای وضوح بیشتر استفاده می شود.
رایج ترین نمایش یک اتم مدلی است که شبیه ساختار منظومه شمسی است.
اغلب برای مدل سازی مولکول های مواد استفاده می شود. توپ و چوبمدل ها. مدل هایی از این نوع از توپ های رنگی که نشان دهنده اتم های سازنده مولکول هستند، مونتاژ می شوند. توپ ها توسط میله هایی به هم متصل شده اند که نماد پیوندهای شیمیایی است. با کمک مدلهای توپ و چوب، زوایای پیوند در یک مولکول کاملاً دقیق بازتولید میشوند، اما فواصل بین هستهای فقط تقریباً منعکس میشوند، زیرا طول میلههایی که توپها را به هم متصل میکنند با طول پیوند متناسب نیستند.
مدل های لایروبیزوایای پیوند و نسبت طول پیوند در مولکول ها را کاملاً دقیق منتقل می کند. هسته اتم ها در آنها، بر خلاف مدل های توپ و میله، نه با توپ، بلکه توسط نقاط اتصال میله ها تعیین می شود.
مدل های نیمکره ایمدلهای استوارت-بریگلب نیز نامیده میشوند و از توپهایی با بخشهای بریده مونتاژ میشوند. مدل های اتم ها با صفحات برش با استفاده از دکمه ها به هم متصل می شوند. مدلهای نیمکره به دقت هم نسبت طول پیوند و زوایای پیوند و هم پر شدن فضای بین هستهای در مولکولها را نشان میدهند. با این حال، این اشغال همیشه به فرد اجازه نمی دهد که یک نمایش بصری از آن به دست آورد موقعیت نسبیهسته ها
مدلهای کریستالها شبیه مدلهای توپ و چوب مولکولها هستند، با این حال، مولکولهای جداگانه یک ماده را نشان نمیدهند، اما آرایش متقابل ذرات یک ماده را در حالت کریستالی نشان میدهند.
با این حال، اغلب شیمیدان ها از مواد استفاده نمی کنند، بلکه مدل های نمادین -اینها نمادهای شیمیایی، فرمول های شیمیایی، معادلات هستند واکنش های شیمیایی. با استفاده از نمادهای عناصر و شاخص های شیمیایی، فرمول مواد نوشته می شود. این شاخص نشان می دهد که چند اتم از یک عنصر معین در مولکول یک ماده گنجانده شده است. در سمت راست علامت عنصر شیمیایی نوشته شده است.
فرمول شیمیایی مدل نمادین اصلی در شیمی است. نشان می دهد: یک ماده خاص; یک ذره از این ماده؛ ترکیب کیفیموادی که اتم های آن عناصر جزء این ماده هستند. ترکیب کمی، یعنی چند اتم از هر عنصر بخشی از مولکول ماده است.
تمام مدل های فوق به طور گسترده ای در ایجاد استفاده می شود مدل های کامپیوتری تعاملی.
1.4.2 طبقه بندی مدل های کامپیوتری
در میان انواع مختلف نرم افزارهای آموزشی، آنهایی که از مدل های کامپیوتری استفاده می کنند برجسته می شوند. استفاده از مدلهای رایانهای نه تنها باعث افزایش دید فرآیند یادگیری و تشدید آن میشود، بلکه این فرآیند را نیز به شدت تغییر میدهد. AT سال های گذشتهرایانه ها با سرعتی سریع در حال پیشرفت هستند و قابلیت های مدل سازی آنها تقریباً نامحدود شده است، بنابراین اهمیت مدل های رایانه ای در مطالعه رشته های مدرسه می تواند به طور قابل توجهی افزایش یابد. E.E. نیفانتیف، A.K. آخلبینین، V.N. لیخاچف توجه داشته باشید که مزیت اصلی مدل های کامپیوتری این است امکان مدلسازی تقریباً هر فرآیند و پدیده، تعامل تعاملی کاربر با مدل، و همچنین اجرای رویکردهای پژوهشی مشکلساز در فرآیند یادگیری.
V. N. Likhachev پیشنهاد می کند که مدل های کامپیوتری آموزشی را بر اساس تعدادی از معیارها طبقه بندی کند که اصلی ترین آنها وجود انیمیشن در هنگام نمایش مدل، روش کنترل، روش نمایش بصری مدل است. با وجود انیمیشن، UKM می تواند پویا و ایستا باشد. پویاها حاوی قطعات انیمیشن برای نمایش اشیا و فرآیندهای شبیه سازی شده هستند، در موارد استاتیک وجود ندارند. با توجه به روش کنترل، RCM را می توان مدیریت کرد، که به شما امکان می دهد پارامترهای مدل را تغییر دهید، و مدیریت نشده، که چنین فرصتی را فراهم نمی کند.

در بین مدل های نمایشی (مدیریت نشده)، دو گروه دیگر را می توان با توجه به امکان تعامل با کاربر متمایز کرد: تعاملی و غیر تعاملی. موارد تعاملی به شما امکان می دهند نوع نمایش مدل یا نقطه مشاهده روی مدل را بدون تغییر پارامترهای آن تغییر دهید. غیر تعاملی چنین فرصت هایی فراهم نمی کند.
E.E. نیفانتیف، A.K. آخلبینین و V.N. لیخاچف از نظر روش شناختی مفیدترین است طبقه بندی با توجه به هدف مدل سازیبا توجه به سطح اشیاء ارائه شده، مدل های مورد استفاده در آموزش شیمی را می توان به دو گروه تقسیم کرد : مدل های دنیای ماکرو، که منعکس کننده خواص خارجی اشیاء شبیه سازی شده و تغییر آنها هستند و مدل های دنیای میکروکه ساختار اجسام و تغییرات ایجاد شده در آنها را در سطح نمایش اتمی و مولکولی آنها منعکس می کند. و مدل هایی از اجسام مانند مواد شیمیایی، واکنش های شیمیایی و فرآیندهای فیزیکی-شیمیایی را می توان هم در سطح جهان خرد و هم در سطح جهان کلان ایجاد کرد.

طبقه بندی UKM را می توان در قالب یک نمودار برای وضوح بیشتر ارائه کرد.
1.4.3 مدل های کامپیوتری دنیای خرد
اجسام برای مدل سازی در سطح جهان خرد عبارتند از اتم ها، یون ها، مولکول ها، شبکه های کریستالی، عناصر ساختاری اتم ها. در سطح جهان خرد، ویژگیهای ساختار ماده، برهمکنش ذرات سازنده ماده مدلسازی میشوند. برای مدلسازی واکنشهای شیمیایی در سطح ریزجهان، مکانیسمهای فرآیندهای شیمیایی بسیار مورد توجه هستند. و در مدلهای فرآیندهای فیزیکی و شیمیایی، فرآیندهایی که در سطح الکترونیکی یا اتمی-مولکولی رخ میدهند در نظر گرفته میشوند.
واضح است که CCM های شبیه سازی کننده مدل های ریز جهان به دستیاران عالی در مطالعه ساختار اتم ها، انواع پیوندهای شیمیایی، ساختار ماده و غیره تبدیل می شوند.
مدل های اتم های 1 - 3 دوره های جدول تناوبی مندلیف در برنامه پیاده سازی شده است. 1C: معلم خصوصی. علم شیمی» در قالب مدل های بور اتم. ایده های مدرن تر در مورد ساختار اتم در برنامه پیاده سازی شده است شیمی لند،که در آن توزیع الکترون ها بر روی سطوح فرعی انرژی اتم های عناصر و شکل اوربیتال های منفرد در سطوح مختلف انرژی در نظر گرفته می شود.
برنامه مورد علاقه خاص است HyperChem. این یکی از اصلی ترین برنامه های حرفه ای برای محاسبه نظری پارامترهای مختلف ترمودینامیکی و الکترونیکی مولکول ها است. با کمک آن می توان مدل های فضایی ترکیبات مختلف ساخت، ویژگی های ساختار هندسی آنها را بررسی کرد، شکل و انرژی اوربیتال های مولکولی، ماهیت توزیع چگالی الکترون، گشتاور دوقطبی و غیره را تعیین کرد. به صورت طرح های رنگی ارائه می شود که سپس می توان آنها را بر روی چاپگر چاپ کرد و تصویری با کیفیت از ترکیبات شیمیایی در زوایای و برجستگی های مورد نیاز به دست آورد. مزیت برنامه توانایی در نظر گرفتن یک مولکول با طرف های مختلفتا با ویژگی های ساختار فضایی آن آشنا شود. به نظر می رسد که این بسیار مهم است، زیرا، همانطور که تمرین نشان می دهد، دانش آموزان معمولاً ایده هایی در مورد مولکول ها به عنوان ساختارهای فضایی ایجاد نمی کنند. تصویر سنتی از مواد شیمیایی در یک صفحه منجر به از دست دادن کل بعد می شود و توسعه تخیل فضایی را تحریک نمی کند.
در دوره چند رسانه ای شیمی برای همه» یک برنامه استفاده می شود - نمایشگر استریو مولکول ها. به شما امکان می دهد تصاویر حجمی از مولکول های متشکل از اتم های هیدروژن، اکسیژن، کربن و نیتروژن ارائه دهید. برای نمایش، از مدلهای قاب سیمی مولکولها استفاده میشود. مدل ها را می توان حرکت داد، چرخاند، تصاویری از چندین مولکول مختلف را به طور همزمان نشان داد. این برنامه به شما امکان می دهد مدل های جدیدی از مولکول ها را به تنهایی ایجاد کنید. در مجموع، مدلهایی از 25 مولکول آلی ارائه شده است، اما ارزش آموزشی این مدلها کم است، زیرا مدلها به اندازه کافی ارائه شدهاند. اتصالات ساده، که هر دانش آموز می تواند با استفاده از پلاستیک و کبریت جمع آوری کند.
مدلهای سهبعدی مداری-پرهای نمایشی برخی مولکولها در برنامه پیادهسازی شدهاند. روش پیوندهای ظرفیت: هیبریداسیون اوربیتال های اتمی.و در برنامه ماهیت پیوند شیمیایی» علل وقوع پیوند شیمیایی را با استفاده از مثال تشکیل مولکول هیدروژن از اتم ها توضیح می دهد. هر دوی این برنامه ها در مجموعه برنامه های آموزشی گنجانده شده است. شیمی برای همه - 2000».
وایرفریم های نمایشی تعاملی مورد استفاده در برنامه ها ChemLand- 115 مولکول از ترکیبات عمدتا آلی، و " شیمی برای همه". این دو برنامه مزایا و معایب خود را دارند: در برنامه Chemistry for All، مدل ها را می توان در صفحه تمام صفحه نمایشگر نمایش داد، در حالی که در برنامه ChemLand چنین عملکردی وجود ندارد، با این حال، برنامه حاوی تعداد زیادی مولکول است. در ChemLand مدلهای دینامیکی استفاده میشوند که ساختار فضایی مولکولها را با توانایی اندازهگیری زوایای پیوند و طول پیوند نشان میدهند.، که به ما امکان می دهد تغییر قطبیت یک مولکول مثلثی را بسته به نوع اتم ها ردیابی کنیم.
هنگام مطالعه ساختار مولکول ها و کریستال ها، برنامه هایی که بیشتر برای اهداف تحقیقاتی طراحی شده اند می توانند مفید باشند. این مثلاً یک برنامه است CS Chem3D Pro،که به شما امکان می دهد ساختار سه بعدی مولکول های مختلف را ایجاد، اصلاح و نمایش دهید. همچنین برنامه مفید طراح کریستال،که برای تجسم ساختار سه بعدی شبکه کریستالی طراحی شده است. این برنامه ها می توانند برای ایجاد تصاویر سه بعدی از مولکول ها و کریستال ها و نمایش آنها در کلاس درس با استفاده از کامپیوتر مفید باشند.
برنامه " مولکول را جمع کنید"، اگرچه از نظر قابلیت های پایین تر از برنامه های فوق است، اما می تواند به طور موثر در کار فردی دانش آموزان استفاده شود.
مدلهای فرآیندها و مکانیسمهای فیزیکی و شیمیایی در برنامه پیادهسازی شدهاند. شیمی برای همه". مدل های غیر تعاملی با موضوع "تفکیک الکترولیتی" در اینجا نشان داده شده است: تفکیک نمک ها، اسیدها، قلیایی ها، هیدرولیز نمک ها. در همین برنامه چند مدل از مکانیسمهای واکنش آلی اجرا میشود: برماسیون آلکان، استریسازی، مکانیسم کلی واکنشهای پلیمریزاسیون و غیره. همه مدل های مکانیسم های واکنش غیر تعاملی هستند، در یک صفحه نمایش کامل نمایش داده می شوند، صدا دارند، اما هیچ توضیح متنی از پدیده های رخ داده وجود ندارد، که به طور قابل توجهی استفاده از برنامه را محدود می کند.
در نسخه آنلاین کتاب درسی تعاملی برای دبیرستان در شیمی آلی برای کلاس های X - XI، ویرایش شده توسط G. I. Deryabina، A. V. Solovovمکانیسمهای تبادل و گیرنده-دهنده تشکیل پیوند کووالانسی، مکانیسمهای همولیتیک و هترولیتیک برش پیوند کووالانسی در مثالی از انتزاع اتم هیدروژن از مولکول متان، فرآیند هیبریداسیون sp ارائه شدهاند. از علاقه زیاد هستند مدلهای نمایش سه بعدی تعاملی مولکولهای آلیو مکانیسم های واکنش های شیمیایی: کلرزنی متان و مکانیسم کلی جایگزینی هسته دوست. بسیار مهم است که هنگام کار با مدل ها، موقعیت آنها را در فضا تغییر دهید و برای مکانیسم واکنش، موقعیت نقطه مشاهده را تغییر دهید.
برنامه دیگری که مکانیسم های واکنش های شیمیایی را نشان می دهد، برنامه است انیمیشن های واکنش آلیاین شامل 34 مکانیسم واکنش های آلی است. علاوه بر این، هر مکانیزم در قالب چهار نوع مدل مولکولی ارائه میشود: مدلهای توپ و چوب، سه بعدی و دو گونه از مدلهای پره مداری. یکی از انواع مدلهای مداری-پره، تغییر در اوربیتالهای بیرونی بستر را در طول دوره واکنش نشان میدهد و دیگری واکنشدهنده. این امر مشاهده تغییر اوربیتال های بیرونی واکنش دهنده ها را در طول واکنش آسان تر می کند. در صورت لزوم، می توانید از مطالب نظری یک ابزار شناخت چند کانالی تعاملی استفاده کنید. توسعهدانش آموزان خودشان ...
تست کامپیوتر
تست ها >> انفورماتیک... روش شناسی ها ... در حال مطالعهادبیات... توسعهتست ها و تست ها فناوری تست کامپیوتری باید دارای ویژگی های اصلی زیر باشد: در ارتباط بودن ... جهان های خرد); ... (مدرسه ... آنها استفاده در ... مدل ها / آموزشبه قیمت ارز ...
فلسفه و روش شناسی علم
راهنمای مطالعه >> فلسفهدر رشته زیست شناسی در در حال مطالعههم تکاملی مختلف گونه ها, آنهاساختارها و سطوح سازمانی... و تأسیس شد. استفادهروش ها در برابر محدودیت های خارجی اعمال شده بر پارامترهای مطالعه مقاومت می کنند. مدل هاپیاده سازی...
فعالیت های اجتماعی و فرهنگی (2)
کتاب درسی >> جامعه شناسی... آنها مطالعهحفاظت، تولید، توسعه، استفاده کنیدو در نتیجه، توسعه ... . در در حال مطالعه دوره, ... دنیای خرد ... مدل هاو پایان دادن مدل ... در ارتباط بودنروش ها و فن آوری های آموزشی از جمله آنها خصوصی است مواد و روش ها... پیش دبستانی، مدرسه (...
ارسال کار خوب خود را در پایگاه دانش ساده است. از فرم زیر استفاده کنید
دانشجویان، دانشجویان تحصیلات تکمیلی، دانشمندان جوانی که از دانش پایه در تحصیل و کار خود استفاده می کنند از شما بسیار سپاسگزار خواهند بود.
هنوز نسخه HTML کار وجود ندارد.
با کلیک بر روی لینک زیر می توانید آرشیو اثر را دانلود کنید.
اسناد مشابه
سری همولوگ متان ساختار مولکول متان زوایای بین همه پیوندها مشخصات فیزیکیآلکان ها روش های آزمایشگاهی به دست آوردن. گرفتن از نمک اسیدهای کربوکسیلیک. نوع هیبریداسیون اتم های کربن در آلکان ها. ایزومری ساختاری آلکان ها.
ارائه، اضافه شده در 10/08/2014
مدل الکترونیکی یک مولکول نظریه دفع جفت الکترون پوسته ظرفیت. واکنش پذیری مولکول ها طبقه بندی واکنش های شیمیایی درجات آزادی یک مولکول، آنها حرکت چرخشی. شرح تقارن نوسانات، برهمکنش آنها.
ارائه، اضافه شده در 10/15/2013
ویژگی های ساختار اتم. تعیین تعداد پروتون، الکترون، نوترون. در نظر گرفتن پیوند شیمیایی و قطبیت مولکول به عنوان یک کل. معادلات تفکیک و ثابت های تفکیک برای الکترولیت های ضعیف. واکنش های ردوکس
تست، اضافه شده در 11/09/2015
ساختار مولکول، پیوندهای اتم ها و خواص استیلن ها به عنوان مواد شیمیایی. ویژگی های به دست آوردن آلکین ها با ترمولیز متان و هیدروژنه کردن کربن در صنعت و واکنش حذف در آزمایشگاه. واکنش های آلکین ها شامل پیوند سه گانه.
کار کنترل، اضافه شده در 2013/08/05
مفاد اصلی نظریه کلاسیکساختار شیمیایی مولکول ویژگی هایی که واکنش پذیری آن را تعیین می کند. راد همولوگ آلکان ها. نامگذاری و ایزومتریک هیدروکربن ها. طبقه بندی ترکیبات آلی حاوی اکسیژن
ارائه، اضافه شده در 2017/01/25
یک عنصر شیمیایی مجموعه ای از اتم های یک نوع است. کشف عناصر شیمیایی اندازه اتم ها و مولکول ها اشکال وجود عناصر شیمیایی اطلاعاتی در مورد ساختار مولکولی و غیر مولکولی مواد. دکترین اتمی - مولکولی.
ارائه، اضافه شده در 2012/04/15
توالی کلی برای محاسبه ساختار الکترونیکی یک مولکول با استفاده از روش MO LCAO. روش ساده هوکل مثال ها ساختارهای مولکولیبرای روش MOX آلیل در روش MOX. خواص عمومیتوزیع الکترونیکی در سیستم هیدروکربنی هاکل
مدل فیزیکی و شیمیایی فرآیندها در تخلیه میکرو آند
V.F. بوربات، O.A. گولووانوا، A.M. سیزیکوف، اومسک دانشگاه دولتی، گروه شیمی معدنی
لایه های اکسیدی بر روی آندهای ساخته شده از آلومینیوم، تیتانیوم، تانتالیوم و برخی فلزات دیگر در طول عبور تشکیل شده است. جریان الکتریسیتهبین الکترودهای غوطه ور در الکترولیت، در برخی موارد دارای خواص حفاظتی و دی الکتریک بالایی هستند. در حال حاضر، آزمایشگاهها در کشورهای مختلف در حال انجام تحقیقات قابل توجهی با هدف ایجاد فرصتهایی برای بهبود خواص حفاظتی و الکتریکی پوششهای آند، جستجوی ترکیبهای الکترولیت بهینه، بهبود قابلیت ساخت فرآیند و غیره هستند. تجربه عملی که اخیراً در استفاده از درمان آند پلاسما-الکترولیتیک برای ایجاد پوشش های محافظ انباشته شده است، به طور قابل توجهی از مفاهیم نظری موجود در این زمینه پیشی گرفته است.
بر اساس ادبیات و دادههای تجربی ما، میتوانیم یک مدل فیزیکی از ریزدشارژ آند را بپذیریم، ایده اصلی آن این است که تخلیه میکرو آندی ترکیبی از شکست جرقه قسمت مانع لایه اکسید و یک گاز است. تخلیه در حباب گاز پلاسما که پس از شکست ظاهر شد. مطابقت مدل پیشنهادی را در نظر بگیرید نتایج تجربیبا در نظر گرفتن توالی فرآیندها.
اکسیداسیون. در طی اکسیداسیون (با ولتاژ ثابت روی الکترودها)، لایه هایی با ضخامت صدها میکرون تشکیل می شوند. همزمان با تشکیل لایه های اکسیدی جدید، فرآیند انحلال آنها نیز صورت می گیرد. تعدادی از مطالعات نشان داده اند که در دوره قبل از جرقه رشد فیلم اکسید، آنیون های الکترولیت، مانند یون های سولفات، در حجم اکسید قرار می گیرند. در فیلم های متخلخل، آنیون ها در اکسید آندی به دلیل "جاسازی" مکانیکی اجزای محلول ظاهر می شوند. محتوای آنیون های موجود در اکسید با توانایی آنها در جذب روی سطح رسوب یا حتی تشکیل ترکیباتی با ترکیب غیر استوکیومتری تعیین می شود.
هنگام مطالعه ترکیب فازی و عنصری پوششهای بهدستآمده با عملیات پلاسما الکترولیتی، مشخص شد که با این روش پوششها، یونهای سولفات وارد فیلم میشوند. علاوه بر این، نوع رجیستروگرام ها نشان می دهد که "درآمد" اجزای الکترولیت در مکان هایی اتفاق می افتد که ریز تخلیه های آندی در زمان "درمان بهبود" آنها رخ می دهد، بنابراین، توزیع اجزای الکترولیت روی فیلم یکنواخت نیست و با آن متفاوت است. توزیع در فیلم های به دست آمده با آندایزاسیون معمولی.
شکست یک فرآیند احتمالی پیچیده است که می تواند در یک نقطه معین در یک دی الکتریک در محدوده نسبتاً وسیعی از ولتاژها و زمان ها رخ دهد. مهمترین فرآیند برای شروع شکست، تغییر در بار فضایی نزدیک کاتد (محلول الکترولیت) و افزایش حجم تزریق الکترون ها به نوار رسانایی فیلم دی الکتریک است. این فرآیندها به توسعه شکست کمک می کنند. شروع شکست با توسعه بهمن های الکترونی همراه است. کاملاً محتمل است که سطوح ناخالصی در اکسید می تواند منبع یون های اولیه باشد. چنین مکانیزمی نقش ویژه ای را برای اجزای الکترولیت وارد شده به اکسید، در درجه اول آنیون ها، نشان می دهد. به همین دلیل است که امکان به دست آوردن پوشش های جرقه آندی تا حد زیادی توسط ترکیب محلول تعیین می شود. الکترون هایی که وارد نوار رسانایی می شوند و توسط میدان شتاب می گیرند انرژی کافی برای ایجاد یونیزاسیون ضربه ای اتم ها در اکسید به دست می آورند. دومی منجر به وقوع بهمن می شود که با رسیدن به سطح فلز، کانال های شکست را تشکیل می دهد. وجود داشتن وابستگی خطیتفاوت بین ولتاژ شکست و ضخامت نشان دهنده یکنواختی میدان در هنگام خرابی و ماهیت الکتریکی خرابی است.
تخریب فیلم اکسید - هنگامی که در معرض ریز تخلیه های آندی روی محلول های اسید سولفوریک قرار می گیرد، عمل تسریع می شود. میدان الکتریکیالکترون ها در معرض مولکول های آب و اسید سولفوریک قرار خواهند گرفت. داده های مربوط به یونیزاسیون این محلول ها در ادبیات موجود است. بر اساس آنها، محتمل ترین یون ها در پلاسمای ریز تخلیه ها به احتمال زیاد یون هایی با کمترین پتانسیل ظاهری خواهند بود، یعنی. H2O+ برای مولکولهای آب، H2SO4+ برای اسید سولفوریک و احتمال کمتر HSO4+ باید انتظار داشت.
بنابراین، فرآیندهای یونیزاسیون و اتصال تجزیهای الکترونها یونهای زیر را تحت تأثیر تخلیههای ریز روی محلولهای اسید سولفوریک به دست میدهند (واکنشهای 1-5). e + H2O H2O+ + 2e (1)، e + H2SO4 H2SO4+ + 2e (2)، یا HSO4 + H+ + 2e (3)، e + H2O OH + H- (4)، e + H2SO4 H + HSO4- (5).
یونهای مثبت و منفی تشکیلشده توسط این واکنشها دو روش متفاوت برای تبدیل خود دارند: 1) خنثیسازی بارها. 2) واکنش های یون مولکولی. رادیکال هایی که در نتیجه تفکیک ذرات برانگیخته و با واکنش های مولکولی یونی ایجاد می شوند، وارد واکنش های جدا شدن اتم H از مولکول های حباب گاز و به واکنش نوترکیبی می شوند.
پس از تشکیل رادیکال ها، واکنش های انتزاع اتم H انجام می شود: H(OH, HSO4) + H2SO4 H2(H2O, H2SO4) + HSO4 (6)، H(HSO3) + H2O H2(H2SO3) + OH (7) و واکنش های نوترکیب رادیکال ها: HSO4 + OH H2SO4 (8)، HSO4 + HSO4 H2S2O8 (9)، OH + OH H2O2 (10)، H + HSO4 H2SO4 (11).
تشکیل دی اکسید گوگرد در نتیجه برهمکنش مولکول های اسید سولفوریک برانگیخته شده توسط پلاسمای ریز تخلیه با مولکول های همسایه: H2SO4* + H2SO4 H2SO3 + H2SO5 (12)، یا مکانیسم نیز امکان پذیر است: H2SO4* H2SO3 + (13). H2SO3 و H2SO5 حاصل به دلیل دمای بالا در ناحیه تخلیه ریز از نظر حرارتی مطابق با معادلات تفکیک می شوند:
H2SO3 H2O + SO2 (14)، 2H2SO5 2H2SO4 + 0.5 O2 (15).
برخی از رادیکالها فراتر از حباب گاز میکرودشارژ به مایع اطراف آن میروند و در آنجا وارد واکنشهای نوترکیبی با یکدیگر میشوند و با اجزای الکترولیت واکنش میدهند. بازده محصولات در نتیجه فرآیندهایی که در لایه نزدیک به حباب الکترولیت انجام می شود به غلظت اسید سولفوریک (یعنی به نسبت یون های موجود در محلول های اسید سولفوریک با غلظت های مختلف) بستگی دارد.
با توجه به مکانیسم پیشنهادی تبدیلات شیمیایی اسید سولفوریک، با افزایش غلظت آن در محلول، در غیر این صورت، با افزایش غلظت آن در یک حباب گاز ریز تخلیه، تعداد سولفوریک مستقیماً یونیزه شده و برانگیخته شده توسط الکترون برخورد می شود. مولکول های اسید رخ خواهد داد. از آنجایی که به دلیل یونیزاسیون کم در انرژی های الکترونی رایج برای تخلیه گاز، تبدیلات شیمیایی مواد عمدتاً از طریق حالت های برانگیخته انجام می شود، در صورت قرار گرفتن در معرض تخلیه های ریز با افزایش غلظت اسید سولفوریک، باید انتظار افزایش را داشت. در بازده محصولاتی که ذرات برانگیخته پیش ساز آنها هستند.
با افزایش غلظت اسید سولفوریک (بیش از 14 مولار)، نسبت مولکول های اسید سولفوریک در حباب گاز پلاسما افزایش می یابد، به ترتیب، تجزیه ماده محلول به دلیل عمل مستقیمترشحات میکرو پلاسما برای محلول های اسید سولفوریک کمتر از 14 مولار، تبدیل املاح عمدتاً به دلیل اثر پلاسما روی حلال اتفاق می افتد - یک عمل غیر مستقیم. این امر احتمال واکنش های 9،10،11،13 را افزایش می دهد که منجر به تشکیل پایدار می شود. محصولات مولکولی: ترکیبات دی اکسید گوگرد و پراکسید.
"درمان" منافذ - گسترش بیشتر تشکیل پلاسما به سرعت منجر به کاهش قابل توجه دمای دومی و در نتیجه کاهش غلظت حامل های تخلیه، قطع جریان و خنک شدن سریع کانال می شود. . ناپدید شدن حباب گاز پلاسما پس از خاموش شدن تخلیه گاز در آن رخ می دهد. مشخص است که تخلیه گاز زمانی خاموش می شود که چگالی جریان در آن به زیر حداقل حد مجاز برای خودپایداری تخلیه برسد. در مورد ریزدشارژها، دلایل کاهش چگالی جریان تخلیه گاز می تواند موارد زیر باشد: 1) تخلیه لایه نزدیک به حباب الکترولیت با حامل های جریان در طول زمان، که به دلیل آن الکترولیت قادر به تامین آن نیست. حداقل چگالی جریان مجاز برای حفظ خود تخلیه تخلیه، و تخلیه گاز از بین می رود. 2) افزایش اندازه حباب ریز تخلیه به دلیل تبخیر مایع اطراف آن به داخل آن. 3) ذوب یا "درمان" (با آندایز کردن در پلاسمای گاز) کانال شکست در قسمت مانع از فیلم اکسید. دهانه ای که در طی اولین شکست تشکیل می شود معمولاً به سطح فلز می رسد. در این نقطه، چگالی جریان به دلیل مقاومت نسبتا کم الکترولیت در دهانه به حداکثر می رسد، که تضمین می کند ظاهر سریعفیلم اکسید (محصولی از واکنش پلاسما-شیمیایی MexOy). "درمان" محل شکست وجود دارد، ضخامت فیلم اکسید افزایش می یابد، و عمدتا در عمق مواد بستر.
بنابراین، بر اساس نتایج آزمایش و داده های ادبیات، مکانیسم اثر تخلیه میکرو آند بر محلول های اسید سولفوریک پیشنهاد شده است که شامل مراحل زیر است:
تشکیل مولکول های برانگیخته و یونیزه شده در حباب ریز تخلیه به دلیل تخلیه گازی که در آن جریان دارد.
سیر واکنش ها با تشکیل رادیکال ها و محصولات مولکولی که واکنش های آنها با یکدیگر و با مواد اولیه بخش عمده ای از محصولات نهایی را می دهد.
حذف انتشار رادیکال های حاصل و سایر ذرات خارج از حباب گاز که واکنش های آن منجر به تولید محصولات مولکولی نهایی در لایه نزدیک به حباب الکترولیت می شود.
کتابشناسی - فهرست کتب
Bakovets V.V.، Polyakov O.V.، Dolgovesova I.P. درمان آند پلاسما الکترولیتی فلزات // Novosibirsk: Nauka، 1991. P.63-68.
Nagatant T.، Yashinara S.T. مطالعات بر روی توزیع یون قطعه و واکنش آنها توسط یک طیف سنج بار // J. Bull. شیمی soc ژاپن، 1973. V.46. شماره 5. ص1450-1454.
Mann M., Hastrulid A., Tate J. یونیزاسیون و تفکیک بخار آب و آمونیاک با برخورد الکترون // J. Phys. کشیش 1980. V.58. ص 340-347.
ایوانف یو.آ.، پولاک ال.اس. توزیع انرژی الکترون ها در پلاسمای دمای پایین // شیمی پلاسما، مسکو: Atomizdat، 1975. شماره. 2. ج.161-198.
برای تهیه این کار، مطالبی از سایت http://www.omsu.omskreg.ru/