Mejorar la gestión de las actividades de innovación. Tecnologías innovadoras como objeto de mejorar la gestión empresarial en el ejemplo de SMZ. la cultura organizacional de la empresa, así como las relaciones interpersonales entre los empleados, la gerencia y
>> Química: Producción de halógenos. Importancia biológica y aplicación de los halógenos y sus compuestos.
Obtención de halógenos . El flúor y el cloro se obtienen por electrólisis de fundidos o soluciones de sus sales. Por ejemplo, el proceso de electricidad || El arrastre de la masa fundida de cloruro de sodio se puede reflejar mediante la ecuación:
Pero si el hidrógeno se puede obtener de otras formas más convenientes y económicas, por ejemplo, a partir del gas natural, entonces el hidróxido de sodio se obtiene casi exclusivamente por electrólisis de una solución de cloruro de sodio, como el cloro.
El bromo y el yodo se obtienen en la industria por reacción de su desplazamiento a partir de bromuros y yoduros, respectivamente.
La importancia biológica de los halógenos. Su aplicación. No pudo evitar notar que las etiquetas de muchas marcas de pasta de dientes indican el contenido de flúor en ellas, por supuesto, no gratis, sino sus compuestos. Gracias a este importante componente que interviene en la construcción del esmalte dental y de los huesos, se previene una enfermedad como la caries dental. Además, el flúor es un elemento necesario en los procesos metabólicos de las glándulas, los músculos y las células nerviosas.
El flúor también es importante en la producción industrial, donde sus principales consumidores son la industria nuclear y la ingeniería eléctrica. Su compuesto Na3AlF6 (¿cómo se llama?) se usa para producir aluminio. Y en la vida cotidiana, los utensilios de teflón, cuyo nombre proviene del plástico que contiene flúor, el teflón, se utilizan cada vez más.
Cloro- uno de los elementos químicos, sin el cual la existencia de organismos vivos es impensable. Su forma principal. ingesta es cloruro de sodio. Estimula el metabolismo, el crecimiento del cabello, da vitalidad y fuerza. La mayor parte del NaCl se encuentra en el plasma sanguíneo.
El ácido clorhídrico HC1, que forma parte del jugo gástrico, desempeña un papel especial en la digestión. Sin HCl al 0,2%, el proceso de digestión de los alimentos prácticamente se detiene. Y aunque casi todos los alimentos contienen alguna cantidad de sal de mesa, una persona se ve obligada a agregar diariamente unos 20 g de sal a la comida.
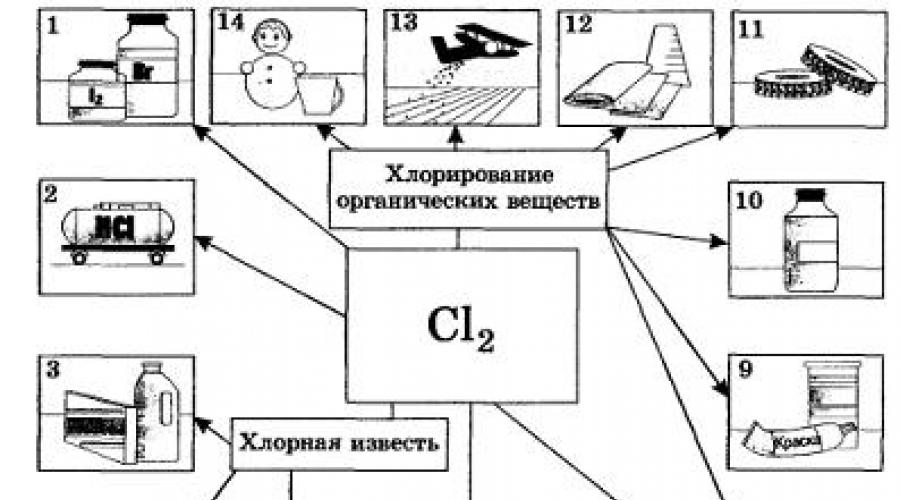
En términos de uso industrial, el cloro supera con creces a todos los halógenos. El cloro y sus compuestos son necesarios para el blanqueo de tejidos de lino y algodón, papel, etc. Especialmente una gran parte se consume en síntesis orgánica para la producción de plásticos, cauchos, colorantes y disolventes (Fig. 20).

Muchos compuestos que contienen cloro se utilizan para controlar las plagas agrícolas. El cloro se consume en grandes cantidades para desinfectar el agua potable, aunque no sin consecuencias negativas (¿qué sustancia es más segura utilizar para este fin?). En la metalurgia no ferrosa, ciertos metales (titanio, niobio, tantalio) se extraen de los minerales mediante el método de cloración de minerales. El cloro también se ha utilizado con fines militares como agente de guerra química. Más tarde, fue reemplazado por otras sustancias venenosas que contienen cloro, más efectivas, como el fosgeno COCl2.
El cloro está contenido en una sustancia muy peligrosa para la vida y la salud: la dioxina. Los compuestos de cloro son una de las causas de la destrucción de la capa de ozono de la Tierra.
Otro halógeno: el bromo también es muy importante para el cuerpo humano. Los compuestos de este elemento regulan los procesos de excitación e inhibición del sistema nervioso central, por lo tanto, para el tratamiento de enfermedades nerviosas (insomnio, histeria, neurastenia, etc.), los médicos prescriben "bromo", medicamentos que contienen bromo.
Algunas plantas, incluidas las algas marinas, acumulan bromo activamente. Es en el mar donde se concentra la mayor parte del bromo de nuestro planeta, y el mar es el principal proveedor de bromo. Se estima que anualmente cerca de 4 millones de toneladas de bromo pasan al aire con el agua de mar. Está claro que su contenido en el aire de las zonas costeras es siempre mayor que en las zonas alejadas del mar. Esta es una de las razones por las que es tan beneficioso respirar el aire del mar.
El bromo, o más bien el bromuro de plata AgBr, juega un papel igualmente importante en la fotografía. Aquellos que se dedican a la fotografía probablemente recordarán de inmediato los nombres de los tipos de papel fotográfico: "Uni-bromo", "Bromretrato", etc. El papel fotográfico contiene una capa de bromuro de plata depositada con gelatina, que se descompone fácilmente bajo el acción de la luz:
2AgBr = 2Ag + Br2
Y finalmente, el último de los halógenos que estamos considerando, el yodo, es el elemento sin el cual una persona no puede vivir: su falta en el agua y los alimentos reduce la producción de hormona tiroidea y conduce al bocio endémico. Bajo la acción reguladora de la hormona tiroidea se encuentran la excitación muscular, los latidos del corazón, el apetito, la digestión, la función cerebral y el temperamento humano. El yodo ingresa al cuerpo con los alimentos: pan, huevos, leche, agua, col rizada y con el aire (especialmente el mar) al respirar.
Una solución alcohólica de yodo (5-10%), llamada tintura de yodo, se usa para tratar heridas. El yodo es un ingrediente en muchos medicamentos.
Los principales consumidores de yodo son las industrias farmacéutica y química, así como la producción de materiales fotográficos sensibles a la luz.
1. Producción de halógenos por electrólisis de fundidos y soluciones salinas.
2. Importancia biológica de los halógenos.
3. El uso de cloro y compuestos de flúor, cloro y yodo.
¿Qué volumen de cloro (n.a.) y qué masa de sodio se puede obtener por electrólisis de 585 g de cloruro de sodio que contiene 2% de impurezas?
Calcule cuántos gramos de una solución alcalina al 40% se pueden obtener a partir de sodio, cuya masa determinó en el problema anterior.
El químico francés Scheele obtuvo cloro haciendo reaccionar óxido de manganeso (IV) con ácido clorhídrico. Como resultado de esta reacción, también se forman cloruro de manganeso (II) y agua. Escribe una ecuación para esta reacción, considera procesos redox y calcula la masa de óxido de manganeso (IV) y la cantidad de cloruro de hidrógeno necesaria para producir 100 litros de cloro (n.a.) si su rendimiento es el 95% del teóricamente posible.
Prepare un mensaje sobre el valor positivo y negativo de los halógenos en la vida humana.
Contenido de la lección resumen de la lección marco de apoyo lección presentación métodos acelerativos tecnologías interactivas Práctica tareas y ejercicios autoexamen talleres, capacitaciones, casos, búsquedas deberes preguntas de discusión preguntas retóricas de los estudiantes Ilustraciones audio, video clips y multimedia fotos, imágenes gráficas, cuadros, esquemas de humor, anécdotas, chistes, historietas, parábolas, refranes, crucigramas, citas Complementos resúmenes artículos fichas para inquisitivos chuletas libros de texto básicos y adicionales glosario de términos otros Mejorar los libros de texto y las lecciones.corregir errores en el libro de texto actualizar un fragmento en el libro de texto elementos de innovación en la lección reemplazar el conocimiento obsoleto por otros nuevos Solo para profesores lecciones perfectas plan de calendario para el año recomendaciones metodológicas del programa de discusión Lecciones integradasDEFINICIÓN
halógenos- elementos del grupo VIIA - flúor (F), cloro (Cl), bromo (Br) y yodo (I). Configuración electrónica del nivel de energía externa de los halógenos ns 2 np 5 .
Dado que, antes de completar el nivel de energía, los halógenos carecen de un solo electrón, en OVR exhiben con mayor frecuencia las propiedades de los agentes oxidantes. Estados de oxidación de los halógenos: de "-1" a "+7". El único elemento del grupo de los halógenos, el flúor, presenta un solo estado de oxidación "-1" y es el elemento más electronegativo.
Obtención de halógenos y sus compuestos
Los halógenos se pueden obtener por electrólisis de soluciones o fundidos de haluros:
MgCl 2 \u003d Mg + Cl 2 (derretido)
La mayoría de las veces, los halógenos se obtienen mediante la reacción de oxidación de los ácidos hidrohálicos:
MnO 2 + 4HCl \u003d MnCl 2 + Cl 2 + 2H 2 O
K 2 Cr 2 O 7 + 14HCl \u003d 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O
2KMnO4 + 16HCl \u003d 2MnCl2 + 5Cl2 + 8H2O + 2KCl
El HF y el HCl se obtienen por la interacción de sus sales sólidas con ácido sulfúrico concentrado cuando se calientan:
CaCl 2 + H 2 SO 4 \u003d CaSO 4 + 2HCl
El HBr y el HI no se pueden obtener de esta forma, ya que estas sustancias son reductores fuertes y se oxidan con ácido sulfúrico:
2KBr + 2H 2 SO 4 = K 2 SO 4 + Br 2 + 2H 2 O + SO 2
8KI + 5H 2 SO 4 = 4K 2 SO 4 + 4I 2 + 4H 2 O + H 2 S
Por lo tanto, HBr y HI se obtienen por hidrólisis de los correspondientes haluros de fósforo:
PBr 3 + 3H 2 O \u003d 3HBr + H 3 PO 3
Entre los compuestos de halógenos que contienen oxígeno, los ácidos que contienen oxígeno y sus sales son de la mayor importancia. Entonces, HClO, uno de los ácidos del cloro que contienen oxígeno, el ácido hipocloroso se obtiene en soluciones acuosas de cloro como producto de hidrólisis:
Cl 2 + H 2 O ↔ HClO + HCl
Sales de ácido hipocloroso: los hipocloritos se forman cuando el cloro pasa a través de soluciones frías de álcalis, por ejemplo:
Cl 2 + 2KOH \u003d KClO + KCl + H 2 O
El ácido clórico (HClO 3) se obtiene mediante el tratamiento de sales ácidas (cloratos) con ácido sulfúrico concentrado:
Ba(ClO 3 ) 2 + H 2 SO 4 = BaSO 4 + 2HClO 3
Las sales de ácido hipocloroso: los cloratos se obtienen pasando Cl 2 a una solución alcalina caliente:
3Cl2 + 6KOH = 5 KCl + KClO3 + 3H2O
HClO 4 - ácido perclórico, que se puede obtener actuando sobre perclorato de potasio con ácido sulfúrico concentrado:
2 KClO 4 + H 2 SO 4 = K 2 SO 4 +2 HClO 4
Se pueden obtener soluciones de ácidos hipobromoso (HOBr) e hipoyodoso (HOI), como HClO, haciendo reaccionar los correspondientes halógenos con agua.
Br 2 + H 2 O \u003d HBr + HOBr
Yo 2 + H 2 O \u003d HI + HOI
Los ácidos brómico (HBrO 3) y yódico (HIO 3) se pueden obtener oxidando agua de bromo o yodo con cloro:
Br2 + 5Cl2 + 6H2O = 2HBrO3 + 10 HCl
Importancia biológica de los halógenos y sus compuestos.
Cloro - uno de los elementos más importantes que componen los organismos vivos. En el cuerpo, se encuentra en forma de sal: cloruro de sodio. El cloro estimula el metabolismo, el crecimiento del cabello, da vitalidad y fuerza. La mayor parte del NaCl se encuentra en el plasma sanguíneo.
El HCl, que forma parte del jugo gástrico, controla el proceso de digestión. En ausencia de HCl al 0,2%, el proceso de digestión de los alimentos prácticamente se detiene.
Las algas, así como algunas otras plantas, acumulan bromo activamente. El agua de mar contiene la mayor cantidad de bromo, que es capaz de pasar al aire, por lo que su contenido en el aire de las zonas costeras siempre es mayor que en las zonas alejadas del mar.
El yodo, como el cloro, es uno de los elementos más importantes que componen los organismos vivos. La falta de yodo en el agua y los alimentos reduce la producción de hormona tiroidea y conduce al bocio endémico. El yodo entra al cuerpo con los alimentos: pan, huevos, leche, agua, algas y con el aire (especialmente el mar) al respirar.
El uso de halógenos y sus compuestos.
Los halógenos son ampliamente utilizados en la industria. Así, el flúor se utiliza para producir lubricantes que pueden soportar altas temperaturas, teflón, freones, etc. El cloro se utiliza en la producción de ácido clorhídrico, lejía, hipocloritos y cloratos, para blanquear tejidos y pastas utilizadas en la fabricación de papel, para esterilizar agua potable y desinfectar aguas residuales, etc.
El bromo es necesario para la producción de varias sustancias medicinales, algunos tintes, así como el bromuro de plata, que se usa en la producción de materiales fotográficos.
El yodo se usa en medicina en forma de una solución al 10% en etanol como agente antiséptico y hemostático. El yodo es parte de una serie de preparaciones farmacéuticas.
El ácido fluorhídrico (HF) se utiliza para producir fluoruros, grabar vidrio, eliminar arena de fundiciones de metal y analizar minerales.
El ácido clorhídrico (HCl) ha encontrado una amplia aplicación en la práctica química, así como sus sales. Por ejemplo, el cloruro de sodio (sal común) sirve como materia prima para la producción de cloro, ácido clorhídrico, sosa cáustica, se utiliza en tintorería, fabricación de jabón y otras industrias.
Ejemplos de solución por configuración
EJEMPLO 1
| Ejercicio | Escribe ecuaciones para las siguientes reacciones: 1) FeSO 4 + KClO 3 + H 2 SO 4 → ... 2) FeSO 4 + KClO 3 + KOH → ... 3) Yo 2 + Ba (OH) 2 → ... 4) KBr + KBrO 3 + H 2 SO 4 → ... |
| Responder | a) En esta reacción, el hierro aumenta el estado de oxidación de "+2" a "+3", es decir FeSO 4 es un agente reductor, y el cloro reduce el estado de oxidación de "+5" a "1", es decir KClO 3 es un agente oxidante: 6FeSO 4 + KClO 3 + 3H 2 SO 4 = 3Fe 2 (SO 4) 3 + KCl + 3H 2 O b) En esta reacción, el hierro aumenta el estado de oxidación de "+2" a "+3", es decir FeSO 4 es un agente reductor, y el cloro reduce el estado de oxidación de "+5" a "1", es decir KClO 3 es un agente oxidante: 6FeSO 4 + KClO 3 + 12KOH + 3H 2 O \u003d 6Fe (OH) 3 ↓ + KCl + 6K 2 SO 4 c) En esta reacción, el yodo aumenta y disminuye el estado de oxidación de "0" a "+5" y de "0" a "-1", es decir I 2 es tanto un agente reductor como un agente oxidante; se produce una reacción de desproporción: 6I 2 + 6Ва(OH) 2 = 5ВаI 2 + Ва(IO 3) 2 + 6N 2 О d) En esta reacción, el bromo aumenta y disminuye el estado de oxidación de "-1" a "0" y de "+5" a "0", es decir KBr es un agente reductor y KBrO 3 es un agente oxidante: 5КВr + КВrО 3 + 3Н 2 SO 4 = 3Вr 2 + 3К 2 SO 4 + 3Н 2 О |
1. Características generales de los halógenos . La estructura de los átomos y el estado de oxidación de los halógenos en los compuestos. La naturaleza del cambio en los radios atómicos, energías de ionización, afinidad electrónica y electronegatividad en la serie F - At. La naturaleza de los enlaces químicos de los halógenos con metales y no metales. Estabilidad de los estados de mayor valencia de los halógenos. Características del flúor.
1. Con. 367-371; 2. Con. 338-347; 3. Con. 415-416; 4. Con. 270-271; 7. Con. 340-345.
2. Estructura molecular y propiedades físicas de sustancias halógenas simples . La naturaleza del enlace químico en las moléculas de halógeno. Propiedades físicas de los halógenos: estado de agregación, puntos de fusión y ebullición en la serie flúor - astato, solubilidad en agua y en disolventes orgánicos.
1. Con. 370-372; 2. Con. 340-347; 3. Con. 415-416; 4. Con. 271-287; 8. Con. 367-370.
3. Propiedades químicas de los halógenos. . Razones de la alta actividad química de los halógenos y su cambio en el grupo. Relación con el agua, soluciones alcalinas, metales y no metales. Influencia de la temperatura en la composición de productos de desproporción de halógenos en soluciones alcalinas. Características de la química del flúor. Compuestos halogenados naturales. Principios de los métodos industriales y de laboratorio para la obtención de halógenos. El uso de halógenos. Acción fisiológica y farmacológica de los halógenos y sus compuestos sobre los organismos vivos. Toxicidad de los halógenos y precauciones para su manipulación.
1. Con. 372-374, pág. 387-388; 2. Con. 342-347; 3. Con. 416-419; 4. Con. 276-287; 7. págs.340-345, pág. 355; 8. Con. 380-382.
Los halógenos de sustancias simples, a diferencia del hidrógeno, son muy activos. Se caracterizan principalmente por sus propiedades oxidantes, que se debilitan gradualmente en la serie F 2 - At 2. El más activo de los halógenos es el flúor: ¡incluso el agua y la arena se encienden espontáneamente en su atmósfera! Los halógenos reaccionan vigorosamente con la mayoría de los metales, con los no metales, con sustancias complejas.
4. Producción y uso de halógenos. .
1. Con. 371-372; 2. Con. 345-347; 3. Con. 416-419; 4. Con. 275-287; 7. págs. 340-345; 8. Con. 380-382.
Todos los métodos para producir halógenos se basan en las reacciones de oxidación de aniones de haluro con varios agentes oxidantes: 2Gal -1 -2e - = Gal
Los halógenos en la industria se obtienen por electrólisis de fundidos (F 2 y Cl 2) o soluciones acuosas (Cl 2) de haluros; desplazamiento de halógenos menos activos por otros más activos de los haluros correspondientes (I 2 - bromo; I 2 o Br 2 - cloro)
Los halógenos se obtienen en laboratorio por oxidación de haluros de hidrógeno (HCl, HBr) en soluciones con oxidantes fuertes (KMnO 4 , K 2 Cr 2 O 7 , PbO 2 , MnO 2 , KClO 3 ); oxidación de haluros (NaBr, KI) con los oxidantes indicados en medio ácido (H 2 SO 4).
Compuestos binarios de halógenos
1. Compuestos con hidrógeno (haluros de hidrógeno) . La naturaleza del enlace químico en las moléculas. La polaridad de las moléculas. Propiedades físicas, estado de agregación, solubilidad en agua. La naturaleza del cambio en los puntos de fusión y ebullición en la serie HF - HI. Asociación de moléculas de fluoruro de hidrógeno. Estabilidad térmica de los haluros de hidrógeno. reactividad. Propiedades ácidas, características del ácido fluorhídrico. propiedades reparadoras. Principios generales para la producción de haluros de hidrógeno: síntesis a partir de sustancias simples ya partir de haluros. Cloruro de hidrógeno y ácido clorhídrico. Propiedades físicas y químicas. Formas de conseguir. El uso de ácido clorhídrico. El papel del ácido clorhídrico y los cloruros en los procesos vitales. haluros.
1. Con. 375-382; 2. Con. 347-353; 3. Con. 419-420; 4. Con. 272-275, pág. 289-292; 7. págs. 354-545; 8. Con. 370-373, pág. 374-375.
2 . Compuestos de halógenos con oxígeno.
1. Con. 377-380; 2. Con. 353-359; 3. Con. 420-423; 4. Con. 292-296; 7. págs. 350-354; 8. Con. 375-376, pág. 379.
3. Compuestos con otros no metales.
1. Con. 375-381; 2. Con. 342-345; 4. Con. 292-296; 7. págs. 350-355.
4 . Conexiones con metales .
2. Con. 342; 4. Con. 292-296; 7. págs. 350-355.
Compuestos halógenos de elementos múltiples
1. Ácidos clorados que contienen oxígeno y sus sales. Ácidos hipocloroso, clórico, clorhídrico y perclórico. Cambio en propiedades ácidas, estabilidad y propiedades oxidantes en la serie HClO - HClO 4 . Principios para la obtención de estos ácidos. Hipocloritos, cloritos, cloratos y percloratos. Estabilidad térmica y propiedades oxidativas. Principios generales para la obtención de sales. El uso de sales. Polvo de blanquear. Sal de Berthollet. Perclorato de amonio.
1. Con. 382-387; 2. Con. 353-359; 3. Con. 423; 4. Con. 292-296; 7. págs. 350-354; 8. Con. 375-378.
2 . Ácidos de bromo y yodo que contienen oxígeno y sus sales .
1. Con. 382-387; 2. Con. 353-359; 3. Con. 423; 4. Con. 292-296; 7. págs. 350-354; 8. Con. 379-380.
3 . El uso de halógenos y sus compuestos más importantes.
1. Con. 387-388; 2. Con. 345-347; 3. Con. 419-423; 4. Con. 272-296; 8. Con. 380-382.
4 . El papel biológico de los compuestos halógenos.
1. Con. 387-388; 2. Con. 340-347; 3. Con. 419-423; 4. Con. 272-296; 8. Con. 380-382.
RelaciónLos compuestos de cloro más importantes:
