وصف مادة سائلة. الحالة السائلة. تتشابه هياكل السوائل والأجسام غير المتبلورة
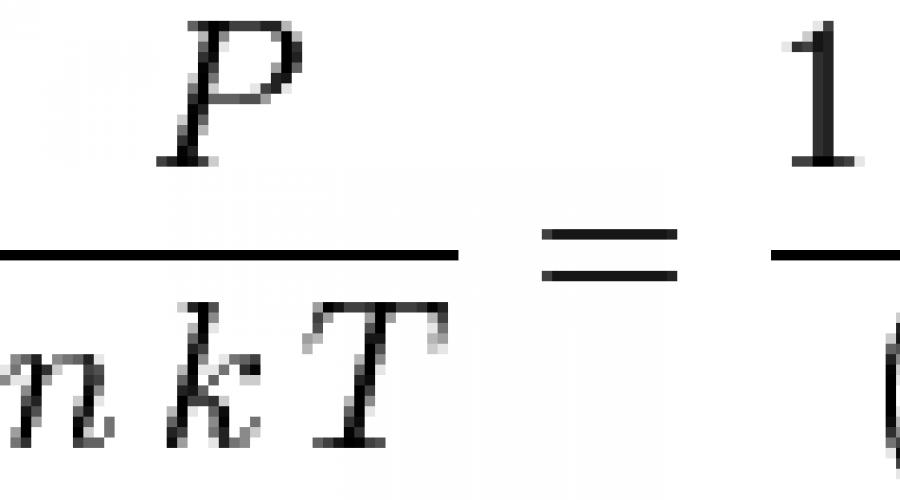
معادلة أويلر معادلات نافيير-ستوكس معادلة الانتشار قانون هوك
كقاعدة عامة ، المادة في الحالة السائلة لها تعديل واحد فقط. (أهم الاستثناءات هي السوائل الكمومية والبلورات السائلة.) لذلك ، في معظم الحالات ، لا يكون السائل حالة تجمع فحسب ، بل هو أيضًا مرحلة ديناميكية حرارية (المرحلة السائلة).
تنقسم جميع السوائل عادة إلى سوائل ومخاليط نقية. بعض مخاليط السوائل لها أهمية كبيرة للحياة: الدم ، ماء البحر ، إلخ. السوائل يمكن أن تعمل كمذيبات.
الخصائص الفيزيائية للسوائل
- سيولة
السيولة هي الخاصية الرئيسية للسوائل. إذا تم تطبيق قوة خارجية على قسم من السائل في حالة توازن ، فإن تدفق جزيئات السائل يحدث في الاتجاه الذي يتم تطبيق هذه القوة فيه: يتدفق السائل. وبالتالي ، تحت تأثير القوى الخارجية غير المتوازنة ، لا يحتفظ السائل بالشكل والترتيب النسبي للأجزاء ، وبالتالي يأخذ شكل الوعاء الذي يوجد فيه.
على عكس المواد الصلبة البلاستيكية ، فإن السائل ليس له قوة خضوع: يكفي استخدام قوة خارجية صغيرة بشكل تعسفي لتدفق السائل.
- حفظ الحجم
من الخصائص المميزة للسائل أن له حجمًا معينًا (في ظل ظروف خارجية ثابتة). من الصعب للغاية ضغط السائل ميكانيكيًا لأنه ، على عكس الغاز ، توجد مساحة خالية قليلة جدًا بين الجزيئات. الضغط الذي يمارس على سائل مغلق في وعاء ينتقل دون تغيير إلى كل نقطة من حجم هذا السائل (قانون باسكال ، صالح أيضًا للغازات). هذه الميزة ، إلى جانب الانضغاط المنخفض للغاية ، تُستخدم في الآلات الهيدروليكية.
تزداد السوائل عادة في الحجم (التمدد) عند تسخينها وتنخفض في الحجم (الانكماش) عند التبريد. ومع ذلك ، هناك استثناءات ، على سبيل المثال ، ضغط الماء عند التسخين ، عند الضغط العادي ودرجات الحرارة من 0 درجة مئوية إلى حوالي 4 درجات مئوية.
- اللزوجة
بالإضافة إلى ذلك ، تتميز السوائل (مثل الغازات) باللزوجة. يتم تعريفه على أنه القدرة على مقاومة حركة أحد الأجزاء بالنسبة للآخر - أي كاحتكاك داخلي.
عندما تتحرك الطبقات المتجاورة من السائل بالنسبة لبعضها البعض ، هناك حتما تصادم للجزيئات بالإضافة إلى ذلك بسبب الحركة الحرارية. هناك قوى تبطئ الحركة المنظمة. في هذه الحالة ، يتم تحويل الطاقة الحركية للحركة المنظمة إلى طاقة حرارية - طاقة الحركة الفوضوية للجزيئات.
السائل الموجود في الوعاء يتحرك ويترك لنفسه سيتوقف تدريجيًا ، لكن درجة حرارته سترتفع.
- تشكيل السطح الحر وتوتر السطح
بسبب الحفاظ على الحجم ، فإن السائل قادر على تكوين سطح حر. مثل هذا السطح هو واجهة الطور لمادة معينة: من جانب يوجد الطور السائل ، ومن الجانب الآخر - الغازي (البخار) ، وربما الغازات الأخرى ، مثل الهواء.
إذا كانت المراحل السائلة والغازية من نفس المادة على اتصال ، تظهر قوى تميل إلى تقليل منطقة الواجهة - قوى التوتر السطحي. تتصرف الواجهة كغشاء مرن يميل إلى الانكماش.
يمكن تفسير التوتر السطحي من خلال التجاذب بين جزيئات السائل. كل جزيء يجذب جزيئات أخرى ، ويميل إلى "إحاطة" نفسه بها ، وبالتالي ، مغادرة السطح. وفقًا لذلك ، يميل السطح إلى الانخفاض.
لذلك ، تميل فقاعات الصابون والفقاعات أثناء الغليان إلى أن تأخذ شكلًا كرويًا: بالنسبة لحجم معين ، يكون للكرة حد أدنى من السطح. إذا كانت قوى التوتر السطحي تعمل فقط على السائل ، فسيأخذ بالضرورة شكلًا كرويًا - على سبيل المثال ، يسقط الماء في حالة انعدام الوزن.
الأجسام الصغيرة ذات الكثافة الأكبر من كثافة السائل قادرة على "الطفو" على سطح السائل ، لأن قوة الجاذبية أقل من القوة التي تمنع زيادة مساحة السطح. (انظر التوتر السطحي.)
- التبخر والتكثيف
- انتشار
عندما يكون هناك سائلين قابلين للامتزاج في وعاء ، نتيجة للحركة الحرارية ، تبدأ الجزيئات بالمرور تدريجيًا عبر الواجهة ، وبالتالي تختلط السوائل تدريجيًا. تسمى هذه الظاهرة بالانتشار (تحدث أيضًا في المواد الموجودة في حالات التجميع الأخرى).
- ارتفاع درجة الحرارة وانخفاض درجة حرارة الجسم
يمكن تسخين السائل فوق نقطة الغليان بحيث لا يحدث الغليان. يتطلب هذا تسخينًا منتظمًا ، دون اختلافات كبيرة في درجة الحرارة داخل الحجم وبدون تأثيرات ميكانيكية مثل الاهتزاز. إذا تم إلقاء شيء ما في سائل شديد السخونة ، فإنه يغلي على الفور. من السهل الحصول على الماء الساخن في الميكروويف.
التبريد الفرعي - تبريد السائل تحت درجة التجمد دون التحول إلى حالة صلبة من التراكم. كما هو الحال مع التسخين الفائق ، يتطلب التبريد الفرعي عدم وجود اهتزازات وتقلبات كبيرة في درجات الحرارة.
- موجات الكثافة
على الرغم من صعوبة ضغط السائل ، إلا أن حجمه وكثافته يتغيران مع تغير الضغط. لا يحدث ذلك على الفور. لذلك ، إذا تم ضغط أحد الأقسام ، فسيتم نقل هذا الضغط إلى أقسام أخرى مع تأخير. هذا يعني أن الموجات المرنة ، وبشكل أكثر تحديدًا موجات الكثافة ، يمكن أن تنتشر داخل السائل. إلى جانب الكثافة ، تتغير أيضًا الكميات الفيزيائية الأخرى ، على سبيل المثال ، درجة الحرارة.
إذا تغيرت الكثافة بشكل ضعيف أثناء انتشار الموجة ، فإن هذه الموجة تسمى موجة صوتية أو صوت.
إذا تغيرت الكثافة بقوة كافية ، فإن هذه الموجة تسمى موجة الصدمة. توصف معادلات أخرى موجة الصدمة.
تكون موجات الكثافة في السائل طولية ، أي أن الكثافة تختلف على طول اتجاه انتشار الموجة. لا توجد موجات مرنة عرضية في السائل بسبب عدم الحفاظ على الشكل.
الموجات المرنة في سائل الاضمحلال بمرور الوقت ، تتحول طاقتها تدريجياً إلى طاقة حرارية. أسباب التخميد هي اللزوجة و "الامتصاص الكلاسيكي" والاسترخاء الجزيئي وغيرها. في هذه الحالة ، يعمل ما يسمى باللزوجة الثانية ، أو اللزوجة السائبة - الاحتكاك الداخلي مع تغير الكثافة. نتيجة للتوهين ، تتحول موجة الصدمة إلى موجة صوتية بعد مرور بعض الوقت.
تخضع الموجات المرنة في السائل أيضًا للتشتت بسبب عدم التجانس الناتج عن الحركة الحرارية العشوائية للجزيئات.
- موجات على السطح
إذا تم إزاحة سطح السائل من وضع التوازن ، ثم تحت تأثير قوى الاستعادة ، يبدأ السطح في العودة إلى وضع التوازن. هذه الحركة ، مع ذلك ، لا تتوقف ، بل تتحول إلى حركة تذبذبية بالقرب من وضع التوازن وتنتشر إلى مناطق أخرى. هذه هي الطريقة التي تظهر بها الموجات على سطح السائل.
إذا كانت قوة الاستعادة هي الجاذبية في الغالب ، فإن هذه الموجات تسمى موجات الجاذبية (يجب عدم الخلط بينها وبين موجات الجاذبية). يمكن رؤية موجات الجاذبية على الماء في كل مكان.
إذا كانت قوة الاستعادة هي في الغالب قوة توتر سطحي ، فإن هذه الموجات تسمى شعري.
إذا كانت هذه القوى قابلة للمقارنة ، فإن هذه الموجات تسمى موجات الجاذبية الشعرية.
تضعف اللزوجة وعوامل أخرى الموجات الموجودة على سطح السائل.
- التعايش مع الأطوار الأخرى
من الناحية الرسمية ، من أجل تحقيق التوازن بين الطور السائل والمراحل الأخرى لنفس المادة - الغازية أو البلورية - هناك حاجة إلى شروط محددة بدقة. لذلك ، عند ضغط معين ، هناك حاجة إلى درجة حرارة محددة بدقة. ومع ذلك ، في الطبيعة والتكنولوجيا ، يتعايش السائل في كل مكان مع البخار ، أو أيضًا مع الحالة الصلبة للتجمع - على سبيل المثال ، الماء مع بخار الماء وغالبًا مع الثلج (إذا اعتبرنا البخار كمرحلة منفصلة موجودة مع الهواء). هذا يرجع إلى الأسباب التالية.
حالة غير متوازنة. يستغرق الأمر وقتًا حتى يتبخر السائل ، حتى يتبخر السائل تمامًا ، يتعايش مع البخار. في الطبيعة ، يتبخر الماء باستمرار ، وكذلك العملية العكسية - التكثيف.
حجم مغلق. يبدأ السائل الموجود في وعاء مغلق في التبخر ، ولكن نظرًا لأن الحجم محدود ، يرتفع ضغط البخار ، ويصبح مشبعًا حتى قبل أن يتبخر السائل تمامًا ، إذا كانت الكمية كبيرة بدرجة كافية. عندما يتم الوصول إلى حالة التشبع ، فإن كمية السائل المتبخر تساوي كمية السائل المكثف ، ويأتي النظام في حالة توازن. وبالتالي ، في حجم محدود ، يمكن إنشاء الشروط اللازمة لتوازن التعايش بين السائل والبخار.
وجود الغلاف الجوي في ظروف الجاذبية الأرضية. يعمل الضغط الجوي على السائل (الهواء والبخار) ، بينما بالنسبة للبخار ، يجب أن يؤخذ في الاعتبار ضغطه الجزئي فقط. لذلك ، فإن السائل والبخار فوق سطحه يتوافقان مع نقاط مختلفة على مخطط الطور ، في منطقة وجود المرحلة السائلة وفي منطقة وجود الغازي ، على التوالي. هذا لا يلغي التبخر ، لكن التبخر يستغرق وقتًا تتعايش خلاله كلتا المرحلتين. بدون هذه الحالة ، سوف تغلي السوائل وتتبخر بسرعة كبيرة.
نظرية
علم الميكانيكا
تعد دراسة الحركة والتوازن الميكانيكي للسوائل والغازات وتفاعلها مع بعضها البعض ومع المواد الصلبة موضوعًا لفرع الميكانيكا - ميكانيكا الهواء (غالبًا ما تسمى أيضًا الديناميكا المائية). ميكانيكا الموائع هي جزء من فرع عام للميكانيكا ، ميكانيكا التواصل.
ميكانيكا الموائع هي أحد فروع ميكانيكا الموائع التي تتعامل مع السوائل غير القابلة للضغط. نظرًا لأن انضغاط السوائل صغير جدًا ، يمكن إهماله في كثير من الحالات. ديناميات الغاز مكرسة لدراسة السوائل والغازات الانضغاطية.
تنقسم الميكانيكا المائية إلى هيدروستاتيك ، والتي تدرس توازن السوائل غير القابلة للضغط ، والديناميكا المائية (بالمعنى الضيق) ، التي تدرس حركتها.
تتم دراسة حركة السوائل الموصلة كهربائياً والمغناطيسية في الديناميكا المائية المغناطيسية. تستخدم المكونات الهيدروليكية لحل المشكلات التطبيقية.
القانون الأساسي للهيدروستاتيكا هو قانون باسكال.
2. سوائل من جزيئات ثنائية الذرة تتكون من ذرات متطابقة (هيدروجين سائل ، نيتروجين سائل). هذه الجزيئات لها عزم رباعي.
4. سوائل تتكون من جزيئات قطبية مرتبطة بتفاعل ثنائي القطب ثنائي القطب (بروميد الهيدروجين السائل).
5. السوائل أو السوائل المصاحبة مع روابط هيدروجينية (ماء ، جلسرين).
6. سوائل تتكون من جزيئات كبيرة ، والتي تعتبر درجات الحرية الداخلية ضرورية لها.
عادة ما تسمى السوائل من أول مجموعتين (في بعض الأحيان ثلاث) بسيطة. تمت دراسة السوائل البسيطة بشكل أفضل من غيرها ؛ بالنسبة للسوائل المعقدة ، كان الماء هو الأكثر دراسة. لا يشمل هذا التصنيف السوائل الكمومية والبلورات السائلة ، وهي حالات خاصة ويجب النظر إليها بشكل منفصل.
النظرية الإحصائية
تمت دراسة التركيب والخصائص الديناميكية الحرارية للسوائل بنجاح باستخدام معادلة Percus-Yevick.
إذا استخدمنا نموذج الكرات الصلبة ، أي ، اعتبر الجزيئات السائلة كرات ذات قطر د، ثم يمكن حل معادلة Percus-Yevick بشكل تحليلي ويمكن الحصول على معادلة حالة السائل:
![]() أين ن- عدد الجسيمات لكل وحدة حجم ،
أين ن- عدد الجسيمات لكل وحدة حجم ، ![]() هي كثافة بلا أبعاد. عند الكثافات المنخفضة ، تصبح هذه المعادلة هي معادلة الغاز المثالية للحالة:
هي كثافة بلا أبعاد. عند الكثافات المنخفضة ، تصبح هذه المعادلة هي معادلة الغاز المثالية للحالة: ![]() . بالنسبة للكثافات العالية للغاية ، يتم الحصول على معادلة الحالة للسائل غير القابل للضغط:.
. بالنسبة للكثافات العالية للغاية ، يتم الحصول على معادلة الحالة للسائل غير القابل للضغط:.
لا يأخذ نموذج الكرة الصلبة في الاعتبار التجاذب بين الجزيئات ، لذلك لا يوجد انتقال حاد بين السائل والغاز عندما تتغير الظروف الخارجية.
إذا تم الحصول على نتائج أكثر دقة ، فسيتم تحقيق أفضل وصف لهيكل وخصائص المائع باستخدام نظرية الاضطراب. في هذه الحالة ، يعتبر نموذج الكرة الصلبة التقريب الصفري ، وتعتبر قوى الجذب بين الجزيئات اضطرابات وتعطي تصحيحات.
نظرية الكتلة
إحدى النظريات الحديثة هي "نظرية الكتلة". يعتمد على فكرة أن السائل يتم تمثيله على أنه مزيج من مادة صلبة وغاز. في هذه الحالة ، توجد جسيمات المرحلة الصلبة (بلورات تتحرك على مسافات قصيرة) في سحابة غازية ، وتتشكل هيكل الكتلة. تتوافق طاقة الجسيمات مع توزيع Boltzmann ، بينما يظل متوسط طاقة النظام ثابتًا (في حالة عزله). تصطدم الجسيمات البطيئة بالعناقيد وتصبح جزءًا منها. وبالتالي ، فإن تكوين المجموعات يتغير باستمرار ، والنظام في حالة توازن ديناميكي. عند إنشاء تأثير خارجي ، سيتصرف النظام وفقًا لمبدأ Le Chatelier. وبالتالي ، من السهل شرح تحول المرحلة:
- عند تسخينه ، سيتحول النظام تدريجيًا إلى غاز (يغلي)
- عند تبريده ، سيتحول النظام تدريجيًا إلى جسم صلب (متجمد).
طرق الدراسة التجريبية
تمت دراسة بنية السوائل باستخدام التحليل الإنشائي للأشعة السينية ، وحيود الإلكترون وطرق الحيود النيوتروني.
أنظر أيضا
- ملامح الطبقة السطحية للسائل
الروابط
| الحالات الديناميكية الحرارية للمادة | |
|---|---|
| الفيزياء: صلب سائلبلازما الغاز | |
- الحالة الصلبة
- الحالة السائلة
- الحالة الغازية
- التغيير في حالة المادة
الكيمياء هي دراسة المادة. ما هي "الجوهر"؟ المادة هي أي شيء له كتلة وحجم.يمكن أن تكون المادة في واحدة من ثلاث حالات مجمعة: صلبة ، سائلة ، غازية.
1. الحالة الصلبة
يتم دمج الجزيئات (الجزيئات) في الجسم الصلب في بنية متكررة صلبة - شعرية الكريستال. تُحدث الجسيمات الموجودة في الشبكة البلورية اهتزازات صغيرة حول مراكز التوازن. الصلبة لها شكلو الصوت.
2. الحالة السائلة
على عكس المواد الصلبة ، فإن السائل ليس له شكل محدد ، ولكن له حجم. ويفسر ذلك حقيقة أن الجزيئات في السوائل تكون على مسافة أكبر من بعضها في المواد الصلبة وتتحرك بشكل أكثر نشاطًا.
نظرًا لأن الجسيمات في السوائل أقل كثافة من المواد الصلبة ، فلا يمكنها تكوين شبكة بلورية ، وبالتالي ليس للسوائل شكل محدد.
3. الحالة الغازية
في الغاز ، لا تزال الجسيمات على مسافات أكبر من مسافات السوائل. علاوة على ذلك ، فإن الجسيمات في حركة فوضوية (عشوائية) باستمرار. لذلك ، تميل الغازات إلى ملء الحجم المقدم لها بشكل موحد (ومن هنا تأتي حقيقة أن الغازات ليس لها شكل محدد).
4. التغيير في حالة الأمر
لنأخذ مثالًا عاديًا ونتابع عملية تغيير حالة الماء.
في الحالة الصلبة ، يكون الماء جليدًا. تكون درجة حرارة الجليد أقل من 0 درجة مئوية. عند تسخينه ، يبدأ الجليد في الذوبان ويتحول إلى ماء. هذا يرجع إلى حقيقة أن جزيئات الجليد في الشبكة البلورية تبدأ في التحرك عند تسخينها ، مما يؤدي إلى تدمير الشبكة. تسمى درجة الحرارة التي تذوب عندها المادة "نقطة الانصهار"مواد. نقطة انصهار الماء هي 0 درجة مئوية.
وتجدر الإشارة إلى أنه حتى يذوب الجليد تمامًا ، ستكون درجة حرارة الجليد 0 درجة مئوية.
| أثناء تغيرات طور المادة ، تظل درجة الحرارة ثابتة. |
بعد أن يتحول الجليد تمامًا إلى ماء ، سنواصل التسخين. سترتفع درجة حرارة الماء ، وسوف تتسارع حركة الجسيمات تحت تأثير الحرارة أكثر فأكثر. يحدث هذا حتى يصل الماء إلى نقطة تغيير حالته التالية - الغليان.
تأتي هذه اللحظة عندما تنكسر روابط جزيئات الماء تمامًا وتصبح حركتها حرة: يتحول الماء إلى بخار.
| تسمى العملية التي تتغير بها المادة من الحالة السائلة إلى الحالة الغازية الغليان |
درجة الحرارة التي يتم عندها استدعاء السائل "نقطة الغليان".
لاحظ أن درجة الغليان تعتمد على الضغط. عند الضغط العادي (760 ملم زئبق) تكون درجة غليان الماء 100 درجة مئوية.
بالقياس مع الذوبان: حتى يتحول الماء تمامًا إلى بخار ، ستكون درجة الحرارة ثابتة.
لخص. نتيجة للتسخين ، حصلنا على حالات طور مختلفة للماء:
ثلج ← ماء ← بخارأو H 2 0 (t) → H 2 0 (g) → H 2 0 (g)
ماذا يحدث إذا بدأنا في تبريد بخار الماء؟ ليس عليك أن تكون "سبع امتدادات في الجبهة" لتخمن - ستستمر العملية العكسية لتغييرات الطور في الماء:
البخار ← الماء ← الثلج
هناك بعض المواد التي تنتقل مباشرة من الحالة الصلبة إلى الحالة الغازية ، متجاوزة المرحلة السائلة. تسمى هذه العملية تساميأو تسامي. لذلك ، على سبيل المثال ، يتصرف "الجليد الجاف" (ثاني أكسيد النيتروجين CO 2). عندما يتم تسخينه ، لن ترى قطرة ماء - سيبدو "الجليد الجاف" وكأنه يتبخر أمام عينيك.
تسمى العملية التي هي عكس التسامي (انتقال مادة من غاز إلى حالة صلبة) إزالة الذوبان.
تحتل السوائل موقعًا وسيطًا بين المواد الغازية والصلبة. عند درجات حرارة قريبة من نقاط الغليان ، تقترب خصائص السوائل من خصائص الغازات ؛ عند درجات حرارة قريبة من نقاط الانصهار ، تقترب خصائص السوائل من خصائص المواد الصلبة. إذا كانت المواد الصلبة تتميز بترتيب صارم للجسيمات ، يمتد عبر مسافات تصل إلى مئات الآلاف من نصف القطر بين الذرات أو الجزيئية ، فعندئذٍ في المادة السائلة لا يوجد عادة أكثر من بضع عشرات من الجسيمات المرتبة - وهذا ما يفسره حقيقة أن الترتيب بين الجسيمات في أماكن مختلفة من مادة سائلة ينشأ بسرعة أيضًا ، وكذلك "تلطخ" مرة أخرى بالاهتزاز الحراري للجسيمات. في الوقت نفسه ، تختلف كثافة التعبئة الإجمالية لجزيئات المادة السائلة قليلاً عن كثافة المادة الصلبة - لذلك ، كثافتها قريبة من كثافة المواد الصلبة ، والانضغاطية منخفضة للغاية. على سبيل المثال ، لتقليل الحجم الذي يشغله الماء السائل بنسبة 1٪ ، يلزم تطبيق ضغط يبلغ ~ 200 ضغط جوي ، بينما يتطلب نفس الانخفاض في حجم الغازات ضغطًا قدره 0.01 ضغط جوي. لذلك ، فإن انضغاطية السوائل تقارب 200: 0.01 = 20000 مرة أقل من انضغاطية الغازات.
لقد لوحظ أعلاه أن السوائل لها حجم معين خاص بها وتتخذ شكل الوعاء الذي توجد فيه ؛ هذه الخصائص هي أقرب إلى خصائص المادة الصلبة من المادة الغازية. تم تأكيد القرب الشديد للحالة السائلة من الحالة الصلبة أيضًا من خلال البيانات الموجودة على المحتوى الحراري القياسي لاختبار التبخر ∆Н ° والمحتوى الحراري القياسي للذوبان ∆Н ° pl. المحتوى الحراري القياسي للتبخيراستدعي كمية الحرارة المطلوبة لتحويل 1 مول من السائل إلى بخار عند 1 ضغط جوي (101.3 كيلو باسكال). يتم إطلاق نفس القدر من الحرارة عندما يتكثف 1 مول من البخار في سائل عند 1 ضغط جوي. يتم استدعاء كمية الحرارة التي يتم إنفاقها على تحويل 1 مول من مادة صلبة إلى سائل عند 1 ضغط جوي المحتوى الحراري القياسي للانصهار(يتم إطلاق نفس القدر من الحرارة عند "التجميد" ("التجميد") 1 مول من السائل عند 1 ضغط جوي). من المعروف أن ∆Н ° pl أقل بكثير من القيم المقابلة لـ ∆Н ° exp ، والتي يسهل فهمها ، حيث أن الانتقال من الحالة الصلبة إلى الحالة السائلة يكون مصحوبًا بانتهاك أصغر للتجاذب بين الجزيئات من a الانتقال من الحالة السائلة إلى الحالة الغازية.
هناك عدد من الخصائص المهمة الأخرى للسوائل التي تذكرنا بخصائص الغازات. لذلك ، مثل الغازات ، يمكن للسوائل أن تتدفق - خصائصها تسمى السيولة. يتم تحديد مقاومة التدفق من خلال اللزوجة. تتأثر السيولة واللزوجة بقوى الجذب بين الجزيئات السائلة ووزنها الجزيئي النسبي وعدد من العوامل الأخرى. تبلغ لزوجة السوائل حوالي 100 مرة أكبر من لزوجة الغازات. تمامًا مثل الغازات ، يمكن للسوائل أن تنتشر ، وإن كان ذلك أبطأ بكثير ، لأن الجزيئات السائلة تكون معبأة بكثافة أكبر بكثير من جزيئات الغاز.
من أهم خصائص السائل هو التوتر السطحي(هذه الخاصية ليست متأصلة في أي من الغازات أو المواد الصلبة). يخضع جزيء في سائل لقوى جزيئية موحدة من جميع الجوانب. ومع ذلك ، على سطح السائل ، يكون توازن هذه القوى مضطربًا ، ونتيجة لذلك ، تكون جزيئات "السطح" تحت تأثير قوة ناتجة معينة موجهة داخل السائل. لهذا السبب ، يكون سطح السائل في حالة توتر. التوتر السطحي- هذه هي القوة الدنيا التي تقيد حركة جزيئات السائل في عمق السائل وبالتالي تحافظ على سطح السائل من الانكماش. إن التوتر السطحي هو الذي يفسر شكل "الدمعة" للجسيمات السائلة المتساقطة بحرية.
في الحالة السائلة ، تكون المسافة بين الجسيمات أصغر بكثير مما كانت عليه في الحالة الغازية. تشغل الجزيئات الجزء الأكبر من الحجم ، وتتلامس باستمرار مع بعضها البعض وتنجذب إلى بعضها البعض. لوحظ بعض ترتيب الجسيمات (ترتيب قصير المدى). تتحرك الجسيمات بالنسبة لبعضها البعض.
في السوائل ، تنشأ تفاعلات فان دير فال بين الجسيمات: التشتت والتوجيه والاستقراء. تسمى مجموعات صغيرة من الجسيمات توحدها قوى معينة عناقيد المجموعات. في حالة الجسيمات المتطابقة ، تسمى العناقيد في السائل المرتبطين
في السوائل ، يزيد تكوين الروابط الهيدروجينية من ترتيب الجسيمات. ومع ذلك ، فإن روابط الهيدروجين وقوى فان دير فال هشة - والجزيئات في الحالة السائلة في حالة حركة فوضوية مستمرة ، وهو ما يسمى الحركة البراونية.
بالنسبة للحالة السائلة ، يكون توزيع الجزيئات وفقًا لسرعات وطاقات ماكسويل بولتزمان صحيحًا.
تعتبر نظرية السوائل أقل تطوراً بكثير من نظريات الغازات ، حيث تعتمد خصائص السوائل على هندسة وقطبية الجزيئات المتقاربة التباعد. بالإضافة إلى ذلك ، فإن عدم وجود بنية محددة للسوائل يجعل من الصعب إضفاء الطابع الرسمي على وصفها - في معظم الكتب المدرسية ، تعطى السوائل مساحة أقل بكثير من الغازات والمواد الصلبة البلورية.
لا توجد حدود حادة بين السوائل والغازات - فهي تختفي تمامًا نقاط حرجة. لكل غاز درجة حرارة معروفة ، وفوقها لا يمكن أن يكون سائلاً تحت أي ضغط ؛ مع هذا حرجدرجة الحرارة ، تختفي الحدود (الغضروف المفصلي) بين السائل وبخاره المشبع. تم تحديد وجود درجة حرارة حرجة ("نقطة الغليان المطلقة") بواسطة D.I. Mendeleev في عام 1860
الجدول 7.2 - المعلمات الحرجة (t k، p k، V k) لبعض المواد
| مستوى | ر إلى حوالي ج | ص ك ، أجهزة الصراف الآلي | الخامس إلى ، سم 3 / مول | ر تذوب س ج | ر بال حول ج |
| هو | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| العدد 2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| س 2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH 4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| ثاني أكسيد الكربون | +31,0 | 72,9 | 94,0 | -56,16 | -78.48 (subl) |
| NH3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| SO2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
ضغط البخار المشبع- الضغط الجزئي الذي تكون عنده معدلات تبخر وتكثيف البخار متساوية:
حيث A و B ثوابت.
درجة حرارة الغليانهي درجة الحرارة التي يكون عندها ضغط البخار المشبع لسائل مساويًا للضغط الجوي.
السوائل لها سيولة- القدرة على التحرك تحت تأثير قوى القص الصغيرة ؛ يحتل السائل الحجم الذي يوضع فيه.
تسمى مقاومة السائل للتدفق اللزوجة[با. مع].
التوتر السطحي[J / م 2] - العمل المطلوب لإنشاء وحدة السطح.
حالة الكريستال السائل- المواد في الحالة السائلة ، بدرجة عالية من الترتيب ، تحتل موقعًا وسيطًا بين البلورات والسائل. لديهم سيولة ، لكن في نفس الوقت لديهم ترتيب بعيد المدى. على سبيل المثال - مشتقات حمض البني ، أزوليث ، المنشطات.
درجة حرارة التخليص- درجة الحرارة التي تنتقل عندها البلورات السائلة إلى الحالة السائلة المعتادة.
7.5 جوامد
في الحالة الصلبة ، تكون الجسيمات قريبة جدًا من بعضها البعض بحيث تنشأ روابط قوية بينها ، ولا توجد حركة انتقالية ، ويتم الحفاظ على التذبذبات حول موضعها. يمكن أن تكون المواد الصلبة في الحالة غير المتبلورة والبلورية.
7.5.1 المواد في الحالة غير المتبلورة
في الحالة غير المتبلورة ، لا تحتوي المواد على بنية منظمة.
زجاجيالحالة - حالة صلبة غير متبلورة من مادة ، والتي يتم الحصول عليها نتيجة التبريد الفائق العميق للسائل. هذه الحالة غير متوازنة ، لكن يمكن أن توجد النظارات لفترة طويلة. يحدث تليين الزجاج في نطاق درجة حرارة معينة - نطاق التزجج ، الذي تعتمد حدوده على معدل التبريد. مع زيادة معدل تبريد السائل أو البخار ، تزداد احتمالية الحصول على مادة معينة في حالة زجاجية.
في نهاية الستينيات من القرن العشرين ، تم الحصول على معادن غير متبلورة (زجاج معدني) - لذلك كان من الضروري تبريد المعدن المنصهر بسرعة 10 6-10 8 درجات / ثانية. تتبلور معظم المعادن والسبائك غير المتبلورة عند تسخينها فوق 300 درجة مئوية ، ومن أهم التطبيقات الإلكترونيات الدقيقة (حواجز الانتشار في واجهة أشباه الموصلات المعدنية) وأجهزة التخزين المغناطيسية (رؤوس FMD). هذا الأخير يرجع إلى النعومة المغناطيسية الفريدة (التباين المغناطيسي أقل بمرتين من حيث الحجم من السبائك التقليدية).
مواد غير متبلورة متماثل، بمعنى آخر. لها نفس الخصائص في كل الاتجاهات.
7.5.2 المواد في الحالة البلورية
بلوري صلبالمواد لها بنية مرتبة مع عناصر متكررة ، مما يجعل من الممكن دراستها عن طريق حيود الأشعة السينية (طريقة تحليل حيود الأشعة السينية ، المستخدمة منذ عام 1912.
تتميز البلورات المفردة (مركبات مفردة) بتباين الخواص - اعتماد الخصائص على الاتجاه في الفضاء.
يُصوَّر الترتيب المنتظم للجسيمات في مادة صلبة كشبكة بلورية. المواد البلورية تذوب عند درجة حرارة معينة تسمى نقطة الانصهار.
تتميز البلورات بالطاقة وثابت الشبكة البلورية ورقم التنسيق.
شعرية دائمةيميز المسافة بين مراكز الجسيمات التي تشغل العقد في البلورة في اتجاه المحاور المميزة.
رقم التنسيقعادة ما يسمى عدد الجسيمات المجاورة مباشرة لجسيم معين في بلورة (انظر الشكل 7.2 - التنسيق رقم ثمانية لكل من السيزيوم والكلور)
طاقة الشبكة البلوريةتسمى الطاقة المطلوبة لتدمير مول واحد من البلورة وإزالة الجسيمات التي تتجاوز حدود تفاعلها.

الشكل 7.2 - بنية بلورة CsCl كلوريد السيزيوم (أ) وخلية الوحدة المكعبة المتمركزة في الجسم من هذه البلورة (ب)
7.5.3 الهياكل البلورية
أصغر وحدة هيكلية في البلورة ، والتي تعبر عن جميع خصائص تناظرها ، هي خلية أولية.مع التكرار المتكرر للخلية في ثلاثة أبعاد ، يتم الحصول على شبكة بلورية.
هناك سبع خلايا أساسية: مكعب ، رباعي السطوح ، سداسي ، معيني السطوح ، متعامد السطوح ، أحادي الميل ، وثلاثي الميل. هناك سبعة مشتقات من خلايا الوحدة الأساسية ، على سبيل المثال ، محور الجسم ، مكعب ، متمركز في الوجه.

أ - خلية وحدة من بلور NaCl ؛ ب - تعبئة مكعبة كثيفة مركزة على الوجه من كلوريد الصوديوم ؛ ج - التعبئة المكعبة المتمركزة حول الجسم لبلورة CsCl الشكل 7.3 - خلية الوحدة
المواد المتشابهة- مواد ذات طبيعة كيميائية متشابهة ، وتشكل نفس الهياكل البلورية: CaSiO 4 و MgSiO 4
تعدد الأشكال– المركبات الموجودة في اثنين أو أكثر من الهياكل البلورية ، مثل SiO 2 (مثل الكوارتز السداسي ، ثلاثي الأبعاد المعيني والكريستوباليت المكعب.)
تعديلات متآصلة- تعديلات متعددة الأشكال لمواد بسيطة ، مثل الكربون: الماس ، الجرافيت ، الكاربين ، الفوليرين.
وفقًا لطبيعة الجزيئات الموجودة في عُقد الشبكة البلورية والروابط الكيميائية بينها ، تنقسم البلورات إلى:
1) جزيئي- توجد في العقد جزيئات تعمل قوى فان دير فالس بينها ، والتي لها طاقة منخفضة: بلورات الجليد ؛
2) ذريًا- بلورات تساهمية- توجد في عقد البلورات ذرات تشكل روابط تساهمية قوية مع بعضها البعض ، ولها طاقة شعرية عالية ، على سبيل المثال الماس (الكربون) ؛
3) بلورات أيونية- الوحدات الهيكلية للبلورات من هذا النوع عبارة عن أيونات موجبة وسالبة الشحنة ، يحدث بينها تفاعل كهربائي ، تتميز بطاقة عالية بما فيه الكفاية ، على سبيل المثال ، NaCL ، KCL ؛
4) بلورات معدنية- المواد ذات الموصلية الكهربائية العالية ، والتوصيل الحراري ، والقابلية للطرق ، واللدونة ، والوهج المعدني ، والانعكاسية العالية للضوء ؛ الرابطة في البلورات معدنية ، وطاقة الرابطة المعدنية وسيطة بين طاقات البلورات التساهمية والجزيئية ؛
5) بلورات السندات المختلطة- هناك تفاعلات معقدة بين الجسيمات يمكن وصفها عن طريق تراكب نوعين أو أكثر من الروابط فوق بعضها البعض ، على سبيل المثال ، clathrates (يتم تضمين المركبات) - تتشكل من خلال إدراج الجزيئات (الضيوف) في تجويف a إطار بلوري يتكون من جسيمات من نوع مختلف (مضيفات): غازات clathrates CH4. 6H 2 O ، اليوريا كلثرات.
في الطبيعة ، يوجد الماء في ثلاث حالات:
- الحالة الصلبة (الثلج والبرد والجليد) ؛
- الحالة السائلة (الماء والضباب والندى والمطر) ؛
- الحالة الغازية (البخار).
منذ الطفولة المبكرة ، في المدرسة ، قاموا بدراسة حالات مختلفة من المياه: الضباب ، هطول الأمطار ، البرد ، الثلج ، الجليد ، إلخ. هناك تلك التي تمت دراستها بالتفصيل في المدرسة. يقابلوننا كل يوم في الحياة ويؤثرون في الحياة. - هذه هي حالة الماء عند درجة حرارة وضغط معينين ، والتي تتميز خلال فترة زمنية معينة.
يجب توضيح المفاهيم الأساسية لحالة الماء أن حالة الضباب والحالة الغائمة لا تنطبقان على تكوين الغاز. تظهر أثناء التكثيف. هذه خاصية فريدة للمياه يمكن أن تكون في ثلاث حالات تجميع مختلفة. تعتبر حالات الماء الثلاث حيوية بالنسبة للكوكب ، فهي تشكل دورة هيدرولوجية ، وتضمن عملية دورة المياه في الطبيعة. تظهر المدرسة تجارب مختلفة على التبخر و. في أي ركن من أركان الطبيعة ، يعتبر الماء مصدر الحياة. هناك دولة رابعة لا تقل أهمية - مياه Deryaginskaya (النسخة الروسية) ، أو كما يطلق عليها حاليًا - مياه الأنابيب النانوية (النسخة الأمريكية).
الحالة الصلبة للماء
الشكل والحجم محفوظان. في درجات حرارة منخفضة ، تتجمد المادة وتتحول إلى مادة صلبة. إذا كان الضغط مرتفعًا ، فإن درجة حرارة التصلب مطلوبة أعلى. يمكن أن تكون المواد الصلبة إما متبلورة أو غير متبلورة. في البلورة ، يتم ترتيب موضع الذرة بدقة. أشكال البلورات طبيعية وتشبه متعدد السطوح. في جسم غير متبلور ، يتم تحديد النقاط بشكل عشوائي وتتأرجح ، ولا يتم الاحتفاظ إلا بترتيب قصير المدى فيها.
الحالة السائلة للماء
في الحالة السائلة ، يحتفظ الماء بحجمه ، لكن لا يتم الحفاظ على شكله. من خلال هذا يفهم أن السائل يحتل جزءًا فقط من الحجم ، ويمكن أن يتدفق على السطح بأكمله. عند دراسة قضايا الحالة السائلة في المدرسة ، يجب أن نفهم أن هذه حالة وسيطة بين وسط صلب ووسط غازي. تنقسم السوائل إلى حالات نقية ومخلوطة. بعض الخلطات مهمة جدًا للحياة ، مثل الدم أو ماء البحر. يمكن أن تعمل السوائل كمذيب.
حالة الغاز
لا يتم الاحتفاظ بالشكل والحجم. بطريقة أخرى ، تسمى الحالة الغازية ، التي تتم دراستها في المدرسة ، بخار الماء. تظهر التجارب بوضوح أن البخار غير مرئي ، وهو قابل للذوبان في الهواء ، ويظهر رطوبة نسبية. الذوبان يعتمد على درجة الحرارة والضغط. يعد البخار المشبع ونقطة الندى مؤشراً لأقصى تركيز. البخار والضباب حالات مختلفة للتجميع.
الحالة الرابعة للتجمع هي البلازما
بدأ النظر في دراسة البلازما والتجارب الحديثة بعد ذلك بقليل. البلازما عبارة عن غاز مؤين كليًا أو جزئيًا ، ويحدث في حالة توازن عند درجة حرارة عالية. تحت ظروف الأرض ، يتم تشكيل تصريف غاز. تحدد خصائص البلازما حالتها الغازية ، باستثناء أن الديناميكا الكهربية تلعب دورًا كبيرًا في كل هذا. من بين حالات التجمع ، تعتبر البلازما هي الأكثر شيوعًا في الكون. أظهرت دراسة النجوم والفضاء بين الكواكب أن المواد في حالة البلازما.
كيف تتغير الدول الكلية؟
تغيير عملية الانتقال من دولة إلى أخرى:
- سائل - بخار (تبخر وغليان) ؛
- بخار - سائل (تكثيف) ؛
- جليد سائل (تبلور) ؛
- جليد - سائل (ذوبان) ؛
- الجليد - البخار (التسامي) ؛
- البخار - الجليد ، تكوين الصقيع (إزالة الذوبان).
 يسمى الماء معدنًا أرضيًا طبيعيًا مثيرًا للاهتمام. هذه الأسئلة معقدة ودراسة مستمرة مطلوبة. يتم تأكيد الحالة الإجمالية في المدرسة من خلال التجارب التي تم إجراؤها ، وإذا ظهرت أسئلة ، فمن الواضح أن التجارب تجعل من الممكن فهم المواد التي تم سردها في الدرس. أثناء التبخر ، يمر السائل إلى الداخل ، تكون العملية قادرة على البدء بالفعل من درجة الصفر. مع ارتفاع درجة الحرارة ، تزداد. تم تأكيد شدة ذلك من خلال تجارب الغليان عند 100 درجة. يتم الرد على أسئلة التبخر في حالة التبخر من أسطح البحيرات والأنهار وحتى من اليابسة. عند التبريد ، يتم الحصول على عملية تحول عكسي ، عندما يتكون سائل من غاز. تسمى هذه العملية بالتكثيف ، عندما تتشكل قطرات صغيرة من السحب من بخار الماء في الهواء.
يسمى الماء معدنًا أرضيًا طبيعيًا مثيرًا للاهتمام. هذه الأسئلة معقدة ودراسة مستمرة مطلوبة. يتم تأكيد الحالة الإجمالية في المدرسة من خلال التجارب التي تم إجراؤها ، وإذا ظهرت أسئلة ، فمن الواضح أن التجارب تجعل من الممكن فهم المواد التي تم سردها في الدرس. أثناء التبخر ، يمر السائل إلى الداخل ، تكون العملية قادرة على البدء بالفعل من درجة الصفر. مع ارتفاع درجة الحرارة ، تزداد. تم تأكيد شدة ذلك من خلال تجارب الغليان عند 100 درجة. يتم الرد على أسئلة التبخر في حالة التبخر من أسطح البحيرات والأنهار وحتى من اليابسة. عند التبريد ، يتم الحصول على عملية تحول عكسي ، عندما يتكون سائل من غاز. تسمى هذه العملية بالتكثيف ، عندما تتشكل قطرات صغيرة من السحب من بخار الماء في الهواء.
ومن الأمثلة الصارخة مقياس الحرارة الزئبقي ، حيث يتم تقديم الزئبق في حالة سائلة ، عند درجة حرارة -39 درجة يصبح الزئبق صلبًا. من الممكن تغيير حالة الجسم الصلب ، لكن هذا سيتطلب جهدًا إضافيًا ، على سبيل المثال ، عند ثني الظفر. في كثير من الأحيان ، يسأل الطلاب أسئلة حول كيفية تشكيل الجسم الصلب. يتم ذلك في المصانع والورش المتخصصة باستخدام معدات خاصة. بالتأكيد يمكن أن توجد أي مادة في ثلاث حالات ، بما في ذلك الماء ، فهذا يعتمد على الظروف المادية. عندما يمر الماء من حالة إلى أخرى ، يتغير الترتيب الجزيئي والحركة ، ولا يتغير تكوين الجزيء. ستساعد المهام التجريبية في مراقبة مثل هذه الحالات المثيرة للاهتمام.