Modelo ng isang kemikal na tambalan. Makabagong mataas na teknolohiya
Basahin din
ANNOTASYON
Ang artikulo ay tumatalakay sa mga modelong quantum-kemikal ng mga atomo, mga molekula, na nagbibigay-daan sa pag-unawa sa kakanyahan ng mga pagbabagong kemikal ng bagay sa atomic at molekular na antas ng organisasyon nito.
ABSTRAK
Ang artikulo ay nakatuon sa isang detalyadong pagsasaalang-alang ng mga graphic na quantum-kemikal na modelo ng mga atomo, molekula at mga bono ng kemikal. Ang diskarte na ito ay nagbibigay-daan sa pag-unawa sa likas na katangian ng mga proseso ng kemikal at ang mga batas ng kanilang pagpapatuloy.
Ang mga modernong ideya tungkol sa istruktura ng mga atomo at molekula, ang pag-unawa sa mga pagbabagong kemikal ng bagay sa antas ng atomic at molekular ng organisasyon nito ay ipinahayag ng quantum chemistry.
Mula sa pananaw ng quantum chemistry, ang atom ay isang microsystem na binubuo ng isang nucleus at mga electron na gumagalaw sa electromagnetic field ng nucleus. Sa fig. Ang Figure 1 ay nagpapakita ng mga modelo ng orbital, electronic at electron diffraction ng mga atom ng una at ikalawang yugto, na binuo gamit ang mga prinsipyo at panuntunan ng quantum para sa pagpuno ng mga antas ng enerhiya sa mga atom na may mga electron. Apat na quantum number n, l, m l, MS ganap na nailalarawan ang paggalaw ng mga electron sa larangan ng nucleus. Pangunahing numero ng quantum n nagpapakilala sa enerhiya ng elektron, ang distansya nito mula sa nucleus at tumutugma sa bilang ng antas ng enerhiya kung saan matatagpuan ang elektron. Orbital quantum number l tinutukoy ang hugis ng orbital at ang enerhiya ng mga sublevel ng parehong antas ng enerhiya. Ang konsepto ng "orbital" ay nangangahulugang ang pinaka-malamang na rehiyon ng paggalaw ng isang electron sa isang atom. Magnetic na quantum number m l tinutukoy ang bilang ng mga orbital at ang kanilang spatial na oryentasyon. Pinakamahalaga, ang orbital at magnetic quantum number ay magkakaugnay. Orbital quantum number l kumukuha ng mga halaga ng isang mas mababa kaysa sa pangunahing quantum number n. Kung ang n= 1, pagkatapos l= 0, at sa hugis ito ay spherical 1 s-orbital. Kung ang n= 2, pagkatapos ang orbital quantum number ay tumatagal ng dalawang halaga: l= 0, 1, na nagpapahiwatig ng pagkakaroon ng dalawang sublevel. Ito ay spherical 2 s- orbital ( l= 0) at tatlo 2 p-orbitals na kahawig ng gymnastic dumbbells sa hugis, na matatagpuan sa isang anggulo ng 90 ° kasama ang mga axes ng Cartesian coordinate system.
Figure 1. Quantum-chemical, electronic at electron diffraction mga modelo ng mga atomo ng una at ikalawang yugto
Numero at spatial arrangement 2 p-Tinutukoy ng mga orbital ang magnetic quantum number m l, na kumukuha ng mga halaga sa loob ng orbital quantum number mula sa - l sa + l. Kung ang l= 0, pagkatapos m l= 0 (isa s- orbital). Kung ang l= 1, pagkatapos m l tumatagal ng tatlong halaga - 1 , 0, +1 (tatlo R-orbital).
Ang mga modelo ng orbital ng mga atom ay nagpapakita ng spatial na pag-aayos at hugis ng mga orbital, at sa mga modelo ng electron diffraction sa anyo ng mga simbolikong quantum cell, isang imahe ng mga orbital at ang posisyon ng mga antas at sublevel sa diagram ng enerhiya ay ibinibigay. Bigyang-pansin ang laki ng mga atomo. Ang parehong regularidad ay paulit-ulit sa mga panahon - habang ang singil ng nucleus ay tumataas, ang pagtaas ng deformation (compression) ng mga orbital ay nangyayari sa ilalim ng impluwensya ng electromagnetic attraction ng mga electron sa pamamagitan ng nucleus (Fig. 1).
Ang paglalagay ng mga electron sa mga orbital ay napapailalim sa isa sa pinakamahalagang prinsipyo quantum mechanics(Pauli principle): hindi hihigit sa dalawang electron ang maaaring nasa isang orbital, at dapat silang magkaiba sa kanilang sariling angular momentum - spin (English spin rotation). Ang mga electron na may iba't ibang mga spin ay karaniwang inilalarawan ng mga arrow at ¯. Kapag ang dalawang electron ay nasa parehong orbital, mayroon silang mga antiparallel spins at hindi pinipigilan ang isa't isa mula sa paglipat sa larangan ng nucleus.
Ang ari-arian na ito ay kahawig ng pag-ikot sa meshing ng dalawang gears. Kapag naka-engage, ang isang gear ay umiikot sa clockwise, ang isa pa counterclockwise. Ang ikatlong gear ay nakipag-meshed sa dalawa pang huminto sa pag-ikot. Redundant siya. Kaya sa isang orbital ay maaaring magkaroon lamang ng 2 electron, ang pangatlo ay labis.
Kapag ang mga antas ng enerhiya at mga sublevel ay napuno ng mga electron, prinsipyo ng quantum pinakamababang enerhiya (panuntunan ni Klechkovsky) . Pinupuno ng mga electron ang mga orbital mula sa pinakamababa hanggang sa pinakamataas na antas ng enerhiya. Ang prinsipyo ng pinakamababang enerhiya ay tulad ng pagpuno sa mga sahig mataas na gusali sa panahon ng baha. Tumataas ang tubig at pinupuno ang lahat ng sahig mula sa ibaba pataas, walang nawawala kahit isa.
Ayon sa tuntunin ni Hund, lahat R-Ang mga orbital ay napupuno muna ng isang electron at pagkatapos lamang ng pangalawa na may antiparallel spin.
Ginagawang posible ng mga modelong quantum-chemical ng mga atom na ipaliwanag ang mga katangian ng mga atom upang makipagpalitan ng enerhiya, magbigay at kumuha ng mga electron, baguhin ang geometric na pagsasaayos, at bumuo ng mga bono ng kemikal.
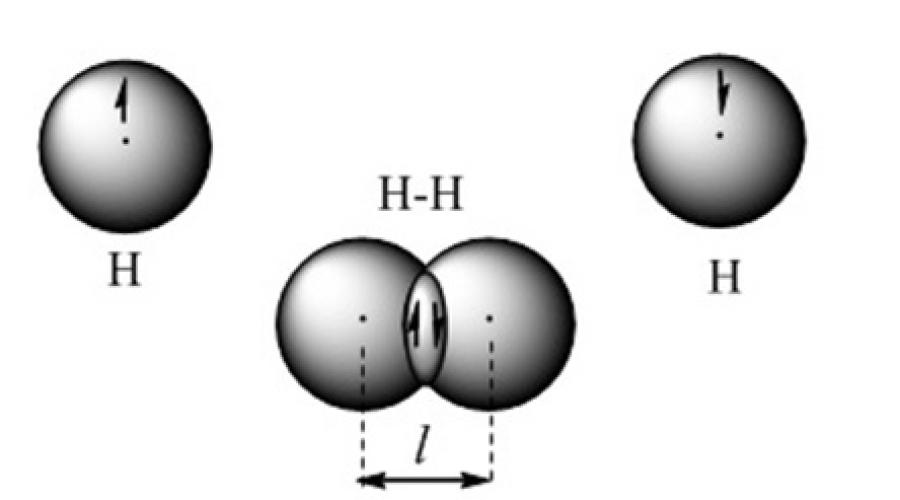
Ang isang covalent chemical bond ay nabuo kapag ang mga valence electron cloud ay nagsasapawan. Halimbawa, ang gayong bono ay kinakatawan sa orbital na modelo ng molekula ng hydrogen (Larawan 2).
/Zakharova.files/image002.jpg)
Figure 2. Modelo ng isang covalent bond sa isang hydrogen molecule
Ang paggamit ng quantum chemical method ng valence bonds ay batay sa ideya na ang bawat pares ng mga atomo sa isang molekula ay pinagsasama-sama ng isa o higit pang mga pares ng electron na may mga antiparallel spins. Mula sa punto ng view ng paraan ng valence bonds, ang isang molekula ay isang microsystem na binubuo ng dalawa o higit pang covalently bonded atoms. Ang positibong sisingilin na nuclei ng mga atom ay hawak ng negatibong singil na nakakonsentra sa rehiyon ng magkakapatong na mga atomic na orbital. Ang pagkahumaling ng nuclei ng mga atomo sa tumaas na densidad ng elektron sa pagitan ng mga ito ay balanse ng puwersa ng pagtanggi ng nuclei sa pagitan nila. Ang isang matatag na microsystem ay nabuo, kung saan ang haba ng covalent bond ay katumbas ng distansya sa pagitan ng nuclei.
Sa molekula ng fluorine, pati na rin sa molekula ng hydrogen, mayroong isang non-polar covalent bond. Overlap 2 R 1 orbitals, ang isang pares ng elektron ay lumilikha ng mas mataas na density ng elektron sa pagitan ng nuclei ng mga atomo at pinapanatili ang molekula sa isang matatag na estado (Larawan 3).
/Zakharova.files/image003.jpg)
Figure 3. Modelo ng isang covalent bond sa isang fluorine molecule
Ang isang non-polar covalent bond ay nangangahulugang tulad ng isang overlap ng valence orbitals, bilang isang resulta kung saan ang mga sentro ng grabidad ng positibo at negatibong mga singil ay nagtutugma.
Posibleng makabuo ng isang polar covalent bond kapag nagsasapawan ng 1 s 1 - at 2 R 1 orbital. Sa fig. Ang 4 ay nagpapakita ng isang modelo ng hydrogen fluoride na may polar covalent bond. Ang densidad ng elektron sa pagitan ng mga covalently bonded na atom ay lumilipat sa fluorine atom, na ang nuclear charge (+9) ay nagbibigay ng mas malaking electromagnetic attraction kumpara sa hydrogen atom nucleus na may charge (+1).
/Zakharova.files/image004.jpg)
Figure 4. Modelo ng isang polar covalent bond sa isang hydrogen fluoride molecule
Ang ionic bonding ay dahil sa pagkahumaling ng mga particle na may kuryente - mga ion. Sa fig. Ang 5 ay nagpapakita ng isang modelo para sa pagbuo ng isang ionic bond sa lithium fluoride. Ang malakas na electromagnetic field na nilikha ng nucleus ng fluorine atom ay kumukuha at kumakapit R-orbital ng isang electron na kabilang sa isang lithium atom. Ang lithium atom, na pinagkaitan ng isang elektron, ay nagbabago ng geometric na pagsasaayos nito (2 s-orbital), nagiging isang positibong sisingilin na ion at naaakit sa isang negatibong sisingilin na fluorine ion, na nakakuha ng dagdag na elektron sa R-orbital.
/Zakharova.files/image005.jpg)
Figure 5. Modelo ng pares ng ion Li + F - lithium fluoride
Ang mga puwersa ng electrostatic attraction ng oppositely charged ions at repulsion ng mga electron shell ng lithium at fluorine ions ay balanse at pinapanatili ang mga ion sa layo na tumutugma sa haba ng ionic bond. Ang orbital overlap sa mga ionically bonded compound ay halos wala.
Ang isang espesyal na uri ng bono ng kemikal ay ipinakita sa mga atomo ng mga metal. Ang isang metal na kristal (Larawan 6) ay binubuo ng mga positibong sisingilin na mga ions, sa larangan kung saan ang mga valence electron ay malayang gumagalaw ("electron cloud").
/Zakharova.files/image006.jpg)
Figure 6. Lithium metal na kristal na modelo
Ang mga ions at ang "electron cloud" ay magkatabi sa isang matatag na estado. Dahil sa mataas na mobility ng mga electron, ang mga metal ay may electronic conductivity.
Sa mga molekula, binabago ng mga atomo na pinag-ugnay ng ilang covalent bond ang kanilang geometric na pagsasaayos. Isaalang-alang ang pagpapakita ng pag-aari na ito sa halimbawa ng isang carbon atom (1 s Ang 2-orbital ay hindi ipinapakita sa mga modelo ng carbon atom, dahil hindi nakikilahok sa pagbuo ng mga bono ng kemikal).
Eksperimento na itinatag na sa molekula ng CH 4, ang carbon atom ay bumubuo ng apat na magkaparehong covalent bond na may mga hydrogen atoms, na katumbas ng kanilang enerhiya at spatial na katangian. Mahirap isipin ang apat na magkaparehong covalent bond, kung ating isaisip na sa carbon ang valence electron ay matatagpuan sa dalawang enerhiya 2 s at 2 p mga sublevel:
/Zakharova.files/image007.jpg)
Sa ground (unexcited) state, ang carbon ay bumubuo lamang ng dalawang covalent bond. Sa nasasabik na estado, isang electron mula sa sublevel 2 s lumilipat sa mas mataas na sublevel 2 ng enerhiya p. Bilang resulta ng naturang electron hopping, ang kabuuang enerhiya ay 2 s- at 2 p-orbitals at ang valency ng carbon atom ay nagbabago sa apat:
/Zakharova.files/image008.jpg)
Ngunit hindi ito sapat upang ipaliwanag ang apat na katumbas na covalent bond sa molekula ng CH 4, dahil 2 s- at 2 p- mayroon ang mga orbital magkaibang hugis at spatial arrangement. Ang problema ay nalutas sa pamamagitan ng pagpapakilala ng hypothesis ng hybridization - ang paghahalo ng mga valence electron sa mga sublevel ng parehong antas ng enerhiya. Mayroong isa 2 sa methane molecule s- at tatlo 2 R-Ang mga orbital ng carbon atom bilang resulta ng hybridization ay nagiging apat na katumbas sp 3-hybrid orbital:
/Zakharova.files/image009.jpg)
Sa kaibahan sa hindi nasasabik (lupa) na estado ng carbon atom, kung saan tatlong 2 R-orbitals ng atom ay matatagpuan sa isang anggulo ng 90 o (Fig. 7, a), sa isang methane molecule (Larawan 7, b) ay katumbas ng hugis at sukat sp 3-hybrid carbon atoms ay matatagpuan sa isang anggulo ng 109 tungkol sa 28 ".
/Zakharova.files/image010.jpg)
Figure 7. Modelo ng methane molecule
Sa ethylene molecule C 2 H 4 (Fig. 8, a) ang mga carbon atom ay nasa sR 2 - hybrid na estado. 2 ay kasangkot sa hybridization s-orbital at dalawa 2 R-mga orbital. Bilang resulta ng hybridization, ang mga carbon atom ay bumubuo ng tatlong katumbas sp 2 -hybrid orbitals na matatagpuan sa isang anggulo ng 120 tungkol sa eroplano; 2 pz-ang orbital ay hindi nakikilahok sa hybridization.
/Zakharova.files/image011.jpg)
Figure 8. Modelo ng ethylene molecule
Sa molekula ng ethylene, ang mga atomo ng carbon ay nakaugnay hindi lamang ng isang s-bond, kundi pati na rin ng isang p-bond. Ito ay nabuo bilang isang resulta ng overlap Rz-orbitals na may pagbuo ng dalawang lugar na magkakapatong sa itaas at ibaba ng axis na nagkokonekta sa nuclei, sa magkabilang panig ng s-bond axis (Fig. 8).
Ang modelo ng triple bond ay ipinakita sa molekula ng acetylene (Larawan 9). Kapag naghahalo ng isa 2 s- at isa 2 p x - dalawang orbital ng isang carbon atom ang nabuo sp-hybrid orbitals, na matatagpuan sa linya na nagkokonekta sa nuclei ng mga atomo (anggulo 180 o). Di-hybrid 2 RU- at 2Rz-orbital ng iba't ibang mga carbon atoms ay nagsasapawan, na bumubuo ng dalawang p-bond sa magkabilang patayo na mga eroplano (Larawan 9).
/Zakharova.files/image012.jpg)
Figure 9. Modelo ng molekula ng acetylene
Ang mga molekula, tulad ng mga atom, ay nagpapakita ng kakayahang masira at bumuo ng mga kemikal na bono, baguhin ang kanilang geometric na pagsasaayos, at lumipat mula sa isang neutral na elektrikal patungo sa isang ionic na estado. Ang mga katangiang ito ay ipinakita sa reaksyon sa pagitan ng mga molekula ng ammonia NH 3 at hydrogen fluoride HF (Larawan 10). Ang covalent bond sa hydrogen fluoride molecule ay nasira, at isang covalent donor-acceptor bond ay nabuo sa pagitan ng nitrogen at hydrogen sa ammonia molecule. Ang donor ay ang nag-iisang pares ng mga electron ng nitrogen atom, ang acceptor ay ang bakanteng orbital ng hydrogen atom (Fig. 10). Ang geometric na configuration ng NH 3 molecule (trigonal pyramid, bond angle 107 o 18") ay nagbabago sa tetrahedral configuration ng NH 4 + ion (109 o 28"). Ang huling proseso ay ang pagbuo ng isang ionic bond sa kristal na istraktura ng ammonium fluoride. Ginagawang posible ng mga orbital na modelo ng mga molekula na ipakita ang lahat ng mga katangian na nakalista sa itaas sa isang reaksyon: pagsira at pagbuo ng mga kemikal na bono, pagbabago ng geometric na pagsasaayos, paglipat mula sa isang neutral na elektrikal patungo sa isang ionic na estado.
/Zakharova.files/image013.jpg)
kanin. 10. Modelo ng pagbuo ng isang pares ng ion ng mala-kristal na NH 4 + F -
Reaksyon ng kemikal gamit ang mga simbolo mga elemento ng kemikal:
NH 3 + HF → NH 4 F,
ay nagbibigay ng pangkalahatang pagpapahayag ng kung ano ang ipinahayag sa mga orbital na modelo ng mga molekula. Ang mga reaksiyong kemikal na kinakatawan ng mga modelo ng orbital at mga simbolo ng mga elemento ng kemikal ay nagpupuno sa isa't isa. Ito ang kanilang merito. Ang pag-master ng elementarya na kaalaman sa quantum-chemical expression ng istraktura at komposisyon ng mga atom at molekula ay humahantong sa pag-unawa sa mga pangunahing konsepto ng kemikal: covalent polar at non-polar bond, donor-acceptor bond, ionic bond, geometric na configuration ng mga atom at molekula, kemikal na reaksyon. At sa pundasyon ng kaalamang ito, may kumpiyansa na magagamit ang simbolismo ng mga elemento ng kemikal at mga compound para sa Maikling Paglalarawan mga estado ng kemikal at pagbabago ng bagay.
Magbigay tayo ng isa pang halimbawa ng isang reaksyon na isinasaalang-alang mula sa pananaw ng quantum chemistry. Ang tubig ay nagpapakita ng mga katangian ng isang mahinang electrolyte. Ang electrolytic dissociation ay karaniwang kinakatawan ng equation:
H 2 O ⇄H + + OH -
H 2 O + H 2 O ⇄H 3 O + + OH -.
Ang paghahati ng mga molekula ng tubig sa positibo at negatibong sisingilin na mga ion ay ipinahayag ng quantum chemical model ng electrolytic dissociation reaction (Larawan 11).
/Zakharova.files/image014.jpg)
Figure 11. Modelo ng electrolytic dissociation ng tubig
Ang molekula ng tubig ay isang distorted pyramid (valence angle 104 o 30 "). sR Ang 3-hybrid orbital ng oxygen atom ay bumubuo ng mga s-bond na may mga hydrogen atoms. Dalawa pa sR Ang 3-hybrid orbital ay may mga libreng pares ng mga electron na may mga antiparallel spins. Ang pagkasira ng covalent H–O bond sa isa sa mga molekula ay humahantong sa pagbuo ng isang covalent chemical bond sa kalapit na molekula ayon sa mekanismo ng donor-acceptor. Ang hydrogen ion, na may bakanteng orbital, ay nagsisilbing acceptor ng electron pair ng oxygen atom ng kalapit na molekula ng tubig. Sa halimbawang ito, tulad ng sa nauna, ginagawang posible ng quantum-chemical approach na maunawaan ang physicochemical na kahulugan ng proseso ng electrolytic dissociation ng tubig.
Ang pag-iisip ay ang proseso kung saan hindi natin direktang mahuhusgahan kung ano ang nakatago sa ating pandama. Ang quantum chemistry ay nagbibigay ng biswal na imahe ng mga proseso ng kemikal at estado ng bagay, ipinapakita kung ano ang nakatago sa ating pandama na pang-unawa, hinihikayat ang pag-aaral at pag-iisip.
Bibliograpiya:
1. Vygotsky L.S. Pag-iisip at pagsasalita. – M.: Labyrinth, 1999. – 352 p.
2. Zagashev I.O., Zair-Bek S.I. Kritikal na pag-iisip: teknolohiya sa pag-unlad. - St. Petersburg: Alliance "Delta", 2003. - 284 p.
3. Krasnov K.S. Mga molekula at kemikal na bono. – M.: graduate School, 1984. - 295 p.
4. Leontiev A.N. Mga Lektura sa Pangkalahatang Sikolohiya. – M.: Kahulugan, 2000. – 512 p.
5. Peregudov F.I., Tarasenko F.P. Panimula sa pag-aanalisa ng systema. - M.: Higher School, 1989. - 367 p.
6. Prokofiev V.F. Tao - isang kinokontrol na biocomputer? // Bulletin ng International Academy of Sciences (Russian section). - 2008. - No. 1. - S. 1-21.
7. Yablokov V.A., Zakharova O.M. Organisasyon ng system ng nilalaman ng pagtuturo ng kimika // Universum: Sikolohiya at edukasyon: elektron. siyentipiko magazine 2016. No. 5(23) / [ Elektronikong mapagkukunan]. - Access mode:
URL://website/ru/psy/archiv/item/2505 (na-access noong 2.04.2017)
1.4.1 Mga modelong kemikal
Bilang karagdagan sa pagmamasid at eksperimento, ang pagmomodelo ay may mahalagang papel sa kaalaman sa natural na mundo at kimika. Ang isa sa mga pangunahing layunin ng pagmamasid ay upang maghanap ng mga pattern sa mga resulta ng mga eksperimento. Gayunpaman, ang ilang mga obserbasyon ay hindi maginhawa o imposibleng direktang magsagawa sa kalikasan. likas na kapaligiran muling likhain sa mga kondisyon ng laboratoryo sa tulong ng mga espesyal na aparato, pag-install, bagay, ibig sabihin, mga modelo. Ang mga modelo ay kinokopya lamang ang pinakamahalagang katangian at katangian ng bagay at tinanggal ang mga hindi mahalaga para sa pag-aaral. Kaya sa kimika, ang mga modelo ay maaaring kondisyon na nahahati sa dalawang grupo: materyal at iconic.
Mga modelo ng kemikal at pang-industriya na kagamitan
Ang mga materyal na modelo ng mga atomo, molekula, kristal, industriya ng kemikal ay ginagamit ng mga chemist para sa higit na kalinawan.
Ang pinakakaraniwang representasyon ng isang atom ay isang modelo na kahawig ng istraktura ng solar system.
Kadalasang ginagamit upang gawing modelo ang mga molekula ng mga sangkap. bola-at-patpat mga modelo. Ang mga modelo ng ganitong uri ay binuo mula sa mga may kulay na bola na kumakatawan sa mga atomo na bumubuo sa molekula. Ang mga bola ay konektado sa pamamagitan ng mga baras, na sumisimbolo sa mga bono ng kemikal. Sa tulong ng mga ball-and-stick na modelo, ang mga anggulo ng bono sa isang molekula ay medyo tumpak na ginawa, ngunit ang mga internuclear na distansya ay makikita lamang ng humigit-kumulang, dahil ang mga haba ng mga rod na nagkokonekta sa mga bola ay hindi proporsyonal sa mga haba ng bono.
Dredding na mga modelo medyo tumpak na ihatid ang mga anggulo ng bono at ang ratio ng mga haba ng bono sa mga molekula. Ang nuclei ng mga atomo sa kanila, sa kaibahan sa mga modelo ng ball-and-rod, ay itinalaga hindi ng mga bola, ngunit sa pamamagitan ng mga punto ng pagkonekta ng mga rod.
hemispherical na mga modelo, tinatawag ding Stewart-Brigleb na mga modelo, ay binuo mula sa mga bola na may mga hiwa na segment. Ang mga modelo ng mga atom ay magkakaugnay sa pamamagitan ng mga slice plane gamit ang mga pindutan. Ang mga hemispherical na modelo ay tumpak na naghahatid ng parehong ratio ng mga haba ng bono at mga anggulo ng bono at ang pagpuno ng internuclear space sa mga molekula. Gayunpaman, hindi palaging pinapayagan ng occupancy na ito ang isa na makakuha ng visual na representasyon ng Kaugnay na posisyon nuclei.
Ang mga modelo ng mga kristal ay kahawig ng mga ball-and-stick na modelo ng mga molekula, gayunpaman, hindi nila inilalarawan ang mga indibidwal na molekula ng isang sangkap, ngunit nagpapakita ng magkaparehong pag-aayos ng mga particle ng isang sangkap sa isang mala-kristal na estado.
Gayunpaman, mas madalas ang mga chemist ay hindi gumagamit ng materyal, ngunit iconic na mga modelo - ito ay mga simbolo ng kemikal, mga formula ng kemikal, mga equation mga reaksiyong kemikal. Gamit ang mga simbolo ng mga elemento at indeks ng kemikal, isinulat ang mga formula ng mga sangkap. Ipinapakita ng index kung gaano karaming mga atom ng isang partikular na elemento ang kasama sa molekula ng isang sangkap. Ito ay nakasulat sa kanan ng tanda ng elemento ng kemikal.
Ang formula ng kemikal ay ang pangunahing iconic na modelo sa kimika. Ito ay nagpapakita ng: isang tiyak na sangkap; isang butil ng sangkap na ito; husay na komposisyon mga sangkap, ibig sabihin, ang mga atomo kung saan ang mga elemento ay bahagi ng sangkap na ito; quantitative composition, ibig sabihin, kung gaano karaming mga atomo ng bawat elemento ang bahagi ng molekula ng sangkap.
Ang lahat ng mga modelo sa itaas ay malawakang ginagamit sa paggawa interactive na mga modelo ng computer.
1.4.2 Pag-uuri ng mga modelo ng computer
Kabilang sa iba't ibang uri ng pedagogical software, ang mga gumagamit ng mga modelo ng computer ay na-highlight. Ang paggamit ng mga modelo ng computer ay nagbibigay-daan hindi lamang upang madagdagan ang kakayahang makita ng proseso ng pag-aaral at patindihin ito, ngunit pati na rin sa radikal na baguhin ang prosesong ito. AT mga nakaraang taon ang mga computer ay mabilis na umuunlad, at ang kanilang mga kakayahan sa pagmomodelo ay naging halos walang limitasyon, kaya ang kahalagahan ng mga modelo ng kompyuter sa pag-aaral ng mga disiplina sa paaralan ay maaaring tumaas nang malaki. E.E. Nifantiev, A.K. Akhlebinin, V.N. Tandaan ni Likhachev na ang pangunahing bentahe ng mga modelo ng computer ay ang posibilidad ng pagmomodelo ng halos anumang mga proseso at phenomena, interactive na pakikipag-ugnayan ng user sa modelo, pati na rin ang pagpapatupad ng problemado, mga diskarte sa pananaliksik sa proseso ng pag-aaral.
Iminumungkahi ni V. N. Likhachev na pag-uri-uriin ang mga modelo ng pang-edukasyon na computer ayon sa isang bilang ng mga pamantayan, ang mga pangunahing ay ang pagkakaroon ng animation kapag ipinapakita ang modelo, ang paraan ng kontrol, ang paraan ng visual na pagpapakita ng modelo. Sa pagkakaroon ng animation, maaaring maging dynamic at static ang UKM. Ang mga dynamic ay naglalaman ng mga fragment ng animation para sa pagpapakita ng mga simulate na bagay at proseso; wala ang mga ito sa mga static. Ayon sa paraan ng kontrol, ang RCM ay maaaring pamahalaan, na nagpapahintulot sa iyo na baguhin ang mga parameter ng modelo, at hindi pinamamahalaan, na hindi nagbibigay ng ganoong pagkakataon.

Sa mga demonstration (unmanaged) na mga modelo, dalawa pang grupo ang maaaring makilala ayon sa posibilidad ng pakikipag-ugnayan sa user: interactive at non-interactive. Pinapayagan ka ng mga interactive na baguhin ang uri ng pagpapakita ng modelo o ang punto ng pagmamasid sa modelo nang hindi binabago ang mga parameter nito. Ang hindi interactive na mga ganitong pagkakataon ay hindi nagbibigay.
E.E. Nifantiev, A.K. Akhlebinin at V.N. Ang Likhachev ay itinuturing na pinaka-kapaki-pakinabang mula sa isang metodolohikal na pananaw pag-uuri ayon sa object ng pagmomodelo. Ayon sa antas ng mga kinakatawan na bagay, ang mga modelong ginamit sa pagtuturo ng kimika ay maaaring hatiin sa dalawang grupo : mga modelo ng macroworld, na sumasalamin sa mga panlabas na katangian ng mga kunwa na bagay at ang kanilang pagbabago at mga modelo ng microworld, na sumasalamin sa istruktura ng mga bagay at ang mga pagbabagong nagaganap sa kanila sa antas ng kanilang atomic at molekular na representasyon. At ang mga modelo ng mga bagay tulad ng mga kemikal, mga reaksiyong kemikal at mga prosesong physico-kemikal ay maaaring malikha kapwa sa antas ng microworld at sa antas ng macrocosm.

Ang pag-uuri ng UKM ay maaaring ipakita sa anyo ng isang diagram para sa higit na kalinawan.
1.4.3 Mga modelo ng computer ng microworld
Ang mga bagay para sa pagmomodelo sa antas ng microcosm ay mga atomo, ion, molekula, kristal na sala-sala, mga elemento ng istruktura ng mga atomo. Sa antas ng microcosm, ang mga tampok ng istraktura ng bagay, ang pakikipag-ugnayan ng mga particle na bumubuo sa bagay ay na-modelo. Para sa pagmomodelo ng mga reaksiyong kemikal sa antas ng microworld, ang mga mekanismo ng mga proseso ng kemikal ay may malaking interes. At sa mga modelo ng pisikal at kemikal na proseso, ang mga prosesong nagaganap sa antas ng elektroniko o atomic-molecular ay isinasaalang-alang.
Malinaw na ang mga CCM na tinutulad ang mga modelo ng microworld ay nagiging mahusay na mga katulong sa pag-aaral ng istruktura ng mga atomo, mga uri ng mga bono ng kemikal, ang istraktura ng bagay, atbp.
Ang mga modelo ng mga atomo 1 - 3 mga panahon ng periodic table ng Mendeleev ay ipinatupad sa programa " 1C: Tutor. Chemistry» sa anyo ng mga modelo ng Bohr ng atom. Ang mas modernong mga ideya tungkol sa istraktura ng atom ay ipinatupad sa programa chemland, kung saan ang distribusyon ng mga electron sa mga sublevel ng enerhiya ng mga atom ng mga elemento at ang anyo ng mga indibidwal na orbital sa iba't ibang antas ng enerhiya ay isinasaalang-alang.
Ang partikular na interes ay ang programa HyperChem. Ito ay isa sa mga pangunahing propesyonal na programa para sa teoretikal na pagkalkula ng iba't ibang thermodynamic at electronic na mga parameter ng mga molekula. Sa tulong nito, posible na bumuo ng mga spatial na modelo ng iba't ibang mga compound, pag-aralan ang mga tampok ng kanilang geometric na istraktura, matukoy ang hugis at enerhiya ng mga molecular orbital, ang likas na katangian ng pamamahagi ng density ng elektron, dipole moment, atbp. Ang lahat ng data ng output ay na ibinigay sa anyo ng mga guhit ng kulay, na maaaring pagkatapos ay i-print sa printer, pagkuha ng isang mataas na kalidad na imahe ng mga kemikal na compound sa mga kinakailangang anggulo at projection. Ang bentahe ng programa ay ang kakayahang isaalang-alang ang isang molekula na may iba't ibang partido upang maging pamilyar sa mga tampok ng spatial na istraktura nito. Ito ay tila napakahalaga, dahil, tulad ng ipinapakita ng kasanayan sa pagtuturo, ang mga mag-aaral ay karaniwang hindi bumubuo ng mga ideya tungkol sa mga molekula bilang spatial na istruktura. Ang tradisyonal na imahe ng mga kemikal sa isang eroplano ay humahantong sa pagkawala ng buong dimensyon at hindi pinasisigla ang pagbuo ng spatial na imahinasyon.
Sa kursong multimedia Chemistry para sa lahat» Ginagamit ang isang programa - isang stereo demonstrator ng mga molekula. Pinapayagan ka nitong magbigay ng mga volumetric na larawan ng mga molekula na binubuo ng mga atomo ng hydrogen, oxygen, carbon at nitrogen. Para sa pagpapakita, ginagamit ang mga modelo ng wireframe ng mga molekula. Ang mga modelo ay maaaring ilipat, paikutin, magpakita ng mga larawan ng ilang magkakaibang molekula nang sabay-sabay. Ang programa ay nagpapahintulot sa iyo na lumikha ng mga bagong modelo ng mga molekula sa iyong sarili. Sa kabuuan, ang mga modelo ng 25 na organikong molekula ay ibinibigay, gayunpaman, ang didactic na halaga ng mga modelong ito ay mababa, dahil may sapat na mga modelong ibinigay. mga simpleng koneksyon, na maaaring kolektahin ng bawat mag-aaral gamit ang plasticine at posporo.
Ang pagpapakita ng orbital-vane 3D na mga modelo ng ilang mga molekula ay ipinatupad sa programa " Ang paraan ng valence bonds: hybridization ng atomic orbitals. At sa programa Ang likas na katangian ng bono ng kemikal» nagpapaliwanag ng mga sanhi ng paglitaw ng isang kemikal na bono gamit ang halimbawa ng pagbuo ng isang molekula ng hydrogen mula sa mga atomo. Ang parehong mga programang ito ay kasama sa hanay ng mga programa sa pagsasanay " Chemistry para sa Lahat - 2000».
Mga interactive na demo wireframe na ginagamit sa mga programa ChemLand- 115 molekula ng karamihan sa mga organikong compound, at " Chemistry para sa lahat". Ang dalawang programang ito ay may kanilang mga kalamangan at kahinaan: sa Chemistry for All program, ang mga modelo ay maaaring ipakita sa buong screen ng monitor, habang sa ChemLand program ay walang ganoong function, gayunpaman, ang programa ay naglalaman ng isang malaking bilang ng mga molekula. Sa ChemLand ginagamit ang mga dynamic na modelo na nagpapakita ng spatial na istraktura ng mga molekula na may kakayahang sukatin ang mga anggulo ng bono at mga haba ng bono, na nagpapahintulot sa amin na masubaybayan ang pagbabago sa polarity ng isang tatsulok na molekula depende sa uri ng mga atomo.
Kapag pinag-aaralan ang istruktura ng mga molekula at kristal, maaaring maging kapaki-pakinabang ang mga programang idinisenyo nang higit pa para sa mga layunin ng pananaliksik. Ito ay, halimbawa, isang programa CS Chem3D Pro, na nagpapahintulot sa iyo na lumikha, baguhin at ipakita ang tatlong-dimensional na istraktura ng iba't ibang mga molekula. Kapaki-pakinabang din na programa Crystal Designer, na idinisenyo upang mailarawan ang tatlong-dimensional na istraktura ng kristal na sala-sala. Ang mga programang ito ay maaaring maging kapaki-pakinabang para sa paglikha ng mga three-dimensional na larawan ng mga molekula at kristal at para sa pagpapakita ng mga ito sa silid-aralan gamit ang isang computer.
Programa " tipunin ang molekula”, kahit na mas mababa sa mga kakayahan nito sa mga programa sa itaas, ay maaaring epektibong magamit sa indibidwal na gawain ng mga mag-aaral.
Ang mga modelo ng pisikal at kemikal na proseso at mekanismo ay ipinatupad sa programa " Chemistry para sa lahat". Ang mga non-interactive na modelo sa paksang "Electrolytic dissociation" ay ipinakita dito: dissociation ng mga asing-gamot, acids, alkalis, hydrolysis ng mga asin. Sa parehong programa, ang ilang mga modelo ng mga mekanismo ng organic na reaksyon ay ipinatupad: alkane bromination, esterification, ang pangkalahatang mekanismo ng mga reaksyon ng polymerization, atbp. Ang lahat ng mga modelo ng mga mekanismo ng reaksyon ay hindi interactive, ipinapakita sa isang buong screen, may tunog, ngunit walang tekstong paglalarawan ng mga nagaganap na phenomena, na makabuluhang naglilimita sa paggamit ng programa.
Sa online na bersyon ng interactive na aklat-aralin para sa sekondaryang paaralan sa organikong kimika para sa mga baitang X - XI, na-edit ni G. I. Deryabina, A. V. Solovov ang exchange at donor-acceptor na mekanismo ng covalent bond formation, homolytic at heterolytic na mekanismo ng covalent bond cleavage ay ipinakita sa halimbawa ng hydrogen atom abstraction mula sa methane molecule, sp-hybridization na proseso. Malaking interes ang mga interactive na 3D demonstration models ng mga organic molecule at mekanismo ng mga kemikal na reaksyon: methane chlorination at ang pangkalahatang mekanismo ng nucleophilic substitution. Napakahalaga na kapag nagtatrabaho sa mga modelo, maaari mong baguhin ang kanilang posisyon sa espasyo, at para sa mekanismo ng reaksyon, maaari mong baguhin ang posisyon ng punto ng pagmamasid.
Ang isa pang programa na nagpapakita ng mga mekanismo ng mga reaksiyong kemikal, ang programa Mga Organic Reaction Animation. Naglalaman ito ng 34 na mekanismo ng mga organikong reaksyon. Bukod dito, ang bawat mekanismo ay ipinakita sa anyo ng apat na variant ng mga molecular models: ball-and-stick, three-dimensional at dalawang variant ng orbital-vane models. Ang isa sa mga variant ng mga modelo ng orbital-blade ay nagpapakita ng pagbabago sa mga panlabas na orbital ng substrate sa kurso ng reaksyon, at ang isa pa sa reactant. Ginagawa nitong mas madaling pagmasdan ang pagbabago sa mga panlabas na orbital ng mga reactant sa panahon ng reaksyon. Kung kinakailangan, maaari mong gamitin ang teoretikal na materyal ng interactive na multi-channel cognition tool. Pag-unlad sariling estudyante...
Pagsusuri sa kompyuter
Mga Pagsusulit >> Informatics... mga pamamaraan ... nag-aaral panitikan... pag-unlad mga pagsubok at pagsubok. Ang teknolohiya ng computerized testing ay dapat magkaroon ng mga sumusunod na pangunahing katangian: interactive ... mga microworld); ... (paaralan ... sila paggamit sa ... mga modelo / Pagtuturo sa halaga ng palitan ...
Pilosopiya at pamamaraan ng agham
Gabay sa Pag-aaral >> PilosopiyaSa larangan ng biology sa nag-aaral co-evolution ng iba't ibang uri ng hayop, sila mga istruktura at antas ng organisasyon... at itinatag. Paggamit Ang mga pamamaraan ay lumalaban sa mga panlabas na paghihigpit na ipinataw sa mga parameter ng pag-aaral. Mga modelo pagpapatupad...
Mga aktibidad sa lipunan at kultura (2)
Teksbuk >> Sosyolohiya... sila pag-aaral, konserbasyon, produksyon, pag-unlad, gamitin at bilang kinahinatnan, pag-unlad ... . Sa nag-aaral kurso, ... microworld ... mga modelo at pagtatapos modelo ... interactive pedagogical na pamamaraan at teknolohiya. Kabilang sa mga ito ay pribado paraan... preschool, paaralan (...
Ipadala ang iyong mabuting gawa sa base ng kaalaman ay simple. Gamitin ang form sa ibaba
Ang mga mag-aaral, nagtapos na mga estudyante, mga batang siyentipiko na gumagamit ng base ng kaalaman sa kanilang pag-aaral at trabaho ay lubos na magpapasalamat sa iyo.
Wala pang HTML na bersyon ng trabaho.
Maaari mong i-download ang archive ng trabaho sa pamamagitan ng pag-click sa link sa ibaba.
Mga Katulad na Dokumento
Homologous na serye ng methane. Ang istraktura ng methane molecule. Anggulo sa pagitan ng lahat ng mga link. Mga Katangiang Pisikal alkanes. Mga pamamaraan sa laboratoryo ng pagkuha. Pagkuha mula sa mga asin mga carboxylic acid. Uri ng hybridization ng carbon atoms sa alkanes. Structural isomerism ng alkanes.
pagtatanghal, idinagdag noong 10/08/2014
Elektronikong modelo ng isang molekula. Ang teorya ng pagtanggi ng mga pares ng elektron ng shell ng valence. Reaktibiti ng mga molekula. Pag-uuri ng mga reaksiyong kemikal. Mga antas ng kalayaan ng isang molekula, ang kanilang rotary motion. Paglalarawan ng simetrya ng mga oscillation, ang kanilang pakikipag-ugnayan.
pagtatanghal, idinagdag noong 10/15/2013
Mga katangian ng istraktura ng atom. Pagpapasiya ng bilang ng mga proton, electron, neutron. Isinasaalang-alang ang bono ng kemikal at polarity ng molekula sa kabuuan. Dissociation equation at dissociation constants para sa mahinang electrolytes. Mga reaksyon ng redox.
pagsubok, idinagdag noong 11/09/2015
Ang istraktura ng molekula, ang mga bono ng mga atomo at ang mga katangian ng acetylenes bilang mga kemikal na sangkap. Mga kakaibang katangian ng pagkuha ng mga alkynes sa pamamagitan ng thermolysis ng methane at hydrogenation ng carbon sa industriya at pag-aalis ng reaksyon sa laboratoryo. Mga reaksyon ng alkynes na kinasasangkutan ng triple bond.
control work, idinagdag noong 08/05/2013
Pangunahing probisyon teoryang klasiko kemikal na istraktura ng molekula. Mga katangian na tumutukoy sa reaktibiti nito. Homologous rad ng alkanes. Nomenclature at isometry ng hydrocarbons. Pag-uuri ng mga organikong compound na naglalaman ng oxygen.
pagtatanghal, idinagdag noong 01/25/2017
Ang elementong kemikal ay isang koleksyon ng mga atomo ng parehong uri. Pagtuklas ng mga elemento ng kemikal. Mga sukat ng mga atomo at molekula. Mga anyo ng pagkakaroon ng mga elemento ng kemikal. Ilang impormasyon tungkol sa molecular at non-molecular na istraktura ng mga substance. Atomic-molecular na doktrina.
pagtatanghal, idinagdag noong 04/15/2012
Ang pangkalahatang pagkakasunud-sunod para sa pagkalkula ng elektronikong istraktura ng isang molekula gamit ang pamamaraang MO LCAO. Ang simpleng paraan ng Hückel. Mga halimbawa mga istrukturang molekular para sa pamamaraang MOX. Alyl sa paraan ng MOX. Pangkaraniwang katangian elektronikong pamamahagi sa Hückel hydrocarbon system.
Pisikal at kemikal na modelo ng mga proseso sa anode microdischarge
V.F. Borbat, O.A. Golovanova, A.M. Sizikov, Omsk Pambansang Unibersidad, Kagawaran ng Inorganic Chemistry
Ang mga layer ng oxide na nabuo sa mga anod na gawa sa aluminyo, titanium, tantalum at ilang iba pang mga metal sa panahon ng pagpasa agos ng kuryente sa pagitan ng mga electrodes na nahuhulog sa electrolyte, sa ilang mga kaso ay may mataas na proteksiyon at dielectric na mga katangian. Sa kasalukuyan, ang mga laboratoryo sa iba't ibang mga bansa ay nagsasagawa ng isang malaking halaga ng pananaliksik na naglalayong magtatag ng mga pagkakataon para sa pagpapabuti ng proteksiyon at elektrikal na mga katangian ng anode coatings, paghahanap para sa pinakamainam na komposisyon ng electrolyte, pagpapabuti ng proseso ng paggawa, at iba pa. Ang praktikal na karanasang naipon kamakailan sa paggamit ng plasma-electrolytic anode treatment upang lumikha ng mga protective coatings ay higit na nalampasan ang mga teoretikal na konsepto na magagamit sa lugar na ito.
Batay sa panitikan at aming pang-eksperimentong data, maaari kaming tumanggap ng isang pisikal na modelo ng isang anode microdischarge, ang pangunahing ideya kung saan ang isang anode microdischarge ay isang kumbinasyon ng isang spark breakdown ng barrier na bahagi ng oxide film at isang gas. discharge sa gas-plasma bubble na lumitaw pagkatapos ng pagkasira. Isaalang-alang ang sulat ng iminungkahing modelo pang-eksperimentong resulta isinasaalang-alang ang pagkakasunud-sunod ng mga proseso.
Oksihenasyon. Sa panahon ng oksihenasyon (sa isang pare-parehong boltahe sa mga electrodes), ang mga layer hanggang sa daan-daang microns ang kapal ay nabuo. Kasabay ng pagbuo ng mga bagong layer ng oxide, nagaganap din ang proseso ng kanilang pagkatunaw. Ang isang bilang ng mga pag-aaral ay nagpakita na sa pre-spark na panahon ng paglago ng oxide film, ang mga electrolyte anion, tulad ng mga sulfate ions, ay kasama sa dami ng oxide. Sa mga porous na pelikula, lumilitaw ang mga anion sa anodic oxide dahil sa mekanikal na "pag-embed" ng mga bahagi ng solusyon. Ang nilalaman ng mga anion na kasama sa oksido ay tinutukoy ng kanilang kakayahang ma-adsorbed sa ibabaw ng sediment o kahit na bumuo ng mga compound ng nonstoichiometric na komposisyon.
Kapag pinag-aaralan ang phase at elemental na komposisyon ng mga coatings na nakuha ng plasma-electrolytic treatment, natagpuan na sa pamamaraang ito ng pagkuha ng mga coatings, ang mga sulfate ions ay ipinakilala sa pelikula. Bukod dito, ang uri ng mga registerogram ay nagbibigay ng mga batayan upang ipagpalagay na ang "kita" ng mga bahagi ng electrolyte ay nangyayari sa mga lugar kung saan nagaganap ang mga anodic microdischarge sa oras ng kanilang "pagpapagaling", samakatuwid, ang pamamahagi ng mga bahagi ng electrolyte sa ibabaw ng pelikula ay hindi pare-pareho at naiiba. mula sa pamamahagi sa mga pelikulang nakuha sa pamamagitan ng conventional anodizing.
Ang breakdown ay isang kumplikadong probabilistic na proseso na maaaring mangyari sa isang partikular na punto sa isang dielectric sa isang medyo malawak na hanay ng mga boltahe at oras. Ang pinakamahalagang proseso para sa simula ng pagkasira ay isang pagbabago sa singil sa espasyo malapit sa cathode (electrolyte solution) at isang pagtaas sa dami ng iniksyon ng mga electron sa conduction band ng dielectric film. Ang mga prosesong ito ay nakakatulong sa pagbuo ng pagkasira. Ang simula ng pagkasira ay nauugnay sa pagbuo ng mga pag-avalanch ng elektron. Malamang na ang mga antas ng karumihan sa oksido ay maaaring pagmulan ng mga pangunahing ion. Ang ganitong mekanismo ay nagmumungkahi ng isang espesyal na papel para sa mga bahagi ng electrolyte na ipinakilala sa oksido, pangunahin ang mga anion. Iyon ang dahilan kung bakit ang posibilidad ng pagkuha ng anodic spark coatings ay higit na tinutukoy ng komposisyon ng solusyon. Ang mga electron na pumapasok sa conduction band at pinabilis ng field ay nakakakuha ng sapat na enerhiya upang maging sanhi ng epekto ng ionization ng mga atomo sa oxide. Ang huli ay humahantong sa paglitaw ng mga avalanches, na, na umaabot sa ibabaw ng metal, ay bumubuo ng mga channel ng pagkasira. Pag-iral linear dependence Ang pagkakaiba sa pagitan ng breakdown boltahe at ang kapal ay nagpapahiwatig ng pagkakapareho ng field sa panahon ng pagkasira at ang elektrikal na katangian ng pagkasira.
Ang pagkasira ng oxide film - kapag nalantad sa anodic microdischarges sa mga solusyon sa sulfuric acid, ang pagkilos ng pinabilis electric field ang mga electron ay malalantad sa mga molekula ng tubig at sulfuric acid. Ang data sa ionization ng mga solusyong ito ay makukuha sa panitikan. Batay sa kanila, ang pinaka-malamang na mga ion sa plasma ng mga microdischarge ay malamang na mga ion na may pinakamababang potensyal na hitsura, i.e. Dapat asahan ang H2O+ para sa mga molekula ng tubig, H2SO4+ para sa sulfuric acid, at mas malamang na HSO4+.
Kaya, ang mga proseso ng ionization at dissociative attachment ng mga electron ay nagbibigay ng mga sumusunod na ion sa ilalim ng pagkilos ng mga microdischarge sa mga solusyon sa sulfuric acid (mga reaksyon 1-5). e + H2O H2O+ + 2e (1), e + H2SO4 H2SO4+ + 2e (2), o HSO4 + H+ + 2e (3), e + H2O OH + H- (4), e + H2SO4 H + HSO4- (5).
Ang mga positibo at negatibong ion na nabuo ng mga reaksyong ito ay may dalawang magkaibang paraan ng kanilang mga pagbabago: 1) neutralisasyon ng mga singil; 2) mga reaksyon ng ion-molecular. Ang mga radikal na nabuo bilang isang resulta ng paghihiwalay ng mga nasasabik na particle at sa pamamagitan ng mga reaksyon ng ion-molecular ay pumapasok sa mga reaksyon ng abstraction ng H atom mula sa mga molekula sa bubble ng gas at sa reaksyon ng recombination.
Matapos ang pagbuo ng mga radical, ang mga reaksyon ng abstraction ng H atom ay nagaganap: H(OH, HSO4) + H2SO4 H2(H2O, H2SO4) + HSO4 (6), H(HSO3) + H2O H2(H2SO3) + OH (7) at ang mga reaksyon ng recombination ng mga radical : HSO4 + OH H2SO4 (8), HSO4 + HSO4 H2S2O8 (9), OH + OH H2O2 (10), H + HSO4 H2SO4 (11).
Ang pagbuo ng sulfur dioxide ay posible bilang resulta ng interaksyon ng mga molekula ng sulfuric acid na nasasabik ng microdischarge plasma sa mga kalapit na molekula: H2SO4* + H2SO4 H2SO3 + H2SO5 (12), o posible rin ang mekanismo: H2SO4* H2SO3 + O (13). Ang nabuo na H2SO3 at H2SO5 dahil sa mataas na temperatura sa zone ng mga microdischarge ay thermally dissociate ayon sa mga equation:
H2SO3 H2O + SO2 (14), 2H2SO5 2H2SO4 + 0.5 O2 (15).
Ang ilan sa mga radical ay lumampas sa microdischarge gas bubble sa likidong nakapalibot dito, kung saan sila ay pumapasok sa recombination reactions sa isa't isa at tumutugon sa mga bahagi ng electrolyte. Ang ani ng mga produkto bilang resulta ng mga prosesong nagaganap sa malapit-bubble layer ng electrolyte ay depende sa konsentrasyon ng sulfuric acid (i.e., sa proporsyon ng mga ion na naroroon sa mga solusyon ng sulfuric acid ng iba't ibang konsentrasyon).
Ayon sa iminungkahing mekanismo ng mga pagbabagong kemikal ng sulfuric acid, na may pagtaas sa konsentrasyon nito sa isang solusyon, kung hindi man, na may pagtaas sa konsentrasyon nito sa isang microdischarge gas bubble, isang pagtaas sa bilang ng direktang ionized at nasasabik ng electron impact sulfuric magaganap ang mga molekula ng acid. Dahil, dahil sa mababang ionization sa mga electron energies na karaniwan para sa isang paglabas ng gas, ang mga pagbabagong kemikal ng mga sangkap ay isinasagawa pangunahin sa pamamagitan ng mga nasasabik na estado, kung gayon sa kaso ng pagkakalantad sa mga microdischarge na may pagtaas sa konsentrasyon ng sulfuric acid, dapat asahan ng isang tao ang pagtaas sa ani ng mga produkto kung saan ang mga nasasabik na particle ay ang pasimula.
Sa pagtaas ng konsentrasyon ng sulfuric acid (higit sa 14M), ang proporsyon ng mga molekula ng sulfuric acid sa bula ng gas-plasma ay tumataas, ayon sa pagkakabanggit, ang agnas ng natunaw na sangkap ay nangyayari dahil sa direktang aksyon mga microdischarge ng plasma. Para sa mga solusyon ng sulfuric acid na mas mababa sa 14 M, ang conversion ng solute ay nangyayari pangunahin dahil sa pagkilos ng plasma sa solvent - isang hindi direktang aksyon. Pinatataas nito ang posibilidad ng mga reaksyon 9,10,11,13 na humahantong sa pagbuo ng matatag mga produktong molekular: mga compound ng sulfur dioxide at peroxide.
"Pagpapagaling" ng butas ng butas - ang karagdagang pagpapalawak ng pagbuo ng plasma sa halip ay mabilis na humahantong sa isang makabuluhang pagbaba sa temperatura ng huli at, bilang kinahinatnan, sa isang pagbawas sa konsentrasyon ng mga carrier ng discharge, kasalukuyang pagkagambala at mabilis na paglamig ng channel . Ang paglaho ng bula ng gas-plasma ay magaganap pagkatapos mapatay ang paglabas ng gas dito. Ito ay kilala na ang gas discharge ay papatayin kapag ang kasalukuyang density nito ay bumaba sa ibaba ng minimum na pinahihintulutang halaga para sa self-sustaining ng discharge. Sa kaso ng mga microdischarge, ang mga dahilan para sa pagbaba sa kasalukuyang density ng isang paglabas ng gas ay maaaring: 1) pag-ubos ng malapit-bubble layer ng electrolyte na may kasalukuyang mga carrier sa paglipas ng panahon, dahil sa kung saan ang electrolyte ay nagiging hindi makapagbigay ng pinahihintulutan ang pinakamababang kasalukuyang density para sa self-sustaining ng discharge, at ang paglabas ng gas ay namatay; 2) isang pagtaas sa laki ng microdischarge bubble dahil sa pagsingaw ng likidong nakapalibot dito; 3) pagtunaw o "pagpapagaling" (sa pamamagitan ng anodizing sa gas plasma) ng breakdown channel sa barrier na bahagi ng oxide film. Ang bunganga na nabuo sa unang pagkasira ay karaniwang umaabot sa ibabaw ng metal. Sa puntong ito, ang kasalukuyang density ay nagiging maximum dahil sa medyo mababang paglaban ng electrolyte sa bunganga, na nagsisiguro mabilis na hitsura oxide film (isang produkto ng plasma-chemical reaction na MexOy). Mayroong isang "pagpapagaling" ng breakdown site, ang kapal ng oxide film ay tumataas, at higit sa lahat sa lalim ng materyal na substrate.
Kaya, batay sa mga resulta ng data ng eksperimento at panitikan, ang mekanismo ng epekto ng anode microdischarge sa mga solusyon sa sulfuric acid ay iminungkahi, na kinabibilangan ng mga sumusunod na yugto:
Ang pagbuo ng nasasabik at ionized na mga molekula sa microdischarge bubble dahil sa paglabas ng gas na dumadaloy dito;
Ang kurso ng mga reaksyon sa pagbuo ng mga radical at molekular na produkto, ang mga reaksyon kung saan sa bawat isa at sa mga panimulang materyales ay nagbibigay ng karamihan sa mga huling produkto;
Pag-alis ng pagsasabog ng mga nagresultang radical at iba pang mga particle sa labas ng bula ng gas, ang mga reaksyon nito ay humahantong sa mga panghuling produkto ng molekular sa malapit-bubble layer ng electrolyte.
Bibliograpiya
Bakovets V.V., Polyakov O.V., Dolgovesova I.P. Plasma-electrolytic anode na paggamot ng mga metal // Novosibirsk: Nauka, 1991. P.63-68.
Nagatant T.,Yashinara S.T. Mga pag-aaral sa pamamahagi ng fragment ion at ang kanilang reaksyon sa pamamagitan ng isang charge spectrometer // J. Bull. chem. soc. Jap., 1973. V.46. 5. P.1450-1454.
Mann M., Hastrulid A., Tate J. Ionization at dissociation ng water vapor at ammonia sa pamamagitan ng electron impact // J. Phys. Sinabi ni Rev. 1980. V.58. P.340-347.
Ivanov Yu.A., Polak L.S. Pamamahagi ng enerhiya ng mga electron sa mababang temperatura na plasma // Plasma Chemistry, Moscow: Atomizdat, 1975. Isyu. 2. C.161-198.
Para sa paghahanda ng gawaing ito, ginamit ang mga materyales mula sa site na http://www.omsu.omskreg.ru/.