Reações de apego. Tipos de reações químicas em química orgânica Divisão de substituintes no anel benzênico em dois tipos
Leia também
) ligações de outro composto químico. A adesão pode ser realizada como uma conexão carbono-carbono, e por comunicação heteroátomo de carbono. As reações de adição são indicadas por letras em inglês "De Anúncios".
Visão geral das reações de adição por ligação carbono-carbono:
Visão geral das reações de adição por ligação carbono-oxigênio:
Normalmente, o reagente ao qual ocorre a adição é chamado de substrato, e o outro ( "X-Y") - reagente de ataque.
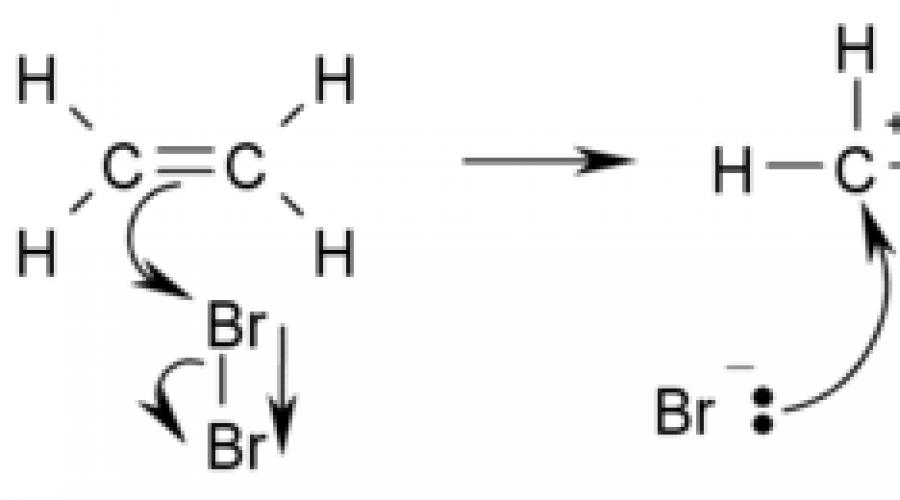
Um exemplo de uma reação de adição é a bromação de etileno:

As reações de adição são muitas vezes reversíveis, emparelhadas com reações de eliminação, portanto, deve-se ter em mente que o mecanismo para essa reação de adição-eliminação "emparelhada" é comum.
Dependendo da natureza da partícula atacante e do mecanismo de reação, é feita uma distinção entre adição nucleofílica, eletrofílica, radical ou síncrona.
Reações de adição nucleofílica
Nas reações de adição nucleofílica, a partícula atacante é o nucleófilo, ou seja, uma partícula carregada negativamente ou uma partícula com um par de elétrons livre.
Visão geral das reações de adição nucleofílica:
As reações de adição nucleofílica são indicadas "AdN".
Reações de adição nucleofílica em uma ligação C=C são bastante raros, o valor mais difundido e prático é conexão por conexão C=O :
Entre as reações de adição nucleofílica, a mais comum é o mecanismo bimolecular de dois estágios acima Anúncio N 2: No início, o nucleófilo adiciona lentamente uma ligação múltipla para formar um carbânion, que na segunda etapa é rapidamente atacado por uma espécie eletrofílica.
Reações de adição eletrofílica
Nas reações de adição eletrofílica, a partícula atacante é eletrófilo, isto é, uma partícula carregada positivamente, na maioria das vezes um próton H+, ou uma partícula deficiente em elétrons.
Visão geral das reações de adição eletrofílica:
As reações de adição eletrofílica são indicadas "Anúncio e".
As reações de adição eletrofílica são comuns entre as reações de hidrocarbonetos insaturados: alcenos, alcinos e dienos.
Um exemplo de tais reações é a hidratação de alcenos:
Ligação eletrofílica heteroátomo de carbono também é bastante comum, e na maioria das vezes essa conexão é C=O:



Entre as reações de adição eletrofílica, a mais comum é o mecanismo bimolecular de dois estágios acima Anúncio E 2: No início, o eletrófilo adiciona lentamente uma ligação múltipla para formar um carbocátion, que sofre ataque nucleofílico na segunda etapa.
Reações de adição de radicais
Nas reações de adição de radicais, os radicais livres são as espécies atacantes.
As reações de adição de radicais são indicadas "Anúncio R".
As reações de adição de radicais geralmente ocorrem em vez de reações de adição eletrofílica na presença de uma fonte de radicais livres:

Reações de adição síncrona
Em alguns casos, a adição por ligação múltipla ocorre com o ataque simultâneo de ambos os átomos, o que não permite determinar a prioridade do ataque. Tal mecanismo é chamado conexão síncrona. As reações de adição síncronas levam à formação de produtos cíclicos, por isso são frequentemente chamadas de cicloadição.
Notas
| Reações químicas em química orgânica | |
|---|---|
| Reações de substituição | Reações de substituição nucleofílica Reações de substituição eletrofílica Reações de substituição radical |
| Reações de adição | Reações de adição nucleofílica Reações de adição eletrofílica Reações de adição radical Reações de adição simultânea |
| Reações de eliminação | Reações de eliminação heterolítica Reações de eliminação pericíclica Reações de eliminação radical |
| reações de rearranjo | Rearranjos Nucleofílicos Rearranjos Eletrofílicos Rearranjos Radicais |
| Reações de oxidação e redução | Reações de oxidação Reações de redução |
| Outro | Reações nominais em química orgânica |
Fundação Wikimedia. 2010.
Veja o que são "reações de adição" em outros dicionários:
polímero de reação de adição- - Polímero de adição EN Um polímero formado pela adição em cadeia de moléculas de monômeros insaturados, como olefinas, entre si sem a formação de um subproduto, como água;… … Manual do Tradutor Técnico
- (reação eletrofílica de adição em inglês) reações de adição, nas quais o ataque no estágio inicial é realizado por uma partícula eletrófila, carregada positivamente ou com déficit de elétrons. Na fase final, o resultado ... ... Wikipedia
- (reação nucleofílica de adição em inglês) reações de adição em que o ataque no estágio inicial é realizado por uma partícula nucleófila, carregada negativamente ou com um par de elétrons livre. Na fase final, o resultado ... ... Wikipedia
- (eng. reação radical de adição) reações de adição em que o ataque é realizado por radicais livres de uma partícula contendo um ou mais elétrons desemparelhados. Ao mesmo tempo, os radicais podem atacar outros radicais e ... ... Wikipedia
Reações de adição em que ambos os átomos de uma ligação múltipla são atacados simultaneamente. Outro nome para reações desse tipo é reações de cicloadição, uma vez que os produtos finais de tais reações são substratos cíclicos. Existem dois ... ... Wikipédia
- (reação de substituição nucleofílica inglesa) reações de substituição em que o ataque é realizado por um reagente nucleófilo carregando um par de elétrons não compartilhado. O grupo de saída em reações de substituição nucleofílica é chamado de nucleófugo. Todos... Wikipédia
As reações de substâncias orgânicas podem ser formalmente divididas em quatro tipos principais: substituição, adição, eliminação (eliminação) e rearranjo (isomerização). Obviamente, toda a variedade de reações de compostos orgânicos não pode ser reduzida à classificação proposta (por exemplo, reações de combustão). No entanto, essa classificação ajudará a estabelecer analogias com as reações já familiares a você que ocorrem entre substâncias inorgânicas.
Como regra, o principal composto orgânico envolvido na reação é chamado de substrato, e o outro componente da reação é condicionalmente considerado como reagente.
Reações de substituição
Reações de substituição- são reações que resultam na substituição de um átomo ou grupo de átomos na molécula original (substrato) por outros átomos ou grupos de átomos.
As reações de substituição envolvem compostos saturados e aromáticos, como alcanos, cicloalcanos ou arenos. Vamos dar exemplos de tais reações.
Sob a ação da luz, os átomos de hidrogênio em uma molécula de metano podem ser substituídos por átomos de halogênio, por exemplo, por átomos de cloro:
Outro exemplo de substituição de hidrogênio por halogênio é a conversão de benzeno em bromobenzeno:

A equação para esta reação pode ser escrita de forma diferente:
![]()
Com esta forma de registro, os reagentes, catalisadores e condições de reação são escritos acima da seta e os produtos inorgânicos da reação abaixo dela.
Como resultado de reações substituições em substâncias orgânicas são formadas não simples e complexas substâncias, como na química inorgânica, e duas substâncias complexas.
Reações de adição
Reações de adição são reações em que duas ou mais moléculas de reagentes se combinam em uma.
Compostos insaturados, como alcenos ou alcinos, entram em reações de adição. Dependendo de qual molécula atua como reagente, são distinguidas as reações de hidrogenação (ou redução), halogenação, hidrohalogenação, hidratação e outras reações de adição. Cada um deles requer certas condições.
1. Hidrogenação- a reação de adicionar uma molécula de hidrogênio a uma ligação múltipla:
2. Hidrohalogenação- reação de adição de haleto de hidrogênio (cloridrato):
3. Halogenação- reação de adição de halogênio:
![]()
4.Polimerização- um tipo especial de reações de adição, durante as quais as moléculas de uma substância com um peso molecular pequeno são combinadas umas com as outras para formar moléculas de uma substância com um peso molecular muito alto - macromoléculas.
As reações de polimerização são os processos de combinação de muitas moléculas de uma substância de baixo peso molecular (monômero) em grandes moléculas (macromoléculas) de um polímero.
Um exemplo de reação de polimerização é a produção de polietileno a partir de etileno (eteno) sob a ação da radiação ultravioleta e um iniciador de polimerização radicalar R.
A ligação covalente mais característica dos compostos orgânicos é formada quando os orbitais atômicos se sobrepõem e a formação de pares de elétrons comuns. Como resultado disso, um orbital comum a dois átomos é formado, no qual um par de elétrons comum está localizado. Quando a ligação é quebrada, o destino desses elétrons comuns pode ser diferente.
Tipos de partículas reativas
Um orbital com um elétron desemparelhado pertencente a um átomo pode se sobrepor a um orbital de outro átomo que também contém um elétron desemparelhado. Neste caso, a formação de uma ligação covalente ocorre de acordo com o mecanismo de troca:
O mecanismo de troca para a formação de uma ligação covalente é realizado se um par de elétrons comum for formado a partir de elétrons desemparelhados pertencentes a átomos diferentes.
O processo oposto à formação de uma ligação covalente pelo mecanismo de troca é a quebra de ligação, na qual um elétron () vai para cada átomo. Como resultado, duas partículas não carregadas com elétrons desemparelhados são formadas:
![]()
Essas partículas são chamadas de radicais livres.
radicais livres- átomos ou grupos de átomos com elétrons desemparelhados.
Reações de radicais livres são reações que ocorrem sob a ação e com a participação de radicais livres.
No curso da química inorgânica, são reações de interação de hidrogênio com oxigênio, halogênios, reações de combustão. Reações deste tipo são caracterizadas por alta velocidade, liberação de uma grande quantidade de calor.
Uma ligação covalente também pode ser formada pelo mecanismo doador-aceitador. Um dos orbitais de um átomo (ou ânion), que contém um par de elétrons não compartilhado, se sobrepõe a um orbital não preenchido de outro átomo (ou cátion) que possui um orbital não preenchido, e uma ligação covalente é formada, por exemplo:
![]()
A quebra de uma ligação covalente leva à formação de partículas carregadas positiva e negativamente (); uma vez que, neste caso, ambos os elétrons de um par de elétrons comum permanecem com um dos átomos, o outro átomo recebe um orbital não preenchido:
![]()
Considere a dissociação eletrolítica de ácidos:
![]()
Pode-se facilmente adivinhar que uma partícula com um par de elétrons não compartilhado R: -, ou seja, um íon carregado negativamente, será atraída por átomos carregados positivamente ou por átomos nos quais há pelo menos uma carga positiva parcial ou efetiva.
Partículas com pares de elétrons não compartilhados são chamadas de agentes nucleofílicos (núcleo- "núcleo", a parte carregada positivamente do átomo), ou seja, os "amigos" do núcleo, uma carga positiva.
Nucleófilos(Não) - ânions ou moléculas que possuem um par solitário de elétrons, interagindo com as regiões das moléculas, nas quais se concentra a carga positiva efetiva.
Exemplos de nucleófilos: Cl - (íon cloreto), OH - (ânion hidróxido), CH 3 O - (ânion metóxido), CH 3 COO - (ânion acetato).
As partículas que possuem um orbital não preenchido, ao contrário, tenderão a preenchê-lo e, portanto, serão atraídas para as regiões das moléculas que possuem uma densidade eletrônica aumentada, uma carga negativa e um par de elétrons não compartilhado. Eles são eletrófilos, "amigos" de um elétron, uma carga negativa ou partículas com uma densidade eletrônica aumentada.
eletrófilos- cátions ou moléculas que possuem um orbital de elétrons não preenchido, tendendo a preenchê-lo com elétrons, pois isso leva a uma configuração eletrônica do átomo mais favorável.
Nem toda partícula é um eletrófilo com um orbital vazio. Assim, por exemplo, os cátions de metais alcalinos têm a configuração de gases inertes e não tendem a adquirir elétrons, pois possuem um baixo afinidade eletrônica.
A partir disso, podemos concluir que, apesar da presença de um orbital não preenchido, tais partículas não serão eletrófilos.
Principais mecanismos de reação
Existem três tipos principais de partículas reagentes - radicais livres, eletrófilos, nucleófilos - e três tipos correspondentes de mecanismo de reação:
- radical livre;
- eletrofílico;
- nulofilo.
Além de classificar as reações de acordo com o tipo de partículas reagentes, a química orgânica distingue quatro tipos de reações de acordo com o princípio de alterar a composição das moléculas: adição, substituição, eliminação ou eliminação (do inglês. para eliminar- excluir, dividir) e reagrupar. Como a adição e a substituição podem ocorrer sob a ação de todos os três tipos de espécies reativas, vários formar-semecanismos de reação.


Além disso, considere as reações de clivagem ou eliminação que ocorrem sob a influência de partículas nucleofílicas - bases.
6. Eliminação:
Uma característica distintiva dos alcenos (hidrocarbonetos insaturados) é a capacidade de entrar em reações de adição. A maioria dessas reações ocorre pelo mecanismo de adição eletrofílica.
Hidrohalogenação (adição de halogênio hidrogênio):
Quando um haleto de hidrogênio é adicionado a um alceno hidrogênio é adicionado a mais hidrogenado átomo de carbono, ou seja, o átomo no qual há mais átomos hidrogênio e halogênio - para menos hidrogenado.
Propriedades químicas dos alcanos
Alcanos (parafinas) são hidrocarbonetos não cíclicos, nas moléculas das quais todos os átomos de carbono estão conectados apenas por ligações simples. Em outras palavras, não há ligações múltiplas, duplas ou triplas nas moléculas dos alcanos. De fato, os alcanos são hidrocarbonetos que contêm o número máximo possível de átomos de hidrogênio e, portanto, são chamados de limitantes (saturados).
Devido à saturação, os alcanos não podem entrar em reações de adição.
Como os átomos de carbono e hidrogênio têm eletronegatividade bastante próxima, isso leva ao fato de que as ligações CH em suas moléculas são de polaridade extremamente baixa. A este respeito, para os alcanos, as reações que ocorrem de acordo com o mecanismo de substituição radical, denotada pelo símbolo S R, são mais características.
1. Reações de substituição
Em reações desse tipo, as ligações carbono-hidrogênio são quebradas.
RH + XY → RX + HY
Halogenação
Os alcanos reagem com halogênios (cloro e bromo) sob a ação da luz ultravioleta ou com forte calor. Neste caso, é formada uma mistura de derivados de halogênio com diferentes graus de substituição de átomos de hidrogênio - mono-, di-tri-, etc. alcanos substituídos por halogênio.
No exemplo do metano, fica assim:
Ao alterar a razão halogênio/metano na mistura de reação, é possível garantir que qualquer derivado de halogênio metano particular predomine na composição dos produtos.
mecanismo de reação
Vamos analisar o mecanismo da reação de substituição de radicais livres usando o exemplo da interação de metano e cloro. É composto de três etapas:
- iniciação (ou iniciação da cadeia) - o processo de formação de radicais livres sob a ação da energia do exterior - irradiação com luz UV ou aquecimento. Nesta fase, a molécula de cloro sofre uma clivagem homolítica da ligação Cl-Cl com a formação de radicais livres:
Os radicais livres, como pode ser visto na figura acima, são chamados de átomos ou grupos de átomos com um ou mais elétrons desemparelhados (Cl, H, CH 3 , CH 2, etc.);
2. Desenvolvimento da cadeia
Esta etapa consiste na interação de radicais livres ativos com moléculas inativas. Neste caso, novos radicais são formados. Em particular, quando os radicais de cloro agem sobre as moléculas de alcano, um radical alquil e cloreto de hidrogênio são formados. Por sua vez, o radical alquila, colidindo com as moléculas de cloro, forma um derivado de cloro e um novo radical de cloro:
3) Quebra (morte) da corrente:
Ocorre como resultado da recombinação de dois radicais entre si em moléculas inativas:
2. Reações de oxidação
Em condições normais, os alcanos são inertes em relação a agentes oxidantes fortes como ácidos sulfúrico e nítrico concentrados, permanganato e dicromato de potássio (KMnO 4, K 2 Cr 2 O 7).
Combustão em oxigênio
A) combustão completa com excesso de oxigênio. Leva à formação de dióxido de carbono e água:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
B) combustão incompleta com falta de oxigênio:
2CH 4 + 3O 2 \u003d 2CO + 4H 2 O
CH 4 + O 2 \u003d C + 2H 2 O
Oxidação catalítica com oxigênio
Como resultado do aquecimento de alcanos com oxigênio (~200 o C) na presença de catalisadores, uma grande variedade de produtos orgânicos pode ser obtida a partir deles: aldeídos, cetonas, álcoois, ácidos carboxílicos.
Por exemplo, o metano, dependendo da natureza do catalisador, pode ser oxidado em álcool metílico, formaldeído ou ácido fórmico:
3. Transformações térmicas de alcanos
Rachaduras
O craqueamento (do inglês crack - to tear) é um processo químico que ocorre em alta temperatura, como resultado do qual o esqueleto de carbono das moléculas de alcano se rompe com a formação de moléculas de alcano e alcano com pesos moleculares mais baixos em comparação com os alcanos originais. Por exemplo:
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH 2 -CH 2 -CH 3 + CH 3 -CH \u003d CH 2
O craqueamento pode ser térmico ou catalítico. Para a implementação do craqueamento catalítico, devido ao uso de catalisadores, são utilizadas temperaturas significativamente mais baixas em relação ao craqueamento térmico.
Desidrogenação
A eliminação do hidrogênio ocorre como resultado da quebra das ligações C-H; realizado na presença de catalisadores a temperaturas elevadas. A desidrogenação do metano produz acetileno:
2CH 4 → C 2 H 2 + 3H 2
O aquecimento do metano a 1200 ° C leva à sua decomposição em substâncias simples:
CH 4 → C + 2H 2
A desidrogenação de outros alcanos dá alcenos:
C 2 H 6 → C 2 H 4 + H 2
Ao desidrogenar n-butano, buteno-1 e buteno-2 são formados (este último na forma cis- e transe-isômeros):
Desidrociclização
Isomerização
Propriedades químicas dos cicloalcanos
As propriedades químicas dos cicloalcanos com mais de quatro átomos de carbono nos ciclos são geralmente quase idênticas às dos alcanos. Para o ciclopropano e o ciclobutano, curiosamente, as reações de adição são características. Isso se deve à alta tensão dentro do ciclo, o que leva ao fato de que esses ciclos tendem a se romper. Assim, o ciclopropano e o ciclobutano adicionam facilmente bromo, hidrogênio ou cloreto de hidrogênio:
Propriedades químicas dos alcenos
1. Reações de adição
Como a ligação dupla nas moléculas de alceno consiste em uma ligação sigma forte e uma ligação pi fraca, elas são compostos bastante ativos que entram facilmente em reações de adição. Os alcenos frequentemente entram em tais reações mesmo sob condições brandas - no frio, em soluções aquosas e solventes orgânicos.
Hidrogenação de alcenos
Os alcenos são capazes de adicionar hidrogênio na presença de catalisadores (platina, paládio, níquel):
CH 3 -CH \u003d CH 2 + H 2 → CH 3 -CH 2 -CH 3
A hidrogenação de alcenos ocorre facilmente mesmo em pressão normal e leve aquecimento. Um fato interessante é que os mesmos catalisadores podem ser usados para a desidrogenação de alcanos a alcenos, apenas o processo de desidrogenação ocorre a uma temperatura mais alta e pressão mais baixa.
Halogenação
Os alcenos entram facilmente em uma reação de adição com bromo tanto em solução aquosa quanto em solventes orgânicos. Como resultado da interação, soluções inicialmente amarelas de bromo perdem sua cor, ou seja, descolorir.
CH 2 \u003d CH 2 + Br 2 → CH 2 Br-CH 2 Br
Hidrohalogenação
É fácil ver que a adição de um haleto de hidrogênio a uma molécula de alceno assimétrica deveria teoricamente levar a uma mistura de dois isômeros. Por exemplo, quando o brometo de hidrogênio é adicionado ao propeno, os seguintes produtos devem ser obtidos:
No entanto, na ausência de condições específicas (por exemplo, a presença de peróxidos na mistura de reação), a adição de uma molécula de haleto de hidrogênio ocorrerá estritamente seletivamente de acordo com a regra de Markovnikov:
A adição de um haleto de hidrogênio a um alceno ocorre de tal forma que o hidrogênio é ligado a um átomo de carbono com um grande número de átomos de hidrogênio (mais hidrogenados), e um halogênio é ligado a um átomo de carbono com um número menor de átomos de hidrogênio. (menos hidrogenado).
Hidratação
Esta reação leva à formação de álcoois e também prossegue de acordo com a regra de Markovnikov:
Como você pode imaginar, devido ao fato de que a adição de água à molécula de alceno ocorre de acordo com a regra de Markovnikov, a formação de álcool primário só é possível no caso de hidratação de etileno:
CH 2 \u003d CH 2 + H 2 O → CH 3 -CH 2 -OH
É por essa reação que a maior quantidade de álcool etílico é realizada na indústria de grande porte.
Polimerização
Um caso específico da reação de adição é a reação de polimerização, que, diferentemente da halogenação, hidrohalogenação e hidratação, ocorre através de um mecanismo de radicais livres:
Reações de oxidação
Como todos os outros hidrocarbonetos, os alcenos queimam facilmente em oxigênio para formar dióxido de carbono e água. A equação para a combustão de alcenos em excesso de oxigênio tem a forma:
C n H 2n + (3/2) nO 2 → nCO 2 + nH 2 O
Ao contrário dos alcanos, os alcenos são facilmente oxidados. Sob a ação de uma solução aquosa de KMnO 4 em alcenos, descoloração, que é uma reação qualitativa para ligações CC duplas e triplas em moléculas de substâncias orgânicas.
A oxidação de alcenos com permanganato de potássio em solução neutra ou levemente alcalina leva à formação de dióis (álcoois di-hídricos):
C 2 H 4 + 2KMnO 4 + 2H 2 O → CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH (resfriamento)
Em um ambiente ácido, ocorre uma clivagem completa da ligação dupla com a transformação dos átomos de carbono que formaram a ligação dupla em grupos carboxila:
5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (aquecimento)
Se a ligação dupla C=C está no final da molécula de alceno, então o dióxido de carbono é formado como o produto de oxidação do átomo de carbono extremo na ligação dupla. Isso se deve ao fato de que o produto intermediário da oxidação, o ácido fórmico, é facilmente oxidado por si mesmo em excesso de um agente oxidante:
5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2O (aquecimento)
Na oxidação de alcenos, em que o átomo de C na ligação dupla contém dois substituintes de hidrocarbonetos, forma-se uma cetona. Por exemplo, a oxidação do 2-metilbuteno-2 produz acetona e ácido acético.
A oxidação dos alcenos, que quebra o esqueleto de carbono na ligação dupla, é usada para estabelecer sua estrutura.
Propriedades químicas dos alcadienos
Reações de adição
Por exemplo, a adição de halogênios:
A água de bromo torna-se incolor.
Em condições normais, a adição de átomos de halogênio ocorre nas extremidades da molécula de butadieno-1,3, enquanto as ligações π são quebradas, os átomos de bromo são ligados aos átomos de carbono extremos e as valências livres formam uma nova ligação π. Assim, como se houvesse um "movimento" da dupla ligação. Com um excesso de bromo, mais uma molécula de bromo pode ser adicionada no local da dupla ligação formada.
reações de polimerização
Propriedades químicas dos alcinos
Os alcinos são hidrocarbonetos insaturados (insaturados) e, portanto, são capazes de entrar em reações de adição. Entre as reações de adição para alcinos, a adição eletrofílica é a mais comum.
Halogenação
Como a ligação tripla das moléculas de alcino consiste em uma ligação sigma mais forte e duas ligações pi mais fracas, elas são capazes de ligar uma ou duas moléculas de halogênio. A adição de duas moléculas de halogênio por uma molécula de alcino ocorre pelo mecanismo eletrofílico sequencialmente em duas etapas:
Hidrohalogenação
A adição de moléculas de haleto de hidrogênio também ocorre pelo mecanismo eletrofílico e em duas etapas. Em ambos os estágios, a adição procede de acordo com a regra de Markovnikov:
Hidratação
A adição de água aos alcinos ocorre na presença de sais de rutio em meio ácido e é chamada de reação de Kucherov.
Como resultado da hidratação da adição de água ao acetileno, o acetaldeído (aldeído acético) é formado:
Para homólogos de acetileno, a adição de água leva à formação de cetonas:
Hidrogenação de alcino
Os alcinos reagem com o hidrogênio em duas etapas. Metais como platina, paládio, níquel são usados como catalisadores:
Trimerização de alcino
Quando o acetileno é passado sobre o carvão ativado em alta temperatura, uma mistura de vários produtos é formada a partir dele, sendo o principal o benzeno, um produto da trimerização do acetileno:
Dimerização de alcinos
O acetileno também entra em uma reação de dimerização. O processo prossegue na presença de sais de cobre como catalisadores:
Oxidação de alcino
Alcinos queimam em oxigênio:
C n H 2n-2 + (3n-1) / 2 O 2 → nCO 2 + (n-1) H 2 O
A interação de alcinos com bases
Alcinos com um triplo C≡C no final da molécula, ao contrário de outros alcinos, são capazes de entrar em reações nas quais o átomo de hidrogênio na ligação tripla é substituído por um metal. Por exemplo, o acetileno reage com amida de sódio em amônia líquida:
HC≡CH + 2NaNH 2 → NaC≡CNa + 2NH 3,
e também com uma solução de amônia de óxido de prata, formando substâncias salinas insolúveis chamadas acetilenos:
Graças a essa reação, é possível reconhecer alcinos com uma ligação tripla terminal, bem como isolar tal alcino de uma mistura com outros alcinos.
Deve-se notar que todos os acetilenos de prata e cobre são substâncias explosivas.
Acetilídeos são capazes de reagir com derivados de halogênio, que são usados na síntese de compostos orgânicos mais complexos com uma ligação tripla:
CH 3 -C≡CH + NaNH 2 → CH 3 -C≡CNa + NH 3
CH 3 -C≡CNa + CH 3 Br → CH 3 -C≡C-CH 3 + NaBr
Propriedades químicas de hidrocarbonetos aromáticos
A natureza aromática da ligação afeta as propriedades químicas de benzenos e outros hidrocarbonetos aromáticos.
Um único sistema de elétrons de 6pi é muito mais estável do que as ligações pi convencionais. Portanto, para hidrocarbonetos aromáticos, as reações de substituição são mais características do que as reações de adição. Os arenos entram em reações de substituição por um mecanismo eletrofílico.
Reações de substituição
Halogenação
Nitração
A reação de nitração ocorre melhor sob a ação do ácido nítrico não puro, mas de sua mistura com ácido sulfúrico concentrado, a chamada mistura de nitração:
Alquilação
A reação na qual um dos átomos de hidrogênio no núcleo aromático é substituído por um radical hidrocarboneto:
Alcenos também podem ser usados em vez de alcanos halogenados. Haletos de alumínio, haletos de ferro férrico ou ácidos inorgânicos podem ser usados como catalisadores.<
Reações de adição
hidrogenação
Adesão de cloro
Procede por um mecanismo radical sob intensa irradiação com luz ultravioleta:
Da mesma forma, a reação pode ocorrer apenas com cloro.
Reações de oxidação
Combustão
2C 6 H 6 + 15O 2 \u003d 12CO 2 + 6H 2 O + Q
oxidação incompleta
O anel benzênico é resistente a agentes oxidantes como KMnO 4 e K 2 Cr 2 O 7 . A reação não vai.
Divisão de substituintes no anel benzênico em dois tipos:
Considere as propriedades químicas de homólogos de benzeno usando tolueno como exemplo.
Propriedades químicas do tolueno
Halogenação
A molécula de tolueno pode ser considerada como constituída por fragmentos de moléculas de benzeno e metano. Portanto, é lógico supor que as propriedades químicas do tolueno devem, em certa medida, combinar as propriedades químicas dessas duas substâncias tomadas separadamente. Em particular, isso é precisamente o que é observado durante sua halogenação. Já sabemos que o benzeno entra em uma reação de substituição com o cloro por um mecanismo eletrofílico, e catalisadores (haletos de alumínio ou ferro férrico) devem ser usados para realizar essa reação. Ao mesmo tempo, o metano também é capaz de reagir com o cloro, mas por um mecanismo de radicais livres, que requer a irradiação da mistura inicial da reação com luz UV. O tolueno, dependendo das condições em que sofre cloração, é capaz de fornecer produtos de substituição de átomos de hidrogênio no anel de benzeno - para isso, você precisa usar as mesmas condições da cloração de benzeno ou produtos de substituição de átomos de hidrogênio em o radical metil, se nele, como agir no metano com cloro quando irradiado com radiação ultravioleta:
Como você pode ver, a cloração do tolueno na presença de cloreto de alumínio levou a dois produtos diferentes - orto e para-clorotolueno. Isso se deve ao fato de o radical metil ser um substituinte do primeiro tipo.
Se a cloração do tolueno na presença de AlCl 3 for realizada em excesso de cloro, a formação de tolueno substituído com tricloro é possível:
Da mesma forma, quando o tolueno é clorado à luz em uma razão cloro/tolueno mais alta, diclorometilbenzeno ou triclorometilbenzeno podem ser obtidos:
Nitração
A substituição de átomos de hidrogênio por nitrogrupo, durante a nitração do tolueno com uma mistura de ácidos nítrico e sulfúrico concentrados, leva a produtos de substituição no núcleo aromático, e não no radical metila:
Alquilação
Como já mencionado, o radical metil é um orientante do primeiro tipo, portanto, sua alquilação de Friedel-Crafts leva a produtos de substituição nas posições orto e para:
Reações de adição
O tolueno pode ser hidrogenado a metilciclohexano usando catalisadores metálicos (Pt, Pd, Ni):
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
oxidação incompleta
Sob a ação de um agente oxidante como uma solução aquosa de permanganato de potássio, a cadeia lateral sofre oxidação. O núcleo aromático não pode ser oxidado em tais condições. Neste caso, dependendo do pH da solução, será formado um ácido carboxílico ou seu sal.
; neste caso, uma ligação p é quebrada e uma ou duas ligações s são formadas. Para indicar conexão reações use o símbolo Ad (da adição em inglês - juntando-se); para p-ções de cicloadição, tal símbolo não é usado.
dependendo da natureza substrato distinguir as conexões reações em isolados ou acoplados ligações múltiplas, por exemplo: C=C, C=C, C=C-C=C, C=O, C=N, C=N. Distinga p-ção homolítica. (Ad R) e heterolítico. acessos. Este último dependendo da carga do atacante reagente subdividido em r-tion elektrof. (Ad E) e nucleófo. (AdN)adições. Comportamento reagente depende do tipo substrato e as condições para a realização da distribuição (distribuição, presença catalisador, o efeito da irradiação UV, etc.). Mn. reagentes em diferentes condições podem mostrar diferentes. tipos de reações. habilidades, ex. halogênios pode atuar como radical, elektrof. e até mesmo o nucleófo. agentes.
Naib. acessos estudados reações sobre ligações múltiplas carbono-carbono. Esses processos prosseguem de acordo com um mecanismo passo a passo (por etapas) ou síncrono (coordenado). Com um mecanismo passo a passo, o primeiro estágio é o ataque do nucleófilo, eletrófilo ou livre. radical, o segundo - recombinação resultante intermediário positivo negativo ou uma partícula neutra, por exemplo:
Eletrof. ou nucleof. partículas não precisam ser íons; eles podem representar uma parte (grupo) retiradora ou doadora de elétrons moléculas. R-tions de Ad N são possíveis apenas com ligações C=C ativadas por substituintes que retiram elétrons; a implementação de Ad E requer ligações C=C não substituídas ou aquelas ativadas por substituintes doadores de elétrons. Para p-ção Ad R, a natureza do substituinte na ligação C=C não importa muito.
Estereoquímico. o resultado da adição da etapa depende do mecanismo de p-ção e da natureza dos compostos reagentes. Sim, eletro. juntando-se olefinas pode prosseguir como o ataque das partículas Y e W molécula de um lado do avião ligação dupla ou como anti-aderência - as partículas atacam de diferentes lados do plano; em alguns casos, os distritos não são estereoespecíficos. Núcleo de juntando-se com carbânions procede, via de regra, de forma não estereoespecífica. Ao ingressar reações sobre ligações triplas a adição syn leva ao isômero cis, a adição anti leva ao isômero trans.
No caso de um mecanismo síncrono, um ataque em ambos átomo C é realizado simultaneamente e o p-tion prossegue como uma adição dipolar (veja Cicloadição), enquanto a adição reações pelo dobro ou ligação tripla ir como apego de filho (ver, por exemplo, Reações de resposta).
P conexões reações por conjugado ligações duplas, fluindo através de um mecanismo passo a passo, levam à formação de produtos de adição de 1,2 e 1,4:
Conexão síncrona 1,4 para dienos trilha está correndo. caminho:

Um tipo especial de reações de adição é a adição conjugada. O fluxo de tais p-tions é acompanhado pela ligação do p-solvente (ou especialmente adicionado reagente) na fase final do processo. Por exemplo, elektrof conjugado. adesão halogênios para alcenos em CH 3 COOH conduz, juntamente com 1,2-di-haletos, a haletos de b-acetoxialquil:
Exemplos de nucleófos conjugados. adesão - Reação de Miguel e interação. ativado alcenos com ânion cianeto em próton p-solventes SH:

Em caso de adesão reações sobre ligações múltiplas carbono-hetero-átomo, em que colocar. a cobrança está localizada átomo C (ligações C=O, C=N, C=N e C=S), nucleófilos sempre se ligam a átomo C, e eletrófilos a um heteroátomo. Em naib. grau estudado adições nucleofílicas reações para o grupo carbonila:

P conexões reação sobre átomo C pode ser um dos estágios de substituição p-tion em aromáticos. em uma linha, por exemplo: