Frente de chama. A chama pode dobrar em um acordeão sob a influência de seu próprio eco Percolação da frente da chama
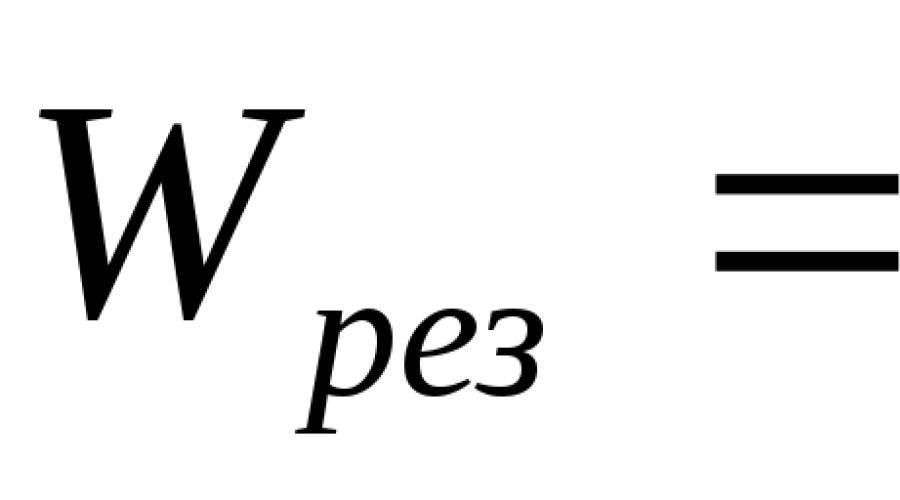
Quando uma mistura em movimento está queimando, a velocidade de propagação da chama resultante será a soma das somas  .
.
A condição de que a frente de chama seja estacionária (ou seja, imóvel) é  - a velocidade resultante é zero,
- a velocidade resultante é zero,  .
.
Como modelo, considere o queimador Buzin.
Quando gás e ar são fornecidos à boca do tubo a uma velocidade C, um cone se formará, enquanto um aumento na velocidade levará a um aumento na altura (superfície) do cone e a uma diminuição no ângulo no topo. Ou o contrário também é possível.
4.3. Processos em uma frente de chama plana.
R  Vamos olhar para a frente da chama. Constituirá uma área estreita onde h f
é a espessura da frente, e h X
é a espessura da zona de reação química. Ao mesmo tempo, pode ser dividido em 2 zonas: a zona de aquecimento e a zona de reação.
Vamos olhar para a frente da chama. Constituirá uma área estreita onde h f
é a espessura da frente, e h X
é a espessura da zona de reação química. Ao mesmo tempo, pode ser dividido em 2 zonas: a zona de aquecimento e a zona de reação.
Uma mistura fresca de gás e ar entra na zona 1, a concentração de gás no ar permanece constante porque a reação química ainda não começou, mas apenas o aquecimento está em andamento devido ao calor liberado na zona de reação. Começa onde a entrada de calor se torna igual à saída de calor, ou na linguagem da matemática  , que corresponde à temperatura de ignição T B. Na zona de aquecimento, o fornecimento de calor é maior do que a remoção de calor
, que corresponde à temperatura de ignição T B. Na zona de aquecimento, o fornecimento de calor é maior do que a remoção de calor  , e na zona de reação
, e na zona de reação  . O transporte de calor na frente da chama é realizado por condução térmica. E a liberação máxima de calor fica na zona de reação e diminui para 0 no final da frente.
. O transporte de calor na frente da chama é realizado por condução térmica. E a liberação máxima de calor fica na zona de reação e diminui para 0 no final da frente.
A propagação da frente de chama é afetada não apenas pela velocidade de uma reação química, mas também pelo transporte de substâncias e produtos de combustão.
4.4 Estabilização da frente de chama laminar.
P 
 Quando o gás real é fornecido ao queimador, a velocidade de propagação muda de um valor máximo no centro para seu valor mínimo na periferia. A frente da chama é assim curvada a partir de uma forma cônica. E a velocidade normal de propagação da chama só pode ser compensada
Quando o gás real é fornecido ao queimador, a velocidade de propagação muda de um valor máximo no centro para seu valor mínimo na periferia. A frente da chama é assim curvada a partir de uma forma cônica. E a velocidade normal de propagação da chama só pode ser compensada  , e o outro componente
, e o outro componente  irá demolir o ponto para o topo da tocha. Na periferia devido à capacidade de refrigeração das paredes você n diminui significativamente em relação ao seu valor médio, cria-se a possibilidade de compensação direta da velocidade do fluxo C
Rapidez você n. Devido a isso, a frente da chama na borda se transforma em um plano horizontal e uma zona de combustão estável é formada - um anel incendiário. Esta área pode muito bem existir de forma independente.
irá demolir o ponto para o topo da tocha. Na periferia devido à capacidade de refrigeração das paredes você n diminui significativamente em relação ao seu valor médio, cria-se a possibilidade de compensação direta da velocidade do fluxo C
Rapidez você n. Devido a isso, a frente da chama na borda se transforma em um plano horizontal e uma zona de combustão estável é formada - um anel incendiário. Esta área pode muito bem existir de forma independente.
A frente de chama é geralmente determinada pela lei do cosseno, e sua estabilidade é determinada pela estabilização do anel de ignição. Portanto, determinamos as principais dependências de uma chama estável.
Porque todos os queimadores operam em modos variáveis, então são possíveis situações em que a taxa de fluxo excederá você n, ou a situação inversa é possível.
O desprendimento da chama está associado à existência do anel incendiário e à sua destruição. A separação ocorrerá se a velocidade do fluxo exceder a velocidade crítica de separação (zona II na Figura 8).
Vários fatores afetarão a velocidade de decolagem. A PARTIR DE aumentardiâmetro queimador sua capacidade de refrigeração diminui e limite de quebra de chamaaumenta(linhas retas 3,2,1). Com mistura pobre (aumento do ar primário) declinante velocidade de ruptura. E com a diminuição da quantidade de ar primário (chama de difusão), as velocidades limite aumentarão.
Um avanço ocorre quando você n excede a taxa de fluxo da chama (zona 3 na Fig. 8).
O flashback está relacionado com a capacidade de refrigeração das paredes do queimador. Sem condição de deslizamento  . Com o aumento do diâmetro, a taxa de queima normal aumenta, quanto mais ceteris paribus aumenta a probabilidade de rompimento, maior deve ser a vazão que impede o rompimento da chama (curvas 1,2,3 na Fig. 8) 1 . As velocidades máximas sem escorregamento serão observadas em valores de excesso de ar ligeiramente menores que estequiométricos. O resfriamento da boca da tocha é usado para reduzir a chance de flashover.
. Com o aumento do diâmetro, a taxa de queima normal aumenta, quanto mais ceteris paribus aumenta a probabilidade de rompimento, maior deve ser a vazão que impede o rompimento da chama (curvas 1,2,3 na Fig. 8) 1 . As velocidades máximas sem escorregamento serão observadas em valores de excesso de ar ligeiramente menores que estequiométricos. O resfriamento da boca da tocha é usado para reduzir a chance de flashover.
Existem também métodos para estabilizar a chama.


Fig. 9. Estabilização com a ajuda da fig. 10. Estabilização de chama
anel incendiário com corpo em forma de V.
H  e fig. 9 mostra um dispositivo que se estabiliza devido ao fato de que o gás através dos canais 2 entra no intervalo anular 3. Isso cria um anel de ignição estável que evita que a chama se rompa. Na fig. 10 mostra a estabilização do escoamento por um corpo em forma de V. Devido à turbulência, uma aparência de um anel incendiário é criada e a probabilidade de separação da chama diminui (a velocidade máxima aumenta).
e fig. 9 mostra um dispositivo que se estabiliza devido ao fato de que o gás através dos canais 2 entra no intervalo anular 3. Isso cria um anel de ignição estável que evita que a chama se rompa. Na fig. 10 mostra a estabilização do escoamento por um corpo em forma de V. Devido à turbulência, uma aparência de um anel incendiário é criada e a probabilidade de separação da chama diminui (a velocidade máxima aumenta).
O estabilizador de túnel é mostrado na fig. 11. A mistura gás-ar sai do queimador 1 para o túnel 3, onde se forma a chama 2. Os produtos da combustão são sugados até a raiz da chama, criando-se uma zona de seu movimento de retorno, formando um anel de ignição estável. Porque se o ar frio fosse sugado, isso pioraria significativamente as condições de ignição.
A estrutura de uma chama de difusão depende essencialmente da seção transversal do fluxo de vapores e gases combustíveis e sua velocidade. De acordo com a natureza do escoamento, distinguem-se as chamas de difusão laminar e turbulenta.
turbulentoé chamado de uma chama inquieta e rodopiante de forma em constante mudança.
à medida que o fluxo aumenta, a chama muda de forma e fica inquieta, rodopiando com vórtices, mudando constantemente de forma, esta é uma chama turbulenta.
Este comportamento da chama no regime turbulento é explicado pelo fato de que uma quantidade muito maior de gás combustível começa a entrar na zona de combustão, ou seja, cada vez mais combustível deve ser oxidado por vez, o que leva a um aumento da tamanho da chama e sua turbulência adicional.
frente de chama- uma fina camada superficial que limita a chama, diretamente na qual ocorrem as reações redox.
A espessura da frente de chama é pequena, depende dos parâmetros gás-dinâmicos e do mecanismo de propagação da chama (deflagração ou detonação) e pode variar de décimos de milímetro a vários centímetros. No interior da chama, quase todo o volume é ocupado por gases combustíveis (GH) e vapores. Os produtos de combustão (PG) estão na frente de chama. Existe um agente oxidante no ambiente.
Na fig. 1.2.
A espessura da frente de chama de várias misturas de gases no regime laminar é de 0,5 - 10 -3 cm. O tempo médio para a conversão completa do combustível em produtos de combustão nesta zona estreita é de 10 -3 -10 -6 s.
Zona de temperatura máxima localizado 5-10 mm acima do cone da chama luminosa e para uma mistura propano-ar é de cerca de 1600 K.
A chama de difusão ocorre durante a combustão, quando os processos de combustão e mistura ocorrem simultaneamente.
Como observado anteriormente, a principal diferença entre a combustão por difusão e a combustão de misturas combustíveis pré-misturadas é que a taxa de transformação química durante a combustão por difusão é limitada pela mistura do oxidante e combustível, mesmo que a taxa de reação química seja muito alta. a intensidade de combustão é limitada pelas condições de mistura.
Uma consequência importante deste conceito é o fato de que na frente de chama, o combustível e o oxidante estão em razão estequiométrica. Quaisquer que sejam as proporções dos fluxos de oxidante e combustível fornecidos separadamente, a frente de chama é sempre colocada em tal posição que o fluxo de reagentes ocorra em proporções estequiométricas. Isso foi confirmado por muitos experimentos.
A força motriz da difusão de oxigênio na zona de combustão é a diferença entre suas concentrações dentro da chama (СО = 0) e no ar ambiente (СО inicial = 21%). Com uma diminuição dessa diferença, a taxa de difusão de oxigênio diminui e, em certas concentrações de oxigênio no ar ambiente - abaixo de 14-16%, a combustão pára. Tal fenômeno de atenuação espontânea (auto-extinguível) é observado durante a combustão em volumes fechados.
Cada chama ocupa um certo volume no espaço, cujos limites externos podem ser claramente ou indistintamente limitados. Quando os gases são queimados, a forma e o tamanho da chama resultante dependem da natureza da mistura inicial, da forma do queimador e dos dispositivos de estabilização. A influência da composição do combustível na forma da chama é determinada pela sua influência na taxa de queima.
A altura da chama é uma das principais características do tamanho da chama. Isto é especialmente importante quando se considera a combustão e extinção de fontes de gás, a combustão de produtos petrolíferos em tanques abertos.
A altura da chama é tanto maior quanto maior o diâmetro do tubo e maior a velocidade de escoamento, e quanto menor, maior a velocidade normal de propagação da chama.
Para uma dada mistura de combustível e oxidante, a altura da chama é proporcional à velocidade do fluxo e ao quadrado do diâmetro do jato:
onde é a vazão;
Diâmetro do jato;
coeficiente de difusão.
No entanto, a forma da chama permanece desconhecida e depende da convecção natural e da distribuição de temperatura na frente da chama.
Esta dependência é mantida até um determinado valor da vazão. Com um aumento na velocidade de fluxo, a chama turbuliza, após o que um aumento adicional em sua altura pára. Essa transição ocorre, como já observado, para determinados valores do critério de Reynolds.
Para chamas, quando há uma liberação significativa de partículas não queimadas na forma de fumaça, o conceito de altura da chama perde sua certeza, pois. é difícil determinar o limite de combustão de produtos gasosos no topo da chama.
Além disso, em chamas contendo partículas sólidas, em comparação com chamas contendo apenas gases de combustão, a radiação aumenta significativamente.
Tópico 7. DISTRIBUIÇÃO DE CHAMA.
7.1. Teoria térmica da combustão.
Para adiabático, ou seja, combustão, que não é acompanhada por perdas térmicas, todo o fornecimento de energia química do sistema combustível é convertido em energia térmica dos produtos da reação. A temperatura dos produtos da combustão adiabática não depende da velocidade das reações que ocorrem na chama, mas apenas do seu efeito térmico total e das capacidades caloríficas dos produtos finais. Este valor é chamado de temperatura de combustão adiabática Tg. É uma característica importante de um meio combustível. Para a maioria das misturas combustíveis, o valor de Tg está na faixa de 1500-3000 ° K. É óbvio que Tg é a temperatura máxima dos produtos da reação na ausência de aquecimento externo. A temperatura real dos produtos de combustão só pode ser inferior a T g em caso de perda de calor.
De acordo com a teoria térmica da combustão desenvolvida pelos cientistas soviéticos Ya.B. Zeldovich e D.A. Frank-Kamenetsky, a propagação da chama ocorre pela transferência de calor dos produtos de combustão para a mistura não queimada (fresca). A distribuição de temperatura na mistura gasosa, levando em consideração a liberação de calor da reação química e a condutividade térmica, é mostrada na fig. 26.
Frente de chama, ou seja a zona na qual ocorre a reação de combustão e autoaquecimento intenso do gás em combustão começa na temperatura de autoignição Tsv e termina na temperatura Tg.
Na frente da frente da chama se propagando para a direita, há uma mistura fresca e atrás - produtos de combustão. Acredita-se que na zona de aquecimento a reação ocorre tão lentamente que a liberação de calor é desprezada.
O processo de transferência de calor durante a propagação estacionária da chama não leva a perdas de calor e diminuição da temperatura em relação à Tg diretamente atrás da frente de chama. A remoção de calor de cada camada de gás em combustão durante a ignição da camada adjacente, ainda não aquecida, é compensada por uma quantidade similar de calor previamente obtida na camada de ignição durante a sua própria ignição. O calor adicional do pulso de ignição inicial não distorce visivelmente o regime de combustão estacionária, pois seu papel diminui cada vez mais à medida que a quantidade de gás queimado aumenta.
Os produtos da combustão perdem calor apenas como resultado da radiação e em contato com uma superfície sólida. Se a radiação for desprezível, tal combustão é praticamente adiabática. Perdas significativas de calor são possíveis apenas a uma certa distância atrás da frente da chama.
Assim, o início da combustão da mistura gasosa em um ponto leva ao aquecimento da camada próxima, que é aquecida por condução de calor dos produtos da reação até a auto-ignição. A combustão desta camada implica a ignição da próxima, e assim sucessivamente. até a combustão completa da mistura combustível. O calor removido da zona de reação para a mistura fresca é completamente compensado pela liberação de calor de reação e surge uma frente de chama estável. Como resultado da combustão em camadas, a frente de chama se move através da mistura, proporcionando a propagação da chama.
Se a mistura fresca se mover em direção à frente da chama a uma velocidade igual à velocidade de propagação da chama, a chama ficará imóvel (estacionária).
A fundamentação teórica das condições de propagação de uma chama pode ser dada quando se considera uma chama estacionária, quando a velocidade de sua propagação U pl é igual à taxa de fornecimento da mistura gasosa υ g: U pl = υ g (Fig. . 27). Neste caso, a razão entre a taxa de queima normal U n e a velocidade de propagação da chama U pl é expressa pela equação:
vocên = vocêpl* sinφ. (7.1)


A quantidade de calor é fornecida à mistura fresca de uma unidade da superfície da chama por unidade de tempo por condução térmica:
![]() (7.2)
(7.2)
onde: - coeficiente de condutividade térmica;
Largura frontal da chama.
Este calor é gasto no aquecimento da mistura fresca desde a temperatura inicial T o até a temperatura de combustão T g:
Onde: Comé a capacidade calorífica específica;
A densidade da mistura.
Levando em conta as equações (7.2) e (7.3) com U pl = υ g, a velocidade de propagação da chama é determinada pela relação:
![]() (7.4)
(7.4)
onde: - coeficiente de difusividade térmica.
Como a taxa de combustão é muito dependente da temperatura, a combustão da maior parte do gás ocorre em uma zona cuja temperatura é próxima de Tg.
A velocidade de uma reação química, conforme discutido no § 6.1., é determinada pela equação:
![]() . (7.5)
. (7.5)
Então a velocidade de propagação da chama é:
Onde: bé um indicador que depende das propriedades da mistura, .
Assim, a chama não será capaz de se propagar através da mistura combustível se a sua temperatura for inferior à temperatura teórica de combustão por um valor superior (ver § 9.3).
![]() é o intervalo de temperatura característico em cinética química. Uma mudança na temperatura por este valor leva a uma mudança na taxa de reação por um fator de “e”.
é o intervalo de temperatura característico em cinética química. Uma mudança na temperatura por este valor leva a uma mudança na taxa de reação por um fator de “e”.
O valor limite da velocidade de propagação da chama U LIMIT é determinado pela razão:
![]() (7.7)
(7.7)
Ao contrário do caso considerado de combustão normal, em condições reais de explosões em espaço confinado, o processo de combustão por deflagração é auto-acelerado. Isso se deve à expansão da superfície de combustão, à ocorrência de movimento do gás e ao aumento da pressão durante a combustão.
7.2. Combustão em volume fechado.
Durante a combustão de gases em um tubo aberto e em uma corrente, os produtos da reação se expandem livremente, a pressão permanece quase constante. A combustão em um recipiente fechado está associada a um aumento de pressão. Isso é de grande importância para resolver problemas de segurança contra explosão. Um aumento de pressão durante a combustão em aparelhos fechados, bem como em salas, pode levar à destruição e acidentes.
Durante a combustão sem perda de calor (combustão adiabática) em um volume fechado, como resultado de um aumento na temperatura de T o para a temperatura de combustão T g e uma mudança no número de moléculas grama durante a reação, a pressão aumenta de P o para Rg:
![]() (7.8)
(7.8)
onde: m, n - o número de moles de substâncias antes e depois da explosão do estequiométrico
composição da mistura.
No entanto, a maior pressão se desenvolve não para misturas estequiométricas, embora tenham o maior poder calorífico e criem a Tg máxima, mas misturas enriquecidas com uma substância combustível que tenham uma taxa de combustão máxima. Durante a combustão de deflagração, a pressão atinge 7-10 atm., Durante a detonação, é muito maior.
Uma característica do processo de combustão em volume fechado é a distribuição desigual da temperatura dos produtos da reação imediatamente após a combustão. A parte inicialmente combustível da mistura combustível, localizada no centro do recipiente, reage à pressão inicial p o; a última camada queimando perto da parede reage a uma pressão finita R.
O aquecimento de cada camada de gás ocorre em duas etapas: durante a transformação química e a compressão adiabática. Embora a composição dos produtos de combustão e a pressão sejam iguais em todos os pontos do volume, a temperatura final depende essencialmente da sequência de ambos os processos de aquecimento. Sob compressão de pressão adiabática p o até a pressão R aumento de temperatura de T o para T é determinado pela equação de Poisson
![]() , (7.9)
, (7.9)
onde: g = s r / sv.
A temperatura final dos produtos de combustão será maior se o gás for aquecido primeiro durante a transformação química, e então sua temperatura aumentar durante a compressão de acordo com a equação (7.9), do que no caso da sequência inversa de ambos os processos.
7.3. O movimento dos gases durante a combustão.
A expansão dos gases em uma chama (de acordo com a lei de Gay-Lussac) leva ao fato de que a combustão é sempre acompanhada pelo movimento dos gases. Denote por ρ g - a densidade do meio inicial, ρ pr - a densidade dos produtos de combustão, sua velocidade em relação à frente de chama estacionária é u pr. Para cada centímetro quadrado da superfície frontal, o fluxo traz a cada segundo u n cm 3 da mistura combustível, sua massa é u n * ρ g, respectivamente, desta seção da chama é removido em 1 s u pr cm 3 dos produtos da reação com uma massa u pr * ρ pr. mistura em chamas e os produtos da reação são iguais, então
u н* ρ г = u pr* ρ pr (7,10)
A equação (7.10) expressa a lei de conservação da massa durante a combustão.
O valor de u pr excede a velocidade normal da chama tantas vezes quanto a densidade do meio inicial for maior que a densidade dos produtos de combustão. O aumento da vazão de gás durante a combustão é consequência da expansão dos gases.
A temperatura absoluta durante a combustão aumenta de 5 a 10 vezes. Se a combustão ocorre a pressão constante, o gás se expande em r o / r pr uma vez. Considere a combustão de uma frente de chama estacionária em um tubo aberto, mostrada na Figura 28.

Arroz. 28. Esquema para explicar a lei das áreas: S - seção do tubo, F - superfície frontal da chama, ω - velocidade da mistura combustível inicial, T 0, - temperatura e densidade da mistura inicial, U H - taxa de queima normal, U PL - velocidade de propagação da chama, U PR - velocidade dos produtos de combustão, T PR, - temperatura e densidade dos produtos de combustão.
Como a chama é estacionária, ω = U PR. Então, por exemplo, para 1 cm 2 da superfície da frente de chama F, o escoamento traz ω cm 3 /s da mistura combustível. Sua massa é ω. Consequentemente, U PR cm3/s de produtos de combustão com uma massa de U PR é removido deste local. Então, de acordo com a lei de conservação das massas (equação 7.10) em ω = U PL:
![]() (7.11)
(7.11)
Assim, a velocidade volumétrica dos produtos de combustão excede a taxa de combustão tantas vezes quanto a densidade do meio inicial for maior que a densidade dos produtos de combustão.
Por outro lado, se U N cm 3 /s da mistura queima em 1 cm 2 da superfície da frente da chama, então U N * F cm 3 / s queima em toda a área F. Ao mesmo tempo, o volume do gás queimado é igual à velocidade volumétrica do fluxo de gás ω * S cm 3 / s. Então U H *F = ω*S, ou ω = U H *F / S.
Com a igualdade ω \u003d U PL:
vocêPL= UH* F / S. (7.12)
Nós temos lei de área: a velocidade de propagação da chama no tubo será tantas vezes maior que o normal quanto a superfície da chama exceder a seção transversal do tubo.
Se considerarmos uma mistura combustível estacionária, quando a frente da chama se propaga, os gases fortemente aquecidos não têm tempo para se expandir e, na zona de combustão, a pressão aumenta acentuadamente, o que “explode” e empurra os gases em ambas as direções da chama , e não apenas os produtos da combustão são expelidos, mas também há um movimento da mistura inicial à frente da frente de chama, como na Figura 29:

A velocidade dos gases aumenta conforme a combustão da mistura inicial e, consequentemente, a pressão dos gases. Ao mesmo tempo, gases queimados quentes comprimidos são ejetados de uma extremidade do tubo e uma mistura inicial comprimida é empurrada para fora da outra extremidade, que inflama explosivamente da chama ejetada na atmosfera da sala, seguida por uma onda de choque , fogo e destruição.
7.4. Fatores de aceleração de queima.
Diferentes modos de combustão de deflagração diferem apenas na velocidade de propagação da chama devido ao desenvolvimento desigual da superfície da frente de chama. A combustão de um gás inicialmente estacionário é sempre complicada por influências externas perturbadoras que distorcem a forma da chama. Os mais importantes são a gravidade, o atrito e a turbulência da mistura em chamas.
Assim, ao acender no meio de um tubo vertical, como mostra a Figura 30, a mistura inicial pesada fica localizada acima dos produtos leves da combustão. Nesse caso, os fluxos convectivos da mistura inicial se movem para baixo e os produtos da combustão se movem para cima. Sob sua influência, a frente de chama se estende e a combustão acelera.
Quando a chama se propaga para baixo, o meio combustível é estacionário e a perturbação da frente da chama é insignificante. Em baixas taxas de queima e comprimento de tubo, a forma da chama é quase plana.
No entanto, neste caso, o gás também desce pelo tubo devido à expansão durante a combustão. O atrito do gás em movimento contra as paredes leva a uma diminuição de sua velocidade na periferia e alongamento da frente de chama, e o perfil de velocidade da frente de chama também assume a forma de uma cúpula. A superfície da chama aumenta progressivamente e a combustão acelera.
A combustão suficientemente rápida, na qual a velocidade da chama atinge centenas de m/s, ocorre durante a turbulização da mistura gasosa e, consequentemente, durante a turbulência da frente de chama. A turbulização causa uma expansão significativa da frente de chama, aceleração da transferência de calor entre os produtos de combustão e a mistura inicial e, consequentemente, a combustão. Essa combustão é frequentemente chamada de explosão.
7.5. Condições de explosão.
Como descobrimos anteriormente, uma explosão é uma transformação química ou física de uma substância, acompanhada por uma transição extremamente rápida de sua energia para a energia de compressão e movimento das substâncias iniciais, os produtos de sua transformação e o ambiente. A partir disso, uma explosão química é uma reação de combustão extremamente rápida, acompanhada por uma transição acentuada da energia térmica liberada para a energia de compressão e movimento das substâncias de partida, produtos de combustão e meio ambiente.
A explosão consiste em três fases:
1) a conversão da energia química da reação em energia térmica;
2) conversão de energia térmica em energia de um gás altamente comprimido;
3) propagação de gás comprimido na forma de onda de choque.
As principais condições para a ocorrência de uma reação química na forma de uma explosão são:
1. exotermicidade, o que se deve ao fato de que a força das ligações entre os átomos nos produtos da reação é muito maior do que nas substâncias iniciais, de modo que a energia "extra" é liberada. Nas reações endotérmicas, não ocorre uma explosão.
2. Formação de gás, Porque:
Em primeiro lugar, a transição para um estado gasoso durante a reação química de qualquer substância em volume constante leva a um aumento na pressão;
Em segundo lugar, os gases têm um coeficiente de expansão volumétrica muito alto quando aquecidos. Sem a presença de gases, ocorrerá apenas o aquecimento da substância.
3. Alta taxa de reação e sua capacidade de auto-propagação e auto-aceleração. A autopropagação ocorre devido a uma "onda" térmica realizada por condutividade térmica (explosão de deflagração), ou a uma onda de choque de gases comprimidos (detonação).
A "onda" térmica é suportada pelo calor liberado durante a combustão, e a onda de choque é suportada pelo próprio gás comprimido.
A autoaceleração da reação e a ocorrência de uma explosão ocorrem como resultado do aumento da temperatura das substâncias reagentes devido ao calor da reação, ou do aumento dos radicais ativos ou do aumento da pressão na onda de choque.
A combustão de uma mistura gasosa em tubos fechados gera um eco, que leva a um rearranjo completo da frente de chama. Os detalhes desse fenômeno foram reproduzidos pela primeira vez em simulações numéricas.
Uma chama interagindo com uma poderosa onda sonora pode gerar estruturas espaciais interessantes (veja, por exemplo, um vídeo impressionante com "visualização de fogo" de ondas sonoras). Nesse caso, a onda sonora não precisa ser externa: a combustão intensa de uma mistura gasosa de combustível e oxidante em volume fechado, por exemplo, em tubulações, gera um eco que pode distorcer a frente da chama e alterar o modo de reação da combustão .
A distorção da forma da chama durante a combustão em tubos é conhecida há mais de cem anos, mas somente nos experimentos clássicos de Jeffrey Sirby (G. Searby) em 1992 foi realizado um estudo sistemático desse processo. Em particular, Sirby observou a turbulência da chama sob a ação de seu próprio eco. Em si, esse fenômeno não parece surpreendente, mas uma descrição teórica desse processo ainda não foi proposta. As perguntas que precisavam ser respondidas eram “Como exatamente ocorre a transição para a turbulência?”, “Que tipo de oscilação de chama oscila primeiro?” etc. Tudo isso, por sua vez, agrilhoou as mãos de pesquisadores que buscavam aplicações práticas desse efeito na tecnologia (de modo geral, a turbulência da chama é de grande importância para a indústria de foguetes).
Um artigo recente da equipe de pesquisa russo-sueca A. Petchenko et al., Physical Review Letters, 97, 164501 (19 de outubro de 2006) deu o primeiro passo para a construção de tal teoria. Os autores deste trabalho realizaram uma simulação numérica detalhada do processo de combustão de uma mistura gasosa em um tubo longo e muito estreito, fechado em uma extremidade (a mistura foi inflamada pela extremidade aberta e a chama se propagou profundamente no tubo ). Para simplificar os cálculos, foi resolvido um problema bidimensional em vez de tridimensional, a mistura gasosa foi considerada um gás ideal e o processo de combustão foi modelado por uma reação química hipotética de um estágio e irreversível com determinada liberação de calor e ativação energia. Mas todos os gases e termodinâmica - compressão e expansão, fluxos de gás, transferência de calor, estrutura da frente de chama - foram levados em consideração na íntegra.
Os resultados da simulação provaram inequivocamente que, à medida que se aproximava a extremidade fechada, a frente de chama começava a “tremer”. Esse tremor gerou um eco sonoro de mesma frequência, que "balançava" ainda mais a chama. Nas imediações da extremidade do tubo, as oscilações da chama tornaram-se tão fortes que a frente da chama literalmente se dobrou em um acordeão. Durante cada período dessas oscilações, a frente de chama se desestabilizou bruscamente, liberando um jato estreito e muito longo de gás frio na região ocupada pelos produtos quentes da combustão. O jato então queimou rapidamente, a frente da chama se transformou em um redemoinho e depois se nivelou novamente. A velocidade das correntes geradas por essas oscilações é dez vezes excedeu a velocidade "normal" de propagação da chama em espaço aberto.
As oscilações fortes e os vórtices gerados por elas são geralmente o primeiro estágio na transição para a turbulência. Os autores do artigo, no entanto, não têm pressa em anunciar a descoberta do mecanismo de turbulência da chama. O fato é que o poder computacional disponível hoje permite que essa modelagem detalhada seja realizada apenas em tubos extremamente estreitos, ou melhor, até mesmo em capilares. Como esse processo mudará em tubos largos, para os quais foram obtidos dados experimentais e nos quais o efeito das paredes sobre os escoamentos é muito mais fraco, ainda precisa ser estudado. Também é interessante verificar se as distorções de chama encontradas na simulação são a mesma “chama de tulipa” que vem sendo observada há muito tempo, mas ainda permanece inexplicável (ver C. Clanet e G. Searby. Sobre a “Tulip Flame” Fenômeno (PDF, 1,3 Mb) // Combustão e chama, 1996. V. 105. P. 225-238).