O que é um exemplo químico. Os produtos químicos mais importantes usados na vida cotidiana. Fabricantes e fornecedores de produtos químicos industriais
Leia também
É impossível imaginar a vida e a produção modernas sem produtos químicos. Em contato próximo com eles, um certo efeito é exercido no corpo humano. Deve-se notar que também existem compostos que mostrarão sua influência após um determinado período de tempo. No artigo, tentaremos descobrir quais fatores químicos existem, as classes de perigo das substâncias nocivas e como elas afetam o corpo humano.
Uso humano de produtos químicos
Vários milhões de compostos químicos são agora conhecidos, e a maioria deles é usada por humanos em várias indústrias. Se considerarmos as classes de perigo dos produtos químicos do ponto de vista da aplicação, a lista pode ficar assim:
- Substâncias venenosas usadas na indústria. São eles: corantes (anilina), dentre os solventes está o dicloroetano, por exemplo.
- Os pesticidas são amplamente utilizados na indústria agrícola.
- Compostos químicos que são usados no dia a dia: produtos de higiene, para sanitização.
- Substâncias venenosas de origem natural, como venenos de plantas e animais.
- Substâncias venenosas: gás mostarda, fosgênio e outros.
Várias classes de perigo de produtos químicos nocivos podem entrar no corpo através dos órgãos do sistema respiratório, pele ou membranas mucosas. As substâncias podem exercer seu impacto negativo seletivamente, ou seja, em um sistema orgânico específico. Por exemplo, o chumbo afeta o sistema reprodutivo humano e os óxidos de nitrogênio podem provocar inchaço do tecido pulmonar.
Efeitos tóxicos de produtos químicos
Se considerarmos a classe de perigo dos produtos químicos, o GOST distingue vários grupos. Cada um tem suas próprias divisões.
Cinco classes são distinguidas dependendo do efeito tóxico e da dose letal média.
- A primeira classe de perigo inclui compostos que requerem muito pouco para danificar o corpo. Por exemplo, quando ingerido pelo estômago, essa quantidade é de 50 mg por quilograma de peso humano.
- A classe 2 inclui substâncias cuja concentração pode ser maior para provocar um efeito tóxico. Isso pode estar entre 5 e 50 mg por m3 se a exposição ocorrer através da pele ou do trato gastrointestinal.
- As classes 3 e 4 incluem compostos que exigem mais do que as duas primeiras classes e geralmente essa quantidade é de até 5.000 unidades.
- A quinta classe inclui substâncias que causam danos tóxicos profundos.
Produtos químicos e o órgão da visão
Se levarmos em conta o efeito dos produtos químicos no órgão da visão, as seguintes classes são distinguidas:
- A primeira classe inclui compostos que levam a alterações irreversíveis no aparelho ocular, e tudo isso termina com deficiência visual.
- A segunda classe contém substâncias que causam alterações patológicas na visão, mas são capazes de passar dentro de algumas semanas.
O efeito de produtos químicos na pele
Existe outra classificação, identifica classes de produtos químicos que têm um efeito negativo na pele. Ao dividir os compostos, dois critérios foram usados. Dada a primeira, existem três classes:
- O primeiro grupo inclui substâncias que causam necrose visível da pele.
- A segunda classe inclui substâncias que causam danos reversíveis. Em cerca de duas semanas, a pele é restaurada.
- As substâncias pertencentes à terceira classe causam apenas uma leve irritação na pele, que geralmente desaparece em alguns dias.

O segundo critério de classificação é usado nos casos em que não há dados suficientes para atribuir substâncias aos três primeiros grupos.
O impacto dos compostos químicos no meio ambiente
De acordo com o GOST, também existe uma classificação que leva em consideração o impacto dos compostos químicos no meio ambiente. Este grupo inclui as seguintes categorias de substâncias:
- Prejudicial para a camada de ozônio.
- Com efeitos tóxicos agudos no ambiente aquático.
- Substâncias que têm um efeito tóxico gradual sobre os habitantes dos recursos aquáticos.
Todos esses compostos nocivos também podem ser divididos em categorias de acordo com a nocividade. Para fornecer um efeito tóxico, uma concentração de 0,1 mg / l é suficiente.
Classificação de produtos químicos por classes de perigo
Em uma enorme variedade de substâncias conhecidas, nem todas são igualmente perigosas para o corpo humano. As seguintes classes são distinguidas:
- A primeira classe inclui substâncias e compostos extremamente perigosos. Para um resultado fatal, será suficiente introduzir no estômago 15 mg de uma substância por quilograma de peso de uma pessoa. Exemplos incluem o seguinte: cianeto de potássio, mercúrio, nicotina e outros.
- A segunda classe inclui substâncias altamente perigosas. A dosagem letal varia de 15 a 150 mg por quilograma de peso corporal, dadas as propriedades da substância. Esses compostos têm um impacto negativo não apenas nos seres humanos, mas também no meio ambiente. Estes incluem: arsênico, lítio, chumbo, clorofórmio.
- Moderadamente perigoso é a terceira classe de perigo de produtos químicos. Para um resultado letal, 500-2500 mg / kg são suficientes. Quando ingerida, a dose letal é de 150-5000 mg/kg de peso corporal. Esta classe inclui: gasolina, compostos de alumínio e manganês. Como muitas substâncias desta classe são usadas com frequência na vida cotidiana, elas não devem ser manuseadas com negligência.
- As substâncias de baixo risco são as mais inofensivas, pois se distinguem por sua baixa toxicidade e perigo. Essas substâncias muitas vezes nos cercam, por exemplo, amônia pode ser encontrada em todos os armários de remédios, querosene é usado em lâmpadas, etanol é usado em remédios e é encontrado em bebidas alcoólicas.

Não importa quantas classes de perigo de produtos químicos existam, é importante tratá-los com extrema cautela, observar todas as medidas de segurança ao trabalhar com eles.
Classificação das substâncias de acordo com seus efeitos no corpo
Todos os produtos químicos e compostos disponíveis diferem uns dos outros não apenas no grau de toxicidade, mas também na natureza do impacto nos seres humanos.
Dependendo da classe de perigo, todas as substâncias recebem uma determinada cor.
- Substâncias extremamente perigosas estão marcadas em vermelho.
- Um alto grau de perigo está marcado em laranja.
- Moderadamente perigosos são amarelos.
- As substâncias classificadas como de baixo risco são marcadas em verde.
Classificação de substâncias em termos de efeitos tóxicos
Toxicidade completamente diferente de produtos químicos, classes de perigo a este respeito, distinguem-se os seguintes:
- As substâncias que têm um efeito paralisante dos nervos incluem: inseticidas, nicotina, sarin.
- Compostos que causam processos inflamatórios e alterações necróticas em conjunto com um efeito tóxico geral. Um exemplo é: essência de vinagre, arsênico, mercúrio.
- Compostos que causam convulsões, coma, edema cerebral, ou seja, têm um efeito tóxico geral. Estes incluem: ácido cianídrico, monóxido de carbono, álcool.
- Asfixiantes (fosten, óxidos de nitrogênio).
- Substâncias que causam lacrimejamento e irritação das membranas mucosas. Um exemplo é: pares de ácidos e álcalis.
- Substâncias e compostos que afetam a psique. Estes incluem substâncias narcóticas, atropina e outros.

Cuidados especiais devem ser tomados se alguém for usar ou entrar em contato com essas substâncias.
Classificação internacional
Consideramos quantas classes de perigo de produtos químicos existem de acordo com o GOST, mas também há uma divisão baseada em requisitos internacionais. Representa 9 grupos, cada um com suas próprias regras de transporte e armazenamento.
- Substâncias que podem facilmente explodir ou pegar fogo.
- A segunda classe inclui substâncias inflamáveis, venenosas e quimicamente instáveis.
- Os produtos químicos em estado líquido que são altamente inflamáveis pertencem à classe 3.
- A classe 4 inclui sólidos capazes de auto-ignição ou ignição após exposição externa.
- Os oxidantes orgânicos pertencem à 5ª classe, pois são capazes de liberar oxigênio que suporta a combustão.
- Classe 6 - são substâncias tóxicas que causam intoxicações graves ou levam à morte quando inalados pelos vapores.
- A próxima classe são substâncias radioativas.
- As substâncias corrosivas são a oitava classe de perigo.
- A classe 9 incluía todas as outras substâncias que não se enquadravam nas classes anteriores, mas que, em certa medida, podem ser perigosas.

Como se proteger de substâncias perigosas
É importante não apenas conhecer a classe de perigo dos produtos químicos, mas também ser capaz de minimizar o grau de impacto no corpo humano e na natureza. Para fazer isso, você pode usar os seguintes métodos:
- Coloque substâncias tóxicas e nocivas nas empresas o mais longe possível dos locais de trabalho.
- Tenha um sistema de ventilação moderno e eficiente para remover substâncias perigosas.
- Use equipamentos de proteção individual em tempo hábil.
- Use métodos modernos de tratamento de água antes de liberá-la no meio ambiente.
- Diluir os compostos nocivos para concentrações aceitáveis.

A utilização destes métodos disponíveis permitirá proteger tanto quanto possível os seres humanos e a natureza dos efeitos das substâncias químicas nocivas.
Resumindo
Para resumir tudo o que foi dito, é possível não apenas destacar a classe de perigo dos produtos químicos, mas também observar os seguintes tipos de exposição a compostos nocivos:
- Ação irritante, se entrarem na pele, causam vermelhidão, por exemplo, flúor, fósforo, etc.
- A ação cauterizante da substância pode causar queimaduras de vários graus. Estes incluem: amônia, ácido clorídrico.
- As substâncias asfixiantes podem levar à asfixia e à morte. Fosgênio e cloropicrina têm esse efeito.
- Substâncias com efeitos tóxicos podem causar envenenamento de gravidade variável. Estes incluem: sulfeto de hidrogênio, ácido cianídrico, óxido de etileno e outros.
- Substâncias mutagênicas podem provocar o aparecimento de mutações.
- A exposição cancerígena leva ao desenvolvimento de câncer.
Algumas classificações também liberam substâncias entorpecentes, que, entrando no corpo, causam dependência e envenenamento gradual do corpo.
Então nos familiarizamos com a variedade de produtos químicos que nos cercam em quase todos os lugares. É quase impossível imaginar a indústria e a produção modernas sem a química. Mas, para não prejudicar seu corpo no processo de interação com substâncias nocivas, você deve ter um cuidado especial e conhecer as regras de armazenamento e transporte.
Abreviaturas:
T fardo - temperatura de ebulição,
T pl. - temperatura de fusão.
Ácido adípico (CH 2) 4 (COOH) 2- cristais incolores, solúveis em água. T. pl. 153°C. Forma sais - adipatos. Usado para descalcificação.
Ácido nítrico HNO3- um líquido incolor de odor pungente, infinitamente solúvel em água. T. kip. 82,6°C. Ácido forte, causa queimaduras profundas e deve ser manuseado com cuidado. Forma sais - nitratos.
Alúmen de potássio KAl (SO 4) 2,12 H 2 O- sal duplo, uma substância cristalina incolor, altamente solúvel em água. T pl. 92°C.
Acetato de amila CH 3 COOS 5 H 11 (éster amílico de ácido acético)— um líquido incolor com odor frutado, um solvente orgânico e fragrância.
Aminoácidos- substâncias orgânicas nas moléculas das quais existem grupos carboxila COOH e grupos amino NH 2. Incluído na composição de proteínas.
Amônia NH- um gás incolor de odor pungente, altamente solúvel em água, forma hidrato de amônia NH 3 .H 2 O.
Nitrato de amônio (amônia), cm. . Anilina (aminobenzeno, fenilamina) C 6 H 5 NH 2- um líquido viscoso incolor, escurecendo na luz e no ar. Insolúvel em água, solúvel em álcool etílico e éter dietílico. T fardo 184°C. Venenoso.
Ácido araquidônico C 19 H 31 COOH- ácido carboxílico insaturado com quatro ligações duplas na molécula, líquido incolor. T fardo 160-165°C. Faz parte das gorduras vegetais.
Ácido ascórbico (vitamina C), uma substância orgânica de estrutura complexa - cristais incolores, sensíveis ao calor. Participa nos processos redox de um organismo vivo.
Esquilos- biopolímeros constituídos por resíduos de aminoácidos. Eles desempenham um papel importante nos processos da vida.
Gasolina— uma mistura de hidrocarbonetos leves; obtido durante o refino do petróleo. T fardo de 30 a 200°C. Combustível e solvente orgânico.
Ácido benzóico C 6 H 5 COOH- uma substância cristalina incolor, pouco solúvel em água. Acima de 100 ° C, ele se decompõe.
Benzeno C 6 H 6- hidrocarboneto aromático. T fardo 80°C. Inflamável, venenoso.
Betaína (trimetilglicina) (CH 3) 3 N + CH 2 COO- matéria orgânica, altamente solúvel em água, é encontrada nas plantas (por exemplo, na beterraba).
Ácido bórico B (OH) 3- uma substância cristalina incolor, ligeiramente solúvel em água, um ácido fraco.
Bromato de sódio NaBrO3- cristais incolores, solúveis em água. Derrete a 384°C com decomposição. Em um ambiente ácido, é um forte agente oxidante.
Cera- substância amorfa semelhante à gordura de origem vegetal, uma mistura de ésteres de ácidos graxos. Ele derrete na faixa de 40–90 °С.
Galactose C 6 H 12 O 6 .H 2 O- carboidrato, monossacarídeo, substância cristalina incolor, solúvel em água.
Hipoclorito de sódio (trihidrato) NaClO .ZN 2 O- uma substância cristalina amarelo-esverdeada, altamente solúvel em água. T. pl. 26 °C, acima de 40 °C se decompõe, explode na presença de substâncias orgânicas. Alvejante.
Glicerina CH (OH) (CH 2 OH) 2- um líquido viscoso incolor, ilimitadamente solúvel em água e absorvendo a umidade do ar, álcool tri-hídrico. Incluído na composição de gorduras na forma de lipídios - triglicerídeos (ésteres de glicerol com ácidos orgânicos).
Glicose (açúcar de uva) C 6 H 12 O 6- carboidrato, monossacarídeo, substância cristalina incolor, altamente solúvel em água. T pl. 146°C. É encontrado no suco de todas as plantas e no sangue de humanos e animais.
Gluconato de cálcio Ca [CH 2 OH (CHOH) 4 COO] 2. H 2 O (monohidrato)- pó cristalino branco, pouco solúvel em água fria, praticamente insolúvel em álcool etílico.
Ácido glucônico (açúcar) CH 2 (OH) (CHOH) 4 COOH- uma substância cristalina incolor, solúvel em água, obtida pela oxidação da glicose. Forma sais - gluconatos.
Superfosfato duplo (mono-hidrato de di-hidroortofosfato de cálcio) Ca (H 2 PO 4) 2 .H 2 O- pó branco, solúvel em água.
Dibutil ftalato C 6 H 4 (SOOS 4 H 9) 2 (éster butílico de ácido ftálico)- líquido incolor com odor frutado, ligeiramente solúvel em água. Solvente orgânico e repelente.
Dihidroortofosfato de amônio NH 4 H 2 PO 4- uma substância cristalina incolor, solúvel em água. Fertilizante (diammo-phos).
Dimetzlftalato C 6 H 4 (COOSH 3) 2 (éster metílico de ácido ftálico)é um líquido volátil incolor. Solvente orgânico e repelente.
Vitriol de ferro (sulfato de ferro heptahidratado) F e S O 4 .7H 2 O- cristais esverdeados, solúveis em água. No ar, oxida-se gradualmente.
Mínimo de ferro- óxido de ferro (III) Fe 2 O 3 com impurezas. Tinta mineral de cor vermelho-marrom.
Sal de sangue amarelo (trihidrato de hexacianoferrato de potássio (II)) K 4 [Fe (CN) 6]. ZN 2 O- cristais amarelos claros, solúveis em água. No século XVIII. Foi obtido a partir de resíduos de matadouros, daí o nome.
Ácido graxo- ácidos carboxílicos contendo 13 ou mais átomos de carbono.
carbonato de sódio, cm. .
Cânfora C 10 H 16 O- cristais incolores com odor característico. T pl. 179 °C, sublima facilmente quando aquecido. Solúvel em solventes orgânicos, ligeiramente solúvel em água.
colofónia- substância vítrea amarela. T pl. 100 - 140 ° C, consiste em ácidos resínicos - substâncias orgânicas de estrutura cíclica. Solúvel em solventes orgânicos e ácido acético, insolúvel em água.
Carbonato de amônio (NH 4) 2 CO 3- uma substância cristalina incolor, altamente solúvel em água, decompõe-se quando aquecida.
Querosene- uma mistura de hidrocarbonetos, obtida durante a refinação do petróleo. T fardo 150-300°C. Combustível e solvente orgânico.
Sal vermelho do sangue K 3 [Fe (CN) 6] (hexacianoferrato de potássio (SH))- cristais vermelhos, solúveis em água. No século XVIII. Foi obtido a partir de resíduos de matadouros, daí o nome.
Amido [C 6 H 10 O 5] n- pó amorfo branco, polissacarídeo. Com o contato prolongado com a água, ele incha, se transforma em uma pasta e forma dextrina quando aquecido. Contido em batatas, farinha, cereais.
tornassol- matéria orgânica natural, indicador ácido-base (azul em meio alcalino, vermelho em meio ácido).
Ácido butírico C 3 H 7 COOH- um líquido incolor com odor desagradável. T fardo 163°C.
Mercaptanos (tioálcoois)- compostos orgânicos contendo o grupo SH, por exemplo, metil mercaptano CH 3 SH. Eles têm um cheiro desagradável.
Metahidróxido de ferro FeO(OH)- pó castanho-acastanhado, insolúvel em água, à base de ferrugem.
Metassilicato de sódio (não-hidratado) Na 2 SiO 3 .9H 2 O- uma substância incolor, altamente solúvel em água. T pl. 47 °C, acima de 100 °C perde água. As soluções aquosas (cola de silicato, vidro de água) são altamente alcalinas devido à hidrólise.
Monóxido de carbono (monóxido de carbono) CO- gás incolor e inodoro, veneno forte. É formado durante a combustão incompleta de substâncias orgânicas.
Ácido fórmico HCOOH- um líquido incolor com um odor pungente, ilimitadamente solúvel em água, um dos ácidos orgânicos mais fortes. T fardo 100,7°C. Contido nas secreções de insetos, em urtigas, agulhas. Sais de formas - formatos.
Naftaleno C 10 H 8- uma substância cristalina incolor com odor característico acentuado, insolúvel em água. Sublima a 50°C. Venenoso.
Amônia- 5-10% de solução aquosa de amônia.
Ácidos graxos insaturados (insaturados)Ácidos graxos que possuem uma ou mais ligações duplas em suas moléculas.
Polissacarídeos carboidratos complexos (amido, celulose, etc.).
Propano C 3 H 8- gás combustível incolor, hidrocarboneto.
Ácido propiônico C 2 H 5 COOH- líquido incolor, solúvel em água. T fardo 141°C. Ácido fraco, forma sais - propionatos.
Superfosfato simples- uma mistura de dihidroortofosfato de cálcio solúvel em água Ca (H 2 PO 4) 2. H 2 O e sulfato de cálcio insolúvel CaSO 4.
Resorcinol C 6 H 4 (OH) 2- cristais incolores com odor característico, solúveis em água e álcool etílico. T pl. 109 - 110 °С
Ácido salicílico HOS 6 H 4 COOH- uma substância cristalina incolor, ligeiramente solúvel em água fria, altamente solúvel em álcool etílico. T pl. 160°C.
Sacarose C 12 H 22 O 11- uma substância cristalina incolor, bem solúvel em água. T pl. 185°C.
Chumbo vermelho Rb 3 O 4- uma substância finamente cristalina de cor vermelha, insolúvel em água. Oxidante forte. Pigmento. Venenoso.
Enxofre S 8- uma substância cristalina amarela, insolúvel em água. T pl. 119,3°C.
Ácido sulfúrico H 2 SO 4- um líquido oleoso incolor e inodoro, ilimitadamente solúvel em água (com forte aquecimento). T fardo 338°C. Um ácido forte, uma substância cáustica, forma sais - sulfatos e hidrossulfatos.
Cor de enxofre- pó de enxofre finamente moído.
Sulfeto de hidrogênio H 2 S- um gás incolor com cheiro de ovo podre, solúvel em água, é formado durante a decomposição das proteínas. Forte restaurador. Venenoso.
Gel de Sílica (Polihidrato de Dióxido de Silício) n SiO2 m H2O- grânulos incolores, insolúveis em água. Bom adsorvente (absorvente) de umidade.
Tetracloreto de carbono (tetracloreto de carbono) CCl 4- líquido incolor, insolúvel em água. T fardo 77°C. Solvente. Venenoso.
Chumbo tetraetila Rb (C 2 H 5) 4é um líquido inflamável incolor. Aditivo para combustível automotivo (até 0,08%). Venenoso.
Tripolifosfato de sódio Na 3 P 3 O 9- um sólido incolor, ilimitadamente solúvel em água, as soluções aquosas têm um ambiente alcalino devido à hidrólise.
hidrocarbonetos- compostos orgânicos da composição C x H y (por exemplo, propano C 3 H 8, benzeno C 6 H 6).
Ácido carbônico H 2 CO 3- um ácido fraco, existe apenas em solução aquosa, forma sais - carbonatos e bicarbonatos.
Ácido acético CH 3 COOH- líquido incolor. Cristaliza a 17°C. Irrestritamente solúvel em água e álcool etílico. O ácido acético "gelo" contém 99,8% de CH3COOH.
aldeído acético, cm. .
Frutose (açúcar de frutas) C 6 H 12 O 6 .H 2 O- monossacarídeo, substância cristalina incolor, solúvel em água. T pl. cerca de 100°C. Uma vez e meia mais doce que a sacarose, encontrada em frutas, néctar de flores, mel.
Fluoreto de hidrogênio HF- um gás incolor com odor sufocante, bem dissolveremos na água com a formação de ácido fluorídrico (fluorídrico).
citratos- sais de ácido cítrico.
Ácido oxálico (di-hidratado) H 2 C 2 O 4 .2H 2 O- uma substância cristalina incolor, solúvel em água. Sublima a 125°C. Contido em azeda, espinafre, azeda na forma de sal de potássio.
Acetato de etila (acetato de etila) CH 3 COOS 2 H 5- um líquido incolor com odor frutado, ligeiramente solúvel em água. T fardo 77°C.
Etilenoglicol C 2 H 4 (OH) 2 - líquido viscoso incolor, infinitamente solúvel em água. T pl. 12,3°C, Tbp. 197,8°C. Venenoso.
Álcool etílico (etanol, álcool de vinho) C 2 H 5 OH— líquido incolor, ilimitadamente solúvel em água. T fardo 78°C. Usado como solvente e conservante. Em grandes doses - um forte veneno.
Éteres- substâncias orgânicas, incluindo fragmentos de álcoois ou álcoois e ácidos, ligados através de um átomo de oxigênio.
Ácido málico (oxisuccínico) CH (OH) CH 2 (COOH) 2- substância cristalina incolor, solúvel em água. T pl. 100°C.
Ácido succínico (CH 2) 2 (COOH) 2- uma substância cristalina incolor, solúvel em água. T pl. 183°C. Forma sais - succinatos.
As partículas elementares da matéria física em nosso planeta são átomos. De forma livre, eles podem existir apenas em temperaturas muito altas. Em condições normais, as partículas elementares tendem a se unir usando ligações químicas: iônicas, metálicas, covalentes polares ou não polares. Dessa forma, as substâncias são formadas, exemplos dos quais consideraremos em nosso artigo.
Substâncias simples
Os processos de interação entre átomos de um mesmo elemento químico terminam com a formação de substâncias químicas chamadas simples. Assim, o carvão é formado apenas por átomos de carbono, o gás hidrogênio é formado por átomos de hidrogênio e o mercúrio líquido consiste em partículas de mercúrio. O conceito de substância simples não deve ser identificado com o conceito de elemento químico. Por exemplo, o dióxido de carbono não consiste em substâncias simples de carbono e oxigênio, mas nos elementos carbono e oxigênio. Convencionalmente, compostos que consistem em átomos do mesmo elemento podem ser divididos em metais e não metais. Considere alguns exemplos das propriedades químicas de tais substâncias simples.
Metais
Com base na posição do elemento metálico no sistema periódico, os seguintes grupos podem ser distinguidos: metais ativos, elementos dos subgrupos principais do terceiro - oitavo grupos, metais dos subgrupos secundários do quarto - sétimo grupos, bem como lantanídeos e actinídeos. Metais - substâncias simples, cujos exemplos daremos a seguir, possuem as seguintes propriedades gerais: condutividade térmica e elétrica, brilho metálico, ductilidade e maleabilidade. Tais características são inerentes ao ferro, alumínio, cobre e outros. Com o aumento do número de série em períodos, as temperaturas de ebulição e fusão, bem como a dureza dos elementos metálicos, aumentam. Isso se deve à compressão de seus átomos, ou seja, à diminuição do raio, bem como ao acúmulo de elétrons. Todos os parâmetros dos metais são determinados pela estrutura interna da rede cristalina desses compostos. Abaixo, consideramos as reações químicas e também damos exemplos das propriedades das substâncias relacionadas aos metais.
Características das reações químicas
Todos os metais com estado de oxidação 0 exibem apenas as propriedades de agentes redutores. Elementos alcalinos e alcalino-terrosos interagem com a água para formar bases quimicamente agressivas - álcalis:
- 2Na+2H20=2NaOH+H2
Uma reação típica dos metais é a oxidação. Como resultado da conexão com átomos de oxigênio, surgem substâncias da classe de óxidos:
- Zn + O 2 \u003d ZnO
São compostos binários relacionados a substâncias complexas. Exemplos de óxidos básicos são óxidos de sódio Na 2 O, cobre CuO, cálcio CaO. Eles são capazes de interagir com ácidos, como resultado, sal e água são encontrados nos produtos:
- MgO + 2HCl \u003d MgCl 2 + H 2 O

Substâncias de classes de ácidos, bases, sais são compostos complexos e exibem uma variedade de propriedades químicas. Por exemplo, ocorre uma reação de neutralização entre hidróxidos e ácidos, resultando no aparecimento de sal e água. A composição dos sais dependerá da concentração dos reagentes: por exemplo, com excesso de ácido na mistura reagente, sais ácidos são obtidos, por exemplo, NaHCO 3 - bicarbonato de sódio, e uma alta concentração alcalina causa a formação de sais básicos, tais como Al (OH) 2 Cl - dicloridrato de alumínio.
não metais
Os elementos não metálicos mais importantes são encontrados nos grupos nitrogênio, carbono e halogênio e calcogênio da Tabela Periódica. Vamos dar exemplos de substâncias relacionadas a não metais: são enxofre, oxigênio, nitrogênio, cloro. Todas as suas características físicas são opostas às propriedades dos metais. Eles não conduzem eletricidade, não transmitem bem os raios de calor e têm baixa dureza. Interagindo com o oxigênio, os não metais formam compostos complexos - óxidos ácidos. Este último, reagindo com ácidos, dá ácidos:
- H 2 O + CO 2 → H 2 CO 3
Uma reação típica característica de óxidos ácidos é a interação com álcalis, levando ao aparecimento de sal e água.
A atividade química dos não metais no período aumenta, devido a um aumento na capacidade de seus átomos de atrair elétrons de outros elementos químicos. Em grupos, observamos o fenômeno oposto: as propriedades não metálicas enfraquecem devido à inflação do volume do átomo devido à adição de novos níveis de energia.

Assim, examinamos os tipos de produtos químicos, exemplos que ilustram suas propriedades, posição no sistema periódico.
Os produtos químicos são, por definição, algum tipo de perigo se usados incorretamente e as precauções não forem seguidas. Para saber exatamente o que se pode esperar de uma determinada substância, existem classificações de produtos químicos de acordo com o grau de perigo.
De acordo com os requisitos estabelecidos do GOST 12.1.007-76 produtos químicos são divididos em quatro classes sobre o nível de toxicidade e o seu impacto nos organismos vivos, em particular nos seres humanos e nos animais. A classe de perigo depende de fatores como MPC, CVIO, a dose letal média quando aplicada na pele ou ingestão. Outro documento que regulamenta o nível de perigo dos produtos químicos é o SanPiN 2.1.4. 1074-01.
Classificação de substâncias quimicamente perigosas
1ª classe de perigo
1ª classe de perigo. Estas são substâncias extremamente perigosas., MPC que é inferior a 0,1. A dose de ingestão para atingir um resultado letal é inferior a 15 mg/kg de qualquer substância nesta classe de toxicidade. Apenas 100 miligramas ou menos dessa substância por quilograma é suficiente para ser fatal em contato com a pele. As doses acima durante os experimentos levaram à morte de mais da metade dos animais experimentais. Nas tabelas, eles são referidos como LD 50 (oral) e LD 50 (dérmico).
O próximo e mais importante indicador da toxicidade e perigo de uma substância é seu MPC, ou concentração máxima permitida. O MPC de substâncias extremamente perigosas na atmosfera é de cerca de 0,1 miligramas por metro cúbico. O fator de possibilidade de intoxicação por inalação é superior a 300, a zona de ação aguda é 6,0, a zona de ação crônica é 10, a zona de ação biológica é superior a 1000.
É costume referir nicotina, cianeto de potássio e outros a substâncias extremamente perigosas. Exceder os indicadores acima leva a distúrbios irreversíveis no sistema ecológico e à morte de organismos vivos.2ª classe de perigo
São substâncias altamente perigosas., o LD 50 (oral) dessas substâncias é de 15 a 150 mg/kg, dependendo da natureza da substância, e o LD 50 (dérmico) é de 100 a 500 mg/kg. Essas substâncias são de grande perigo para humanos e animais devido ao seu efeito destrutivo.
Eles também carregam um grande perigo, pois o MPC de tais substâncias é de até 1,0 miligramas, KVIO - de 30 a 300, ZOD - 6, 18, ZKhD - 5-10, ZBD - 100-100.
Substâncias altamente perigosas incluem arsênico, clorofórmio, chumbo, lítio e assim por diante. Muitas vezes, essas substâncias são usadas como venenos ou tranquilizantes. A maioria deles está em acesso muito limitado.3ª classe de perigo
Substâncias moderadamente perigosas. A dose letal de tais substâncias em contato com a pele é de 501-2500 mg/kg e, se ingerida - 151-5000 mg/kg. A concentração máxima permitida na atmosfera é de até 10 mg / m3, o coeficiente de ocorrência de intoxicação por inalação a uma temperatura de 20 graus Celsius é de 3 a 30. Este indicador foi estabelecido durante experimentos em ratos de laboratório.
A zona de ação aguda é de 18 a 54, a zona de ação crônica é de 5 a 2,5, a ação biológica é de 10 a 100.
A lista de substâncias moderadamente perigosas inclui gasolina, ácido de alumínio, compostos de alumínio, manganês e assim por diante. Apesar das taxas relativamente baixas, tais substâncias devem ser tratadas com cautela. Essas substâncias são usadas ativamente não apenas na produção, mas também na vida cotidiana, e é por isso que você precisa prestar atenção especial a elas.4ª classe de perigo
Substâncias pouco perigosas. Esses produtos químicos representam a menor ameaça devido às suas baixas classificações de perigo e toxicidade. LD 50 (oral) de tais substâncias é superior a 5000 mg / kg, dérmico - mais de 2500 mg / kg, MPC - mais de 10, KVIO - menos de 0,3, zona de ação aguda - mais de 54, zona de ação crônica - menos superior a 2,5 e zona de ação biológica - inferior a 10.
Todos conhecem essas substâncias, pois representam em grande parte um dos componentes de nossa vida. A lista de substâncias de baixo risco inclui o popular querosene combustível, amônia, que pode ser encontrado em quase qualquer kit de primeiros socorros, alumínio, compostos de ferro e etanol. Muitas vezes, essas substâncias são usadas para realizar experimentos em aulas de química.A lista de substâncias nocivas pela natureza do impacto no corpo
Substâncias e elementos químicos podem diferir não apenas em toxicidade, mas também na natureza de seu efeito no corpo. E para ter uma visão completa de qualquer substância ou composto, é preciso levar em consideração os dados de ambas as classificações, dependendo da classe, cada uma das substâncias é atribuída a sua própria cor, de acordo com a tabela.
Será útil para você saber como é realizado de acordo com SanPiN 2.1.7.2790-10.
Em que casos são aplicadas sobretaxas crescentes, leia as novas normas para o consumo de combustíveis e lubrificantes.
A sequência de entrada de objetos no "Registro Estadual de Instalações de Eliminação de Resíduos" pode ser encontrada aqui.
Assim, o impacto dos produtos químicos pode ser da seguinte natureza:
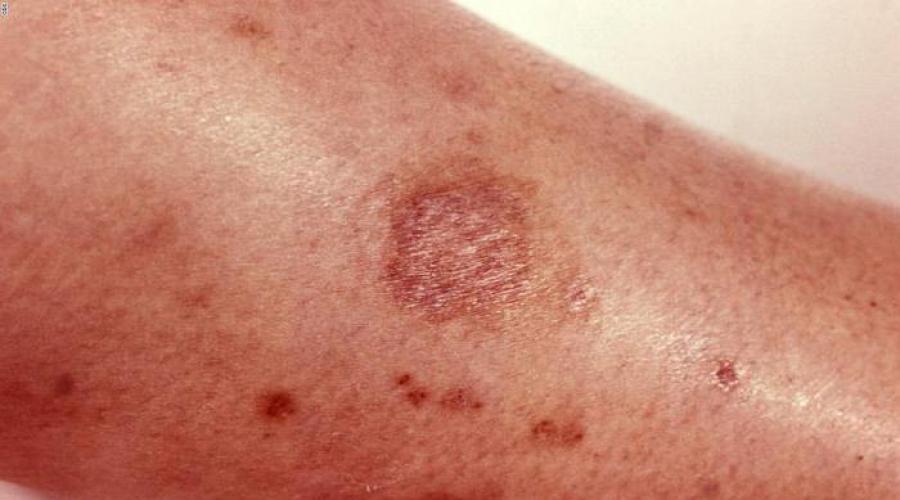
- A natureza do irritante. O contato com a pele pode causar alguma vermelhidão. Tais substâncias incluem fósforo, cloro, flúor, óxidos de hidrogênio, etc.
- A natureza da ação de cauterização. Em caso de contato com a pele ou dentro do corpo, podem ocorrer queimaduras de gravidade variável. São substâncias como ácido clorídrico e amônia.
- Substâncias sufocantes. Um alto teor de tais substâncias no ar pode levar à asfixia e, posteriormente, à morte. Fosgênio e cloropicrina têm esse efeito.
- Químicos tóxicos. São substâncias que podem afetar negativamente o corpo humano, causando vários graus de envenenamento. Hidrogênio arsênico, sulfeto de hidrogênio, óxido de etileno, ácido cianídrico - estas são as substâncias que representam um risco tóxico para os organismos vivos.
- Substâncias narcóticas. Tais substâncias são viciantes, entrando no corpo, destroem-no. É muito difícil ou impossível abandonar um hábito adquirido. Tais substâncias são chamadas de drogas e devem ser evitadas pela pessoa comum. Tais substâncias só podem ser úteis na medicina, mas mesmo assim existem vários requisitos e restrições. As drogas incluem nicotina, cloreto de metila, brometo de metila, formaldeído e assim por diante.
- Substância- uma forma de matéria de uma certa composição, consistindo de moléculas, átomos, íons.
- Molécula- a menor partícula de uma determinada substância que retém suas propriedades químicas.
- Átomo A menor partícula que não pode ser separada quimicamente.
- E ele- átomo eletricamente carregado (um grupo de átomos).
O mundo ao nosso redor consiste em muitos objetos diferentes (corpos físicos): mesas, cadeiras, casas, carros, árvores, pessoas... Por sua vez, todos esses corpos físicos consistem em compostos mais simples chamados substâncias: vidro, água, metal, argila, plástico, etc.
Diferentes corpos físicos podem ser feitos da mesma substância, por exemplo, várias jóias (anéis, brincos, anéis), pratos, eletrodos, moedas são feitas de ouro.
A ciência moderna conhece mais de 10 milhões de substâncias diferentes. Como, por um lado, vários corpos físicos podem ser feitos de uma substância e, por outro lado, corpos físicos complexos consistem em várias substâncias, o número de vários corpos físicos é geralmente difícil de explicar.
Qualquer substância pode ser caracterizada por certas propriedades inerentes apenas a ela, que permitem distinguir uma substância da outra - é cheiro, cor, estado de agregação, densidade, condutividade térmica, fragilidade, dureza, solubilidade, pontos de fusão e ebulição, etc.
Vários corpos físicos, constituídos pelas mesmas substâncias, sob as mesmas condições ambientais (temperatura, pressão, umidade, etc.) têm as mesmas propriedades físicas e químicas.
As substâncias mudam suas propriedades dependendo das condições externas. O exemplo mais simples é a água bem conhecida, que em temperaturas negativas em Celsius toma a forma de um corpo sólido (gelo), na faixa de temperatura de 0 a 100 graus é um líquido e acima de 100 graus à pressão atmosférica normal vira em vapor (gás), ao mesmo tempo, em cada um desses estados de agregação, a água tem uma densidade diferente.
Uma das propriedades mais interessantes e surpreendentes das substâncias é sua capacidade, sob certas condições, de interagir com outras substâncias, como resultado da qual novas substâncias podem aparecer. Essas interações são chamadas reações químicas.
Além disso, as substâncias podem sofrer alterações quando as condições externas mudam, que são divididas em dois grupos - físicas e químicas.
No mudanças físicas a substância permanece a mesma, apenas suas características físicas mudam: forma, estado de agregação, densidade, etc. Por exemplo, quando o gelo derrete, a água é formada e, quando a água ferve, ela se transforma em vapor, mas todas as transformações se referem a uma substância - a água.
No mudanças químicas a substância pode interagir com outras substâncias, por exemplo, quando a madeira é aquecida, ela começa a interagir com o oxigênio contido no ar atmosférico, resultando na formação de água e dióxido de carbono.
As reações químicas são acompanhadas por mudanças externas: mudança de cor, aparência de cheiro, precipitação, liberação de luz, gás, calor, etc. propriedades dos materiais de partida.