Średnia wartość opałowa gazu ziemnego. Ciepło właściwe spalania paliw i materiałów palnych
WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE GAZÓW ZIEMNYCH
U gazy naturalne bez koloru, zapachu i smaku.
Do głównych wskaźników gazów ziemnych zalicza się: skład, wartość opałową, gęstość, temperaturę spalania i zapłonu, granice wybuchowości oraz ciśnienie wybuchu.
Gazy ziemne z czystych złóż gazu składają się głównie z metanu (82-98%) i innych węglowodorów.
Gaz palny zawiera substancje łatwopalne i substancje niepalne. Do gazów palnych zalicza się: węglowodory, wodór, siarkowodór. Do gazów niepalnych zalicza się: dwutlenek węgla, tlen, azot i parę wodną. Ich skład jest niski i wynosi 0,1-0,3% C0 2 i 1-14% N 2. Po ekstrakcji z gazu usuwa się toksyczny siarkowodór, którego zawartość nie powinna przekraczać 0,02 g/m3.
Ciepło spalania to ilość ciepła wydzielonego podczas całkowite spalanie 1 m3 gazu. Ciepło spalania mierzy się w kcal/m3, kJ/m3 gazu. Wartość opałowa suchego gazu ziemnego wynosi 8000-8500 kcal/m3.
Wartość obliczoną ze stosunku masy substancji do jej objętości nazywa się gęstością substancji. Gęstość mierzy się w kg/m3. Gęstość gazu ziemnego zależy całkowicie od jego składu i mieści się w przedziale c = 0,73-0,85 kg/m3.
Najważniejsza cecha dowolnego gazu palnego to moc cieplna, tj. Maksymalna temperatura osiąga się przy całkowitym spalaniu gazu, jeżeli wymagana ilość powietrze do spalania dokładnie odpowiada wzorom chemicznym spalania, a początkowa temperatura gazu i powietrza wynosi zero.
Moc cieplna gazów ziemnych wynosi około 2000 -2100 °C, metanu - 2043 °C. Rzeczywista temperatura spalania w piecach jest znacznie niższa od mocy cieplnej i zależy od warunków spalania.
Temperatura zapłonu to temperatura mieszanki paliwowo-powietrznej, w której zapala się ona bez źródła zapłonu. Dla gazu ziemnego mieści się ona w zakresie 645-700°C.
Wszystkie gazy łatwopalne są wybuchowe i mogą zapalić się w przypadku wystawienia na działanie otwartego płomienia lub iskry. Wyróżnić dolny i górny granica koncentracji rozprzestrzenianie się płomienia , tj. dolne i górne stężenie, przy którym możliwa jest eksplozja mieszaniny. dolna granica wybuchowość gazów wynosi 3 6%, górna 12 16%.
Granice wybuchowości.
Mieszanka gazowo-powietrzna zawierająca następującą ilość gazu:
do 5% - nie świeci;
od 5 do 15% - eksploduje;
więcej niż 15% - pali się, gdy dostarczane jest powietrze.
Ciśnienie podczas wybuchu gazu ziemnego wynosi 0,8-1,0 MPa.
Wszystkie gazy łatwopalne mogą powodować zatrucie organizmu człowieka. Głównymi substancjami toksycznymi są: tlenek węgla (CO), siarkowodór (H 2 S), amoniak (NH 3).
Gaz ziemny nie ma zapachu. W celu stwierdzenia nieszczelności gaz poddaje się nawanianiu (tj specyficzny zapach). Nawanianie przeprowadza się za pomocą merkaptanu etylowego. Nawanianie odbywa się na stacjach dystrybucji gazu (GDS). Kiedy 1% gazu ziemnego dostanie się do powietrza, zaczyna śmierdzieć. Praktyka pokazuje, że średnia dawka merkaptanu etylowego do nawaniania gazu ziemnego wprowadzanego do sieci miejskich powinna wynosić 16 g na 1000 m3 gazu.
W porównaniu do solidnych i płynne paliwo Gaz ziemny wygrywa pod wieloma względami:
Względna taniość, która została wyjaśniona więcej łatwa droga górnictwo i transport;
Brak popiołu i emisji cząstek stałych do atmosfery;
Wysoka wartość opałowa;
Nie jest wymagane przygotowanie paliwa do spalania;
Uproszczono pracę pracowników usług i poprawiono warunki sanitarno-higieniczne ich pracy;
Uproszczono warunki automatyzacji procesów pracy.
Ze względu na możliwość wystąpienia nieszczelności na skutek nieszczelności połączeń i armatury gazociągów, użytkowanie gazu ziemnego wymaga szczególnej ostrożności i ostrożności. Przedostanie się do pomieszczenia więcej niż 20% gazu może spowodować uduszenie, a w przypadku jego obecności w zamkniętej przestrzeni od 5 do 15% może spowodować eksplozję mieszaniny gaz-powietrze. Niecałkowite spalanie powoduje powstawanie substancji toksycznych tlenek węgla CO, który już w małych stężeniach powoduje zatrucie personelu obsługi.
Ze względu na pochodzenie gazy ziemne dzielą się na dwie grupy: suche i tłuste.
Suchy gazy są gazami pochodzenia mineralnego i występują na obszarach związanych z obecną lub przeszłą aktywnością wulkaniczną. Gazy suche składają się prawie wyłącznie z metanu z niewielką zawartością składników balastowych (azot, dwutlenek węgla) i mają wartość opałową Qn=7000÷9000 kcal/nm3.
Tłuszcz gazy towarzyszą złożom naftowym i zwykle gromadzą się w górnych warstwach. Ze względu na swoje pochodzenie mokre gazy są zbliżone do ropy naftowej i zawierają wiele łatwo ulegających kondensacji węglowodorów. Wartość opałowa gazy ciekłe Qn=8000-15000 kcal/nm3
Zaletami paliwa gazowego są łatwość transportu i spalania, brak popiołu i wilgoci oraz znaczna prostota wyposażenia kotła.
Wraz z gazy naturalne wykorzystuje się także sztuczne gazy palne uzyskiwane podczas przetwarzania paliwa stałe lub w wyniku pracy instalacje przemysłowe jako gazy odlotowe. Gazy sztuczne składają się z palnych gazów niecałkowitego spalania paliwa, gazów balastowych i pary wodnej i dzielą się na gazy bogate i ubogie, których średnia wartość opałowa wynosi odpowiednio 4500 kcal/m3 i 1300 kcal/m3. Skład gazów: wodór, metan, inne związki węglowodorowe CmHn, siarkowodór H 2 S, gazy niepalne, dwutlenek węgla, tlen, azot i niewielka ilość pary wodnej. Balast – azot i dwutlenek węgla.
Zatem skład suchego paliwa gazowego można przedstawić jako następującą mieszaninę pierwiastków:
CO + H2 + ∑CmHn + H2S + CO2 + O2 + N2 =100%.
Skład mokrego paliwa gazowego wyraża się następująco:
CO + H 2 + ∑CmHn + H 2 S + CO 2 + O 2 + N 2 + H 2 O = 100%.
Ciepło spalania suchy paliwa gazowego kJ/m3 (kcal/m3) na 1 m3 gazu w warunkach normalnych ustala się w następujący sposób:
Qn= 0,01,
Gdzie Qi jest ciepłem spalania odpowiedniego gazu.
Wartość opałową paliwa gazowego podano w tabeli 3.
Gaz wybuchowy powstający podczas wytapiania żeliwa w wielkich piecach. Jego wydajność i skład chemiczny zależą od właściwości wsadu i paliwa, trybu pracy pieca, sposobów intensyfikacji procesu i innych czynników. Wydajność gazu waha się w granicach 1500-2500 m 3 na tonę żeliwa. Udział składników niepalnych (N 2 i CO 2) w gazie wielkopiecowym wynosi około 70%, co decyduje o jego niskich parametrach cieplnych (dolna wartość opałowa gazu wynosi 3-5 MJ/m 3).
Podczas spalania gazu wielkopiecowego maksymalna temperatura produktów spalania (bez uwzględnienia strat ciepła i zużycia ciepła na dysocjację CO 2 i H 2 O) wynosi 400-1500 0 C. Jeśli gaz i powietrze zostaną podgrzane przed spalaniem , temperatura produktów spalania może znacznie wzrosnąć.
Gaz żelazostopowy powstaje podczas wytapiania żelazostopów w piecach redukcyjnych rudy. Gaz wydobywający się z zamknięte piekarniki, może być wykorzystany jako paliwo SER (wtórne źródła energii). W piecach otwartych, dzięki swobodnemu dostępowi powietrza, gaz spala się górą. Wydajność i skład gazu żelazostopowego zależy od gatunku wytopu
stop, skład wsadu, tryb pracy pieca, jego moc itp. Skład gazu: 50-90% CO, 2-8% H2, 0,3-1% CH4, O2<1%, 2-5% CO 2 , остальное N 2 . Максимальная температура продуктов сгорания равна 2080 ^0 C. Запылённость газа составляет 30-40 г/м^3 .
Gaz konwertorowy powstający podczas wytapiania stali w konwertorach tlenowych. Gaz składa się głównie z tlenku węgla, a jego wydajność i skład znacznie się różnią podczas wytapiania. Po oczyszczeniu skład gazu jest w przybliżeniu następujący: 70–80% CO; 15-20% CO2; 0,5-0,8% O2; 3-12% N 2. Ciepło spalania gazu wynosi 8,4-9,2 MJ/m 3. Maksymalna temperatura spalania osiąga 2000 0 C.
Gaz koksowy powstający podczas koksowania mieszanki węglowej. W hutnictwie żelaza stosuje się go po ekstrakcji produktów chemicznych. Skład gazu koksowniczego zależy od właściwości wsadu węglowego i warunków koksowania. Udziały objętościowe składników w gazie mieszczą się w następujących granicach,%: 52-62H 2 ; 0,3-0,6 O2; 23,5-26,5 CH4; 5,5-7,7 CO; 1,8-2,6 CO2. Ciepło spalania wynosi 17-17,6 MJ/m^3, maksymalna temperatura produktów spalania wynosi 2070 0 C.
Paliwo gazowe dzieli się na naturalne i sztuczne i jest mieszaniną gazów palnych i niepalnych, zawierającą pewną ilość pary wodnej, a czasami także pyłów i smoły. Ilość paliwa gazowego wyraża się w metrach sześciennych w warunkach normalnych (760 mm Hg i 0°C), a skład wyraża się w procentach objętościowych. Przez skład paliwa rozumie się skład jego suchej części gazowej.
Paliwo gazowe
Najpopularniejszym paliwem gazowym jest gaz ziemny, który charakteryzuje się wysoką wartością opałową. Podstawą gazu ziemnego jest metan, którego zawartość wynosi 76,7–98%. Inne gazowe związki węglowodorów obejmują gaz ziemny w ilości od 0,1 do 4,5%.
Gaz skroplony jest produktem rafinacji ropy naftowej – składa się głównie z mieszaniny propanu i butanu.
Gaz ziemny (CNG, NG): metan CH4 powyżej 90%, etan C2 H5 poniżej 4%, propan C3 H8 poniżej 1%
Gaz skroplony (LPG): propan C3 H8 powyżej 65%, butan C4 H10 poniżej 35%
W skład gazów palnych wchodzą: wodór H2, metan CH4, inne związki węglowodorowe CmHn, siarkowodór H2S i gazy niepalne, dwutlenek węgla CO2, tlen O2, azot N2 i niewielka ilość pary wodnej H2O M I P w C i H charakteryzują związki różnych węglowodorów, na przykład metanu CH 4 t = 1 i N= 4, dla etanu C 2 N b t = 2 I N= b itd.
Skład suchego paliwa gazowego (procent objętościowy):
CO + H 2 + 2 C m H n + H2S + CO2 + O2 + N2 = 100%.
Niepalna część suchego paliwa gazowego – balast – składa się z azotu N i dwutlenku węgla CO2.
Skład mokrego paliwa gazowego wyraża się następująco:
CO + H 2 + Σ C m H n + H2S + CO2 + O2 + N2 + H2O = 100%.
Ciepło spalania, kJ/m (kcal/m3), 1 m3 czystego suchego gazu w normalnych warunkach określa się w następujący sposób:
Q n s = 0,01,
gdzie Qso, Q n 2, Q c m n n Q n 2 S. - ciepło spalania poszczególnych gazów wchodzących w skład mieszaniny, kJ/m 3 (kcal/m 3); CO, H2, Cm H n, H 2 S - składniki tworzące mieszaninę gazów, % objętości.
Wartość opałowa 1 m3 suchego gazu ziemnego w normalnych warunkach dla większości krajowych złóż wynosi 33,29 - 35,87 MJ/m3 (7946 - 8560 kcal/m3). Charakterystykę paliwa gazowego podano w tabeli 1.
Przykład. Określ dolną wartość opałową gazu ziemnego (w normalnych warunkach) o następującym składzie:
H2S = 1%; CH4 = 76,7%; C2H6 = 4,5%; C3H8 = 1,7%; C4H10 = 0,8%; C5H12 = 0,6%.
Podstawiając charakterystyki gazów z tabeli 1 do wzoru (26) otrzymujemy:
Q ns = 0,01 = 33981 kJ/m 3 lub
Q ns = 0,01 (5585,1 + 8555 76,7 + 15 226 4,5 + 21 795 1,7 + 28 338 0,8 + 34 890 0,6) = 8109 kcal/m3.
Tabela 1. Charakterystyka paliwa gazowego
|
Gaz |
Przeznaczenie |
Ciepło spalania Q n s |
|
|
KJ/m3 |
Kcal/m3 |
||
| Wodór | N, | 10820 | 2579 |
| Tlenek węgla | WSPÓŁ | 12640 | 3018 |
| Siarkowodór | H2S | 23450 | 5585 |
| Metan | CH 4 | 35850 | 8555 |
| Etan | C 2 H 6 | 63 850 | 15226 |
| Propan | C 3 H 8 | 91300 | 21795 |
| Butan | C 4 H 10 | 118700 | 22338 |
| Pentan | C 5 H 12 | 146200 | 34890 |
| Etylen | C 2 H 4 | 59200 | 14107 |
| Propylen | C 3 H 6 | 85980 | 20541 |
| Butylen | C 4 H 8 | 113 400 | 27111 |
| Benzen | C 6 H 6 | 140400 | 33528 |
Kotły typu DE zużywają od 71 do 75 m3 gazu ziemnego do wytworzenia jednej tony pary. Koszt gazu w Rosji według stanu na wrzesień 2008 r. wynosi 2,44 rubla za metr sześcienny. Dlatego tona pary będzie kosztować 71 × 2,44 = 173 rubli 24 kopiejek. Rzeczywisty koszt tony pary w fabrykach wynosi dla kotłów DE nie mniej niż 189 rubli za tonę pary.
Kotły typu DKVR do wytworzenia jednej tony pary zużywają od 103 do 118 m3 gazu ziemnego. Minimalny szacunkowy koszt tony pary dla tych kotłów wynosi 103 × 2,44 = 251 rubli 32 kopiejek. Rzeczywisty koszt pary w fabrykach wynosi nie mniej niż 290 rubli za tonę.
Jak obliczyć maksymalne zużycie gazu ziemnego dla kotła parowego DE-25? To są parametry techniczne kotła. 1840 kostek na godzinę. Ale możesz też liczyć. 25 ton (25 tys. kg) należy pomnożyć przez różnicę entalpii pary i wody (666,9-105) i wszystko to podzielić przez sprawność kotła wynoszącą 92,8% i ciepło spalania gazu. 8300. i tyle
Sztuczne paliwo gazowe
Sztuczne gazy palne są paliwem o znaczeniu lokalnym, ponieważ mają znacznie niższą wartość opałową. Ich głównymi pierwiastkami palnymi są tlenek węgla CO i wodór H2. Gazy te wykorzystywane są na obszarze produkcyjnym, gdzie pozyskiwane są jako paliwo dla zakładów technologicznych i energetycznych.
Wszystkie naturalne i sztuczne gazy palne są wybuchowe i mogą zapalić się w otwartym płomieniu lub iskrze. Wyróżnia się dolną i górną granicę wybuchowości gazu, tj. jego najwyższe i najniższe procentowe stężenie w powietrzu. Dolna granica wybuchowości gazów ziemnych waha się od 3% do 6%, a górna granica – od 12% do 16%. Wszystkie gazy łatwopalne mogą powodować zatrucie organizmu człowieka. Głównymi substancjami toksycznymi gazów palnych są: tlenek węgla CO, siarkowodór H2S, amoniak NH3.
Gazy palne naturalne i sztuczne są bezbarwne (niewidoczne) i bezwonne, co czyni je niebezpiecznymi w przypadku przedostania się do wnętrza kotłowni przez nieszczelności armatury gazociągów. Aby uniknąć zatrucia, gazy łatwopalne należy traktować środkiem zapachowym - substancją o nieprzyjemnym zapachu.
Produkcja tlenku węgla CO w przemyśle poprzez zgazowanie paliwa stałego
Do celów przemysłowych tlenek węgla otrzymywany jest poprzez zgazowanie paliwa stałego, czyli przekształcenie go w paliwo gazowe. W ten sposób można uzyskać tlenek węgla z dowolnego paliwa stałego - węgla kopalnego, torfu, drewna opałowego itp.
W doświadczeniu laboratoryjnym przedstawiono proces zgazowania paliwa stałego (rys. 1). Po napełnieniu ogniotrwałej rurki kawałkami węgla drzewnego mocno ją podgrzewamy i pozwalamy na wypływ tlenu z gazometru. Gazy wydobywające się z rury przepuszczamy przez myjkę z wodą wapienną, a następnie podpalamy. Woda wapienna staje się mętna, a gaz pali się niebieskawym płomieniem. Wskazuje to na obecność dwutlenku CO2 i tlenku węgla CO w produktach reakcji.
Powstawanie tych substancji można wytłumaczyć faktem, że gdy tlen wchodzi w kontakt z gorącym węglem, ten ostatni najpierw utlenia się do dwutlenku węgla: C + O2 = CO2
Następnie, przechodząc przez rozżarzony węgiel, dwutlenek węgla ulega częściowej redukcji do tlenku węgla: CO2 + C = 2CO
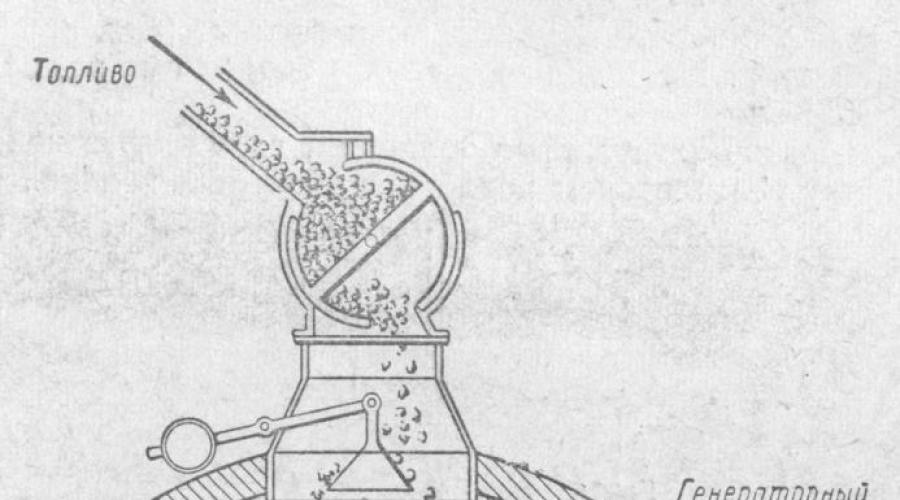
Ryż. 1. Produkcja tlenku węgla (doświadczenie laboratoryjne).
W warunkach przemysłowych zgazowanie paliwa stałego odbywa się w piecach zwanych generatorami gazu.
Powstała mieszanina gazów nazywana jest gazem generatorowym.
Urządzenie generujące gaz pokazano na rysunku. Jest to stalowy cylinder o wysokości około 5 M i średnicy około 3,5 M, wewnątrz wyłożony cegłami ogniotrwałymi. Generator gazu ładowany jest paliwem od góry; Od dołu powietrze lub para wodna dostarczane są za pomocą wentylatora poprzez ruszt.
Tlen zawarty w powietrzu reaguje z węglem zawartym w paliwie, tworząc dwutlenek węgla, który unosząc się przez warstwę gorącego paliwa jest redukowany przez węgiel do tlenku węgla.
Jeśli do generatora wdmuchuje się tylko powietrze, w rezultacie powstaje gaz zawierający tlenek węgla i azot z powietrza (a także pewną ilość CO 2 i innych zanieczyszczeń). Ten gaz generatorowy nazywany jest gazem powietrznym.
Jeśli do generatora wdmuchnie się parę wodną z rozżarzonym węglem, w wyniku reakcji powstanie tlenek węgla i wodór: C + H 2 O = CO + H 2
Ta mieszanina gazów nazywana jest gazem wodnym. Gaz wodny ma wyższą wartość opałową niż gaz powietrzny, gdyż w jego składzie oprócz tlenku węgla znajduje się także drugi gaz palny – wodór. Gaz wodny (gaz syntezowy), jeden z produktów zgazowania paliw. Gaz wodny składa się głównie z CO (40%) i H2 (50%). Gaz wodny jest paliwem (ciepło spalania 10 500 kJ/m3, czyli 2730 kcal/mg) i jednocześnie surowcem do syntezy alkoholu metylowego. Gazu wodnego nie można jednak wytwarzać przez długi czas, gdyż reakcja jego powstawania jest endotermiczna (z absorpcją ciepła), w związku z czym paliwo w generatorze ochładza się. Aby utrzymać węgiel w stanie gorącym, wtryskiwanie pary wodnej do generatora odbywa się na zmianę z wtryskiem powietrza, którego tlen reaguje z paliwem, uwalniając ciepło.
Ostatnio do zgazowania paliw powszechnie stosuje się podmuch pary i tlenu. Jednoczesne przedmuchiwanie pary wodnej i tlenu przez warstwę paliwa pozwala na ciągły przebieg procesu, znacznie zwiększając wydajność generatora i wytwarzając gaz o dużej zawartości wodoru i tlenku węgla.
Nowoczesne generatory gazu to potężne urządzenia o pracy ciągłej.
Aby zapobiec przedostawaniu się łatwopalnych i toksycznych gazów do atmosfery podczas dostarczania paliwa do generatora gazu, bęben ładujący jest podwójny. Podczas gdy paliwo dostaje się do jednego przedziału bębna, paliwo wlewa się do generatora z innego przedziału; gdy bęben się obraca, procesy te powtarzają się, ale generator pozostaje cały czas odizolowany od atmosfery. Równomierna dystrybucja paliwa w generatorze odbywa się za pomocą stożka, który można zainstalować na różnych wysokościach. Po opuszczeniu węgiel opada bliżej środka generatora, przy podniesieniu stożka węgiel jest wyrzucany bliżej ścianek generatora.
Usuwanie popiołu z generatora gazu jest zmechanizowane. Ruszt w kształcie stożka jest powoli obracany za pomocą silnika elektrycznego. W tym przypadku popiół przemieszcza się w stronę ścianek generatora i za pomocą specjalnych urządzeń wrzuca do popielnika, skąd jest okresowo usuwany.
Pierwsze lampy gazowe zapalono w Petersburgu na Wyspie Aptekarskiej w 1819 roku. Wykorzystywany gaz uzyskiwany był poprzez zgazowanie węgla. Nazywano go gazem oświetlającym.
Wielki rosyjski naukowiec D.I. Mendelejew (1834–1907) jako pierwszy wyraził pogląd, że zgazowanie węgla można przeprowadzić bezpośrednio pod ziemią, bez jego wydobywania. Rząd carski nie docenił tej propozycji Mendelejewa.
Ideę podziemnego zgazowania gorąco poparł W.I. Lenin. Nazwał to „jednym z największych zwycięstw technologii”. Podziemne zgazowanie zostało po raz pierwszy przeprowadzone przez państwo radzieckie. Już przed Wielką Wojną Ojczyźnianą podziemne generatory działały w zagłębiach węglowych obwodu donieckiego i moskiewskiego w Związku Radzieckim.
Ideę jednej z metod podziemnego zgazowania przedstawiono na rysunku 3. W pokład węgla wkopane są dwa odwierty, które od dołu połączone są kanałem. W takim kanale w pobliżu jednego ze studni rozpala się węgiel i tam dostarcza się podmuch. Produkty spalania przemieszczając się wzdłuż kanału wchodzą w interakcję z gorącym węglem, w wyniku czego powstaje gaz palny jak w konwencjonalnym generatorze. Gaz wydobywa się na powierzchnię drugim odwiertem.
Gaz generatorowy znajduje szerokie zastosowanie do ogrzewania pieców przemysłowych – hutniczych, koksowniczych oraz jako paliwo w samochodach (rys. 4).
Ryż. 3. Schemat podziemnego zgazowania węgla.
Wiele produktów organicznych, takich jak paliwa płynne, syntetyzuje się z wodoru i tlenku węgla w gazie wodnym. Syntetyczne paliwo ciekłe to paliwo (głównie benzyna) otrzymywane w wyniku syntezy tlenku węgla i wodoru w temperaturze 150-170 stopni Celsjusza i pod ciśnieniem 0,7 - 20 MN/m2 (200 kgf/cm2), w obecności katalizatora (niklu, żelazo, kobalt). Pierwszą produkcję syntetycznego paliwa ciekłego zorganizowano w Niemczech podczas II wojny światowej z powodu niedoborów ropy. Syntetyczne paliwo ciekłe nie jest powszechnie stosowane ze względu na wysoki koszt. Do produkcji wodoru wykorzystuje się gaz wodny. W tym celu gaz wodny zmieszany z parą wodną podgrzewa się w obecności katalizatora, w wyniku czego oprócz tego, który jest już obecny w gazie wodnym, otrzymuje się wodór: CO + H 2 O = CO 2 + H 2
5.BILANS TERMICZNY SPALANIA
Rozważmy metody obliczania bilansu cieplnego procesu spalania paliw gazowych, ciekłych i stałych. Obliczenia sprowadzają się do rozwiązania następujących problemów.
· Oznaczanie ciepła spalania (wartości opałowej) paliwa.
· Wyznaczanie teoretycznej temperatury spalania.
5.1. CIEPŁO SPALANIA
Reakcjom chemicznym towarzyszy wydzielanie lub absorpcja ciepła. Kiedy ciepło jest uwalniane, reakcję nazywamy egzotermiczną, a gdy ciepło jest absorbowane, nazywamy ją endotermiczną. Wszystkie reakcje spalania są egzotermiczne, a produkty spalania są związkami egzotermicznymi.
Ciepło uwolnione (lub pochłonięte) podczas reakcji chemicznej nazywane jest ciepłem reakcji. W reakcjach egzotermicznych jest dodatni, w reakcjach endotermicznych jest ujemny. Reakcji spalania zawsze towarzyszy wydzielanie ciepła. Ciepło spalania Q g(J/mol) to ilość ciepła wydzielana podczas całkowitego spalania jednego mola substancji i przemiany substancji palnej w produkty całkowitego spalania. Mol jest podstawową jednostką ilości substancji w układzie SI. Jeden mol to ilość substancji zawierająca taką samą liczbę cząstek (atomów, cząsteczek itp.), ile atomów znajduje się w 12 g izotopu węgla-12. Masa ilości substancji równej 1 molowi (masa cząsteczkowa lub molowa) pokrywa się liczbowo ze względną masą cząsteczkową tej substancji.
Na przykład względna masa cząsteczkowa tlenu (O2) wynosi 32, dwutlenku węgla (CO2) wynosi 44, a odpowiednie masy cząsteczkowe będą wynosić M = 32 g/mol i M = 44 g/mol. Zatem jeden mol tlenu zawiera 32 gramy tej substancji, a jeden mol CO2 zawiera 44 gramy dwutlenku węgla.
W obliczeniach technicznych to nie ciepło spalania jest najczęściej wykorzystywane. Q g oraz wartość opałowa paliwa Q(J/kg lub J/m 3). Wartość opałowa substancji to ilość ciepła wydzielona podczas całkowitego spalenia 1 kg lub 1 m 3 substancji. W przypadku substancji ciekłych i stałych obliczenia przeprowadza się na 1 kg, a dla substancji gazowych - na 1 m 3.
Znajomość ciepła spalania i wartości opałowej paliwa jest konieczna do obliczenia temperatury spalania lub wybuchu, ciśnienia wybuchu, prędkości rozprzestrzeniania się płomienia i innych parametrów. Wartość opałową paliwa określa się doświadczalnie lub metodą obliczeniową. Przy doświadczalnym wyznaczaniu wartości opałowej daną masę paliwa stałego lub ciekłego spala się w bombie kalorymetrycznej, a w przypadku paliwa gazowego w kalorymetrze gazowym. Przyrządy te mierzą całkowite ciepło Q 0 wydzielający się podczas spalania próbki paliwa naważanej M. Wartość opałowa Q g znajduje się ze wzoru
Związek pomiędzy ciepłem spalania i
wartość kaloryczna paliwa
Aby ustalić związek między ciepłem spalania a wartością opałową substancji, należy zapisać równanie reakcji chemicznej spalania.
Produktem całkowitego spalania węgla jest dwutlenek węgla:
C+O2 →CO2.
Produktem całkowitego spalenia wodoru jest woda:
2H 2 + O 2 → 2H 2 O.
Produktem całkowitego spalania siarki jest dwutlenek siarki:
S +O 2 →SO 2.
W tym przypadku azot, halogeny i inne niepalne pierwiastki uwalniają się w postaci wolnej.
Substancja palna – gaz
Jako przykład obliczmy wartość opałową metanu CH 4, dla którego ciepło spalania jest równe Q g=882.6 .
· Wyznaczmy masę cząsteczkową metanu zgodnie z jego wzorem chemicznym (CH 4):
M=1∙12+4∙1=16 g/mol.
· Ustalmy wartość opałową 1 kg metanu:
· Znajdźmy objętość 1 kg metanu, znając jego gęstość ρ=0,717 kg/m3 w normalnych warunkach:
 .
.
· Ustalmy wartość opałową 1 m 3 metanu:
W podobny sposób określa się wartość opałową wszelkich gazów palnych. W przypadku wielu powszechnych substancji ciepło spalania i wartości opałowe zostały zmierzone z dużą dokładnością i podane w odpowiedniej literaturze przedmiotu. Oto tabela wartości opałowych niektórych substancji gazowych (tabela 5.1). Ogrom Q w tej tabeli podano w MJ/m 3 i kcal/m 3, ponieważ 1 kcal = 4,1868 kJ jest często używany jako jednostka ciepła.
Tabela 5.1
Wartość opałowa paliw gazowych
|
Substancja |
Acetylen |
|||||
|
Q |
||||||
Substancja palna - ciekła lub stała
Jako przykład obliczmy wartość opałową alkoholu etylowego C 2 H 5 OH, dla którego ciepło spalania wynosi Q g= 1373,3 kJ/mol.
· Wyznaczmy masę cząsteczkową alkoholu etylowego zgodnie z jego wzorem chemicznym (C 2 H 5 OH):
M = 2∙12 + 5∙1 + 1∙16 + 1∙1 = 46 g/mol.
Określmy wartość opałową 1 kg alkoholu etylowego:
W podobny sposób określa się wartość opałową wszelkich materiałów palnych w postaci ciekłej i stałej. W tabeli Rysunki 5.2 i 5.3 przedstawiają wartości opałowe Q(MJ/kg i kcal/kg) dla niektórych cieczy i ciał stałych.
Tabela 5.2
Wartość opałowa paliw ciekłych
|
Substancja |
Alkohol metylowy |
Etanol |
Olej opałowy, olej |
||||
|
Q |
|||||||
Tabela 5.3
Wartość opałowa paliw stałych
|
Substancja |
Drzewo jest świeże |
Suche drewno |
brązowy węgiel |
Suchy torf |
Antracyt, koks |
||
|
Q |
|||||||
Wzór Mendelejewa
Jeżeli wartość opałowa paliwa nie jest znana, można ją obliczyć korzystając ze wzoru empirycznego zaproponowanego przez D.I. Mendelejew. Aby to zrobić, musisz znać skład pierwiastkowy paliwa (równoważny wzór paliwa), czyli procentową zawartość w nim następujących pierwiastków:
Tlen (O);
Wodór (H);
Węgiel (C);
Siarka (S);
Popiół (A);
Woda (W).
Produkty spalania paliwa zawsze zawierają parę wodną, która powstaje zarówno w wyniku obecności wilgoci w paliwie, jak i podczas spalania wodoru. Produkty spalania odpadów opuszczają zakład przemysłowy w temperaturze wyższej od punktu rosy. Dlatego też ciepło wydzielające się podczas kondensacji pary wodnej nie może być użytecznie wykorzystane i nie powinno być brane pod uwagę w obliczeniach cieplnych.
Do obliczeń zwykle używa się wartości opałowej netto Q rz paliwo, które uwzględnia straty ciepła z parą wodną. Dla paliw stałych i ciekłych wartość Q rz(MJ/kg) określa się w przybliżeniu za pomocą wzoru Mendelejewa:
Q rz=0.339+1.025+0.1085 – 0.1085 – 0.025, (5.1)
gdzie w nawiasach podano procentową (wagową) zawartość odpowiednich pierwiastków w składzie paliwa.
Wzór ten uwzględnia ciepło egzotermicznych reakcji spalania węgla, wodoru i siarki (ze znakiem plus). Tlen zawarty w paliwie częściowo zastępuje tlen w powietrzu, dlatego odpowiedni wyraz we wzorze (5.1) należy przyjmować ze znakiem minus. Kiedy wilgoć wyparowuje, zużywane jest ciepło, dlatego odpowiedni termin zawierający W jest również przyjmowany ze znakiem minus.
Porównanie danych obliczonych i doświadczalnych dotyczących wartości opałowej różnych paliw (drewno, torf, węgiel, olej) wykazało, że obliczenia przy użyciu wzoru Mendelejewa (5.1) dają błąd nie przekraczający 10%.
Wartosc kaloryczna netto Q rz(MJ/m3) suchych gazów palnych można obliczyć z wystarczającą dokładnością jako sumę iloczynów wartości opałowej poszczególnych składników i ich procentowej zawartości w 1 m3 paliwa gazowego.
Q rz= 0,108[Н 2 ] + 0,126[СО] + 0,358[СН 4 ] + 0,5[С 2 Н 2 ] + 0,234[Н 2 S ]…, (5,2)
gdzie w nawiasach podano procentową (objętościową) zawartość odpowiednich gazów w mieszaninie.
Średnia wartość opałowa gazu ziemnego wynosi około 53,6 MJ/m 3 . W sztucznie wytwarzanych gazach palnych zawartość metanu CH4 jest nieznaczna. Głównymi składnikami palnymi są wodór H2 i tlenek węgla CO. Przykładowo w gazie koksowniczym zawartość H2 sięga (55 ÷ 60)%, a dolna wartość opałowa takiego gazu sięga 17,6 MJ/m3. Gaz generatorowy zawiera CO ~ 30% i H 2 ~ 15%, natomiast niższa wartość opałowa gazu generatorowego wynosi Q rz= (5,2 6,5) MJ/m3. Zawartość CO i H 2 w gazie wielkopiecowym jest niższa; ogrom Q rz= (4,0 4,2) MJ/m 3.
Spójrzmy na przykłady obliczania wartości opałowej substancji za pomocą wzoru Mendelejewa.
Określmy wartość opałową węgla, którego skład pierwiastkowy podano w tabeli. 5.4.
Tabela 5.4
Skład pierwiastkowy węgla
· Zastąpmy podane w tabeli. 5.4 dane we wzorze Mendelejewa (5.1) (azot N i popiół A nie są uwzględnione w tym wzorze, ponieważ są substancjami obojętnymi i nie biorą udziału w reakcji spalania):
Q rz=0,339∙37,2+1,025∙2,6+0,1085∙0,6–0,1085∙12–0,025∙40=13,04 MJ/kg.
Obliczmy ilość drewna opałowego potrzebną do ogrzania 50 litrów wody od 10°C do 100°C, jeżeli na ogrzanie zużyjemy 5% ciepła powstałego podczas spalania oraz pojemność cieplną wody Z=1 kcal/(kg∙deg) lub 4,1868 kJ/(kg∙deg). Skład pierwiastkowy drewna opałowego podano w tabeli. 5,5:
Tabela 5.5
Skład pierwiastkowy drewna opałowego
|
· Obliczmy wartość opałową drewna opałowego, korzystając ze wzoru Mendelejewa (5.1): Q rz=0,339∙43+1,025∙7–0,1085∙41–0,025∙7= 17,12 MJ/kg. · Obliczmy ilość ciepła wydatkowanego na podgrzanie wody przy spalaniu 1 kg drewna opałowego (biorąc pod uwagę fakt, że na jej ogrzanie przypada 5% ciepła (a = 0,05) wydzielonego podczas spalania): Q 2 = a Q rz=0,05·17,12=0,86 MJ/kg. · Ustalmy ilość drewna opałowego potrzebną do podgrzania 50 litrów wody od 10°C do 100°C:
Zatem do podgrzania wody potrzeba około 22 kg drewna opałowego. |
W tabelach przedstawiono masowe ciepło właściwe spalania paliw (ciekłych, stałych i gazowych) oraz niektórych innych materiałów palnych. Brano pod uwagę następujące paliwa: węgiel, drewno opałowe, koks, torf, nafta, olej, alkohol, benzyna, gaz ziemny itp.
Wykaz tabel:
Podczas egzotermicznej reakcji utleniania paliwa jego energia chemiczna zamieniana jest na energię cieplną z wydzieleniem określonej ilości ciepła. Powstałą energię cieplną nazywa się zwykle ciepłem spalania paliwa. Zależy to od jego składu chemicznego, wilgotności i jest najważniejsze. Ciepło spalania paliwa na 1 kg masy lub 1 m3 objętości tworzy masowe lub objętościowe ciepło właściwe spalania.
Ciepło właściwe spalania paliwa to ilość ciepła wydzielana podczas całkowitego spalania jednostkowej masy lub objętości paliwa stałego, ciekłego lub gazowego. W międzynarodowym układzie jednostek wartość tę mierzy się w J/kg lub J/m 3.
Ciepło właściwe spalania paliwa można wyznaczyć eksperymentalnie lub obliczyć analitycznie. Eksperymentalne metody wyznaczania wartości opałowej opierają się na praktycznym pomiarze ilości ciepła wydzielanego podczas spalania paliwa, np. w kalorymetrze z termostatem i bombą spalinową. Dla paliwa o znanym składzie chemicznym ciepło właściwe spalania można wyznaczyć za pomocą wzoru okresowego.
Wyróżnia się wyższe i niższe ciepło właściwe spalania. Wyższa wartość opałowa jest równa maksymalnej ilości ciepła wydzielonego podczas całkowitego spalania paliwa, biorąc pod uwagę ciepło oddane na odparowanie wilgoci zawartej w paliwie. Najniższe ciepło spalania jest mniejsze od najwyższej wartości o ilość ciepła kondensacji, które powstaje z wilgoci paliwa i wodoru z masy organicznej, która podczas spalania zamienia się w wodę.
Aby określić wskaźniki jakości paliwa, a także w obliczeniach termicznych zwykle wykorzystują niższe ciepło właściwe spalania, która jest najważniejszą charakterystyką cieplną i eksploatacyjną paliwa, przedstawioną w poniższych tabelach.
Ciepło właściwe spalania paliw stałych (węgiel, drewno opałowe, torf, koks)
W tabeli przedstawiono wartości ciepła właściwego spalania suchego paliwa stałego w wymiarze MJ/kg. Paliwa w tabeli ułożone są według nazw w kolejności alfabetycznej.
Spośród rozpatrywanych paliw stałych największą wartość opałową posiada węgiel koksowy – jego ciepło właściwe spalania wynosi 36,3 MJ/kg (w jednostkach SI 36,3·10 6 J/kg). Ponadto wysoką wartością opałową charakteryzują się węgiel kamienny, antracyt, węgiel drzewny i węgiel brunatny.
Paliwa o niskiej efektywności energetycznej obejmują drewno, drewno opałowe, proch strzelniczy, torf mielony i łupki bitumiczne. Przykładowo ciepło właściwe spalania drewna opałowego wynosi 8,4...12,5, a prochu zaledwie 3,8 MJ/kg.
| Paliwo | |
|---|---|
| Antracyt | 26,8…34,8 |
| Pelety drzewne (pelety) | 18,5 |
| Suche drewno opałowe | 8,4…11 |
| Suche drewno opałowe brzozowe | 12,5 |
| Koks gazowy | 26,9 |
| Wysadzić koks | 30,4 |
| Pół-koks | 27,3 |
| Proszek | 3,8 |
| Łupek | 4,6…9 |
| Łupki naftowe | 5,9…15 |
| Stałe paliwo rakietowe | 4,2…10,5 |
| Torf | 16,3 |
| Włóknisty torf | 21,8 |
| Torf mielony | 8,1…10,5 |
| Okruchy torfu | 10,8 |
| brązowy węgiel | 13…25 |
| Węgiel brunatny (brykiety) | 20,2 |
| Węgiel brunatny (pył) | 25 |
| Doniecki węgiel | 19,7…24 |
| Węgiel drzewny | 31,5…34,4 |
| Węgiel | 27 |
| Węgiel koksujący | 36,3 |
| Węgiel Kuźnieck | 22,8…25,1 |
| Węgiel Czelabińska | 12,8 |
| Węgiel Ekibastuz | 16,7 |
| Frestorf | 8,1 |
| Żużel | 27,5 |
Ciepło właściwe spalania paliw ciekłych (alkoholu, benzyny, nafty, oleju)
Podano tabelę ciepła właściwego spalania paliwa ciekłego i niektórych innych cieczy organicznych. Należy zauważyć, że paliwa takie jak benzyna, olej napędowy i olej charakteryzują się dużym wydzielaniem ciepła podczas spalania.
Ciepło właściwe spalania alkoholu i acetonu jest znacznie niższe niż w przypadku tradycyjnych paliw silnikowych. Ponadto ciekłe paliwo rakietowe ma stosunkowo niską wartość opałową i przy całkowitym spaleniu 1 kg tych węglowodorów wydziela się ilość ciepła odpowiednio 9,2 i 13,3 MJ.
| Paliwo | Ciepło właściwe spalania, MJ/kg |
|---|---|
| Aceton | 31,4 |
| Benzyna A-72 (GOST 2084-67) | 44,2 |
| Benzyna lotnicza B-70 (GOST 1012-72) | 44,1 |
| Benzyna AI-93 (GOST 2084-67) | 43,6 |
| Benzen | 40,6 |
| Zimowy olej napędowy (GOST 305-73) | 43,6 |
| Letni olej napędowy (GOST 305-73) | 43,4 |
| Płynne paliwo rakietowe (nafta + ciekły tlen) | 9,2 |
| Nafta lotnicza | 42,9 |
| Nafta do oświetlenia (GOST 4753-68) | 43,7 |
| Ksylen | 43,2 |
| Olej opałowy o wysokiej zawartości siarki | 39 |
| Olej opałowy o niskiej zawartości siarki | 40,5 |
| Olej opałowy o niskiej zawartości siarki | 41,7 |
| Siarkowy olej opałowy | 39,6 |
| Alkohol metylowy (metanol) | 21,1 |
| Alkohol n-butylowy | 36,8 |
| Olej | 43,5…46 |
| Olej metanowy | 21,5 |
| Toluen | 40,9 |
| benzyna lakowa (GOST 313452) | 44 |
| Glikol etylenowy | 13,3 |
| Alkohol etylowy (etanol) | 30,6 |
Ciepło właściwe spalania paliw gazowych i gazów palnych
W tabeli przedstawiono ciepło właściwe spalania paliwa gazowego i niektórych innych gazów palnych w wymiarze MJ/kg. Spośród rozpatrywanych gazów ma on najwyższe masowe ciepło właściwe spalania. Całkowite spalenie jednego kilograma tego gazu spowoduje wydzielenie 119,83 MJ ciepła. Paliwo takie jak gaz ziemny charakteryzuje się także wysoką wartością opałową – ciepło właściwe spalania gazu ziemnego wynosi 41...49 MJ/kg (dla gazu czystego wynosi 50 MJ/kg).
| Paliwo | Ciepło właściwe spalania, MJ/kg |
|---|---|
| 1-buten | 45,3 |
| Amoniak | 18,6 |
| Acetylen | 48,3 |
| Wodór | 119,83 |
| Wodór, mieszanina z metanem (50% H 2 i 50% CH 4 wagowo) | 85 |
| Wodór, mieszanina metanu i tlenku węgla (33-33-33% wag.) | 60 |
| Wodór, mieszanina z tlenkiem węgla (50% H 2 50% CO 2 wagowo) | 65 |
| Gaz wielkopiecowy | 3 |
| Gaz koksowniczy | 38,5 |
| Skroplony gaz węglowodorowy LPG (propan-butan) | 43,8 |
| Izobutan | 45,6 |
| Metan | 50 |
| n-butan | 45,7 |
| n-heksan | 45,1 |
| n-Pentan | 45,4 |
| Powiązany gaz | 40,6…43 |
| Gazu ziemnego | 41…49 |
| Propadien | 46,3 |
| Propan | 46,3 |
| Propylen | 45,8 |
| Propylen, mieszanina z wodorem i tlenkiem węgla (90%-9%-1% wag.) | 52 |
| Etan | 47,5 |
| Etylen | 47,2 |
Ciepło właściwe spalania niektórych materiałów palnych
Podano tabelę ciepła właściwego spalania niektórych materiałów palnych (drewno, papier, plastik, słoma, guma itp.). Należy zwrócić uwagę na materiały wydzielające duże ciepło podczas spalania. Do takich materiałów zaliczają się: różnego rodzaju guma, styropian (pianka), polipropylen i polietylen.
| Paliwo | Ciepło właściwe spalania, MJ/kg |
|---|---|
| Papier | 17,6 |
| Skóra ekologiczna | 21,5 |
| Drewno (pręty o wilgotności 14%) | 13,8 |
| Drewno w stosach | 16,6 |
| Drewno dębowe | 19,9 |
| Drewno świerkowe | 20,3 |
| Drewno zielone | 6,3 |
| drewno sosnowe | 20,9 |
| Capron | 31,1 |
| Produkty karbolitowe | 26,9 |
| Karton | 16,5 |
| Kauczuk butadienowo-styrenowy SKS-30AR | 43,9 |
| Kauczuk naturalny | 44,8 |
| Kauczuk syntetyczny | 40,2 |
| Guma SKS | 43,9 |
| Kauczuk chloroprenowy | 28 |
| Linoleum z polichlorku winylu | 14,3 |
| Linoleum dwuwarstwowe z polichlorku winylu | 17,9 |
| Linoleum z polichlorku winylu na bazie filcu | 16,6 |
| Linoleum z polichlorku winylu na bazie ciepłego materiału | 17,6 |
| Linoleum na bazie polichlorku winylu | 20,3 |
| Linoleum gumowe (Relin) | 27,2 |
| Parafina parafina | 11,2 |
| Pianka PVC-1 | 19,5 |
| Tworzywo piankowe FS-7 | 24,4 |
| Tworzywo piankowe FF | 31,4 |
| Styropian PSB-S | 41,6 |
| Pianka poliuretanowa | 24,3 |
| Płyta pilśniowa | 20,9 |
| Polichlorek winylu (PVC) | 20,7 |
| Poliwęglan | 31 |
| Polipropylen | 45,7 |
| Polistyren | 39 |
| Polietylen wysokociśnieniowy | 47 |
| Polietylen niskociśnieniowy | 46,7 |
| Guma | 33,5 |
| Ruberoid | 29,5 |
| Sadza kanałowa | 28,3 |
| Siano | 16,7 |
| Słoma | 17 |
| Szkło organiczne (pleksi) | 27,7 |
| Tekstolit | 20,9 |
| Toł | 16 |
| TNT | 15 |
| Bawełna | 17,5 |
| Celuloza | 16,4 |
| Wełna i włókna wełniane | 23,1 |
Źródła:
- GOST 147-2013 Stałe paliwo mineralne. Wyznaczanie wyższej wartości opałowej i obliczanie dolnej wartości opałowej.
- GOST 21261-91 Produkty naftowe. Metoda wyznaczania wyższej wartości opałowej i obliczania dolnej wartości opałowej.
- GOST 22667-82 Naturalne gazy łatwopalne. Metoda obliczeniowa służąca do wyznaczania wartości opałowej, gęstości względnej i liczby Wobbego.
- GOST 31369-2008 Gaz ziemny. Obliczanie wartości opałowej, gęstości, gęstości względnej i liczby Wobbego na podstawie składu składników.
- Zemsky G. T. Palne właściwości materiałów nieorganicznych i organicznych: książka referencyjna M.: VNIIPO, 2016 - 970 s.
Co to jest paliwo?
Jest to jeden składnik lub mieszanina substancji zdolnych do przemian chemicznych związanych z wydzielaniem ciepła. Poszczególne rodzaje paliw różnią się ilościową zawartością utleniacza, który służy do uwolnienia energii cieplnej.
W szerokim znaczeniu paliwo jest nośnikiem energii, czyli potencjalnym rodzajem energii potencjalnej.
Klasyfikacja
Obecnie paliwa dzieli się ze względu na stan skupienia na ciekłe, stałe i gazowe.
Do naturalnych twardych materiałów zalicza się kamień, drewno opałowe i antracyt. Brykiety, koks, termoantracyt to rodzaje sztucznego paliwa stałego.
Do cieczy zalicza się substancje zawierające substancje pochodzenia organicznego. Ich głównymi składnikami są: tlen, węgiel, azot, wodór, siarka. Sztucznym paliwem ciekłym będą różne żywice i olej opałowy.
Jest to mieszanina różnych gazów: etylenu, metanu, propanu, butanu. Oprócz nich paliwo gazowe zawiera dwutlenek i tlenek węgla, siarkowodór, azot, parę wodną i tlen.

Wskaźniki paliwa
Główny wskaźnik spalania. Wzór na określenie wartości opałowej rozważany jest w termochemii. emitują „paliwo standardowe”, co implikuje wartość opałową 1 kilograma antracytu.
Domowy olej opałowy przeznaczony jest do spalania w urządzeniach grzewczych małej mocy znajdujących się w pomieszczeniach mieszkalnych, kotłach wykorzystywanych w rolnictwie do suszenia pasz, konserwowania.
Ciepło właściwe spalania paliwa jest wielkością obrazującą ilość ciepła, jaka powstaje podczas całkowitego spalenia paliwa o objętości 1 m 3 lub masie jednego kilograma.
Do pomiaru tej wartości stosuje się J/kg, J/m3 i kalorie/m3. Aby określić ciepło spalania, stosuje się metodę kalorymetrii.
Wraz ze wzrostem ciepła właściwego spalania paliwa, specyficzne zużycie paliwa maleje, a wydajność pozostaje niezmieniona.
Ciepło spalania substancji to ilość energii uwalnianej podczas utleniania substancji stałej, ciekłej lub gazowej.
Zależy to od składu chemicznego, a także stanu skupienia substancji palnej.

Cechy produktów spalania
Wyższe i niższe wartości opałowe związane są ze stanem skupienia wody w substancjach uzyskanych po spaleniu paliwa.
Wyższa wartość opałowa to ilość ciepła wydzielanego podczas całkowitego spalania substancji. Do tej wartości zalicza się także ciepło kondensacji pary wodnej.
Najniższe robocze ciepło spalania to wartość odpowiadająca wydzieleniu ciepła podczas spalania bez uwzględnienia ciepła skraplania pary wodnej.
Utajone ciepło kondensacji to ilość energii kondensacji pary wodnej.

Związek matematyczny
Wyższe i niższe wartości kaloryczne powiązane są następującą zależnością:
QB = QH + k(W + 9H)
gdzie W oznacza zawartość wagową (w %) wody w substancji palnej;
H to ilość wodoru (% masowych) w substancji palnej;
k - współczynnik równy 6 kcal/kg

Metody wykonywania obliczeń
Wyższą i niższą wartość opałową określa się dwiema głównymi metodami: obliczeniową i eksperymentalną.
Kalorymetry służą do wykonywania obliczeń eksperymentalnych. Najpierw spala się w nim próbkę paliwa. Wydzielone ciepło jest całkowicie pochłaniane przez wodę. Mając pojęcie o masie wody, na podstawie zmiany jej temperatury można określić wartość ciepła spalania.
Technika ta jest uważana za prostą i skuteczną; wymaga jedynie znajomości danych analizy technicznej.
W metodzie obliczeniowej wyższe i niższe wartości kaloryczne oblicza się za pomocą wzoru Mendelejewa.
Q p H = 339C p +1030H p -109(O p -S p) - 25 W p (kJ/kg)
Uwzględnia zawartość węgla, tlenu, wodoru, pary wodnej, siarki w kompozycji roboczej (w procentach). Ilość ciepła powstałego podczas spalania określa się biorąc pod uwagę paliwo równoważne.
Ciepło spalania gazu pozwala na wstępne obliczenia i określenie efektywności wykorzystania danego rodzaju paliwa.

Cechy pochodzenia
Aby zrozumieć, ile ciepła wydziela się podczas spalania określonego paliwa, należy mieć pojęcie o jego pochodzeniu.
W przyrodzie występują różne wersje paliw stałych, które różnią się składem i właściwościami.
Jego powstawanie przebiega w kilku etapach. Najpierw powstaje torf, następnie uzyskuje się węgiel brunatny i kamienny, a następnie antracyt. Głównymi źródłami paliwa stałego są liście, drewno i igły sosnowe. Kiedy części roślin obumierają i są wystawione na działanie powietrza, są niszczone przez grzyby i tworzą torf. Jego nagromadzenie zamienia się w brązową masę, po czym powstaje brązowy gaz.
Pod wysokim ciśnieniem i temperaturą gaz brunatny zamienia się w węgiel, po czym paliwo gromadzi się w postaci antracytu.
Oprócz materii organicznej paliwo zawiera dodatkowy balast. Za organiczną uważa się tę część, która jest utworzona z substancji organicznych: wodoru, węgla, azotu, tlenu. Oprócz tych pierwiastków chemicznych zawiera balast: wilgoć, popiół.
Technologia spalania polega na oddzieleniu masy roboczej, suchej i palnej spalonego paliwa. Masa robocza to paliwo w oryginalnej postaci dostarczone konsumentowi. Sucha masa to kompozycja, w której nie ma wody.

Mieszanina
Najcenniejszymi składnikami są węgiel i wodór.
Pierwiastki te zawarte są w każdym rodzaju paliwa. W torfie i drewnie zawartość węgla sięga 58 proc., w węglu kamiennym i brunatnym – 80 proc., a w antracycie sięga 95 proc. wagowo. W zależności od tego wskaźnika zmienia się ilość ciepła wydzielanego podczas spalania paliwa. Wodór jest drugim najważniejszym pierwiastkiem każdego paliwa. Wiążąc się z tlenem tworzy wilgoć, która znacząco obniża wartość cieplną każdego paliwa.
Jego zawartość procentowa waha się od 3,8 w łupkach bitumicznych do 11 w oleju opałowym. Tlen zawarty w paliwie pełni rolę balastu.
Nie jest pierwiastkiem chemicznym wytwarzającym ciepło, dlatego negatywnie wpływa na wartość ciepła jego spalania. Spalanie azotu, zawartego w produktach spalania w formie wolnej lub związanej, zaliczane jest do szkodliwych zanieczyszczeń, dlatego jego ilość jest wyraźnie ograniczona.
Siarka zawarta jest w paliwie w postaci siarczanów, siarczków, a także w postaci gazowego dwutlenku siarki. Po uwodnieniu tlenki siarki tworzą kwas siarkowy, który niszczy urządzenia kotłowe i negatywnie wpływa na roślinność i organizmy żywe.
Dlatego siarka jest pierwiastkiem chemicznym, którego obecność w paliwie naturalnym jest wyjątkowo niepożądana. Jeżeli związki siarki dostaną się do obszaru pracy, powodują znaczne zatrucie personelu obsługującego.
W zależności od pochodzenia wyróżnia się trzy rodzaje popiołu:
- podstawowy;
- wtórny;
- trzeciorzędowy
Gatunek pierwotny powstaje z minerałów występujących w roślinach. Popiół wtórny powstaje w wyniku przedostania się resztek roślinnych do piasku i gleby podczas ich powstawania.
Popiół trzeciorzędowy pojawia się w składzie paliwa podczas wydobycia, przechowywania i transportu. Przy znacznym osadzaniu się popiołu następuje zmniejszenie wymiany ciepła na powierzchni grzewczej kotła, zmniejszając ilość ciepła przekazywanego do wody z gazów. Ogromna ilość popiołu negatywnie wpływa na pracę kotła.
Wreszcie
Substancje lotne mają znaczący wpływ na proces spalania każdego rodzaju paliwa. Im większa jest ich moc, tym większa będzie objętość czoła płomienia. Łatwo zapalają się np. węgiel i torf, procesowi temu towarzyszą niewielkie straty ciepła. Koks pozostały po usunięciu lotnych zanieczyszczeń zawiera wyłącznie związki mineralne i węgiel. W zależności od właściwości paliwa ilość ciepła zmienia się znacząco.
W zależności od składu chemicznego wyróżnia się trzy etapy powstawania paliwa stałego: torf, węgiel brunatny i węgiel.
W małych instalacjach kotłowych stosuje się drewno naturalne. Wykorzystują głównie zrębki, trociny, płyty, korę, a samo drewno opałowe wykorzystuje się w niewielkich ilościach. W zależności od rodzaju drewna ilość wydzielanego ciepła znacznie się różni.
Wraz ze spadkiem ciepła spalania drewno opałowe zyskuje pewne zalety: szybką palność, minimalną zawartość popiołu i brak śladów siarki.
Rzetelna informacja o składzie paliwa naturalnego lub syntetycznego, jego wartości opałowej, to doskonały sposób na przeprowadzenie obliczeń termochemicznych.
Obecnie istnieje realna szansa na zidentyfikowanie głównych opcji paliw stałych, gazowych i ciekłych, które w określonej sytuacji będą najskuteczniejsze i najtańsze w zastosowaniu.
 kg.
kg.