Reakcje przywiązania. Rodzaje reakcji chemicznych w chemii organicznej Podział podstawników w pierścieniu benzenowym na dwa typy
Przeczytaj także
) wiązania innego związku chemicznego. Przystąpienie może odbywać się jako połączenie węgiel-węgiel i przez komunikację heteroatom węgla. Reakcje dodawania są oznaczone literami angielskimi "Ogłoszenie".
Ogólny widok reakcji addycji przez wiązanie węgiel-węgiel:
Ogólny widok reakcji addycji przez wiązanie węgiel-tlen:
Zwykle odczynnik, do którego następuje dodanie, nazywa się podłoże, i inni ( „X-Y”) - odczynnik ataku.
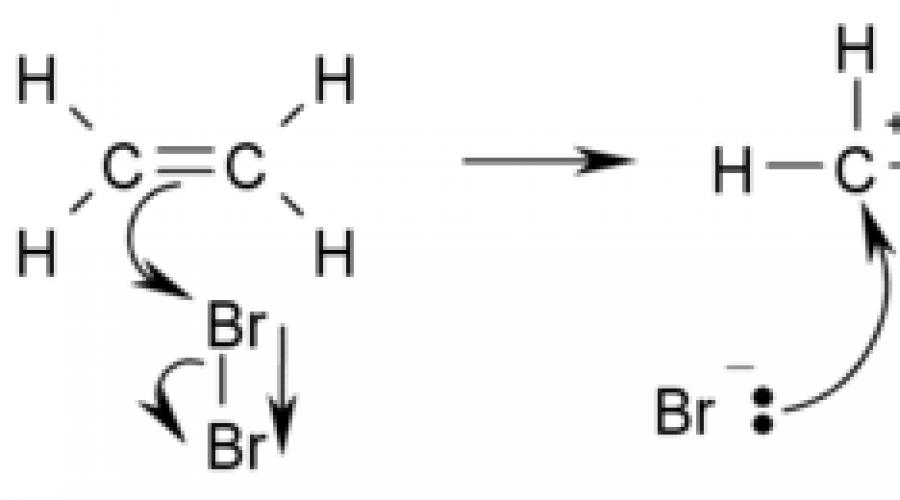
Przykładem reakcji addycji jest bromowanie etylenu:

Reakcje addycji są często odwracalne, w parze z reakcjami eliminacji, dlatego należy pamiętać, że mechanizm takiej „sparowanej” reakcji addycji i eliminacji jest powszechny.
W zależności od charakteru atakującej cząstki i mechanizmu reakcji rozróżnia się addycję nukleofilową, elektrofilową, rodnikową lub synchroniczną.
Reakcje addycji nukleofilowej
W reakcjach addycji nukleofilowej atakującą cząstką jest nukleofil, czyli cząstka naładowana ujemnie lub cząstka z wolną parą elektronów.
Ogólny widok reakcji addycji nukleofilowej:
Oznaczono reakcje addycji nukleofilowej „AdN”.
Reakcje addycji nukleofilowej na wiązaniu C=C są dość rzadkie, najbardziej rozpowszechnioną i praktyczną wartością jest połączenie przez połączenie C=O :
Wśród reakcji addycji nukleofilowej najczęstszym jest powyższy dwustopniowy mechanizm dwucząsteczkowy Ad N 2: Na początku nukleofil powoli dodaje wiązanie wielokrotne, tworząc karboanion, który w drugim etapie jest szybko atakowany przez gatunek elektrofilowy.
Reakcje addycji elektrofilowej
W reakcjach addycji elektrofilowej atakującą cząstką jest elektrofil, czyli cząstka naładowana dodatnio, najczęściej proton H+ lub cząstka z niedoborem elektronów.
Ogólny widok reakcji addycji elektrofilowej:
Oznaczono reakcje addycji elektrofilowej „Ad e”.
Reakcje addycji elektrofilowej są szeroko rozpowszechnione wśród reakcji węglowodorów nienasyconych: alkenów, alkinów i dienów.
Przykładem takich reakcji jest uwodnienie alkenów:
Wiązanie elektrofilowe heteroatom węgla jest również dość powszechny i najczęściej takie połączenie jest C=O:



Wśród reakcji addycji elektrofilowej najczęstszym jest powyższy dwustopniowy mechanizm bimolekularny Ad E 2: Na początku elektrofil powoli dodaje wiązanie wielokrotne, tworząc karbokation, który w drugim etapie ulega atakowi nukleofilowemu.
Radykalne reakcje addycyjne
W reakcjach addycji rodnikowej atakującymi gatunkami są wolne rodniki.
Oznaczono reakcje addycji rodnikowej „Reklama R”.
Reakcje addycji rodnikowej zwykle zachodzą zamiast reakcji addycji elektrofilowej w obecności źródła wolnych rodników:

Synchroniczne reakcje addycyjne
W niektórych przypadkach addycja przez wiązanie wielokrotne następuje z jednoczesnym atakiem obu atomów, co nie pozwala na określenie priorytetu ataku. Taki mechanizm nazywa się połączenie synchroniczne. Reakcje addycji synchronicznej prowadzą do powstania produktów cyklicznych, dlatego często nazywa się je cykloaddycja.
Uwagi
| Reakcje chemiczne w chemii organicznej | |
|---|---|
| Reakcje podstawienia | Reakcje podstawienia nukleofilowego Reakcje podstawienia elektrofilowego Reakcje podstawienia rodnikowego |
| Reakcje dodawania | Reakcje addycji nukleofilowej Reakcje addycji elektrofilowej Reakcje addycji rodnikowej Reakcje addycji jednoczesnej |
| Reakcje eliminacyjne | Reakcje eliminacji heterolitycznej Okołocykliczne reakcje eliminacji Reakcje eliminacji rodnikowej |
| reakcje rearanżacji | Rearanżacje nukleofilowe Rearanżacje elektrofilowe Rearanżacje radykalne |
| Reakcje utleniania i redukcji | Reakcje utleniania Reakcje redukcji |
| Inny | Reakcje nominalne w chemii organicznej |
Fundacja Wikimedia. 2010 .
Zobacz, jakie „Reakcje dodawania” znajdują się w innych słownikach:
addycyjny polimer reakcji- - PL Polimer addycyjny Polimer utworzony przez dodanie łańcuchowe cząsteczek nienasyconych monomerów, takich jak olefiny, ze sobą bez tworzenia produktu ubocznego, takiego jak woda;… … Podręcznik tłumacza technicznego
- (ang. addycja elektrofilowa reakcja) reakcje addycyjne, w których atak w początkowej fazie jest realizowany przez cząstkę elektrofilową, naładowaną dodatnio lub mającą deficyt elektronów. Na ostatnim etapie powstały ... ... Wikipedia
- (Angielski addycja nukleofilowa reakcja) reakcje addycji, w których atak na początkowym etapie jest przeprowadzany przez cząsteczkę nukleofilową, naładowaną ujemnie lub mającą wolną parę elektronów. Na ostatnim etapie powstały ... ... Wikipedia
- (ang. addycyjny reakcja rodnikowa) reakcje addycyjne, w których atak przeprowadzany jest przez wolne rodniki cząstki zawierającej jeden lub więcej niesparowanych elektronów. Jednocześnie radykałowie mogą atakować zarówno innych radykałów, jak i ... ... Wikipedia
Reakcje addycji, w których oba atomy wiązania wielokrotnego są atakowane jednocześnie. Inną nazwą dla tego typu reakcji są reakcje cykloaddycji, ponieważ produktami końcowymi takich reakcji są substraty cykliczne. Istnieją dwa ... ... Wikipedia
- (angielska reakcja substytucji nukleofilowej) reakcje substytucji, w których atak jest przeprowadzany przez odczynnik nukleofilowy niosący niewspólną parę elektronów. Grupa opuszczająca w reakcjach podstawienia nukleofilowego nazywana jest nukleofugą. Wszystko ... Wikipedia
Reakcje substancji organicznych można formalnie podzielić na cztery główne typy: substytucja, addycja, eliminacja (eliminacja) i rearanżacja (izomeryzacja). Oczywiście całej różnorodności reakcji związków organicznych nie da się sprowadzić do proponowanej klasyfikacji (np. reakcje spalania). Jednak taka klasyfikacja pomoże ustalić analogie do znanych ci już reakcji, które zachodzą między substancjami nieorganicznymi.
Z reguły nazywa się główny związek organiczny biorący udział w reakcji podłoże, a drugi składnik reakcji jest warunkowo uważany za odczynnik.
Reakcje podstawienia
Reakcje podstawienia- są to reakcje, które powodują zastąpienie jednego atomu lub grupy atomów w pierwotnej cząsteczce (substracie) innymi atomami lub grupami atomów.
Reakcje podstawienia obejmują związki nasycone i aromatyczne, takie jak alkany, cykloalkany lub areny. Podajmy przykłady takich reakcji.
Pod działaniem światła atomy wodoru w cząsteczce metanu można zastąpić atomami halogenu, na przykład atomami chloru:
Innym przykładem zastąpienia wodoru halogenem jest konwersja benzenu do bromobenzenu:

Równanie tej reakcji można zapisać inaczej:
![]()
W tej formie zapisu odczynniki, katalizator, warunki reakcji są zapisywane nad strzałką, a nieorganiczne produkty reakcji poniżej.
W wyniku reakcji powstają substytucje w substancjach organicznych, które nie są proste i złożone substancje, jak w chemii nieorganicznej i dwa złożone substancje.
Reakcje dodawania
Reakcje dodawania to reakcje, w których dwie lub więcej cząsteczek reagentów łączy się w jedną.
Związki nienasycone, takie jak alkeny lub alkiny, wchodzą w reakcje addycji. W zależności od tego, która cząsteczka działa jako odczynnik, rozróżnia się uwodornienie (lub redukcję), halogenowanie, hydrohalogenowanie, uwodnienie i inne reakcje addycji. Każdy z nich wymaga spełnienia określonych warunków.
1.Uwodornienie- reakcja dodawania cząsteczki wodoru do wiązania wielokrotnego:
2. Hydrohalogenowanie- reakcja addycji halogenowodoru (chlorowodorowanie):
3. Halogenacja- reakcja addycji halogenu:
![]()
4.Polimeryzacja- specjalny rodzaj reakcji addycji, podczas których cząsteczki substancji o małej masie cząsteczkowej łączą się ze sobą, tworząc cząsteczki substancji o bardzo dużej masie cząsteczkowej - makrocząsteczki.
Reakcje polimeryzacji to procesy łączenia wielu cząsteczek substancji o niskiej masie cząsteczkowej (monomeru) w duże cząsteczki (makrocząsteczki) polimeru.
Przykładem reakcji polimeryzacji jest wytwarzanie polietylenu z etylenu (etenu) pod działaniem promieniowania ultrafioletowego i rodnikowego inicjatora polimeryzacji R.
Wiązanie kowalencyjne najbardziej charakterystyczne dla związków organicznych powstaje, gdy orbitale atomowe zachodzą na siebie i tworzą się wspólne pary elektronów. W wyniku tego powstaje orbital wspólny dla dwóch atomów, na którym znajduje się wspólna para elektronów. Kiedy wiązanie zostanie zerwane, los tych wspólnych elektronów może być inny.
Rodzaje reaktywnych cząstek
Orbital z niesparowanym elektronem należącym do jednego atomu może nakładać się na orbital innego atomu, który również zawiera niesparowany elektron. W tym przypadku tworzenie wiązania kowalencyjnego następuje zgodnie z mechanizmem wymiany:
Mechanizm wymiany dla tworzenia wiązania kowalencyjnego jest realizowany, gdy wspólna para elektronów jest utworzona z niesparowanych elektronów należących do różnych atomów.
Procesem odwrotnym do tworzenia wiązania kowalencyjnego przez mechanizm wymiany jest zerwanie wiązania, w którym jeden elektron () trafia do każdego atomu. W rezultacie powstają dwie nienaładowane cząstki z niesparowanymi elektronami:
![]()
Takie cząstki nazywane są wolnymi rodnikami.
wolne rodniki- atomy lub grupy atomów o niesparowanych elektronach.
Reakcje wolnorodnikowe to reakcje zachodzące pod działaniem iz udziałem wolnych rodników.
W toku chemii nieorganicznej są to reakcje oddziaływania wodoru z tlenem, halogeny, reakcje spalania. Reakcje tego typu charakteryzują się dużą szybkością, wydzielaniem dużej ilości ciepła.
Wiązanie kowalencyjne może być również utworzone przez mechanizm donor-akceptor. Jeden z orbitali atomu (lub anionu), który zawiera niewspólną parę elektronów, nakłada się na niewypełniony orbital innego atomu (lub kationu), który ma niewypełniony orbital i powstaje wiązanie kowalencyjne, na przykład:
![]()
Zerwanie wiązania kowalencyjnego prowadzi do powstania cząstek naładowanych dodatnio i ujemnie (); ponieważ w tym przypadku oba elektrony ze wspólnej pary elektronowej pozostają przy jednym z atomów, drugi atom otrzymuje niewypełniony orbital:
![]()
Rozważ dysocjację elektrolityczną kwasów:
![]()
Łatwo można się domyślić, że cząstka posiadająca niepodzielną parę elektronów R: -, czyli jon naładowany ujemnie, będzie przyciągana do dodatnio naładowanych atomów lub do atomów, na których występuje przynajmniej częściowy lub efektywny ładunek dodatni.
Cząstki z niepodzielonymi parami elektronów są nazywane środki nukleofilowe (jądro- „jądro”, dodatnio naładowana część atomu), czyli „przyjaciele” jądra, ładunek dodatni.
Nukleofile(Nu) - aniony lub cząsteczki, które mają wolną parę elektronów, oddziałując z obszarami cząsteczek, na których koncentruje się skuteczny ładunek dodatni.
Przykłady nukleofili: Cl - (jon chlorkowy), OH - (anion wodorotlenkowy), CH 3 O - (anion metoksynowy), CH 3 COO - (anion octanowy).
Przeciwnie, cząstki, które mają niewypełniony orbital, będą miały tendencję do wypełniania go, a zatem będą przyciągane do obszarów cząsteczek, które mają zwiększoną gęstość elektronów, ładunek ujemny i niewspólną parę elektronów. Są to elektrofile, „przyjaciele” elektronu, o ładunku ujemnym lub cząsteczkach o zwiększonej gęstości elektronowej.
elektrofile- kationy lub cząsteczki, które mają niewypełniony orbital elektronowy, z tendencją do wypełniania go elektronami, ponieważ prowadzi to do korzystniejszej konfiguracji elektronowej atomu.
Nie każda cząsteczka jest elektrofilem z pustym orbitalem. Na przykład kationy metali alkalicznych mają konfigurację gazów obojętnych i nie mają tendencji do gromadzenia elektronów, ponieważ mają niską powinowactwo elektronowe.
Z tego możemy wywnioskować, że pomimo obecności niewypełnionego orbitalu takie cząstki nie będą elektrofilami.
Główne mechanizmy reakcji
Istnieją trzy główne typy reagujących cząstek - wolne rodniki, elektrofile, nukleofile - i trzy odpowiadające im typy mechanizmu reakcji:
- wolny rodnik;
- elektrofilowy;
- nullofilowy.
Oprócz klasyfikacji reakcji według rodzaju reagujących cząstek, chemia organiczna wyróżnia cztery typy reakcji zgodnie z zasadą zmiany składu cząsteczek: dodawanie, substytucję, eliminację lub eliminację (z angielskiego. do wyeliminować- usuń, oddziel) i przegrupuj. Ponieważ dodawanie i zastępowanie może zachodzić pod działaniem wszystkich trzech typów reaktywnych gatunków, kilka poważnymechanizmy reakcji.


Ponadto rozważ reakcje rozszczepiania lub eliminacji, które zachodzą pod wpływem cząstek nukleofilowych - zasad.
6. Eliminacja:
Charakterystyczną cechą alkenów (węglowodorów nienasyconych) jest zdolność do wchodzenia w reakcje addycyjne. Większość z tych reakcji przebiega zgodnie z mechanizmem addycji elektrofilowej.
Hydrohalogenowanie (dodatek halogenu) wodór):
Gdy halogenowodorek dodaje się do alkenu wodór jest dodawany do bardziej uwodornionego atom węgla, czyli atom, przy którym jest więcej atomów wodór i halogen - do mniej uwodornionego.
Właściwości chemiczne alkanów
Alkany (parafiny) to niecykliczne węglowodory, w cząsteczkach których wszystkie atomy węgla są połączone tylko pojedynczymi wiązaniami. Innymi słowy, w cząsteczkach alkanów nie ma wiązań wielokrotnych, podwójnych ani potrójnych. W rzeczywistości alkany to węglowodory zawierające maksymalną możliwą liczbę atomów wodoru i dlatego nazywane są ograniczającymi (nasyconymi).
Z powodu nasycenia alkany nie mogą wejść w reakcje addycji.
Ponieważ atomy węgla i wodoru mają dość zbliżoną elektroujemność, prowadzi to do tego, że wiązania CH w ich cząsteczkach mają wyjątkowo niską polarność. Pod tym względem dla alkanów bardziej charakterystyczne są reakcje zachodzące zgodnie z mechanizmem podstawienia rodnikowego, oznaczone symbolem SR.
1. Reakcje podstawienia
W reakcjach tego typu zrywane są wiązania węgiel-wodór.
RH + XY → RX + HY
Halogenacja
Alkany reagują z halogenami (chlorem i bromem) pod wpływem światła ultrafioletowego lub silnego ciepła. W tym przypadku powstaje mieszanina pochodnych halogenowych o różnym stopniu podstawienia atomów wodoru - mono-, di-tri- itp. alkany podstawione halogenem.
Na przykładzie metanu wygląda to tak:
Zmieniając stosunek chlorowiec/metan w mieszaninie reakcyjnej, można zapewnić, że w składzie produktów dominuje jakakolwiek konkretna chlorowcopochodna metanu.
mechanizm reakcji
Przeanalizujmy mechanizm reakcji podstawienia wolnych rodników na przykładzie oddziaływania metanu i chloru. Składa się z trzech etapów:
- inicjacja (lub inicjacja łańcuchowa) - proces powstawania wolnych rodników pod wpływem energii z zewnątrz - naświetlanie światłem UV lub ogrzewanie. Na tym etapie cząsteczka chloru ulega homolitycznemu rozerwaniu wiązania Cl-Cl z utworzeniem wolnych rodników:
Wolne rodniki, jak widać na powyższym rysunku, nazywane są atomami lub grupami atomów z jednym lub większą liczbą niesparowanych elektronów (Cl, H, CH3, CH2 itd.);
2. Rozwój łańcucha
Ten etap polega na interakcji aktywnych wolnych rodników z nieaktywnymi cząsteczkami. W tym przypadku powstają nowe rodniki. W szczególności, gdy rodniki chloru działają na cząsteczki alkanu, powstaje rodnik alkilowy i chlorowodór. Z kolei rodnik alkilowy zderzając się z cząsteczkami chloru tworzy pochodną chloru i nowy rodnik chloru:
3) Zerwanie (śmierć) łańcucha:
Występuje w wyniku rekombinacji dwóch rodników ze sobą w nieaktywne cząsteczki:
2. Reakcje utleniania
W normalnych warunkach alkany są obojętne w stosunku do tak silnych środków utleniających jak stężony kwas siarkowy i azotowy, nadmanganian i dwuchromian potasu (KMnO 4, K 2 Cr 2 O 7).
Spalanie w tlenie
A) całkowite spalanie z nadmiarem tlenu. Prowadzi do powstania dwutlenku węgla i wody:
CH4 + 2O2 \u003d CO2 + 2H2O
B) niepełne spalanie z brakiem tlenu:
2CH 4 + 3O 2 \u003d 2CO + 4H 2 O
CH4 + O2 \u003d C + 2H2O
Katalityczne utlenianie tlenem
W wyniku ogrzewania alkanów tlenem (~200 o C) w obecności katalizatorów można z nich otrzymać szeroką gamę produktów organicznych: aldehydy, ketony, alkohole, kwasy karboksylowe.
Na przykład metan, w zależności od charakteru katalizatora, może zostać utleniony do alkoholu metylowego, formaldehydu lub kwasu mrówkowego:
3. Przemiany termiczne alkanów
Pękanie
Pękanie (z angielskiego na crack - to tear) to proces chemiczny zachodzący w wysokiej temperaturze, w wyniku którego pęka szkielet węglowy cząsteczek alkanu z utworzeniem cząsteczek alkenu i alkanu o niższych masach cząsteczkowych w porównaniu do oryginalnych alkanów. Na przykład:
CH 3-CH 2-CH 2-CH 2-CH 2-CH 2-CH 3 → CH 3-CH 2-CH 2-CH 3 + CH 3-CH \u003d CH 2
Kraking może być termiczny lub katalityczny. Do realizacji krakingu katalitycznego, dzięki zastosowaniu katalizatorów, stosuje się znacznie niższe temperatury w porównaniu do krakingu termicznego.
Odwodornienie
Eliminacja wodoru następuje w wyniku zerwania wiązań C-H; prowadzone w obecności katalizatorów w podwyższonych temperaturach. Odwodornienie metanu wytwarza acetylen:
2CH4 → C2H2 + 3H2
Podgrzanie metanu do 1200 ° C prowadzi do jego rozkładu na proste substancje:
CH4 → C + 2H 2
Odwodornienie innych alkanów daje alkeny:
C2H6 → C2H4 + H2
Podczas odwodornienia n-powstają butan, buten-1 i buten-2 (ten ostatni w formie) cis- oraz trans-izomery):
Dehydrocyklizacja
Izomeryzacja
Właściwości chemiczne cykloalkanów
Właściwości chemiczne cykloalkanów z więcej niż czterema atomami węgla w cyklach są na ogół prawie identyczne z właściwościami alkanów. Co dziwne, w przypadku cyklopropanu i cyklobutanu charakterystyczne są reakcje addycji. Wynika to z wysokiego napięcia w cyklu, co prowadzi do tego, że cykle te mają tendencję do pękania. Tak więc cyklopropan i cyklobutan łatwo dodają brom, wodór lub chlorowodór:
Właściwości chemiczne alkenów
1. Reakcje dodawania
Ponieważ podwójne wiązanie w cząsteczkach alkenu składa się z jednego silnego wiązania sigma i jednego słabego wiązania pi, są one dość aktywnymi związkami, które łatwo wchodzą w reakcje addycji. Alkeny często wchodzą w takie reakcje nawet w łagodnych warunkach - na zimno, w roztworach wodnych i rozpuszczalnikach organicznych.
Uwodornienie alkenów
Alkeny są w stanie dodać wodór w obecności katalizatorów (platyna, pallad, nikiel):
CH 3-CH \u003d CH 2 + H 2 → CH 3-CH 2-CH 3
Uwodornienie alkenów przebiega łatwo nawet przy normalnym ciśnieniu i lekkim podgrzaniu. Ciekawostką jest to, że te same katalizatory można zastosować do odwodornienia alkanów do alkenów, jedynie proces odwodornienia przebiega w wyższej temperaturze i niższym ciśnieniu.
Halogenacja
Alkeny łatwo wchodzą w reakcję addycji z bromem zarówno w roztworze wodnym, jak iw rozpuszczalnikach organicznych. W wyniku oddziaływania początkowo żółte roztwory bromu tracą kolor, tj. odbarwiać.
CH 2 \u003d CH 2 + Br 2 → CH 2 Br-CH 2 Br
Hydrohalogenowanie
Łatwo zauważyć, że dodanie halogenowodoru do niesymetrycznej cząsteczki alkenu powinno teoretycznie prowadzić do mieszaniny dwóch izomerów. Na przykład, gdy do propenu dodaje się bromowodór, należy otrzymać następujące produkty:
Niemniej jednak, przy braku określonych warunków (na przykład obecności nadtlenków w mieszaninie reakcyjnej), dodanie cząsteczki halogenowodoru nastąpi ściśle selektywnie zgodnie z regułą Markovnikova:
Dodanie halogenowodoru do alkenu następuje w taki sposób, że wodór jest przyłączony do atomu węgla z dużą liczbą atomów wodoru (bardziej uwodorniony), a halogen jest przyłączony do atomu węgla z mniejszą liczbą atomów wodoru (mniej uwodorniony).
Uwodnienie
Ta reakcja prowadzi do powstania alkoholi, a także przebiega zgodnie z regułą Markownikowa:
Jak można się domyślić, z uwagi na fakt, że dodanie wody do cząsteczki alkenu następuje zgodnie z regułą Markownikowa, powstanie alkoholu pierwszorzędowego jest możliwe tylko w przypadku hydratacji etylenu:
CH2 \u003d CH2 + H2O → CH3-CH2-OH
To dzięki tej reakcji główna ilość alkoholu etylowego jest przeprowadzana w przemyśle o dużej wydajności.
Polimeryzacja
Specyficznym przypadkiem reakcji addycji jest reakcja polimeryzacji, która w odróżnieniu od halogenowania, hydrohalogenowania i hydratacji przebiega poprzez mechanizm wolnorodnikowy:
Reakcje utleniania
Podobnie jak wszystkie inne węglowodory, alkeny łatwo spalają się w tlenie, tworząc dwutlenek węgla i wodę. Równanie spalania alkenów w nadmiarze tlenu ma postać:
C n H 2n + (3/2) nO 2 → nCO 2 + nH 2 O
W przeciwieństwie do alkanów, alkeny łatwo się utleniają. Pod działaniem wodnego roztworu KMnO 4 na alkeny dochodzi do przebarwienia, które jest jakościową reakcją na podwójne i potrójne wiązania CC w cząsteczkach substancji organicznych.
Utlenianie alkenów nadmanganianem potasu w roztworze obojętnym lub lekko zasadowym prowadzi do powstania dioli (alkoholi dwuwodorotlenowych):
C 2 H 4 + 2KMnO 4 + 2H 2 O → CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH (chłodzenie)
W środowisku kwaśnym następuje całkowite rozszczepienie wiązania podwójnego wraz z przekształceniem atomów węgla, które utworzyły wiązanie podwójne, w grupy karboksylowe:
5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (ogrzewanie)
Jeśli podwójne wiązanie C=C znajduje się na końcu cząsteczki alkenu, wówczas dwutlenek węgla powstaje jako produkt utleniania skrajnego atomu węgla przy podwójnym wiązaniu. Wynika to z faktu, że pośredni produkt utleniania, kwas mrówkowy, łatwo ulega samoutlenieniu w nadmiarze środka utleniającego:
5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O (ogrzewanie)
W utlenianiu alkenów, w których atom C przy podwójnym wiązaniu zawiera dwa podstawniki węglowodorowe, powstaje keton. Na przykład w wyniku utleniania 2-metylobutenu-2 powstaje aceton i kwas octowy.
Utlenianie alkenów, które rozbija szkielet węglowy przy podwójnym wiązaniu, służy do ustalenia ich struktury.
Właściwości chemiczne alkadienów
Reakcje dodawania
Na przykład dodanie halogenów:
Woda bromowa staje się bezbarwna.
W normalnych warunkach dodanie atomów halogenu następuje na końcach cząsteczki butadienu-1,3, podczas gdy wiązania π są zerwane, atomy bromu są przyłączone do skrajnych atomów węgla, a wolne wartościowości tworzą nowe wiązanie π. Tak, jakby nastąpił „ruch” wiązania podwójnego. Przy nadmiarze bromu w miejscu utworzonego wiązania podwójnego można dodać jeszcze jedną cząsteczkę bromu.
reakcje polimeryzacji
Właściwości chemiczne alkinów
Alkiny są nienasyconymi (nienasyconymi) węglowodorami i dlatego mogą wchodzić w reakcje addycji. Wśród reakcji addycji dla alkinów najczęściej występuje addycja elektrofilowa.
Halogenacja
Ponieważ potrójne wiązanie cząsteczek alkinu składa się z jednego silniejszego wiązania sigma i dwóch słabszych wiązań pi, są one w stanie przyłączyć jedną lub dwie cząsteczki halogenu. Dodanie dwóch cząsteczek halogenu przez jedną cząsteczkę alkinu przebiega sekwencyjnie w dwóch etapach przez mechanizm elektrofilowy:
Hydrohalogenowanie
Dodawanie cząsteczek halogenowodoru odbywa się również w mechanizmie elektrofilowym i dwuetapowo. W obu etapach dodawanie przebiega zgodnie z regułą Markownikowa:
Uwodnienie
Dodanie wody do alkinów następuje w obecności soli rutu w środowisku kwaśnym i nazywa się reakcją Kucherowa.
W wyniku uwodnienia dodatku wody do acetylenu powstaje aldehyd octowy (aldehyd octowy):
W przypadku homologów acetylenowych dodanie wody prowadzi do powstania ketonów:
Uwodornienie alkinów
Alkiny reagują z wodorem w dwóch etapach. Jako katalizatory stosowane są metale takie jak platyna, pallad, nikiel:
Trimeryzacja alkinów
Podczas przepuszczania acetylenu nad węglem aktywnym w wysokiej temperaturze powstaje z niego mieszanina różnych produktów, z których głównym jest benzen, produkt trimeryzacji acetylenu:
Dimeryzacja alkinów
Acetylen również wchodzi w reakcję dimeryzacji. Proces przebiega w obecności soli miedzi jako katalizatorów:
Utlenianie alkinów
Alkiny spalają się w tlenie:
C n H 2n-2 + (3n-1) / 2 O 2 → nCO 2 + (n-1) H 2 O
Oddziaływanie alkinów z zasadami
Alkiny z potrójnym C≡C na końcu cząsteczki, w przeciwieństwie do innych alkinów, są w stanie wejść w reakcje, w których atom wodoru w wiązaniu potrójnym zostaje zastąpiony metalem. Na przykład acetylen reaguje z amidkiem sodu w ciekłym amoniaku:
HC≡CH + 2NaNH 2 → NaC≡CNa + 2NH 3,
a także z amoniakalnym roztworem tlenku srebra, tworząc nierozpuszczalne, podobne do soli substancje zwane acetylenkami:
Dzięki tej reakcji możliwe jest rozpoznanie alkinów z końcowym wiązaniem potrójnym, a także wyizolowanie takiego alkinu z mieszaniny z innymi alkinami.
Należy zauważyć, że wszystkie acetylenki srebra i miedzi są substancjami wybuchowymi.
Acetylidy są w stanie reagować z pochodnymi halogenowymi, co jest wykorzystywane w syntezie bardziej złożonych związków organicznych z wiązaniem potrójnym:
CH3 -C≡CH + NaNH2 → CH3 -C≡CNa + NH3
CH3 -C≡CNa + CH3Br → CH3 -C≡C-CH3 + NaBr
Właściwości chemiczne węglowodorów aromatycznych
Aromatyczny charakter wiązania wpływa na właściwości chemiczne benzenów i innych węglowodorów aromatycznych.
Pojedynczy układ elektronów 6pi jest znacznie bardziej stabilny niż konwencjonalne wiązania pi. Dlatego w przypadku węglowodorów aromatycznych reakcje podstawienia są bardziej charakterystyczne niż reakcje addycji. Areny wchodzą w reakcje substytucji przez mechanizm elektrofilowy.
Reakcje podstawienia
Halogenacja
Nitrowanie
Reakcja nitrowania przebiega najlepiej pod działaniem nie czystego kwasu azotowego, ale jego mieszaniny ze stężonym kwasem siarkowym, tzw. mieszaniny nitrującej:
Alkilacja
Reakcja, w której jeden z atomów wodoru w pierścieniu aromatycznym zostaje zastąpiony przez rodnik węglowodorowy:
Alkeny mogą być również stosowane zamiast halogenowanych alkanów. Jako katalizatory można stosować halogenki glinu, halogenki żelaza żelazowego lub kwasy nieorganiczne.<
Reakcje dodawania
uwodornienie
Przystąpienie chloru
Działa radykalnym mechanizmem pod wpływem intensywnego napromieniowania światłem ultrafioletowym:
Podobnie reakcja może przebiegać tylko z chlorem.
Reakcje utleniania
Spalanie
2C 6 H 6 + 15O 2 \u003d 12 CO 2 + 6 H 2 O + Q
niepełne utlenianie
Pierścień benzenowy jest odporny na czynniki utleniające, takie jak KMnO 4 i K 2 Cr 2 O 7 . Reakcja nie idzie.
Podział podstawników w pierścieniu benzenowym na dwa typy:
Rozważ właściwości chemiczne homologów benzenu na przykładzie toluenu.
Właściwości chemiczne toluenu
Halogenacja
Cząsteczka toluenu może być uważana za składającą się z fragmentów cząsteczek benzenu i metanu. Dlatego logiczne jest założenie, że właściwości chemiczne toluenu powinny w pewnym stopniu łączyć właściwości chemiczne tych dwóch substancji rozpatrywanych oddzielnie. W szczególności to właśnie obserwuje się podczas jego halogenowania. Wiemy już, że benzen wchodzi w reakcję podstawienia chlorem w mechanizmie elektrofilowym, a do przeprowadzenia tej reakcji muszą być stosowane katalizatory (halogenki glinu lub żelaza). Jednocześnie metan może również reagować z chlorem, ale w mechanizmie wolnorodnikowym, co wymaga napromieniowania wyjściowej mieszaniny reakcyjnej światłem UV. Toluen, w zależności od warunków, w jakich ulega chlorowaniu, jest w stanie dawać albo produkty podstawienia atomów wodoru w pierścieniu benzenowym - do tego trzeba zastosować te same warunki, co przy chlorowaniu benzenu, albo produkty podstawienia atomów wodoru w pierścieniu benzenowym. rodnik metylowy, jeśli na nim, jak działać na metan z chlorem po napromieniowaniu promieniowaniem ultrafioletowym:
Jak widać, chlorowanie toluenu w obecności chlorku glinu doprowadziło do powstania dwóch różnych produktów - orto- i para-chlorotoluenu. Wynika to z faktu, że rodnik metylowy jest podstawnikiem pierwszego rodzaju.
Jeżeli chlorowanie toluenu w obecności AlCl3 prowadzi się w nadmiarze chloru, możliwe jest powstanie toluenu podstawionego trichlorem:
Podobnie, gdy toluen jest chlorowany na świetle przy wyższym stosunku chlor/toluen, można otrzymać dichlorometylobenzen lub trichlorometylobenzen:
Nitrowanie
Podstawienie atomów wodoru za grupę nitro, podczas nitrowania toluenu mieszaniną stężonych kwasów azotowego i siarkowego, prowadzi do produktów substytucji w jądrze aromatycznym, a nie w rodniku metylowym:
Alkilacja
Jak już wspomniano, rodnik metylowy jest orientantem pierwszego rodzaju, dlatego jego alkilacja Friedela-Craftsa prowadzi do produktów substytucji w pozycjach orto i para:
Reakcje dodawania
Toluen można uwodornić do metylocykloheksanu przy użyciu katalizatorów metalicznych (Pt, Pd, Ni):
C6H5 CH3 + 9O2 → 7CO2 + 4H2O
niepełne utlenianie
Pod działaniem takiego środka utleniającego, jak wodny roztwór nadmanganianu potasu, łańcuch boczny ulega utlenianiu. W takich warunkach rdzeń aromatyczny nie może ulec utlenieniu. W takim przypadku, w zależności od pH roztworu, powstanie albo kwas karboksylowy, albo jego sól.
; w tym przypadku jedno wiązanie p zostaje zerwane i powstaje jedno lub dwa wiązania s. Aby wskazać połączenie reakcje użyć symbolu Ad (z angielskiego dodatku - łączenie); dla p-cji cykloaddycji taki symbol nie jest używany.
w zależności od charakteru podłoże rozróżniać połączenia reakcje na izolowanych lub połączonych wielokrotne wiązania, na przykład: C=C, C=C, C=C-C=C, C=O, C=N, C=N. Rozróżnij p-tion homolityczny. (Ad R) i heterolityczne. przystąpień. Te ostatnie w zależności od szarży napastnika odczynnik podzielony na r-tion elektrof. (Ad E) i nukleof. (AdN)dodatki. Zachowanie odczynnik zależy od typu podłoże oraz warunki prowadzenia dystrybucji (dystrybucja, obecność) katalizator, efekt promieniowania UV itp.). Mn. odczynniki w różnych warunkach może pokazać różne. rodzaje reakcji. umiejętności, m.in. halogeny może działać jako radykał, elektrof. a nawet nukleof. agentów.
Naib. badane akcesje reakcje na wielokrotne wiązania węgiel-węgiel. Procesy te przebiegają zgodnie z mechanizmem krokowym (stopniowym) lub synchronicznym (skoordynowanym). W mechanizmie stopniowym pierwszym etapem jest atak nukleofila, elektrofila lub wolnego. radykalny, drugi - rekombinacja wynikły mediator pozytywny Negatywny lub obojętna cząstka, na przykład:
Elektrof. lub nukleof. cząstki nie muszą być jony; mogą reprezentować część (grupę) pobierającą lub oddającą elektrony Cząsteczki. R-cje Ad N są możliwe tylko przy wiązaniach C=C aktywowanych podstawnikami odciągającymi elektrony; realizacja Ad E wymaga albo niepodstawionych wiązań C=C, albo aktywowanych przez podstawniki elektronodonorowe. Dla części p Ad R natura podstawnika w wiązaniu C=C nie ma większego znaczenia.
Stereochemia. wynik krokowego dodawania zależy od mechanizmu p-tion i charakteru reagujących związków. Tak, elektro. łączący olefiny może być kontynuowany jako atak syn-przywiązanie-cząstki Y i W cząsteczka po jednej stronie samolotu podwójne wiązanie lub jako anti-attachment - cząstki atakują z różnych stron samolotu; w niektórych przypadkach dystrykty przechodzą niestereotypowo. Jądro. łączenie się z karboany przebiega z reguły niestereotypowo. Kiedy dołączasz reakcje na potrójne wiązania addycja syn prowadzi do izomeru cis, addycja anty prowadzi do izomeru trans.
W przypadku mechanizmu synchronicznego atak na oba atom C jest przeprowadzane jednocześnie, a tion p przebiega jako addycja dipolarna (patrz cykloaddycja), podczas gdy addycja reakcje przez podwójne lub potrójne wiązanie idź jako załącznik do syna (patrz np. Reakcje powtórzeń).
P znajomości reakcje przez koniugat podwójne wiązania, przepływając przez mechanizm stopniowy, prowadzą do powstania produktów 1,2- i 1,4-addycyjnych:
Połączenie synchroniczne 1,4 do dieny szlak biegnie. droga:

Szczególnym rodzajem reakcji addycji jest addycja sprzężona. Przepływowi takich p-tionów towarzyszy wiązanie p-rozpuszczalnika (lub specjalnie dodanego) odczynnik) na ostatnim etapie procesu. Na przykład sprzężony elektrof. przystąpienie halogeny do alkeny w CH 3 COOH prowadzi, wraz z 1,2-dihalogenkami, do halogenków b-acetoksyalkilowych:
Przykłady sprzężonego nukleofu. przystąpienie - Reakcja Michaela i interakcji. aktywowany alkeny z anionem cyjankowym w p-rozpuszczalnikach protonowych SH:

W przypadku przystąpienia reakcje na wielokrotne wiązania węgiel-hetero-atom, w którym umieściłem. opłata jest zlokalizowana atom C (wiązania C=O, C=N, C=N i C=S), nukleofile zawsze przyłączają się do atom C, a elektrofile do heteroatomu. W naibie. stopień studiował addycje nukleofilowe reakcje dla grupy karbonylowej:

P znajomości reakcja na atom C może być jednym z etapów podstawienia p-tion w aromacie. z rzędu, na przykład: