Echokardiografia w nieprawidłowym drenażu żył płucnych. Częściowy nieprawidłowy drenaż żył płucnych Nieprawidłowy drenaż żył płucnych Rozpoznanie
Przeczytaj także
10 Ud/m2 początkowo i >7 Ud/m2 po zastosowaniu środków rozszerzających naczynia krwionośne); - obecność bezwzględnych przeciwwskazań do współistniejącej patologii somatycznej. Taktyka chirurgiczna W przypadku braku objawów korektę należy przeprowadzić przed 3-4 rokiem życia. Szybka korekta pomaga uniknąć długotrwałych powikłań PALV: nadciśnienia płucnego i niewydolności prawej komory, trzepotania i migotania przedsionków. Pacjenci z zespołem Scimitar e mają objawy niewydolności serca w okresie niemowlęcym. Leczenie chirurgiczne jest etapowe - przede wszystkim wykonuje się cewnikowanie serca w celu wykrycia i embolizacji obojczyków aortalno-płucnych prawego płuca. Ponadto, w zależności od objawów niewydolności serca, wykonuje się chirurgiczną korekcję PALV. Technika chirurgiczna Jeśli ASD jest małe lub nieobecne, jest rozszerzone lub ukształtowane. Przemieszczenie ujścia PV do jamy RA odbywa się za pomocą łaty, jest ona wszyta tak, aby nie zwężać ujścia PV. W przypadku zwężenia żyły głównej wykonuje się dodatkową plastykę jej jamy ustnej za pomocą plastra autoksenoperikardialnego. Techniki korygowania PALV: - izolacja i przeszczepienie nieprawidłowo przepływających PV do lewego przedsionka lub do normalnie przepływających PV; - podział wspólnego pnia żyły głównej górnej lub dolnej na dwa kanały (kolektor żył płucnych i kolektor żyły głównej) z późniejszym ukierunkowaniem ich napływu do przedsionków; - zespolenie dystalnego końca SVC (PV jest odprowadzany przez proksymalny odcinek SVC); - wewnątrzsercowe przełączanie przez ASD prądów żylnych dużych i małych kręgów krążenia krwi; Jako materiał na tworzywa sztuczne wykorzystuję tautoperikardium potraktowane aldehydem glutarowym, czyli ksenopericardium. Specyficzne powikłania leczenia chirurgicznego: - przeciek resztkowy między przedsionkami; - zwężenia ujść pustych żył lub żył płucnych; - zespół osłabienia węzła zatokowego w plastiku jamy ustnej VIV; NRS, tachyarytmie. Obserwacja pooperacyjna 1. Czas obserwacji pacjentów z skorygowaną PADL przy braku zaburzeń hemodynamicznych nie przekracza 2 lat. Przed wyrejestrowaniem wykonuje się EKG i USG serca. 2. W przypadku rejestracji w okresie pooperacyjnym NRS (bradyarytmie, częstoskurcze przedsionkowe) oprócz badania zaleca się SMEKG co 6 miesięcy lub częściej. W razie wskazań wykonuje się terapię antyarytmiczną, RFA lub wszczepienie stymulatora. 3. Profilaktykę bakteryjnego zapalenia wsierdzia prowadzi się według wskazań w ciągu pierwszych 6 miesięcy po korekcji chirurgicznej wady. 4. Dopuszczalność wychowania fizycznego i sportu po korekcji wady (max-width: 448px) 100vw, 448px"> PALV charakteryzuje się tym, że jedna lub więcej, ale nie wszystkie żyły płucne uchodzą do prawego przedsionka i jego dopływów Żyły płucne mogą spływać do żyły bezimiennej, zatoki wieńcowej, SVC (żyła główna górna), PP (prawy przedsionek), IVC (żyła główna dolna), żył wrotnych, żył wątrobowych.
W przeciwieństwie do TADPV (całkowity anomalny drenaż żył płucnych), wada ta może wystąpić bez połączenia z ASD (ubytek przegrody międzyprzedsionkowej) (5,7%).
Najbardziej klinicznie istotne warianty PALV to:
- żyły górnych i / lub środkowych płatów prawego płuca wpływają do SVC poniżej ujścia żyły bezimiennej (w połączeniu z ASD „zatoką żylną”);
- żyły dolnego płata prawego płuca wpływają do IVC powyżej lub poniżej poziomu przepony (jest częścią „zespołu Scimitar”
- nieprawidłowy dopływ krwi tętniczej i hipoplazja dolnego płata prawego płuca, dekstropozycja serca);
- zbieg lewego PV (żył(y) płucnych) do żyły bezimiennej przez lewą żyłę pionową.
Hemodynamika PALV jest pod wieloma względami podobna do ASD, z tą różnicą, że hiperwolemia ICC (krążenie płucne) jest związana nie z przeciekiem lewo-prawo, ale z jego częściową recyrkulacją przez płuca. Objętość recyrkulacji zależy od liczby drenujących żył płucnych, obecności DMMP i wielkości TRL (całkowity opór płucny). Tempo rozwoju PH (nadciśnienia płucnego) zależy od objętości krwi krążącej w płucach. PH osiąga znaczny stopień w 3-4 dekadzie życia.
KLINIKA
a. Objawy kliniczne choroby:
- dzieci z PADL są zwykle bezobjawowe;
- w przypadku obecności drenażu prawego PV w IVC dzieci mogą mieć częste infekcje oskrzelowo-płucne.
b. Badanie lekarskie: trwałe rozszczepienie II tonu w II m.r. po lewej stronie mostka, niezależnie od faz oddychania (z kombinacją CHADLV i ASD);
słabe lub umiarkowane nasilenie (nie więcej niż 3/6) szmer skurczowy względnego zwężenia zastawki LA w II m. po lewej stronie mostka;
Delikatny mezodiastoliczny szmer względnego zwężenia TC (zastawka trójdzielna);
Wzdłuż lewej krawędzi mostka w dolnej jednej trzeciej.
DIAGNOSTYKA
- Elektrokardiografia
- przerost trzustki (prawej komory);
- całkowita lub niekompletna blokada prawej nogi pakietu Jego;
- normalny wariant EKG nie jest wykluczony.
- echokardiografia
Rozpoznanie PALV jest zwykle osiągane przez wykrycie braku typowego zbiegu jednej lub więcej żył płucnych do LA w typowych lokalizacjach.
Wysokie ASD typu „sinus venosus” z reguły łączy się z PALV.
Kryteria diagnostyczne:
- rozszerzenie odpowiednich działów;
- rozszerzenie tętnicy płucnej;
- względny spadek LA i LV;
- poszerzona żyła główna górna.
LECZENIE I OBSERWACJA
- Obserwacja i leczenie pacjentów z nieskorygowaną PADL
a. Nie jest wskazane zapobieganie bakteryjnemu zapaleniu wsierdzia.
b. Korekta objawów niewydolności serca (w rzadkich przypadkach).
w. Dopuszczalność wychowania fizycznego w sporcie przed korektą wady.
- Chirurgia
Wskazania do leczenia chirurgicznego
Potwierdzone rozpoznanie PADLV jest bezwzględnym wskazaniem do leczenia chirurgicznego.
Przeciwwskazania do leczenia chirurgicznego:
- wysokie nadciśnienie płucne (ARS > 10 U d/m 2 początkowo i > 7 U d/m 2 po zastosowaniu leków rozszerzających naczynia);
- obecność bezwzględnych przeciwwskazań do współistniejącej patologii somatycznej.
Taktyka chirurgiczna
W przypadku braku objawów korektę należy przeprowadzić przed 3-4 rokiem życia. Szybka korekta pomaga uniknąć długotrwałych powikłań PALV: nadciśnienia płucnego i niewydolności prawej komory, trzepotania i migotania przedsionków.
U pacjentów z zespół buławy objawy niewydolności serca rozwijają się w okresie niemowlęcym. Leczenie chirurgiczne jest etapowe - przede wszystkim wykonuje się cewnikowanie serca w celu wykrycia i embolizacji obojczyków aortalno-płucnych prawego płuca. Ponadto, w zależności od objawów niewydolności serca, wykonuje się chirurgiczną korekcję PALV.
Technika chirurgiczna
W przypadku małego rozmiaru lub braku ASD jest on rozszerzony lub uformowany. Przemieszczenie ujścia PV do jamy RA odbywa się za pomocą łaty, jest ona wszyta tak, aby nie zwężać ujścia PV. W przypadku zwężenia żyły głównej wykonuje się dodatkową plastykę jej jamy ustnej za pomocą plastra autoksenoperikardialnego.
Techniki korygowania PHADLV:
- izolacja i przeszczepienie nieprawidłowo przepływających PV do lewego przedsionka lub do normalnie przepływających PV;
- podział wspólnego pnia żyły głównej górnej lub dolnej na dwa kanały (kolektor żył płucnych i kolektor żyły głównej) z późniejszym ukierunkowaniem ich napływu do przedsionków;
- zespolenie dystalnego końca SVC (PV jest odprowadzany przez proksymalny odcinek SVC);
- wewnątrzsercowe przełączanie przez ASD prądów żylnych dużych i małych kręgów krążenia krwi;
Jako materiał na tworzywa sztuczne wykorzystuję tautoperikardium potraktowane aldehydem glutarowym, czyli ksenopericardium.
Specyficzne powikłania leczenia chirurgicznego:
- przeciek resztkowy między przedsionkami;
- zwężenie ujścia żył pustych lub żył płucnych;
- zespół osłabienia węzła zatokowego z operacją plastyczną ujścia VIV; NRS, tachyarytmie.
Kontrola pooperacyjna
- Czas obserwacji pacjentów z skorygowaną PADL przy braku zaburzeń hemodynamicznych nie przekracza 2 lat. Przed wyrejestrowaniem wykonuje się badanie ultrasonograficzne serca.
- W przypadku rejestracji w okresie pooperacyjnym NRS (bradyarytmie, częstoskurcze przedsionkowe) oprócz badania zaleca się SMEKG co 6 miesięcy lub częściej. W razie wskazań wykonuje się terapię antyarytmiczną, RFA lub wszczepienie stymulatora.
- Profilaktykę bakteryjnego zapalenia wsierdzia prowadzi się według wskazań w ciągu pierwszych 6 miesięcy po korekcji chirurgicznej wady.
- Dopuszczalność wychowania fizycznego i sportu po korekcie wady.
Żyła płucna (zdjęcie poniżej) to naczynie, które dostarcza do lewego przedsionka krew tętniczą, wzbogaconą w tlen w płucach.
Zaczynając od naczyń włosowatych płuc, naczynia te łączą się w większe żyły, które przechodzą do oskrzeli, następnie segmenty, płaty, a u wrót płuc tworzą duże pnie (po dwa z każdego korzenia), które w pozycji poziomej idą w górę część lewego przedsionka. W tym przypadku każdy z pni wnika w osobny otwór: lewe - z lewej strony lewego przedsionka, a prawe z prawej. Prawe żyły płucne, idąc za przedsionkiem (po lewej), przecinają poprzecznie prawy przedsionek (jego ścianę tylną).
Górna żyła płucna (prawa)
Tworzą go żyły segmentowe z segmentów środkowego i górnego płata płuc.

Dolna żyła płucna (prawa)
Naczynie to otrzymuje krew z dolnego płata (jego 5 segmentów) i ma dwa główne dopływy: podstawową żyłę wspólną i górną gałąź.
Górna gałąź
Leży między segmentami podstawowym i górnym. Powstaje z żył dodatkowych i głównych, biegnie do przodu i do dołu, przechodząc za segmentowym oskrzelem wierzchołkowym. Ta gałąź jest najwyższa ze wszystkich, które wpływają do dolnej prawej żyły płucnej.
Odpowiednio do oskrzeli, żyła główna zawiera trzy dopływy: boczny, górny, przyśrodkowy, położony głównie międzysegmentowo, ale może również leżeć wewnątrzsegmentowo.

Dzięki żyle dodatkowej krew jest odprowadzana z górnego segmentu (jej górnej części) do obszaru podpłatowego segmentowej żyły tylnej górnego płata (jego segmentu tylnego).
Podstawowa żyła wspólna
Jest to krótki pień żylny utworzony przez zbieg żył podstawnych dolnych i górnych, których główne gałęzie leżą znacznie głębiej niż przednia powierzchnia płata.
Żyła podstawna górna. Powstaje w wyniku zbiegu największej z podstawowych żył segmentowych, a także żył przenoszących krew z segmentów przyśrodkowych, przednich i bocznych.
Podstawowa żyła dolna. Przylega do żyły podstawowej wspólnej od strony jej tylnej powierzchni. Głównym dopływem tego naczynia jest podstawna gałąź tylna, która zbiera krew z tylnego segmentu podstawnego. W niektórych przypadkach żyła podstawna dolna może zbliżać się do żyły podstawnej górnej.
ADLV
Jest to wrodzona patologia serca, w której stwierdza się nieanatomiczne wejście żył płucnych do przedsionka (po prawej) lub do ostatnich pustych żył.

Patologii tej towarzyszy częste zapalenie płuc, zmęczenie, duszność, opóźnienie rozwoju fizycznego, ból serca. W diagnostyce wykorzystują: EKG, MRI, radiografię, USG, ventriculo- i atriografię, angiopulmonografię.
Leczenie operacyjne wady zależy od jej rodzaju.
Informacje ogólne
ADLV jest wadą wrodzoną i stanowi około 1,5-3,0% wad serca. Najczęściej obserwowane u pacjentów płci męskiej.
Najczęściej ta wada jest połączona z owalnym (otwartym) okienkiem i ubytkami przegrody między komorami. Nieco rzadziej (20%) - z tętniczym wspólnym pniem, hipoplazją lewej strony serca, VSD, dekstrokardią, tetradą Fallota i transpozycjami głównych naczyń, wspólną komorą serca.
Oprócz powyższych wad ADLV często towarzyszy patologia pozasercowa: przepukliny pępkowe, wady rozwojowe układu hormonalnego i kostnego, uchyłki jelitowe, nerka podkowiasta, wodonercze i wielotorbielowatość nerek.
Klasyfikacja nieprawidłowego drenażu żył płucnych (APLV)
Jeśli wszystkie żyły wpływają do krążenia systemowego lub do prawego przedsionka, wada ta nazywana jest całkowitym nieprawidłowym drenażem, ale jeśli jedna lub więcej żył wpływa do powyższych struktur, to taka wada nazywana jest częściową.
Zgodnie z poziomem konfluencji rozróżnia się kilka wariantów wady:
- Opcja pierwsza: suprakardialna (nadkardialna). Żyły płucne (jako wspólny pień lub osobno) spływają do jednej z jego gałęzi.
- Opcja druga: sercowa (wewnątrzsercowa). Żyły płucne są odprowadzane do prawego przedsionka.
- Opcja trzecia: podsercowa (podsercowa lub podsercowa). Żyły płucne wchodzą do żyły głównej wrotnej lub dolnej (znacznie rzadziej do przewodu limfatycznego).
- Czwarta opcja: mieszana. Żyły płucne wchodzą w różne struktury i na różnych poziomach.
Cechy hemodynamiki
W okresie wewnątrzmacicznym ta wada z reguły nie objawia się ze względu na specyfikę krążenia krwi płodu. Po urodzeniu dziecka objawy zaburzeń hemodynamicznych są determinowane przez wariant wady i jej połączenie z innymi anomaliami wrodzonymi.
W przypadku całkowitego nieprawidłowego drenażu zaburzenia hemodynamiczne wyrażają się hipoksemią, hiperkinetycznym przeciążeniem prawego serca i nadciśnieniem płucnym.
W przypadku częściowego drenażu hemodynamika jest podobna do tej w ASD. Wiodącą rolę w naruszeniach należy do nieprawidłowego wypływu krwi żylno-tętniczego, co prowadzi do zwiększenia objętości krwi w małym kole.
Objawy nieprawidłowego drenażu żył płucnych
Dzieci z tą wadą często cierpią na powtarzające się SARS i zapalenie płuc, mają kaszel, niski przyrost masy ciała, tachykardię, duszność, bóle serca, łagodną sinicę i zmęczenie.

W przypadku oczywistego nadciśnienia płucnego w młodym wieku, niewydolności serca, ciężkiej sinicy i
Diagnostyka
Obraz osłuchiwania w ADLV jest podobny do ASD, to znaczy skurczowy szmer szorstki jest słyszalny w obszarze występów tętnic żył (żyły płucne) i rozszczepienia drugiego tonu.
- W EKG widoczne są oznaki przeciążenia prawego serca, odchylenie EOS w prawo, blokada (niepełna) prawej nogi pęczka Hissa.
- Fonografia wykazuje oznaki ASD.
- W radiografii obraz płuc jest wzmocniony, tętnica płucna (jej łuk) wybrzusza się, rozszerzenie granic serca w prawo, objaw "szabli tureckiej".
- EchoCG.
- Sondowanie jam serca.
- Flebografia.
- Atriografia (po prawej).
- Angiopulmonografia.
- Ventrikulografia.

Diagnozę różnicową tej wady należy przeprowadzić z:
- Limfangiektazja.
- Atrezja
- Transpozycja naczyniowa.
- Zwężenie zastawki dwudzielnej.
- Zwężenie prawej / lewej żyły płucnej.
- Potrójne serce.
- Izolowane ASD.
Leczenie
Rodzaje chirurgicznego leczenia częściowego drenażu zależą od wariantu wady, wielkości i lokalizacji ASD.

Komunikacja międzyprzedsionkowa jest eliminowana za pomocą plastiku lub zszycia ASD. Niemowlęta do trzeciego miesiąca życia w stanie krytycznym przechodzą operację paliatywną (zamkniętą atrioseptomię), której celem jest rozszerzenie komunikacji międzyprzedsionkowej.
Ogólna radykalna korekta wady (forma całkowita) obejmuje kilka manipulacji.
- Podwiązanie patologicznej komunikacji naczyń z żyłami.
- Izolacja żył płucnych.
- Zamknięcie DMP.
- Powstanie zespolenia między lewym przedsionkiem a żyłami płucnymi.
Konsekwencją takich operacji może być: wzrost nadciśnienia płucnego i zespołu niewydolności węzła zatokowego.
Prognozy
Rokowanie co do naturalnego przebiegu tej wady jest niekorzystne, gdyż 80% pacjentów umiera w pierwszym roku życia.
Pacjenci z częściowym drenażem mogą dożyć trzydziestego roku życia. Śmierć takich pacjentów jest najczęściej związana z infekcjami płuc lub ciężką niewydolnością serca.
Wyniki chirurgicznej korekcji wady są często zadowalające, jednak wśród noworodków śmiertelność w trakcie lub po zabiegu pozostaje wysoka.
Żyły płucne wpływają do lewego przedsionka i to przez nie natleniona krew dostaje się do lewej komory, a następnie do aorty. Ponadto jest przenoszony przez tętnice w krążeniu ogólnoustrojowym.
Pod wpływem szeregu zewnętrznych czynników negatywnych w okresie prenatalnym można stworzyć warunki do powstania takiej wrodzonej wady serca, jak nieprawidłowy drenaż żył płucnych (ADPV), w którym naczynia te spływają nie w lewo, ale w prawego przedsionka, żyły głównej lub zatoki wieńcowej. Taka nieprawidłowa lokalizacja naczyń może być częściowa lub całkowita, tj. część poszczególnych żył płucnych lub wszystkie ujścia tych naczyń mogą komunikować się z prawym przedsionkiem. Stan pacjenta w dużej mierze zależy od tych czynników.
Według statystyk ADLV wykrywa się u 1,5-3% pacjentów. Częściej ta patologia występuje wśród mężczyzn.
Często ADLV łączy się z takimi anomaliami w rozwoju serca, jak ubytek przegrody międzyprzedsionkowej. A u 20% pacjentów towarzyszą mu inne wady: tetrada Fallota, ubytek przegrody międzykomorowej, niedorozwój lewych komór serca itp. Ponadto u pacjentów z tą diagnozą często wykrywane są anomalie rozwojowe niesercowe: podkowa nerkowata, wielotorbielowatość nerek, wodonercze, przepuklina pępkowa, uchyłki jelitowe i wady rozwojowe układu mięśniowo-szkieletowego lub hormonalnego.
W tym artykule przedstawimy Ci możliwe przyczyny, rodzaje, objawy, metody wykrywania i leczenia nieprawidłowego drenażu żył płucnych. Uzyskane informacje pomogą Ci zrozumieć istotę tej wrodzonej choroby serca i będziesz mógł zadać lekarzowi interesujące Cię pytania.
Ta rzadka wada wrodzona została po raz pierwszy opisana przez Wilsona w 1798 roku, ale jej warianty rozważono bardziej szczegółowo dopiero po zgromadzeniu wystarczającego doświadczenia kardiochirurgicznego w latach 50. i 60. XX wieku. Pierwszą udaną operację skorygowania tej patologii przeprowadził Miller w 1951 roku. Następnie udoskonalono techniki kardiochirurgiczne, a w 1956 r. dokonano radykalnej korekcji ADLV przy użyciu powierzchownej hipotermii. W tym samym roku wykonano podobną interwencję z zastosowaniem krążenia pozaustrojowego.
Na terytorium ZSRR po raz pierwszy udaną operację usunięcia takiej wady serca przeprowadził w 1978 r. Nikołaj Michajłowicz Amosow, a jeden z czołowych rosyjskich kardiochirurgów, Georgy Eduardovich Falkovsky, poinformował o szeregu udanych korekt u małych dzieci w 1984 roku.
Powody
Prawdopodobnie dziedziczność odgrywa pewną rolę w rozwoju ADLV.Prawdopodobnymi przyczynami rozwoju ADLV mogą być te same czynniki zewnętrzne, które wywołują inne wrodzone anomalie w budowie serca i naczyń krwionośnych:
- dziedziczność (mutacje chromosomów);
- przyjmowanie niektórych leków teratogennych;
- narażenie na toksyczne substancje na ciele podczas ciąży;
- złe nawyki przyszłej matki;
- choroby zakaźne przeniesione na kobietę w ciąży;
- zaburzenia endokrynologiczne;
- toksykoza;
- niekorzystne środowisko.
Dysocjacja żył płucnych z lewym przedsionkiem może być spowodowana następującymi czynnikami:
- brak ich połączenia z lewym przedsionkiem - powstaje z powodu faktu, że pod wpływem opisanych powyżej przyczyn zewnętrznych lewy odrost przedsionka nie może kontaktować się ze splotami żylnymi przyszłego płuca;
- wczesna atrezja żyły płucnej - występuje przy początkowym połączeniu płucnego łożyska naczyniowego i wspólnej żyły płucnej, której światło ulega następnie zatarciu, a krew z płuc zaczyna płynąć innymi drogami pobocznymi.
Odmiany
ADLV jest dwojakiego rodzaju:
- Całkowity (lub kompletny). Przy takiej wadzie krążenie krwi między dużymi i małymi kręgami całkowicie się zatrzymuje, ponieważ nie ma komunikacji między żyłami płucnymi a lewym przedsionkiem. Ta forma wady jest niezgodna z życiem, jednak dziecko może mieć takie współistniejące anomalie w rozwoju serca, jak wady przegrody międzyprzedsionkowej lub międzykomorowej, nieznacznie kompensujące tak istotne naruszenie hemodynamiki. W takich przypadkach dziecko może żyć przez pewien czas. Jednak w większości przypadków, bez terminowej kardiochirurgicznej korekcji całkowitej ADLV, dzieci umierają przed pierwszym rokiem życia.
- Częściowy. Przy takiej anomalii jedna z gałęzi żył płucnych komunikuje się z lewym przedsionkiem, a stan hemodynamiczny pacjenta zależy od objętości wypływu krwi.
W zależności od stopnia wejścia żył płucnych do lewego przedsionka wyróżnia się cztery warianty anatomiczne ADLV:
- nadkardialny (lub nadkardialny) - obserwowany u prawie 55% noworodków i towarzyszy mu przepływ żył płucnych do układu żyły głównej górnej;
- sercowy (lub wewnątrzsercowy) - wykryty u 30% pacjentów i towarzyszy mu przepływ żył płucnych do prawego przedsionka lub zatoki wieńcowej;
- podsercowy (lub podsercowy, podsercowy) - obserwowany u 12% dzieci i towarzyszy mu przepływ żył płucnych do żyły głównej dolnej lub żyły wrotnej (czasem do przewodu limfatycznego);
- mieszane - wykryte u 3% noworodków i mogą towarzyszyć różne odmiany zbiegu żył płucnych opisane powyżej.
Jak zaburzona jest hemodynamika?
Podczas rozwoju wewnątrzmacicznego ta choroba serca nie objawia się w żaden sposób, ponieważ krążeniu wewnątrzsercowemu u płodu towarzyszy komunikacja lewego i prawego przedsionka przez otwarte owalne okno. ADLV zaczyna być odczuwalne po urodzeniu dziecka, a nasilenie zaburzeń hemodynamicznych będzie determinowane przez rodzaj i wariant tej anomalii. Ponadto obecność współistniejących wad rozwoju serca i naczyń krwionośnych może wpływać na nasilenie objawów wady.
Przy całkowitym ADLV krew wzbogacona tlenem wchodząca do prawego przedsionka miesza się z krwią żylną. Co więcej, część z nich wchodzi do prawej komory, a druga do lewego przedsionka przez istniejący ubytek przegrody międzyprzedsionkowej lub otwarty otwór owalny. W takich przypadkach całkowita ADLV jest zgodna z życiem, ponieważ komunikacja między krążeniem ogólnoustrojowym a płucnym nie zostaje utracona. Takie zaburzenia hemodynamiczne prowadzą do przeciążenia prawych komór serca, wzrostu ciśnienia w naczyniach płucnych i spadku zawartości tlenu we krwi, co prowadzi do głodu tlenowego narządów i tkanek.
W przypadku częściowej ADLV zaburzenia hemodynamiczne występują w taki sam sposób, jak w przypadku wad międzyprzedsionkowych. Ciężkość stanu pacjenta z tego typu anomalią zależy od ilości patologicznego wyładowania tętniczo-żylnego.
Objawy
Oznaki ADLV dają się odczuć natychmiast po urodzeniu dziecka. Przy całkowitej wadzie, której nie towarzyszy obecność wad w komunikacji międzyprzedsionkowej, krążenie krwi między małym i dużym kołem staje się całkowicie niemożliwe, a noworodek szybko umiera. W takich przypadkach życie dziecka może uratować jedynie pilna operacja kardiochirurgiczna metodą Rashkinda jako balonowa endowaskularna septostomia przedsionkowa.
W innych przypadkach nasilenie objawów klinicznych ADLV zależy od jego wariantu anatomicznego, wielkości ubytków przegrody międzyprzedsionkowej i charakteru zaburzeń hemodynamicznych. Zwykle rodzice dzieci z taką wrodzoną wadą zauważają następujące przejawy tej patologii:
- szybka męczliwość;
- pojawienie się duszności po aktywności fizycznej (karmienie, płacz itp.);
- ból w okolicy serca (dziecko nie śpi dobrze, jest niespokojne, głośno płacze i rozciąga nogi);
- blada skóra;
- światło ;
- kaszel;
- nudności i wymioty;
- powolny przyrost masy ciała
- częste SARS i zapalenie płuc.
Podczas badania pulsu lekarz może wykryć jego szybkość i arytmię. Podczas badania określa się deformację klatki piersiowej i przyspieszone bicie serca.
Łagodna sinica występująca w pierwszych tygodniach życia może z czasem zniknąć lub stać się mniej wyraźna. Z reguły sinica jest bardziej wyraźna podczas wysiłku fizycznego.
Podczas słuchania dźwięków serca nie są wykrywane specyficzne oznaki tej wady. Może być usłyszany:
- głośno tonuję nad sercem;
- rozszczepienie tonu II ze wzrostem komponentu płucnego;
- osłuchiwany ton III nad wierzchołkiem serca (u wielu pacjentów);
- cichy skurczowy szmer nad tętnicą płucną o zmiennym czasie trwania i intensywności.
Na EKG określa się przeciążenie prawego serca - wysokie napięcie załamka P w prawych odprowadzeniach i odchylenia osi elektrycznej w prawo w standardowych odprowadzeniach. Przeciążenie prawego przedsionka jest sygnalizowane wysokim załamkiem P w prawej klatce piersiowej i standardowymi odprowadzeniami. Często pojawiają się oznaki niekompletności.
Jeśli w przegrodzie międzyprzedsionkowej występuje duży ubytek, dziecko może rozwijać się normalnie, a następnie w starszym wieku pojawiają się skargi na znaczne zmniejszenie tolerancji wysiłku, duszność, bladość i zły stan ogólny. Później u tych dzieci pojawiają się objawy.
Diagnostyka
 Jedną z metod pomagających wykryć i zweryfikować ADLV jest USG serca.
Jedną z metod pomagających wykryć i zweryfikować ADLV jest USG serca. Po raz pierwszy ADLV można wykryć u płodu podczas badania ultrasonograficznego w trzecim trymestrze ciąży.
Aby wyjaśnić wszystkie dane dotyczące takiej wrodzonej choroby serca, zaleca się następujące instrumentalne metody badawcze:
- radiografia;
- (przepisywane są dorośli i starsze dzieci);
- sondowanie komór serca i.
Leczenie
Jedynym sposobem na wyeliminowanie ADLV jest jego korekcja kardiochirurgiczna. Przed zabiegiem zaleca się dziecku ograniczenie aktywności fizycznej i przepisuje się leki zapobiegające ostrej niewydolności serca (,). Rodzice dziecka powinni mieć świadomość, że nawet płacz czy dyskomfort temperaturowy mogą znacznie pogorszyć samopoczucie przy takiej chorobie serca. Jeśli dziecko jest już dorosłym, powinno stale monitorować swój wolny czas - nie powinien biegać, podnosić ciężarów i przepracować.
Metody korekcji chirurgicznej
Sposób wykonania korekcji kardiochirurgicznej w ADLV zależy od rodzaju i wariantu wady.
Przy całkowitym drenażu krytycznie chore dziecko do 3 miesiąca życia może zostać poddane operacji paliatywnej, która polega na zwiększeniu komunikacji międzyprzedsionkowej poprzez wykonanie atrioseptomy balonowej metodą Rashkinda. Taka korekta przyczynia się do przepływu krwi do lewego przedsionka i przywrócenia krążenia krwi w dużym okręgu.
W celu radykalnej eliminacji ADLV przeprowadza się interwencje mające na celu stworzenie szerokiego zespolenia między lewym przedsionkiem a żyłami płucnymi, zatrzymanie patologicznego drenażu żył płucnych z innymi naczyniami żylnymi oraz wyeliminowanie ubytku przegrody międzyprzedsionkowej. Takie interwencje najlepiej wykonywać w młodym wieku. Metoda radykalnej korekcji dobierana jest w zależności od anatomicznego wariantu ADLV.
Interwencje korekcyjne są dość skuteczne, jednak pomimo rozwoju nowoczesnej kardiochirurgii odsetek zgonów występujących podczas operacji lub w okresie pooperacyjnym pozostaje wysoki. Wynik radykalnej korekcji w dużej mierze zależy od umiejętności kardiochirurga, wyposażenia technicznego, rodzaju i wariantu wady. Ponadto najwyższe ryzyko zgonu występuje u noworodków i małych dzieci z ciężkim nadciśnieniem płucnym. Najczęściej taką manifestację wady obserwuje się u pacjentów z podsercowym wariantem anomalii.
Wyniki odległe wśród dzieci, które przeżyły radykalną korekcję ADLV, są dość zadowalające. Tylko u niektórych pacjentów może rozwinąć się osłabienie węzła zatokowego i nadciśnienie płucne, na które trudno jest odpowiedzieć na leczenie farmakologiczne.
Prognoza
Skutecznie przeprowadzona radykalna korekcja kardiochirurgiczna ADLV znacznie poprawia rokowanie w przebiegu tej choroby serca. Jednak ryzyko śmierci w trakcie lub po operacji pozostaje wysokie.
Przy całkowitej postaci ADLV i braku doraźnej korekcji kardiochirurgicznej około 80% dzieci umiera przed ukończeniem pierwszego roku życia. Jeśli nieprawidłowy drenaż żył płucnych jest częściowy, pacjenci mogą żyć nawet 20-30 lat. W przypadku braku leczenia chirurgicznego tacy pacjenci umierają z powodu niewydolności serca lub infekcji płuc.
Nieprawidłowy drenaż żył płucnych jest rzadką wrodzoną wadą serca i zawsze wymaga operacji kardiochirurgicznej. W niektórych przypadkach stan noworodka staje się krytyczny z powodu znacznych zaburzeń hemodynamicznych, a takie operacje są wykonywane w trybie nagłym. Po udanej radykalnej korekcji kardiochirurgicznej stan pacjenta znacznie się poprawia, a rokowanie co do wyniku choroby staje się korzystne.
Anomalny drenaż żył płucnych (ADPV) to defekt, w którym wszystkie (całkowite) lub pojedyncze (częściowe) żyły płucne wpływają do prawego przedsionka lub żyły głównej prowadzącej do niego. Pierwszy opis imadła jest autorstwa J.B. Winslowa (1739) i J.G. Wilsona (1798). Częstość ADLV wynosi 0,5-2% wszystkich CHD w połączeniu z ASD w 10-15%. Prawdopodobnie znaczna liczba przypadków częściowej ADLV pozostaje niezdiagnozowana z powodu braku objawów klinicznych.
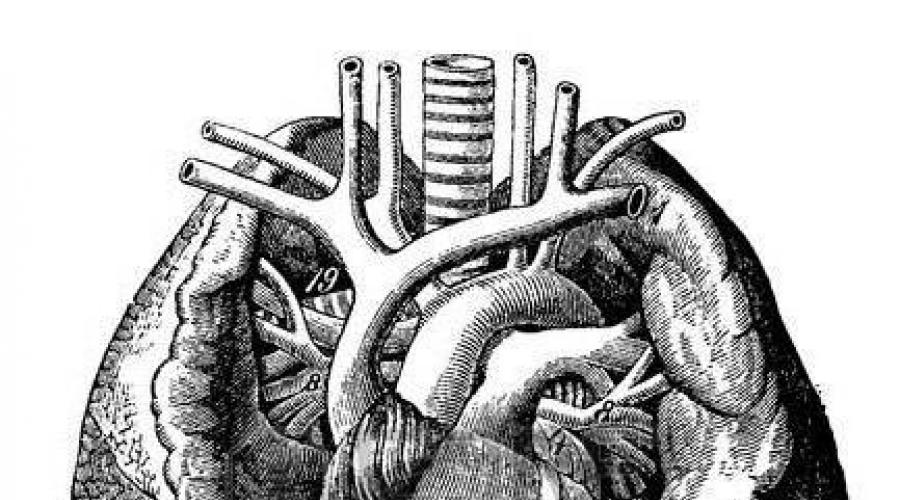
Anatomia, klasyfikacja. Częściej występuje nieprawidłowy drenaż żył prawego płuca. Można wyróżnić następujące warianty ADLV (ryc. 12): 1) poziom nadsercowy – płucny
a - poziom nadsercowy: nieprawidłowy drenaż JIB w SVC; b - poziom serca: nieprawidłowy drenaż PV w RZS; c - poziom podsercowy: nieprawidłowy drenaż LV do IVC; 1 - ubytek przegrody międzyprzedsionkowej.
nee żyły płyną do lewej bezimiennej, górnej żyły głównej lub jednej z ich odgałęzień; 2) poziom serca - drenaż całości lub części żył płucnych do jamy prawego przedsionka lub zatoki wieńcowej; 3) podsercowe - część żył płucnych wpływa do naczynia żylnego znajdującego się poniżej serca; 4) mieszane.
Większość pacjentów ma współistniejące wtórne ASD (często defekt zatoki żylnej), otwarty otwór owalny. Autopsja wykazała powiększone jamy prawego przedsionka i komory, poszerzone tętnice płucne i żyłę główną; lewe komory serca i aorty nie ulegają zmianie. Zwykle u zbiegu znajduje się kilka ujścia żył płucnych, czasami zbierają się one w jeden pień i otwierają się wspólnym ujściem. W 20% przypadków występują inne CHD (VSD, transpozycja aorty i tętnicy płucnej, tetralogia Fallota, pojedyncza komora, zwężenie tętnicy płucnej, dekstrokardia).
Hemodynamika. W przypadku częściowej ADLV zaburzenia hemodynamiczne są podobne do tych występujących w ASD i są określane przez liczbę nieprawidłowo drenujących żył, wielkość przecieku lewo-prawego oraz wielkość ASD związanego z CHD. Jeśli jedna żyła płucna jest drenowana i nie ma ASD, wada pozostaje bezobjawowa. Ciśnienie w tętnicy płucnej przy częściowej ADLV przez długi czas pozostaje prawidłowe, ponieważ krew jest przeciekana na poziomie przedsionków i nie ma czynnika „ciśnienia transferu” (z lewej komory i aorty do prawej komory i tętnicy płucnej, jak w VSD i PDA).
Klinika, diagnostyka. W przypadku częściowej ADLV objawy kliniczne mogą być nieobecne przez długi czas lub przypominać objawy wtórnego ASD. Główne objawy wady nie są
objawy: zmęczenie, ból w sercu, duszność podczas ćwiczeń, powtarzające się zapalenie płuc, opóźnienie w rozwoju fizycznym. Z wiekiem pojawia się garb sercowy, granice otępienia serca rozszerzają się bardziej w prawo. Obraz osłuchowy jest podobny jak we wtórnym ASD: nieszorstki szmer skurczowy w miejscu projekcji tętnicy płucnej, rozszczepienie
- dźwięki. Niewydolność serca u dzieci rozwija się rzadko, zwykle w przypadkach, gdy ponad 50% żył płucnych jest nieprawidłowo drenowanych; u dorosłych pogorszenie stanu ogólnego pojawia się wcześniej niż w przypadku izolowanego ASD.
W badaniu rentgenowskim narządów klatki piersiowej stan układu płucnego zależy od wartości wydzieliny tętniczo-żylnej. W przypadku częściowego ADLV jest bardziej nasilone wzdłuż łożyska tętniczego, jeśli wydzielina przekracza 50% objętości minimalnej krążenia płucnego. W tych samych przypadkach możliwe jest wybrzuszenie pnia tętnicy płucnej i zwiększona pulsacja korzeni płuc. Cień serca jest powiększony dzięki odpowiednim odcinkom; prawy przedsionek jest poszerzony w większym stopniu niż w izolowanym ASD. W przypadku ADLV jego ekspansja jest widoczna w górnej żyle głównej. Owalny cień z prawych żył płucnych rozciągający się do dolnej żyły głównej wzdłuż prawej granicy serca (wzorzec „szabli” lub „szabla turecka”) jest niezawodnym objawem wad rozwojowych w przypadkach nieprawidłowego zbiegu prawych żył płucnych do żyła główna dolna.
Do chwili obecnej nie ma przekonujących kryteriów echokardiograficznych pozwalających na rozpoznanie częściowego nieprawidłowego drenażu żył płucnych. Pośrednimi (hemodynamicznymi) objawami tego są: poszerzenie prawej komory, paradoksalny ruch przegrody międzykomorowej, małe rozmiary lewego przedsionka i komory, zwiększony ruch zastawki trójdzielnej. W echokardiografii 2D należy podejrzewać częściową ADLV, gdy anatomiczny ubytek przegrody jest niezgodny z hemodynamiczną manifestacją przecieku tętniczo-żylnego.
Podczas cewnikowania jam serca sonda z prawego przedsionka wchodzi do jednej z żył głównych, a stamtąd do wolnego pola płucnego. Konieczne jest przeprowadzenie etapowego badania żyły głównej i prawego przedsionka, co pozwala ustalić poziom zbiegu żył płucnych i ich liczbę. Gdy sonda z prawego przedsionka wchodzi do pnia żyły płucnej, ma łagodny przebieg w odstępie między ujściami żyły głównej i żył płucnych, odchylając się w prawo od linii pośrodkowej lub nie przechodzi
przeciętny na skraju cienia prawego przedsionka. W niektórych przypadkach sonda może przejść do pnia żyły płucnej przez ASD i lewą jamę przedsionkową. O połączeniu żył płucnych z żyłą główną świadczy wzrost nasycenia krwi tlenem na poziomie lewej żyły bezimiennej, górnej lub dolnej żyły głównej.
Przy nieprawidłowym drenażu do prawego przedsionka obserwuje się arterializację krwi w tej jamie, co jest również charakterystyczne dla izolowanego ASD. Ciśnienie w komorach serca może być normalne.
Za najcenniejszą technikę diagnostyczną należy uznać selektywną angiokardiografię z wprowadzeniem środka kontrastowego do pnia tętnicy płucnej lub selektywnie do jej prawej lub lewej gałęzi. Po szczelnym i szybkim wypełnieniu tętnicy płucnej środkiem kontrastowym widoczna jest faza kapilarna, następnie uwidacznia się przebieg i miejsce zbiegu wszystkich żył płucnych, żył pełnych, prawego przedsionka i komory oraz lewych części serca .
Leczenie. Podczas korygowania częściowego ADLV stosuje się różne operacje w zależności od rodzaju defektu (poziom drenażu, wielkość i lokalizacja ASD). W przypadku nieprawidłowego drenażu części żył płucnych do żyły głównej górnej lub jej ujścia stosuje się następującą taktykę: a) utworzenie tunelu z łatą łączącą ujście nieprawidłowo drenujących żył płucnych z lewym przedsionkiem przez przegrodę wada; b) utworzenie dwóch tuneli z pnia żyły głównej górnej w celu utworzenia oddzielnych – ogólnoustrojowych i płucnych – przepływów krwi i odprowadzenia krwi z żył płucnych. bezpośrednio do lewego przedsionka przez ASD; c) przyszycie dolnej krawędzi ubytku do tylnej ściany żyły głównej powyżej ujścia nieprawidłowo drenujących żył płucnych. W przypadku nieprawidłowego drenażu żył płucnych do jamy prawego przedsionka wykonuje się operację za pomocą plastra. Przy małym ASD jest on rozbudowywany w celu stworzenia odpowiedniego tunelu, który nie zaburza przepływu krwi z żył płucnych do lewego przedsionka. Przy izolowanym nieprawidłowym drenażu żył płucnych do żyły głównej górnej lub prawego przedsionka zaleca się wykonanie sztucznego ubytku przegrody międzyprzedsionkowej z późniejszą korekcją ubytku. W przypadku nieprawidłowego drenażu żył płucnych do żyły głównej dolnej stosuje się jedną z powyższych metod lub odcina się kolektor żyły płucnej i wszczepia się ją do lewego przedsionka. W przypadku nieprawidłowego drenażu lewych żył płucnych do lewej żyły pionowej, żyłę tę podwiązuje się, lewe żyły płucne odcina się i implantuje do uszka lewego przedsionka.
Wyniki operacji są dobre. Śmiertelność chirurgiczna nie przekracza 2-3%. Spośród powikłań możliwe jest częściowe zwężenie żyły głównej górnej, upośledzenie drenażu żył płucnych, uszkodzenie węzła zatokowego lub przedsionkowo-komorowego.
Życie pacjenta jest możliwe tylko w przypadku współistniejącego ASD. Jeśli nie ma ASD, ale jest tylko otwarty przewód tętniczy, pacjenci umierają w młodym wieku, ponieważ lewe części serca nie uczestniczą w krążeniu krwi; śmierć następuje również w przypadku przedwczesnego (przed lub tuż po urodzeniu) zamknięcia otworu owalnego. Istnieje wiele odmian tej złożonej CHD, dlatego zaproponowano różne klasyfikacje. Najprostszą klasyfikacją jest R. Darling i in. (1957) rozróżniają cztery typy defektów: typ I - nadsercowy - zbieg wszystkich żył płucnych przez wspólny pień (kolektor) przez żyłę anomalną do żyły głównej górnej, przez żyłę pionową - do lewej bezimiennej, przez anomalna żyła - do niesparowanej (47% ); Typ II - sercowy - zbieg wszystkich żył płucnych do prawego przedsionka lub zatoki wieńcowej (30%);
- typ - podsercowy - zbieg wszystkich żył płucnych do żyły wrotnej lub żyły głównej dolnej (18%); Typ IV – mieszany – różne kombinacje tych trzech typów (5%) (ryc. 13). Przed wpłynięciem do serca lub idącego do niego naczynia żyły płucne gromadzą się w jednej komorze – kolektorze, który jest następnie połączony z krążeniem ogólnoustrojowym na różnych poziomach. W przypadku tego typu ADLV dochodzi do poszerzenia prawych komór, pnia tętnicy płucnej, podczas gdy lewe serce jest zwykle prawidłowe.
Przy całkowitej ADLV mogą wystąpić anatomiczne przyczyny niedrożności w drenażu żył płucnych: najczęściej jest to spowodowane zwężeniem ujścia nieprawidłowo drenujących żył płucnych lub otworu kolektora, rzadziej występuje ucisk zewnętrzny na nieprawidłową żyłę (na punkt przejścia przez przeponę między lewą tętnicą płucną a lewym oskrzelem głównym). W 80% przypadków podprzeponowej odmianie ADLV towarzyszy niedrożność żył płucnych.
Najczęstszymi współistniejącymi CHD w całkowitej ADLV są wspólne przedsionki, pojedyncza komora, niedorozwój lewych odcinków, transpozycja wielkich naczyń (ta kombinacja tworzy funkcjonalną korekcję wady). W 25-30% przypadków występują pozasercowe wady rozwojowe przewodu pokarmowego (malrotacja jelita, uchyłki, przepuklina pępkowa), śledziona (ageneza, wiele dodatkowych śledzion), moczowo-płciowy
1-nadsercowy poziom; Poziom 2-sercowy (zbieg wszystkich żył płucnych do zatoki wieńcowej); 3 - poziom podsercowy.
(wrodzone torbiele nerek, wodonercze) i układu mięśniowo-szkieletowego.
Hemodynamika. Przy całkowitym ADLV krew z obu kręgów krążenia krwi wchodzi do prawego przedsionka, wielkość i kierunek wyładowania określa stosunek oporów dużych i małych kręgów krążenia krwi i rozkurczowego rozluźnienia komór. Z kolektora do prawego przedsionka dostaje się duża ilość krwi tętniczej, do której przepływają żyły płucne. W przedsionku krew tętnicza miesza się z krwią żylną, stąd przez ASD część krwi (mniejsza) dostaje się do lewego przedsionka, a następnie do krążenia ogólnoustrojowego; więcej krwi jest przesyłane do małego koła, przyczyniając się do zmniejszenia lewego serca i rozwoju nadciśnienia płucnego. Jeśli ASD osiąga znaczne rozmiary, a upływ krwi do krążenia ogólnoustrojowego jest wystarczający, wówczas lewa komora nie jest hipoplastyczna, nadciśnienie płucne nie przekracza stopnia I-II. a pacjenci mogą dożyć dorosłości. W przypadku niedrożności żył płucnych rozwija się żylne nadciśnienie płucne; w przypadku braku fizjologicznej inwolucji w strukturze naczyń płucnych możliwe jest również wrodzone nadciśnienie płucne. Całkowite ADLV charakteryzuje się więc mieszanym krążeniem krwi z niewielkim spadkiem zawartości tlenu w krążeniu ogólnoustrojowym, przeciążeniem prawego serca, nadciśnieniem płucnym (tętniczym, żylnym, wrodzonym).
Klinika, diagnostyka. Przebieg kliniczny całkowitej ADLV jest determinowany przez anatomiczne i hemodynamiczne cechy wady, w szczególności poziom ogólnego oporu płucnego, stopień niedrożności żył płucnych, wielkość komunikacji międzyprzedsionkowej oraz stan mięśnia sercowego prawej komory . Pierwsze oznaki tego typu wady pojawiają się często już od pierwszych dni i miesięcy życia, pojawiają się objawy sercowe
niewydolność, powtarzające się zapalenie płuc i ostre wirusowe infekcje dróg oddechowych, kaszel, opóźnienie w rozwoju fizycznym. Sinica może pojawić się w każdym wieku, często pod koniec pierwszego roku życia. Z reguły jest nieistotny i zauważalny tylko podczas krzyku; wyraźna sinica od pierwszych dni życia jest charakterystyczna dla niedrożności żył płucnych. Garb sercowy (głównie strona prawa) pojawia się wcześniej niż przy izolowanym DMG1G1. Zwykle nie występuje drżenie skurczowe. Podczas osłuchiwania zwiększa się ton I w okolicy zastawki trójdzielnej (oznaka zwiększonego przepływu krwi przez nią). II ton nad tętnicą płucną jest zaakcentowany, rozszczepiony, często występuje III ton; w drugiej przestrzeni międzyżebrowej po lewej stronie słychać szmer skurczowy o średniej intensywności (jak w ASD), przy dolnej krawędzi mostka po lewej stronie możliwy jest szmer mezodiastoliczny. Jeśli kolektor wpływa do żyły głównej górnej i występuje niedrożność żył płucnych, to nad obojczykiem po prawej lub lewej stronie słychać przedłużający się szmer skurczowy.
U dorosłych pacjentów z całkowitą ADLV i nadciśnieniem płucnym słychać skurczowy dźwięk wyrzutu w drugiej przestrzeni międzyżebrowej po lewej stronie (patrz rozdział 2). Niewydolność prawej komory w połączeniu z klinicznymi objawami ASD i umiarkowaną sinicą pozwala podejrzewać całkowitą ADLV u dzieci. U dorosłych pacjentów z tą wadą obraz kliniczny jest nie do odróżnienia od ASD.
Na EKG (ryc. 14) znaczne odchylenie osi elektrycznej serca w prawo (Z.aAQRS od +90 do +210 °), wzrost prawego przedsionka (wysoki bolec Pn.v), prawej komory (w V4R i V| postaci qR ', rR', rSR', załamki R są niskie w odprowadzeniach lewej klatki piersiowej, załamki S są głębokie; objawy te są szczególnie wyraźne w przypadku wysokiego nadciśnienia płucnego
ma R do Vi). Można zaobserwować zespół WPW typu B. Wraz ze wzrostem obciążenia prawej komory poniżej izolinii pojawia się przesunięcie odcinka ST z głębokimi ujemnymi załamkami T w odprowadzeniach II, III, aVF, Vt-Ve.
Fonokardiografia potwierdza dane osłuchowe i posiada wszystkie objawy ASD.
Na radiogramie z całkowitym ADLV obraz płucny jest znacząco wzmocniony zarówno w kanałach tętniczych, jak i żylnych, kardiomegalia umiarkowana lub znaczna spowodowana powiększeniem komór prawej, lewe odcinki normalnej wielkości, czasami powiększony cień widoczna górna żyła główna. W przypadku nadsercowej postaci wady typowy cień sercowy w kształcie ósemki lub bałwana jest typowy, gdzie dolna część to samo serce, a dodatkowa formacja w prawym górnym rogu to kolektor, który zbiera krew ze wszystkich płuc żyły i otwiera się do lewej lub prawej żyły głównej lub żył bezimiennych (ryc. 15). Te ostatnie są rozszerzone, ponieważ zawierają dużą objętość przepływu krwi w płucach. Czasami kształt serca naśladuje powiększoną grasicę. Gdy żyły płucne wpływają do zatoki wieńcowej lub żyły głównej dolnej, nie ma charakterystycznych radiologicznych objawów wady.
M-echokardiografia nie ujawnia wady; objawy pośrednie to stosunkowo niewielki rozmiar lewego przedsionka i lewej komory, poszerzenie prawego przedsionka i komory, paradoksalny ruch przegrody międzykomorowej. Gdy żyły płucne wpływają do zatoki wieńcowej, echokardiografia dwuwymiarowa umożliwia określenie przestrzeni utworzonej przez kolektor żylny za cieniem serca, co potwierdza dożylne podanie kontrastu ultradźwiękowego.
Sondowanie jam serca całkowitym ADLV ujawnia wysokie wysycenie krwi tlenem we wszystkich częściach serca (90-96%); w tętnicy płucnej saturacja jest czasami taka sama jak w aorcie. Najwyższe wysycenie obserwuje się w prawym przedsionku lub w żyle, do której odpływa kolektor płucny. Ciśnienie w tętnicy płucnej może wzrosnąć w wyniku zmian (płodowych, sklerotycznych) w tętniczkach płucnych, zwiększonego przepływu krwi w płucach, niedrożności żył płucnych (jednocześnie wzrasta również ciśnienie w kapilarach płucnych). Ciśnienie w przedsionkach po prawej stronie jest takie samo lub wyższe niż po lewej stronie. W takich przypadkach od pierwszych dni obserwuje się małe ASD i łagodny przebieg choroby. Często pokazywana jest pilna atrioseptostomia (procedura Rush Kinda) podczas cewnikowania.
Wprowadzenie środka kontrastowego do tętnicy płucnej pozwala natychmiast postawić prawidłową diagnozę (ryc. 16). Środek kontrastowy znajduje się w kolektorze żyły płucnej (CLV), przez żyłę pionową (VV) wchodzi do lewej żyły bezimiennej (LV), a następnie do żyły głównej górnej i prawego przedsionka.
diagnostyka różnicowa. U noworodków i dzieci w pierwszych miesiącach życia wada ta jest różnicowana z atrezją zastawki mitralnej lub zastawki aortalnej, zwężeniem zastawki mitralnej, sercem trójprzedsionkowym, zwężeniem żył płucnych, transpozycją wielkich naczyń, limfangektazją; w starszym wieku - z VSD.
Oczywiście, leczenie. Około 80% dzieci z całkowitą ADLV umiera w pierwszych latach życia, zwłaszcza w przypadku wad podsercowych (podprzeponowych) i innych rodzajów wad z niedrożnością żył płucnych. Główne przyczyny zgonów pacjentów: niewydolność serca, zapalenie płuc, przedwczesne zamknięcie otworu owalnego. Im później pojawią się pierwsze objawy choroby, tym lepsze rokowanie. Obserwacje opisano, gdy pacjenci żyli do 30 lat; w takich przypadkach dochodzi do dobrego wymieszania krwi na poziomie przedsionków ze względu na dostateczną wielkość ASD, brak niedrożności żylnej, niski poziom ciśnienia i ogólnego oporu płucnego oraz stan mięśnia sercowego prawej komory jest zadowalająca. W przypadku niewydolności serca wskazane jest wyznaczenie glikozydów nasercowych i diuretyków (patrz rozdział 22). Skuteczna terapia lekowa umożliwia odroczenie leczenia chirurgicznego do starszego wieku, ponieważ korekcji wady we wczesnym wieku towarzyszy śmiertelność od 35 do 50% [Falkovsky GE i in., 1986; Clarke D. i wsp., 1977].
Przy całkowitej ADLV do prawego przedsionka (postać sercowa) operacja wykonywana jest z zastosowaniem bypassu krążeniowo-oddechowego i hipotermii i polega na powiększeniu ubytku międzyprzedsionkowego i nałożeniu łaty w taki sposób, aby skierować przepływ krwi z ujścia żył płucnych przez ubytek do lewego przedsionka. W przypadkach, gdy kolektor spływa przez zatokę wieńcową, w celu uzyskania odpowiedniego drenażu, wycina się część przegrody znajdującej się pomiędzy zatoką wieńcową a okienkiem owalnym, nacina się górną tylną ścianę zatoki wieńcowej, łata przesuwa ścianę i zatoki wieńcowej do lewego przedsionka. W ubytkach typu nadsercowego i podsercowego wykonuje się zespolenie pomiędzy kolektorem żyły płucnej a lewym przedsionkiem [Burakovsky VI i wsp., 1989].
W przypadku ciężkiej hipoplazji lewej komory stosuje się korekcję ASD plastrem perforowanym lub dwuetapowe leczenie chirurgiczne obejmujące: stopień 1 – zespolenie kolektora z lewym przedsionkiem (pozwala na rozwój lewych odcinków serce), etap II - podwiązanie pionu
żyła, przez którą żyły płucne spływają do prawej żyły głównej górnej.
Śmiertelność po operacji u dzieci poniżej 6. roku życia wg
- Galloway i wsp. (1985) wynosił 10%. Jest wyższy w postaci podsercowej, drenażu żył płucnych do żyły głównej górnej, zwłaszcza do prawej (niż gdy dopływają do zatoki wieńcowej lub bezpośrednio do prawego przedsionka), z nadciśnieniem płucnym, niedorozwojem lewej komory i lewego przedsionka .
Podczas operacji w dzieciństwie wyniki odległe są zwykle dobre, ponieważ zmiany miażdżycowe w naczyniach krążenia płucnego i mięśniu sercowym komór serca nie mają czasu na rozwój. Jeśli zespolenie wykazuje oznaki niedrożności czynnościowej, wskazana jest druga operacja.
W tym przypadku dość rzadki rodzaj wady, żyły płucne nie wpływają do lewego przedsionka, ale poprzez nieprawidłowe połączenia do układu żylnego. Wszystkie cztery żyły płucne mogą spływać przez wspólny kolektor albo do żyły głównej górnej, do zatoki wieńcowej lub do układu żyły wrotnej. Bardzo rzadko są połączone bezpośrednio z prawym przedsionkiem.
Ponieważ przy tej wadzie krew z obu kręgów krwi ostatecznie dostaje się do prawego przedsionka, krążenie ogólnoustrojowe jest podtrzymywane przez krew przepływającą przez otwór owalny, o ile oczywiście nie działa przewód tętniczy lub ciśnienie w naczyniach krążenia płucnego nie przekracza tego w statkach wielkiego koła. Cechy hemodynamiki tego typu ubytku, podobnie jak w LVH bez atrezji zastawki mitralnej lub tętniczej, nie wpływają niekorzystnie na rozwój płodu. Lewe części serca płodu otrzymują mniejszą ilość krwi w stosunku do przepływu krwi przez płuca (w zależności od wielkości otworu owalnego), który nie przechodzi przez żyły płucne, ale z prawego przedsionka. Ważnym punktem determinującym naturalny przebieg choroby i symptomatologię jest współistniejąca niedrożność żył płucnych, która niezmiennie występuje, gdy żyły płucne wpływają do krążenia ogólnego poniżej przepony. Niedrożność żył w tym podprzeponowym typie wady wynika z objętości i długości kolektora, zmniejszenia kalibru przewodu żylnego po urodzeniu dziecka lub zwężenia kolektora w miejscu jego przyłączenia do żyły systemowej . Tak więc po urodzeniu dziecka natleniona krew z płuc przechodzi przez żyłę wrotną i wątrobę przed wejściem do prawego przedsionka. Przeciwnie, w ubytku typu nadprzeponowego natleniona krew z płuc dostaje się albo bezpośrednio do zatoki wieńcowej, albo do żyły głównej górnej przez wspólną lewą żyłę pionową lub do prawego przedsionka, mieszając się z układową krwią żylną . Ustalono, że w przypadku tego typu wady może wystąpić niedrożność żylna różnego stopnia.
Na ogół u dzieci z ciężką niedrożnością żył płucnych objawy pojawiają się wcześniej w postaci wady podprzeponowej. W takim przypadku dziecko może doświadczyć obrzęku płuc i niedodmy, rozwija się rozedma śródmiąższowa i zwiększa się liczba przewodów limfatycznych. Ponadto przerost środkowej warstwy żył płucnych i zmiany w tętniczkach płucnych pozostają niezmienione. Ponadto przy ciężkiej niedrożności żył płucnych rozszerzają się żyły oskrzelowe, które pełnią rolę zabezpieczeń. Ściany małych tętnic płucnych pogrubiają się, a masa mięśniowa tętniczek obwodowych wzrasta. Prawe serce i tętnica płucna mają tendencję do rozszerzenia, podczas gdy lewe serce jest stosunkowo małe.
Objawy choroby u noworodków, u których żyły płucne nie są zatkane, pojawiają się później niż przy zatkanych żyłach. Jednocześnie znacznie zwiększa się przepływ krwi przez płuca dziecka. Zazwyczaj u dzieci, u których objawy pojawiają się we wczesnym okresie poporodowym, komunikacja między przedsionkami jest niewielka, tj. jest prowadzona bardziej przez otwór owalny niż przez prawdziwy ubytek przegrody międzyprzedsionkowej. Prognoza zależy od jej wielkości.
Częstość całkowitego nieprawidłowego drenażu żylnego płuc wynosi 2-4% wszystkich wrodzonych wad serca, które ujawniają się w okresie noworodkowym, wada jest równie powszechna zarówno u chłopców, jak iu dziewcząt.
U dzieci z tą wadą krew z naczyń zarówno dużych, jak i małych kręgów dostaje się do prawego przedsionka, a z niego do naczyń płucnych i krążenia ogólnoustrojowego przez otwór w przegrodzie międzyprzedsionkowej i lewej komorze. Pod tym względem poziom pO 2 w naczyniach dużego koła i natlenienie krwi jest mniejszy niż normalnie. Ich bezwzględna wartość zależy od przepływu krwi w płucach. Przy niedrożności żył płucnych zmniejsza się przepływ krwi do płuc i może rozwinąć się przekrwienie i obrzęk płuc, nasilając hipoksemię i sinicę. Bez radykalnej operacji dziecko szybko umiera. W takim przypadku zawsze odnotowuje się nadciśnienie płucne i wcześnie pojawiają się oznaki niewydolności serca. Podprzeponowy typ wady można łatwo założyć, jeśli poziom pO 2 we krwi żyły pępowinowej jest wyższy niż w aorcie.
Całkowity nieprawidłowy drenaż żył płucnych
Słowo „anomalny” oznacza „zły”. Przy tej wadzie żyły płucne (a jest ich cztery), które powinny płynąć do opuścił Atrium, nie wpadaj w to, czyli nie łącz się z nim. Istnieje wiele możliwości ich złego zbiegu.
Występuje „częściowy” anomalny drenaż – wtedy jedna lub dwie z czterech żył dopływają do prawego przedsionka (najczęstsza opcja), a w zdecydowanej większości przypadków łączy się to z ubytkami przegrody międzyprzedsionkowej, o której mówiliśmy to w rozdziale o ASD.
Całkowity lub całkowity anomalny drenaż żył płucnych (TADPV) to zupełnie inna sprawa. W przypadku tej wady wszystkie cztery żyły płucne z obu płuc są połączone w jeden szeroki kolektor naczyń. Ten kolektor krwi tętniczej utlenionej w płucach nie łączy się z lewym przedsionkiem, jak powinien, ale łączy się z układem żylnym organizmu, zwykle przez dużą żyłę. Krew tętnicza w ten sposób, omijając serce, wchodzi do dużych żył i do prawego przedsionka. Tylko tutaj, po przejściu przez ubytek przegrody międzyprzedsionkowej, będzie tam, gdzie powinien być początkowo - w lewym przedsionku, a następnie pokonuje zwykłą ścieżkę przez krążenie ogólnoustrojowe. Trudno sobie w ogóle wyobrazić, jak mogłoby to być. Ale dzieci z tą wadą rodzą się w terminie, a serce od jakiegoś czasu radzi sobie z taką sytuacją. Jednak ten czas może być bardzo krótki.
Po pierwsze, życie dziecka zależy od wielkości komunikatu międzyprzedsionkowego – im jest on mniejszy, tym trudniej krwi tętniczej dotrzeć do miejsca docelowego w lewej połowie serca.
Po drugie, w tej lewej połowie serca znaczna część krwi jest po prostu żylna, tj. nieutleniony i ponownie zostanie wciśnięty w duży okrąg. U dziecka w ten sposób w tętnicach zaczyna krążyć częściowo krew żylna, a dziecko staje się „niebieskie”, tj. kolor skóry, a zwłaszcza - opuszki palców i błony śluzowe (wargi, usta) - sinicowy. To jest sinica, ao jej przyczynach, przejawach i konsekwencjach porozmawiamy później.
Przy całkowitym nieprawidłowym drenażu sinica może nie być bardzo wyraźna, ale jest obecna i zwykle jest zauważalna wkrótce po urodzeniu.
W większości przypadków stan dzieci z całkowitym nieprawidłowym drenażem żylnym płuc jest „krytyczny” od samego początku życia. Jeśli nic nie zostanie zrobione, umrą za kilka dni lub miesięcy.
Leczenie chirurgiczne istnieje, a dzisiejsze wyniki są dość zachęcające. Operacja jest dość skomplikowana, wykonywana jest na otwartym sercu i polega na tym, że wspólny kolektor żyły płucnej jest przyszyty do lewego przedsionka, a otwór w przegrodzie międzyprzedsionkowej jest zamknięty łatą. W ten sposób po operacji przywracane jest normalne krążenie krwi w dwóch oddzielnych kręgach.
Czasami dopuszczalna jest również opcja awaryjna - rozszerzenie wady podczas sondowania jako pierwszy, ratujący życie etap, co pozwala nieco opóźnić główną interwencję.
Nie poruszymy tutaj wielu szczegółów związanych z różnego rodzaju imadłami i sposobami ich korygowania. Ale chcemy tylko podkreślić, że dzieci z tą wadą potrzebują natychmiastowa specjalistyczna pomoc, która dzisiaj jest absolutnie realna.
Długofalowe wyniki operacji są całkiem dobre – w końcu główna wada została wyeliminowana. Jednak dzieci powinny znajdować się pod opieką kardiologów, ponieważ możliwe są powikłania w postaci zaburzeń rytmu lub zwężenia żył płucnych w miejscach zszycia (wynika to z faktu, że serce, które przeszło tak poważną operację nadal rosnąć). I znowu chcemy podkreślić: to dziecko nie jest niepełnosprawne. Musi prowadzić absolutnie normalne życie, a im szybciej operacja zostanie wykonana, tym szybciej wszystko zostanie zapomniane.
Pacjenci
Informacja zwrotna
© Copyright 1998 - 2018, Federalna Państwowa Instytucja Budżetowa „N.M. JAKIŚ. Bakulev” Ministerstwa Zdrowia Rosji. Wszelkie prawa zastrzeżone.
Choroby → Całkowity nieprawidłowy drenaż żył płucnych
Materiały zamieszczone w serwisie są zweryfikowanymi informacjami od specjalistów z różnych dziedzin medycyny i służą wyłącznie celom edukacyjnym i informacyjnym. Witryna nie zapewnia porad medycznych i usług związanych z diagnozowaniem i leczeniem chorób. Rekomendacje i opinie specjalistów publikowane na łamach portalu nie zastępują wykwalifikowanej opieki medycznej. Możliwe przeciwwskazania. ZAWSZE skonsultuj się z lekarzem.
Zauważyłeś błąd w tekście? Wybierz go myszką i naciśnij Ctrl + Enter! DZIĘKUJĘ!
Całkowity nieprawidłowy drenaż żył płucnych u noworodków
Wszystkie żyły płucne spływają do prawego serca.
Suyaracardial (żyły płucne spływają do wznoszącej się żyły pionowej, żyły bezimiennej);
Sercowy (żyły płucne spływają do prawego przedsionka, zatoki wieńcowej);
Podsercowe (żyły płucne spływają do żył wewnątrzbrzusznych).
PATOFIZJOLOGIA
Pomimo odmiennej anatomii wady, pod względem patofizjologii krążenia, można ją podzielić na dwa typy w zależności od obecności lub braku niedrożności żył płucnych. Ważna dla kontynuacji życia w okresie poporodowym jest obecność komunikacji między RA (prawym przedsionkiem) a LP (lewym przedsionkiem) (AMPP, LLC).
Hemodynamika nieobturacyjnej odmiany TALV jest podobna do tej w przypadku dużego ASD. Krew z żył płucnych dostaje się do RA, następnie do RV (prawej komory), aw przypadku ASD do LA. W takim przypadku ilość krwi powracającej przez ASD do LA zależy od wielkości ubytku i stopnia rozciągliwości prostaty. Jednak w każdych warunkach znacznie większa część krwi dostaje się do trzustki i krąży w ICC (krążenie płucne), powodując przeciążenie objętościowe trzustki i wyraźną hiperwolemię ICC. Ciśnienie w LA (tętnicy płucnej) pozostaje niskie. Ze względu na to, że mieszanie się krwi żylnej i tętniczej pochodzącej z żył płucnych następuje na poziomie PP, saturacja w LA i aorcie jest identyczna.
W obturacyjnym wariancie TALV odpływ krwi wzbogaconej w tlen z żył płucnych jest utrudniony. Prowadzi to do rozwoju żylnego nadciśnienia płucnego, a następnie do wzrostu ciśnienia w LA i trzustce. Powstaje sytuacja przypominająca hemodynamikę w zwężeniu zastawki mitralnej. W tym przypadku ryzyko wystąpienia obrzęku płuc jest wysokie, ponieważ. ciśnienie hydrostatyczne w naczyniach włosowatych staje się znacznie wyższe niż ciśnienie osmotyczne krwi. Dopóki istniejące ASD zapewnia wystarczającą objętość przecieku krwi z prawej na lewą, jama trzustki pozostaje mała. Lewa strona serca, podobnie jak w przypadku nieobturacyjnej odmiany TALV, pozostaje „niedociążona” i ma stosunkowo niewielkie rozmiary. Poziom nasycenia tlenem w aorcie i LA jest równy, ale jego wartości są znacznie niższe niż w nieobturacyjnej odmianie wady. Stopień desaturacji tętnic będzie odwrotnie proporcjonalny do objętości przepływu krwi w ICC.
Rokowanie dla pacjentów z TALV jest wyjątkowo niekorzystne. Bez korekcji chirurgicznej dwie trzecie pacjentów z nieobturacyjną postacią choroby umiera do końca pierwszego roku życia.
Przyczyną śmierci jest często zapalenie płuc. W wariancie obturacyjnym oczekiwana długość życia to miesiąc.
KLINIKA
a. Objawy kliniczne choroby:
Obstrukcyjny wariant TADLV:
Charakteryzuje się szybko postępującą sinicą od urodzenia, która nasila się wraz z karmieniem, co jest związane z uciskiem żył płucnych przez przełyk;
Duszność i objawy obrzęku płuc w okresie noworodkowym.
Umiarkowana sinica od urodzenia;
Opóźnienie w rozwoju fizycznym, częste infekcje oskrzelowo-płucne;
Objawy niewydolności serca (tachykardia, duszność, powiększenie wątroby).
b. Badanie lekarskie:
Obstrukcyjny wariant TADLV:
Głośny ton II u podstawy serca;
Nieobstrukcyjny wariant TADLV:
Ton II jest rozszczepiony u podstawy serca (uwydatniony jest składnik płucny tonu II);
Słabe lub umiarkowane nasilenie (nie więcej niż 3/6) szmer skurczowy względnego zwężenia zastawki płucnej w II m. po lewej stronie mostka;
Mezodiastoliczny szmer względnego zwężenia TC (zastawka trójdzielna) wzdłuż lewej krawędzi mostka w dolnej jednej trzeciej (ze znacznym przepływem z RA).
DIAGNOSTYKA
- Elektrokardiografia
Obstrukcyjny wariant TADLV:
przerost trzustki (typ R);
Rzadko przerost PP.
Nieobstrukcyjny wariant TADLV:
Przerost trzustki w zależności od rodzaju blokady prawej nogi pęczka Hisa w odprowadzeniu Vj (konsekwencja przeciążenia objętościowego trzustki);
Rzadko przerost PP.
Rozpoznanie TALVV opiera się na braku wszystkich żył płucnych dopływających do lewego przedsionka w typowych miejscach.
Ostre poszerzenie prawych części serca;
Rozbudowa tętnicy płucnej;
Znaczna redukcja lewych kamer;
Rozszerzona żyła pionowa i żyła główna górna;
Obecność ASD z wyładowaniem prawo-lewym.
LECZENIE I OBSERWACJA
- 1. Monitorowanie i leczenie pacjentów z nieskorygowaną TALV
Wariant obturacyjny TALV jest nagłym wskazaniem do operacji. Przed wejściem pacjenta do kliniki kardiochirurgicznej należy podjąć następujące działania:
a. IV wlew preparatów prostaglandyny E 1, który utrzyma otwarty przewód i zapewni odpływ krwi z LA do aorty. Zmniejszy to ryzyko rozwoju obrzęku płuc i zwiększy objętość przepływu krwi w BCC.
w. Korekcja kwasicy metabolicznej.
Nieobstrukcyjny wariant TADLV:
a. Intensywna opieka nad niewydolnością serca (diuretyki, digoksyna).
b. Jeśli wystąpi kwasica metaboliczna, jest ona korygowana.
Przy ustalaniu diagnozy TALV z obecnością małego / restrykcyjnego ASD wykonuje się zabieg Rashkinda w celu zwiększenia objętości przepływu krwi w BCC. Wskazaniem do zabiegu jest obecność restrykcyjnej komunikacji między przedsionkami – gradient ciśnienia powyżej 6 mm Hg.
Wskazania do leczenia chirurgicznego:
Ustalenie rozpoznania TADLV jest bezwzględnym wskazaniem do operacji.
Przeciwwskazania do leczenia chirurgicznego:
Obecność bezwzględnych przeciwwskazań do jednoczesnego stosowania
Wysoka żylna odporność naczyń płuc.
Taktyka chirurgiczna
Czas operacji zależy od obecności lub braku niedrożności żył płucnych.
W obturacyjnej TALV interwencję przeprowadza się natychmiast w ciągu pierwszych godzin po postawieniu diagnozy. Zwykle są to pierwsze godziny życia dziecka.
W nieobturacyjnej TALV leczenie chirurgiczne może być opóźnione i wykonane w pierwszych miesiącach życia.
Technika chirurgiczna
w warunkach IR. Przydziel wspólny kolektor LV w miejscu jego zbiegu. Zwykle kolektor jest wystarczająco długi (nawet w przypadku drenażu podsercowego), aby przenieść go do lewego przedsionka. Kolektor jest szeroko otwarty, eliminując obszary zwężeń. Szeroko otwórz lewe przedsionek. Pomiędzy kolektorem PV a LA powstaje szerokie zespolenie. Dodatkowe elementy układu żylnego (żyła pionowa itp.) są podwiązane.
Specyficzne powikłania leczenia chirurgicznego
Resztkowe nadciśnienie płucne;
Naruszenie rytmu serca (zespół osłabienia węzła zatokowego), częstoskurcz przedsionkowy;
Zmniejszona pojemność minutowa serca z powodu resztkowej niedrożności drogi odpływu PV.
Kontrola pooperacyjna
- Obserwacja prowadzona jest co miesiąc. Czas trwania obserwacji ustalany jest indywidualnie. Prowadzone jest monitorowanie późnych powikłań chirurgicznej korekcji wady: zwężenia żył płucnych, zaburzeń rytmu serca.
- W przypadku rejestracji w okresie pooperacyjnym NRS, oprócz badania, zaleca się SMEKG co 6 miesięcy lub częściej. W razie wskazań wykonuje się terapię antyarytmiczną, RFA lub wszczepienie stymulatora.
- Zapobieganie bakteryjnemu zapaleniu wsierdzia odbywa się zgodnie ze wskazaniami, jeśli występuje zwężenie żył płucnych.
- Dopuszczalność wychowania fizycznego po naprawie wady. Aktywność fizyczna jest ograniczona u pacjentów ze zwężeniem żył płucnych.
Jeśli znajdziesz błąd, wybierz fragment tekstu i naciśnij Ctrl + Enter.
Całkowity nieprawidłowy drenaż żył płucnych (TADLV)
Całkowity nieprawidłowy drenaż żył płucnych to wada, w której nie ma bezpośredniego połączenia między żyłami płucnymi a lewym przedsionkiem. Żyły płucne nieprawidłowo spływają do prawego przedsionka lub jego dopływów. Prawie wszyscy pacjenci mają przetrwały otwór owalny lub ASD.
TADLV został po raz pierwszy opisany przez Wilsona w 1798 roku. W 1951 roku Muller przeprowadził pierwszą udaną operację. Była paliatywna. Bez użycia technologii otwartego serca wykonano zespolenie pomiędzy kolektorem żyły płucnej a lewym uchem. W 1956 Lewis, Varco i wsp. donieśli o udanej korekcji wady w warunkach umiarkowanej hipotermii wywołanej chłodzeniem powierzchniowym i czasową niedrożnością dopływu żylnego do serca. W tym samym roku Burroughs i Kirklin wykonali korekcję wady w IR. Doświadczenia kolejnych lat wykazały, że śmiertelność niemowląt była istotnie wyższa niż dzieci starszych. Z biegiem czasu w literaturze zaczęły pojawiać się doniesienia o powodzeniu operacji u pacjentów z ciężką postacią obturacyjną TALV. Poprawa wyników była związana z wprowadzeniem perfuzji hipotermicznej ze zmniejszoną objętością przepływu krwi i zatrzymaniem krążenia.
Częstość występowania TALV według różnych badań waha się od 0,83 do 2,8%.
Morfogeneza
Związek powstawania TADLV ze znanymi zewnętrznymi czynnikami teratogennymi nie został jasno ustalony, chociaż prawdopodobną przyczyną może być narażenie na ołów, farby, rozpuszczalniki i pestycydy. Genetyczny charakter TALV nie został zidentyfikowany, ale jednogenowy wzór dziedziczenia nie jest wykluczony ze względu na liczne doniesienia o rodzinnych przypadkach wśród spokrewnionych braci i sióstr. Gen tej rodzinnej postaci TADLV jest połączony z chromosomem 4q13-q12. W tym samym regionie znaleziono gen receptora czynnika wzrostu śródbłonka naczyniowego, który jest związany z rodzinną i prawdopodobnie sporadyczną postacią TADLW.
TADLV łączy się z wieloma wrodzonymi zespołami - asplenią, polisplenia, zespołem kociego oka. W przypadku zespołu kociego oka 50% pacjentów ma takie CHD jak TADLV, tetralogia Fallota, VSD, ATK.
Anatomia
Zgodnie z klasyfikacją kliniczną Darlinga i wsp., w zależności od poziomu drenażu, wada jest reprezentowana przez cztery opcje:
Nadkardialny. Stanowi 50% wszystkich TADLV. Wspólny kolektor żylny płucny, znajdujący się za lewym przedsionkiem, spływa do PVVC przez lewą żyłę pionową i lewą żyłę bezimienną.
Wewnątrzsercowe. Obserwuje się ją u 20% pacjentów z TALV. Wspólny kolektor żył płucnych spływa do zatoki wieńcowej lub osobno uchodzi do prawego przedsionka czterema otworami.
Podsercowe. Występuje w 20% przypadków. Wspólny kolektor żylny płucny spływa do żyły wrotnej, przewodu żylnego, żyły wątrobowej i IVC. Wspólna żyła płucna poprzez żyłę pionową, która przebija przeponę w przełyku, łączy się z żyłami wrotnymi i IVC przez przewód żylny lub zatoki wątrobowe.
Mieszany. Występuje u 10% pacjentów. Ten typ jest kombinacją poprzednich opcji.
Życie pacjenta jest możliwe tylko w obecności współistniejącego ASD lub otwartego owalnego okna, które są integralną częścią wady. Z tego samego powodu przetrwały przetrwały przewód tętniczy u małych dzieci nie jest komplikującą anomalią.
Niezależnie od lokalizacji nieprawidłowego połączenia żył płucnych serce u pacjentów z TADLV ma wspólne cechy anatomiczne: poszerzenie i przerost prawej komory i prawego przedsionka, poszerzenie tętnicy płucnej. Lewa połowa serca jest stosunkowo słabo rozwinięta, zwłaszcza lewy przedsionek. Jego objętość jest zmniejszona do 50% normy.
Połączenie z prawym przedsionkiem
Skrzyżowanie znajduje się zwykle w dolnej części prawego przedsionka. Wspólna żyła płucna lub dwie, trzy lub cztery żyły płucne spływają do prawego przedsionka. Zwężenie nieprawidłowych połączeń żył płucnych jest rzadkie. Powiązane wady serca są powszechne.
Połączenie z odpowiednim wspólnym systemem kardynalnym
Żyły płucne po obu stronach tworzą wspólny kolektor znajdujący się za lewym przedsionkiem. Pojedynczy żylny pień odchodzi z prawej strony tego kolektora, który unosi się, przechodzi przed korzeniem prawego płuca i wpada do SVC. W rzadkich przypadkach łączy się z v.azygos. Chirurdzy domowi spotkali się z tym wariantem TADLV u jednego pacjenta. Nie postawiono dokładnej diagnozy przed operacją. Badanie zewnętrzne i wewnątrzsercowe nie wykazało połączenia kolektora z prawym sercem, pomimo znacznego rozszerzenia SVC. Po utworzeniu zespolenia pomiędzy kolektorem żyły płucnej a lewym przedsionkiem i odłączeniu od EC, rzut serca uległ zmniejszeniu, co objawiało się niedociśnieniem tętniczym. Przy próbnym, krótkotrwałym zaciśnięciu SVC w miejscu jego zbiegu z prawym przedsionkiem, ciśnienie tętnicze odpowiednio wzrosło. Stało się jasne, że na krótkiej ścieżce od lewego przedsionka do SVC doszło do wycieku krwi. Tylna ściana SVC była odsłonięta na całej jej długości i znaleziono powiększoną żyłę nieparzystą. Po jej bandażowaniu przywrócono prawidłową hemodynamikę.
Połączenie z lewym wspólnym systemem kardynalnym
Lewa żyła bezimienna.
W tym, najczęstszym wariancie TALV, żyły płucne po obu stronach tworzą wspólny kolektor za lewym przedsionkiem. Żyła pionowa wychodząca z lewej strony kolektora zwykle biegnie do przodu od lewej tętnicy płucnej i oskrzela głównego, wstępuje do śródpiersia górnego, przechodzi do przodu do łuku aorty i łączy się z lewą żyłą bezimienną proksymalnie do zbiegu lewej szyjnej i żyły podobojczykowe. Lewa żyła bezimienna normalnie łączy się z SVC. Rzadziej żyła pionowa przebiega między lewą tętnicą płucną a lewym oskrzelem głównym. Struktury te ściskają go z zewnątrz, powodując utrudnienie odpływu żylnego płucnego. Pień żylny łączący kolektor z lewą żyłą bezimienną nazywamy przetrwałą lewą żyłą główną górną lub anomalną żyłą pionową.
Naczynie łączące kolektor żyły płucnej bezpośrednio z SVC z pominięciem żyły bezimiennej przechodzi między prawą tętnicą płucną a tchawicą i jest przez nie uciskane. Jednym z wariantów niedrożności żył pionowych jest jego dyskretne lub rozlane zwężenie.
Nieprawidłowa droga żylna biegnie wewnątrz osierdzia. Żyły płucne łączą się ze wspólnym pniem, który łączy się z zatoką wieńcową w bruździe przedsionkowo-komorowej. Zatoka wieńcowa następnie przechodzi normalną drogą do prawego przedsionka, a otwór znajduje się, jak zwykle, między IVC a zastawką trójdzielną. Żyły serca normalnie spływają do zatoki wieńcowej. Ten ostatni pokryty jest włóknami lewego przedsionka. Zatoka wieńcowa ma na prawie całej długości wspólną ścianę z lewym przedsionkiem. Mogą wystąpić zwężenia na połączeniu lub w połączeniu wspólnej żyły płucnej z zatoką wieńcową.
Połączenie z systemem pępowinowo-żółtkowym
Złącze dystalne znajduje się poniżej przepony. Żyły płucne po obu stronach tworzą wspólny kolektor za lewym przedsionkiem. Wspólny pień żylny odchodzi od środkowej części kolektora, schodzi do przodu do przełyku i penetruje przeponę przez otwór przełykowy. Najczęściej żyła anomalna łączy się z żyłą wrotną u zbiegu żyły śledzionowej i żyły krezkowej górnej. Rzadziej anomalny pień łączy się z przewodem żylnym, jedną z żył wątrobowych lub bezpośrednio z żyłą główną dolną. W tym typie TALV zwykle występuje niedrożność powrotu żylnego płuca.
Miejsca anatomicznej niedrożności drenażu żył płucnych
Wielu pacjentów z nad- i wewnątrzsercowymi typami TALV oraz większość pacjentów z typem podsercowym ma nadciśnienie płucne z powodu niedrożności powrotu żył płucnych w postaci zwężenia ujścia żyły płucnej, ujścia kolektora lub zewnętrznego ucisku na nieprawidłową żyłę. Obecność niedrożności w nieprawidłowym żylnym kanale płucnym ma decydujący wpływ na stan hemodynamiczny i objawy kliniczne.
Niedrożność na poziomie przegrody międzyprzedsionkowej.
Niewielka komunikacja międzyprzedsionkowa może zakłócać przepływ krwi do lewego przedsionka, a tym samym zakłócać odpływ krwi z żył płucnych. Średnia długość życia pacjentów z TALV jest oczywiście związana z rozmiarem ASD. Pacjenci z dużymi wadami żyją dłużej niż ci z restrykcyjną komunikacją przedsionkową.
Zwężenie żył płucnych i ich ujść jest szczególnie częste w izomerii przedsionkowej. Badanie histologiczne ujawnia pogrubienie błony środkowej i przydanki oraz proliferację błony wewnętrznej.
Niedrożność nieprawidłowych dróg żylnych.
Jedną z przyczyn niedrożności jest ciśnienie zewnętrzne. Tak więc w nadsercowej TALV żyła pionowa może przechodzić za lewą tętnicą płucną i być uciskana w wąskiej przestrzeni między oskrzelem, tętnicą płucną i przetrwałym przewodem tętniczym lub więzadłem. Można go uciskać między prawą tętnicą płucną a tchawicą. Występuje również wewnętrzne zwężenie w typowym przejściu żyły pionowej przed lewą tętnicą płucną. W przypadku podsercowego TALV dochodzi do ucisku żyły pionowej w przełyku. W przypadkach, gdy żyła pionowa jest połączona z przewodem żylnym, jej naturalne zwężenie zakłóca odpływ krwi z żył płucnych. Wreszcie, gdy anomalna żyła łączy się z żyłą wrotną lub jednym z jej dopływów, zatoki wątrobowe ściskają żylny kanał płucny, utrudniając powrót żył płucnych.
Atrezja wspólnej żyły płucnej
Rzadko atrezja wspólnej żyły płucnej jest zbiegiem wszystkich żył płucnych bez połączenia z sercem lub żyłami układowymi. Krótka żywotność jest możliwa dzięki małym połączeniom między żyłami oskrzelowymi i płucnymi. Przy tej patologii wyraźne jest rozszerzenie płucnych naczyń limfatycznych. Atrezja pospolita żył płucnych jest najcięższą postacią obturacyjnej TALV, objawiającą się ciężkim obrzękiem płuc i silną sinicą zaraz po urodzeniu. Rozpoznanie ustala się na podstawie echokardiografii i angiografii. Interwencja chirurgiczna jest skuteczna tylko w wyjątkowych przypadkach. ECMO stosuje się przed i po zabiegu do czasu poprawy stanu płuc.
Powiązane wady serca
TADLV łączy się z wieloma CHD, szczególnie często u pacjentów z heterotaksją przedsionkowo-brzuszną:
tetrada z brakującą zastawką płucną;
przerwanie łuku aorty;
poprawiona i pełna transpozycja wielkich statków;
komora z dwoma wylotami;
zespół hipoplazji lewych części serca;
zespół szabli tureckiej.
Mikrostruktura płuc
Obraz histologiczny zależy od obecności lub braku niedrożności żył płucnych. W przypadku braku niedrożności w tętnicach mięśniowych i tętniczkach dochodzi do wyraźnego przerostu warstwy przyśrodkowej. Powiększenie błony wewnętrznej jest rzadko obserwowane u niemowląt, ale jest powszechnie obserwowane u starszych dzieci i dorosłych.
TALV z niedrożnością charakteryzuje się przyśrodkowym przerostem ścian nieprawidłowych kanałów żylnych, żył pozapłucnych i małych żył płucnych. Wykazano, że ściany tętnic i żył płucnych z nieprawidłowym drenażem są znacznie grubsze niż normalnie, z VSD i nadciśnieniem płucnym. Pogrubienie warstwy przyśrodkowej w tętnicach i żyłach jest bardziej wyraźne w przypadku niedrożności żył płucnych. Pogrubienie warstwy mięśniowej w małych tętnicach płucnych w TALV koreluje z ciśnieniem w tętnicy płucnej. Przy tym samym ciśnieniu w tętnicy płucnej pogrubienie przyśrodkowe jest zawsze bardziej wyraźne w TALV niż w VSD. Grubość środkowej warstwy żył płucnych jest również ściśle związana z poziomem tętniczego nadciśnienia płucnego u pacjentów z TAHD. Tętnice zwykle wykazują proliferację błony wewnętrznej, a martwicze zapalenie tętnic jest powszechne.
Przestrzenie międzypęcherzykowe charakteryzują się obrzękiem i wynaczynieniem erytrocytów. Podopłucnowe i międzyzrazikowe naczynia limfatyczne są rozszerzone. Limfangiektazja występuje u 62% pacjentów z TALV. Towarzyszy mu rozedma śródmiąższowa, która jest jedną z przyczyn śmiertelności pooperacyjnej.
Hemodynamika
Prawy przedsionek otrzymuje krew z obu obiegów. Krew tętnicza dostaje się do prawego przedsionka z kolektora, do którego przepływają żyły płucne. W przedsionku miesza się z żylnym, stąd przez VSD lub otwarte owalne okno część krwi dostaje się do lewego przedsionka, a następnie do krążenia ogólnoustrojowego; druga część trafia do małego koła. Charakter krążenia krwi zależy od rozmieszczenia mieszanej krwi żylnej między kręgami płucnym i układowym. Krążenie krwi wynika przede wszystkim z wielkości komunikacji międzyprzedsionkowej. Jeśli jest restrykcyjna, ilość krwi przedostającej się do lewego przedsionka jest mała, a ogólnoustrojowy przepływ krwi jest zmniejszony. Spadek ogólnoustrojowego przepływu krwi jest częściowo kompensowany wzrostem ciśnienia w prawym przedsionku. Ponieważ wszystkie żyły systemowe i płucne spływają do prawego przedsionka, ciśnienie w obu basenach żylnych wzrasta.
Przy szeroko otwartym otworze owalnym lub ASD istnieje swobodny przepływ krwi między dwoma przedsionkami. W tych warunkach rozkład mieszanej krwi żylnej zależy od stosunku oporów dużych i małych kręgów krążenia krwi i rozciągliwości komór. U pacjentów z niedrożnością żył płucnych rozwija się żylne, aw związku z tym tętnicze nadciśnienie płucne. W przypadku braku inwolucji płodowej struktury tętnic płucnych czasami występuje pierwotne nadciśnienie płucne.
TALV charakteryzuje się przeciążeniem prawego serca i nadciśnieniem płucnym.
TALV bez niedrożności żylnej
Po urodzeniu rozkład przepływu krwi między dużymi i małymi okręgami jest w przybliżeniu taki sam, ponieważ opór naczyniowy jest prawie równy. W pierwszych tygodniach życia dochodzi do dojrzewania płucnego łożyska naczyniowego, spadku oporu w tętnicy płucnej i stopniowego zwiększania objętości mieszanej krwi żylnej dostającej się do krążenia płucnego. Przepływ krwi w płucach jest 3-5 razy większy niż ogólnoustrojowy. Ogólnoustrojowy przepływ krwi jest normalny. Ponieważ pula mieszanej krwi żylnej otrzymuje od 3 do 5 części w pełni arterializowanej krwi do jednej części nienasyconej układowej krwi żylnej, saturacja prawego przedsionka tlenem może przekroczyć 90%. Z reguły krew w prawym przedsionku dobrze się miesza, więc wysycenie krwi w prawej komorze, tętnicy płucnej, lewym przedsionku, lewej komorze i aorcie jest takie samo jak w prawym przedsionku.
W TALV obserwuje się poszerzenie i przerost prawej komory oraz poszerzenie tętnicy płucnej.
Ciśnienie w tętnicy płucnej u niemowląt waha się od lekko podwyższonego do ogólnoustrojowego. U nielicznych dzieci, które przeżyły okres dojrzewania i później, ciśnienie w tętnicy płucnej jest nieznacznie podwyższone. Z biegiem czasu w tętniczkach płucnych rozwija się hipertorofia przyśrodkowa i proliferacja błony wewnętrznej, dlatego bardziej nasilone nadciśnienie obserwuje się w 3. i 4. dekadzie życia.
TALV z niedrożnością żył płucnych
Podwyższone ciśnienie w płucnych kanałach żylnych jest przenoszone do łożyska naczyń włosowatych płuc. Gdy ciśnienie hydrostatyczne w naczyniach włosowatych przekracza ciśnienie osmotyczne krwi, rozwija się obrzęk płuc. Mechanizmy mające na celu zapobieganie obrzękowi płuc obejmują zwiększony ruch limfatyczny, alternatywne kanały pomostowania żył płucnych, zmniejszoną przepuszczalność ścian naczyń włosowatych płuc i odruchowy skurcz tętniczek. To ostatnie prowadzi do zmniejszenia przepływu krwi w płucach, nadciśnienia płucnego, wzrostu ciśnienia w prawej komorze, przerostu i niewydolności prawej komory. Zmniejszenie objętości płucnego przepływu krwi prowadzi do zmniejszenia udziału krwi utlenowanej w mieszanej krwi żylnej i zmniejszenia wysycenia tętnic krążenia ogólnoustrojowego.
Klinika, diagnostyka
Przebieg kliniczny TALVV determinują anatomiczne i hemodynamiczne cechy wady, a w szczególności:
poziom ogólnego oporu płucnego;
stopień niedrożności żył płucnych;
rozmiar wiadomości międzyprzedsionkowej;
stan mięśnia sercowego prawej komory;
obecność funkcjonującego przewodu tętniczego.
TALV bez niedrożności żył płucnych
Te dzieci są bezobjawowe po urodzeniu. Wkrótce u połowy dzieci pojawia się duszność, kaszel, trudności w karmieniu, nawracające infekcje dróg oddechowych i niewydolność serca. Pozostałe objawy pojawiają się w pierwszym roku życia.
Sinica może pojawić się w każdym wieku. Początkowo sinica nie jest wyraźna i nasila się w obecności niewydolności serca, a także w wyniku stopniowo rozwijających się zmian wtórnych w naczyniach płucnych. W pierwszym roku życia umiera 75-85% dzieci, najwięcej w ciągu pierwszych 3 miesięcy. Niemowlęta są zapóźnione w rozwoju fizycznym, rozdrażnione, płaczem i wysiłkiem, twarz ciemnieje. Prawie zawsze występują duszność, szybki oddech i tachykardia. Garb sercowy, głównie prawostronny, pojawia się wcześniej niż w przypadku izolowanego ASD.
Obraz osłuchowy charakteryzuje się obecnością wielu tonów serca. Pierwszy ton jest głośny i wyraźny, po nim następuje ton wygnania. Drugi ton jest szeroko rozdwojony i nie zmienia się wraz z oddychaniem. Uwydatnia się składnik płucny tonu II. Prawie zawsze słychać trzeci ton, maksymalnie na górze. U starszych pacjentów prawie zawsze słyszalny jest ton serca z IV.
Szmery serca mogą czasami być nieobecne. Drżenie nie jest odczuwalne. Na tętnicy płucnej zwykle słychać cichy szmer skurczowy. Często hałas jest dobrze słyszalny w wyrostku mieczykowatym i wzdłuż dolnej krawędzi mostka po lewej stronie. Szmery są wynikiem turbulentnego przepływu w drodze odpływu płucnego i niewydolności zastawki trójdzielnej. W połowie przypadków poniżej lewej krawędzi mostka słychać rozkurczowy szmer o zwiększonym przepływie krwi przez zastawkę trójdzielną. Podczas opróżniania kolektora do lewej żyły bezimiennej, po prawej lub lewej stronie u podstawy serca, słychać przedłużający się szmer skurczowy. W przeciwieństwie do czynnościowych szmerów żylnych, szmery patologiczne nie zwiększają rozkurczu i nie zmieniają się wraz ze zmianą pozycji lub naciskiem na żyły szyjne.
W przypadku niewydolności serca wątroba jest powiększona, występują obrzęki obwodowe. U niektórych dzieci, które przeżyły niemowlęctwo, końcowe paliczki palców są pogrubione.
Typowym objawem jest wysoka, zaostrzona fala P w odprowadzeniach II lub prawej, odzwierciedlająca powiększenie prawego przedsionka. Oś elektryczna odchylona w prawo. Zawsze występują objawy przerostu prawej komory, objawiające się wysokim napięciem zębów w odprowadzeniach prawych oraz niepełną blokadą bloku prawej odnogi pęczka Hisa.
Celem USG TALV jest potwierdzenie rozpoznania klinicznego i zlokalizowanie miejsca nieprawidłowego drenażu. Badania dopplerowskie mogą wykryć obecność niedrożności w poszczególnych żyłach płucnych i wzdłuż żyły pionowej. Objawem wspólnym dla wszystkich postaci TALV jest przeciążenie objętości prawej komory. Prawa komora jest poszerzona. Poszerzeniu ulega również prawy przedsionek i tętnice płucne, a przegroda międzyprzedsionkowa wybrzusza się w lewo. Obserwuje się paradoksalny ruch przegrody międzykomorowej.
Oprócz objawów przeciążenia objętościowego prawej komory podejrzenie TALV wynika z niemożności prześledzenia przepływu żył płucnych do lewego przedsionka wzdłuż wysokiej przymostkowej lub nadmostkowej osi krótkiej. Z tego, jak również z położenia podżebrowego, można wykryć przestrzeń wolną od echa, czyli wspólny kanał żylny płucny za lewym przedsionkiem z dopływającymi do niego żyłami płucnymi. Po zidentyfikowaniu wspólnego kolektora żylnego należy zlokalizować miejsce jego drenażu. W nadsercowym TALVV wstępująca żyła pionowa spływa do poszerzonej układowej struktury żylnej, najczęściej do lewej żyły bezigłowej lub LVVC. Badanie dopplerowskie żyły pionowej ujawnia kierunek przepływu krwi ku górze i przeciwny kierunek przepływu krwi w żyle głównej górnej.
W przypadku drenażu TALV do zatoki wieńcowej, ta ostatnia jest poszerzona i może być wykryta wzdłuż długiej osi przymostkowej lub z pozycji wierzchołkowej czterojamowej.
Badanie dopplerowskie żyły pionowej ujawnia kierunek przepływu krwi ku górze, w przeciwieństwie do ruchu przeciwnego w żyle głównej górnej.
Jeśli wspólny kolektor żylny płucny spływa do zatoki wieńcowej, ta ostatnia jest poszerzona i można ją zobaczyć z czterokomorowej pozycji wierzchołkowej. Poszerzona zatoka wieńcowa wybrzusza się do przodu i ku górze do lewego przedsionka, ponieważ znajduje się w bruździe przedsionkowo-komorowej. Jeśli kolektor wpływa bezpośrednio do prawego przedsionka, znajduje się wyżej niż przy odpływie do zatoki wieńcowej.
W podprzeponowej TALV, wspólny kolektor żylny płucny spływa do układu żyły wrotnej, ale może łączyć się z żyłami wątrobowymi. Żyły płucne zbiegają się we wspólny kanał, który często jest mały i znajduje się poniżej lewego przedsionka i tuż nad przeponą. Jest widoczny z pozycji podżebrowej. Wspólna żyła zstępująca leży między aortą a IVC. Naczynia te można różnicować w zależności od kierunku i charakteru przepływu krwi za pomocą echokardiografii dopplerowskiej: w aorcie - laminarnie pulsujące w kierunku od serca, wzdłuż żyły głównej dolnej - prawie stałe w kierunku serca. Przepływ przez żyłę pionową opadającą przypomina przepływ w IVC, ale skierowany z dala od serca.
Aby zdiagnozować mieszany TADLV, konieczne jest użycie różnych pozycji czujnika. Najczęstszym typem drenażu mieszanego jest połączenie drenażu do zatoki wieńcowej i lewej żyły bezimiennej.
Najlepszą metodą oceny obecności niedrożności żył płucnych jest badanie dopplerowskie. Niezakłócony przepływ w żyłach płucnych charakteryzuje się prawie stałym przepływem dwu- lub trójfazowym, z krótkim okresem odwrócenia na początku rozkurczu. Niedrożność w obrębie jednego z elementów płucnej drogi żylnej objawia się szybkim, bezpośrednim prądem jednofazowym. Niedrożność krążenia płucnego może być maskowana, jeśli przepływ krwi przez płuca jest zmniejszony. Można to zdemaskować przez wprowadzenie prostaglandyny E1. Bezpośrednio można zaobserwować dyskretne zwężenie lub ucisk wzdłuż płucnej drogi żylnej między strukturami, takimi jak gałąź tętnicy płucnej i oskrzela.
Badanie kolorowego Dopplera dostarcza informacji o kierunku i średniej prędkości przepływu przez nieprawidłowe połączenie żyły płucnej. Pozwala to na szybką identyfikację połączenia żylnego kanału płucnego z żyłą systemową. Przeszkoda tworzy turbulencje w przepływie i wygląda jak mozaikowy strumień. Po zlokalizowaniu miejsca turbulencji oceń stopień zwężenia na podstawie wielkości szczytowej prędkości przepływu widmowego w echokardiografii dopplerowskiej.
W każdym typie TALV dokładnie bada się możliwość współistniejących wad rozwojowych, takich jak wady poduszek wsierdzia, atrezja płuc, pojedyncza komora, TMA. Błędy w rozpoznaniu TALV są bardziej prawdopodobne w przypadku anomalii umiejscowienia przedsionka, mieszanego drenażu żył płucnych i związanych z nimi wad rozwojowych.
W diagnostyce wad serca w przypadkach wysokiego ryzyka coraz częściej stosuje się echokardiografię przedporodową. Prawidłowe połączenie żył płucnych z lewym przedsionkiem można określić z wierzchołkowej czterokomorowej pozycji serca płodu. Ponieważ płodowy przepływ krwi przez płuca jest zmniejszony, identyfikacja nieprawidłowego drenażu żył płucnych jest trudna. Pośrednim objawem TALV jest rozszerzenie prawej komory i tętnicy płucnej, które nie jest proporcjonalne do wielkości lewej komory i aorty, zwłaszcza gdy wykluczone są inne wady tworzące ten sam obraz. Pomimo trudności w diagnostyce prenatalnej, w piśmiennictwie istnieją pojedyncze doniesienia o przypadkach jednoznacznego rozpoznania TALV potwierdzonego po urodzeniu. Odwrotnie, istnieją przypadki TALV, które po raz pierwszy wykryto w okresie noworodkowym, pomimo prenatalnej echodiagnostyki.
TALV można zdiagnozować za pomocą nieinwazyjnego MRI. Metoda ta wykrywa żyły płucne wpływające do komory za lewym przedsionkiem. Widać, że wspólna żyła płucna łączy się z lewą żyłą bezimienną, zatoką wieńcową lub prawym przedsionkiem.
Wspólne dla wszystkich typów TADLV są oznaki zwiększonego przepływu krwi w płucach. Prawy przedsionek i prawa komora są rozszerzone i przerośnięte, łuk tętnicy płucnej wybrzusza się. Komory lewych części serca nie są rozszerzone. Połączenie płucnego kolektora żylnego może być odzwierciedlone w konfiguracji cienia sercowego. Przy nieprawidłowym odpływie do żyły bezimiennej cień serca przypomina ósemkę lub bałwana. Górna część „ósemki” jest utworzona przez żyłę pionową po lewej stronie, lewą żyłę bezimienną na górze i żyłę główną górną po prawej stronie. Charakterystyczne wyniki radiologiczne są zwykle nieobecne w pierwszych miesiącach życia i są często obserwowane u starszych dzieci i dorosłych. Przy nieprawidłowym drenażu żył płucnych do żyły głównej górnej jej rozszerzenie objawia się wybrzuszeniem prawej górnej krawędzi cienia serca.
Wskazania do cewnikowania serca są obecnie ograniczone ze względu na wysoką czułość i 99% swoistość diagnostyki echokardiograficznej TALV. Cewnikowanie przeprowadza się w celu wyjaśnienia ważnych szczegółów, które nie zostały wyjaśnione podczas badania echokardiograficznego:
identyfikacja współistniejących wad;
wykrywanie miejsc anomalnych połączeń;
lokalizacja niedrożności żylnej.
Miejsce nieprawidłowego połączenia żył płucnych z żyłami systemowymi można wykryć po „skoku” tlenu na poziomie lewej żyły bezimiennej, prawej żyły głównej górnej górnej lub zatoki wieńcowej. Nieprawidłowy drenaż do prawego przedsionka jest identyfikowany przez zwiększone natlenienie na poziomie prawego przedsionka, podobnie jak w przypadku innych przecieków lewo-prawo do prawego przedsionka. W TALV wysycenie tlenem w prawym przedsionku wynosi od 80 do 95%. W przybliżeniu taki sam poziom saturacji w prawej komorze, tętnicy płucnej, lewym przedsionku, lewej komorze i tętnicach systemowych. Przy nieprawidłowym drenażu żył płucnych powracających do lewej żyły bezimiennej lub SVC, krew mieszana przepływa głównie do prawej komory, a krew z żyły głównej dolnej przepływa głównie do lewego przedsionka, więc saturacja krwi w tętnicy płucnej może być wyższa niż w tętnicach systemowych.
Ciśnienie w prawej komorze i tętnicy płucnej waha się od lekko podwyższonego do poziomu ogólnoustrojowego. Ciśnienie w prawym przedsionku nie odzwierciedla w pełni adekwatności komunikacji międzyprzedsionkowej. Obecność równych ciśnień w obu przedsionkach nie jest wiarygodnym objawem nieobturacyjnej wady przedsionków. Zjawisko to tłumaczy się niemal identyczną rozciągliwością obu komór, więc ciśnienia napełniania są prawie równe nawet przy restrykcyjnej komunikacji międzyprzedsionkowej. Dodatni gradient ciśnienia już od 2 mmHg. Sztuka. lub więcej może wskazywać na mały ASD, ale może również wystąpić z większym raportem. Jedynym wiarygodnym sposobem oszacowania rozmiaru komunikatu międzyprzedsionkowego jest jego pomiar za pomocą cewnika balonowego.
Selektywna arteriografia płucna znacząco poprawia wyniki echokardiografii. Przejście środka kontrastowego przez tętnice płucne i jego pojawienie się w płucnych kanałach żylnych daje jasny obraz anatomii wady. W przypadku TALVV można zobaczyć żyłę pionową w lewej żyle bezigłowej, wystającą z kolektora żyły płucnej i łączącą się z lewą żyłą bezigłową. Następnie możesz prześledzić przepływ środka kontrastowego do SVC.
W przypadku nieprawidłowego drenażu do zatoki wieńcowej środek kontrastowy gromadzi się we wspólnej żyle płucnej i dostaje się do zatoki wieńcowej w tylnej części serca. W projekcji przednio-tylnej zatoka wieńcowa ma postać jajowatej formacji w środkowej i dolnej części prawego przedsionka. Szczegóły anatomiczne zatoki wieńcowej są lepiej widoczne w widoku bocznym.
Gdy żyły płucne spływają bezpośrednio do prawego przedsionka, struktury pozasercowe nie są widoczne i środek kontrastowy szybko dostaje się do prawego przedsionka.
Jeśli cewnik zostanie wprowadzony do nieprawidłowej żyły, saturacja krwi osiąga 100%. Przydatne jest wykonanie selektywnej angiografii, należy jednak pamiętać, że cewnik może blokować miejsca niedrożności żył płucnych.
TALV z niedrożnością żył płucnych
Niedrożność żył płucnych występuje zawsze w przypadku podsercowej TALV; w 50% przypadków - z drenażem nadsercowym, rzadziej - z drenażem do zatoki wieńcowej lub do prawego przedsionka. Niezależnie od miejsca niedrożności obraz kliniczny jest podobny. Objawy zwykle nie pojawiają się w ciągu pierwszych 12 godzin życia, co pozwala odróżnić tę wadę od zespołu niewydolności oddechowej. Objawy obturacyjnej TALV obejmują postępującą duszność, trudności w karmieniu i niewydolność serca.
Dzieci umierają w ciągu 2 dni - 4 miesięcy. życie. Drenaż podsercowy charakteryzuje się sinicą i dusznością, które nasila się przy wysiłku i połykaniu z powodu zwiększonego ciśnienia w jamie brzusznej lub ucisku wspólnej żyły płucnej przez przełyk, co obserwuje się w przypadku przepukliny przełyku.
Pomimo ciężkich objawów objawy sercowo-naczyniowe mogą być minimalne. Serce nie jest rozszerzone, prawa komora nie jest uniesiona. Drugi ton jest zwykle podzielony, a komponent płucny jest uwydatniony. Nie ma szmeru serca lub jest miękki, dmuchając nad tętnicą płucną. W dolnych partiach płuc zwykle słychać rzęsy wilgotne. Prawie zawsze obserwuje się powiększenie wątroby, któremu towarzyszy obrzęk obwodowy.
EKG wykazuje oznaki przerostu prawej komory. W przeciwieństwie do TALV bez niedrożności żylnej zwykle nie ma oznak powiększenia prawego przedsionka.
W przypadku klinicznych objawów obturacyjnej TALVV należy dokładnie zbadać poszczególne żyły płucne, kolektor żyły płucnej i jej zbieg z prawostronnymi strukturami serca w celu zlokalizowania miejsca zwężenia. Charakteryzuje się szybkim, stałym i jednofazowym charakterem przepływu krwi żylnej.
Rozmiar cienia serca jest prawie normalny. Wzór płucny jest wzmocniony i charakteryzuje się rozlanymi, wachlarzowatymi uszczelkami promieniującymi od korzeni. Granice cienia serca są niewyraźne. Brak jest specyficznych radiologicznych objawów TALV z niedrożnością.
Wykrycie wysoce utlenowanej krwi w żyle głównej górnej lub dolnej ma duże znaczenie diagnostyczne. Należy jednak interpretować ten fakt ostrożnie, ponieważ z jednej strony, ze względu na zmniejszenie przepływu płucnego krwi, wysycenie mieszanej krwi płucnej i układowej krwi żylnej może być niskie, z drugiej strony u noworodków z TALV do żyły wrotnej krew z żyły pępowinowej jest całkowicie dotleniona, co potwierdza diagnozę. Ciśnienie w prawej komorze jest zwykle równe lub większe niż ciśnienie systemowe. Ciśnienie przedsionkowe jest prawidłowe, w przeciwieństwie do wysokiego ciśnienia w naczyniach tętniczych płuc.
Angiogram płucny jest niezawodną metodą diagnozowania TALV w układzie żyły wrotnej z niedrożnością żylną. Miejsca niedrożności można również znaleźć w innych miejscach nieprawidłowego drenażu żył płucnych. Biorąc pod uwagę znaczne opóźnienie w przechodzeniu środka kontrastowego przez łożysko naczyniowe płuc, pojawia się on w układzie żylnym płuc z opóźnieniem do 12 s po podaniu.
Jeśli cewnik wejdzie do nieprawidłowego kanału żylnego, może przejść przez obszar zwężenia z groźbą znacznego lub całkowitego utrudnienia odpływu żylnego, dlatego wstrzyknięcie środka kontrastowego należy wykonać szybko i ręcznie.
Diagnoza różnicowa
TALV bez niedrożności należy odróżnić od dużego VSD, przewodu tętniczego, OBS, AVSD i pojedynczej komory bez zwężenia zastawki płucnej. W przeciwieństwie do TALVV, wszystkie te anomalie mają radiologiczne i EKG objawy przerostu lewego przedsionka i lewej komory. W przypadku TALVV różne szmery serca charakterystyczne dla wad porównawczych nie są typowe.
U starszych dzieci i dorosłych należy różnicować ASD, wspólny przedsionek i PALV. W TALV występuje zwykle przynajmniej umiarkowana sinica, która nie występuje u osób w pierwszej lub drugiej dekadzie życia z różnymi wadami rozwojowymi z przeciekiem tętniczo-żylnym na poziomie przedsionków.
TALV z niedrożnością należy odróżnić od innych przyczyn niedrożności żył płucnych oraz zespołu niedorozwoju lewego serca, atrezji zastawki trójdzielnej, atrezji zastawki płucnej, koarktacji, TMA, zespołu niewydolności oddechowej i przetrwałego krążenia płodowego. Ciężka kardiomegalia zwykle towarzyszy atrezji zastawki i koarktacji aorty i jest wyraźną cechą charakterystyczną nieobecną w obturacyjnej TALV. Wzmocniony wzór naczyń tętniczych jest charakterystyczny dla TMA i zespołu niedorozwoju lewego serca. Osłabione unaczynienie płuc jest typowe dla atrezji zastawki płucnej i zastawki trójdzielnej. Niedrożność powrotu żył płucnych może być spowodowana niedomykalnością mitralną lub niewydolnością lewej komory. Przyczyny te są łatwo diagnozowane na podstawie charakterystycznych objawów klinicznych, w szczególności przerostu i poszerzenia lewej komory. Brak przerostu lewej komory jest charakterystyczny dla zwężenia zastawki mitralnej, która jest również przyczyną upośledzenia odpływu krwi z płuc. Obecność przerostu lewego przedsionka wskazuje, że zwężenie jest blisko zastawki mitralnej. Może to być zwężenie zastawki mitralnej lub nadzastawkowy pierścień zwężający lewego przedsionka, w którym ciśnienie w lewym przedsionku jest zwiększone.
U pacjentów z przerostem prawej komory TALVV należy różnicować ze zwężeniem poszczególnych żył płucnych, przedsionkowo-sercowym i atrezją wspólnej żyły płucnej. We wszystkich tych przypadkach ciśnienie w łożysku tętniczym płuc jest zwiększone, a ciśnienie w lewym przedsionku jest normalne.
Identyfikacja wad obturacyjnych odbywa się za pomocą selektywnej angiografii. Ważnymi kryteriami diagnostycznymi są wykrycie przecieku prawo-lewego, czas trwania wypełnienia lewego przedsionka.
EchoCG jest szczególnie pouczające w różnicowaniu TALV z przetrwałym krążeniem płodowym, zespołem niewydolności oddechowej.
naturalny przepływ
Rokowanie dla TALV zależy od wielkości komunikacji międzyprzedsionkowej, obecności niedrożności żył płucnych i oporności tętnicy płucnej u dzieci, które mają szczęście przeżyć kilka lat.
W przeglądzie przeprowadzonym przez Keitha i wsp., obejmującym wszystkie typy TADP, 50% dzieci z tą diagnozą zmarło do 3 miesiąca życia, a 80% do pierwszego roku życia. Dane Burroughsa i Edwardsa są podobne. Jeszcze gorsze rokowanie mają pacjenci z niewystarczającą komunikacją międzyprzedsionkową. Rokowanie jest katastrofalne u pacjentów z niedrożnością nieprawidłowego kanału żylnego. Zwykle umierają w ciągu pierwszych kilku tygodni życia, najstarsze dziecko żyło 4,5 miesiąca. Niektórzy pacjenci przeżywają niemowlęctwo z powodu zwiększonego oporu w tętnicach płucnych. Ten adaptacyjny mechanizm może sprowokować lekarza do ryzykownej interwencji chirurgicznej. Wyraźne zmiany w błonie wewnętrznej tętniczek płucnych wykrywa się już w wieku 8 miesięcy.