Poboljšanje upravljanja inovacijama. Inovativne tehnologije kao objekt za unapređenje upravljanja preduzećem na primjeru SMZ. · organizaciona kultura kompanije, kao i međuljudski odnosi između zaposlenih, administracije i
>> Hemija: Proizvodnja halogena. Biološki značaj i upotreba halogena i njihovih spojeva
Proizvodnja halogena . Fluor i hlor se dobijaju elektrolizom talina ili rastvora njihovih soli. Na primjer, proces električnih | Troliza rastopljenog natrijum hlorida može se odraziti jednadžbom:
Ali ako se vodik može dobiti na druge, pogodnije i jeftinije načine, na primjer iz prirodni gas, tada se natrijum hidroksid dobija skoro isključivo elektrolizom rastvora kuhinjske soli, poput hlora.
Brom i jod se industrijski proizvode reakcijom njihovog istiskivanja iz bromida, odnosno jodida.
Biološki značaj halogena. Njihova primjena. Niste mogli a da ne primijetite da etikete mnogih marki pasta za zube ukazuju na sadržaj fluora u njima – naravno, ne slobodnog fluora, već njegovih spojeva. Zahvaljujući ovoj važnoj komponenti, koja učestvuje u izgradnji zubne cakline i kostiju, sprečavaju se bolesti poput karijesa. Osim toga, fluor je neophodni element u metaboličkim procesima u žlijezdama, mišićima i nervnim stanicama.
Fluor je važan u industrijska proizvodnja, gdje su njeni glavni potrošači nuklearna industrija i elektrotehnika. Njegovo jedinjenje Na3AlF6 (kako se zove?) koristi se za proizvodnju aluminijuma. A u svakodnevnom životu sve više široka primena pronalazi teflonsko posuđe, kojem je ime dala plastika koja sadrži fluor - teflon.
Hlor- jedan od hemijski elementi, bez kojih je nezamislivo postojanje živih organizama. Njegov osnovni oblik. u organizam ulazi natrijum hlorid. Stimuliše metabolizam, rast kose, daje snagu i snagu. Većina NaCl se nalazi u krvnoj plazmi.
Hlorovodonična kiselina HC1, koja je deo želudačnog soka, ima posebnu ulogu u varenju. Bez 0,2% HCl, proces varenja hrane se praktično zaustavlja. I mada skoro sve prehrambeni proizvodi sadrže određenu količinu kuhinjske soli, osoba je prisiljena dodati oko 20 g soli dnevno u hranu.
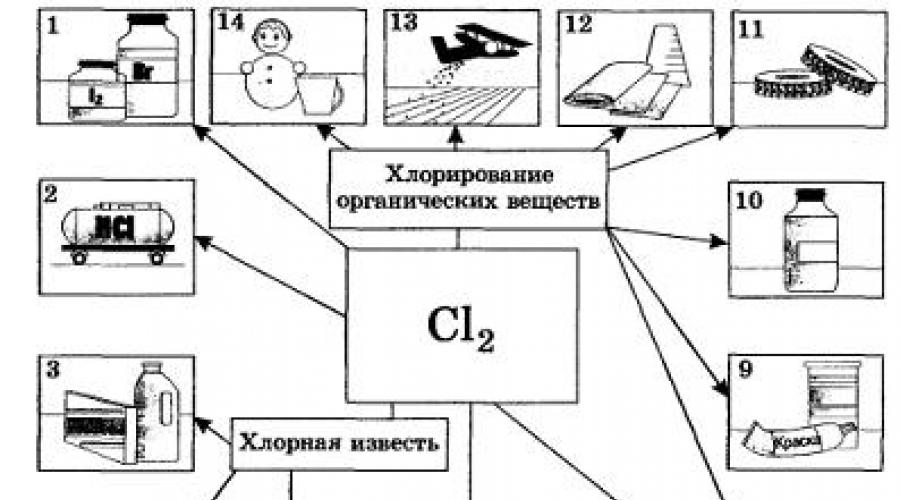
Po mjerilu industrijske primjene hlor je daleko bolji od svih halogena. Hlor i njegovi spojevi neophodni su za izbjeljivanje lanenih i pamučnih tkanina, papira itd. Posebno se mnogo troši u organskoj sintezi za proizvodnju plastike, gume, boja i rastvarača (Sl. 20).

Mnoga jedinjenja koja sadrže klor koriste se za kontrolu štetočina Poljoprivreda. IN velike količine hlor se koristi za dezinfekciju pije vodu, međutim, ne bez negativnih posljedica (koju je supstancu sigurnije koristiti u tu svrhu?). U obojenoj metalurgiji neki metali (titanijum, niobijum, tantal) se ekstrahuju iz ruda hlorisanjem. Klor je takođe našao upotrebu u vojne svrhe kao hemijsko ratno sredstvo. Kasnije je zamijenjen drugim, efikasnijim toksičnim supstancama koje sadrže hlor, kao što je fosgen COCl2.
Klor se nalazi u vrlo opasnoj tvari po život i zdravlje – dioksinu. Jedinjenja hlora su jedan od razloga za uništavanje ozonskog omotača Zemlje.
Još jedan halogen, brom, takođe je veoma važan za ljudski organizam. Jedinjenja ovog elementa regulišu procese ekscitacije i inhibicije centralnog nervni sistem Stoga, za liječenje nervnih bolesti (nesanica, histerija, neurastenija itd.), liječnici propisuju "brom" - lijekove koji sadrže brom.
Brom se aktivno akumulira u nekim biljkama, uključujući morske alge. U moru je koncentrisana većina broma na našoj planeti, a more služi kao glavni dobavljač broma. Procjenjuje se da se oko 4 miliona tona broma godišnje ispusti u zrak zajedno s morskom vodom. Jasno je da je njegov sadržaj u zraku priobalnih područja uvijek veći nego u područjima udaljenim od mora. To je jedan od razloga zašto je udisanje morskog zraka tako blagotvorno.
Brom, tačnije srebro bromid AgBr, igra podjednako važnu ulogu u fotografiji. Oni koji se bave fotografijom vjerovatno će se odmah sjetiti naziva tipova fotografskog papira – “Uni-brom”, “Bromineportrait” itd. svjetlosti:
2AgBr = 2Ag + Br2
I na kraju, posljednji od halogena koje razmatramo - jod - je element bez kojeg čovjek ne može živjeti: njegov nedostatak u vodi i hrani smanjuje proizvodnju hormona štitnjače i dovodi do endemske gušavosti. Regulacijski efekti hormona štitnjače uključuju uzbuđenje mišića, otkucaje srca, apetit, probavu, funkciju mozga i ljudski temperament. Jod ulazi u organizam sa hranom: hlebom, jajima, mlekom, vodom, morske alge i sa vazduhom (posebno morskim) pri disanju.
Alkoholna otopina joda (5-10%), koja se zove jodna tinktura, koristi se za liječenje rana. Jod je uključen u mnoge lijekove.
Glavni potrošači joda su farmaceutska i hemijska industrija, kao i proizvodnja fotoosjetljivih fotografskih materijala.
1. Proizvodnja halogena elektrolizom taline i rastvora soli.
2. Biološki značaj halogena.
3. Upotreba hlora i jedinjenja fluora, hlora i joda.
Koja zapremina hlora (br.) i koja masa natrijuma se mogu dobiti elektrolizom 585 g natrijum hlorida koji sadrži 2% nečistoća?
Izračunajte koliko grama 40% alkalne otopine se može dobiti iz natrijuma čiju ste masu odredili u prethodnom zadatku.
Francuski hemičar Šele je dobio hlor reakcijom mangan(IV) oksida sa hlorovodoničnom kiselinom. Kao rezultat ove reakcije nastaju i mangan(II) hlorid i voda. Napišite jednadžbu za ovu reakciju, razmotrite redoks procese i izračunajte masu mangan(IV) oksida i količinu klorovodika koja je potrebna za proizvodnju 100 litara klora (n.o.), ako je njegov prinos 95% teoretski mogućeg.
Pripremite poruku o pozitivnom i negativnom značaju halogena u ljudskom životu.
Sadržaj lekcije beleške sa lekcija potporni okvir Metode ubrzanja prezentacije časa interaktivne tehnologije Vježbajte zadaci i vježbe radionice za samotestiranje, treninzi, slučajevi, potrage domaća zadaća diskusija pitanja retorička pitanja učenika Ilustracije audio, video i multimedija fotografije, slike, grafike, tabele, dijagrami, humor, anegdote, vicevi, stripovi, parabole, izreke, ukrštene riječi, citati Dodaci sažetakačlanci trikovi za radoznale jaslice udžbenici osnovni i dodatni rječnik pojmova ostalo Poboljšanje udžbenika i lekcijaispravljanje grešaka u udžbeniku ažuriranje fragmenta u udžbeniku, elementi inovacije u lekciji, zamjena zastarjelog znanja novim Samo za nastavnike savršene lekcije kalendarski plan za godinu smjernice diskusioni programi Integrisane lekcijeDEFINICIJA
Halogeni– Elementi VIIA grupe – fluor (F), hlor (Cl), brom (Br) i jod (I). Elektronska konfiguracija vanjskog energetskog nivoa halogena ns 2 np 5.
Budući da halogenima nedostaje samo jedan elektron prije nego što završe energetski nivo, u ORR-u najčešće ispoljavaju svojstva oksidacijskih sredstava. Oksidacijska stanja halogena: od “-1” do “+7”. Jedini element halogenske grupe, fluor, pokazuje samo jedno oksidaciono stanje "-1" i najelektronegativniji je element.
Priprema halogena i njihovih spojeva
Halogeni se mogu dobiti elektrolizom otopina ili talina halogenida:
MgCl 2 = Mg + Cl 2 (rastop)
Najčešće se halogeni dobivaju reakcijom oksidacije halogenovodičnih kiselina:
MnO 2 + 4HCl = MnCl 2 + Cl 2 +2H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl
HF i HCl se pripremaju reakcijom njihovih čvrstih soli s koncentriranom sumpornom kiselinom kada se zagrijavaju:
CaCl 2 + H 2 SO 4 = CaSO 4 + 2HCl
HBr i HI se ne mogu dobiti na ovaj način, jer su ove tvari jaka redukcijska sredstva i oksidiraju se sumpornom kiselinom:
2KBr + 2H 2 SO 4 = K 2 SO 4 + Br 2 + 2H 2 O + SO 2
8KI + 5H 2 SO 4 = 4K 2 SO 4 +4I 2 +4H 2 O + H 2 S
Stoga se HBr i HI dobijaju hidrolizom odgovarajućih fosfornih halida:
PBr 3 + 3H 2 O = 3HBr + H 3 PO 3
Među jedinjenja koja sadrže kiseonik halogeni najveća vrijednost imaju kiseline koje sadrže kiseonik i njihove soli. Dakle, HClO je jedna od kiselina klora koje sadrže kisik - hipoklorovita kiselina se dobiva u vodenim otopinama klora kao proizvod hidrolize:
Cl 2 + H 2 O ↔ HClO + HCl
Soli hipohlorne kiseline - hipohloriti nastaju kada se klor propušta kroz hladne alkalne rastvore, na primer:
Cl 2 + 2KOH = KClO + KCl + H 2 O
Hipohlorna kiselina (HClO 3) se dobija obradom kiselih soli (hlorata) koncentriranom sumpornom kiselinom:
Ba(ClO 3) 2 + H 2 SO 4 = BaSO 4 +2HClO 3
Soli hipohlorne kiseline - klorati se dobijaju propuštanjem Cl 2 u vrući alkalni rastvor:
3Cl 2 + 6KOH = 5 KCl + KClO 3 + 3H 2 O
HClO 4 je perhlorna kiselina, koja se može dobiti tretiranjem kalijum perhlorata koncentrovanom sumpornom kiselinom:
2 KClO 4 + H 2 SO 4 = K 2 SO 4 +2 HClO 4
Otopine hipobromnih (HOBr) i hipojodnih (HOI) kiselina mogu se pripremiti, poput HClO, reakcijom odgovarajućih halogena sa vodom.
Br 2 + H 2 O = HBr + HOBr
I 2 + H 2 O = HI + HOI
Bromne (HBrO 3) i jodne (HIO 3) kiseline mogu se dobiti oksidacijom broma ili jodne vode hlorom:
Br 2 + 5Cl 2 + 6H 2 O = 2HBrO 3 + 10 HCl
Biološki značaj halogena i njihovih spojeva
Hlor - jedan bitnih elemenata koji su deo živih organizama. Tijelo ga sadrži u obliku soli – natrijum hlorida. Hlor stimuliše metabolizam, rast kose, daje snagu i snagu. Većina NaCl se nalazi u krvnoj plazmi.
HCl, koji je dio želudačnog soka, kontrolira probavne procese. U nedostatku 0,2% HCl, proces varenja hrane se praktično zaustavlja.
Alge, kao i neke druge biljke, aktivno akumuliraju brom. Morska voda sadrži najviše veliki broj brom, koji može proći u zrak, pa je njegov sadržaj u zraku priobalnih područja uvijek veći nego u područjima udaljenim od mora.
Jod je, kao i hlor, jedan od najvažnijih elemenata koji čine žive organizme. Nedostatak joda u vodi i hrani smanjuje proizvodnju hormona štitnjače i dovodi do endemske strume. Jod ulazi u organizam hranom: hljebom, jajima, mlijekom, vodom, morskim algama i zrakom (posebno morskim) prilikom disanja.
Primjena halogena i njihovih spojeva
Halogeni se široko koriste u industriji. Dakle, fluor se koristi za proizvodnju maziva koja mogu izdržati visoke temperature, teflon, freoni itd. U proizvodnji se koristi hlor hlorovodonične kiseline, izbjeljivač, hipoklorit i klorati, za izbjeljivanje tkanina i celuloze za izradu papira, za sterilizaciju vode za piće i dezinfekciju Otpadne vode itd.
Brom je neophodan za proizvodnju raznih lekovitih supstanci, nekih boja, kao i bromida srebra koji se koristi u proizvodnji fotografskih materijala.
Jod se u medicini koristi u obliku 10% rastvora u etanolu kao antiseptik i hemostatsko sredstvo. Jod je uključen u brojne farmaceutske lijekove.
Fluorovodonična kiselina (HF) se koristi za proizvodnju fluorida, jetkanje stakla, uklanjanje peska sa metalnih odlivaka i analizu minerala.
Hlorovodonična kiselina (HCl) se široko koristi u hemijskoj praksi, kao i njene soli. Na primjer, natrijum hlorid ( sol) služi kao sirovina za proizvodnju hlora, hlorovodonične kiseline, kaustične sode, a koristi se u farbanju, proizvodnji sapuna i drugim industrijama.
Primjeri rješenja postavljanjem pitanja
PRIMJER 1
| Vježbajte | Zapišite jednadžbe za sljedeće reakcije: 1) FeSO 4 + KClO 3 + H 2 SO 4 → ... 2) FeSO 4 + KClO 3 + KOH → ... 3) I 2 + Ba(OH) 2 → … 4) KBr + KVrO 3 + H 2 SO 4 → ... |
| Odgovori | a) U ovoj reakciji gvožđe povećava svoje oksidaciono stanje sa “+2” na “+3”, tj. FeSO 4 je redukciono sredstvo, a hlor smanjuje oksidaciono stanje sa “+5” na “1”, tj. KClO 3 je oksidant: 6FeSO 4 + KClO 3 + 3H 2 SO 4 = 3Fe 2 (SO 4) 3 + KCl + 3H 2 O b) U ovoj reakciji gvožđe povećava svoje oksidaciono stanje sa “+2” na “+3”, tj. FeSO 4 je redukciono sredstvo, a hlor smanjuje oksidaciono stanje sa “+5” na “1”, tj. KClO 3 je oksidant: 6FeSO 4 + KClO 3 + 12KOH + 3H 2 O = 6Fe(OH) 3 ↓ + KCl + 6K 2 SO 4 c) U ovoj reakciji jod povećava i smanjuje oksidaciono stanje sa “0” na “+5” i sa “0” na “-1”, tj. I 2 je i redukcijski i oksidacijski agens - javlja se reakcija disproporcionalnosti: 6I 2 + 6Ba(OH) 2 = 5BaI 2 + Ba(IO 3) 2 + 6H 2 O d) U ovoj reakciji brom povećava i smanjuje oksidaciono stanje sa “-1” na “0” i sa “+5” na “0”, tj. KBr je redukcijski agens, a KBrO 3 je oksidant: 5KVr + KVrO 3 + 3N 2 SO 4 = 3Vr 2 + 3K 2 SO 4 + 3N 2 O |
1. Opće karakteristike halogena . Atomska struktura i oksidaciona stanja halogena u jedinjenjima. Priroda promjena atomskih radijusa, energija jonizacije, afiniteta elektrona i elektronegativnosti u seriji F - At. Priroda hemijskih veza halogena sa metalima i nemetalima. Stabilnost viših valentnih stanja halogena. Karakteristike fluora.
1. With. 367-371; 2. With. 338-347; 3. With. 415-416; 4. With. 270-271; 7. With. 340-345.
2. Molekularna struktura i fizička svojstva jednostavnih halogenih tvari . karakter hemijska veza u molekulima halogena. Fizička svojstva halogeni: agregatno stanje, tačke topljenja i ključanja u nizu fluor - astatin, rastvorljivost u vodi i organskim rastvaračima.
1. With. 370-372; 2. With. 340-347; 3. With. 415-416; 4. With. 271-287; 8. With. 367-370.
3. Hemijska svojstva halogena . Razlozi visoke hemijske aktivnosti halogena i njihova promena po grupama. Odnos prema vodi, alkalnim rastvorima, metalima i nemetalima. Utjecaj temperature na sastav proizvoda disproporcioniranja halogena u alkalnim otopinama. Karakteristike hemije fluora. Prirodna jedinjenja halogena. Principi industrijskih i laboratorijskih metoda za proizvodnju halogena. Upotreba halogena. Fiziološki i farmakološki efekti halogena i njihovih spojeva na žive organizme. Toksičnost halogena i mjere opreza pri radu s njima.
1. With. 372-374, str. 387-388; 2. With. 342-347; 3. With. 416-419; 4. With. 276-287; 7. str.340-345, str. 355; 8. With. 380-382.
Jednostavne supstance, halogeni, za razliku od vodonika, su veoma aktivni. Najviše ih karakterišu oksidaciona svojstva, koja postepeno slabe u seriji F 2 – At 2. Najaktivniji od halogena je fluor: čak i voda i pijesak se spontano zapale u njegovoj atmosferi! Halogeni snažno reaguju sa većinom metala, nemetala i složenih supstanci.
4. Proizvodnja i upotreba halogena .
1. With. 371-372; 2. With. 345-347; 3. With. 416-419; 4. With. 275-287; 7. str.340-345; 8. With. 380-382.
Sve metode za proizvodnju halogena zasnivaju se na reakcijama oksidacije halogenih anjona sa različitim oksidantima: 2Gal -1 -2e - = Gal
U industriji se halogeni dobijaju elektrolizom talina (F 2 i Cl 2) ili vodenih rastvora (Cl 2) halogenida; pomicanje manje aktivnih halogena aktivnijim iz odgovarajućih halogenida (I 2 - brom; I 2 ili Br 2 - klor)
Halogeni se laboratorijski dobijaju oksidacijom halogenovodonika (HCl, HBr) u rastvorima sa jakim oksidantima (KMnO 4, K 2 Cr 2 O 7, PbO 2, MnO 2, KClO 3); oksidacija halogenida (NaBr, KI) sa navedenim oksidantima u kiseloj sredini (H 2 SO 4).
Binarna jedinjenja halogena
1. Jedinjenja sa vodonikom (halogenidi vodonika) . Priroda hemijskih veza u molekulima. Polaritet molekula. Fizička svojstva, agregatno stanje, rastvorljivost u vodi. Priroda promjene temperatura topljenja i ključanja u seriji HF – HI. Asocijacija molekula fluorovodonika. Termička stabilnost vodonik halogenida. Reaktivnost. Svojstva kiseline, karakteristike fluorovodonične kiseline. Restorativna svojstva. Opšti principi dobijanje vodonik halogenida: sinteza iz jednostavne supstance i od halogenida. Hlorovodonik i hlorovodonična kiselina. Fizički i Hemijska svojstva. Metode dobijanja. Upotreba hlorovodonične kiseline. Uloga hlorovodonične kiseline i hlorida u životnim procesima. Halogenidi.
1. With. 375-382; 2. With. 347-353; 3. With. 419-420; 4. With. 272-275, str. 289-292; 7. str.354-545; 8. With. 370-373, str. 374-375.
2 . Spojevi halogena sa kiseonikom.
1. With. 377-380; 2. With. 353-359; 3. With. 420-423; 4. With. 292-296; 7. str.350-354; 8. With. 375-376, str. 379.
3. Spojevi sa drugim nemetalima.
1. With. 375-381; 2. With. 342-345; 4. With. 292-296; 7. str.350-355.
4 . Veze za metale .
2. With. 342; 4. With. 292-296; 7. str.350-355.
Višeelementna jedinjenja halogena
1. Klorne kiseline koje sadrže kiseonik i njihove soli. Hipohlorne, hlorne, perhlorne i perhlorne kiseline. Promjene kiselinskih svojstava, stabilnosti i oksidacijskih svojstava u nizu HClO – HClO 4 . Principi za dobijanje ovih kiselina. Hipohloriti, hloriti, hlorati i perhlorati. Termička stabilnost i oksidativna svojstva. Opšti principi za dobijanje soli. Upotreba soli. Prašak za izbjeljivanje. Bertoletova so. Amonijum perhlorat.
1. With. 382-387; 2. With. 353-359; 3. With. 423; 4. With. 292-296; 7. str.350-354; 8. With. 375-378.
2 . Kiseline broma i joda koje sadrže kiseonik i njihove soli .
1. With. 382-387; 2. With. 353-359; 3. With. 423; 4. With. 292-296; 7. str.350-354; 8. With. 379-380.
3 . Primjena halogena i njihovih najvažnijih spojeva
1. With. 387-388; 2. With. 345-347; 3. With. 419-423; 4. With. 272-296; 8. With. 380-382.
4 . Biološka uloga halogenih spojeva
1. With. 387-388; 2. With. 340-347; 3. With. 419-423; 4. With. 272-296; 8. With. 380-382.
Vezanajvažnija jedinjenja hlora:
