Model hemijskog jedinjenja. Moderne visoke tehnologije
Pročitajte također
ANOTATION
Članak se bavi kvantno-hemijskim modelima atoma, molekula, koji omogućavaju razumevanje suštine hemijskih transformacija materije na atomskom i molekularnom nivou njene organizacije.
SAŽETAK
Članak je posvećen detaljnom razmatranju grafičkih kvantno-hemijskih modela atoma, molekula i hemijskih veza. Ovaj pristup omogućava razumijevanje prirode hemijskih procesa i zakona njihovog odvijanja.
Moderne ideje o strukturi atoma i molekula, razumijevanje hemijskih transformacija materije na atomskom i molekularnom nivou njene organizacije otkriva kvantna hemija.
Sa stanovišta kvantne hemije, atom je mikrosistem koji se sastoji od jezgra i elektrona koji se kreću u elektromagnetnom polju jezgra. Na sl. Na slici 1 prikazani su orbitalni, elektronski i difrakcijski modeli atoma prvog i drugog perioda, izgrađeni pomoću kvantnih principa i pravila za popunjavanje energetskih nivoa u atomima elektronima. Četiri kvantna broja n, l, m l, gospođa u potpunosti karakteriziraju kretanje elektrona u polju jezgra. Glavni kvantni broj n karakterizira energiju elektrona, njegovu udaljenost od jezgra i odgovara broju energetskog nivoa na kojem se elektron nalazi. Orbitalni kvantni broj l određuje oblik orbitale i energiju podnivoa istog energetskog nivoa. Koncept "orbitale" označava najvjerovatniji dio kretanja elektrona u atomu. Magnetski kvantni broj m l određuje broj orbitala i njihovu prostornu orijentaciju. Ono što je najvažnije, orbitalni i magnetni kvantni brojevi su međusobno povezani. Orbitalni kvantni broj l uzima vrijednosti za jedan manji od glavnog kvantnog broja n. Ako a n= 1, onda l= 0, a po obliku je sfernog 1 s-orbitalna. Ako a n= 2, tada orbitalni kvantni broj uzima dvije vrijednosti: l= 0, 1, što ukazuje na prisustvo dva podnivoa. Sfernog je 2 s- orbitalni ( l= 0) i tri 2 str-orbitale koje po obliku nalikuju gimnastičkim bučicama, koje se nalaze pod uglom od 90 ° duž osa kartezijanskog koordinatnog sistema.
Slika 1. Kvantno-hemijska, elektronska i elektronska difrakcija modeli atoma prvog i drugog perioda
Broj i prostorni raspored 2 str-orbitale određuju magnetni kvantni broj m l, koji uzima vrijednosti unutar orbitalnog kvantnog broja od – l do + l. Ako a l= 0, onda m l= 0 (jedan s- orbitalni). Ako a l= 1, onda m l uzima tri vrijednosti - 1 , 0, +1 (tri R-orbitale).
Orbitalni modeli atoma pokazuju prostorni raspored i oblik orbitala, a na modelima difrakcije elektrona u obliku simboličkih kvantnih ćelija data je slika orbitala i položaja nivoa i podnivoa u energetskom dijagramu. Obratite pažnju na veličinu atoma. Ista pravilnost se ponavlja u periodima - kako se naelektrisanje jezgra povećava, dolazi do sve veće deformacije (kompresije) orbitala pod uticajem elektromagnetnog privlačenja elektrona jezgrom (slika 1).
Postavljanje elektrona u orbitale podliježe jednom od najvažnijih principa kvantna mehanika(Paulijev princip): u jednoj orbiti ne mogu biti više od dva elektrona, a moraju se razlikovati po vlastitom momentu momenta - spin (engleska spin rotacija). Elektroni sa različitim spinovima su konvencionalno prikazani strelicama i ¯. Kada su dva elektrona na istoj orbitali, oni imaju antiparalelne spinove i ne sprečavaju jedan drugog da se kreće u polju jezgra.
Ovo svojstvo podsjeća na rotaciju u spoju dva zupčanika. Kada je uključen, jedan zupčanik se okreće u smjeru kazaljke na satu, drugi u suprotnom smjeru. Treći zupčanik u spoju s druga dva zaustavlja rotaciju. Ona je suvišna. Dakle, u jednoj orbitali mogu biti samo 2 elektrona, treći je suvišan.
Kada su energetski nivoi i podnivoi ispunjeni elektronima, kvantni princip minimalna energija (pravilo Klečkovskog) . Elektroni ispunjavaju orbitale od najnižeg do najvišeg energetskog nivoa. Princip minimalne energije je poput punjenja podova visoka zgrada tokom perioda poplava. Voda se diže i ispunjava sve etaže odozdo prema gore, ne propuštajući ni jedan.
Prema Hundovom pravilu, sve R-orbitale su ispunjene prvo jednim elektronom, a tek onda drugim elektronom sa antiparalelnim spinom.
Kvantno-hemijski modeli atoma omogućavaju da se objasne svojstva atoma da razmjenjuju energiju, daju i uzimaju elektrone, mijenjaju geometrijsku konfiguraciju i formiraju kemijske veze.
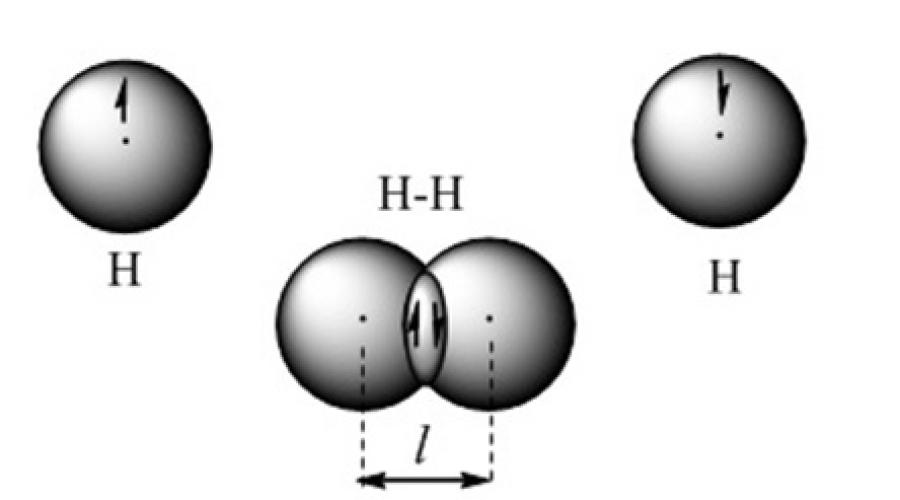
Kovalentna hemijska veza nastaje kada se oblaci valentnih elektrona preklapaju. Na primjer, takva veza je predstavljena u orbitalnom modelu molekula vodonika (slika 2).
/Zakharova.files/image002.jpg)
Slika 2. Model kovalentne veze u molekulu vodonika
Upotreba kvantno-hemijske metode valentnih veza zasniva se na ideji da svaki par atoma u molekulu drži zajedno jedan ili više elektronskih parova sa antiparalelnim spinovima. Sa stanovišta metode valentnih veza, molekul je mikrosistem koji se sastoji od dva ili više kovalentno vezanih atoma. Pozitivno nabijena jezgra atoma drže se negativnim nabojem koncentrisanim u području preklapajućih atomskih orbitala. Privlačenje jezgara atoma na povećanu gustoću elektrona između njih uravnoteženo je silom odbijanja jezgara između sebe. Formira se stabilan mikrosistem u kojem je dužina kovalentne veze jednaka udaljenosti između jezgara.
U molekulu fluora, kao iu molekulu vodonika, postoji nepolarna kovalentna veza. Preklapanje 2 R 1 orbitale, elektronski par stvara povećanu elektronsku gustoću između jezgara atoma i održava molekulu u stabilnom stanju (slika 3).
/Zakharova.files/image003.jpg)
Slika 3. Model kovalentne veze u molekulu fluora
Nepolarna kovalentna veza znači takvo preklapanje valentnih orbitala, zbog čega se centri gravitacije pozitivnih i negativnih naboja poklapaju.
Moguće je formirati polarnu kovalentnu vezu pri preklapanju 1 s 1 - i 2 R 1 orbitale. Na sl. 4 prikazuje model fluorovodonika sa polarnom kovalentnom vezom. Gustoća elektrona između kovalentno vezanih atoma prelazi na atom fluora, čiji nuklearni naboj (+9) ispoljava veću elektromagnetsku privlačnost u odnosu na jezgro atoma vodika s nabojem (+1).
/Zakharova.files/image004.jpg)
Slika 4. Model polarne kovalentne veze u molekulu fluorovodonika
Jonska veza nastaje zbog privlačenja električno nabijenih čestica - jona. Na sl. Slika 5 prikazuje model za formiranje jonske veze u litijum fluoridu. Jako elektromagnetno polje koje stvara jezgro atoma fluora hvata i zadržava R-orbitale elektrona koji pripadaju atomu litijuma. Atom litija, lišen elektrona, mijenja svoju geometrijsku konfiguraciju (2 s-orbitalni), postaje pozitivno nabijen ion i privlači ga negativno nabijeni ion fluora, koji je dobio dodatni elektron na R-orbitalna.
/Zakharova.files/image005.jpg)
Slika 5. Model jonskog para Li + F - litijum fluorid
Sile elektrostatičkog privlačenja suprotno nabijenih jona i odbijanja elektronskih omotača litijumskih i fluorovih jona su uravnotežene i drže ione na udaljenosti koja odgovara dužini jonske veze. Orbitalno preklapanje u ionski vezanim jedinjenjima praktički ne postoji.
Posebna vrsta hemijske veze manifestuje se u atomima metala. Metalni kristal (slika 6) sastoji se od pozitivno nabijenih jona u čijem se polju valentni elektroni slobodno kreću („oblak elektrona“).
/Zakharova.files/image006.jpg)
Slika 6. Model litijum metalnog kristala
Joni i "elektronski oblak" međusobno se drže u stabilnom stanju. Zbog velike pokretljivosti elektrona, metali imaju elektronsku provodljivost.
U molekulima, atomi povezani s nekoliko kovalentnih veza mijenjaju svoju geometrijsku konfiguraciju. Razmotrimo manifestaciju ovog svojstva na primjeru atoma ugljika (1 s 2-orbitala nije prikazana u modelima atoma ugljika, jer ne učestvuje u stvaranju hemijskih veza).
Eksperimentalno je utvrđeno da u molekuli CH 4 atom ugljika formira četiri identične kovalentne veze sa atomima vodonika, koje su ekvivalentne po svojim energetskim i prostornim karakteristikama. Teško je zamisliti četiri identične kovalentne veze, ako se ima u vidu da se u ugljiku valentni elektroni nalaze na dvije energije 2 s i 2 str podnivoi:
/Zakharova.files/image007.jpg)
U osnovnom (nepobuđenom) stanju, ugljenik formira samo dve kovalentne veze. U pobuđenom stanju, jedan elektron sa podnivoa 2 s prelazi na viši energetski podnivo 2 str. Kao rezultat takvog skakanja elektrona, ukupna energija 2 s- i 2 str-orbitale i valencija atoma ugljika mijenja se na četiri:
/Zakharova.files/image008.jpg)
Pa ipak, ovo nije dovoljno da objasni četiri ekvivalentne kovalentne veze u molekuli CH 4, jer 2 s- i 2 str-orbitale imaju različit oblik i prostornog uređenja. Problem je riješen uvođenjem hipoteze o hibridizacija - miješanje valentnih elektrona u podnivoima istog energetskog nivoa. U molekulu metana postoji jedan 2 s- i tri 2 R-orbitale atoma ugljika kao rezultat hibridizacije pretvaraju se u četiri ekvivalenta sp 3-hibridne orbitale:
/Zakharova.files/image009.jpg)
Za razliku od nepobuđenog (osnovnog) stanja atoma ugljika, u kojem su tri 2 R-orbitale atoma se nalaze pod uglom od 90o (slika 7, a), u molekulu metana (slika 7, b) su ekvivalentni po obliku i veličini sp 3-hibridni atomi ugljika nalaze se pod kutom od 109 oko 28".
/Zakharova.files/image010.jpg)
Slika 7. Model molekula metana
U molekulu etilena C 2 H 4 (sl. 8, a) atomi ugljika su unutra sR 2 - hibridno stanje. 2 su uključeni u hibridizaciju s-orbitalna i dva 2 R-orbitale. Kao rezultat hibridizacije, atomi ugljika formiraju tri ekvivalenta sp 2 -hibridne orbitale koje se nalaze pod uglom od 120o na ravni; 2 pz-orbitala ne učestvuje u hibridizaciji.
/Zakharova.files/image011.jpg)
Slika 8. Model molekula etilena
U molekuli etilena, atomi ugljika su povezani ne samo s-vezom, već i p-vezom. Nastaje kao rezultat preklapanja Rz-orbitale sa formiranjem dva područja preklapanja iznad i ispod ose koja povezuje jezgre, sa obe strane ose s-veze (slika 8).
Model trostruke veze predstavljen je u molekulu acetilena (slika 9). Prilikom miješanja jednog 2 s- i jedan 2 p x - formiraju se dvije orbitale atoma ugljika sp-hibridne orbitale, koje se nalaze na liniji koja spaja jezgra atoma (ugao 180o). Nehibridni 2 RU- i 2Rz-orbitale različitih atoma ugljika se preklapaju, formirajući dvije p-veze u međusobno okomitim ravninama (slika 9).
/Zakharova.files/image012.jpg)
Slika 9. Model molekule acetilena
Molekule, poput atoma, pokazuju sposobnost razbijanja i formiranja kemijskih veza, promjene svoje geometrijske konfiguracije i prelaska iz električno neutralnog u ionsko stanje. Ova svojstva su prikazana u reakciji između molekula amonijaka NH 3 i fluorovodonika HF (slika 10). Kovalentna veza u molekulu fluorovodonika je prekinuta, a kovalentna veza donor-akceptor se formira između dušika i vodonika u molekulu amonijaka. Donator je usamljeni par elektrona atoma azota, akceptor je prazna orbitala atoma vodonika (slika 10). Geometrijska konfiguracija molekula NH 3 (trigonalna piramida, vezni ugao 107 o 18") mijenja se u tetraedarsku konfiguraciju NH 4 + jona (109 o 28"). Konačni proces je formiranje jonske veze u kristalnoj strukturi amonijum fluorida. Orbitalni modeli molekula omogućavaju da se u jednoj reakciji pokažu sva gore navedena svojstva: prekid i formiranje hemijskih veza, promena geometrijske konfiguracije, prelazak iz električno neutralnog u ionsko stanje.
/Zakharova.files/image013.jpg)
Rice. 10. Model formiranja ionskog para kristalnog NH 4 + F -
Hemijska reakcija pomoću simbola hemijski elementi:
NH 3 + HF → NH 4 F,
daje generalizirani izraz onoga što se otkriva u orbitalnim modelima molekula. Hemijske reakcije predstavljene orbitalnim modelima i simbolima hemijskih elemenata međusobno se nadopunjuju. To je njihova zasluga. Ovladavanje elementarnim znanjem o kvantno-hemijskom izrazu strukture i sastava atoma i molekula dovodi do razumijevanja ključnih kemijskih koncepata: kovalentne polarne i nepolarne veze, donor-akceptorske veze, ionske veze, geometrijske konfiguracije atoma i molekula, hemijska reakcija. A na temelju ovog znanja može se sa sigurnošću koristiti simbolika hemijskih elemenata i jedinjenja za Kratki opis hemijska stanja i transformacije materije.
Navedimo još jedan primjer reakcije razmatrane sa stanovišta kvantne hemije. Voda pokazuje svojstva slabog elektrolita. Elektrolitička disocijacija se obično predstavlja jednadžbom:
H 2 O ⇄H + + OH -
H 2 O + H 2 O ⇄H 3 O + + OH -.
Podjela molekula vode na pozitivno i negativno nabijene ione otkriva kvantno hemijski model reakcije elektrolitičke disocijacije (slika 11).
/Zakharova.files/image014.jpg)
Slika 11. Model elektrolitičke disocijacije vode
Molekul vode je iskrivljena piramida (valentni ugao 104 o 30"). sR 3-hibridne orbitale atoma kisika formiraju s-veze s atomima vodika. Dva druga sR 3-hibridne orbitale imaju slobodne parove elektrona sa antiparalelnim spinovima. Prekid kovalentne H–O veze u jednom od molekula dovodi do stvaranja kovalentne hemijske veze na susjednom molekulu prema mehanizmu donor-akceptor. Jon vodika, koji ima praznu orbitalu, djeluje kao akceptor elektronskog para atoma kisika susjedne molekule vode. U ovom primjeru, kao iu prethodnom, kvantno-hemijski pristup omogućava razumijevanje fizičko-hemijskog značenja procesa elektrolitičke disocijacije vode.
Razmišljanje je proces kojim možemo indirektno suditi o onome što je skriveno od naše čulne percepcije. Kvantna hemija daje vizuelnu sliku hemijskih procesa i stanja materije, otkriva šta je skriveno od naše čulne percepcije, podstiče učenje i razmišljanje.
Bibliografija:
1. Vygotsky L.S. Razmišljanje i govor. – M.: Lavirint, 1999. – 352 str.
2. Zagashev I.O., Zair-Bek S.I. Kritično mišljenje: razvojna tehnologija. - Sankt Peterburg: Alijansa "Delta", 2003. - 284 str.
3. Krasnov K.S. Molekule i hemijske veze. – M.: postdiplomske škole, 1984. - 295 str.
4. Leontiev A.N. Predavanja iz opšte psihologije. – M.: Značenje, 2000. – 512 str.
5. Peregudov F.I., Tarasenko F.P. Uvod u analiza sistema. - M.: Viša škola, 1989. - 367 str.
6. Prokofjev V.F. Čovjek - kontrolirani biokompjuter? // Bilten Međunarodne akademije nauka (ruska sekcija). - 2008. - br. 1. - S. 1-21.
7. Yablokov V.A., Zakharova O.M. Sistemska organizacija sadržaja nastave hemije // Universum: Psihologija i obrazovanje: elektron. naučnim časopis 2016. br. 5(23) / [ Elektronski resurs]. - Način pristupa:
URL://website/ru/psy/archiv/item/2505 (pristupljeno 2.04.2017.)
1.4.1 Hemijski modeli
Osim promatranja i eksperimenta, modeliranje igra važnu ulogu u poznavanju svijeta prirode i hemije. Jedan od glavnih ciljeva posmatranja je traženje obrazaca u rezultatima eksperimenata. Međutim, neka zapažanja su nezgodna ili nemoguće sprovesti direktno u prirodi. prirodno okruženje rekreirati u laboratorijskim uslovima uz pomoć posebnih uređaja, instalacija, objekata, odnosno modela. Modeli kopiraju samo najvažnije karakteristike i svojstva objekta, a izostavljaju one koje nisu bitne za proučavanje. Dakle, u hemiji, modeli se mogu uvjetno podijeliti u dvije grupe: materijala i ikona.
Modeli hemijskih i industrijskih aparata
Hemičari koriste materijalne modele atoma, molekula, kristala, hemijske industrije radi veće jasnoće.
Najčešći prikaz atoma je model koji liči na strukturu Sunčevog sistema.
Često se koristi za modeliranje molekula supstanci. lopta i štap modeli. Modeli ovog tipa sastavljeni su od kuglica u boji koje predstavljaju atome koji čine molekul. Kuglice su povezane šipkama, simbolizirajući hemijske veze. Uz pomoć modela kuglice i štapa, uglovi veze u molekuli se prilično precizno reproduciraju, ali se međunuklearne udaljenosti odražavaju samo približno, budući da duljine štapova koji spajaju kuglice nisu proporcionalne dužinama veze.
Dredding modeli prilično precizno prenesu uglove veze i omjer dužina veza u molekulima. Jezgra atoma u njima, za razliku od modela kugle i štapa, nisu označena kuglicama, već spojnim točkama štapova.
hemisferni modeli, takođe se nazivaju Stewart-Brigleb modeli, sastavljaju se od loptica sa izrezanim segmentima. Modeli atoma su međusobno povezani ravninama preseka pomoću dugmadi. Hemisferični modeli precizno prenose i omjer dužina veza i uglova veze i popunjavanje internuklearnog prostora u molekulima. Međutim, ova popunjenost ne omogućava uvijek da se dobije vizualni prikaz relativnu poziciju jezgra.
Modeli kristala podsjećaju na modele molekula s kuglom i štapom, ali ne prikazuju pojedinačne molekule tvari, već pokazuju međusobni raspored čestica tvari u kristalnom stanju.
Međutim, češće kemičari ne koriste materijal, već kultni modeli - to su hemijski simboli, hemijske formule, jednadžbe hemijske reakcije. Koristeći simbole hemijskih elemenata i indeksa, pišu se formule supstanci. Indeks pokazuje koliko je atoma datog elementa uključeno u molekulu supstance. Napisano je desno od znaka hemijskog elementa.
Hemijska formula je glavni ikonski model u hemiji. Pokazuje: specifičnu supstancu; jedna čestica ove supstance; kvalitativni sastav tvari, tj. atomi čiji su elementi dio ove supstance; kvantitativni sastav, odnosno koliko atoma svakog elementa je dio molekula supstance.
Svi gore navedeni modeli se široko koriste u stvaranju interaktivni kompjuterski modeli.
1.4.2 Klasifikacija kompjuterskih modela
Među raznim vrstama pedagoškog softvera, ističu se oni koji koriste kompjuterske modele. Upotreba kompjuterskih modela omogućava ne samo povećanje vidljivosti i intenziviranje procesa učenja, već i radikalnu promjenu ovog procesa. AT poslednjih godina kompjuteri se ubrzano usavršavaju, a njihove mogućnosti modeliranja postale su gotovo neograničene, pa se značaj kompjuterskih modela u izučavanju školskih disciplina može značajno povećati. E.E. Nifantiev, A.K. Ahlebinin, V.N. Lihačov napominje da je glavna prednost kompjuterskih modela mogućnost modeliranja gotovo svih procesa i pojava, interaktivna interakcija korisnika sa modelom, kao i implementacija problematičnih, istraživačkih pristupa u procesu učenja.
V. N. Likhachev predlaže klasifikaciju obrazovnih kompjuterskih modela prema nizu kriterija, od kojih su glavni prisustvo animacije pri prikazivanju modela, način kontrole, način vizualnog prikaza modela. Po prisutnosti animacije, UKM može biti dinamičan i statičan. Dinamički sadrže fragmente animacije za prikaz simuliranih objekata i procesa, a u statičnim ih nema. Prema načinu upravljanja, RCM se može upravljati, što vam omogućava promjenu parametara modela, i neupravljano, koje ne pruža takvu mogućnost.

Među demonstracionim (neupravljanim) modelima mogu se izdvojiti još dve grupe prema mogućnosti interakcije sa korisnikom: interaktivni i neinteraktivni. Interaktivni vam omogućavaju da promijenite vrstu prikaza modela ili točke promatranja na modelu bez promjene njegovih parametara. Neinteraktivne takve mogućnosti ne pružaju.
E.E. Nifantiev, A.K. Ahlebinin i V.N. Lihačov se smatra najkorisnijim sa metodološke tačke gledišta klasifikacija prema objektu modeliranja. Prema nivou zastupljenosti objekata, modeli koji se koriste u nastavi hemije mogu se podijeliti u dvije grupe : modeli makrosvijeta, koji odražavaju vanjska svojstva simuliranih objekata i njihovu promjenu i modeli mikrosveta, koji odražavaju strukturu objekata i promjene koje se u njima dešavaju na nivou njihove atomske i molekularne reprezentacije. A modeli takvih objekata kao što su hemikalije, hemijske reakcije i fizičko-hemijski procesi mogu se kreirati i na nivou mikrosvijeta i na nivou makrokosmosa.

Klasifikacija UKM-a može se prikazati u obliku dijagrama radi veće jasnoće.
1.4.3 Kompjuterski modeli mikrosvijeta
Objekti za modeliranje na nivou mikrokosmosa su atomi, joni, molekuli, kristalne rešetke, strukturni elementi atoma. Na nivou mikrokosmosa modeliraju se karakteristike strukture materije, interakcija čestica koje čine materiju. Za modeliranje hemijskih reakcija na nivou mikrosvijeta, od velikog su interesa mehanizmi hemijskih procesa. A u modelima fizičkih i hemijskih procesa razmatraju se procesi koji se odvijaju na elektronskom ili atomsko-molekularnom nivou.
Jasno je da CCM koji simuliraju modele mikrosvijeta postaju odlični asistenti u proučavanju strukture atoma, vrsta kemijskih veza, strukture materije itd.
Modeli atoma 1 - 3 perioda periodnog sistema Mendeljejeva implementirani su u programu " 1C: Tutor. hemija» u obliku Bohrovih modela atoma. U programu su implementirane modernije ideje o strukturi atoma chemland, gdje se razmatra raspodjela elektrona po energetskim podnivoima atoma elemenata i oblik pojedinačnih orbitala na različitim energetskim nivoima.
Program je od posebnog interesa HyperChem. To je jedan od glavnih stručnih programa za teorijsko izračunavanje različitih termodinamičkih i elektronskih parametara molekula. Uz njegovu pomoć moguće je graditi prostorne modele različitih jedinjenja, proučavati karakteristike njihove geometrijske strukture, odrediti oblik i energiju molekularnih orbitala, prirodu distribucije elektronske gustine, dipolnog momenta itd. Svi izlazni podaci su pruža se u obliku crteža u boji, koji se potom mogu štampati na štampaču, čime se dobija kvalitetna slika hemijskih jedinjenja u potrebnim uglovima i projekcijama. Prednost programa je mogućnost razmatranja molekula sa različite strane da se upoznaju sa karakteristikama njegove prostorne strukture. Ovo se čini izuzetno važnim, jer, kako pokazuje nastavna praksa, učenici obično ne formiraju ideje o molekulima kao prostornim strukturama. Tradicionalna slika hemikalija u jednoj ravni dovodi do gubitka čitave dimenzije i ne stimuliše razvoj prostorne mašte.
Na kursu multimedije Hemija za sve» Koristi se program - stereo demonstrator molekula. Omogućava vam da pružite volumetrijske slike molekula koje se sastoje od atoma vodika, kisika, ugljika i dušika. Za demonstraciju se koriste žičani modeli molekula. Modeli se mogu pomicati, rotirati, prikazivati slike nekoliko različitih molekula u isto vrijeme. Program vam omogućava da sami kreirate nove modele molekula. Ukupno su dati modeli od 25 organskih molekula, međutim didaktička vrijednost ovih modela je niska, jer su modeli dovoljno obezbjeđeni. jednostavne veze, koje svaki učenik može prikupiti koristeći plastelin i šibice.
U programu su implementirani demonstracijski orbitalni 3D modeli nekih molekula " Metoda valentnih veza: hibridizacija atomskih orbitala. I u programu Priroda hemijske veze» objašnjava uzroke nastanka kemijske veze na primjeru stvaranja molekule vodika iz atoma. Oba ova programa su uključena u set programa obuke" Hemija za sve - 2000».
Interaktivni demo žičani okviri koji se koriste u programima ChemLand- 115 molekula pretežno organskih jedinjenja, i " Hemija za sve". Ova dva programa imaju svoje prednosti i nedostatke: u programu Chemistry for All modeli se mogu prikazati na cijelom ekranu monitora, dok u programu ChemLand takve funkcije nema, međutim program sadrži veliki broj molekula. U ChemLand koriste se dinamički modeli koji pokazuju prostornu strukturu molekula sa mogućnošću mjerenja uglova veze i dužine veze, što nam omogućava da pratimo promjenu polariteta trokutastog molekula ovisno o vrsti atoma.
Prilikom proučavanja strukture molekula i kristala, programi dizajnirani više za istraživačke svrhe mogu biti korisni. Ovo je, na primjer, program CS Chem3D Pro, koji vam omogućava da kreirate, modifikujete i prikažete trodimenzionalnu strukturu različitih molekula. Takođe koristan program Kristalni dizajner, koji je dizajniran da vizualizuje trodimenzionalnu strukturu kristalne rešetke. Ovi programi mogu biti korisni za kreiranje trodimenzionalnih slika molekula i kristala i za njihovo demonstriranje u učionici pomoću kompjutera.
Program " sastaviti molekul“, iako inferioran po svojim mogućnostima u odnosu na gore navedene programe, može se efikasno koristiti u individualnom radu školaraca.
Modeli fizičkih i hemijskih procesa i mehanizama implementirani su u program " Hemija za sve". Ovdje su prikazani neinteraktivni modeli na temu "Elektrolitička disocijacija": disocijacija soli, kiselina, alkalija, hidroliza soli. Isti program implementira neke modele mehanizama organskih reakcija: alkansko bromiranje, esterifikacija, opći mehanizam reakcija polimerizacije itd. Svi modeli reakcionih mehanizama su neinteraktivni, prikazani su na celom ekranu, imaju zvuk, ali ne postoji tekstualni opis pojava koje se dešavaju, što značajno ograničava upotrebu programa.
U internet verziji interaktivnog udžbenika za srednju školu organske hemije za X - XI razred, urednik G. I. Deryabina, A. V. Solovov prikazani su razmjenski i donor-akceptorski mehanizmi stvaranja kovalentne veze, homolitički i heterolitički mehanizmi cijepanja kovalentne veze na primjeru apstrakcije atoma vodika iz molekula metana, proces sp-hibridizacije. Od velikog interesa su interaktivni 3D demonstracijski modeli organskih molekula i mehanizmi hemijskih reakcija: hlorisanje metana i opšti mehanizam nukleofilne supstitucije. Vrlo je važno da pri radu sa modelima možete promijeniti njihov položaj u prostoru, a za mehanizam reakcije možete promijeniti položaj točke posmatranja.
Još jedan program koji demonstrira mehanizme hemijskih reakcija, program Organske animacije reakcija. Sadrži 34 mehanizma organskih reakcija. Štaviše, svaki mehanizam je predstavljen u obliku četiri varijante molekularnih modela: loptasti i štap, trodimenzionalni i dvije varijante modela orbitalnih lopatica. Jedna od varijanti modela orbitalne oštrice pokazuje promjenu vanjskih orbitala supstrata u toku reakcije, a druga reaktanta. Ovo olakšava promatranje promjene vanjskih orbitala reaktanata tokom reakcije. Ako je potrebno, možete koristiti teorijski materijal interaktivnog višekanalnog alata za spoznaju. Razvoj sopstveni studenti...
Kompjutersko testiranje
Testovi >> Informatika... metodologije ... studiranje književnost... razvoj testovi i testiranje. Kompjuterizovana tehnologija testiranja treba da ima sledeće glavne karakteristike: interaktivno ... mikrosvjetovi); ... (škola ... njima upotreba at ... modeli / Tutorial to kurs ...
Filozofija i metodologija nauke
Vodič za učenje >> FilozofijaU oblasti biologije at studiranje koevolucija različitih vrste, njima strukture i nivoi organizacije... i uspostavljena. Upotreba metode odolijevaju vanjskim ograničenjima nametnutim parametrima studije. Modeli implementacija...
Društvene i kulturne aktivnosti (2)
Udžbenik >> Sociologija... njima studija, konzervacija, proizvodnja, razvoj, koristiti i kao posljedica toga, razvoj ... . At studiranje kurs, ... mikrosvet ... modeli i kraj model ... interaktivno pedagoške metode i tehnologije. Među njima su i privatnici metode... predškolske ustanove, škola (...
Pošaljite svoj dobar rad u bazu znanja je jednostavno. Koristite obrazac ispod
Studenti, postdiplomci, mladi naučnici koji koriste bazu znanja u svom studiranju i radu biće vam veoma zahvalni.
Još ne postoji HTML verzija rada.
Arhivu radova možete preuzeti klikom na link ispod.
Slični dokumenti
Homologna serija metana. Struktura molekula metana. Uglovi između svih karika. Physical Properties alkani. Laboratorijske metode dobijanja. Dobivanje od soli karboksilne kiseline. Vrsta hibridizacije ugljikovih atoma u alkanima. Strukturni izomerizam alkana.
prezentacija, dodano 08.10.2014
Elektronski model molekula. Teorija odbijanja elektronskih parova valentne ljuske. Reaktivnost molekula. Klasifikacija hemijskih reakcija. Stepeni slobode molekula, njihovi rotaciono kretanje. Opis simetrije oscilacija, njihova interakcija.
prezentacija, dodano 15.10.2013
Karakteristike strukture atoma. Određivanje broja protona, elektrona, neutrona. Razmatranje hemijske veze i polariteta molekula kao celine. Jednačine disocijacije i konstante disocijacije za slabe elektrolite. Redox reakcije.
test, dodano 09.11.2015
Struktura molekula, veze atoma i svojstva acetilena kao hemijske supstance. Osobenosti dobijanja alkina termolizom metana i hidrogenacijom ugljika u industriji i reakcijom eliminacije u laboratoriji. Reakcije alkina koje uključuju trostruku vezu.
kontrolni rad, dodano 05.08.2013
Glavne odredbe klasična teorija hemijska struktura molekula. Karakteristike koje određuju njegovu reaktivnost. Homologni rad alkana. Nomenklatura i izometrija ugljikovodika. Klasifikacija organskih jedinjenja koja sadrže kiseonik.
prezentacija, dodano 25.01.2017
Hemijski element je skup atoma istog tipa. Otkriće hemijskih elemenata. Veličine atoma i molekula. Oblici postojanja hemijskih elemenata. Neke informacije o molekularnoj i nemolekularnoj strukturi tvari. Atomsko-molekularna doktrina.
prezentacija, dodano 15.04.2012
Opšti redosled za izračunavanje elektronske strukture molekula pomoću MO LCAO metode. Jednostavna Hückelova metoda. Primjeri molekularne strukture za MOX metodu. Alil u MOX metodi. Opća svojstva elektronska distribucija u Hückel sistemu ugljovodonika.
Fizički i hemijski model procesa u anodnom mikropražnjenju
V.F. Borbat, O.A. Golovanova, A.M. Sizikov, Omsk Državni univerzitet, Katedra za neorgansku hemiju
Oksidni slojevi formirani na anodama od aluminijuma, titana, tantala i nekih drugih metala tokom prolaska električna struja između elektroda uronjenih u elektrolit, u nekim slučajevima imaju visoka zaštitna i dielektrična svojstva. Trenutno, laboratorije u raznim zemljama provode značajnu količinu istraživanja koja imaju za cilj uspostavljanje mogućnosti za poboljšanje zaštitnih i električnih svojstava anodnih prevlaka, traženje optimalnih sastava elektrolita, poboljšanje proizvodnosti procesa i tako dalje. Praktično iskustvo stečeno nedavno u upotrebi plazma-elektrolitičke anodne obrade za stvaranje zaštitnih premaza značajno je nadmašilo teorijske koncepte koji su dostupni u ovoj oblasti.
Na osnovu literature i naših eksperimentalnih podataka, možemo prihvatiti fizički model anodnog mikropražnjenja, čija je glavna ideja da je anodno mikropražnjenje kombinacija iskri proboja barijernog dijela oksidnog filma i plina. pražnjenje u gasno-plazma mehuru koji se pojavio nakon sloma. Razmotrite korespondenciju predloženog modela eksperimentalni rezultati uzimajući u obzir slijed procesa.
Oksidacija. Prilikom oksidacije (pri konstantnom naponu na elektrodama) nastaju slojevi debljine do stotine mikrona. Uz formiranje novih oksidnih slojeva, odvija se i proces njihovog rastvaranja. Brojna istraživanja su pokazala da su u periodu prije iskre rasta oksidnog filma anioni elektrolita, poput sulfatnih jona, uključeni u volumen oksida. U poroznim filmovima, anioni se pojavljuju u anodnom oksidu zbog mehaničkog "ugrađivanja" komponenti otopine. Sadržaj anjona uključenih u oksid određen je njihovom sposobnošću da se adsorbiraju na površini sedimenta ili čak da formiraju spojeve nestehiometrijskog sastava.
Proučavanjem faznog i elementarnog sastava prevlaka dobijenih plazma-elektrolitičkom obradom, utvrđeno je da se ovim načinom dobivanja prevlaka u film uvode sulfatni ioni. Štaviše, vrsta registrograma daje osnovu za pretpostavku da se „zarada“ komponenti elektrolita događa na mjestima gdje se javljaju anodna mikropražnjenja u vrijeme njihovog „zacjeljivanja“, stoga raspodjela elektrolitnih komponenti po filmu nije ravnomjerna i različita. iz distribucije u filmovima dobivenim konvencionalnim eloksiranjem.
Slom je složen probabilistički proces koji se može dogoditi u datoj tački u dielektriku u prilično širokom rasponu napona i vremena. Najvažniji procesi za početak sloma su promjena prostornog naboja u blizini katode (otopina elektrolita) i povećanje volumnog ubrizgavanja elektrona u provodni pojas dielektričnog filma. Ovi procesi doprinose razvoju sloma. Početak sloma povezan je s razvojem elektronskih lavina. Vrlo je vjerovatno da nivoi nečistoća u oksidu mogu biti izvor primarnih jona. Takav mehanizam ukazuje na posebnu ulogu komponenti elektrolita koje se unose u oksid, prvenstveno aniona. Zbog toga je mogućnost dobivanja anodnih varničkih premaza u velikoj mjeri određena sastavom otopine. Elektroni koji ulaze u pojas provodljivosti i ubrzavaju ih polje dobijaju energiju dovoljnu da izazove udarnu ionizaciju atoma u oksidu. Potonje dovodi do pojave lavina, koje, dostižući metalnu površinu, formiraju kanale za probijanje. Postojanje linearna zavisnost Razlika između probojnog napona i debljine ukazuje na uniformnost polja tokom proboja i električnu prirodu sloma.
Uništavanje oksidnog filma - kada je izložen anodnim mikropražnjenjima na otopinama sumporne kiseline, djelovanje ubrzanog električno polje elektroni će biti izloženi molekulima vode i sumpornoj kiselini. Podaci o jonizaciji ovih rastvora dostupni su u literaturi. Na osnovu njih, najvjerovatniji joni u plazmi mikropražnjenja će najvjerovatnije biti ioni sa najmanjim potencijalima pojave, tj. H2O+ treba očekivati za molekule vode, H2SO4+ za sumpornu kiselinu, a manje vjerovatno HSO4+.
Dakle, procesi jonizacije i disocijativnog vezivanja elektrona daju sledeće ione pod dejstvom mikropražnjenja na rastvore sumporne kiseline (reakcije 1-5). e + H2O H2O+ + 2e (1), e + H2SO4 H2SO4+ + 2e (2), ili HSO4 + H+ + 2e (3), e + H2O OH + H- (4), e + H2SO4 H + HSO4- (5).
Pozitivni i negativni joni nastali ovim reakcijama imaju dva različita načina transformacije: 1) neutralizacija naelektrisanja; 2) ionsko-molekularne reakcije. Radikali nastali kao rezultat disocijacije pobuđenih čestica i ionsko-molekularnim reakcijama ulaze u reakcije apstrakcije H atoma od molekula u mjehuru plina iu reakciju rekombinacije.
Nakon formiranja radikala, odvijaju se reakcije apstrakcije H atoma: H(OH, HSO4) + H2SO4 H2(H2O, H2SO4) + HSO4 (6), H(HSO3) + H2O H2(H2SO3) + OH (7) i reakcije rekombinacije radikala: HSO4 + OH H2SO4 (8), HSO4 + HSO4 H2S2O8 (9), OH + OH H2O2 (10), H + HSO4 H2SO4 (11).
Nastajanje sumpor-dioksida moguće je kao rezultat interakcije molekula sumporne kiseline pobuđenih mikropražnjenjem plazme sa susjednim molekulima: H2SO4* + H2SO4 H2SO3 + H2SO5 (12), ili je moguć i mehanizam: H2SO4* H2SO3 + O (13). Nastali H2SO3 i H2SO5 zbog visoke temperature u zoni mikropražnjenja termički se disociraju prema jednadžbama:
H2SO3 H2O + SO2 (14), 2H2SO5 2H2SO4 + 0,5 O2 (15).
Neki od radikala izlaze izvan mjehurića plina mikropražnjenja u tekućinu koja ga okružuje, gdje ulaze u reakcije rekombinacije jedni s drugima i reagiraju s komponentama elektrolita. Prinos proizvoda kao rezultat procesa koji se odvijaju u sloju elektrolita koji je blizu mjehurića ovisit će o koncentraciji sumporne kiseline (tj. o udjelu iona prisutnih u otopinama sumporne kiseline različitih koncentracija).
Prema predloženom mehanizmu hemijskih transformacija sumporne kiseline, sa povećanjem njene koncentracije u rastvoru, u suprotnom, sa povećanjem njene koncentracije u mjehuriću plina s mikropražnjenjem, povećava se broj direktno ioniziranih i pobuđenih sumpornim udarom elektrona. će se pojaviti molekuli kiseline. Budući da se zbog niske jonizacije na energijama elektrona uobičajenim za plinsko pražnjenje, kemijske transformacije tvari odvijaju uglavnom kroz pobuđena stanja, onda u slučaju izlaganja mikropražnjenjima s povećanjem koncentracije sumporne kiseline, treba očekivati povećanje u prinosu proizvoda čiji su prekursor pobuđene čestice.
Sa povećanjem koncentracije sumporne kiseline (više od 14M), udio molekula sumporne kiseline u mjehuru plina i plazme raste, odnosno dolazi do raspada otopljene tvari zbog direktnu akciju mikropražnjenja plazme. Za otopine sumporne kiseline manje od 14 M, konverzija otopljene tvari se događa uglavnom zbog djelovanja plazme na otapalo - indirektno djelovanje. Ovo povećava vjerovatnoću reakcija 9,10,11,13 koje dovode do formiranja stabilnog molekularni proizvodi: sumpordioksid i peroksidna jedinjenja.
"Liječenje" pora - daljnje širenje formiranja plazme prilično brzo dovodi do značajnog smanjenja temperature potonje i, kao posljedica toga, do smanjenja koncentracije nosilaca pražnjenja, prekida struje i brzog hlađenja kanala . Nestanak plinsko-plazma mjehurića će se dogoditi nakon što se gasno pražnjenje u njemu ugasi. Poznato je da će se gasno pražnjenje ugasiti kada gustina struje u njemu padne ispod minimalne dozvoljene vrednosti za samoodrživost pražnjenja. U slučaju mikropražnjenja, razlozi za smanjenje gustine struje gasnog pražnjenja mogu biti: 1) iscrpljivanje sloja elektrolita blizu mehurića tokom vremena nosiocima struje, zbog čega elektrolit postaje nesposoban da obezbedi minimalna gustina struje dozvoljena za samoodrživost pražnjenja, a gasno pražnjenje se gasi; 2) povećanje veličine mjehurića mikropražnjenja zbog isparavanja tečnosti koja ga okružuje u njega; 3) topljenje ili "zacjeljivanje" (eloksiranjem u plinskoj plazmi) razgradnog kanala u dijelu barijere oksidnog filma. Krater nastao prilikom prvog sloma obično dopire do metalne površine. U ovom trenutku, gustina struje postaje maksimalna zbog relativno niskog otpora elektrolita u krateru, što osigurava brzo pojavljivanje oksidni film (proizvod plazma-hemijske reakcije MexOy). Dolazi do "cijeljenja" mjesta razgradnje, povećava se debljina oksidnog filma i to uglavnom u dubini materijala podloge.
Dakle, na osnovu rezultata eksperimenta i literaturnih podataka, predlaže se mehanizam djelovanja anodnog mikropražnjenja na otopine sumporne kiseline, koji uključuje sljedeće faze:
Formiranje pobuđenih i jonizovanih molekula u mjehuru mikropražnjenja zbog plinskog pražnjenja koji teče u njemu;
Tok reakcija sa stvaranjem radikala i molekularnih proizvoda, čije reakcije međusobno i sa polaznim materijalima daju većinu konačnih proizvoda;
Difuzijsko uklanjanje nastalih radikala i drugih čestica izvan mjehurića plina, čije reakcije dovode do konačnih molekularnih proizvoda u sloju elektrolita koji se nalazi blizu mjehurića.
Bibliografija
Bakovets V.V., Polyakov O.V., Dolgovesova I.P. Plazma-elektrolitička anodna obrada metala // Novosibirsk: Nauka, 1991. P.63-68.
Nagatant T., Yashinara S.T. Studije raspodjele iona fragmenata i njihove reakcije spektrometrom naboja // J. Bull. chem. soc. Jap., 1973. V.46. br. 5. P.1450-1454.
Mann M., Hastrulid A., Tate J. Ionizacija i disocijacija vodene pare i amonijaka udarom elektrona // J. Phys. Rev. 1980. V.58. P.340-347.
Ivanov Yu.A., Polak L.S. Energetska distribucija elektrona u niskotemperaturnoj plazmi // Plasma Chemistry, Moskva: Atomizdat, 1975. Br. 2. C.161-198.
Za pripremu ovog rada, materijali sa stranice http://www.omsu.omskreg.ru/