Determinación de la sequedad del vapor según el diagrama. Vapor de agua. diagrama h,s de vapor de agua. estudio de los procesos de vapor según el diagrama h,s
¡Hola! A menudo es difícil determinar los parámetros y funciones del estado mediante fórmulas debido a la compleja dependencia de la capacidad calorífica del vapor de agua y el calor de vaporización de la temperatura y la presión. Por lo tanto, para el vapor de agua, sobre la base de estudios experimentales, se compilaron tablas que reflejan las dependencias los parámetros más importantes vapor de agua. Utilizándolos, por ejemplo, a partir de la presión conocida del vapor saturado seco, puede determinar todos los demás parámetros.
Dado que el estado del vapor saturado seco está determinado únicamente por su presión p o temperatura de saturación Tn, las tablas se compilan por presión o temperatura. Uno de estos parámetros de las tablas se puede utilizar para determinar otras cantidades que caracterizan el estado del vapor saturado seco. Las tablas de vapor sobrecalentado enumeran sus parámetros y funciones de estado en función de la temperatura y presión del vapor.
El cálculo de los procesos de cambio de estado del vapor se simplifica al cambiar a un método gráfico basado en el uso de diagramas de estado. En este caso, no se requiere realizar una gran cantidad de cálculos y el cálculo se reduce a determinar los parámetros mediante diagramas. Usando un método gráfico, es fácil determinar no solo los parámetros iniciales y finales del vapor en el proceso, sino también todos los parámetros de estado intermedio, lo que simplifica enormemente los cálculos de ingeniería.
ventaja método gráfico es relativamente fácil rastrear la conexión entre diferentes tamaños, esto lo hace indispensable en el análisis teórico de diversos procesos en motores térmicos. Usando el diagrama, así como usando las tablas, es posible determinar los parámetros y funciones del estado del vapor de agua, incluido el vapor saturado húmedo.
Los diagramas Ts e is del estado del vapor de agua son los más utilizados. Dado que es fácil determinar la cantidad de calor en el proceso utilizando el diagrama Ts, se utiliza principalmente para el análisis teórico de la eficiencia de los motores térmicos. Al calcular varios procesos de cambio de estado, se utiliza principalmente es-diagrama vapor de agua.
En la fig. 1 en las coordenadas Ts muestra el proceso de vaporización en p = const (proceso abcd). La curva aKs es la curva límite y el punto K es el punto crítico. El origen de la entropía corresponde a su valor a 273 K. El área bajo la curva de proceso en el diagrama is corresponde a la cantidad de calor.

Por tanto, el área bajo la isobara ab es equivalente a la entalpía del agua i "a la temperatura de vaporización Tn. En la sección isobárica bc, que coincide con la isoterma, se produce el proceso de vaporización, y el área bajo la recta bc corresponde al calor de vaporización g.B proceso isobárico sobrecaliente cd, la temperatura del vapor aumenta al valor T, y la cantidad de calor cm (T-Tn) se suministra al vapor. Las líneas del grado constante de sequedad x=const, como en todos los diagramas, convergen en el punto crítico K.
En la fig. 2 mostrados varios procesos cambios en el estado del vapor de agua en el diagrama is. La región del diagrama ubicada a la izquierda de la curva límite eK corresponde al estado del líquido. La curva límite del par Kf divide el diagrama en dos regiones. Por encima de esta curva está la región de vapor sobrecalentado, y por debajo está la región de vapor húmedo. En la curva límite Kf, el vapor está saturado seco (x=1). El proceso isobárico está representado por la línea abc, el proceso isotérmico - abd (en la región de vapor húmedo la isoterma y la isobara coinciden), isocórico - υ=const y adiabático - gh. Además, esta figura muestra las líneas de un grado de sequedad constante x = const. Las tablas y diagramas no muestran valores energía interna gas, que se puede determinar a partir de la relación u = i-pυ.
En la fig. 3 muestra un diagrama is de vapor de agua. En el cálculo gráfico de procesos para dos valores conocidos (p, υ, T; x, i, s), se encuentra un punto en el diagrama correspondiente al estado inicial del vapor y todos los parámetros desconocidos. El estado final del vapor también se puede determinar a partir de dos parámetros de estado conocidos. Si solo se da un parámetro de estado final, entonces también se debe conocer la naturaleza del proceso. En este caso, el punto que caracteriza el estado final se encuentra en la intersección de la curva de proceso especificada y la curva isoparamétrica correspondiente, como una isobara.
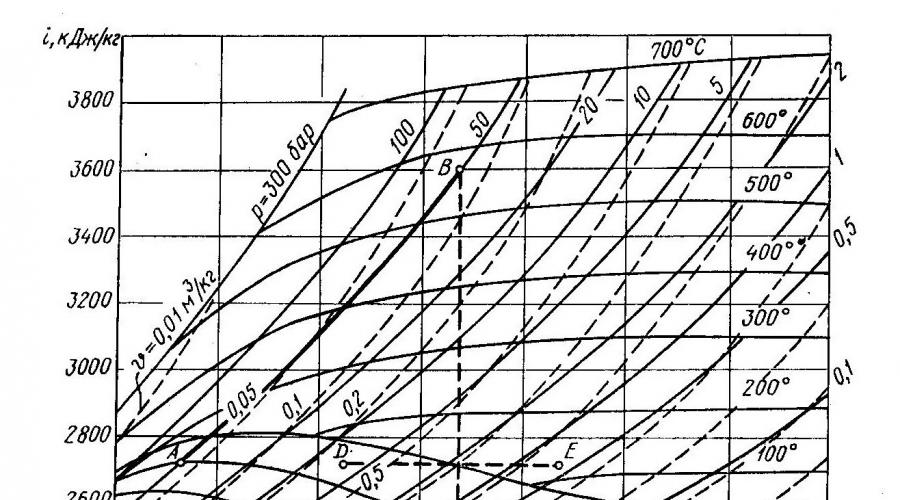
Ejemplo. Determine la cantidad de calor reportada por 1 kg de vapor en el sobrecalentador de la unidad de caldera. Parámetros iniciales de vapor p1 = 5 MPa y x1=0,95. También se sabe que después de la expansión adiabática del vapor en la turbina, x2 = 0,87 y la presión final del vapor p2 = 0,01 MPa.
Decisión. Como se suministra calor al vapor a presión constante en el sobrecalentador, su cantidad es igual a la diferencia entre la entalpía inicial i1 y la entalpía i2 del vapor después del sobrecalentador: q=i2-i1. De acuerdo con los parámetros de vapor iniciales p1 y x1 en el diagrama is, encontramos el punto A (Fig. 3), que corresponde al valor de entalpía i1=2720 kJ/kg. El punto B, correspondiente al estado del vapor a la salida del sobrecalentador, se encuentra en la intersección de la isobara p1=5 MPa y la adiabática BC, que pasa por el punto C. La posición del punto C está determinada por los parámetros del vapor p2 y x2. Entalpía de vapor en el punto В i2 = 3600 kJ/kg.
La cantidad de calor suministrada a 1 kg de vapor es q = 3600–2720=880 kJ/kg. El ejemplo considerado muestra que el diagrama is simplifica enormemente los cálculos del proceso para el vapor de agua. Literatura útil: 1) Ingeniería térmica y equipos de ingeniería térmica de empresas industriales. materiales de construcción y productos, N. M. Nikiforova, Moscú, " Escuela de posgrado”, 1981. 2) Ingeniería térmica, Bondarev V.A., Protsky A.E., Grinkevich R.N. Minsk, ed. 2º, "Escuela Superior", 1976.
VAPOR DE AGUA. DIAGRAMA H,S VAPOR DE AGUA. ESTUDIO DE PROCESOS DE VAPOR EN EL DIAGRAMA H,s
Agua y. El vapor de agua se usa ampliamente en ingeniería energética, calefacción, ventilación y suministro de agua caliente.
El vapor de agua es un gas real. Puede estar húmedo, seco saturado y sobrecalentado. Las ecuaciones de estado de las cuencas reales son complejas, por lo tanto, en cálculos termotécnicos prefieren utilizar tablas y gráficos. Significado especial para cálculos técnicos de procesos con vapor de agua tiene un diagrama h, s de vapor de agua.
El diagrama h,S muestra (Fig. 5.1) la curva límite superior (el grado de sequedad del vapor X=1) correspondiente al vapor saturado seco. Por encima de esta curva se encuentra la zona de vapor sobrecalentado.
Figura 5.1 Diagrama h,S de vapor de agua
Por debajo del vapor saturado húmedo. Las curvas de sequedad se trazan en la región del vapor húmedo saturado (X=0,95; X=0,90; X=0,85, etc.)
en la coordenada ejes h,S(Fig.5.1) trazó las curvas de los procesos más simples r=const (isobaras); v= const (isocoros); t = constante (y términos); cualquier línea vertical (Fig.5.2.) representa un proceso adiabático (S=const).
En la región del vapor saturado húmedo, las isotermas (t = const) coinciden con las curvas isobáricas (p = const), ya que la vaporización ocurre a presión y temperatura constantes. En la curva límite superior, la dirección de la isoterma cambia, y en la curva límite, la dirección de la isoterma cambia, y las áreas de vapor sobrecalentado de la isoterma se desvían hacia la derecha y no coinciden con las isobaras.
En la práctica, se usa una parte del diagrama h,S cuando X 0.5, que está encerrado en un marco. Esta parte del diagrama se muestra en el apéndice y en la Figura 5.2.
El estado del vapor sobrecalentado en el diagrama h, S está determinado por dos parámetros (p 1 y t 1 o p 1 y v 1), y el vapor saturado húmedo, por un parámetro y el grado de sequedad del vapor X. Según 2 dados los parámetros p 1 y t 1 en el área de vapor sobrecalentado encontramos el punto I (Fig. 5.2.), Correspondiente a un estado dado de vapor de agua. Para este estado, todos los demás parámetros (h 1 ,s 1 ,v 1) se pueden encontrar en el diagrama.
 El valor de la energía interna se calcula mediante la fórmula.
El valor de la energía interna se calcula mediante la fórmula.
Conociendo el tipo de proceso termodinámico, se mueven a lo largo de él hasta que se cruza con un parámetro final dado y encuentran el estado final del vapor en el diagrama. Habiendo determinado los parámetros del estado final, puede calcular los indicadores del proceso (trabajo, calor, cambio de parámetros)
El cambio en la energía interna y el trabajo en cualquier proceso se calculan mediante las fórmulas
Consideremos las principales tareas resueltas por el diagrama h,S.
Proceso isocórico (v= const)
La cantidad de calor involucrada en el proceso está determinada por la fórmula 5.2. para determinar el cambio en la energía interna.
Trabaja proceso isocórico es igual a cero
Proceso isobárico (p=const), la cantidad de calor involucrada en el proceso está determinada por la fórmula 
 Cambio de energía interna según fórmula 5.2 o según fórmula 5.3
Cambio de energía interna según fórmula 5.2 o según fórmula 5.3
Proceso isotérmico (t = const).
El calor y el trabajo del proceso se encuentran mediante la fórmula:
 5.6
5.6
proceso adiabático  . En la fig. 5.2. se presenta un proceso adiabático que transcurre sin intercambio de calor con ambiente externo. En un proceso adiabático, la entropía no cambia y muy a menudo este proceso se llama isentrópico.
. En la fig. 5.2. se presenta un proceso adiabático que transcurre sin intercambio de calor con ambiente externo. En un proceso adiabático, la entropía no cambia y muy a menudo este proceso se llama isentrópico.
Al realizar cálculos técnicos y económicos para la selección de equipos en la industria de la energía térmica y otras industrias, y al modelar procesos térmicos, se requieren datos confiables y verificados sobre las propiedades termofísicas del agua y el vapor en una amplia gama de presiones y temperaturas.
En 1904, el termofísico alemán Richard Mollier desarrolló un diagrama especial para simplificar y facilitar la solución de problemas prácticos en ingeniería térmica, en el que la información de las tablas de estado se muestra gráficamente en las coordenadas de entalpía (h) y entropía (s). Los diagramas s suelen contener datos sobre las propiedades del agua en estado líquido y gaseoso, ya que son de gran interés desde el punto de vista de la ingeniería térmica.
$h-s$ diagrama de agua y vapor.
El vapor de agua para fines industriales se produce en generadores de vapor ( calderas de vapor) varios tipos, que tienen en común que el proceso de obtención de vapor es isobárico. El punto de ebullición del agua y del vapor que se forma a partir de ella es constante, depende únicamente de la presión del generador de vapor y se denomina temperatura de saturación $t_n$.
El vapor cuya temperatura es igual a la temperatura de saturación se denomina saturado (el vapor está en equilibrio termodinámico con un líquido en ebullición). El vapor saturado que no contiene impurezas líquidas se llama vapor saturado seco. Una mezcla de vapor saturado seco y líquido en ebullición se llama vapor saturado húmedo. La fracción de masa de vapor saturado seco en esta mezcla se denomina grado de sequedad y se denota por x. Para vapor saturado seco $x=1$, para líquido en ebullición $x=0$, para vapor saturado húmedo $0
Por debajo calor de vaporización$r$ es la cantidad de calor requerida para convertir 1 kg de líquido hirviendo a presión constante (y por lo tanto a temperatura constante) en vapor saturado seco.
Los parámetros de líquido en ebullición (volumen específico, entalpía, entropía) se denotan, respectivamente, $v"$, $h"$, $s"$, y los parámetros de vapor saturado seco - $v""$, $h""$, $ s ""$ Los parámetros de vapor saturado húmedo generalmente se denotan $v_x$, $h_x$ y $s_x$ y están determinados por las siguientes fórmulas como para una mezcla de agua hirviendo y vapor seco:
$$v_x=v""x+v"(1–x),$$ $$h_x=h""x+h"(1–x),$$ $$s_x=s"" x+s" ( 1–x).$$
Los parámetros de vapor sobrecalentado se indican sin trazos ni índices, es decir, $v$, $h$ y $s$.
Dado que el vapor de agua se obtiene en un proceso isobárico, la cantidad de calor suministrada al fluido de trabajo se puede calcular como la diferencia de entalpías al final y al comienzo del proceso. Esto es muy conveniente, porque permite prescindir de la capacidad calorífica, que en este caso(gas real) depende no solo de la temperatura, sino también de la presión.
El calor de vaporización, teniendo en cuenta lo dicho, es igual a:
$$r=h""–h".$$
La figura muestra el diagrama $h-s$ del vapor de agua. Este diagrama muestra la curva límite inferior ($x=0$) o la línea de líquido en ebullición y la curva límite superior ($x=1$) o la línea de vapor saturado seco. Las curvas límite se unen en el punto crítico $K$, que denota el estado crítico del agua, cuando no hay diferencia entre el líquido en ebullición y el vapor seco. Las líneas divisorias dividen los diagramas en áreas de goteo de líquido (agua), vapor saturado húmedo y vapor sobrecalentado. En la región del vapor húmedo, las isobaras y las isotermas coinciden.
 Isolíneas en el diagrama $h-s$ de agua y vapor.
Isolíneas en el diagrama $h-s$ de agua y vapor.
Con el desarrollo de la tecnología informática electrónica moderna y la llegada de computadoras y aplicaciones asequibles, generalizado recibido diagramas hs en formato electrónico.
Por ejemplo, un simulador de diagramas HS, TS, PS, PT, PV para agua y vapor con el cálculo de propiedades termofísicas según el formulario IAPWS-IF97 y sus adiciones.

Dependiendo de la posición del cursor (control del mouse y flechas del teclado), se muestran p, T, h, s, v, x del punto seleccionado. También es posible ingresar datos manualmente y moverse por los modos: p-const, T-const, h-const, s-const, v-const, x-const. El simulador tiene la capacidad de construir y ver gráficos termodinámicos y guardarlos en un archivo. Zoom: usando el control deslizante o la rueda del mouse. Este programa es el más visible y manera conveniente encontrar los parámetros termodinámicos del agua y el vapor, además es gratis.
El tamaño: 3070x3995 píxeles
Formatos: .PDF, .JPG
Diagrama de colores– se destacan los grados de sequedad, temperatura, presión y volumen Colores diferentes, lo que hace que trabajar con el diagrama sea muy conveniente.
El tamaño grande le permitirá imprimir el gráfico en A3 y más grande.
is-diagram se utiliza para cálculos prácticos de procesos de vapor. En él, el calor y la entalpía se miden mediante segmentos lineales.
is-chart tiene una fila propiedades importantes: usándolo, puede determinar rápidamente los parámetros de vapor y la diferencia de entalpía en forma de segmentos, representar visualmente el proceso adiabático y resolver otros problemas.
También puede utilizar una muy conveniente y visual.
Descripción del diagrama is
El diagrama is muestra los procesos termodinámicos:
- proceso isobárico (pag= const) - líneas moradas (isobaras),
- Proceso isotérmico (t= const) — líneas verdes (isotermas),
- Proceso isocórico (v= const) son líneas rojas (isocoros).
Sequedad y contenido de vapor (X) son líneas rosas. La línea rosa gruesa es el grado de sequedad X=1. Todo lo que está debajo de esta línea es una zona de vapor húmedo.
Eje "X" - entropía, eje "Y" - entalpía.

La familia de isobaras en la región de saturación es un conjunto de líneas rectas divergentes que comienzan en la curva límite inferior y terminan en la superior. Cuanto mayor sea la presión, mayor será la isobara correspondiente. La transición de las isobaras de la región de vapor saturado húmedo a la región de vapor sobrecalentado ocurre sin interrupción en la curva límite superior.
En el diagrama i, s del vapor de agua, también se trazan líneas de contenido de vapor constante ( X= const) y líneas de volumen específico constante ( v= constante). Las isocoras son algo más empinadas que las isobaras.
El estado del vapor sobrecalentado generalmente se define en ingeniería por la presión pag y temperatura t. El punto que representa este estado se encuentra en la intersección de la isobara y la isoterma correspondientes. El estado del vapor saturado húmedo está determinado por la presión pag y contenido de vapor X.
El punto que representa este estado está determinado por la intersección de la isobara y la línea X= constante
Cómo usar is-chart
Usemos un pequeño problema para describirlo. Tomemos una condición del techo.
Sean los parámetros iniciales de vapor: presión de vapor R= 120 bar, temperatura del vapor t= 550°С. El vapor se expande adiabáticamente en la turbina hasta una temperatura de, por ejemplo, 400°C.
Esto será suficiente para un ejemplo.
Adiabático proceso en el diagrama is es una línea vertical (la línea horizontal es estrangulación). Esto es para referencia.
Entonces, tenemos la presión y la temperatura iniciales. Encontremos este punto en el diagrama is:
Nosotros necesitamos isobara, correspondiente a la presión 120 bares y isoterma, correspondiente a la temperatura 550 °C. En su intersección habrá un punto correspondiente a los parámetros iniciales del vapor en nuestro problema.

Habiendo encontrado este punto, ya podemos determinar la entalpía y la entropía en él. Habiendo bajado las proyecciones del punto encontrado en el eje, encontramos los valores entalpía(eje "Y") y entropía(eje "X").
i = ~3480 kJ/kg, S = 6,65 kJ/(kg·K)
A continuación, necesitamos averiguar los parámetros del vapor después de la expansión adiabática. Sabemos que según las condiciones establecidas por nosotros, el vapor se ha expandido y su temperatura en punto 2= 400 °C. Ya mencioné que en el diagrama is, el proceso adiabático se representa como una línea vertical. Dibujar esta línea desde el punto 1 (parámetros iniciales) hasta la intersección con la isoterma 400 °C.

Recibió punto 2. Una isobara pasa por este punto. Coincide con la presión 50 bares. La entropía no ha cambiado, ya que el proceso es adiabático, pero la entalpía se ha vuelto igual a i = 3200 kJ/kg.
Eso es todo. Entonces solo quedan los cálculos: determinar el cambio en la energía interna ( tu), trabaja ( yo, yo), etc. Todo esto se calcula de acuerdo con las fórmulas (puede encontrar las fórmulas en el artículo), y ya tiene los valores y el gráfico del proceso de expansión de vapor.