Reakcije vezanosti. Tipovi hemijskih reakcija u organskoj hemiji Podela supstituenata u benzenovom prstenu na dva tipa
Pročitajte također
) veze drugog hemijskog jedinjenja. Pristup se može izvršiti kao veza ugljenik-ugljik i komunikacijom heteroatom ugljenika. Reakcije sabiranja su označene engleskim slovima "Oglas".
Opšti pogled na reakcije adicije vezom ugljenik-ugljik:
Opšti pogled na reakcije adicije vezom ugljenik-kiseonik:
Obično se zove reagens kojem se dodaje supstrat, a drugi ( "X-Y") - reagens za napad.
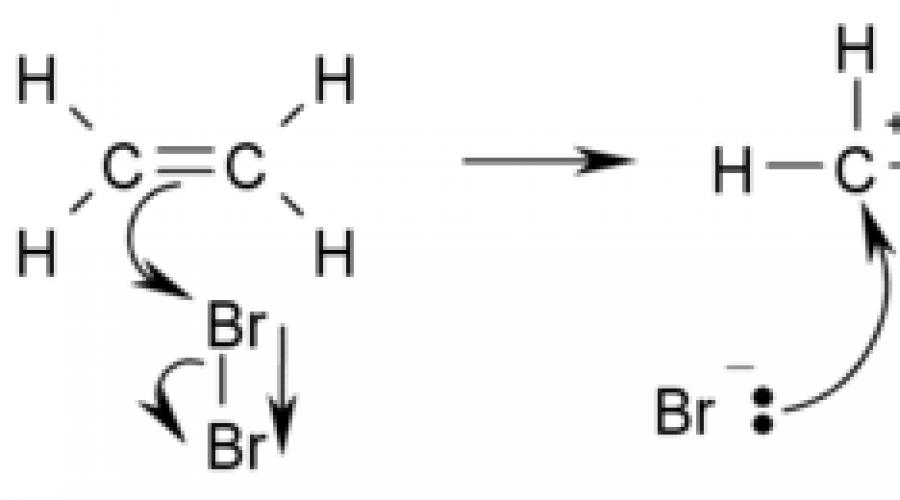
Primjer reakcije adicije je bromiranje etilena:

Reakcije adicije su često reverzibilne, uparuju se sa reakcijama eliminacije, pa treba imati na umu da je mehanizam za takvu "uparenu" reakciju adicije-eliminacije uobičajen.
U zavisnosti od prirode čestice koja napada i mehanizma reakcije, pravi se razlika između nukleofilnog, elektrofilnog, radikalnog ili sinhronog dodavanja.
Reakcije nukleofilne adicije
U reakcijama nukleofilne adicije, čestica koja napada je nukleofil, odnosno negativno nabijena čestica ili čestica sa slobodnim elektronskim parom.
Opšti pogled na reakcije nukleofilne adicije:
Nukleofilne reakcije adicije su označene "AdN".
Reakcije nukleofilne adicije na vezi C=C su prilično rijetke, najraširenija i najpraktičnija vrijednost je povezivanje po vezu C=O :
Među reakcijama nukleofilne adicije, najčešći je gornji dvostepeni bimolekularni mehanizam Oglas N 2: U početku, nukleofil polako dodaje višestruku vezu da bi formirao karbanion, koji u drugom koraku brzo napada elektrofilna vrsta.
Elektrofilne reakcije adicije
U reakcijama elektrofilne adicije, čestica koja napada je elektrofil, odnosno pozitivno nabijenu česticu, najčešće proton H+, ili čestica s nedostatkom elektrona.
Opšti pogled na reakcije elektrofilne adicije:
Reakcije elektrofilne adicije su označene "Ad e".
Reakcije elektrofilne adicije su široko rasprostranjene među reakcijama nezasićenih ugljikovodika: alkena, alkina i diena.
Primjer takvih reakcija je hidratacija alkena:
Elektrofilno vezivanje heteroatom ugljenika je također prilično česta, a najčešće takva veza jeste C=O:



Među reakcijama elektrofilne adicije, najčešći je gornji dvostepeni bimolekularni mehanizam Oglas E 2: U početku, elektrofil polako dodaje višestruku vezu da bi formirao karbokation, koji je podvrgnut nukleofilnom napadu u drugom koraku.
Reakcije radikalne adicije
U reakcijama adicije radikala, slobodni radikali su napadačke vrste.
Reakcije radikalne adicije su označene "Ad R".
Reakcije radikalne adicije obično se odvijaju umjesto reakcija elektrofilne adicije u prisustvu izvora slobodnih radikala:

Sinhrone reakcije adicije
U nekim slučajevima dolazi do dodavanja višestrukom vezom uz istovremeni napad oba atoma, što ne dozvoljava da se odredi prioritet napada. Takav mehanizam se zove sinhrone veze. Sinhrone reakcije adicije dovode do stvaranja cikličkih proizvoda, pa se često nazivaju cikloadicija.
Bilješke
| Hemijske reakcije u organskoj hemiji | |
|---|---|
| Reakcije supstitucije | Reakcije nukleofilne supstitucije Reakcije elektrofilne supstitucije Reakcije radikalne supstitucije |
| Reakcije sabiranja | Reakcije nukleofilne adicije Reakcije elektrofilne adicije Reakcije radikalne adicije Reakcije simultane adicije |
| Reakcije eliminacije | Heterolitičke reakcije eliminacije Periciklične reakcije eliminacije Reakcije radikalne eliminacije |
| reakcije preuređivanja | Nukleofilna preuređivanja Elektrofilna preuređivanja Radikalna preuređivanja |
| Reakcije oksidacije i redukcije | Reakcije oksidacije Reakcije redukcije |
| Ostalo | Nazivne reakcije u organskoj hemiji |
Wikimedia fondacija. 2010 .
Pogledajte šta su "Reakcije na dodavanje" u drugim rječnicima:
polimer reakcije adicije- - EN adicijski polimer Polimer nastao lančanim dodavanjem molekula nezasićenih monomera, kao što su olefini, jedan s drugim bez stvaranja nusproizvoda, kao što je voda;… … Priručnik tehničkog prevodioca
- (engleska adiciona elektrofilna reakcija) reakcije adicije, u kojoj napad u početnoj fazi vrši elektrofilna čestica, pozitivno naelektrisana ili sa manjkom elektrona. U završnoj fazi, rezultirajuća ... ... Wikipedia
- (engleski adiciona nukleofilna reakcija) reakcije adicije u kojima napad u početnoj fazi vrši nukleofilna čestica, negativno naelektrisana ili sa slobodnim elektronskim parom. U završnoj fazi, rezultirajuća ... ... Wikipedia
- (eng. add radikalna reakcija) reakcije adicije u kojima napad izvode slobodni radikali čestice koja sadrži jedan ili više nesparenih elektrona. Istovremeno, radikali mogu napasti i druge radikale i ... ... Wikipediju
Reakcije sabiranja u kojima su oba atoma višestruke veze napadnuta istovremeno. Drugi naziv za reakcije ovog tipa su reakcije cikloadicije, jer su krajnji produkti takvih reakcija ciklički supstrati. Postoje dvije ... ... Wikipedia
- (engleska nukleofilna supstitucijska reakcija) supstitucijske reakcije u kojima se napad izvodi nukleofilnim reagensom koji nosi nepodijeljeni elektronski par. Odlazeća grupa u reakcijama nukleofilne supstitucije naziva se nukleofuga. Sve ... Wikipedia
Reakcije organskih tvari mogu se formalno podijeliti u četiri glavna tipa: zamjena, dodavanje, eliminacija (eliminacija) i preuređenje (izomerizacija). Očigledno, čitav niz reakcija organskih spojeva ne može se svesti na predloženu klasifikaciju (na primjer, reakcije sagorijevanja). Međutim, takva klasifikacija će pomoći da se uspostave analogije s već poznatim reakcijama koje se javljaju između neorganskih supstanci.
U pravilu se glavni organski spoj uključen u reakciju naziva supstrat, a druga komponenta reakcije se uslovno smatra kao reagens.
Reakcije supstitucije
Reakcije supstitucije- to su reakcije koje rezultiraju zamjenom jednog atoma ili grupe atoma u izvornom molekulu (supstratu) drugim atomima ili grupama atoma.
Reakcije supstitucije uključuju zasićena i aromatična jedinjenja kao što su alkani, cikloalkani ili areni. Navedimo primjere takvih reakcija.
Pod djelovanjem svjetlosti, atomi vodika u molekuli metana mogu se zamijeniti atomima halogena, na primjer, atomima klora:
Drugi primjer zamjene vodika halogenom je konverzija benzena u bromobenzen:

Jednačina za ovu reakciju može se napisati drugačije:
![]()
Kod ovog oblika snimanja, reagensi, katalizator, uslovi reakcije su upisani iznad strelice, a neorganski produkti reakcije ispod nje.
Kao rezultat reakcija supstitucije u organskim supstancama nastaju ne jednostavne i složene supstance, kao u neorganskoj hemiji, i dva složene supstance.
Reakcije sabiranja
Reakcije sabiranja su reakcije u kojima se dva ili više molekula reaktanata spajaju u jednu.
Nezasićena jedinjenja, kao što su alkeni ili alkini, ulaze u reakcije adicije. Ovisno o tome koja molekula djeluje kao reagens, razlikuju se hidrogenacija (ili redukcija), halogenacija, hidrohalogenacija, hidratacija i druge reakcije adicije. Svaki od njih zahteva određene uslove.
1.Hidrogenacija- reakcija dodavanja molekule vodika na višestruku vezu:
2. Hidrohalogenacija- reakcija dodavanja halogenovodonika (hidrokloracija):
3. Halogenacija- reakcija adicije halogena:
![]()
4.Polimerizacija- posebna vrsta reakcija adicije, tokom koje se molekuli tvari male molekularne težine međusobno spajaju da bi se formirali molekuli tvari vrlo velike molekularne mase - makromolekule.
Reakcije polimerizacije su procesi spajanja mnogih molekula tvari male molekularne težine (monomera) u velike molekule (makromolekule) polimera.
Primjer reakcije polimerizacije je proizvodnja polietilena iz etilena (etena) pod djelovanjem ultraljubičastog zračenja i inicijatora radikalne polimerizacije R.
Kovalentna veza najkarakterističnija za organska jedinjenja nastaje kada se atomske orbitale preklapaju i formiraju zajednički elektronski parovi. Kao rezultat toga, formira se orbitala zajednička za dva atoma, na kojoj se nalazi zajednički elektronski par. Kada je veza prekinuta, sudbina ovih uobičajenih elektrona može biti različita.
Vrste reaktivnih čestica
Orbitala s nesparenim elektronom koji pripada jednom atomu može se preklapati s orbitalom drugog atoma koji također sadrži nespareni elektron. U ovom slučaju, formiranje kovalentne veze odvija se prema mehanizmu razmjene:
Mehanizam izmjene za formiranje kovalentne veze ostvaruje se ako se od nesparenih elektrona koji pripadaju različitim atomima formira zajednički elektronski par.
Proces suprotan formiranju kovalentne veze mehanizmom razmjene je prekid veze, u kojem jedan elektron () ide na svaki atom. Kao rezultat, formiraju se dvije nenabijene čestice s nesparenim elektronima:
![]()
Takve čestice se nazivaju slobodni radikali.
slobodni radikali- atomi ili grupe atoma koji imaju nesparene elektrone.
Reakcije slobodnih radikala su reakcije koje nastaju pod dejstvom i uz učešće slobodnih radikala.
U toku neorganske hemije to su reakcije interakcije vodonika sa kiseonikom, halogeni, reakcije sagorevanja. Reakcije ovog tipa karakteriziraju velika brzina, oslobađanje velike količine topline.
Kovalentna veza može se formirati i mehanizmom donor-akceptor. Jedna od orbitala atoma (ili aniona), koja sadrži nepodijeljeni elektronski par, preklapa se s nepopunjenom orbitalom drugog atoma (ili kationa) koja ima neispunjenu orbitalu i formira se kovalentna veza, na primjer:
![]()
Prekid kovalentne veze dovodi do stvaranja pozitivno i negativno nabijenih čestica (); budući da u ovom slučaju oba elektrona iz zajedničkog elektronskog para ostaju s jednim od atoma, drugi atom ima neispunjenu orbitalu:
![]()
Razmotrimo elektrolitičku disocijaciju kiselina:
![]()
Lako se može pretpostaviti da će čestica koja ima nepodijeljeni elektronski par R: -, tj. negativno nabijeni ion, biti privučena pozitivno nabijenim atomima ili atomima na kojima postoji barem djelomični ili efektivni pozitivni naboj.
Zovu se čestice s nepodijeljenim elektronskim parovima nukleofilnih agenasa (jezgro- "nukleus", pozitivno nabijeni dio atoma), odnosno "prijatelji" jezgra, pozitivno naelektrisanje.
Nukleofili(Nu) - anjoni ili molekuli koji imaju usamljeni par elektrona, u interakciji sa regionima molekula, na kojima je koncentrisano efektivno pozitivno naelektrisanje.
Primeri nukleofila: Cl - (hloridni jon), OH - (hidroksid anjon), CH 3 O - (metoksid anjon), CH 3 COO - (acetatni anjon).
Čestice koje imaju neispunjenu orbitalu, naprotiv, težiće da je popune i stoga će biti privučene oblastima molekula koje imaju povećanu gustoću elektrona, negativan naboj i nepodeljeni elektronski par. Oni su elektrofili, "prijatelji" elektrona, negativnog naboja ili čestice sa povećanom gustinom elektrona.
elektrofili- kationi ili molekuli koji imaju nepopunjenu elektronsku orbitalu, težeći da je popune elektronima, jer to dovodi do povoljnije elektronske konfiguracije atoma.
Nije svaka čestica elektrofil sa praznom orbitalom. Tako, na primjer, katjoni alkalnih metala imaju konfiguraciju inertnih plinova i nemaju tendenciju da stječu elektrone, jer imaju nisku afinitet prema elektronu.
Iz ovoga možemo zaključiti da unatoč prisutnosti neispunjene orbitale, takve čestice neće biti elektrofili.
Glavni mehanizmi reakcije
Postoje tri glavna tipa reagujućih čestica - slobodni radikali, elektrofili, nukleofili - i tri odgovarajuća tipa reakcionih mehanizama:
- slobodni radikali;
- elektrofilni;
- nulofilni.
Pored klasifikacije reakcija prema vrsti reagujućih čestica, organska hemija razlikuje četiri tipa reakcija prema principu promene sastava molekula: adicija, supstitucija, eliminacija ili eliminacija (od engl. to eliminisati- izbrisati, odvojiti) i pregrupisati. Budući da se adicija i supstitucija mogu dogoditi pod djelovanjem sve tri vrste reaktivnih vrsta, nekoliko majorreakcionih mehanizama.


Uz to, razmotrite reakcije cijepanja ili eliminacije koje se odvijaju pod utjecajem nukleofilnih čestica - baza.
6. eliminacija:
Posebnost alkena (nezasićenih ugljikovodika) je sposobnost ulaska u reakcije adicije. Većina ovih reakcija odvija se mehanizmom elektrofilnog dodavanja.
Hidrohalogenacija (dodatak halogena vodonik):
Kada se alkenu doda halogen vodonik vodonik se dodaje u više hidrogenizovane atom ugljika, odnosno atom kod kojeg ima više atoma vodonik, a halogen - na manje hidrogenizovan.
Hemijska svojstva alkana
Alkani (parafini) su neciklični ugljikovodici, u čijim su molekulima svi atomi ugljika povezani samo jednostrukim vezama. Drugim riječima, u molekulima alkana nema višestrukih, dvostrukih ili trostrukih veza. Zapravo, alkani su ugljikovodici koji sadrže najveći mogući broj atoma vodika, pa se stoga nazivaju ograničavajućim (zasićenim).
Zbog zasićenja, alkani ne mogu stupiti u reakcije adicije.
Budući da atomi ugljika i vodika imaju prilično blisku elektronegativnost, to dovodi do činjenice da su CH veze u njihovim molekulima izuzetno niskog polariteta. S tim u vezi, za alkane su karakterističnije reakcije koje se odvijaju po mehanizmu supstitucije radikala, označene simbolom S R.
1. Reakcije supstitucije
U reakcijama ovog tipa dolazi do prekida veze ugljik-vodik.
RH + XY → RX + HY
Halogenacija
Alkani reagiraju s halogenima (hlorom i bromom) pod djelovanjem ultraljubičastog svjetla ili jakom toplinom. U ovom slučaju nastaje mješavina halogenih derivata s različitim stupnjevima supstitucije atoma vodika - mono-, di-tri- itd. halogen-supstituisani alkani.
Na primjeru metana to izgleda ovako:
Promjenom omjera halogen/metan u reakcionoj smjesi, moguće je osigurati da bilo koji određeni derivat halogena metana prevladava u sastavu proizvoda.
mehanizam reakcije
Analizirajmo mehanizam reakcije supstitucije slobodnih radikala na primjeru interakcije metana i hlora. Sastoji se od tri faze:
- inicijacija (ili lančana inicijacija) - proces stvaranja slobodnih radikala pod dejstvom energije izvana - zračenjem UV svetlom ili zagrevanjem. U ovoj fazi, molekula hlora prolazi kroz homolitičko cepanje Cl-Cl veze sa stvaranjem slobodnih radikala:
Slobodni radikali, kao što se može vidjeti sa gornje slike, nazivaju se atomi ili grupe atoma sa jednim ili više nesparenih elektrona (Cl, H, CH 3 , CH 2, itd.);
2. Razvoj lanca
Ova faza se sastoji u interakciji aktivnih slobodnih radikala sa neaktivnim molekulima. U tom slučaju nastaju novi radikali. Konkretno, kada radikali hlora djeluju na molekule alkana, nastaju alkil radikal i klorovodik. Zauzvrat, alkil radikal, sudarajući se s molekulama hlora, formira derivat hlora i novi radikal hlora:
3) Prekid (smrt) lanca:
Nastaje kao rezultat rekombinacije dva radikala jedan s drugim u neaktivne molekule:
2. Reakcije oksidacije
U normalnim uslovima, alkani su inertni u odnosu na jaka oksidaciona sredstva kao što su koncentrisana sumporna i azotna kiselina, permanganat i kalijum dihromat (KMnO 4, K 2 Cr 2 O 7).
Sagorevanje u kiseoniku
A) potpuno sagorevanje sa viškom kiseonika. Dovodi do stvaranja ugljičnog dioksida i vode:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
B) nepotpuno sagorevanje uz nedostatak kiseonika:
2CH 4 + 3O 2 \u003d 2CO + 4H 2 O
CH 4 + O 2 \u003d C + 2H 2 O
Katalitička oksidacija kisikom
Kao rezultat zagrijavanja alkana kisikom (~200 o C) u prisustvu katalizatora, iz njih se može dobiti širok spektar organskih proizvoda: aldehidi, ketoni, alkoholi, karboksilne kiseline.
Na primjer, metan, ovisno o prirodi katalizatora, može se oksidirati u metil alkohol, formaldehid ili mravlju kiselinu:
3. Termičke transformacije alkana
Pucanje
Cracking (od engleskog to crack - trgati) je kemijski proces koji se odvija na visokoj temperaturi, uslijed čega se ugljični kostur molekula alkana lomi formiranjem alkena i molekula alkana niže molekularne težine u odnosu na originalne alkane. Na primjer:
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH 2 -CH 2 -CH 3 + CH 3 -CH \u003d CH 2
Krekiranje može biti termičko ili katalitičko. Za izvođenje katalitičkog krekinga, zbog upotrebe katalizatora, koriste se znatno niže temperature u odnosu na termički kreking.
Dehidrogenacija
Eliminacija vodonika nastaje kao rezultat prekida C-H veza; izvode se u prisustvu katalizatora na povišenim temperaturama. Dehidrogenacijom metana nastaje acetilen:
2CH 4 → C 2 H 2 + 3H 2
Zagrijavanje metana na 1200 ° C dovodi do njegovog razlaganja na jednostavne tvari:
CH 4 → C + 2H 2
Dehidrogenacija drugih alkana daje alkene:
C 2 H 6 → C 2 H 4 + H 2
Prilikom dehidrogeniranja n-nastaju butan, buten-1 i buten-2 (potonji u obliku cis- i trans-izomeri):
Dehidrociklizacija
Izomerizacija
Hemijska svojstva cikloalkana
Hemijska svojstva cikloalkana s više od četiri atoma ugljika u ciklusima općenito su gotovo identična onima alkana. Za ciklopropan i ciklobutan, začudo, karakteristične su reakcije adicije. To je zbog visoke napetosti unutar ciklusa, što dovodi do činjenice da ovi ciklusi imaju tendenciju prekida. Tako ciklopropan i ciklobutan lako dodaju brom, vodonik ili klorovodik:
Hemijska svojstva alkena
1. Reakcije sabiranja
Budući da se dvostruka veza u molekulima alkena sastoji od jedne jake sigma veze i jedne slabe pi veze, oni su prilično aktivni spojevi koji lako ulaze u reakcije adicije. Alkeni često ulaze u takve reakcije čak i pod blagim uslovima - na hladnom, u vodenim rastvorima i organskim rastvaračima.
Hidrogenacija alkena
Alkeni su u stanju da dodaju vodonik u prisustvu katalizatora (platina, paladijum, nikl):
CH 3 -CH \u003d CH 2 + H 2 → CH 3 -CH 2 -CH 3
Hidrogenacija alkena se odvija lako čak i pri normalnom pritisku i blagom zagrijavanju. Zanimljiva činjenica je da se isti katalizatori mogu koristiti za dehidrogenaciju alkana u alkene, samo što se proces dehidrogenacije odvija na višoj temperaturi i nižem pritisku.
Halogenacija
Alkeni lako ulaze u reakciju adicije sa bromom i u vodenom rastvoru i u organskim rastvaračima. Kao rezultat interakcije, u početku žute otopine broma gube boju, tj. obezbojiti.
CH 2 \u003d CH 2 + Br 2 → CH 2 Br-CH 2 Br
Hidrohalogenacija
Lako je vidjeti da bi dodavanje halogenvodika nesimetričnoj molekuli alkena trebalo teoretski dovesti do mješavine dva izomera. Na primjer, kada se bromovodonik doda propenu, trebali bi se dobiti sljedeći proizvodi:
Ipak, u nedostatku specifičnih uvjeta (na primjer, prisutnost peroksida u reakcionoj smjesi), dodavanje molekule halogen vodika će se dogoditi striktno selektivno u skladu s pravilom Markovnikov:
Dodavanje halogenovodonika alkenu se događa na način da je vodik vezan za atom ugljika s velikim brojem atoma vodika (više hidrogeniziran), a halogen je vezan za atom ugljika s manjim brojem atoma vodika. (manje hidrogenizovano).
Hidratacija
Ova reakcija dovodi do stvaranja alkohola, a također se odvija u skladu s Markovnikovovim pravilom:
Kao što možete pretpostaviti, zbog činjenice da se dodavanje vode molekuli alkena odvija prema Markovnikovom pravilu, stvaranje primarnog alkohola moguće je samo u slučaju hidratacije etilena:
CH 2 \u003d CH 2 + H 2 O → CH 3 -CH 2 -OH
Ovom reakcijom se glavna količina etilnog alkohola provodi u industriji velikih kapaciteta.
Polimerizacija
Specifičan slučaj reakcije adicije je reakcija polimerizacije koja se, za razliku od halogenacije, hidrohalogenacije i hidratacije, odvija mehanizmom slobodnih radikala:
Reakcije oksidacije
Kao i svi drugi ugljikovodici, alkeni lako sagorevaju u kisiku i stvaraju ugljični dioksid i vodu. Jednačina za sagorijevanje alkena u višku kisika ima oblik:
C n H 2n + (3/2)nO 2 → nCO 2 + nH 2 O
Za razliku od alkana, alkeni se lako oksidiraju. Pod djelovanjem vodenog rastvora KMnO 4 na alkene dolazi do promjene boje, što je kvalitativna reakcija na dvostruke i trostruke CC veze u molekulima organskih tvari.
Oksidacija alkena kalijum permanganatom u neutralnoj ili blago alkalnoj otopini dovodi do stvaranja diola (dihidričnih alkohola):
C 2 H 4 + 2KMnO 4 + 2H 2 O → CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH (hlađenje)
U kiseloj sredini dolazi do potpunog cijepanja dvostruke veze s transformacijom atoma ugljika koji su formirali dvostruku vezu u karboksilne grupe:
5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (zagrijavanje)
Ako je dvostruka C=C veza na kraju molekule alkena, tada nastaje ugljični dioksid kao produkt oksidacije ekstremnog atoma ugljika na dvostrukoj vezi. To je zbog činjenice da se međuprodukt oksidacije, mravlja kiselina, lako oksidira sam po sebi u višku oksidacijskog sredstva:
5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O (grijanje)
Prilikom oksidacije alkena, u kojoj C atom na dvostrukoj vezi sadrži dva ugljikovodična supstituenta, nastaje keton. Na primjer, oksidacija 2-metilbutena-2 proizvodi aceton i octenu kiselinu.
Oksidacija alkena, koja razbija ugljični kostur na dvostrukoj vezi, koristi se za uspostavljanje njihove strukture.
Hemijska svojstva alkadiena
Reakcije sabiranja
Na primjer, dodavanje halogena:
Bromna voda postaje bezbojna.
U normalnim uslovima, dodavanje atoma halogena se dešava na krajevima molekula butadiena-1,3, dok se π veze prekidaju, atomi broma su vezani za ekstremne atome ugljenika, a slobodne valencije formiraju novu π vezu. Dakle, kao da dolazi do "kretanja" dvostruke veze. Uz višak broma, može se dodati još jedan molekul broma na mjesto formirane dvostruke veze.
reakcije polimerizacije
Hemijska svojstva alkina
Alkini su nezasićeni (nezasićeni) ugljovodonici i stoga su sposobni da uđu u reakcije adicije. Među reakcijama adicije za alkine, elektrofilna adicija je najčešća.
Halogenacija
Budući da se trostruka veza alkinskih molekula sastoji od jedne jače sigma veze i dvije slabije pi veze, oni su u stanju da vežu jedan ili dva molekula halogena. Dodavanje dva molekula halogena jednoj molekuli alkina odvija se elektrofilnim mehanizmom uzastopno u dva stupnja:
Hidrohalogenacija
Dodavanje molekula halogenovodonika također se odvija elektrofilnim mehanizmom i to u dvije faze. U obje faze, sabiranje se odvija u skladu s pravilom Markovnikova:
Hidratacija
Dodavanje vode alkinima događa se u prisustvu soli rutijuma u kiseloj sredini i naziva se reakcija Kučerova.
Kao rezultat hidratacije dodavanjem vode acetilenu, nastaje acetaldehid (octeni aldehid):
Za homologe acetilena, dodavanje vode dovodi do stvaranja ketona:
Hidrogenacija alkina
Alkini reaguju sa vodonikom u dva koraka. Metali poput platine, paladijuma, nikla koriste se kao katalizatori:
Alkinska trimerizacija
Kada se acetilen prebacuje preko aktivnog ugljena na visokoj temperaturi, iz njega nastaje mješavina raznih proizvoda, od kojih je glavni benzen, produkt trimerizacije acetilena:
Dimerizacija alkina
Acetilen također ulazi u reakciju dimerizacije. Proces se odvija u prisustvu soli bakra kao katalizatora:
Alkinska oksidacija
Alkini sagorevaju u kiseoniku:
C n H 2n-2 + (3n-1) / 2 O 2 → nCO 2 + (n-1) H 2 O
Interakcija alkina sa bazama
Alkini sa trostrukim C≡C na kraju molekula, za razliku od drugih alkina, mogu da uđu u reakcije u kojima se atom vodonika u trostrukoj vezi zamenjuje metalom. Na primjer, acetilen reagira s natrijevim amidom u tekućem amonijaku:
HC≡CH + 2NaNH 2 → NaC≡CNa + 2NH 3,
a također i s otopinom srebrnog oksida amonijaka, tvoreći nerastvorljive tvari slične solima zvane acetilenidi:
Zahvaljujući ovoj reakciji moguće je prepoznati alkine sa terminalnom trostrukom vezom, kao i izolovati takav alkin iz mješavine s drugim alkinima.
Treba napomenuti da su svi acetilenidi srebra i bakra eksplozivne tvari.
Acetilidi mogu reagirati s halogenim derivatima, što se koristi u sintezi složenijih organskih spojeva s trostrukom vezom:
CH 3 -C≡CH + NaNH 2 → CH 3 -C≡CNa + NH 3
CH 3 -C≡CNa + CH 3 Br → CH 3 -C≡C-CH 3 + NaBr
Hemijska svojstva aromatičnih ugljovodonika
Aromatična priroda veze utiče na hemijska svojstva benzena i drugih aromatičnih ugljovodonika.
Jedan 6pi elektronski sistem je mnogo stabilniji od konvencionalnih pi veza. Stoga su za aromatične ugljovodonike reakcije supstitucije karakterističnije od reakcija adicije. Areni ulaze u reakcije supstitucije elektrofilnim mehanizmom.
Reakcije supstitucije
Halogenacija
Nitracija
Reakcija nitriranja najbolje se odvija pod djelovanjem ne čiste dušične kiseline, već njene mješavine s koncentriranom sumpornom kiselinom, tzv. nitrirajuće smjese:
Alkilacija
Reakcija u kojoj je jedan od atoma vodika u aromatičnom jezgru zamijenjen ugljikovodičnim radikalom:
Alkeni se također mogu koristiti umjesto halogeniranih alkana. Kao katalizatori mogu se koristiti aluminijski halogenidi, feri željezo-halogenidi ili neorganske kiseline.<
Reakcije sabiranja
hidrogenacija
Pristupanje hlora
Nastaje radikalnim mehanizmom pod intenzivnim zračenjem ultraljubičastim svjetlom:
Slično, reakcija se može odvijati samo s hlorom.
Reakcije oksidacije
Sagorijevanje
2C 6 H 6 + 15O 2 \u003d 12CO 2 + 6H 2 O + Q
nepotpuna oksidacija
Benzinski prsten je otporan na oksidirajuća sredstva kao što su KMnO 4 i K 2 Cr 2 O 7 . Reakcija ne ide.
Podjela supstituenata u benzenskom prstenu na dva tipa:
Razmotrite hemijska svojstva homologa benzena koristeći toluen kao primjer.
Hemijska svojstva toluena
Halogenacija
Može se smatrati da se molekul toluena sastoji od fragmenata molekula benzena i metana. Stoga je logično pretpostaviti da bi hemijska svojstva toluena u određenoj mjeri trebala kombinovati hemijska svojstva ove dvije supstance odvojene. Konkretno, to je upravo ono što se uočava prilikom njegovog halogeniranja. Već znamo da benzen ulazi u reakciju supstitucije s hlorom elektrofilnim mehanizmom, a za izvođenje ove reakcije moraju se koristiti katalizatori (aluminij ili feri željezo halidi). U isto vrijeme, metan također može reagirati sa hlorom, ali mehanizmom slobodnih radikala, što zahtijeva zračenje početne reakcione smjese UV svjetlom. Toluen, u zavisnosti od uslova pod kojima se podvrgava hlorisanju, može dati ili supstitucijske proizvode atoma vodika u benzenskom prstenu - za to morate koristiti iste uslove kao kod hlorisanja benzena, ili supstitucijske proizvode atoma vodika u metilni radikal, ako je na njemu, kako djelovati na metan s hlorom kada je ozračen ultraljubičastim svjetlom:
Kao što možete vidjeti, hloriranje toluena u prisustvu aluminij hlorida dovelo je do dva različita proizvoda - orto- i para-klorotoluena. To je zbog činjenice da je metilni radikal supstituent prve vrste.
Ako se kloriranje toluena u prisustvu AlCl 3 provodi u višku klora, moguće je stvaranje toluena supstituiranog triklorom:
Slično, kada se toluen klorira na svjetlu pri većem omjeru hlor/toluen, može se dobiti diklorometilbenzen ili triklorometilbenzen:
Nitracija
Zamjena atoma vodika za azotnu grupu, tokom nitriranja toluena mješavinom koncentrisane dušične i sumporne kiseline, dovodi do supstitucijskih proizvoda u aromatičnom jezgru, a ne u metil radikalu:
Alkilacija
Kao što je već spomenuto, metilni radikal je orijentant prve vrste, stoga njegova Friedel-Craftsova alkilacija dovodi do supstitucijskih proizvoda u orto i para pozicijama:
Reakcije sabiranja
Toluen se može hidrogenirati u metilcikloheksan pomoću metalnih katalizatora (Pt, Pd, Ni):
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
nepotpuna oksidacija
Pod djelovanjem takvog oksidacijskog sredstva kao što je vodena otopina kalijevog permanganata, bočni lanac prolazi kroz oksidaciju. Aromatično jezgro se ne može oksidirati u takvim uslovima. U tom slučaju, ovisno o pH otopine, formirat će se ili karboksilna kiselina ili njena sol.
; u ovom slučaju se prekida jedna p-veza i formiraju se jedna ili dvije s-veze. Za označavanje veze reakcije koristite simbol Ad (od engleskog add - spajanje); za p-cije cikloadicije, takav simbol se ne koristi.
zavisno od prirode supstrat razlikovati veze reakcije na izolovanom ili spregnutom višestruke obveznice, na primjer: C=C, C=C, C=C-C=C, C=O, C=N, C=N. Razlikovati p-tion homolitičke. (Ad R) i heterolitički. pristupanja. Ovo poslednje zavisi od optužbe napadača reagens podijeljen na r-tion elektrof. (Ad E) i nukleof. (AdN)dodaci. Ponašanje reagens zavisi od vrste supstrat i uslove za obavljanje distribucije (distribucija, prisustvo katalizator, efekat UV zračenja itd.). Mn. reagensi u različitim uslovima može pokazati različite. vrste reakcija. sposobnosti, npr. halogeni može djelovati kao radikal, elektrof. pa čak i nukleof. agenti.
Naib. akcesije proučavane reakcije on višestruke obveznice ugljenik-ugljik. Ovi procesi se odvijaju prema postupnom (etapnom) ili sinhronom (koordiniranom) mehanizmu. Sa stepenastim mehanizmom, prva faza je napad nukleofila, elektrofila ili slobodnog. radikalno, drugo - rekombinacija rezultirajući srednji pozitivno, negativno ili neutralna čestica, na primjer:
Electrof. ili nukleof. čestice ne moraju biti joni; mogu predstavljati dio (grupu) koji povlači ili donira elektrone molekule. R-cije Ad N su moguće samo sa C=C vezama aktiviranim supstituentima koji povlače elektrone; implementacija Ad E zahtijeva ili nesupstituirane C=C veze ili one aktivirane supstituentima koji doniraju elektrone. Za p-ciju Ad R, priroda supstituenta u C=C vezi nije mnogo bitna.
Stereochem. rezultat koraka dodavanja zavisi od mehanizma p-cije i prirode jedinjenja koja reaguju. Da, elektro. pridruživanje olefini može nastaviti kao sin-vezi-čestice Y i W napad molekula na jednoj strani aviona dvostruka veza ili kao anti-vezivanje - čestice napadaju sa različitih strana aviona; u nekim slučajevima, distrikti idu nestereospecifično. Nucleof. spajanje sa karbanioni teče, po pravilu, nestereospecifično. Prilikom pridruživanja reakcije on trostruke veze sin adicija dovodi do cis izomera, anti adicija dovodi do trans izomera.
U slučaju sinhronog mehanizma, napad na oba atom C se izvodi istovremeno i p-cija se nastavlja kao dipolarna adicija (vidi Cycloaddition), dok adicija reakcije dvostrukim ili trostruka veza ići kao sin-vezanost (vidi, npr. Reppe reakcije).
P veze reakcije po konjugatu dvostruke veze, teče kroz stepenasti mehanizam, dovode do stvaranja 1,2- i 1,4-adicionih proizvoda:
Sinhrona 1,4 veza na dienes staza teče. način:

Posebna vrsta adicionih reakcija je konjugirana adicija. Protok takvih p-cija je praćen vezivanjem p-otapala (ili posebno dodanog reagens) u završnoj fazi procesa. Na primjer, konjugirani elektrof. pristupanje halogeni to alkeni u CH 3 COOH vodi, zajedno sa 1,2-dihalidima, do b-acetoksialkil halida:
Primjeri konjugiranih nukleofa. pristupanje - Michael reakcija i interakcija. aktiviran alkeni sa cijanid anionom u protonskim p-otapalima SH:

U slučaju pridruživanja reakcije on višestruke obveznice ugljen-hetero-atom, u koji se stavlja. naplata je lokalizovana atom C (veze C=O, C=N, C=N i C=S), nukleofili se uvijek vezuju za atom C, a elektrofili u heteroatom. In naib. stepen proučavanih nukleofilnih adicija reakcije za karbonilnu grupu:

P veze reakcija on atom C može biti jedna od faza p-cije supstitucije u aromatičnoj. redom, na primjer: