ردود الفعل المرفقة. أنواع التفاعلات الكيميائية في الكيمياء العضوية. قسم البدائل في حلقة البنزين إلى نوعين
) روابط مركب كيميائي آخر. يمكن إجراء الانضمام كاتصال الكربون الكربون، وعن طريق الاتصال ذرة الكربون غير المتجانسة. يتم الإشارة إلى تفاعلات الإضافة بأحرف إنجليزية "ميلادي".
منظر عام لتفاعلات الإضافة بالسندات الكربون الكربون:
منظر عام لتفاعلات الإضافة بالسندات أكسجين الكربون:
عادة ما يسمى الكاشف الذي تحدث الإضافة المادة المتفاعلة، والآخر ( "X-Y") - كاشف الهجوم.
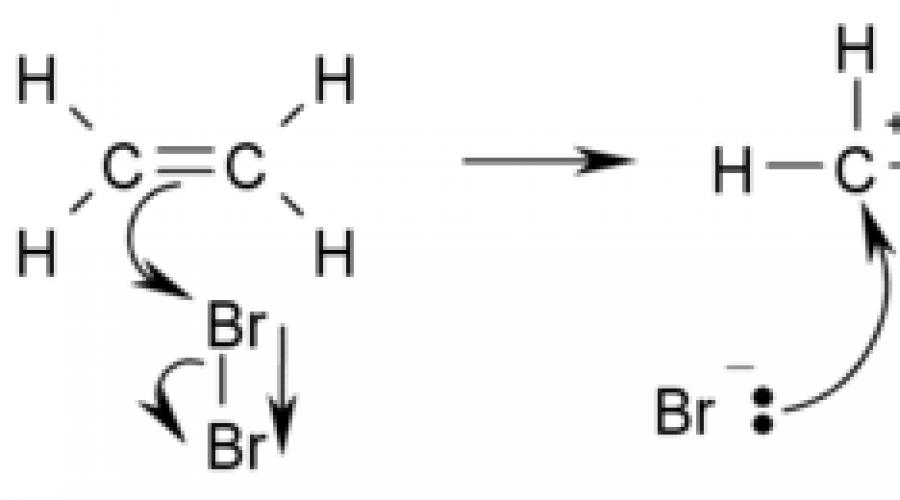
مثال على تفاعل إضافة هو معالجة الإيثيلين بالبروم:

غالبًا ما تكون تفاعلات الإضافة قابلة للعكس ، حيث تقترن بتفاعلات الإزالة ، لذلك يجب أن يوضع في الاعتبار أن آلية تفاعل الإزالة "المزدوجة" هذه شائعة.
اعتمادًا على طبيعة الجسيم المهاجم وآلية التفاعل ، يتم التمييز بين الإضافة المحبة للنووية أو المحبة للكهرباء أو الجذرية أو المتزامنة.
تفاعلات الإضافة النووية
في تفاعلات الإضافة nucleophilic ، يكون الجسيم المهاجم هو nucleophile ، أي جسيم سالب الشحنة أو جسيم به زوج إلكترون حر.
نظرة عامة على تفاعلات الإضافة nucleophilic:
يشار إلى تفاعلات الإضافة المحبة للنووية "AdN".
تفاعلات الإضافة المحبة للنيوكليوفيليا في السندات ج = جنادرة جدًا ، القيمة الأكثر انتشارًا وعملية هي الاتصال عن طريق الاتصال ج = س :
من بين تفاعلات الإضافة المحبة للنواة ، الأكثر شيوعًا هي الآلية ثنائية الجزيئات المذكورة أعلاه ذات المرحلتين الإعلان ن 2: في البداية ، يضيف النوكليوفيل ببطء في رابطة متعددة لتشكيل كربانيون ، والذي في الخطوة الثانية يتم مهاجمته بسرعة من قبل الأنواع المحبة للكهرباء.
تفاعلات الإضافة الكهربية
في تفاعلات الإضافة الكهربية ، يكون الجسيم المهاجم اليكتروفيل، أي جسيم موجب الشحنة ، وغالبًا ما يكون بروتونًا ح +، أو الجسيم الذي يعاني من نقص الإلكترون.
منظر عام لتفاعلات الإضافة الكهربية:
يشار إلى تفاعلات الإضافة الكهربية "إعلان هـ".
تنتشر تفاعلات الإضافة المحبة للكهرباء على نطاق واسع بين تفاعلات الهيدروكربونات غير المشبعة: الألكينات والألكينات والدينات.
مثال على هذه التفاعلات هو ترطيب الألكينات:
الرابطة الكهربية ذرة الكربون غير المتجانسةهو أيضًا شائع جدًا ، وغالبًا ما يكون هذا الاتصال ج = س:



من بين تفاعلات الإضافة الكهربية ، الأكثر شيوعًا هي الآلية ثنائية الجزيئات المذكورة أعلاه ذات المرحلتين الإعلان هـ 2: في البداية ، يضيف المحمل الكهربائي ببطء في رابطة متعددة لتشكيل carbocation ، والذي يخضع لهجوم محب للنيوكليوفيلي في الخطوة الثانية.
تفاعلات الإضافة الجذرية
في تفاعلات الإضافة الجذرية ، الجذور الحرة هي الأنواع المهاجمة.
يشار إلى تفاعلات الإضافة الجذرية "Ad R".
عادةً ما تستمر تفاعلات الإضافة الجذرية بدلاً من تفاعلات الإضافة الكهربية في وجود مصدر للجذور الحرة:

تفاعلات إضافة متزامنة
في بعض الحالات ، تحدث الإضافة بواسطة رابطة متعددة مع الهجوم المتزامن لكلتا الذرتين ، مما لا يسمح لأحد بتحديد أولوية الهجوم. تسمى هذه الآلية اتصال متزامن. تؤدي تفاعلات الإضافة المتزامنة إلى تكوين منتجات دورية ، لذلك غالبًا ما يتم استدعاؤها اضافة حلقية.
ملحوظات
| التفاعلات الكيميائية في الكيمياء العضوية | |
|---|---|
| تفاعلات الاستبدال | تفاعلات الاستبدال المحبة للنواة تفاعلات الاستبدال المحبة للكهرباء تفاعلات الاستبدال الجذري |
| تفاعلات الإضافة | تفاعلات الإضافة المحبة للنووية تفاعلات الإضافة الكهربية تفاعلات الإضافة الجذرية تفاعلات الإضافة المتزامنة |
| ردود فعل القضاء | تفاعلات الإزالة غير المتجانسة تفاعلات الإزالة الحلقية تفاعلات الإزالة الجذرية |
| ردود فعل إعادة الترتيب | إعادة ترتيب محبة النواة إعادة ترتيب محبة للكهرباء إعادة ترتيب جذرية |
| تفاعلات الأكسدة والاختزال | تفاعلات الأكسدة تفاعلات الاختزال |
| آخر | التفاعلات الاسمية في الكيمياء العضوية |
مؤسسة ويكيميديا. 2010.
شاهد ما هي "تفاعلات الإضافة" في القواميس الأخرى:
إضافة بوليمر تفاعل- - إضافة بوليمر EN: بوليمر يتكون من الإضافة المتسلسلة لجزيئات المونومر غير المشبعة ، مثل الأوليفينات ، مع بعضها البعض دون تكوين منتج ثانوي ، مثل الماء ؛ ... ... دليل المترجم الفني
- تفاعلات إضافة (تفاعل إلكتروفيلي إنجليزي) ، حيث يتم تنفيذ الهجوم في المرحلة الأولية بواسطة جسيم كهربائي ، موجب الشحنة أو به عجز في الإلكترونات. في المرحلة النهائية ، الناتج ...... ويكيبيديا
- تفاعلات الإضافة (تفاعل محب للنيوكليوفيلي بالإنجليزية) يتم فيها الهجوم في المرحلة الأولية بواسطة جسيم محب للنيوكليوفيل ، سالب الشحنة أو له زوج إلكترون حر. في المرحلة النهائية ، الناتج ...... ويكيبيديا
- (تفاعل جذري هندسة إضافة) تفاعلات إضافة يتم فيها الهجوم بواسطة الجذور الحرة لجسيم يحتوي على واحد أو أكثر من الإلكترونات غير المزدوجة. في الوقت نفسه ، يمكن للراديكاليين مهاجمة كل من الراديكاليين الآخرين و ... ويكيبيديا
تفاعلات الإضافة التي يتم فيها مهاجمة ذرتين من رابطة متعددة في وقت واحد. الاسم الآخر للتفاعلات من هذا النوع هو تفاعلات التحميل الدوري ، لأن المنتجات النهائية لمثل هذه التفاعلات هي ركائز دورية. هناك نوعان ... ... ويكيبيديا
- تفاعلات الاستبدال (تفاعل الاستبدال الإنجليزي المحب للنووية) التي يتم فيها الهجوم بواسطة كاشف نيوكليوفيل يحمل زوج إلكترون غير مشترك. تسمى المجموعة الخارجة في تفاعلات الاستبدال النووي المحبة للنواة nucleofug. الكل ... ويكيبيديا
يمكن تقسيم تفاعلات المواد العضوية رسميًا إلى أربعة أنواع رئيسية: الاستبدال والإضافة والحذف (الحذف) وإعادة الترتيب (الأزمرة). من الواضح أن المجموعة الكاملة من تفاعلات المركبات العضوية لا يمكن اختزالها إلى التصنيف المقترح (على سبيل المثال ، تفاعلات الاحتراق). ومع ذلك ، فإن مثل هذا التصنيف سيساعد في إنشاء تشابهات مع التفاعلات المألوفة لك بالفعل والتي تحدث بين المواد غير العضوية.
كقاعدة عامة ، يسمى المركب العضوي الرئيسي المتضمن في التفاعل المادة المتفاعلة، والمكون الآخر للتفاعل مشروط كاشف.
تفاعلات الاستبدال
تفاعلات الاستبدال- هذه هي التفاعلات التي تؤدي إلى استبدال ذرة واحدة أو مجموعة ذرات في الجزيء الأصلي (الركيزة) بذرات أو مجموعات ذرات أخرى.
تتضمن تفاعلات الاستبدال مركبات مشبعة وعطرية مثل الألكانات أو الألكانات الحلقية أو الأرينات. دعونا نعطي أمثلة على ردود الفعل هذه.
تحت تأثير الضوء ، يمكن استبدال ذرات الهيدروجين في جزيء الميثان بذرات الهالوجين ، على سبيل المثال ، بواسطة ذرات الكلور:
مثال آخر على استبدال الهيدروجين بالهالوجين هو تحويل البنزين إلى بروموبنزين:

يمكن كتابة معادلة هذا التفاعل بشكل مختلف:
![]()
باستخدام هذا الشكل من التسجيل ، تتم كتابة الكواشف ، والمحفز ، وظروف التفاعل فوق السهم ، ونواتج التفاعل غير العضوي تحته.
نتيجة لردود الفعل بدائل المواد العضوية ليست بسيطة ومعقدة المواد ، كما في الكيمياء غير العضوية ، واثنين مواد معقدة.
تفاعلات الإضافة
تفاعلات الإضافةهي التفاعلات التي يتحد فيها جزيئين أو أكثر من المواد المتفاعلة في جزيء واحد.
تدخل المركبات غير المشبعة ، مثل الألكينات أو الألكينات ، في تفاعلات إضافة. اعتمادًا على الجزيء الذي يعمل ككاشف ، يتم تمييز الهدرجة (أو الاختزال) ، والهالوجين ، والهيدروجين ، والماء ، وتفاعلات الإضافة الأخرى. كل واحد منهم يتطلب شروطا معينة.
1الهدرجة- تفاعل إضافة جزيء الهيدروجين إلى رابطة متعددة:
2. الهالوجين المائي- تفاعل إضافة هاليد الهيدروجين (هيدروكلورة):
3. الهلجنة- تفاعل إضافة الهالوجين:
![]()
4.البلمرة- نوع خاص من تفاعلات الإضافة ، يتم خلالها دمج جزيئات مادة ذات وزن جزيئي صغير مع بعضها البعض لتكوين جزيئات مادة ذات وزن جزيئي مرتفع جدًا - جزيئات كبيرة.
تفاعلات البلمرة هي عمليات الجمع بين العديد من جزيئات مادة منخفضة الوزن الجزيئي (مونومر) في جزيئات كبيرة (جزيئات كبيرة) من البوليمر.
مثال على تفاعل البلمرة هو إنتاج البولي إيثيلين من الإيثيلين (الإيثين) تحت تأثير الأشعة فوق البنفسجية وبادئ البلمرة الجذري R.
تتشكل الرابطة التساهمية الأكثر تميزًا للمركبات العضوية عندما تتداخل المدارات الذرية وتشكل أزواج إلكترونية مشتركة. نتيجة لذلك ، يتم تكوين مدار مشترك بين ذرتين ، حيث يوجد زوج إلكترون مشترك. عندما يتم كسر الرابطة ، يمكن أن يكون مصير هذه الإلكترونات الشائعة مختلفًا.
أنواع الجسيمات التفاعلية
يمكن أن يتداخل المدار الذي يحتوي على إلكترون غير مزدوج ينتمي إلى ذرة واحدة مع مدار ذرة أخرى تحتوي أيضًا على إلكترون غير مزدوج. في هذه الحالة ، يتم تكوين رابطة تساهمية وفقًا لآلية التبادل:
تتحقق آلية التبادل لتشكيل رابطة تساهمية إذا تم تكوين زوج إلكترون مشترك من إلكترونات غير مقترنة تنتمي إلى ذرات مختلفة.
العملية المعاكسة لتكوين رابطة تساهمية بواسطة آلية التبادل هي كسر الرابطة ، حيث يذهب إلكترون واحد () إلى كل ذرة. نتيجة لذلك ، يتكون جسيمان غير مشحون بإلكترونات غير متزاوجة:
![]()
تسمى هذه الجسيمات بالجذور الحرة.
الشوارد الحرة- ذرات أو مجموعات ذرات بها إلكترونات غير متزاوجة.
تفاعلات الجذور الحرةهي ردود الفعل التي تحدث أثناء العمل وبمشاركة الجذور الحرة.
في سياق الكيمياء غير العضوية ، هذه هي تفاعلات تفاعل الهيدروجين مع الأكسجين ، الهالوجينات ، تفاعلات الاحتراق. تتميز ردود الفعل من هذا النوع بالسرعة العالية ، وإطلاق كمية كبيرة من الحرارة.
يمكن أيضًا تكوين رابطة تساهمية بواسطة آلية متلقي المانح. يتداخل أحد مدارات الذرة (أو الأنيون) ، الذي يحتوي على زوج إلكترون غير مشترك ، مع مدار غير مملوء لذرة أخرى (أو كاتيون) لها مدار غير مملوء ، وتتشكل رابطة تساهمية ، على سبيل المثال:
![]()
يؤدي كسر الرابطة التساهمية إلى تكوين جسيمات موجبة وسالبة الشحنة () ؛ نظرًا لأنه في هذه الحالة يظل كلا الإلكترونين من زوج إلكترون مشترك مع إحدى الذرات ، فإن الذرة الأخرى لها مدار غير ممتلئ:
![]()
ضع في اعتبارك التفكك الإلكتروليتي للأحماض:
![]()
يمكن التخمين بسهولة أن الجسيم الذي يحتوي على زوج إلكترون غير مشترك R: - ، أي أيون سالب الشحنة ، سوف ينجذب إلى الذرات المشحونة إيجابياً أو إلى الذرات التي يوجد بها على الأقل شحنة موجبة جزئية أو فعالة.
تسمى الجسيمات التي تحتوي على أزواج إلكترونية غير مشتركة العوامل النووية (نواة- "النواة" ، الجزء الموجب الشحنة من الذرة) ، أي "أصدقاء" النواة ، شحنة موجبة.
نوكليوفيلز(نو) - الأنيونات أو الجزيئات التي لها زوج وحيد من الإلكترونات ، تتفاعل مع مناطق الجزيئات ، حيث تتركز الشحنة الإيجابية الفعالة.
أمثلة من nucleophiles: Cl - (أيون كلوريد) ، OH - (أنيون هيدروكسيد) ، CH 3 O - (أنيون ميثوكسيد) ، CH 3 COO - (أنيون أسيتات).
على العكس من ذلك ، ستميل الجسيمات التي لها مدار غير مملوء إلى ملئه ، وبالتالي ستنجذب إلى مناطق الجزيئات التي تحتوي على كثافة إلكترون متزايدة وشحنة سالبة وزوج إلكترون غير مشترك. وهي عبارة عن مركبات كهربائية ، "أصدقاء" للإلكترون ، أو شحنة سالبة ، أو جسيمات ذات كثافة إلكترون متزايدة.
اليكتروفيل- الكاتيونات أو الجزيئات التي لها مدار إلكترون غير مملوء ، تميل إلى ملئه بالإلكترونات ، لأن هذا يؤدي إلى تكوين إلكتروني أكثر ملاءمة للذرة.
ليس كل جسيم كهربي بمدار فارغ. لذلك ، على سبيل المثال ، تحتوي الكاتيونات الفلزية القلوية على تكوين غازات خاملة ولا تميل إلى اكتساب الإلكترونات ، نظرًا لأنها تحتوي على نسبة منخفضة الإلكترون تقارب.
من هذا يمكننا أن نستنتج أنه على الرغم من وجود مدار غير مملوء ، فإن هذه الجسيمات لن تكون عبارة عن مواد كهربائية.
آليات التفاعل الرئيسية
هناك ثلاثة أنواع رئيسية من الجسيمات المتفاعلة - الجذور الحرة ، والمركبات الكهربائية ، والنيوكليوفيلات - وثلاثة أنواع مماثلة من آليات التفاعل:
- الجذور الحرة؛
- محبة للكهرباء.
- محبة للشفاء.
بالإضافة إلى تصنيف التفاعلات وفقًا لنوع الجسيمات المتفاعلة ، تميز الكيمياء العضوية أربعة أنواع من التفاعلات وفقًا لمبدأ تغيير تكوين الجزيئات: الإضافة ، أو الاستبدال ، أو الحذف ، أو الحذف (من اللغة الإنجليزية. إلى القضاء- حذف وتقسيم) وإعادة التجميع. نظرًا لأن الإضافة والاستبدال يمكن أن تحدث تحت تأثير جميع الأنواع الثلاثة من الأنواع التفاعلية ، فهناك العديد منها رائدآليات التفاعل.


بالإضافة إلى ذلك ، ضع في اعتبارك تفاعلات الانقسام أو الإزالة التي تحدث تحت تأثير الجسيمات النووية - القواعد.
6. إزالة:
السمة المميزة للألكينات (الهيدروكربونات غير المشبعة) هي القدرة على الدخول في تفاعلات إضافة. تستمر معظم هذه التفاعلات بواسطة آلية الإضافة المحبة للكهرباء.
الهالوجين المائي (إضافة الهالوجين هيدروجين):
عندما يضاف هاليد الهيدروجين إلى ألكين يضاف الهيدروجين إلى المزيد من الهدرجة ذرة الكربون ، أي الذرة التي يوجد بها المزيد من الذرات الهيدروجين والهالوجين - إلى أقل مهدرجة.
الخواص الكيميائية للألكانات
الألكانات (البارافينات) عبارة عن هيدروكربونات غير حلقية ، في جزيئاتها جميع ذرات الكربون متصلة فقط بواسطة روابط مفردة. بمعنى آخر ، لا توجد روابط متعددة أو مزدوجة أو ثلاثية في جزيئات الألكانات. في الواقع ، الألكانات عبارة عن هيدروكربونات تحتوي على أكبر عدد ممكن من ذرات الهيدروجين ، وبالتالي فهي تسمى الحد (المشبعة).
بسبب التشبع ، لا يمكن للألكانات الدخول في تفاعلات إضافة.
نظرًا لأن ذرات الكربون والهيدروجين لها كهرسلبية قريبة إلى حد ما ، فإن هذا يؤدي إلى حقيقة أن روابط CH في جزيئاتها ذات قطبية منخفضة للغاية. في هذا الصدد ، بالنسبة للألكانات ، تكون التفاعلات التي تتم وفقًا لآلية الاستبدال الجذري ، والتي يُشار إليها بالرمز S R ، أكثر تميزًا.
1. ردود فعل الاستبدال
في تفاعلات من هذا النوع ، تنكسر روابط الكربون والهيدروجين.
RH + XY → RX + HY
الهلجنة
تتفاعل الألكانات مع الهالوجينات (الكلور والبروم) تحت تأثير الأشعة فوق البنفسجية أو مع الحرارة الشديدة. في هذه الحالة ، يتم تكوين خليط من مشتقات الهالوجين بدرجات مختلفة من استبدال ذرات الهيدروجين - أحادي ، ثنائي ثلاثي ، إلخ. الألكانات المستبدلة بالهالوجين.
في مثال الميثان ، يبدو كالتالي:
عن طريق تغيير نسبة الهالوجين / الميثان في خليط التفاعل ، من الممكن التأكد من أن أي مشتق معين من مشتق الهالوجين من الميثان يسود في تكوين المنتجات.
آلية التفاعل
دعونا نحلل آلية تفاعل استبدال الجذور الحرة باستخدام مثال تفاعل الميثان والكلور. وهو يتألف من ثلاث مراحل:
- بدء (أو بدء السلسلة) - عملية تكوين الجذور الحرة تحت تأثير الطاقة من الخارج - التشعيع بالأشعة فوق البنفسجية أو التسخين. في هذه المرحلة ، يخضع جزيء الكلور لانقسام متجانس لرابطة Cl-Cl مع تكوين الجذور الحرة:
الجذور الحرة ، كما يتضح من الشكل أعلاه ، تسمى الذرات أو مجموعات الذرات مع واحد أو أكثر من الإلكترونات غير المزدوجة (Cl ، H ، CH 3 ، CH 2 ، إلخ) ؛
2. تطوير السلسلة
تتكون هذه المرحلة من تفاعل الجذور الحرة النشطة مع الجزيئات غير النشطة. في هذه الحالة ، يتم تشكيل جذور جديدة. على وجه الخصوص ، عندما تعمل جذور الكلور على جزيئات الألكان ، يتم تكوين جذور ألكيل وكلوريد الهيدروجين. بدوره ، فإن جذور الألكيل ، التي تصطدم بجزيئات الكلور ، تشكل مشتق الكلور وجذر كلور جديد:
3) كسر (موت) السلسلة:
يحدث نتيجة إعادة اتحاد جذرين مع بعضهما البعض في جزيئات غير نشطة:
2. تفاعلات الأكسدة
في الظروف العادية ، تكون الألكانات خاملة فيما يتعلق بعوامل مؤكسدة قوية مثل أحماض الكبريتيك والنتريك المركزة والبرمنجنات وثاني كرومات البوتاسيوم (KMnO 4، K 2 Cr 2 O 7).
الاحتراق في الأكسجين
أ) الاحتراق الكامل مع وجود فائض من الأكسجين. يؤدي إلى تكوين ثاني أكسيد الكربون والماء:
CH 4 + 2O 2 \ u003d CO 2 + 2H 2 O
ب) الاحتراق غير الكامل مع نقص الأكسجين:
2CH 4 + 3O 2 \ u003d 2CO + 4H 2 O
CH 4 + O 2 \ u003d C + 2H 2 O
الأكسدة التحفيزية بالأكسجين
نتيجة لتسخين الألكانات بالأكسجين (~ 200 درجة مئوية) في وجود المحفزات ، يمكن الحصول على مجموعة متنوعة من المنتجات العضوية منها: الألدهيدات ، والكيتونات ، والكحوليات ، والأحماض الكربوكسيلية.
على سبيل المثال ، يمكن أن يتأكسد الميثان ، اعتمادًا على طبيعة العامل الحفاز ، إلى كحول الميثيل ، أو الفورمالديهايد ، أو حمض الفورميك:
3. التحولات الحرارية للألكانات
تكسير
التكسير (من اللغة الإنجليزية إلى الكراك - إلى التمزق) هو عملية كيميائية تحدث عند درجة حرارة عالية ، ونتيجة لذلك ينكسر الهيكل الكربوني لجزيئات الألكان مع تكوين جزيئات الألكان والألكان ذات الأوزان الجزيئية المنخفضة مقارنة بالألكانات الأصلية. فمثلا:
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH 2 -CH 2 -CH 3 + CH 3 -CH \ u003d CH 2
يمكن أن يكون التكسير حراريًا أو محفزًا. لتنفيذ التكسير التحفيزي ، بسبب استخدام المحفزات ، يتم استخدام درجات حرارة أقل بكثير مقارنة بالتكسير الحراري.
نزع الهيدروجين
يحدث التخلص من الهيدروجين نتيجة كسر روابط الكربون الهيدروجينية ؛ أجريت في وجود محفزات في درجات حرارة مرتفعة. ينتج عن نزع الهيدروجين من الميثان الأسيتيلين:
2CH 4 → C 2 H 2 + 3H 2
يؤدي تسخين الميثان إلى 1200 درجة مئوية إلى تحلله إلى مواد بسيطة:
CH 4 → C + 2H 2
يعطي نزع الهيدروجين عن الألكانات الأخرى الألكينات:
ج 2 س 6 ← ج 2 س 4 + ح 2
عند نزع الهيدروجين ن- يتم تكوين - البيوتين ، البيوتين - 1 والبيوتين - 2 (الأخير في الشكل رابطة الدول المستقلة-و نشوة-نظائر):
نزع الماء
الأزمرة
الخواص الكيميائية للألكانات الحلقية
تتطابق الخصائص الكيميائية للألكانات الحلقية التي تحتوي على أكثر من أربع ذرات كربون في الدورات عمومًا تقريبًا مع خصائص الألكانات. بالنسبة إلى السيكلوبروبان والسيكلوبوتان ، من الغريب أن تكون تفاعلات الإضافة مميزة. ويرجع ذلك إلى التوتر الشديد داخل الدورة ، مما يؤدي إلى حقيقة أن هذه الدورات تميل إلى الانكسار. لذا فإن السيكلوبروبان والسيكلوبوتان يضيفان البروم أو الهيدروجين أو كلوريد الهيدروجين بسهولة:
الخواص الكيميائية للألكينات
1. تفاعلات الإضافة
نظرًا لأن الرابطة المزدوجة في جزيئات الألكين تتكون من رابطة سيجما قوية واحدة ورابطة pi ضعيفة ، فهي مركبات نشطة تمامًا تدخل بسهولة في تفاعلات الإضافة. غالبًا ما تدخل الألكينات في مثل هذه التفاعلات حتى في ظل ظروف معتدلة - في البرد ، في المحاليل المائية والمذيبات العضوية.
هدرجة الألكينات
الألكينات قادرة على إضافة الهيدروجين في وجود المحفزات (البلاتين ، البلاديوم ، النيكل):
CH 3 -CH \ u003d CH 2 + H 2 → CH 3 -CH 2 -CH 3
تستمر هدرجة الألكينات بسهولة حتى عند الضغط العادي والتسخين الخفيف. حقيقة مثيرة للاهتمام هي أنه يمكن استخدام نفس المحفزات لنزع الهيدروجين من الألكانات إلى الألكينات ، فقط عملية نزع الهيدروجين تستمر عند درجة حرارة أعلى وضغط أقل.
الهلجنة
تدخل الألكينات بسهولة في تفاعل إضافة مع البروم في كل من محلول مائي وفي مذيبات عضوية. نتيجة للتفاعل ، تفقد المحاليل الصفراء من البروم لونها ، أي تلطيخ.
CH 2 \ u003d CH 2 + Br 2 → CH 2 Br-CH 2 Br
الهالوجين المائي
من السهل أن نرى أن إضافة هاليد الهيدروجين إلى جزيء ألكين غير متماثل يجب أن يؤدي نظريًا إلى خليط من أيزومرين. على سبيل المثال ، عند إضافة بروميد الهيدروجين إلى البروبين ، يجب الحصول على المنتجات التالية:
ومع ذلك ، في حالة عدم وجود شروط محددة (على سبيل المثال ، وجود بيروكسيدات في خليط التفاعل) ، ستحدث إضافة جزيء هاليد الهيدروجين بشكل انتقائي وفقًا لقاعدة ماركوفنيكوف:
تحدث إضافة هاليد الهيدروجين إلى ألكين بطريقة يتم فيها ربط الهيدروجين بذرة كربون مع عدد أكبر من ذرات الهيدروجين (أكثر هدرجة) ، والهالوجين مرتبط بذرة كربون بعدد أقل من ذرات الهيدروجين (أقل مهدرجة).
ترطيب
يؤدي رد الفعل هذا إلى تكوين الكحوليات ، ويستمر أيضًا وفقًا لقاعدة ماركوفنيكوف:
كما قد تتخيل ، نظرًا لحقيقة أن إضافة الماء إلى جزيء الألكين يحدث وفقًا لقاعدة ماركوفنيكوف ، فإن تكوين الكحول الأولي ممكن فقط في حالة ترطيب الإيثيلين:
CH 2 \ u003d CH 2 + H 2 O → CH 3 -CH 2-OH
من خلال هذا التفاعل يتم تنفيذ الكمية الرئيسية من الكحول الإيثيلي في الصناعة ذات السعة الكبيرة.
البلمرة
حالة محددة من تفاعل الإضافة هي تفاعل البلمرة ، والذي ، على عكس الهالوجين والهالوجين المائي والترطيب ، يستمر من خلال آلية الجذور الحرة:
تفاعلات الأكسدة
مثل جميع الهيدروكربونات الأخرى ، تحترق الألكينات بسهولة في الأكسجين لتكوين ثاني أكسيد الكربون والماء. معادلة احتراق الألكينات في الأكسجين الزائد لها الشكل:
C n H 2n + (3/2) nO 2 → nCO 2 + nH 2 O
على عكس الألكانات ، تتأكسد الألكينات بسهولة. تحت تأثير محلول مائي من KMnO 4 على الألكينات ، يتغير اللون ، وهو تفاعل نوعي لروابط CC المزدوجة والثلاثية في جزيئات المواد العضوية.
تؤدي أكسدة الألكينات مع برمنجنات البوتاسيوم في محلول محايد أو قلوي قليلاً إلى تكوين ديول (كحول ثنائي الهيدروجين):
C 2 H 4 + 2KMnO 4 + 2H 2 O → CH 2 OH – CH 2 OH + 2MnO 2 + 2KOH (تبريد)
في البيئة الحمضية ، يحدث انقسام كامل للرابطة المزدوجة مع تحول ذرات الكربون التي شكلت الرابطة المزدوجة إلى مجموعات كربوكسيل:
5CH 3 CH = CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (تدفئة)
إذا كانت الرابطة المزدوجة C = C في نهاية جزيء الألكين ، فإن ثاني أكسيد الكربون يتشكل كمنتج أكسدة لذرة الكربون القصوى عند الرابطة المزدوجة. هذا يرجع إلى حقيقة أن منتج الأكسدة الوسيط ، حمض الفورميك ، يتأكسد بسهولة من تلقاء نفسه في وجود فائض من عامل مؤكسد:
5CH 3 CH = CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O (تدفئة)
في أكسدة الألكينات ، حيث تحتوي ذرة C في الرابطة المزدوجة على بدائل هيدروكربونية ، يتم تكوين كيتون. على سبيل المثال ، ينتج عن أكسدة 2-ميثيل بوتين -2 الأسيتون وحمض الخليك.
يتم استخدام أكسدة الألكينات ، التي تكسر الهيكل الكربوني للرابطة المزدوجة ، لتأسيس هيكلها.
الخواص الكيميائية للكادين
تفاعلات الإضافة
على سبيل المثال ، إضافة الهالوجينات:
يصبح ماء البروم عديم اللون.
في ظل الظروف العادية ، تحدث إضافة ذرات الهالوجين في نهايات جزيء بوتادين 1.3 ، بينما تتكسر روابط ، وترتبط ذرات البروم بذرات الكربون القصوى ، وتشكل التكافؤات الحرة رابطة جديدة. وهكذا ، كما لو كانت هناك "حركة" للرابطة المزدوجة. مع وجود فائض من البروم ، يمكن إضافة جزيء بروم آخر في موقع الرابطة المزدوجة المشكلة.
تفاعلات البلمرة
الخواص الكيميائية للألكينات
الألكينات عبارة عن هيدروكربونات غير مشبعة (غير مشبعة) وبالتالي فهي قادرة على الدخول في تفاعلات إضافية. من بين تفاعلات الإضافة للألكينات ، فإن الإضافة المحبة للكهرباء هي الأكثر شيوعًا.
الهلجنة
نظرًا لأن الرابطة الثلاثية لجزيئات alkyne تتكون من رابطة سيجما أقوى واثنين من روابط pi الأضعف ، فهي قادرة على ربط جزيء أو اثنين من جزيئات الهالوجين. تتم إضافة جزيئين هالوجين بواسطة جزيء ألكين واحد بواسطة آلية الإلكتروفيليك بالتتابع على مرحلتين:
الهالوجين المائي
تتم أيضًا إضافة جزيئات هاليد الهيدروجين بواسطة آلية الإلكتروفيلي وعلى مرحلتين. في كلتا المرحلتين ، تتم الإضافة وفقًا لقاعدة ماركوفنيكوف:
ترطيب
تحدث إضافة الماء إلى الألكينات في وجود أملاح الروثيوم في وسط حمضي ويسمى تفاعل كوتشيروف.
نتيجة لترطيب إضافة الماء إلى الأسيتيلين ، يتشكل الأسيتالديهيد (ألدهيد الخل):
بالنسبة لمتناظرات الأسيتيلين ، تؤدي إضافة الماء إلى تكوين الكيتونات:
هدرجة ألكين
تتفاعل الألكينات مع الهيدروجين في خطوتين. تستخدم المعادن مثل البلاتين والبلاديوم والنيكل كمحفزات:
تقليم ألكين
عندما يتم تمرير الأسيتيلين فوق الكربون المنشط عند درجة حرارة عالية ، يتم تكوين خليط من المنتجات المختلفة منه ، وأهمها البنزين ، وهو منتج من مادة الأسيتيلين:
قلة الألكينات
يدخل الأسيتيلين أيضًا في تفاعل ثنائي الأبعاد. تستمر العملية في وجود أملاح النحاس كمحفزات:
أكسدة ألكين
الألكينات تحترق في الأكسجين:
C n H 2n-2 + (3n-1) / 2 O 2 → nCO 2 + (n-1) H 2 O
تفاعل الألكينات مع القواعد
الألكينات ذات CC ثلاثية في نهاية الجزيء ، على عكس الألكينات الأخرى ، قادرة على الدخول في تفاعلات يتم فيها استبدال ذرة الهيدروجين في الرابطة الثلاثية بمعدن. على سبيل المثال ، يتفاعل الأسيتيلين مع أميد الصوديوم في الأمونيا السائلة:
HC≡CH + 2NaNH 2 → NaC≡CNa + 2NH 3 ،
وأيضًا مع محلول الأمونيا من أكسيد الفضة ، مما يؤدي إلى تكوين مواد غير قابلة للذوبان تشبه الملح تسمى الأسيتيلنيدات:
بفضل هذا التفاعل ، من الممكن التعرف على الألكينات برابطة ثلاثية طرفية ، وكذلك عزل مثل هذا الألكين من خليط مع ألكينات أخرى.
وتجدر الإشارة إلى أن كل أسيتيلنييدات الفضة والنحاس هي مواد متفجرة.
الأسيتيلات قادرة على التفاعل مع مشتقات الهالوجين ، والتي تستخدم في تركيب مركبات عضوية أكثر تعقيدًا مع رابطة ثلاثية:
CH 3 -C≡CH + NaNH 2 → CH 3 -C≡CNa + NH 3
CH 3 -C≡CNa + CH 3 Br → CH 3 -C≡C-CH 3 + NaBr
الخواص الكيميائية للهيدروكربونات العطرية
تؤثر الطبيعة العطرية للرابطة على الخصائص الكيميائية للبنزين والهيدروكربونات العطرية الأخرى.
يعد نظام الإلكترون الواحد 6pi أكثر استقرارًا من روابط pi التقليدية. لذلك ، بالنسبة للهيدروكربونات العطرية ، تكون تفاعلات الاستبدال مميزة أكثر من تفاعلات الإضافة. تدخل Arenes في تفاعلات الاستبدال بواسطة آلية إلكتروفيلية.
تفاعلات الاستبدال
الهلجنة
النترات
يستمر تفاعل النترات بشكل أفضل تحت تأثير ليس حمض النيتريك النقي ، ولكن خليطه مع حمض الكبريتيك المركز ، ما يسمى بخليط النيتريك:
الألكلة
التفاعل الذي يتم فيه استبدال إحدى ذرات الهيدروجين في النواة العطرية بجذر هيدروكربوني:
يمكن أيضًا استخدام الألكينات بدلاً من الألكانات المهلجنة. يمكن استخدام هاليدات الألومنيوم أو هاليدات الحديد أو الأحماض غير العضوية كمحفزات.<
تفاعلات الإضافة
الهدرجة
الحصول على الكلور
إنها تنطلق بآلية جذرية تحت إشعاع مكثف بالأشعة فوق البنفسجية:
وبالمثل ، يمكن أن يستمر التفاعل مع الكلور فقط.
تفاعلات الأكسدة
الإحتراق
2C 6 H 6 + 15O 2 \ u003d 12CO 2 + 6H 2 O + Q
أكسدة غير كاملة
حلقة البنزين مقاومة للعوامل المؤكسدة مثل KMnO 4 و K 2 Cr 2 O 7. رد الفعل لا يذهب.
تقسيم البدائل في حلقة البنزين إلى نوعين:
ضع في اعتبارك الخصائص الكيميائية لمتجانسات البنزين باستخدام التولوين كمثال.
الخواص الكيميائية للتولوين
الهلجنة
يمكن اعتبار أن جزيء التولوين يتكون من أجزاء من جزيئات البنزين والميثان. لذلك ، من المنطقي أن نفترض أن الخواص الكيميائية للتولوين يجب أن تجمع إلى حد ما الخصائص الكيميائية لهاتين المادتين المأخوذة بشكل منفصل. على وجه الخصوص ، هذا هو بالضبط ما يتم ملاحظته أثناء الهالوجين. نحن نعلم بالفعل أن البنزين يدخل في تفاعل استبدال مع الكلور بواسطة آلية محبة للكهرباء ، ويجب استخدام المحفزات (الألومنيوم أو هاليدات الحديديك) لإجراء هذا التفاعل. في نفس الوقت ، الميثان قادر أيضًا على التفاعل مع الكلور ، ولكن بواسطة آلية الجذور الحرة ، والتي تتطلب تشعيع خليط التفاعل الأولي مع ضوء الأشعة فوق البنفسجية. التولوين ، اعتمادًا على الظروف التي يخضع فيها للكلور ، قادر على إعطاء إما نواتج استبدال ذرات الهيدروجين في حلقة البنزين - لهذا تحتاج إلى استخدام نفس الشروط كما في كلورة البنزين ، أو منتجات الاستبدال من ذرات الهيدروجين في جذر الميثيل ، إذا كان عليه ، كيفية التصرف على الميثان بالكلور عند تعريضه للأشعة فوق البنفسجية:
كما ترون ، أدت كلورة التولوين في وجود كلوريد الألومنيوم إلى منتجين مختلفين - أورثو وبارا كلورو تولين. هذا يرجع إلى حقيقة أن جذر الميثيل هو بديل من النوع الأول.
إذا تم إجراء كلورة التولوين في وجود AlCl 3 بما يزيد عن الكلور ، فمن الممكن تكوين التولوين المستبدل بثلاثي الكلور:
وبالمثل ، عند معالجة التولوين بالكلور في الضوء بنسبة أعلى من الكلور / التولوين ، يمكن الحصول على ثنائي كلورو ميثيل بنزين أو ثلاثي كلورو ميثيل بنزين:
النترات
يؤدي استبدال مجموعة النتروجين بذرات الهيدروجين ، أثناء نترات التولوين بمزيج من أحماض النيتريك والكبريتيك المركزة ، إلى استبدال المنتجات في النواة العطرية ، وليس في جذر الميثيل:
الألكلة
كما ذكرنا سابقًا ، فإن جذري الميثيل هو موجه من النوع الأول ، وبالتالي ، تؤدي ألكلة Friedel-Crafts إلى منتجات بديلة في مواضع ortho و para:
تفاعلات الإضافة
يمكن هدرجة التولوين إلى ميثيل سيكلوهكسان باستخدام محفزات معدنية (Pt، Pd، Ni):
ج 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
أكسدة غير كاملة
تحت تأثير عامل مؤكسد مثل محلول مائي من برمنجنات البوتاسيوم ، تخضع السلسلة الجانبية للأكسدة. لا يمكن أن تتأكسد النواة العطرية في ظل هذه الظروف. في هذه الحالة ، اعتمادًا على الرقم الهيدروجيني للمحلول ، سيتم تكوين حمض الكربوكسيل أو الملح.
؛ في هذه الحالة ، يتم كسر رابطة p واحدة وتشكيل رابطة أو اثنتين. للإشارة إلى الاتصال تفاعلاتاستخدم رمز الإعلان (من الإضافة الإنجليزية - الانضمام) ؛ بالنسبة إلى p-tions من cycloaddition ، لا يتم استخدام هذا الرمز.
حسب الطبيعة المادة المتفاعلةيميز بين التوصيلات تفاعلاتعلى معزولة أو مقترنة سندات متعددة، على سبيل المثال: C = C ، C = C ، C = C-C = C ، C = O ، C = N ، C = N. قم بتمييز p-tion homolytic. (Ad R) وغير المتجانسة. الانضمام. هذا الأخير يعتمد على تهمة المهاجم كاشفتنقسم إلى r-نشوئها elektrof. (Ad E) و nucleoph. (AdN) الاضافات. سلوك كاشفيعتمد على النوع المادة المتفاعلةوشروط إجراء التوزيع (التوزيع ، التواجد عامل حفاز، وتأثير الأشعة فوق البنفسجية ، وما إلى ذلك). مينيسوتا. الكواشففي ظروف مختلفة يمكن أن تظهر مختلفة. أنواع ردود الفعل. القدرات ، على سبيل المثال. الهالوجيناتيمكن أن يكون بمثابة جذري ، elektrof. وحتى النواة. عملاء.
نائب. دراسة الانضمام تفاعلاتعلى سندات متعددةالكربون الكربون. تستمر هذه العمليات وفقًا لآلية متدرجة (مرحلية) أو متزامنة (منسقة). مع آلية متدرجة ، فإن المرحلة الأولى هي هجوم النوكليوفيل أو الإلكتروفيل أو الحر. الراديكالية الثانية - إعادة التركيبالناتج متوسطإيجابي ، سلبي أو جسيم محايد ، على سبيل المثال:
اليكتروف. أو نيوكليوف. لا يجب أن تكون الجسيمات الأيونات؛ يمكن أن يمثلوا جزءًا يسحب الإلكترون أو يتبرع بالإلكترون (مجموعة) الجزيئات. لا يمكن إجراء تغييرات في Ad N إلا مع روابط C = C التي يتم تنشيطها بواسطة بدائل سحب الإلكترون ؛ يتطلب تنفيذ Ad E إما روابط C = C غير المستبدلة أو تلك التي يتم تنشيطها بواسطة البدائل المتبرعة بالإلكترون. بالنسبة إلى Ad R ، فإن طبيعة البديل في الرابطة C = C لا تهم كثيرًا.
ستريوتشيم. تعتمد نتيجة إضافة الخطوة على آلية الحركة وطبيعة المركبات المتفاعلة. نعم كهربائي. انضمام الأوليفيناتيمكن المضي قدمًا كهجوم على شكل جسيمات Y و W مركبعلى جانب واحد من الطائرة رابطة مزدوجةأو كمضاد للتعلق - تهاجم الجسيمات من جوانب مختلفة من الطائرة ؛ في بعض الحالات ، تنتقل المقاطعات بطريقة غير نمطية. نوكليوف. الانضمام مع الكربوهيدراتالعائدات ، كقاعدة عامة ، غير ستيريو. عند الانضمام تفاعلاتعلى السندات الثلاثيةتؤدي إضافة syn إلى أيزومر رابطة الدول المستقلة ، ويؤدي مضاد الإضافة إلى الأيزومر العابر.
في حالة وجود آلية متزامنة ، يتم الهجوم على كليهما ذرةيتم تنفيذ C في وقت واحد ويستمر p-tion كإضافة ثنائية القطب (انظر Cycloaddition) ، في حين أن الإضافة تفاعلاتضعف أو السندات الثلاثيةالذهاب كمرفق الابن (انظر ، على سبيل المثال ، ردود فعل ريب).
ص روابط تفاعلاتعن طريق المرافقة سندات مزدوجة، التي تتدفق من خلال آلية متدرجة ، تؤدي إلى تكوين منتجات إضافة 1،2 و 1،4:
1.4 متزامن اتصال ديندرب قيد التشغيل. طريق:

هناك نوع خاص من تفاعلات الإضافة وهو الجمع المترافق. يترافق تدفق هذه p-tions بربط المذيب p (أو مضاف بشكل خاص كاشف) في المرحلة الأخيرة من العملية. على سبيل المثال ، elektrof المترافق. انضمام الهالوجيناتإلى الألكيناتفي CH 3 COOH يؤدي ، جنبًا إلى جنب مع 1،2-ثنائي هاليدات ، إلى هاليدات أسيتوكسي ألكيل:
أمثلة على نوكليوف مترافق. انضمام - رد فعل مايكلوالتفاعل. مفعل الألكيناتمع أنيون السيانيد في مذيبات p البروتون SH:

في حالة الانضمام تفاعلاتعلى سندات متعددةذرة الكربون غير المتجانسة ، والتي وضعت فيها. تهمة مترجمة ذرة C (الروابط C = O ، C = N ، C = N و C = S) ، ترتبط النواة دائمًا بـ ذرة C ، و electrophiles إلى ذرة مغايرة. في نيب. درس درجة الاضافات nucleophilic تفاعلاتلمجموعة كاربونيل:

ص روابط تفاعلعلى ذرةقد يكون C إحدى مراحل الاستبدال في العطرية. على التوالي ، على سبيل المثال: