Descrição de uma substância líquida. Estado líquido. As estruturas de líquidos e corpos amorfos são semelhantes
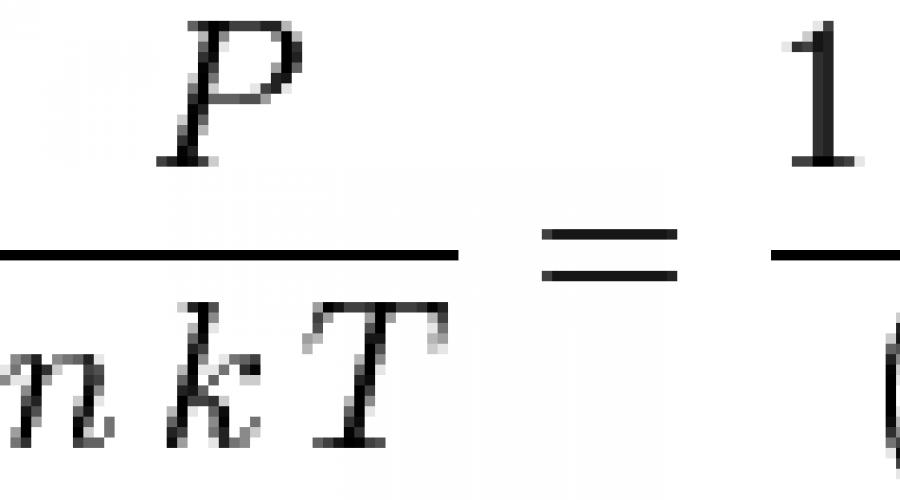
Equação de Euler Equações de Navier-Stokes Equação de difusão Lei de Hooke
Como regra, uma substância em estado líquido tem apenas uma modificação. (As exceções mais importantes são os líquidos quânticos e os cristais líquidos.) Portanto, na maioria dos casos, um líquido não é apenas um estado de agregação, mas também uma fase termodinâmica (fase líquida).
Todos os líquidos são geralmente divididos em líquidos puros e misturas. Algumas misturas de líquidos são de grande importância para a vida: sangue, água do mar, etc. Os líquidos podem atuar como solventes.
Propriedades físicas dos líquidos
- Fluidez
A fluidez é a principal propriedade dos líquidos. Se uma força externa é aplicada a uma seção de um fluido em equilíbrio, então ocorre um fluxo de partículas de fluido na direção em que essa força é aplicada: o fluido flui. Assim, sob a ação de forças externas desequilibradas, o líquido não retém a forma e a disposição relativa das partes e, portanto, assume a forma do recipiente em que está localizado.
Ao contrário dos sólidos plásticos, um líquido não tem limite de escoamento: basta aplicar uma força externa arbitrariamente pequena para fazer o líquido fluir.
- Conservação de Volume
Uma das propriedades características de um líquido é que ele tem um certo volume (sob condições externas constantes). Um líquido é extremamente difícil de comprimir mecanicamente porque, ao contrário de um gás, há muito pouco espaço livre entre as moléculas. A pressão exercida sobre um líquido encerrado em um recipiente é transmitida sem alteração a cada ponto do volume desse líquido (lei de Pascal, também válida para gases). Esse recurso, juntamente com a compressibilidade muito baixa, é usado em máquinas hidráulicas.
Os líquidos normalmente aumentam de volume (expandem) quando aquecidos e diminuem de volume (contraem) quando resfriados. No entanto, há exceções, por exemplo, a água se comprime quando aquecida, em pressão normal e temperaturas de 0°C a cerca de 4°C.
- Viscosidade
Além disso, líquidos (como gases) são caracterizados pela viscosidade. É definida como a capacidade de resistir ao movimento de uma das partes em relação à outra - ou seja, como atrito interno.
Quando camadas adjacentes de um líquido se movem uma em relação à outra, há inevitavelmente uma colisão de moléculas além daquela devido ao movimento térmico. Existem forças que retardam o movimento ordenado. Nesse caso, a energia cinética do movimento ordenado é convertida em energia térmica - a energia do movimento caótico das moléculas.
O líquido no recipiente, posto em movimento e abandonado a si mesmo, parará gradualmente, mas sua temperatura aumentará.
- Formação de Superfície Livre e Tensão Superficial
Devido à conservação do volume, o líquido é capaz de formar uma superfície livre. Essa superfície é a interface de fase de uma determinada substância: de um lado está a fase líquida, do outro - o gasoso (vapor) e possivelmente outros gases, como o ar.
Se as fases líquida e gasosa de uma mesma substância estiverem em contato, surgem forças que tendem a reduzir a área de interface - forças de tensão superficial. A interface se comporta como uma membrana elástica que tende a encolher.
A tensão superficial pode ser explicada pela atração entre as moléculas do líquido. Cada molécula atrai outras moléculas, tende a se "cercar" delas e, portanto, a sair da superfície. Assim, a superfície tende a diminuir.
Portanto, bolhas de sabão e bolhas durante a fervura tendem a assumir uma forma esférica: para um determinado volume, uma bola tem uma superfície mínima. Se apenas as forças de tensão superficial atuarem sobre um líquido, ele necessariamente assumirá uma forma esférica - por exemplo, gotas de água na ausência de peso.
Pequenos objetos com densidade maior que a densidade de um líquido são capazes de “flutuar” na superfície do líquido, pois a força da gravidade é menor que a força que impede o aumento da área superficial. (Veja tensão superficial.)
- Evaporação e condensação
- Difusão
Quando dois líquidos miscíveis estão em um recipiente, as moléculas, como resultado do movimento térmico, começam a passar gradualmente pela interface e, assim, os líquidos se misturam gradualmente. Esse fenômeno é chamado de difusão (também ocorre em substâncias em outros estados de agregação).
- Superaquecimento e hipotermia
Um líquido pode ser aquecido acima do ponto de ebulição de tal forma que a ebulição não ocorra. Isso requer um aquecimento uniforme, sem diferenças significativas de temperatura dentro do volume e sem influências mecânicas, como vibração. Se algo é jogado em um líquido superaquecido, ele ferve instantaneamente. Água superaquecida é fácil de entrar no micro-ondas.
Subresfriamento - resfriamento de um líquido abaixo do ponto de congelamento sem se transformar em um estado sólido de agregação. Assim como no superaquecimento, o subresfriamento requer a ausência de vibração e flutuações significativas de temperatura.
- ondas de densidade
Embora um líquido seja extremamente difícil de comprimir, seu volume e densidade mudam à medida que a pressão muda. Isso não acontece instantaneamente; então, se uma seção é comprimida, então essa compressão é transmitida para outras seções com um atraso. Isso significa que ondas elásticas, mais especificamente ondas de densidade, podem se propagar dentro do líquido. Junto com a densidade, outras quantidades físicas também mudam, por exemplo, a temperatura.
Se durante a propagação de uma onda a densidade muda um pouco fracamente, tal onda é chamada de onda sonora, ou som.
Se a densidade mudar com força suficiente, essa onda é chamada de onda de choque. A onda de choque é descrita por outras equações.
As ondas de densidade em um líquido são longitudinais, ou seja, a densidade varia ao longo da direção de propagação da onda. Não há ondas elásticas transversais no líquido devido à não conservação da forma.
Ondas elásticas em um líquido decaem com o tempo, sua energia gradualmente se transforma em energia térmica. As razões para o amortecimento são viscosidade, "absorção clássica", relaxamento molecular e outros. Nesse caso, funciona a chamada segunda viscosidade, ou viscosidade em massa - atrito interno com mudança de densidade. Como resultado da atenuação, a onda de choque se transforma em uma onda sonora após algum tempo.
As ondas elásticas em um líquido também estão sujeitas à dispersão por heterogeneidades resultantes do movimento térmico aleatório das moléculas.
- Ondas na superfície
Se a superfície do líquido for deslocada da posição de equilíbrio, sob a ação de forças restauradoras, a superfície começa a se mover de volta à posição de equilíbrio. Esse movimento, no entanto, não para, mas se transforma em um movimento oscilatório próximo à posição de equilíbrio e se espalha para outras áreas. É assim que as ondas aparecem na superfície de um líquido.
Se a força restauradora é predominantemente gravitacional, então tais ondas são chamadas de ondas gravitacionais (não confundir com ondas gravitacionais). Ondas gravitacionais na água podem ser vistas em todos os lugares.
Se a força restauradora é predominantemente uma força de tensão superficial, então tais ondas são chamadas de capilares.
Se essas forças são comparáveis, tais ondas são chamadas de ondas de gravidade capilar.
As ondas na superfície de um líquido são amortecidas pela viscosidade e outros fatores.
- Convivência com outras fases
Formalmente, para a coexistência em equilíbrio de uma fase líquida com outras fases da mesma substância - gasosa ou cristalina - são necessárias condições estritamente definidas. Assim, a uma dada pressão, é necessária uma temperatura estritamente definida. No entanto, na natureza e na tecnologia, em toda parte o líquido coexiste com o vapor, ou também com um estado sólido de agregação - por exemplo, água com vapor de água e muitas vezes com gelo (se considerarmos o vapor como uma fase separada presente junto com o ar). Isso se deve aos seguintes motivos.
Estado desequilibrado. Leva tempo para o líquido evaporar, até que o líquido evapore completamente, ele coexiste com o vapor. Na natureza, a água está constantemente evaporando, assim como o processo inverso - condensação.
volume fechado. O líquido em um recipiente fechado começa a evaporar, mas como o volume é limitado, a pressão de vapor aumenta, fica saturado antes mesmo que o líquido tenha evaporado completamente, se sua quantidade for grande o suficiente. Quando o estado de saturação é atingido, a quantidade de líquido evaporado é igual à quantidade de líquido condensado, o sistema entra em equilíbrio. Assim, em um volume limitado, podem ser estabelecidas as condições necessárias para a coexistência de equilíbrio entre líquido e vapor.
A presença da atmosfera nas condições de gravidade terrestre. A pressão atmosférica atua sobre um líquido (ar e vapor), enquanto para o vapor, praticamente apenas sua pressão parcial deve ser levada em consideração. Portanto, o líquido e o vapor acima de sua superfície correspondem a pontos diferentes no diagrama de fases, na região da existência da fase líquida e na região da existência da fase gasosa, respectivamente. Isso não cancela a evaporação, mas a evaporação leva tempo durante o qual ambas as fases coexistem. Sem essa condição, os líquidos ferveriam e evaporariam muito rapidamente.
Teoria
Mecânica
O estudo do movimento e equilíbrio mecânico de líquidos e gases e sua interação entre si e com os sólidos é o assunto de um ramo da mecânica - hidroaeromecânica (muitas vezes também chamada de hidrodinâmica). A mecânica dos fluidos faz parte de um ramo mais geral da mecânica, a mecânica do contínuo.
A mecânica dos fluidos é o ramo da mecânica dos fluidos que lida com fluidos incompressíveis. Como a compressibilidade dos líquidos é muito pequena, em muitos casos ela pode ser desprezada. A dinâmica dos gases é dedicada ao estudo de líquidos e gases compressíveis.
A hidromecânica é subdividida em hidrostática, que estuda o equilíbrio de fluidos incompressíveis, e hidrodinâmica (em sentido estrito), que estuda seu movimento.
O movimento de fluidos eletricamente condutores e magnéticos é estudado em magnetohidrodinâmica. A hidráulica é usada para resolver problemas aplicados.
A lei básica da hidrostática é a lei de Pascal.
2. Líquidos de moléculas diatômicas constituídas por átomos idênticos (hidrogênio líquido, nitrogênio líquido). Tais moléculas têm um momento quadrupolar.
4. Líquidos constituídos por moléculas polares ligadas por uma interação dipolo-dipolo (brometo de hidrogênio líquido).
5. Líquidos associados, ou líquidos com ligações de hidrogênio (água, glicerina).
6. Líquidos constituídos por grandes moléculas, para os quais os graus de liberdade internos são essenciais.
Líquidos dos dois primeiros grupos (às vezes três) são geralmente chamados de simples. Líquidos simples foram estudados melhor do que outros; dos líquidos complexos, a água foi o mais bem estudado. Esta classificação não inclui líquidos quânticos e cristais líquidos, que são casos especiais e devem ser considerados separadamente.
Teoria estatística
A estrutura e as propriedades termodinâmicas dos líquidos são estudadas com mais sucesso usando a equação de Percus-Yevick.
Se usarmos o modelo de bolas sólidas, ou seja, considerarmos as moléculas líquidas como bolas de diâmetro d, então a equação de Percus-Yevick pode ser resolvida analiticamente e a equação de estado do líquido pode ser obtida:
![]() Onde n- número de partículas por unidade de volume,
Onde n- número de partículas por unidade de volume, ![]() é a densidade adimensional. Em baixas densidades, esta equação se torna a equação de estado do gás ideal:
é a densidade adimensional. Em baixas densidades, esta equação se torna a equação de estado do gás ideal: ![]() . Para densidades extremamente altas, , a equação de estado para um fluido incompressível é obtida: .
. Para densidades extremamente altas, , a equação de estado para um fluido incompressível é obtida: .
O modelo de bola dura não leva em consideração a atração entre as moléculas, portanto, não há transição acentuada entre líquido e gás quando as condições externas mudam.
Se resultados mais precisos devem ser obtidos, então a melhor descrição da estrutura e propriedades do fluido é obtida usando a teoria de perturbação. Neste caso, o modelo hard ball é considerado a aproximação zero, e as forças atrativas entre as moléculas são consideradas perturbações e fornecem correções.
teoria do agrupamento
Uma das teorias modernas é "Teoria do agrupamento". Baseia-se na ideia de que um líquido é representado como uma combinação de um sólido e um gás. Neste caso, as partículas da fase sólida (cristais que se movem em distâncias curtas) estão localizadas em uma nuvem de gás, formando estrutura de cluster. A energia da partícula corresponde à distribuição de Boltzmann, enquanto a energia média do sistema permanece constante (sob a condição de seu isolamento). Partículas lentas colidem com aglomerados e se tornam parte deles. Assim, a configuração dos clusters está em constante mudança, o sistema está em estado de equilíbrio dinâmico. Ao criar uma influência externa, o sistema se comportará de acordo com o princípio de Le Chatelier. Assim, é fácil explicar a transformação de fase:
- Quando aquecido, o sistema gradualmente se transformará em um gás (ebulição)
- Quando resfriado, o sistema se transformará gradualmente em um corpo sólido (congelamento).
Métodos de estudo experimental
A estrutura de líquidos é estudada usando métodos de análise estrutural de raios X, difração de elétrons e difração de nêutrons.
Veja também
- Características da camada superficial do líquido
Links
| Estados termodinâmicos da matéria | |
|---|---|
| Física: Sólido Líquido Gás Plasma | |
- Estado sólido
- Estado líquido
- Estado gasoso
- Mudança no estado da matéria
Química é o estudo da matéria. O que é uma "substância"? Matéria é tudo que tem massa e volume. Uma substância pode estar em um dos três estados agregados: sólido, líquido, gasoso.
1. Estado Sólido
Partículas (moléculas) em um corpo sólido são combinadas em uma estrutura rígida de repetição - estrutura de cristal. As partículas na rede cristalina fazem pequenas vibrações em torno dos centros de equilíbrio. O sólido tem Formato e volume.
2. Estado líquido
Ao contrário dos sólidos, um líquido não tem uma forma definida, mas tem um volume. Isso é explicado pelo fato de que nos líquidos as partículas estão a uma distância maior umas das outras do que nos sólidos e se movem mais ativamente.
Como as partículas em líquidos são menos densas do que em sólidos, elas não podem formar uma rede cristalina, portanto, os líquidos não têm uma forma definida.
3. Estado gasoso
Em um gás, as partículas ainda estão a distâncias maiores do que em líquidos. Além disso, as partículas estão constantemente em movimento caótico (aleatório). Portanto, os gases tendem a preencher uniformemente o volume fornecido a eles (daí o fato de os gases não terem uma forma definida).
4. Mudança no estado da matéria
Vamos dar um exemplo banal e seguir o processo de mudança do estado da água.
No estado sólido, a água é gelo. A temperatura do gelo é inferior a 0°C. Quando aquecido, o gelo começa a derreter e se transformar em água. Isso se deve ao fato de que as partículas de gelo na rede cristalina começam a se mover quando aquecidas, como resultado da destruição da rede. A temperatura na qual uma substância derrete é chamada de "ponto de fusão" substâncias. O ponto de fusão da água é 0 o C.
Deve-se notar que até que o gelo esteja completamente derretido, a temperatura do gelo será de 0 o C.
| Durante as mudanças de fase da matéria, a temperatura permanece constante. |
Depois que o gelo se transformar completamente em água, continuaremos o aquecimento. A temperatura da água aumentará e o movimento das partículas sob a influência do calor será cada vez mais acelerado. Isso acontece até que a água atinja seu próximo ponto de mudança de estado - ebulição.
Este momento chega quando as ligações das partículas de água são completamente quebradas e seu movimento se torna livre: a água se transforma em vapor.
| O processo pelo qual uma substância passa do estado líquido para o estado gasoso é chamado de ebulição |
A temperatura na qual um líquido ferve é chamada "ponto de ebulição".
Observe que o ponto de ebulição depende da pressão. À pressão normal (760 mm Hg), o ponto de ebulição da água é 100 o C.
Por analogia com o derretimento: até que a água se transforme completamente em vapor, a temperatura será constante.
Resumir. Como resultado do aquecimento, obtivemos diferentes estados de fase da água:
Gelo → água → vapor ou H 2 0 (t) → H 2 0 (g) → H 2 0 (g)
O que acontece se começarmos a resfriar o vapor de água? Você não precisa ter "sete vãos na testa" para adivinhar - o processo inverso de mudanças de fase na água continuará:
Vapor → água → gelo
Existem algumas substâncias que passam diretamente do estado sólido para o gasoso, contornando a fase líquida. Tal processo é chamado sublimação ou sublimação. Assim, por exemplo, se comporta "gelo seco" (dióxido de nitrogênio CO 2). Quando aquecido, você não verá uma gota de água - o "gelo seco" parecerá evaporar diante de seus olhos.
O processo que é o inverso da sublimação (a transição de uma substância do estado gasoso para o estado sólido) é chamado de dessublimação.
Os líquidos ocupam uma posição intermediária entre as substâncias gasosas e sólidas. Em temperaturas próximas aos pontos de ebulição, as propriedades dos líquidos se aproximam das dos gases; em temperaturas próximas aos pontos de fusão, as propriedades dos líquidos se aproximam das dos sólidos. Se as substâncias sólidas são caracterizadas por um ordenamento estrito de partículas, estendendo-se por distâncias de até centenas de milhares de raios interatômicos ou intermoleculares, em uma substância líquida geralmente não há mais do que algumas dezenas de partículas ordenadas - isso é explicado pelo fato de que a ordenação entre partículas em diferentes locais de uma substância líquida também surge rapidamente. , bem como novamente "manchada" pela vibração térmica das partículas. Ao mesmo tempo, a densidade total de empacotamento das partículas de uma substância líquida difere pouco da de uma substância sólida - portanto, sua densidade é próxima à densidade dos sólidos e a compressibilidade é muito baixa. Por exemplo, para reduzir o volume ocupado pela água líquida em 1%, é necessário aplicar uma pressão de ~ 200 atm, enquanto para a mesma diminuição do volume de gases, é necessária uma pressão da ordem de 0,01 atm. Portanto, a compressibilidade dos líquidos é aproximadamente e 200: 0,01 = 20.000 vezes menor que a compressibilidade dos gases.
Foi observado acima que os líquidos têm um certo volume próprio e assumem a forma do recipiente em que estão localizados; essas propriedades são muito mais próximas das de um sólido do que de uma substância gasosa. A proximidade do estado líquido com o estado sólido também é confirmada pelos dados sobre as entalpias padrão de vaporização ∆Н° e as entalpias padrão de fusão ∆Н° pl. Entalpia padrão de vaporização chame a quantidade de calor necessária para converter 1 mol de líquido em vapor a 1 atm (101,3 kPa). A mesma quantidade de calor é liberada quando 1 mol de vapor se condensa em um líquido a 1 atm. A quantidade de calor gasto na transformação de 1 mol de um sólido em um líquido a 1 atm é chamada entalpia padrão de fusão(a mesma quantidade de calor é liberada ao "congelar" ("solidificar") 1 mol de líquido a 1 atm). Sabe-se que ∆Н° pl é muito menor que os valores correspondentes de ∆Н° exp, o que é fácil de entender, pois a transição do estado sólido para o líquido é acompanhada por uma violação menor da atração intermolecular do que um transição do estado líquido para o gasoso.
Várias outras propriedades importantes dos líquidos lembram mais as propriedades dos gases. Assim, como os gases, os líquidos podem fluir - sua propriedade é chamada de fluidez. A resistência ao fluxo é determinada pela viscosidade. A fluidez e a viscosidade são afetadas por forças atrativas entre moléculas líquidas, seu peso molecular relativo e vários outros fatores. A viscosidade dos líquidos é aproximadamente 100 vezes maior que a dos gases. Assim como os gases, os líquidos podem se difundir, embora muito mais lentamente, porque as partículas líquidas são empacotadas muito mais densamente do que as partículas de gás.
Uma das propriedades mais importantes de um líquido é sua tensão superficial(Esta propriedade não é inerente a gases ou sólidos). Uma molécula em um líquido está sujeita a forças intermoleculares uniformes de todos os lados. No entanto, na superfície do líquido, o equilíbrio dessas forças é perturbado e, como resultado, as moléculas da “superfície” estão sob a ação de uma certa força resultante direcionada para dentro do líquido. Por esta razão, a superfície do líquido está em estado de tensão. Tensão superficial- esta é a força mínima que restringe o movimento de partículas de fluido na profundidade do fluido e, assim, impede a contração da superfície do fluido. É a tensão superficial que explica a forma de "lágrima" das partículas fluidas que caem livremente.
No estado líquido, a distância entre as partículas é muito menor do que no estado gasoso. As partículas ocupam a maior parte do volume, constantemente em contato umas com as outras e são atraídas umas pelas outras. Alguma ordenação de partículas (ordem de curto alcance) é observada. As partículas estão se movendo em relação umas às outras.
Nos líquidos, as interações de van der Waals surgem entre as partículas: dispersão, orientação e indução. Pequenos grupos de partículas unidas por certas forças são chamados aglomerados. No caso de partículas idênticas, aglomerados em um líquido são chamados associados
Em líquidos, a formação de ligações de hidrogênio aumenta o ordenamento das partículas. No entanto, as ligações de hidrogênio e as forças de van der Waals são frágeis - as moléculas no estado líquido estão em movimento caótico contínuo, que é chamado de movimento browniano.
Para o estado líquido, a distribuição das moléculas de acordo com as velocidades e energias de Maxwell-Boltzmann é válida.
A teoria dos líquidos é muito menos desenvolvida do que a dos gases, uma vez que as propriedades dos líquidos dependem da geometria e da polaridade de moléculas próximas. Além disso, a falta de uma estrutura definida dos líquidos dificulta a formalização de sua descrição - na maioria dos livros didáticos, os líquidos recebem muito menos espaço do que os gases e os sólidos cristalinos.
Não há limite nítido entre líquidos e gases - ele desaparece completamente em Pontos críticos. Para cada gás, a temperatura é conhecida, acima da qual não pode ser líquido a qualquer pressão; com isso crítico temperatura, a fronteira (menisco) entre o líquido e seu vapor saturado desaparece. A existência de uma temperatura crítica ("ponto de ebulição absoluto") foi estabelecida por D.I. Mendeleev em 1860
Tabela 7.2 - Parâmetros críticos (t k, p k, V k) de algumas substâncias
| Substância | t para, cerca de C | pk, atm | V para, cm 3 / mol | t derreter o C | t fardo sobre C |
| Ele | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N 2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O 2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH 4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78,48(sub) |
| NH3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| SO2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Pressão de vapor saturado- pressão parcial na qual as taxas de evaporação e condensação do vapor são iguais:
onde A e B são constantes.
Temperatura de ebuliçãoé a temperatura na qual a pressão de vapor saturado de um líquido é igual à pressão atmosférica.
Os líquidos têm fluidez- a capacidade de se mover sob a ação de pequenas forças de cisalhamento; o líquido ocupa o volume em que é colocado.
A resistência de um fluido ao escoamento é chamada de viscosidade[Pa. Com].
Tensão superficial[J / m 2] - o trabalho necessário para criar uma unidade de superfície.
estado de cristal líquido- substâncias no estado líquido, com alto grau de ordem, ocupam uma posição intermediária entre os cristais e o líquido. Eles têm fluidez, mas ao mesmo tempo têm uma ordem de longo alcance. Por exemplo - derivados de ácido marrom, azólitos, esteróides.
Temperatura de liberação- a temperatura na qual os cristais líquidos (LC) passam para o estado líquido usual.
7.5 Sólidos
No estado sólido, as partículas estão tão próximas umas das outras que surgem fortes ligações entre elas, não há movimento de translação e as oscilações em torno de sua posição são preservadas. Os sólidos podem estar no estado amorfo e cristalino.
7.5.1 Substâncias no estado amorfo
No estado amorfo, as substâncias não têm uma estrutura ordenada.
vítreo estado - um estado amorfo sólido de uma substância, que é obtido como resultado do super-resfriamento profundo de um líquido. Este estado não é de equilíbrio, mas os óculos podem existir por muito tempo. O amolecimento do vidro ocorre em uma determinada faixa de temperatura - a faixa de transição vítrea, cujos limites dependem da taxa de resfriamento. Com o aumento da taxa de resfriamento de um líquido ou vapor, a probabilidade de obter uma determinada substância em estado vítreo aumenta.
No final dos anos 60 do século XX, foram obtidos metais amorfos (vidros metálicos) - para isso foi necessário resfriar o metal fundido a uma velocidade de 10 6 - 10 8 graus / s. A maioria dos metais amorfos e ligas cristalizam quando aquecidos acima de 300°C. Uma das aplicações mais importantes é a microeletrônica (barreiras de difusão na interface metal-semicondutor) e dispositivos de armazenamento magnético (cabeças FMD). Este último é devido à suavidade magnética única (a anisotropia magnética é duas ordens de magnitude menor do que nas ligas convencionais).
Substâncias amorfas isotrópico, ou seja têm as mesmas propriedades em todas as direções.
7.5.2 Substâncias no estado cristalino
Sólido cristalino as substâncias têm uma estrutura ordenada com elementos repetidos, o que permite estudá-las por difração de raios X (análise de difração de raios X, usada desde 1912).
Os cristais únicos (compostos únicos) são caracterizados pela anisotropia - a dependência das propriedades da direção no espaço.
O arranjo regular de partículas em um sólido é representado como uma rede cristalina. Substâncias cristalinas fundem a uma certa temperatura chamada ponto de fusão.
Os cristais são caracterizados pela energia, constante de rede cristalina e número de coordenação.
Malha permanente caracteriza a distância entre os centros das partículas que ocupam nós no cristal na direção dos eixos característicos.
número de coordenação geralmente chamado de número de partículas diretamente adjacentes a uma determinada partícula em um cristal (veja a Figura 7.2 - número de coordenação oito para césio e cloro)
A energia da rede cristalina chamada de energia necessária para destruir um mol de um cristal e remover partículas além dos limites de sua interação.

Figura 7.2 - A estrutura de um cristal de cloreto de césio CsCl (a) e a célula unitária cúbica de corpo centrado deste cristal (b)
7.5.3 Estruturas de cristal
A menor unidade estrutural de um cristal, que expressa todas as propriedades de sua simetria, é célula elementar. Com a repetição repetida da célula em três dimensões, uma rede cristalina é obtida.
Existem sete células básicas: cúbica, tetraédrica, hexagonal, romboédrica, ortorromboédrica, monoclínica e triclínica. Existem sete derivados das células unitárias básicas, por exemplo, centrado no corpo, centrado na face cúbica.

a - célula unitária de cristal de NaCl; b - empacotamento cúbico de face centrada densa de NaCl; c - empacotamento cúbico de corpo centrado do cristal CsCl Figura Figura 7.3 - Célula unitária
Substâncias isomórficas- substâncias de natureza química semelhante, formando as mesmas estruturas cristalinas: CaSiO 4 e MgSiO 4
Polimorfismo– compostos que existem em duas ou mais estruturas cristalinas, como SiO 2 (como quartzo hexagonal, tridimita rômbica e cristobalita cúbica).
Modificações alotrópicas- modificações polimórficas de substâncias simples, por exemplo, carbono: diamante, grafite, carabina, fulereno.
De acordo com a natureza das partículas nos nós da rede cristalina e as ligações químicas entre elas, os cristais são divididos em:
1) molecular- nos nós existem moléculas, entre as quais atuam as forças de van der Waals, que possuem baixa energia: cristais de gelo;
2) atomicamente- cristais covalentes- nos nós dos cristais existem átomos que formam fortes ligações covalentes entre si, possuem alta energia de rede, por exemplo, diamante (carbono);
3) cristais iônicos– as unidades estruturais de cristais deste tipo são íons carregados positivamente e negativamente, entre os quais ocorre uma interação elétrica, caracterizada por uma energia suficientemente alta, por exemplo, NaCL, KCL;
4) cristais de metal- substâncias que possuem alta condutividade elétrica, condutividade térmica, maleabilidade, plasticidade, brilho metálico e alta refletividade em relação à luz; a ligação nos cristais é metálica, a energia da ligação metálica é intermediária entre as energias dos cristais covalentes e moleculares;
5) cristais de ligação mista– existem interações complexas entre partículas que podem ser descritas pela sobreposição de dois ou mais tipos de ligações umas sobre as outras, por exemplo, clatratos (compostos incluídos) – formados pela inclusão de moléculas (hóspedes) na cavidade de um cristal estrutura composta por partículas de um tipo diferente (hospedeiros): clatratos de gás CH quatro . 6H2O, clatratos de ureia.
Na natureza, a água existe em três estados:
- estado sólido (neve, granizo, gelo);
- estado líquido (água, neblina, orvalho e chuva);
- estado gasoso (vapor).
Desde a primeira infância, na escola, eles estudam diferentes estados agregados da água: neblina, chuva, granizo, neve, gelo, etc. Há aqueles que são estudados detalhadamente na escola. Eles nos encontram todos os dias na vida e afetam a vida. - este é o estado da água em um determinado regime de temperatura e pressão, caracterizado dentro de um determinado intervalo.
Os conceitos básicos do estado da água devem ser esclarecidos que o estado de neblina e o estado nublado não se aplicam à formação de gás. Eles aparecem durante a condensação. Esta é uma propriedade única da água que pode estar em três diferentes estados de agregação. Três estados da água são vitais para o planeta, eles formam um ciclo hidrológico, proporcionam o processo do ciclo da água na natureza. A escola mostra vários experimentos sobre evaporação e. Em qualquer canto da natureza, a água é considerada a fonte da vida. Existe um quarto estado, não menos importante - água Deryaginskaya (versão russa), ou como é comumente chamada no momento - água Nanotube (versão americana).
estado sólido da água
A forma e o volume são preservados. Em baixas temperaturas, a substância congela e se transforma em um sólido. Se a pressão for alta, então a temperatura de solidificação é necessária mais alta. Os sólidos podem ser cristalinos ou amorfos. Em um cristal, a posição de um átomo é estritamente ordenada. As formas dos cristais são naturais e lembram um poliedro. Em um corpo amorfo, os pontos estão localizados aleatoriamente e oscilam, apenas a ordem de curto alcance é preservada neles.
Estado líquido da água
No estado líquido, a água mantém seu volume, mas sua forma não é preservada. Por isso ele entende que o líquido ocupa apenas uma parte do volume, podendo fluir por toda a superfície. Ao estudar as questões do estado líquido na escola, deve-se entender que este é um estado intermediário entre um meio sólido e um meio gasoso. Os líquidos são divididos em estados puros e de mistura. Algumas misturas são muito importantes para a vida, como o sangue ou a água do mar. Os líquidos podem atuar como solventes.
Condição do gás
A forma e o volume não são preservados. De outra forma, o estado gasoso, cujo estudo ocorre na escola, é chamado de vapor d'água. Experimentos mostram claramente que o vapor é invisível, é solúvel no ar e apresenta umidade relativa. A solubilidade depende da temperatura e da pressão. Vapor saturado e ponto de orvalho é um indicador da concentração máxima. Vapor e neblina são diferentes estados de agregação.
O quarto estado de agregação é o plasma
O estudo do plasma e experimentos modernos começaram a ser considerados um pouco mais tarde. O plasma é um gás total ou parcialmente ionizado, ocorre em estado de equilíbrio a alta temperatura. Sob condições de terra, uma descarga de gás é formada. As propriedades de um plasma determinam seu estado gasoso, exceto que a eletrodinâmica desempenha um grande papel em tudo isso. Entre os estados de agregação, o plasma é o mais comum no Universo. O estudo das estrelas e do espaço interplanetário mostrou que as substâncias estão no estado de plasma.
Como os estados agregados mudam?
Mudando o processo de transição de um estado para outro:
- líquido - vapor (evaporação e ebulição);
- vapor - líquido (condensação);
- líquido - gelo (cristalização);
- gelo - líquido (derretimento);
- gelo - vapor (sublimação);
- vapor - gelo, formação de gelo (dessublimação).
 A água é nomeada um mineral terrestre natural interessante. Essas questões são complexas e é necessário um estudo constante. O estado agregado na escola é confirmado pelos experimentos realizados e, se surgirem dúvidas, os experimentos possibilitam claramente a compreensão do material contado na lição. Durante a evaporação, o líquido passa, o processo já pode começar a partir de zero graus. À medida que a temperatura aumenta, ela aumenta. A intensidade disso é confirmada pelos experimentos de ebulição a 100 graus. As questões de evaporação são respondidas na evaporação das superfícies de lagos, rios e até mesmo da terra. Quando resfriado, obtém-se um processo de transformação reversa, quando um líquido é formado a partir de um gás. Esse processo é chamado de condensação, quando pequenas gotículas de uma nuvem se formam a partir do vapor de água no ar.
A água é nomeada um mineral terrestre natural interessante. Essas questões são complexas e é necessário um estudo constante. O estado agregado na escola é confirmado pelos experimentos realizados e, se surgirem dúvidas, os experimentos possibilitam claramente a compreensão do material contado na lição. Durante a evaporação, o líquido passa, o processo já pode começar a partir de zero graus. À medida que a temperatura aumenta, ela aumenta. A intensidade disso é confirmada pelos experimentos de ebulição a 100 graus. As questões de evaporação são respondidas na evaporação das superfícies de lagos, rios e até mesmo da terra. Quando resfriado, obtém-se um processo de transformação reversa, quando um líquido é formado a partir de um gás. Esse processo é chamado de condensação, quando pequenas gotículas de uma nuvem se formam a partir do vapor de água no ar.
Um exemplo marcante é um termômetro de mercúrio, no qual o mercúrio é apresentado no estado líquido, a uma temperatura de -39 graus o mercúrio se torna um sólido. É possível alterar o estado de um corpo rígido, mas isso exigirá esforço adicional, por exemplo, ao dobrar um prego. Muitas vezes, os alunos fazem perguntas sobre como um corpo sólido é moldado. Isso é feito em fábricas e oficinas especializadas usando equipamentos especiais. Absolutamente qualquer substância pode existir em três estados, incluindo a água, depende das condições físicas. Quando a água passa de um estado para outro, o arranjo molecular e o movimento mudam, a composição da molécula não muda. Tarefas experimentais ajudarão a observar esses estados interessantes.