آیا مسافت طی شده توسط مولکول تغییر می کند؟ سوال قطر موثر یک مولکول حداقل فاصله ای است که مراکز دو مولکول در هنگام برخورد به آن نزدیک می شوند. سرعت متوسط حرکت حرارتی مولکولها
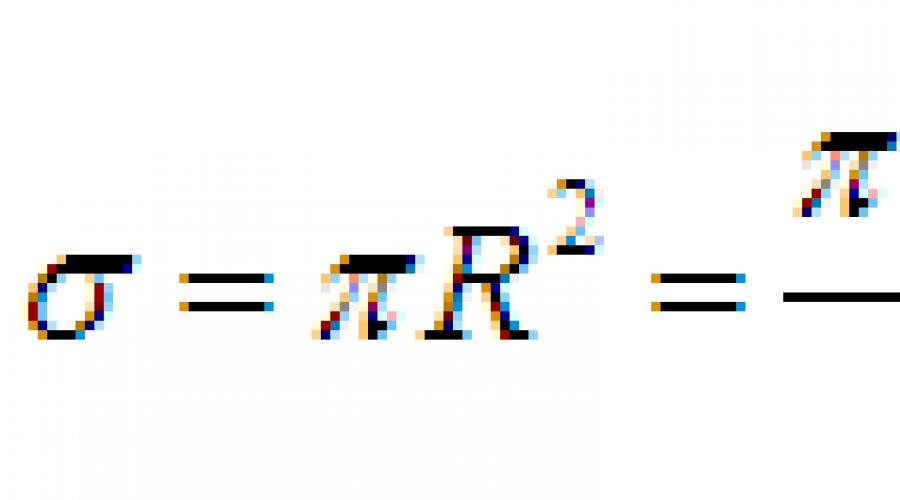
قطر مولکولی موثر - حداقل فاصله ای که در آن مراکز دو مولکول در هنگام برخورد به یکدیگر نزدیک می شوند.
میانگین تعداد برخوردها و میانگین مسیر آزاد مولکولها
سرعت متوسط مولکول ها و گازها بسیار زیاد است - در شرایط عادی حدود صدها متر در ثانیه. با این حال، روند تسطیح ناهمگنی در گاز به دلیل حرکت مولکولی بسیار کند پیش می رود. این به این دلیل است که هنگام حرکت مولکول ها با مولکول های دیگر برخورد می کنند. با هر برخورد، سرعت مولکول در قدر و جهت تغییر می کند. در نتیجه سرعت انتشار یک مولکول از یک قسمت گاز به قسمت دیگر بسیار کمتر از سرعت متوسط حرکت مولکولی است. برای تخمین سرعت حرکت مولکول ها، مفهوم مسیر آزاد متوسط معرفی شده است. بنابراین، میانگین مسیر آزاد میانگین مسافتی است که یک مولکول از برخوردی به برخورد دیگر طی می کند.
برای تعیین، ابتدا میانگین تعداد برخورد مولکول انتخاب شده با مولکول های دیگر را در واحد زمان محاسبه می کنیم. ما فرض می کنیم که مولکول پس از برخورد به حرکت در یک خط مستقیم با سرعت متوسط حرکت ادامه می دهد.
مولکول هایی که مولکول انتخاب شده با آنها برخورد می کند در تقریب اول بی حرکت در نظر گرفته می شوند و به عنوان اجسام کروی با شعاع r در نظر گرفته می شوند. اجازه دهید مولکول انتخاب شده از موقعیتی به موقعیت دیگر در یک خط مستقیم به سمت راست حرکت کند (شکل 11.3). در طول حرکت، برخورد با مولکولهای بیحرکتی را تجربه میکند که مراکز آنها بیش از 2r از مسیر حرکت نمیکنند. به عبارت دیگر، مولکولی که با سرعت متوسط در طول یک ثانیه حرکت میکند، با تمام مولکولهایی برخورد میکند که مرکز آنها در حجمی است که توسط استوانهای با شعاع 2r و طول محدود میشود، یعنی.
اگر غلظت مولکول ها n باشد، در داخل استوانه در نظر گرفته شده تعدادی مولکول برابر با
این عدد میانگین تعداد برخوردها را در واحد زمان تعیین می کند.
این فرض که همه مولکول ها به جز یکی از آنها بی حرکت هستند، البته درست نیست. در حقیقت، همه مولکول ها در حال حرکت هستند و احتمال برخورد دو ذره به سرعت نسبی آنها بستگی دارد. بنابراین به جای سرعت میانگین حسابی باید میانگین سرعت نسبی مولکول ها را در نظر گرفت. اگر سرعت مولکول ها بر اساس قانون ماکسول توزیع شود، همانطور که نشان داده می شود، میانگین سرعت نسبی دو مولکول یک گاز همگن چند برابر بیشتر است. بنابراین، میانگین تعداد برخوردها باید با یک عامل افزایش یابد
بنابراین، مسیر آزاد متوسط به دمای گاز بستگی ندارد، زیرا با افزایش دما، هر دو و، و همچنین به طور همزمان افزایش می یابد. هنگام محاسبه تعداد برخوردها و میانگین مسیر آزاد مولکولها، یک جسم کروی الاستیک به عنوان مدل مولکول در نظر گرفته شد. در واقع، هر مولکول یک سیستم پیچیده از ذرات بنیادی است و هنگام در نظر گرفتن برخورد کشسانی مولکول ها، منظور این بود که مراکز مولکول ها می توانند تا حداقل فاصله معینی به یکدیگر نزدیک شوند. سپس نیروهای دافعه ای وجود دارند که برهمکنشی مشابه برهمکنش در هنگام ضربه الاستیک ایجاد می کنند. فاصله متوسط بین مراکز مولکولهایی که در حال تعامل هستند، مانند ضربه الاستیک، قطر مؤثر نامیده میشود. سپس
کار آزمایشی با موضوع "اطلاعات اولیه در مورد ساختار ماده".
انتخاب 1
قسمت 1.
A1.کوچکترین ذرات تشکیل دهنده مواد مختلف را ...
الف. اتم ها ب. مولکول ها ج. یون ها
A2. مولکول های مواد مختلف ...
ب- پاسخ بدون ابهام نمی توان داد.
A3.وقتی گرم می شود، حجم بدن ...
الف- تغییر نمی کند ب- افزایش می دهد ج- کاهش می یابد
A4.انتشار در چه حالت هایی از ماده می تواند رخ دهد؟
الف- فقط در گازها ب- در مایعات و گازها
ب- در گازها، مایعات و جامدات.
A5.کدام یک از خواص زیر متعلق به مایعات است؟
الف. شکل خاص خود را دارند ب. حجم را حفظ می کنند
A6.مولکول های جامدات چگونه مرتب شده اند؟
A7.هوا در چه حالتی می تواند باشد؟
الف. فقط در گاز ب. فقط در مایع
قسمت 2.
در 1.آیا اگر مقدار معینی گاز از سیلندری که گاز در آن قرار دارد آزاد شود، فاصله ای که یک مولکول گاز از یک برخورد به برخورد بعدی طی می کند، تغییر می کند؟
در 2.شکر در آب گرم سریعتر از آب سرد حل می شود. چرا؟
قسمت 3
C1.برای شکستن یک تکه سیم نیروی زیادی لازم است. با این حال، اگر سیم را در شعله یک مشعل گرم کنید، شکستن آن بسیار آسان تر است. چرا؟
گزینه 2
A1.مولکول های یک ماده ...
الف- با هم فرقی ندارند ب- با هم فرق دارند
ب- به حالت ماده بستگی دارد.
A2.وقتی خنک شود، حجم بدن ...
الف-افزایش می دهد ب-کاهش ج-تغییر نمی کند
A3.چگونه انتشار به دما بستگی دارد؟
الف. این فرآیند با افزایش دما تسریع می یابد
ب- با افزایش دما، این روند کند می شود
ب- فرآیند مستقل از تغییرات دما است.
A4.کدام یک از خواص زیر متعلق به گازها است؟
الف- آنها شکل خاص خود را دارند. ب-حجم را حفظ کنید
ب- شکل و حجم خاص خود را نداشته باشند
A5.مولکول های مایعات چگونه مرتب شده اند؟
الف- در فاصله زیاد از یکدیگر
ب- در فواصل طولانی از هم جدا نشوید
ب- به ترتیب معینی تنظیم شده است.
A6.فولاد در چه وضعیتی است؟
الف. فقط در جامد ب. فقط در مایع
ب- در حالت جامد، مایع و گاز.
A7.یخ آب شد و تبدیل به آب شد. آیا خود مولکول های یخ تغییر کرده اند؟
A. نه، آنها نکرده اند. ب- بله دارند. ب- پاسخ قطعی وجود ندارد.
قسمت 2.
در 1.یک قطره روغن روی سطح آب پخش می شود و یک لایه نازک تشکیل می دهد. کمترین ضخامت این فیلم چقدر می تواند باشد؟
در 2.آیا سیم های خطوط برق هنگام معلق بودن در تابستان و زمستان یکسان کشیده می شوند؟
قسمت 3
C1.چرا درآوردن جوراب یا جوراب خیس سخت است؟
پاسخ ها.
|
شماره شغل | |||||||
کار تستی با موضوع "برهم کنش اجسام".
انتخاب 1
قسمت 1.
A1.کدام یک از حرکات زیر یکنواخت است؟
الف- حرکت زمین حول محور خود. ب- حرکت آونگ بر حسب ساعت.
ب- حرکت خودرو در هنگام شتاب گیری.
A2.مسیر پرش اسکی باز از پرش اسکی چگونه است؟
الف-خط مستقیم ب-خط منحنی ج-دایره
A3.کدام یک از عبارات زیر به شما امکان می دهد مسافت طی شده را با حرکت یکنواخت محاسبه کنید؟
A. s=v/t ب. s=vt ج. s=t/v
A4.یک موتورسوار با سرعت 72 کیلومتر در ساعت و یک اتوبوس با سرعت 20 متر بر ثانیه حرکت می کند. کدام یک از این اجسام سریعتر حرکت می کنند؟
الف- اتوبوس ب- موتورسوار ج- به همین ترتیب حرکت می کنند.
A5.آیا در صورت توقف عمل اجسام دیگر بر روی آن، سرعت جسم تغییر می کند؟
A. تغییر نخواهد کرد. ب- افزایش ب- کاهش.
A6.چگالی یک ماده نشان می دهد ...
الف- جرم یک ماده در حجم 1m 3 چقدر است.
ب- حجم 1 کیلوگرم ماده چقدر است.
س- جرم یک ماده در حجم 1 لیتر چقدر است؟
A7.ترازو با قرار دادن بدن روی یک ترازو و کل وزنه های نشان داده شده در شکل روی ترازو دیگر متعادل شد. جرم بدن ...
A. 10.99 گرم B. 11.09 گرم C. 11.90 گرم
صحبت از یک گاز ایده آل، از این واقعیت است که مولکول ها با یکدیگر تعامل ندارند. در واقع، البته قرار بر این بود که هیچ انرژی بالقوه ای برای تعامل بین آنها وجود نداشته باشد. برخورد الاستیک بین مولکول ها و مولکول ها با دیواره ها لزوماً باید اتفاق بیفتد، زیرا در غیر این صورت مکانیسمی وجود نخواهد داشت که توسط آن توزیع برابر انرژی در درجات آزادی ایجاد شود، در غیر این صورت صحبت در مورد دمای سیستم، فشار غیرممکن خواهد بود. در آن، و غیره. برخورد مولکول ها به طور تصادفی اتفاق می افتد. آنها منجر به تغییر جهت و بزرگی سرعت ذرات می شوند، اما توزیع مولکول ها را بر روی سرعت ها و مختصات در سیستم های تعادلی تغییر نمی دهند.
این سوال مطرح می شود: آیا مولکول ها همیشه با یکدیگر برخورد می کنند؟ از این گذشته، مولکول ها بسیار کوچک هستند و فواصل بین آنها در یک گاز ایده آل مرتبه ای بزرگتر از ابعاد خطی آنها است. شاید برای کشتی های با اندازه های کوچک، آنها بدون برخورد از دیوار به دیوار پرواز می کنند؟ اجازه دهید محاسبه کنیم که یک مولکول در واحد زمان چند بار می تواند با مولکول های دیگر برخورد کند و به طور متوسط چه فاصله ای بین برخوردها طی می کند.
قبل از شروع محاسبات، اجازه دهید ساده ترین مدل را برای مولکول ها در نظر بگیریم. ما آنها را به شکل توپ های الاستیک نشان خواهیم داد. در برخورد مولکول های با قطر موثر d1و d2مراکز آنها به یکدیگر نزدیک می شوند (d 1 + d 2)/2(شکل 4.2).
برنج. 4.2. برخورد دو مولکول (1) و مسیر حرکت مولکول گاز انتخاب شده (2): جهت حرکت آن زمانی تغییر می کند که یکی از مولکول های محیط به شعاع برهمکنش بیفتد.آر = (dt + د 2 )/2
اگر تصور کنیم که مولکول 1 برخورد با یک مولکول 2 ، سپس یک برخورد رخ خواهد داد. اگر اولین مولکول به یک کره شعاع سقوط کند
در اطراف مولکول دوم توضیح داده شده است. ناحیه مقطعی این کره

مقدار آرتماس گرفت شعاع موثر برهمکنش مولکول ها 1 و 2 ، آ - مقطع تعامل موثر این مولکول ها وقتی مولکول های یکسان با هم برخورد می کنند d 1 \u003d d 2 \u003d d, R \u003d dو
در طول زمان بین دو برخورد متوالی، مولکول مسیر خاصی را طی می کند ل. البته برای هر مولکول منفرد یک موضوع شانسی است که می تواند بدون برخورد تا کجا پیش برود. اما میانگین مسیر لدر تمام مولکول های سیستم، کمیت فیزیکی را به دست می آوریم
تماس گرفت مسیر آزاد متوسط مولکول ها. معنی آماری این کمیت به شرح زیر است: نسبت یک قطعه کوچک از طول dx k احتمال برخورد را نشان می دهد
در یک راه dx. بگذار باشد P(x) -احتمال پرواز بدون برخورد ایکس.سپس
![]()
- احتمال پرواز مسافتی بدون برخورد x + dx.آخرین رویداد شامل دو رویداد مستقل است:
این ذره بدون برخورد پرواز کرد ایکس(که احتمال آن است P(x))؛
این ذره همچنین بر بخش کوچکی از مسیر بدون برخورد غلبه کرد dx(که احتمال آن است 1-dx/). با قضیه ضرب احتمالات، داریم

از آنجا معادله احتمال را دنبال می کند P(x)
از آنجایی که احتمال غلبه بر مسافت صفر بدون برخورد برابر با یک است، یک شرط اولیه اضافی داریم. P(0) = 1. با ادغام معادله دیفرانسیل، در نهایت پیدا می کنیم
|
|
همانطور که می بینید، مسیر طولانی تر است ایکس،کمتر احتمال دارد که بدون برخورد بر آن غلبه کند.
بگذارید اکنون مطمئن شویم که - درست یعنی مسیر آزاد اجازه دهید محاسبه کنیم که مولکول با چه احتمالی مسیر آزاد متوسطی خواهد داشت ل. این بدان معناست که ذره مسافتی را بدون برخورد طی کرده است. x = l(احتمال آنچه هست Р(l)) و مستقیماً در پشت آن با ذره دیگری برخورد کرد - در بخش کوچکی از طول dl(احتمال آن را می توان به صورت dl/). احتمال dwچنین رویدادی، با توجه به قضیه ضرب احتمال، برابر است با
![]()
سپس مسیر آزاد متوسط را پیدا می کنیم
|
|
البته نباید فکر کرد که احتمال غلبه بر فاصله وجود دارد لبدون برخورد صفر است: برخی از مولکول ها می توانند مسافت های بسیار طولانی را طی کنند، اما فقط بخش بسیار کوچکی از آنها. در x =،به شرح زیر از (4.1)، احتمال عبور بدون برخورد برابر است با
![]()
یعنی 63,2 % ذرات در طول مسیر برخورد خواهند داشت. با طول مسیر x = 2ما گرفتیم
![]()
یعنی برخوردها از قبل مقدر شده است 86,5 % ذرات، در x = 3 قبلاً درگیر درگیری ها شده بود 95 % ذرات، زیرا
![]()
برای تعیین میانگین تعداد برخوردها nیک مولکول با مولکول های دیگر در واحد زمان، مفروضات زیر را انجام می دهیم:
همه مولکول ها یکسان هستند، یعنی ما مخلوط گازها را در نظر نمی گیریم.
همه مولکول ها، به استثنای موردی که مشاهده می کنیم، بی حرکت هستند (بعداً نشان خواهیم داد که چگونه از شر این فرض آشکارا نادرست خلاص شویم).
سرعت برخورد v OTمولکول تغییر نمی کند (این فرض، در اصل، همان سطح قبلی است: در یک برخورد الاستیک با مانعی که بی حرکت می ماند، مدول سرعت واقعاً تغییر نمی کند (معنای زیرنویس "از" روشن خواهد شد بعد)).
مسیر مولکول ما قطر است دتا زمانی که با یک مولکول بی حرکت روبرو شود که مرکز آن در فاصله کمتر از R = d.پس از آن، مولکول جهت حرکت را تغییر می دهد و تا یک برخورد جدید در یک خط مستقیم حرکت می کند. برای یک بازه زمانی ∆ تیمولکول مسیر شکسته ای را در پیش خواهد گرفت VOT ∆ تیو با تمام مولکول هایی که در یک استوانه شکسته با شعاع قرار می گیرند برخورد خواهد کرد دو مساحت پایه = pd 2(شکل 4.1 را ببینید). حجم این سیلندر است pd 2 v OT ∆ تیاگر یک n-غلظت مولکول ها در سیستم (تعداد آنها در واحد حجم)، به راحتی می توان تعداد مولکول های بی حرکت در سیلندر، یعنی تعداد برخوردها را پیدا کرد. DN:
![]()
این به معنی فراوانی برخوردها (یعنی تعداد برخورد در واحد زمان) است.
|
|
اکنون اجازه دهید از عواقب این فرض که مولکول ها بی حرکت هستند خلاص شویم. بیایید مولکول را دنبال کنیم 1 ، که با سرعت در حال حرکت است v1، و با مولکول برخورد می کند 2 ، که سرعت دارد v2. در چارچوب مرجع مرتبط با مولکول دوم، ثابت است، اما مولکول اول دارای سرعت است.
اکنون مشخص است که این مقدار متوسط سرعت نسبی مولکول ها است که نقش سرعت را بازی می کند. v FROMکه در استخراج رابطه (4.3) برای فرکانس برخورد استفاده کردیم. آن وقت داریم
جایی که 𝜃 12 زاویه بین جهات حرکت مولکولی است. به دلیل تصادفی بودن حرکت، این زاویه به همان اندازه احتمال دارد که هر مقداری را بگیرد، به طوری که مقدار میانگین کسینوس آن صفر است. و میانگین گیری مجذور سرعت ها منجر به ظهور سرعت ریشه-میانگین-مربع مولکول ها می شود.
![]()
از فصل قبل برای ما آشناست. ما در پایان دریافت می کنیم که
و فرمول (4.3) به شکل نهایی نوشته شده است
توجه داشته باشید که با رفتن از سرعت مولکول به سرعت ریشه-میانگین مربع آن، در واقع از شر فرض سوم نیز خلاص می شویم، زیرا vKBثابت در دمای معین
با دانستن فراوانی برخوردها، می توانید میانگین مسیر آزاد را پیدا کنید. در واقع، میانگین زمان بین دو برخورد متوالی = 1/n، و در این مدت ذره به طور متوسط مسیر را طی می کند = vKBتی. بنابراین، میانگین مسیر آزاد یک مولکول گاز است
|
|
از آنجایی که در دمای ثابت غلظت ذرات متناسب با فشار است، میانگین مسیر آزاد با افزایش فشار کاهش می یابد. این قابل درک است، زیرا فاصله متوسط بین ذرات کاهش می یابد. در واقع، مولکول یک توپ جامد نیست. بنابراین قطر موثر آن د-مقدار کاملاً ثابت نیست: با افزایش دما کاهش می یابد، اگرچه فقط اندکی. بنابراین، میانگین مسیر آزاد با افزایش دما اندکی افزایش می یابد.
لازم به ذکر است که فاصله متوسط بین ذرات با میانگین مسیر آزاد بسیار دور است. قبلاً، قطر مؤثر یک مولکول بخار آب را تخمین زدیم d=3· 10-10 مترو میانگین فاصله بین مولکول ها در شرایط عادی L=3· 10-9 متر. از اینجا غلظت مولکول ها را می یابیم
![]()
جایگزین پیدا شد nبه بیان مسیر آزاد متوسط، می یابیم
می بینیم که مسیر آزاد متوسط در 200 باربزرگتر از قطر مولکولی و 20 باربزرگتر از فاصله متوسط بین مولکولها برای تکمیل تصویر، فرکانس برخوردها را نیز تخمین می زنیم. انرژی جنبشی حرکت انتقالی یک مولکول
![]()
دانستن جرم یک مولکول آب

ما یک تخمین از ریشه میانگین سرعت مربع بدست می آوریم

در نهایت تعریف می کنیم
![]()
به عبارت دیگر، مولکول تجربه می کند 10 میلیاردبرخورد در ثانیه! اندازه خطی یک ظرف حاوی یک لیتر گاز است l = 10 سانتی متر = 0.1 متر. با سرعت 630 متر بر ثانیهاین مولکول می تواند در زمان از دیواری به دیوار دیگر حرکت کند

اما در این مدت او تجربه خواهد کرد
![]()
برخورد با مولکول های دیگر
ما اولین فرض را در مورد هویت همه مولکول ها بدون بحث گذاشته ایم. نه به دلایل اساسی، بلکه برای ساده کردن اشتقاق و عبارات نهایی لازم بود. اگر اینطور نباشد، اگر مخلوطی از گازها را در نظر بگیریم، اجزاء دارای غلظت ذرات متفاوت، سرعت ریشه-میانگین مربع متفاوت هستند و مولکول های آنها جرم های متفاوتی دارند. در نتیجه، فرمول مسیر آزاد میانگین تغییر خواهد کرد و نتایج برای آن متفاوت خواهد بود مولکول های مختلف.
مثال.بیایید دریابیم که چگونه فرمول (4.6) برای میانگین مسیر آزاد مولکولها تغییر میکند اگر آنها دیسکهای مسطحی هستند که در ماده یک لایه نازک حرکت میکنند و قادر به پرواز از آن نیستند؟
مانند قبل، برای برخورد مولکول ها با قطر d1و d2آنها باید نزدیک تر شوند
بنابراین، هنگامی که یک مولکول در امتداد صفحه فیلم حرکت می کند، به تمام مولکول های دیگر که در یک مستطیل شکسته قرار می گیرند (بر خلاف یک استوانه در حالت سه بعدی) با عرض برخورد می کند. 2Rو طول VOT ∆ تیمساحت این مستطیل
![]()
در غلظت سطح nمولکول ها (در این مورد n- تعداد آنها در واحد سطح) رخ خواهد داد ∆ N=Snبرخوردها از این رو، برای فرکانس برخورد، پیدا می کنیم

جایی که ما در نظر گرفتیم که مانند قبل، سرعت نسبی است
از این رو میانگین مسیر آزاد برای در حال حرکت در هواپیمامولکول های مسطح برابر است با

برای همان مولکول ها ( d 1 = d 2 = d)
![]()
یک خرما در جنگل، یک جوجه تیغی در مه و یک بمب اتمی.ایده میانگین مسیر آزاد را می توان برای تخمین دید در جنگل، مه یا حتی تخمین تقریبی جرم بحرانی اورانیوم در یک بمب اتمی استفاده کرد.
تصور کنید که در جنگل یک خرما دارید. حداکثر فاصله چقدر است آرآیا متوجه شریک زندگی خود (و شریک زندگی خود - شما) خواهید شد؟ فرض کنید چراغ قوه را روشن کرده اید تا به او سیگنال بدهید. اگر پراکندگی نور را در نظر نگیرید، همه درختان سایه هایی ایجاد می کنند که اندازه خطی آن را می توان تقریباً برابر با قطر در نظر گرفت. ددرختان. روی انجیر 4.3 مکان شما با یک دایره قرمز مشخص شده است، یک دایره با شعاع اطراف آن کشیده شده است R،درختان به صورت دایره های سبز نشان داده شده اند و سایه های آنها روی دایره با کمان های نارنجی مشخص شده است.

برنج. 4.3. تخمین حداکثر فاصلهآر دید در جنگل
بیایید تعیین کنیم که سایه ها چه بخشی از دایره را می پوشانند. بگذار باشد nتراکم کاشت درختان (تعداد آنها در واحد سطح). اگر یک لپس میانگین فاصله بین درختان است
داخل دایره است pR2nدرختان. بنابراین طول کل سایه روی دایره است pR 2.می بینیم که طول کل سایه به عنوان مربع شعاع و در مقداری افزایش می یابد آراز محیط فراتر می رود 2pR.اما اگر کل دایره با سایه ها پوشانده شود، نور بیشتر نخواهد گذشت. این مقدار آرو حداکثر فاصله دید در جنگل خواهد بود. اکنون مشخص است که از برابری مشخص می شود
![]()
یعنی دریافت کرده ایم

برای مثال عددی، می توانید مقادیری را بر اساس تجربه زندگی خود در نظر بگیرید. فرض کنید در میان درختان توس با قطر تنه متوسط خرما تعیین شده است d = 0.25 مترو میانگین فاصله بین درختان l = 10 متر. سپس پیدا می کنیم R = 800 متر.
اکنون اجازه دهید بین نتیجه به دست آمده و فرمول مسیر آزاد میانگین ارتباط برقرار کنیم. ما یک مولکول داریم (پرتو نور) اندازه ندارد ( d1 = 0اندازه مولکول های دیگر برابر است با قطر متوسط ساقه ( d2 = d) و در نهایت مولکول ها (تنه ها) در حالت استراحت هستند، یعنی باید فاکتور را دور بریزیم. ما در نتیجه - در رابطه با وظیفه خود - بیان می کنیم
بنابراین، شعاع دید ما پیدا کردیم
این احتمال وجود دارد که نور بدون "برخورد" با درختان این فاصله را طی کند

به عبارت دیگر، با یک احتمال 86.5 % نور توسط درختان مسدود خواهد شد.
ملاقات در جنگل در هواپیما انجام شد. اکنون به دنیای حجمی باز خواهیم گشت. همین شکل اکنون کره ای را با شعاع نشان می دهد آرو موانع به شکل توپ با قطر دبه عنوان مثال، ما می خواهیم دید جوجه تیغی را که در مه گم شده است، ارزیابی کنیم و اکنون قطرات آب نقش درختان را بازی می کنند. اگر غلظت قطرات باشد پ(تعداد آنها در واحد حجم)، سپس در داخل کره است
![]()
سایه های آنها روی کره دایره هایی با مساحت است pd 2/4.در حداکثر فاصله دید، سایه ها کل کره را می پوشانند:

از اینجا فاصله دید در مه را پیدا می کنیم
اجازه دهید دوباره این نتیجه را با فرمول (4.6) برای میانگین مسیر آزاد یک مولکول در یک محیط گازی مقایسه کنیم، جایی که باید فاکتور را دور بیندازیم و بگیریم.

ما گرفتیم
![]()
احتمال غلبه بر مسیر R = 3 لیتربدون برخورد برابر است با

بنابراین، احتمال دارد 95 % یک برخورد در طول راه رخ خواهد داد.
ما یک تخمین عددی دریافت می کنیم. استدلال ما در صورتی معتبر است که اندازه قطرات به طور قابل توجهی (مثلاً یک یا دو مرتبه بزرگی) از طول موج نور بیشتر شود. از آنجایی که محدوده مرئی دارای طول موج است 0.40-0.76 میکرومتر، سپس برای قطر قطره تخمین می زنیم d = 10-4 متر. برای غلظت قطره ها، مقدار را می گیریم n=3· 10 7 متر – 3 (برای منبع این عدد به زیر مراجعه کنید.) سپس دید در مه خواهد بود

غلظت قطرات را به صورت زیر تخمین زدیم. فشار بخار آب اشباع شده مثلاً در 20 درجه سانتی گراد (T = 293 K) برابر است pH = 2.3· 10 3 Pa. با استفاده از معادله کلاپیرون - مندلیف، چگالی بخار آب را در مییابیم 100 % رطوبت:
با کاهش شدید دما، تمام بخار به قطرات با اندازه مشخص متراکم می شود - یک مه غلیظ تشکیل می شود. جرم یک قطره است

تعداد قطرات تشکیل شده در حجم Vما به عنوان نسبت جرم بخار پیدا می کنیم متربه جرم قطره m CAP.سپس غلظت قطره ها از رابطه مشخص می شود

در d = 10-4 مترمقدار استفاده شده در بالا را دریافت می کنیم n=3· 10–7 متر–3.
بنابراین وابستگی فاصله دید در مه به اندازه قطرات توسط رابطه داده می شود

برای قطرات بسیار کوچک با قطر حدود ده طول موج نور d = 10 - 5 متردید به یک متر کاهش می یابد. چیزی که به آن گفته می شود، "شما نمی توانید فراتر از بینی خود را ببینید." در اندازه های حتی کوچکتر قطرات، مدل ما نادرست می شود، زیرا دیگر نمی توان نور را صرفاً به عنوان مجموعه ای از ذرات با اندازه ناچیز در نظر گرفت. اثرات پراش شروع به ایفای نقش می کنند و بیان سطح مقطع موثر برای برهمکنش نور با قطره ها دیگر توسط مقطع هندسی خالص قطره ها تعیین نمی شود.
مشکل حل شده همچنین مربوط به جرم بحرانی اورانیوم 235 مورد استفاده برای ساخت بمب اتمی است. به جای نور در این مسئله، ما نوترون داریم و به جای قطره، 235 هسته U داریم. در برخورد با هسته ها، نوترون ها آنها را به قطعات تقسیم می کنند و 3 تا 4 نوترون دیگر به بیرون پرواز می کنند. در شعاع بحرانی R critتعداد نوترون ها کاهش نمی یابد و یک واکنش زنجیره ای خودپایدار رخ می دهد - یک انفجار اتمی رخ می دهد. شعاع دید را می توان به عنوان مبنایی برای تعیین شعاع بحرانی در نظر گرفت
و جرم بحرانی M crit
ما متذکر می شویم که هیچ اسرار تولید سلاح های هسته ای را فاش نمی کنیم: این تخمین ها بسیار خشن هستند. تنها هدف ما این است که یک بار دیگر وحدت قوانین فیزیک را که در متنوع ترین سیستم ها عمل می کنند نشان دهیم.
« فیزیک - کلاس 10 "
آیا می توان با دانستن دما، میانگین انرژی جنبشی مولکول های گاز را محاسبه کرد؟ سرعت متوسط مولکول؟
آیا این سرعت قابل اندازه گیری است؟
سرعت متوسط حرکت حرارتی مولکولها.
معادله (9.16) امکان یافتن مجذور میانگین سرعت مولکول را فراهم می کند. با جایگزینی این معادله، عبارتی را برای مقدار میانگین مربع سرعت بدست می آوریم:
میانگین سرعت مربع مقدار است

با محاسبه با فرمول (9.19) سرعت مولکول ها، به عنوان مثال نیتروژن در t = 0 درجه سانتی گراد، به دست می آوریم. ![]() مولکول های هیدروژن در یک دما دارای سرعت ریشه-میانگین مربع هستند
مولکول های هیدروژن در یک دما دارای سرعت ریشه-میانگین مربع هستند ![]() این سرعت ها زیاد است، اما از آنجایی که مولکول های گاز به طور تصادفی حرکت می کنند، دائماً با یکدیگر برخورد می کنند و زمان بین دو برخورد کوتاه است، فاصله مولکول ها نیز کم است. به دلیل برخورد، مسیر حرکت هر مولکول یک خط شکسته درهم است (شکل 9.6). مولکول دارای سرعت بالایی در بخش های مستقیم خط شکسته است. همانطور که از شکل مشخص است، وقتی یک مولکول از نقطه A به نقطه B حرکت می کند، مسیر طی شده توسط آن بسیار بیشتر از فاصله AB است. در فشار اتمسفر، این فاصله حدود 10 -5 سانتی متر است.
این سرعت ها زیاد است، اما از آنجایی که مولکول های گاز به طور تصادفی حرکت می کنند، دائماً با یکدیگر برخورد می کنند و زمان بین دو برخورد کوتاه است، فاصله مولکول ها نیز کم است. به دلیل برخورد، مسیر حرکت هر مولکول یک خط شکسته درهم است (شکل 9.6). مولکول دارای سرعت بالایی در بخش های مستقیم خط شکسته است. همانطور که از شکل مشخص است، وقتی یک مولکول از نقطه A به نقطه B حرکت می کند، مسیر طی شده توسط آن بسیار بیشتر از فاصله AB است. در فشار اتمسفر، این فاصله حدود 10 -5 سانتی متر است.
هنگامی که این اعداد برای اولین بار به دست آمد (نیمه دوم قرن نوزدهم)، بسیاری از فیزیکدانان حیرت زده شدند. طبق محاسبات، سرعت مولکول های گاز بیشتر از سرعت گلوله های توپخانه بود! بر این اساس حتی در مورد اعتبار نظریه جنبشی نیز تردیدهایی مطرح شد. از این گذشته، مشخص است که بوها نسبتاً آهسته پخش می شوند: مدت زمانی در حدود ده ها ثانیه طول می کشد تا بوی عطر ریخته شده در گوشه ای از اتاق به گوشه ای دیگر پخش شود.
تعیین تجربی سرعت مولکول ها. آزمایشها برای تعیین سرعت مولکولها اعتبار فرمول (9.19) را ثابت کردند. یکی از آزمایش ها توسط O. Stern در سال 1920 پیشنهاد و انجام شد.
چه چیزی میانگین انرژی جنبشی حرکت حرارتی مولکول ها را تعیین می کند و چه چیزی ریشه میانگین سرعت مربع این حرکت را تعیین می کند.
دستگاه Stern از دو سیلندر کواکسیال A و B تشکیل شده است که به طور صلب به یکدیگر متصل شده اند (شکل 9.7، a). سیلندرها می توانند با سرعت زاویه ای ثابت بچرخند. یک سیم پلاتین نازک C که با لایه ای از نقره پوشانده شده است، در امتداد محور استوانه کوچک کشیده شده است.
در سال 1943، O. Stern جایزه نوبل فیزیک را برای کمک به توسعه روش های پرتوهای مولکولی و کشف و اندازه گیری گشتاور مغناطیسی پروتون دریافت کرد.
به نظر شما چرا سیم از پلاتین ساخته شده است؟

جریان الکتریکی از سیم عبور می کند. در دیواره این سیلندر یک شیار باریک O وجود دارد که هوا از سیلندرها خارج شده است. سیلندر B در دمای اتاق است. در ابتدا دستگاه ثابت است. هنگامی که جریان از رشته عبور می کند، گرم می شود و در دمای 1200 درجه سانتیگراد اتم های نقره تبخیر می شوند. سیلندر داخلی با گازی از اتم های نقره پر شده است. برخی از اتم ها از شکاف O عبور می کنند و با رسیدن به سطح داخلی استوانه B روی آن رسوب می کنند. در نتیجه، یک نوار باریک D از نقره درست در مقابل شکاف تشکیل می شود (شکل 9.7، ب).
سپس سیلندرها با تعداد زیادی دور n در ثانیه (تا 1500 1/c) به چرخش در می آیند.
حال، در زمان t لازم برای اتم برای طی کردن مسیری برابر با اختلاف بین شعاع استوانههای R B - R A، استوانهها در یک زاویه مشخص φ خواهند چرخید. در نتیجه، اتمهایی که با سرعت ثابت حرکت میکنند، به سطح داخلی استوانه بزرگ دقیقاً در مقابل شکاف O برخورد نمیکنند (شکل 9.7، ج)، اما در فاصله معینی s از انتهای شعاع عبوری از وسط شکاف (شکل 9.7، د): بعد از اینکه همه اتم ها در یک خط مستقیم حرکت می کنند.
اگر مدول سرعت چرخش نقاط روی سطح استوانه بیرونی را با υ B نشان دهیم، آنگاه
s = υ B t = 2 πnR B t. (9.20)
در واقع، اتم های نقره دارای سرعت های متفاوتی هستند. بنابراین، فاصله s برای اتم های مختلف تا حدودی متفاوت خواهد بود. با s باید فاصله بین بخش های روی نوارهای D و D را با بیشترین ضخامت لایه نقره فهمید. این فاصله مطابق با سرعت متوسط اتم ها است که برابر است با ![]()
با جایگزینی مقدار زمان t از عبارت (9.20) به این فرمول، به دست می آوریم
با دانستن n، R A و R B و اندازه گیری میانگین جابجایی نوار نقره ناشی از چرخش ابزار، می توان سرعت متوسط اتم های نقره را یافت.
ماژول های سرعت تعیین شده از تجربه با مقدار نظری ریشه میانگین سرعت مربع منطبق است. این به عنوان یک اثبات تجربی برای صحت فرمول (9.19) و در نتیجه، فرمول (9.16) عمل می کند که طبق آن میانگین انرژی جنبشی یک مولکول با دمای مطلق نسبت مستقیم دارد.


