Что такое массовое число атома. Масса атома
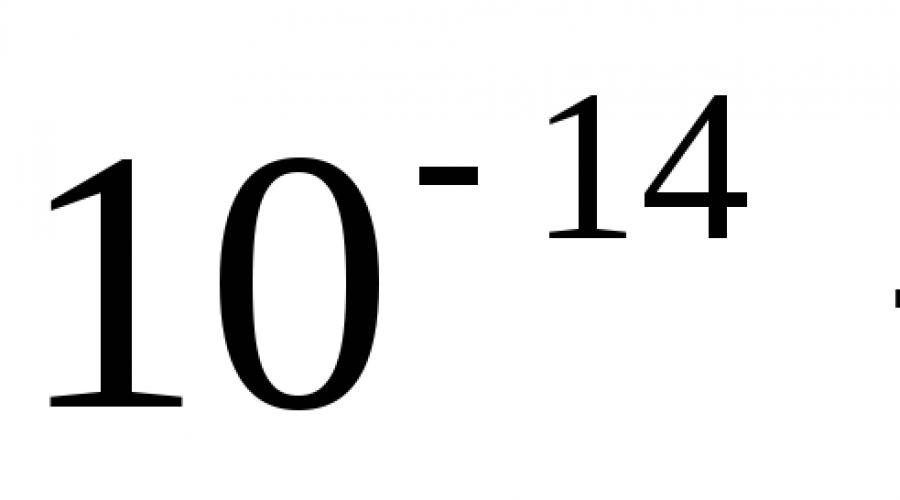
Читайте также
») в ядре. Обычно обозначается буквой A . Массовое число близко к атомной массе изотопа , выраженной в атомных единицах массы , но совпадает с ней только для углерода-12 , поскольку атомная единица массы (а. е. м.) определяется сейчас как 1 ⁄ 12 массы атома 12 С. Во всех остальных случаях атомная масса не является целым числом, в отличие от массового числа. Так, массовое число изотопа хлора 35 Cl равно 35, а его атомная масса составляет 34,96885 а.е.м.
Массовое число в обозначении конкретного нуклида (вида атомных ядер) пишется верхним левым индексом, например 232 Th . Нуклиды с одинаковым массовым числом называются изобарами (например, изобарами являются нуклиды 14 C и 14 N).
Знание массового числа позволяет оценить массу ядра и атома. Если известно массовое число, то масса М атома и его ядра оценивается из следующего соотношения М ≈ А·m N , где m N ≈ 1,67·10 −27 кг - масса нуклона, то есть протона или нейтрона. Например, в состав атома алюминия-27 и его ядра входит 27 нуклонов (13 протонов и 14 нейтронов). Его масса примерно равна 27·1,67·10 −27 кг ≈ 4,5·10 −26 кг. Если необходимо получить массу ядра с большей точностью, то нужно учесть, что нуклоны в ядре связаны силами ядерного притяжения, и поэтому в соответствии с соотношением E = mc 2 масса ядра уменьшается. В массу атома также следует добавить суммарную массу электронов на орбитах вокруг ядра. Однако все эти поправки не превышают 1 %.
| 238 92 U | → | 234 90 Th | + | 4 2 He |
в левой части массовое число начального ядра равно 238, в правой части реакции - два ядра с массовыми числами 234 и 4, что в сумме даёт 238. С учётом того, что массовое число альфа-частицы (ядра гелия-4) равно 4, альфа-распад снижает массовое число распадающегося ядра на 4 единицы. Любые типы бета-распада (бета-минус-распад , позитронный распад , электронный захват , все типы двойного бета-распада) не изменяют массовое число, поскольку в этом процессе происходит лишь превращение некоторых нуклонов ядра из одного вида в другой (протонов в нейтроны или обратно). Изомерный переход также не изменяет массовое число ядра.
Примечания
См. также
Wikimedia Foundation . 2010 .
Смотреть что такое "Массовое число" в других словарях:
- (число нуклонов, символ А), общее число НУКЛОНОВ (НЕЙТРОНОВ и ПРОТОНОВ) в ЯДРЕ АТОМА. Его обычно записывают как верхний индекс перед химическим символом элемента. Таким образом, наилегчайший элемент, водород, имеет только один протон в ядре, и… … Научно-технический энциклопедический словарь
Суммарное число нуклонов (нейтронов и протонов) в ат. ядре. Различно для изотопов одного хим. элемента. Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983. МАССОВОЕ ЧИСЛО … Физическая энциклопедия
Число нуклонов в атомном ядре. Обычно указывается слева вверху у символа химического элемента (напр., 10В) … Большой Энциклопедический словарь
МАССОВОЕ ЧИСЛО - общее число нуклонов (протонов и нейтронов) в атомном ядре, обозначается А и указывается индексом вверху слева у символа соответствующего элемента, напр. 32S означает изотоп серы с массовым числом, равным 32 (А = 32). М. ч. изотопа равно целому… … Большая политехническая энциклопедия
массовое число - — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва] Тематики электротехника, основные понятия EN mass number … Справочник технического переводчика
Число нуклонов в атомном ядре. Обычно указывается слева вверху у символа химического элемента (например, 10В). * * * МАССОВОЕ ЧИСЛО МАССОВОЕ ЧИСЛО, число нуклонов в атомном ядре. Обычно указывается слева вверху у символа химического элемента… … Энциклопедический словарь
массовое число - masės skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: angl. mass number; nuclear number; nucleon number vok. Massenzahl, f; Nukleonenzahl, f rus. массовое число, n; число… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
массовое число - masės skaičius statusas T sritis chemija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: angl. mass number; nuclear number; nucleon number rus. массовое число … Chemijos terminų aiškinamasis žodynas
массовое число - masės skaičius statusas T sritis fizika atitikmenys: angl. mass number; nuclear number; nucleon number vok. Massenzahl, f; Massezahl, f; Nukleonenzahl, f rus. массовое число, n pranc. nombre de masse, m; nombre de nucléons, m … Fizikos terminų žodynas
Число нуклонов (протонов и нейтронов) в атомном ядре; обозначается буквой A и указывается обычно слева вверху рядом с символом элемента, например 32S означает изотоп серы с A = 32. М. ч. и заряд ядра Z, выраженный в единицах элементарного … Большая советская энциклопедия
Книги
- Некомпетентный менеджер. Некомпетентность как массовое безумие , Фарнэм Адриан. Удивительно огромное количество людей работает под началом менеджеров, которые очевидно некомпетентны. Некоторые специалисты полагают, что в некоторых отраслях экономики число некомпетентных…
В центре атома сосредоточена основная его масса и весь положительный заряд. Эта область атома получила название ядра.
Размеры атома
м,
а размеры ядра м
масса ядра составляет 99,95% массы атома.
В нейтральном атомеZ
электронов. Заряд ядра положительный
и кратен элементарному заряду
м
масса ядра составляет 99,95% массы атома.
В нейтральном атомеZ
электронов. Заряд ядра положительный
и кратен элементарному заряду
 Кл.
Заряд ядра можно представить как
Кл.
Заряд ядра можно представить как ,
гдеZ
- зарядовое число, оно совпадает с
химическим номером таблицы Менделеева
и равно числу протонов, входящих в ядро.
,
гдеZ
- зарядовое число, оно совпадает с
химическим номером таблицы Менделеева
и равно числу протонов, входящих в ядро.
Второй важнейшей характеристикой ядра является его масса. Масса ядра оказалась больше суммы масс протонов, входящих в ядро.
Было сделано
предположение, что в состав ядра входят
нейтральные частицы. В 1932 году Чедвиг
открыл нейтроны. Иваненко и Гейзенберг
предложили протонно-нейтронную теорию
ядра. Ядро расщепляется на протоны и
нейтроны. Они называются нуклонами.
Общее число нуклонов в ядре называется
массовым числом
A
.
Общее число нейтронов равно N=A-Z.
Масса покоя протона равна
 кг,
масса нейтрона равна
кг,
масса нейтрона равна кг.
кг.
Ядро химического
элемента обозначают тем же символом,
что и нейтральный атом
 ,
гдеZ
- атомный номер (заряд ядра), A
- массовое число (число нуклонов в ядре).
Ядра с одинаковым зарядовым числом, но
с разным массовым, называются изотопами
(изотопы различаются числом нейтронов).
Ядра с одинаковым массовым числом, но
с разным зарядовым, называются изобарами.
,
гдеZ
- атомный номер (заряд ядра), A
- массовое число (число нуклонов в ядре).
Ядра с одинаковым зарядовым числом, но
с разным массовым, называются изотопами
(изотопы различаются числом нейтронов).
Ядра с одинаковым массовым числом, но
с разным зарядовым, называются изобарами.
28. Свойства ядерных сил.
Особенности ядерных сил:

29. Радиоактивность. Альфа и бетта-распад. Правила смещения.
Радиоактивностью называется превращение неустойчивых изотопов одного химического элемента в изотопы другого элемента, сопровождающееся испусканием некоторых частиц. Естественной радиоактивностью называется радиоактивность, наблюдающаяся у существующих в природе неустойчивых изотопов. Искусственной радиоактивностью называется радиоактивность изотопов, полученных в результате ядерных реакций.
Радиоактивное излучение имеет сложный состав. В магнитном поле узкий пучок радиоактивного излучения расщепляется на три компонента:

 -частицы
–
поток
ядер гелия с зарядом Z
=2
e
и массовым числом A
=4
(
-частицы
–
поток
ядер гелия с зарядом Z
=2
e
и массовым числом A
=4
( ).
Скорость
).
Скорость -частиц
равна
-частиц
равна м/с.
Попадая в вещество
м/с.
Попадая в вещество -частицы
активно взаимодействуют с атомами и
молекулами, ионизируют и возбуждают
его. Когда энергия
-частицы
активно взаимодействуют с атомами и
молекулами, ионизируют и возбуждают
его. Когда энергия -частицы
уменьшается до теплового движения, она
захватывает два электрона и превращается
в атом гелия (He
).
До этого она проходит путь, называемый
пробегом. Из-за сильного взаимодействия
с веществом пробег малый. Лист бумаги
или одежда задерживают
-частицы
уменьшается до теплового движения, она
захватывает два электрона и превращается
в атом гелия (He
).
До этого она проходит путь, называемый
пробегом. Из-за сильного взаимодействия
с веществом пробег малый. Лист бумаги
или одежда задерживают
 -частицы.
Лист алюминия толщиной 0,05 мм также
задерживает
-частицы.
Лист алюминия толщиной 0,05 мм также
задерживает -частицы.
Ионизирующая способность
-частицы.
Ионизирующая способность -частиц
велика и равна
-частиц
велика и равна пар на длине пробега.
пар на длине пробега.
 -частицы
– это поток
электронов, вылетающих из ядер со
скоростью
-частицы
– это поток
электронов, вылетающих из ядер со
скоростью
 м/с.
Ядро испускает электрон при превращении
нейтрона в протон:
м/с.
Ядро испускает электрон при превращении
нейтрона в протон:
![]()
где
 - обозначение электрона,
- обозначение электрона, - электронное антинейтрино.
- электронное антинейтрино.
Ионизирующая
способность
 -частиц
в сотни раз меньше, чем у
-частиц
в сотни раз меньше, чем у -частиц,
а проникающая способность больше.
-частиц,
а проникающая способность больше. -излучение
задерживается слоем алюминия толщиной
в 2мм.
-излучение
задерживается слоем алюминия толщиной
в 2мм.
Что такое массовое число атомного ядра? Массовое число численно равно сумме нейтронов и протонов ядра. Его обозначают буквой А. Понятие "массовое число" появилось в связи с тем, что масса ядра обусловлена числом ядерных частиц. Как связаны между собой масса ядра и количество частиц? Давайте выяснять.
Строение атома
Любой атом состоит из ядра и электронов. Кроме атома водорода, так как он имеет всего один электрон. Ядро заряжено положительно. Отрицательный заряд несут электроны. Заряд каждого электрона принят за -1. Атом в целом электронейтрален, то есть не имеет заряда. Это значит, что количество частиц, несущих отрицательный заряд, то есть электронов, равно положительному заряду ядра. Например, в атоме кислорода заряд ядра +8 и электронов 8, в атоме кальция заряд ядра +20, электронов 20.
Строение ядра
Ядро состоит из двух видов частиц - протонов и нейтронов. Протоны заряжены положительно, нейтроны не имеют заряда. Таким образом, заряд ядру дают протоны. Заряд каждого протона принят за +1. То есть, сколько протонов содержится в ядре, такой и будет заряд всего ядра. К примеру, в ядре углерода 6 протонов, заряд ядра +6.
В периодической системе элементов Менделеева все элементы расположены в порядке увеличения именно заряда ядра. У водорода заряд ядра +1, он расположен первым; у гелия +2, он второй в таблице; у лития +3, он третий и так далее. То есть заряд ядра соответствует порядковому (атомному) номеру элемента в таблице.
В целом любой атом электронейтрален. Это значит, что количество электронов равно заряду ядра, то есть количеству протонов. А поскольку количество протонов определяет атомный номер элемента, то зная этот атомный номер, мы, таким образом, знаем и количество электронов, и количество протонов, и заряд ядра.
Масса атома
Масса атома (М) определяется массой составных частей, то есть электронов и ядра. Электроны очень легкие по сравнению с ядром и почти не вносят вклада в массу всего атома. То есть масса атома обусловлена массой ядра. Что такое массовое число? Масса ядра определяется числом частиц, входящих в его состав, - протонов и нейтронов. Таким образом, массовое число - это масса ядра, выраженная не в единицах измерения массы (граммы), а в количестве частиц. Конечно, абсолютная масса ядер (m), выраженная в граммах, известна. Но это очень маленькие числа, выражаемые в отрицательных степенях. Например, масса атома углерода m (C) = 1,99 ∙ 10 -23 г. Пользоваться такими числами неудобно. И если нет необходимости в абсолютных значениях массы, а нужно просто сравнить массы элементов или частиц, то пользуются относительными массами атомов (A r), выраженными в а.е.м. Относительная масса атома указана в таблице Менделеева, например, у азота 14,007. Относительная масса атома, округленная до целого числа, и есть массовое число ядра элемента (A). Массовые числа такие, что ими удобно пользоваться - это всегда целые числа: 1, 2, 3 и так далее. Например, у азота - 14, у углерода - 12. Их записывают верхним левым индексом, к примеру, 14 N или 12 C.

Когда нужно знать массовое число?
Зная массовое число (A) и атомный номер элемента в периодической системе (Z), можно определить число нейтронов. Для этого нужно вычесть из массового числа протоны.
Зная массовое число, можно вычислить массу ядра или всего атома. Поскольку масса ядра обусловлена массой частиц, входящих в его состав, то она равна произведению количества этих частиц и массы этих частиц, то есть произведению массы нейтрона и массового числа. Масса нейтрона равна массе протона, в целом их обозначают как масса нуклона (ядерная частица).
К примеру, рассчитаем массу атома алюминия. Как видно из периодической системы элементов Менделеева, относительная атомная масса алюминия равна 26,992. Округлив, получаем массовое число ядра алюминия 27. То есть его ядро состоит из 27 частиц. Масса одной частицы - постоянная величина, равная 1,67 ∙ 10 -24 г. Тогда, масса ядра алюминия равна: 27 ∙ 1,67 ∙ 10 -24 г = 4,5 ∙ 10 -23 г.

Что такое массовое число ядер элементов нужно знать при составлении реакций радиоактивного распада или ядерных реакций. Например, при урана 235 U, захватившего один нейтрон 1 n, образуются ядра бария 141 Ba и криптона 92 Kr, а также три свободных нейтрона 1 n. При составлении таких реакций пользуются правилом: сумма массовых чисел в правой и левой частях уравнения не меняется. 235+1 = 92+141+3.
Массовое число - это суммарное число протонов и нейтронов в ядре атома. Оно обозначается символом А.
Говоря о конкретном атомном ядре, обычно употребляют термин нуклид, а ядерные частицы протоны и нейтроны - в совокупности называют нуклонами.
Атомный номер.
Атомный номер элемента совпадает с числом протонов в ядре его атома. Он обозначается символом Z. Атомный номер связан с массовым числом следующим соотношением:
где N - число нейтронов в ядре атома.
Каждый химический элемент характеризуется определенным атомным номером. Другими словами, никакие два элемента не могут иметь одинаковый атомный номер. Атомный номер равен не только числу протонов в ядре атомов данного элемента, но также равен числу электронов, окружающих ядро атома. Это объясняется тем, что атом в целом представляет собой электрически нейтральную частицу. Таким образом, число протонов в ядре атома равно числу электронов, окружающих ядро. Это утверждение не относится к ионам, которые, разумеется, представляют собой заряженные частицы.
Первое экспериментальное обоснование атомных номеров элементов получил в 1913 г. Генри Мозли, работавший в Оксфорде. Он бомбардировал твердые металлические мишени катодными лучами. (В 1909 г. Баркла и Кайи уже показали, что любой твердый элемент при бомбардировке быстрым пучком катодных лучей испускает рентгеновские лучи, характеристические для данного элемента.) Мозли анализировал характеристическое рентгеновское излучение, пользуясь фотографической методикой регистрации. Он обнаружил, что длина волны характеристического рентгеновского излучения увеличивается с возрастанием атомного веса (массы) металла и показал, что квадратный корень из частоты этого рентгеновского излучения прямо пропорционален некоторому целому числу, которое он обозначил символом
![]()
Мозли установил, что это число приблизительно совпадает с половиной значения атомной массы. Он пришел к выводу, что это число - атомный номер элемента - является фундаментальным свойством его атомов. Оно оказалось равно числу протонов в атоме данного элемента. Таким образом, Мозли связал частоту характеристического рентгеновского излучения с порядковым номером излучающего элемента (закон Мозли). Этот закон имел большое значение для утверждения периодического закона химических элементов и установления физического смысла атомного номера элементов.
Исследование Мозли позволило ему предсказать существование трех недостававших к тому времени в периодической таблице элементов с атомными номерами 43, 61 и 75. Эти элементы были обнаружены позже и получили названия технеций, прометий и рений соответственно.
Мозли погиб в боях первой мировой войны.
Символы нуклидов.
Массовое число нуклида принято указывать в виде верхнего индекса, а атомный номер в виде нижнего индекса слева от символа элемента. Например, запись означает, что этот нуклид углерода (как и все другие нуклиды углерода) имеет атомный номер 6. Данный конкретный нуклид имеет массовое число 12. Другому нуклиду углерода отвечает символ Поскольку все нуклиды углерода имеют атомный номер 6, указанный нуклид часто записывают просто как или углерод-14.
Изотопы.
Изотопами называются различные по свойствам атомные разновидности одного элемента. Они различаются числом нейтронов в их ядре. Таким образом, изотопы одного элемента имеют одинаковый атомный номер, но разные массовые числа. В табл. 1.1 приведены значения массового числа А, атомного номера Z и числа нейтронов N в ядре атомов каждого из трех изотопов углерода.
Таблица 1.1. Изотопы углерода

Изотопное содержание элементов.
В большинстве случаев каждый элемент представляет собой смесь различных изотопов. Содержание каждого изотопа в такой смеси называется изотопным содержанием. Например, кремний обнаруживается в соединениях, которые встречаются в природе, с таким естественным изотопным содержанием: . Обратите внимание, что суммарное изотопное содержание элемента должно составлять в точности 100%. Относительное изотопное содержание каждого из указанных изотопов составляет соответственно 0,9228, 0,0467 и 0,0305. Сумма этих чисел составляет в точности 1,0000.
Атомная единица массы (а.е.м.).
В настоящее время в качестве стандарта для определения атомной единицы массы принимается масса нуклида Этому нуклиду приписывается масса 12,0000 а.е.м. Таким образом, атомная единица массы равна одной двенадцатой части массы этого нуклида. Истинное значение атомной единицы массы составляет кг. Три фундаментальные частицы, являющиеся составными частями атома, имеют следующие массы:
масса протона = 1,007277 а.е.м.
масса нейтрона = 1,008 665 а.е.м.
масса электрона = 0,000 548 6 а. е. м.
Пользуясь этими значениями, можно вычислить изотопную массу каждого конкретного нуклида. Например, изотопная масса нуклида представляет собой сумму масс 17 протонов, 18 нейтронов и 17 электронов:
Однако точные экспериментальные данные свидетельствуют о том, что изотопная масса имеет значение 34,968 85 а. е. м. Расхождение между вычисленным и экспериментально найденным значениями составляет Оно называется дефектом массы, причина возникновения дефекта массы объясняется в разд. 1.3.
В шкале относительных атомных масс изотопные массы представляют как результат их деления на одну двенадцатую часть массы нуклида . Таким образом, относительная изотопная масса изотопа равна

Обратите внимание, что относительные изотопные массы выражаются в безразмерных единицах.
Относительная атомная масса АТ химического элемента представляет собой арифметическое среднее из относительных изотопных масс с учетом изотопного содержания. Она вычисляется суммированием произведений относительной изотопной массы каждого изотопа и его относительного содержания.
Вычислим относительную атомную массу хлора по следующим данным:

(называемых общим термином «нуклоны ») в ядре. Обычно обозначается буквой A . Массовое число близко к атомной массе изотопа , выраженной в атомных единицах массы , но совпадает с ней только для углерода-12 , поскольку атомная единица массы (а. е. м.) определяется сейчас как 1 ⁄ 12 массы атома 12 С. Во всех остальных случаях атомная масса не является целым числом, в отличие от массового числа. Так, массовое число изотопа хлора 35 Cl равно 35, а его атомная масса составляет 34,96885 а.е.м.
Массовое число в обозначении конкретного нуклида (вида атомных ядер) пишется верхним левым индексом, например 232 Th . Нуклиды с одинаковым массовым числом называются изобарами (например, изобарами являются нуклиды 14 C и 14 N).
Знание массового числа позволяет оценить массу ядра и атома. Если известно массовое число, то масса М атома и его ядра оценивается из следующего соотношения М ≈ А·m N , где m N ≈ 1,67·10 −27 кг - масса нуклона, то есть протона или нейтрона. Например, в состав атома алюминия-27 и его ядра входит 27 нуклонов (13 протонов и 14 нейтронов). Его масса примерно равна 27·1,67·10 −27 кг ≈ 4,5·10 −26 кг. Если необходимо получить массу ядра с большей точностью, то нужно учесть, что нуклоны в ядре связаны силами ядерного притяжения, и поэтому в соответствии с соотношением E = mc 2 масса ядра уменьшается. В массу атома также следует добавить суммарную массу электронов на орбитах вокруг ядра. Однако все эти поправки не превышают 1 %.
| 238 92 U | → | 234 90 Th | + | 4 2 He |
в левой части массовое число начального ядра равно 238, в правой части реакции - два ядра с массовыми числами 234 и 4, что в сумме даёт 238. С учётом того, что массовое число альфа-частицы (ядра гелия-4) равно 4, альфа-распад снижает массовое число распадающегося ядра на 4 единицы. Любые типы бета-распада (бета-минус-распад , позитронный распад , электронный захват , все типы двойного бета-распада) не изменяют массовое число, поскольку в этом процессе происходит лишь превращение некоторых нуклонов ядра из одного вида в другой (протонов в нейтроны или обратно). Изомерный переход также не изменяет массовое число ядра.
Напишите отзыв о статье "Массовое число"
Примечания
См. также
Отрывок, характеризующий Массовое число
– Скажите, вы не знали еще о кончине графини, когда остались в Москве? – сказала княжна Марья и тотчас же покраснела, заметив, что, делая этот вопрос вслед за его словами о том, что он свободен, она приписывает его словам такое значение, которого они, может быть, не имели.– Нет, – отвечал Пьер, не найдя, очевидно, неловким то толкование, которое дала княжна Марья его упоминанию о своей свободе. – Я узнал это в Орле, и вы не можете себе представить, как меня это поразило. Мы не были примерные супруги, – сказал он быстро, взглянув на Наташу и заметив в лице ее любопытство о том, как он отзовется о своей жене. – Но смерть эта меня страшно поразила. Когда два человека ссорятся – всегда оба виноваты. И своя вина делается вдруг страшно тяжела перед человеком, которого уже нет больше. И потом такая смерть… без друзей, без утешения. Мне очень, очень жаль еe, – кончил он и с удовольствием заметил радостное одобрение на лице Наташи.
– Да, вот вы опять холостяк и жених, – сказала княжна Марья.
Пьер вдруг багрово покраснел и долго старался не смотреть на Наташу. Когда он решился взглянуть на нее, лицо ее было холодно, строго и даже презрительно, как ему показалось.
– Но вы точно видели и говорили с Наполеоном, как нам рассказывали? – сказала княжна Марья.
Пьер засмеялся.
– Ни разу, никогда. Всегда всем кажется, что быть в плену – значит быть в гостях у Наполеона. Я не только не видал его, но и не слыхал о нем. Я был гораздо в худшем обществе.
Ужин кончался, и Пьер, сначала отказывавшийся от рассказа о своем плене, понемногу вовлекся в этот рассказ.
– Но ведь правда, что вы остались, чтоб убить Наполеона? – спросила его Наташа, слегка улыбаясь. – Я тогда догадалась, когда мы вас встретили у Сухаревой башни; помните?
Пьер признался, что это была правда, и с этого вопроса, понемногу руководимый вопросами княжны Марьи и в особенности Наташи, вовлекся в подробный рассказ о своих похождениях.
Сначала он рассказывал с тем насмешливым, кротким взглядом, который он имел теперь на людей и в особенности на самого себя; но потом, когда он дошел до рассказа об ужасах и страданиях, которые он видел, он, сам того не замечая, увлекся и стал говорить с сдержанным волнением человека, в воспоминании переживающего сильные впечатления.