نموذج مركب كيميائي. التقنيات العالية الحديثة
حاشية. ملاحظة
تتناول المقالة النماذج الكمومية والكيميائية للذرات والجزيئات ، والتي تسمح بفهم جوهر التحولات الكيميائية للمادة على المستوى الذري والجزيئي لتنظيمها.
نبذة مختصرة
هذه المقالة مخصصة لدراسة مفصلة لنماذج الرسوم الكمومية الكيميائية للذرات والجزيئات والروابط الكيميائية. يسمح هذا النهج بفهم طبيعة العمليات الكيميائية وقوانين إجرائها.
تم الكشف عن الأفكار الحديثة حول بنية الذرات والجزيئات ، وفهم التحولات الكيميائية للمادة على المستوى الذري والجزيئي لتنظيمها من خلال كيمياء الكم.
من وجهة نظر كيمياء الكم ، الذرة عبارة عن نظام دقيق يتكون من نواة وإلكترونات تتحرك في المجال الكهرومغناطيسي للنواة. على التين. يقدم الشكل 1 نماذج مدارية وإلكترونية ونماذج حيود الإلكترون لذرات الفترتين الأولى والثانية ، مبنية باستخدام مبادئ وقواعد الكم لملء مستويات الطاقة في الذرات بالإلكترونات. أربعة أعداد كمية ن, ل, م ل, تصلب متعددتميز بالكامل حركة الإلكترونات في مجال النواة. عدد الكم الرئيسي نيميز طاقة الإلكترون ، بعده عن النواة ويتوافق مع رقم مستوى الطاقة الذي يقع عليه الإلكترون. رقم الكم المداري ليحدد شكل المدار وطاقة المستويات الفرعية من نفس مستوى الطاقة. مفهوم "المداري" يعني المنطقة الأكثر احتمالا لحركة الإلكترون في الذرة. عدد الكم المغناطيسي م ليحدد عدد المدارات واتجاهها المكاني. والأهم من ذلك ، أن الأرقام الكمية المدارية والمغناطيسية مترابطة فيما بينها. رقم الكم المداري ليأخذ قيمًا واحدة أقل من رقم الكم الرئيسي ن. اذا كان ن= 1 إذن ل= 0 ، وهي كروية الشكل 1 سمداري. اذا كان ن= 2 ، ثم يأخذ الرقم الكمي المداري قيمتين: ل= 0 ، 1 ، مما يشير إلى وجود مستويين فرعيين. إنها كروية 2 س- المداري ( ل= 0) وثلاثة 2 ص- المدرجات تشبه الدمبل في الجمباز ، وتقع بزاوية 90 درجة على طول محاور نظام الإحداثيات الديكارتية.
الشكل 1. حيود الكم الكيميائي والإلكتروني والإلكترون نماذج ذرات الفترتين الأولى والثانية
العدد والترتيب المكاني 2 صالمداري يحدد عدد الكم المغناطيسي م ل, الذي يأخذ القيم داخل رقم الكم المداري من - لل + ل. اذا كان ل= 0 إذن م ل= 0 (واحد س- المداري). اذا كان ل= 1 إذن م ليأخذ ثلاث قيم - 1 , 0, +1 (ثلاثة صمداري).
تُظهر النماذج المدارية للذرات الترتيب المكاني وشكل المدارات ، وعلى نماذج حيود الإلكترون في شكل خلايا كمومية رمزية ، يتم إعطاء صورة للمدارات وموضع المستويات والمستويات الفرعية في مخطط الطاقة. انتبه لحجم الذرات. يتكرر نفس الانتظام في الفترات - مع زيادة شحنة النواة ، يحدث تشوه متزايد (ضغط) للمدارات تحت تأثير التجاذب الكهرومغناطيسي للإلكترونات بواسطة النواة (الشكل 1).
يخضع وضع الإلكترونات في المدارات لأحد أهم المبادئ ميكانيكا الكم(مبدأ باولي): لا يمكن أن يكون أكثر من إلكترونين في مدار واحد ، ويجب أن يختلفا في الزخم الزاوي الخاص بهما - الدوران (دوران الدوران الإنجليزي). تُصوَّر الإلكترونات ذات الدورات المختلفة بشكل تقليدي بواسطة الأسهم و. عندما يكون إلكترونان في نفس المدار ، فإنهما يدوران بشكل مضاد ولا يمنعان بعضهما البعض من التحرك في مجال النواة.
تشبه هذه الخاصية الدوران في شبكة ترسين. عند التعشيق ، يدور أحد الترسين في اتجاه عقارب الساعة والآخر في عكس اتجاه عقارب الساعة. العتاد الثالث المتشابك مع الترسين الآخرين يوقف الدوران. إنها زائدة عن الحاجة. لذلك في مدار واحد يمكن أن يكون هناك إلكترونان فقط ، والثالث غير ضروري.
عندما تمتلئ مستويات الطاقة والمستويات الفرعية بالإلكترونات ، مبدأ الكمالحد الأدنى من الطاقة (حكم كليشكوفسكي) . تملأ الإلكترونات المدارات من أدنى مستوى إلى أعلى مستوى طاقة. مبدأ الحد الأدنى من الطاقة يشبه ملء الأرضيات عمارة شاهقةخلال فترة الفيضان. يرتفع الماء ويملأ جميع الطوابق من الأسفل إلى الأعلى ، ولا ينقصه واحد.
وفقا لحكم هوند ، كل شيء ص- تمتلئ المدارات أولاً بإلكترون واحد ثم بالإلكترون الثاني مع دوران مضاد للتوازي.
تتيح النماذج الكمومية الكيميائية للذرات شرح خصائص الذرات لتبادل الطاقة ، وإعطاء الإلكترونات وأخذها ، وتغيير التكوين الهندسي ، وتشكيل روابط كيميائية.
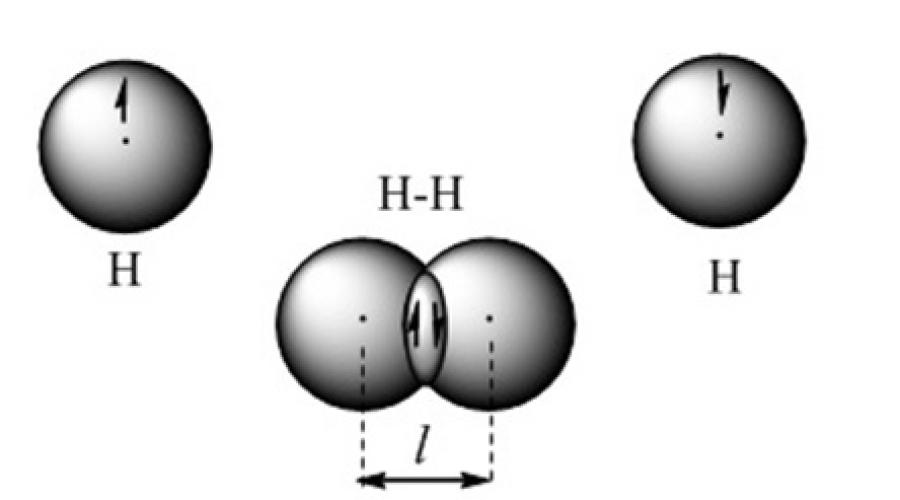
تتشكل الرابطة الكيميائية التساهمية عندما تتداخل سحب الإلكترون التكافؤ. على سبيل المثال ، يتم تمثيل هذه الرابطة في النموذج المداري لجزيء الهيدروجين (الشكل 2).
/Zakharova.files/image002.jpg)
الشكل 2. نموذج الرابطة التساهمية في جزيء الهيدروجين
يعتمد استخدام الطريقة الكيميائية الكمومية لروابط التكافؤ على فكرة أن كل زوج من الذرات في جزيء ما يتم تجميعه معًا بواسطة واحد أو أكثر من أزواج الإلكترونات ذات السبينات المضادة للتوازي. من وجهة نظر طريقة روابط التكافؤ ، الجزيء عبارة عن نظام دقيق يتكون من ذرتين أو أكثر من الذرات المرتبطة تساهميًا. يتم الاحتفاظ بنوى الذرات موجبة الشحنة بواسطة الشحنة السالبة المركزة في منطقة المدارات الذرية المتداخلة. يتم موازنة جاذبية نوى الذرات لزيادة كثافة الإلكترون بينها بقوة تنافر النوى فيما بينها. يتم تشكيل نظام دقيق مستقر ، يكون فيه طول الرابطة التساهمية مساويًا للمسافة بين النوى.
يوجد في جزيء الفلور ، وكذلك في جزيء الهيدروجين ، رابطة تساهمية غير قطبية. التداخل 2 ص 1 المدارات ، زوج الإلكترون يخلق كثافة إلكترون متزايدة بين نوى الذرات ويحافظ على الجزيء في حالة مستقرة (الشكل 3).
/Zakharova.files/image003.jpg)
الشكل 3. نموذج الرابطة التساهمية في جزيء الفلور
تعني الرابطة التساهمية غير القطبية مثل هذا التداخل في مدارات التكافؤ ، ونتيجة لذلك تتطابق مراكز ثقل الشحنات الموجبة والسالبة.
من الممكن تكوين رابطة تساهمية قطبية عند التداخل 1 س 1 - و 2 ص 1 المدارات. على التين. يوضح الشكل 4 نموذجًا لفلوريد الهيدروجين برابطة تساهمية قطبية. تتحول كثافة الإلكترون بين الذرات المترابطة تساهميًا إلى ذرة الفلور ، التي تمارس شحنتها النووية (+9) جاذبية كهرومغناطيسية أكبر مقارنة بنواة ذرة الهيدروجين بشحنة (+1).
/Zakharova.files/image004.jpg)
الشكل 4. نموذج الرابطة التساهمية القطبية في جزيء فلوريد الهيدروجين
يرجع الارتباط الأيوني إلى جاذبية الجسيمات المشحونة كهربائيًا - الأيونات. على التين. يوضح الشكل 5 نموذجًا لتكوين رابطة أيونية في فلوريد الليثيوم. المجال الكهرومغناطيسي القوي الناتج عن نواة ذرة الفلور يلتقط ويثبت صمدارات من إلكترون ينتمي إلى ذرة الليثيوم. تغير ذرة الليثيوم ، المحرومة من الإلكترون ، تكوينها الهندسي (2 س-orbital) ، يصبح أيونًا موجب الشحنة وينجذب إلى أيون الفلور سالب الشحنة ، والذي اكتسب إلكترونًا إضافيًا على صمداري.
/Zakharova.files/image005.jpg)
الشكل 5. نموذج للزوج الأيوني Li + F - فلوريد الليثيوم
تتوازن قوى الجذب الكهروستاتيكي للأيونات المشحونة معاكسة وتنافر غلاف الإلكترون لأيونات الليثيوم والفلور وتحافظ على الأيونات على مسافة تقابل طول الرابطة الأيونية. التداخل المداري في المركبات الأيونية يكاد يكون غير موجود.
يتجلى نوع خاص من الرابطة الكيميائية في ذرات المعادن. تتكون البلورة المعدنية (الشكل 6) من أيونات موجبة الشحنة ، في المجال الذي تتحرك فيه إلكترونات التكافؤ بحرية ("سحابة إلكترونية").
/Zakharova.files/image006.jpg)
الشكل 6. نموذج الكريستال المعدني الليثيوم
تحمل الأيونات و "سحابة الإلكترون" بعضها البعض في حالة مستقرة. نظرًا للحركة العالية للإلكترونات ، فإن المعادن لها موصلية إلكترونية.
في الجزيئات ، الذرات المرتبطة بالعديد من الروابط التساهمية تغير تكوينها الهندسي. ضع في اعتبارك مظهر هذه الخاصية في مثال ذرة كربون (1 سلا يظهر المدار 2 في نماذج ذرة الكربون ، لأن لا تشارك في تكوين روابط كيميائية).
لقد ثبت تجريبياً أنه في جزيء CH 4 ، تشكل ذرة الكربون أربعة روابط تساهمية متطابقة مع ذرات الهيدروجين ، والتي تكافئ في طاقتها وخصائصها المكانية. من الصعب تخيل أربع روابط تساهمية متطابقة ، إذا وضعنا في الاعتبار أنه في الكربون توجد إلكترونات التكافؤ على طاقتيْن 2 سو 2 صالمستويات الفرعية:
/Zakharova.files/image007.jpg)
في حالة الأرض (غير متحمس) ، يشكل الكربون رابطتين تساهمية فقط. في الحالة المثارة ، إلكترون واحد من المستوى الفرعي 2 سينتقل إلى مستوى فرعي أعلى من الطاقة 2 ص. نتيجة لقفز الإلكترون هذا ، إجمالي الطاقة 2 س- و 2 صيتغير المدار وتكافؤ ذرة الكربون إلى أربعة:
/Zakharova.files/image008.jpg)
ومع ذلك ، فإن هذا لا يكفي لتفسير الروابط التساهمية الأربعة المكافئة في جزيء CH 4 ، لأن 2 س- و 2 ص-الربيتات لها هيئة مختلفةوالترتيب المكاني. تم حل المشكلة عن طريق إدخال فرضية التهجين - خلط إلكترونات التكافؤ في المستويات الفرعية من نفس مستوى الطاقة. يوجد 2 واحد في جزيء الميثان س- وثلاثة 2 ص- تتحول مدارات ذرة الكربون نتيجة التهجين إلى أربعة مكافئات ص 3-مدارات هجينة:
/Zakharova.files/image009.jpg)
على عكس الحالة غير المستثارة (الأرضية) لذرة الكربون ، حيث ثلاثة 2 ص- تقع المدارات للذرة بزاوية 90 درجة (الشكل 7 ، أ) ، في جزيء الميثان (الشكل 7 ، ب) متكافئة في الشكل والحجم ص 3 - ذرات كربون هجينة توجد بزاوية 109 حوالي 28 بوصة.
/Zakharova.files/image010.jpg)
الشكل 7. نموذج لجزيء الميثان
في جزيء الإيثيلين C 2 H 4 (الشكل 8 ، أ) ذرات الكربون في سص 2 - الحالة الهجينة. 2 تشارك في التهجين س- مداري واثنان 2 صمداري. نتيجة التهجين ، تشكل ذرات الكربون ثلاث مكافئات ص 2 - مدارات هجينة تقع بزاوية 120 تقريبًا على المستوى ؛ 2 ص-وربيتال لا يشارك في التهجين.
/Zakharova.files/image011.jpg)
الشكل 8. نموذج لجزيء الإيثيلين
في جزيء الإيثيلين ، ترتبط ذرات الكربون ليس فقط برابطة s ، ولكن أيضًا برابطة p. تتشكل نتيجة التداخل صض- مداري مع تكوين منطقتين من التداخل فوق وتحت المحور الذي يربط النوى ، على جانبي محور الرابطة s (الشكل 8).
يتم تقديم نموذج الرابطة الثلاثية في جزيء الأسيتيلين (الشكل 9). عند خلط واحد 2 س- وواحد 2 ص x -يتم تشكيل اثنين من المدارات من ذرة الكربون ص- المدارات الهجينة ، والتي تقع على الخط الذي يربط نوى الذرات (الزاوية 180 درجة). غير هجين 2 RU- و 2صض- تتداخل المدارات من ذرات كربون مختلفة ، مكونة رابطتين p في مستويات متعامدة بشكل متبادل (الشكل 9).
/Zakharova.files/image012.jpg)
الشكل 9. نموذج لجزيء الأسيتيلين
تُظهر الجزيئات ، مثل الذرات ، القدرة على كسر وتشكيل روابط كيميائية ، وتغيير تكوينها الهندسي ، والانتقال من الحالة المحايدة كهربائيًا إلى الحالة الأيونية. يتم عرض هذه الخصائص في التفاعل بين جزيئات الأمونيا NH 3 وفلوريد الهيدروجين HF (الشكل 10). الرابطة التساهمية في جزيء فلوريد الهيدروجين مكسورة ، وتتكون رابطة تساهمية متقبلية بين النيتروجين والهيدروجين في جزيء الأمونيا. المتبرع هو الزوج الوحيد من إلكترونات ذرة النيتروجين ، والمستقبل هو المدار الشاغر لذرة الهيدروجين (الشكل 10). يتغير التكوين الهندسي لجزيء NH 3 (الهرم المثلثي ، زاوية الرابطة 107 o 18 ") إلى التكوين رباعي السطوح لأيون NH 4 + (109 o 28"). تتمثل العملية النهائية في تكوين رابطة أيونية في التركيب البلوري لفلوريد الأمونيوم. تتيح النماذج المدارية للجزيئات إظهار جميع الخصائص المذكورة أعلاه في تفاعل واحد: كسر وتشكيل الروابط الكيميائية ، وتغيير التكوين الهندسي ، والانتقال من الحالة المحايدة كهربائيًا إلى الحالة الأيونية.
/Zakharova.files/image013.jpg)
أرز. 10. نموذج لتكوين زوج أيوني من NH 4 + F -
تفاعل كيميائي باستخدام الرموز العناصر الكيميائية:
NH 3 + HF → NH 4 F ،
يعطي تعبيرًا عامًا عما يتم الكشف عنه في النماذج المدارية للجزيئات. التفاعلات الكيميائية التي تمثلها النماذج المدارية ورموز العناصر الكيميائية تكمل بعضها البعض. هذا هو جدارة. يؤدي إتقان المعرفة الأولية للتعبير الكيميائي الكمي لهيكل وتكوين الذرات والجزيئات إلى فهم المفاهيم الكيميائية الرئيسية: الروابط القطبية وغير القطبية التساهمية ، والسندات المتلقية للمانحين ، والروابط الأيونية ، والتكوين الهندسي للذرات والجزيئات ، تفاعل كيميائي. وعلى أساس هذه المعرفة ، يمكن للمرء أن يستخدم بثقة رمزية العناصر والمركبات الكيميائية وصف قصيرالحالات الكيميائية وتحولات المادة.
دعونا نعطي مثالًا آخر على تفاعل تم اعتباره من وجهة نظر كيمياء الكم. يعرض الماء خصائص إلكتروليت ضعيف. عادة ما يتم تمثيل التفكك الالكتروليتي بالمعادلة:
H 2 O ⇄H + + OH -
H 2 O + H 2 O ⇄H 3 O + + OH -.
يتم الكشف عن تقسيم جزيئات الماء إلى أيونات موجبة وسالبة الشحنة بواسطة النموذج الكيميائي الكمي لتفاعل التفكك الإلكتروليتي (الشكل 11).
/Zakharova.files/image014.jpg)
الشكل 11. نموذج التفكك الكهربائي للماء
جزيء الماء عبارة عن هرم مشوه (زاوية التكافؤ 104 o 30 ") سص 3-المدارات الهجينة لذرة الأكسجين تشكل روابط s مع ذرات الهيدروجين. اثنان آخران سص 3-المدارات الهجينة لها أزواج حرة من الإلكترونات مع لفات متوازنة. يؤدي تكسير رابطة H-O التساهمية في أحد الجزيئات إلى تكوين رابطة كيميائية تساهمية على الجزيء المجاور وفقًا لآلية المتلقي المتلقي. يعمل أيون الهيدروجين ، الذي له مدار شاغر ، كمستقبل لزوج الإلكترون من ذرة الأكسجين لجزيء الماء المجاور. في هذا المثال ، كما في المثال السابق ، يتيح النهج الكمي الكيميائي فهم المعنى الفيزيائي والكيميائي لعملية التفكك الكهربائي للماء.
التفكير هو العملية التي يمكننا من خلالها الحكم بشكل غير مباشر على ما هو مخفي عن إدراكنا الحسي. تعطي كيمياء الكم صورة مرئية للعمليات الكيميائية وحالات المادة ، وتكشف ما هو مخفي عن إدراكنا الحسي ، وتشجع التعلم والتفكير.
فهرس:
1. فيجوتسكي إل. التفكير والكلام. - م: متاهة 1999. - 352 ص.
2. Zagashev IO.، Zair-Bek S.I. التفكير النقدي: تكنولوجيا التطوير. - سان بطرسبرج: تحالف "دلتا" 2003. - 284 ص.
3 - كراسنوف ك. الجزيئات والروابط الكيميائية. - م: تخرج من المدرسه، 1984. - 295 ص.
4. Leontiev A.N. محاضرات في علم النفس العام. - م: المعنى ، 2000. - 512 ص.
5. Peregudov F.I. ، Tarasenko F.P. مقدمة ل تحليل النظام. - م: المدرسة العليا 1989. - 367 ص.
6. بروكوفييف ف. رجل - حاسوب حيوي متحكم فيه؟ // نشرة الأكاديمية الدولية للعلوم (القسم الروسي). - 2008. - رقم 1. - س 1-21.
7. Yablokov V.A.، Zakharova O.M. نظام تنظيم محتوى تدريس الكيمياء // الكون: علم النفس والتعليم: الإلكترون. علمي مجلة 2016. No. 5 (23) / [ المورد الإلكتروني]. - وضع وصول:
URL: // website / ru / psy / archiv / item / 2505 (تم الوصول إليه في 2.04.2017)
1.4.1 النماذج الكيميائية
بالإضافة إلى الملاحظة والتجربة ، تلعب النمذجة دورًا مهمًا في معرفة العالم الطبيعي والكيمياء. أحد الأهداف الرئيسية للملاحظة هو البحث عن أنماط في نتائج التجارب. ومع ذلك ، فإن بعض الملاحظات غير ملائمة أو يستحيل إجراؤها مباشرة في الطبيعة. بيئة طبيعيةإعادة إنشائها في ظروف معملية بمساعدة الأجهزة الخاصة ، والتركيبات ، والأشياء ، أي النماذج. النماذج تنسخ فقط أهم خصائص وخصائص الشيء وتحذف تلك التي ليست ضرورية للدراسة. لذلك في الكيمياء ، يمكن تقسيم النماذج شرطيًا إلى مجموعتين: المادية ومبدع.
نماذج الاجهزة الكيماوية والصناعية
يستخدم الكيميائيون النماذج المادية للذرات والجزيئات والبلورات والصناعات الكيماوية لمزيد من الوضوح.
التمثيل الأكثر شيوعًا للذرة هو نموذج يشبه بنية النظام الشمسي.
كثيرا ما تستخدم لنمذجة جزيئات المواد. الكرة والعصاعارضات ازياء. يتم تجميع نماذج من هذا النوع من كرات ملونة تمثل الذرات التي يتكون منها الجزيء. ترتبط الكرات بقضبان ترمز إلى الروابط الكيميائية. بمساعدة نماذج الكرة والعصا ، يتم إعادة إنتاج زوايا الروابط في الجزيء بدقة تامة ، ولكن تنعكس المسافات بين النوى فقط تقريبًا ، نظرًا لأن أطوال القضبان التي تربط الكرات لا تتناسب مع أطوال الروابط.
نماذج الجرفتنقل بدقة زوايا الرابطة ونسبة أطوال الرابطة في الجزيئات. نوى الذرات فيها ، على عكس نماذج الكرة والقضيب ، لا يتم تحديدها بواسطة الكرات ، ولكن من خلال نقاط التوصيل للقضبان.
نماذج نصف كرويةتسمى أيضًا نماذج Stewart-Brigleb ، ويتم تجميعها من كرات ذات شرائح مقطوعة. ترتبط نماذج الذرات ببعضها البعض عن طريق شرائح الشرائح باستخدام الأزرار. تنقل النماذج نصف الكروية بدقة كلاً من نسبة أطوال الروابط وزوايا الرابطة وملء الفراغ الداخلي في الجزيئات. ومع ذلك ، لا يسمح هذا الشغل دائمًا للفرد بالحصول على تمثيل مرئي لـ الموقف النسبينوى.
نماذج البلورات تشبه نماذج الكرة والعصا من الجزيئات ، ومع ذلك ، فهي لا تصور الجزيئات الفردية للمادة ، ولكنها تظهر الترتيب المتبادل لجزيئات المادة في الحالة البلورية.
ومع ذلك ، في كثير من الأحيان لا يستخدم الكيميائيون المواد ، ولكن نماذج مبدعة -هذه رموز كيميائية ، صيغ كيميائية ، معادلات تفاعلات كيميائية. باستخدام رموز العناصر والمؤشرات الكيميائية ، تتم كتابة صيغ المواد. يوضح الفهرس عدد ذرات عنصر معين متضمنة في جزيء مادة ما. هو مكتوب على يمين علامة العنصر الكيميائي.
الصيغة الكيميائية هي النموذج الأيقوني الرئيسي في الكيمياء. يظهر: مادة معينة ؛ جسيم واحد من هذه المادة التركيب النوعيالمواد ، أي الذرات التي تشكل عناصرها جزءًا من هذه المادة ؛ التركيب الكمي ، أي كم عدد ذرات كل عنصر هي جزء من جزيء المادة.
جميع النماذج المذكورة أعلاه مستخدمة على نطاق واسع في الإنشاء نماذج الكمبيوتر التفاعلية.
1.4.2 تصنيف النماذج الحاسوبية
من بين الأنواع المختلفة من البرامج التربوية ، يتم تمييز تلك التي تستخدم نماذج الكمبيوتر. لا يسمح استخدام نماذج الكمبيوتر بزيادة وضوح عملية التعلم وتكثيفها فحسب ، بل يتيح أيضًا تغيير هذه العملية بشكل جذري. في السنوات الاخيرةتتحسن أجهزة الكمبيوتر بوتيرة سريعة ، وأصبحت قدراتها في النمذجة بلا حدود تقريبًا ، لذا يمكن أن تزداد أهمية نماذج الكمبيوتر في دراسة التخصصات المدرسية بشكل كبير. إي. نيفانتييف ، أ.ك. أخلبينين ، ف. لاحظ Likhachev أن الميزة الرئيسية لنماذج الكمبيوتر هي إمكانية نمذجة أي عمليات وظواهر تقريبًا ، وتفاعل المستخدم التفاعلي مع النموذج ، بالإضافة إلى تنفيذ مناهج البحث الإشكالية في عملية التعلم.
يقترح V.N. Likhachev تصنيف نماذج الكمبيوتر التعليمية وفقًا لعدد من المعايير ، أهمها وجود الرسوم المتحركة عند عرض النموذج ، وطريقة التحكم ، وطريقة العرض المرئي للنموذج. من خلال وجود الرسوم المتحركة ، يمكن أن تكون UKM ديناميكية وثابتة. تحتوي الأجزاء الديناميكية على أجزاء رسوم متحركة لعرض الكائنات والعمليات المحاكاة ؛ فهي غائبة في العناصر الثابتة. وفقًا لطريقة التحكم ، يمكن إدارة RCM ، مما يسمح لك بتغيير معلمات النموذج ، وغير المدارة ، والتي لا توفر مثل هذه الفرصة.

من بين نماذج العرض التوضيحي (غير المُدار) ، يمكن تمييز مجموعتين أخريين وفقًا لإمكانية التفاعل مع المستخدم: تفاعلية وغير تفاعلية. تسمح لك تلك التفاعلية بتغيير نوع عرض النموذج أو نقطة المراقبة على النموذج دون تغيير معلماته. لا تقدم مثل هذه الفرص غير التفاعلية.
إي. نيفانتييف ، أ.ك. أخلبينين وف. يعتبر Likhachev الأكثر فائدة من وجهة نظر منهجية التصنيف حسب كائن النمذجة.وفقًا لمستوى الكائنات الممثلة ، يمكن تقسيم النماذج المستخدمة في تدريس الكيمياء إلى مجموعتين : نماذج من عالم الماكرو، والتي تعكس الخصائص الخارجية للأشياء المحاكية وتغيرها و نماذج العالم الصغير، والتي تعكس بنية الأشياء والتغيرات التي تحدث فيها على مستوى تمثيلها الذري والجزيئي. ويمكن إنشاء نماذج لأشياء مثل المواد الكيميائية والتفاعلات الكيميائية والعمليات الفيزيائية والكيميائية على مستوى العالم الصغير وعلى مستوى العالم الكبير.

يمكن تقديم تصنيف UKM في شكل رسم بياني لمزيد من الوضوح.
1.4.3 نماذج الكمبيوتر للعالم الصغير
الكائنات للنمذجة على مستوى العالم المصغر هي الذرات والأيونات والجزيئات والشبكات البلورية والعناصر الهيكلية للذرات. على مستوى العالم المصغر ، يتم نمذجة ميزات بنية المادة وتفاعل الجسيمات التي تتكون منها المادة. لنمذجة التفاعلات الكيميائية على مستوى العالم المجهري ، تحظى آليات العمليات الكيميائية باهتمام كبير. وفي نماذج العمليات الفيزيائية والكيميائية ، يتم النظر في العمليات التي تحدث على المستوى الإلكتروني أو الجزيئي الذري.
من الواضح أن نماذج محاكاة CCM للعالم الصغير أصبحت مساعدين ممتازين في دراسة بنية الذرات ، وأنواع الروابط الكيميائية ، وبنية المادة ، إلخ.
تم تنفيذ نماذج الذرات 1-3 فترات من الجدول الدوري لمندليف في البرنامج " 1 ج: مدرس. كيمياء»على شكل نماذج بوهر للذرة. يتم تنفيذ أفكار أكثر حداثة حول بنية الذرة في البرنامج كيملاندحيث يتم النظر في توزيع الإلكترونات على المستويات الفرعية للطاقة لذرات العناصر وشكل المدارات الفردية عند مستويات طاقة مختلفة.
أهمية خاصة هو البرنامج هايبر كيم. إنه أحد البرامج المهنية الرئيسية للحساب النظري للعديد من المعلمات الديناميكية الحرارية والإلكترونية للجزيئات. بمساعدتها ، من الممكن بناء نماذج مكانية لمركبات مختلفة ، ودراسة ميزات هيكلها الهندسي ، وتحديد شكل وطاقة المدارات الجزيئية ، وطبيعة توزيع كثافة الإلكترون ، والعزم ثنائي القطب ، وما إلى ذلك. يتم توفيرها على شكل رسومات ملونة يمكن طباعتها بعد ذلك على الطابعة للحصول على صورة عالية الجودة للمركبات الكيميائية بالزوايا والإسقاطات المطلوبة. ميزة البرنامج هي القدرة على النظر في الجزيء مع أطراف مختلفةللتعرف على ملامح هيكلها المكاني. يبدو أن هذا مهم للغاية ، لأنه ، كما تظهر ممارسة التدريس ، لا يقوم الطلاب عادةً بتكوين أفكار حول الجزيئات كتركيبات مكانية. تؤدي الصورة التقليدية للمواد الكيميائية في مستوى واحد إلى فقدان البعد الكامل ولا تحفز على تطوير الخيال المكاني.
في دورة الوسائط المتعددة الكيمياء للجميع»يتم استخدام برنامج - متظاهر استريو للجزيئات. يسمح لك بتوفير صور حجمية للجزيئات التي تتكون من ذرات الهيدروجين والأكسجين والكربون والنيتروجين. للتوضيح ، تم استخدام نماذج سلكية للجزيئات. يمكن تحريك النماذج وتدويرها وإظهار صور للعديد من الجزيئات المختلفة في نفس الوقت. يتيح لك البرنامج إنشاء نماذج جديدة من الجزيئات بنفسك. في المجموع ، تم تقديم نماذج من 25 جزيءًا عضويًا ، ومع ذلك ، فإن القيمة التعليمية لهذه النماذج منخفضة ، حيث يتم توفير النماذج بشكل كافٍ وصلات بسيطة، والتي يمكن لكل طالب جمعها باستخدام البلاستيسين والمباريات.
يتم تنفيذ نماذج توضيحية مدارية ثلاثية الأبعاد لبعض الجزيئات في البرنامج " طريقة روابط التكافؤ: تهجين المدارات الذرية.وفي البرنامج طبيعة الرابطة الكيميائية»يشرح أسباب حدوث الرابطة الكيميائية باستخدام مثال تكوين جزيء الهيدروجين من الذرات. وكلا هذين البرنامجين مشمولان في مجموعة البرامج التدريبية " الكيمياء للجميع - 2000».
إطارات سلكية تجريبية تفاعلية مستخدمة في البرامج تشيملاند- 115 جزيء من المركبات العضوية في الغالب ، و " الكيمياء للجميع". هذان البرنامجان لهما إيجابيات وسلبيات: في برنامج الكيمياء للجميع ، يمكن عرض النماذج على الشاشة الكاملة للشاشة ، بينما في برنامج ChemLand لا توجد مثل هذه الوظيفة ، ومع ذلك ، يحتوي البرنامج على عدد كبير من الجزيئات. في ChemLand يتم استخدام النماذج الديناميكية التي توضح التركيب المكاني للجزيئات مع القدرة على قياس زوايا الروابط وأطوال الروابط، مما يسمح لنا بتتبع التغيير في قطبية الجزيء الثلاثي اعتمادًا على نوع الذرات.
عند دراسة بنية الجزيئات والبلورات ، يمكن أن تكون البرامج المصممة بشكل أكبر لأغراض البحث مفيدة. هذا ، على سبيل المثال ، برنامج CS Chem3D Pro ،الذي يسمح لك بإنشاء وتعديل وعرض البنية ثلاثية الأبعاد للجزيئات المختلفة. برنامج مفيد أيضا مصمم كريستال ،الذي تم تصميمه لتصور الهيكل ثلاثي الأبعاد للشبكة البلورية. يمكن أن تكون هذه البرامج مفيدة لإنشاء صور ثلاثية الأبعاد للجزيئات والبلورات ولتوضيحها في الفصل باستخدام الكمبيوتر.
برنامج " تجميع الجزيء"، على الرغم من أن قدراته أقل من البرامج المذكورة أعلاه ، إلا أنه يمكن استخدامها بشكل فعال في العمل الفردي لأطفال المدارس.
يتم تنفيذ نماذج من العمليات والآليات الفيزيائية والكيميائية في البرنامج " الكيمياء للجميع". النماذج غير التفاعلية حول موضوع "التفكك الالكتروليتي" موضحة هنا: تفكك الأملاح ، الأحماض ، القلويات ، التحلل المائي للأملاح. يقوم نفس البرنامج بتنفيذ بعض نماذج آليات التفاعل العضوي: المعالجة ببروم الألكان ، والأسترة ، والآلية العامة لتفاعلات البلمرة ، إلخ. جميع نماذج آليات التفاعل غير تفاعلية ، ويتم عرضها على شاشة كاملة ، ولها صوت ، ولكن لا يوجد وصف نصي للظواهر التي تحدث ، مما يحد بشكل كبير من استخدام البرنامج.
في النسخة الإلكترونية من الكتاب المدرسي التفاعلي للمدرسة الثانوية في الكيمياء العضوية للصفوف من العاشر إلى الحادي عشر ، تم تحريره بواسطة G. I. Deryabina، A.V.Solovovيتم تقديم آليات التبادل والمقبل المتبرع لتشكيل الرابطة التساهمية ، وآليات التحلل المتماثل والمتغير لانقسام الرابطة التساهمية على مثال استخراج ذرة الهيدروجين من جزيء الميثان ، وعملية التهجين sp. ذات أهمية كبيرة نماذج عرض تفاعلية ثلاثية الأبعاد للجزيئات العضويةوآليات التفاعلات الكيميائية: كلورة الميثان والآلية العامة لإحلال النواة. من المهم جدًا أنه عند العمل مع النماذج ، يمكنك تغيير موضعها في الفضاء ، وبالنسبة لآلية التفاعل ، يمكنك تغيير موضع نقطة المراقبة.
برنامج آخر يوضح آليات التفاعلات الكيميائية وهو البرنامج الرسوم المتحركة للتفاعل العضوي.يحتوي على 34 آلية من التفاعلات العضوية. علاوة على ذلك ، يتم تقديم كل آلية في شكل أربعة أنواع مختلفة من النماذج الجزيئية: الكرة والعصا ، وثلاثية الأبعاد ومتغيران لنماذج الريشة المدارية. يوضح أحد المتغيرات في نماذج الريشة المدارية التغيير في المدارات الخارجية للركيزة أثناء التفاعل ، والآخر - للمادة المتفاعلة. هذا يجعل من السهل ملاحظة التغيير في المدارات الخارجية للمواد المتفاعلة أثناء سير التفاعل. إذا لزم الأمر ، يمكنك استخدام المادة النظرية لأداة الإدراك التفاعلية متعددة القنوات. التطورطلاب خاص بهم ...
اختبار الكمبيوتر
الاختبارات >> المعلوماتية... المنهجيات ... دراسة عربيالمؤلفات... تطويرالاختبارات والاختبارات. يجب أن تتمتع تقنية الاختبار المحوسبة بالخصائص الرئيسية التالية: تفاعلي ... عوالم دقيقة); ... (المدرسة ... معهم الاستخدام في ... عارضات ازياء / درس تعليميل سعر الصرف ...
فلسفة ومنهج العلم
دليل الدراسة >> الفلسفةفي مجال علم الأحياء في دراسة عربيالتطور المشترك لمختلف محيط, معهمهياكل ومستويات التنظيم ... والمنشأة. إستعمالتقاوم الأساليب القيود الخارجية المفروضة على معايير الدراسة. عارضات ازياءالتنفيذ...
الأنشطة الاجتماعية والثقافية (2)
كتاب مدرسي >> علم الاجتماع... معهم دراسة، الحفظ ، الإنتاج ، التطوير ، استعمالونتيجة لذلك ، تطوير ... . في دراسة عربي مسار, ... العالم الصغير ... عارضات ازياءوتنتهي نموذج ... تفاعليالأساليب والتقنيات التربوية. من بينها خاصة أساليب... مرحلة ما قبل المدرسة ، المدرسة (...
إرسال عملك الجيد في قاعدة المعرفة أمر بسيط. استخدم النموذج أدناه
سيكون الطلاب وطلاب الدراسات العليا والعلماء الشباب الذين يستخدمون قاعدة المعرفة في دراساتهم وعملهم ممتنين جدًا لك.
لا توجد نسخة HTML من العمل حتى الان.
يمكنك تنزيل أرشيف العمل بالضغط على الرابط أدناه.
وثائق مماثلة
سلسلة متماثلة من الميثان. هيكل جزيء الميثان. الزوايا بين جميع الروابط. الخصائص الفيزيائيةالألكانات. طرق الحصول على المختبر. الحصول من الأملاح الأحماض الكربوكسيلية. نوع تهجين ذرات الكربون في الألكانات. التماثل الهيكلي للألكانات.
عرض تقديمي ، تمت إضافة 10/08/2014
النموذج الإلكتروني للجزيء. نظرية تنافر أزواج الإلكترون لقشرة التكافؤ. تفاعل الجزيئات. تصنيف التفاعلات الكيميائية. درجات الحرية للجزيء ، الخاصة بهم حركة دوارة. وصف تناظر التذبذبات وتفاعلها.
عرض تقديمي ، تمت الإضافة في 10/15/2013
خصائص بنية الذرة. تحديد عدد البروتونات والإلكترونات والنيوترونات. النظر في الرابطة الكيميائية وقطبية الجزيء ككل. معادلات التفكك وثوابت التفكك للإلكتروليتات الضعيفة. تفاعلات الأكسدة والاختزال.
الاختبار ، تمت إضافة 11/09/2015
هيكل الجزيء ، روابط الذرات وخصائص الأسيتيلين مواد كيميائية. خصائص الحصول على الألكينات بالتحلل الحراري للميثان وهدرجة الكربون في الصناعة وتفاعل الإزالة في المختبر. تفاعلات الألكينات التي تنطوي على رابطة ثلاثية.
التحكم في العمل ، تمت إضافة 08/05/2013
الأحكام الرئيسية النظرية الكلاسيكيةالتركيب الكيميائي للجزيء. الخصائص التي تحدد تفاعلها. راد متماثل من الألكانات. تسمية وتساوي قياس الهيدروكربونات. تصنيف المركبات العضوية المحتوية على الأكسجين.
عرض تقديمي ، تمت إضافة 01/25/2017
العنصر الكيميائي هو مجموعة ذرات من نفس النوع. اكتشاف العناصر الكيميائية. أحجام الذرات والجزيئات. أشكال وجود العناصر الكيميائية. بعض المعلومات حول التركيب الجزيئي وغير الجزيئي للمواد. العقيدة الجزيئية الذرية.
عرض تقديمي ، تمت الإضافة بتاريخ 04/15/2012
التسلسل العام لحساب التركيب الإلكتروني للجزيء باستخدام طريقة MO LCAO. طريقة Hückel البسيطة. أمثلة الهياكل الجزيئيةلطريقة MOX. الأليل في طريقة MOX. الخصائص العامةالتوزيع الإلكتروني في نظام Hückel الهيدروكربوني.
النموذج الفيزيائي والكيميائي للعمليات في التفريغ الدقيق للأنود
ف. بوربات ، أو.أ. جولوفانوفا ، أ.م. سيزيكوف ، أومسك جامعة الدولةقسم الكيمياء غير العضوية
تتكون طبقات الأكسيد على أنودات مصنوعة من الألمنيوم والتيتانيوم والتنتالوم وبعض المعادن الأخرى أثناء المرور التيار الكهربائيبين الأقطاب الكهربائية المغمورة في المنحل بالكهرباء ، في بعض الحالات لها خصائص وقائية وعازلة عالية. حاليًا ، تجري المختبرات في مختلف البلدان قدرًا كبيرًا من الأبحاث التي تهدف إلى إنشاء فرص لتحسين الخصائص الوقائية والكهربائية لطلاء الأنود ، والبحث عن تركيبات الإلكتروليت المثلى ، وتحسين قابلية التصنيع للعملية ، وما إلى ذلك. الخبرة العملية المتراكمة مؤخرًا في استخدام علاج الأنود البلازمي لإنشاء الطلاءات الواقية قد تفوقت بشكل كبير على المفاهيم النظرية المتاحة في هذا المجال.
استنادًا إلى الأدبيات والبيانات التجريبية الخاصة بنا ، يمكننا قبول نموذج فيزيائي للتفريغ الدقيق للأنود ، والفكرة الرئيسية منه هي أن التفريغ الدقيق للأنود هو مزيج من تفكيك شرارة لجزء الحاجز من فيلم الأكسيد والغاز. التفريغ في فقاعة الغاز والبلازما التي ظهرت بعد الانهيار. خذ بعين الاعتبار تطابق النموذج المقترح نتائج تجريبيةمع مراعاة تسلسل العمليات.
أكسدة. أثناء الأكسدة (بجهد ثابت على الأقطاب الكهربائية) ، تتكون طبقات يصل سمكها إلى مئات الميكرونات. إلى جانب تكوين طبقات أكسيد جديدة ، تحدث أيضًا عملية انحلالها. أظهر عدد من الدراسات أنه في فترة ما قبل الشرارة لنمو طبقة الأكسيد ، يتم تضمين الأنيونات المنحل بالكهرباء ، مثل أيونات الكبريتات ، في حجم الأكسيد. في الأغشية المسامية ، تظهر الأنيونات في أكسيد الأنوديك بسبب "التضمين" الميكانيكي لمكونات المحلول. يتم تحديد محتوى الأنيونات المتضمنة في الأكسيد من خلال قدرتها على الامتصاص على سطح الرواسب أو حتى تكوين مركبات ذات تركيبة غير متجانسة.
عند دراسة المرحلة والتكوين الأولي للطلاء الذي تم الحصول عليه عن طريق المعالجة بالتحليل الكهربائي للبلازما ، وجد أنه بهذه الطريقة للحصول على الطلاءات ، يتم إدخال أيونات الكبريتات في الفيلم. علاوة على ذلك ، فإن نوع التسجيلات يعطي أسبابًا لافتراض أن "كسب" مكونات الإلكتروليت يحدث في الأماكن التي يحدث فيها التفريغ الدقيق المصعدي في وقت "الشفاء" ، وبالتالي ، فإن توزيع مكونات الإلكتروليت فوق الفيلم ليس موحدًا ويختلف من التوزيع في الأفلام التي تم الحصول عليها بواسطة الأنودة التقليدية.
الانهيار هو عملية احتمالية معقدة يمكن أن تحدث عند نقطة معينة في عازل على مدى واسع إلى حد ما من الفولتية والأوقات. أهم العمليات لبدء الانهيار هي التغيير في شحنة الفضاء بالقرب من الكاثود (محلول الإلكتروليت) وزيادة في حجم حقن الإلكترونات في نطاق التوصيل للفيلم العازل. تساهم هذه العمليات في تطوير الانهيار. يرتبط بداية الانهيار بتطور الانهيارات الإلكترونية. من المحتمل جدًا أن تكون مستويات الشوائب في الأكسيد مصدرًا للأيونات الأولية. تقترح مثل هذه الآلية دورًا خاصًا لمكونات الإلكتروليت التي يتم إدخالها في الأكسيد ، وخاصة الأنيونات. هذا هو السبب في أن إمكانية الحصول على طلاءات شرارة أنوديك يتم تحديدها إلى حد كبير من خلال تكوين المحلول. تكتسب الإلكترونات التي تدخل نطاق التوصيل والتي يتم تسريعها بواسطة المجال طاقة كافية لإحداث تأين تصادم للذرات في الأكسيد. هذا الأخير يؤدي إلى حدوث الانهيارات الجليدية ، والتي تصل إلى سطح المعدن وتشكل قنوات انهيار. وجود الاعتماد الخطييشير الاختلاف بين جهد الانهيار والسمك إلى توحيد المجال أثناء الانهيار والطبيعة الكهربائية للانهيار.
تدمير فيلم الأكسيد - عند تعريضه لتفريغ دقيق أنوديك على محاليل حمض الكبريتيك ، فإن عمل تسريع الحقل الكهربائيستتعرض الإلكترونات لجزيئات الماء وحمض الكبريتيك. تتوفر بيانات حول تأين هذه الحلول في الأدبيات. بناءً عليها ، فإن الأيونات الأكثر احتمالية في بلازما التفريغ الدقيق ستكون على الأرجح أيونات ذات إمكانات ظهور أقل ، أي يجب توقع H2O + لجزيئات الماء ، H2SO4 + لحمض الكبريتيك ، وأقل احتمالًا لـ H2SO4 +.
لذلك ، فإن عمليات التأين والتعلق الانفصالي للإلكترونات تعطي الأيونات التالية عند تطبيق التفريغ الدقيق على محاليل حمض الكبريتيك (التفاعلات 1-5). e + H2O H2O + 2e (1) ، e + H2SO4 H2SO4 + + 2e (2) ، أو HSO4 + H + + 2e (3) ، e + H2O OH + H- (4) ، e + H2SO4 H + HSO4- (5).
للأيونات الموجبة والسالبة الناتجة عن هذه التفاعلات طريقتان مختلفتان لتحولاتهما: 1) تحييد الشحنات ؛ 2) التفاعلات الجزيئية الأيونية. تدخل الجذور المتكونة نتيجة لتفكك الجسيمات المثارة والتفاعلات الجزيئية الأيونية في تفاعلات تجريد ذرة H من الجزيئات في فقاعة الغاز وفي تفاعل إعادة التركيب.
بعد تكوين الجذور ، تحدث تفاعلات تجريد ذرة H: H (OH ، HSO4) + H2SO4 H2 (H2O ، H2SO4) + HSO4 (6) ، H (HSO3) + H2O H2 (H2SO3) + OH (7) وردود فعل إعادة تركيب الجذور: HSO4 + OH H2SO4 (8)، HSO4 + HSO4 H2S2O8 (9)، OH + OH H2O2 (10)، H + HSO4 H2SO4 (11).
يكون تكوين ثاني أكسيد الكبريت ممكنًا نتيجة تفاعل جزيئات حمض الكبريتيك التي تثيرها بلازما التفريغ الدقيق مع الجزيئات المجاورة: H2SO4 * + H2SO4 H2SO3 + H2SO5 (12) ، أو الآلية ممكنة أيضًا: H2SO4 * H2SO3 + O (13). ينفصل H2SO3 و H2SO5 الناتج عن ارتفاع درجة الحرارة في منطقة التفريغ الدقيق حراريًا وفقًا للمعادلات:
H2SO3 ، H2O + SO2 (14) ، 2H2SO5 ، 2H2SO4 + 0.5 O2 (15).
يتخطى بعض الجذور فقاعة غاز التفريغ الدقيق إلى السائل المحيط بها ، حيث تدخل في تفاعلات إعادة التركيب مع بعضها البعض وتتفاعل مع مكونات الإلكتروليت. سيعتمد إنتاجية المنتجات نتيجة العمليات التي تحدث في الطبقة القريبة من الفقاعة من الإلكتروليت على تركيز حامض الكبريتيك (أي على نسبة الأيونات الموجودة في محاليل حمض الكبريتيك بتركيزات مختلفة).
وفقًا للآلية المقترحة للتحولات الكيميائية لحمض الكبريتيك ، مع زيادة تركيزه في محلول ، وإلا مع زيادة تركيزه في فقاعة غاز التفريغ الدقيق ، وزيادة عدد المؤين مباشرة والمثارة بواسطة تأثير الإلكترون الكبريتي سوف تحدث جزيئات الحمض. نظرًا لانخفاض التأين عند طاقات الإلكترون الشائعة لتصريف الغاز ، فإن التحولات الكيميائية للمواد تتم بشكل أساسي من خلال الحالات المثارة ، ثم في حالة التعرض لتفريغ دقيق مع زيادة تركيز حامض الكبريتيك ، ينبغي توقع زيادة في محصول المنتجات التي تكون الجسيمات المُثارة هي السلائف.
مع زيادة تركيز حامض الكبريتيك (أكثر من 14 مليونًا) ، تزداد نسبة جزيئات حمض الكبريتيك في فقاعة الغاز والبلازما ، على التوالي ، يحدث تحلل المادة المذابة بسبب فعل مباشرالتفريغ الدقيق للبلازما. بالنسبة لمحاليل حمض الكبريتيك الأقل من 14 مترًا ، يحدث تحويل المذاب بشكل أساسي بسبب تأثير البلازما على المذيب - وهو إجراء غير مباشر. هذا يزيد من احتمالية حدوث تفاعلات 9،10،11،13 مما يؤدي إلى تكوين مستقر المنتجات الجزيئية: ثاني أكسيد الكبريت ومركبات البيروكسيد.
"شفاء" المسام - يؤدي التوسع الإضافي في تكوين البلازما إلى انخفاض كبير في درجة حرارة الأخير ، ونتيجة لذلك ، إلى انخفاض في تركيز ناقلات التفريغ ، وانقطاع التيار والتبريد السريع للقناة . سيحدث اختفاء فقاعة الغاز والبلازما بعد إطفاء تصريف الغاز فيها. من المعروف أن تصريف الغاز سوف ينطفئ عندما تنخفض الكثافة الحالية فيه إلى ما دون المستوى الأدنى المسموح به للاكتفاء الذاتي للتصريف. في حالة التفريغ الدقيق ، يمكن أن تكون أسباب الانخفاض في الكثافة الحالية لتفريغ الغاز هي: 1) استنفاد الطبقة القريبة من الفقاعة من الإلكتروليت مع ناقلات التيار بمرور الوقت ، ونتيجة لذلك يصبح المنحل بالكهرباء غير قادر على توفير الحد الأدنى من كثافة التيار يسمح بالاكتفاء الذاتي للتصريف ، ويموت تفريغ الغاز ؛ 2) زيادة حجم فقاعة التفريغ الدقيق بسبب تبخر السائل المحيط بها ؛ 3) الانصهار أو "الشفاء" (بأكسيد البلازما الغازية) لقناة الانهيار في الجزء الحاجز لفيلم الأكسيد. عادة ما تصل الحفرة التي تشكلت خلال الانهيار الأول إلى السطح المعدني. عند هذه النقطة ، تصبح الكثافة الحالية القصوى بسبب المقاومة المنخفضة نسبيًا للكهارل في الحفرة ، مما يضمن ظهور سريعفيلم أكسيد (منتج من تفاعل البلازما الكيميائي MexOy). هناك "شفاء" لموقع الانهيار ، ويزداد سمك طبقة الأكسيد ، وبشكل رئيسي في عمق مادة الركيزة.
وبالتالي ، بناءً على نتائج التجربة وبيانات الأدبيات ، تم اقتراح آلية تأثير التفريغ الدقيق للأنود على محاليل حمض الكبريتيك ، والتي تشمل المراحل التالية:
تكوين الجزيئات المثارة والمتأينة في فقاعة التفريغ الدقيق بسبب تدفق تصريف الغاز فيها ؛
مسار التفاعلات مع تكوين الجذور والمنتجات الجزيئية ، والتي تعطي تفاعلاتها مع بعضها البعض ومع المواد الأولية الجزء الأكبر من المنتجات النهائية ؛
إزالة الانتشار للجذور الناتجة والجسيمات الأخرى خارج فقاعة الغاز ، والتي تؤدي تفاعلاتها إلى المنتجات الجزيئية النهائية في الطبقة القريبة من الفقاعة من الإلكتروليت.
فهرس
Bakovets V.V. ، Polyakov O.V. ، Dolgovesova I.P. معالجة أنود البلازما بالكهرباء للمعادن // Novosibirsk: Nauka، 1991. ص 63-68.
ناجاتانت تي ، ياشينارا إس تي. دراسات حول توزيع شظايا الأيونات ورد فعلها بواسطة مطياف الشحنة // J. Bull. كيمياء. soc. ياب. ، 1973. V.46. رقم 5. ص 1450-1454.
Mann M.، Hastrulid A.، Tate J. تأين وتفكك بخار الماء والأمونيا بتأثير الإلكترون // J. Phys. القس. 1980. V.58. ص340-347.
إيفانوف يو إيه ، بولاك إل إس. توزيع طاقة الإلكترونات في بلازما درجات الحرارة المنخفضة // كيمياء البلازما ، موسكو: أتوميزدات ، 1975. العدد. 2. C.161-198.
لإعداد هذا العمل ، مواد من الموقع http://www.omsu.omskreg.ru/