Qaysi tenglamada koeffitsientlar to'g'ri joylashtirilgan? Kimyoviy tenglamalarda koeffitsientlarni joylashtirish

Shuningdek o'qing
Eng oddiy reaksiya tenglamasi:
Fe + S => FeS
Siz nafaqat reaksiya tenglamasini yozishni, balki uni o'qishni ham bilishingiz kerak. Bu tenglama, eng oddiy shaklda, shunday o'qiydi: temir molekulasi oltingugurt molekulasi bilan o'zaro ta'sir qiladi, natijada temir sulfidning bir molekulasi hosil bo'ladi.
Reaksiya tenglamasini yozishda eng qiyin narsa reaksiya mahsulotlari uchun formulalar yaratishdir, ya'ni. hosil bo'lgan moddalar. Bu erda faqat bitta qoida mavjud: molekulalarning formulalari qat'iy ravishda ularni tashkil etuvchi elementlarning valentligiga qarab qurilgan.
Bundan tashqari, reaktsiya tenglamalarini tuzishda moddalar massasining saqlanish qonunini esga olish kerak: boshlang'ich moddalar molekulalarining barcha atomlari reaktsiya mahsulotlari molekulalariga kiritilishi kerak. Birorta ham atom yo'q bo'lib ketmasligi yoki kutilmaganda paydo bo'lmasligi kerak. Shuning uchun, ba'zida reaktsiya tenglamasidagi barcha formulalarni yozgandan so'ng, siz tenglamaning har bir qismidagi atomlar sonini tenglashtirishingiz kerak - koeffitsientlarni o'rnating. Mana bir misol:
C + O 2 => CO 2Bu erda har bir element bir xil raqam tenglamaning o'ng va chap tomonidagi atomlar. Tenglama tayyor.
Cu+O 2 => CuO
Va bu erda tenglamaning chap tomonida o'ngga qaraganda ko'proq kislorod atomlari mavjud. Mis oksidining juda ko'p molekulalarini olish kerak
CuO , shuning uchun ular bir xil miqdordagi kislorod atomlarini o'z ichiga oladi, ya'ni 2. Shuning uchun formulaCuO o'rnatilgan koeffitsient 2:Cu+O2 => 2 CuO
Endi mis atomlarining soni bir xil emas. Tenglamaning chap tomonida, mis belgisidan oldin biz 2 koeffitsientini qo'yamiz:
2 Cu + O2 => 2 CuO
Tenglamaning chap va o'ng tomonlarida har bir elementning atomlari soni teng yoki yo'qligini hisoblang. Ha bo'lsa, reaksiya tenglamasi to'g'ri.
Yana bir misol: Al+O 2 = Al 2 O 3
Va bu erda reaktsiyadan oldin va keyin har bir elementning turli xil atomlari mavjud. Biz gaz bilan - kislorod molekulalari bilan tekislashni boshlaymiz:
1) chap 2 ta kislorod atomi, o'ng tomonda esa 3 ta. Biz bu ikki raqamning eng kichik umumiy karralini qidiramiz. Bu 2 va 3 ga bo'linadigan eng kichik raqam, ya'ni 6 ga. Kislorod va alyuminiy oksidi formulalaridan oldinAl 2 O 3 Biz koeffitsientlarni shunday o'rnatamiz umumiy soni Ushbu molekulalarda 6 ta kislorod atomi mavjud edi:
Al+ 3 O 2= 2 Al 2 O 3
2) Biz alyuminiy atomlarining sonini hisoblaymiz: chap tomonda 1 atom, o'ngda esa ikkita molekulada 2 ta atom, ya'ni 4 ta. Tenglamaning chap tomonidagi alyuminiy belgisidan oldin biz 4 koeffitsientini qo'yamiz:
4Al + 3O 2 => 2 Al2O3
3) Reaksiyadan oldin va keyin barcha atomlarni yana bir bor hisoblaymiz: har biri 4 ta alyuminiy atomi va 6 ta kislorod atomi.
Hamma narsa tartibda, reaktsiya tenglamasi to'g'ri. Va agar reaktsiya qizdirilganda sodir bo'lsa, u holda o'qning ustiga qo'shimcha belgi qo'yiladi t.
Tenglama kimyoviy reaksiya yordamida kimyoviy reaksiyaning borishini qayd etishdir kimyoviy formulalar va koeffitsientlar.
Ko'rsatmalar
Vazifani o'zi boshlashdan oldin, oldinga qo'yilgan raqamni tushunishingiz kerak kimyoviy element yoki butun koeffitsient formulasi. Va bu raqam indeksga arziydi (va biroz). Bundan tashqari, bu:
Koeffitsient formulada undan keyin paydo bo'lgan barcha kimyoviy belgilarga taalluqlidir
Koeffitsient indeksga ko'paytiriladi (qo'shilmaydi!)
Reaksiyaga kiruvchi moddalarning har bir elementining atomlari soni reaksiya mahsulotlari tarkibiga kiradigan ushbu elementlarning atomlari soniga to'g'ri kelishi kerak.
Masalan, 2H2SO4 formulasini yozish 4 H (vodorod) atomi, 2 S (oltingugurt) atomi va 8 O (kislorod) atomini bildiradi.
1. Misol No 1. Etilenning yonishini ko'rib chiqing.
Yonish paytida organik moddalar uglerod oksidi (IV) hosil bo'ladi ( karbonat angidrid) va suv. Keling, koeffitsientlarni ketma-ket ko'rib chiqaylik.
C2H4 + O2 => CO2+ H2O
Keling, tahlil qilishni boshlaylik. Reaksiyaga 2 ta C (uglerod) atomi kirdi, lekin faqat 1 atom olindi, ya'ni CO2 ning oldiga 2 ta qo'ydik.
C2H4 + O2 => 2CO2+ H2O
Endi H (vodorod) ni ko'rib chiqamiz. Reaksiyaga 4 ta vodorod atomi kirdi, ammo natijada atigi 2 atom bor edi, shuning uchun biz H2O (suv) oldiga 2 ta qo'ydik - endi biz ham 4 tani olamiz.
C2H4 + O2 => 2CO2+ 2H2O
Reaksiya natijasida hosil bo'lgan barcha O (kislorod) atomlarini hisoblaymiz (ya'ni tenglikdan keyin). 2CO2da 4 atom va 2H2Oda 2 atom - jami 6 atom. Va reaktsiyadan oldin faqat 2 ta atom mavjud, ya'ni kislorod molekulasi O2 oldiga 3 tasini qo'yamiz, ya'ni ularning 6 tasi ham bor.
C2H4 + 3O2 => 2CO2+ 2H2O
Shunday qilib, natijada har bir elementning teng belgisidan oldin va keyin bir xil miqdordagi atomlari paydo bo'ladi.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Misol No 2. Alyuminiyning suyultirilgan sulfat kislota bilan reaksiyasini ko'rib chiqing.
Al + H2SO4 => Al2 (SO4) 3 + H2
Biz Al2 (SO4) 3 tarkibiga kiradigan S atomlarini ko'rib chiqamiz - ulardan 3 tasi bor, lekin H2SO4 (sulfat kislota) da faqat 1 bor, shuning uchun biz sulfat kislota oldiga 3 tasini qo'yamiz.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Ammo hozir reaksiyadan oldin 6 ta H (vodorod) atomlari bor va reaktsiyadan keyin faqat 2 ta, ya'ni biz H2 (vodorod) molekulasi oldiga ham 3 ta qo'yamiz, shuning uchun jami 6 tani olamiz.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Nihoyat, biz qaraymiz. Al2 (SO4) 3 (alyuminiy sulfat) tarkibida faqat 2 ta alyuminiy atomi bo'lganligi sababli, reaktsiyadan oldin Al (alyuminiy) oldiga 2 ta qo'yamiz.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Endi reaksiyadan oldin va keyin barcha atomlarning soni bir xil. Ma'lum bo'lishicha, kimyoviy tenglamalarda koeffitsientlarni tartibga solish unchalik qiyin emas. Faqat mashq qiling va hamma narsa muvaffaqiyatli bo'ladi.
Shuni yodda tutingki, koeffitsient indeks bilan ko'paytiriladi va qo'shilmaydi.
Manbalar:
- elementlar qanday reaksiyaga kirishadi
- "Kimyoviy tenglamalar" mavzusi bo'yicha test
Ko'pgina maktab o'quvchilari uchun kimyoviy reaktsiyalar tenglamalarini yozing va ularni to'g'ri joylashtiring imkoniyatlar oson ish yo'q. Bundan tashqari, negadir ular uchun asosiy qiyinchilik uning ikkinchi qismidir. Bunda hech qanday murakkab narsa yo'qdek tuyuladi, lekin ba'zida talabalar taslim bo'lib, butunlay sarosimaga tushib qolishadi. Lekin siz faqat bir nechtasini eslab qolishingiz kerak oddiy qoidalar, va vazifa endi qiyinchiliklarga olib kelmaydi.
Ko'rsatmalar
Koeffitsient, ya'ni molekula formulasi oldidagi son kimyoviy modda, barcha belgilarga va har bir belgiga ko'paytiriladi! U ko'paymoqda, qo'shmaydi! Bu aql bovar qilmaydigan tuyulishi mumkin, lekin ba'zi talabalar ularni ko'paytirish o'rniga ikkita raqam qo'shadilar.
Boshlang'ich moddalarning har bir elementining atomlari soni (ya'ni, tenglamaning chap tomonida joylashgan) reaktsiya mahsulotlarining har bir elementi atomlari soniga to'g'ri kelishi kerak (mos ravishda uning o'ng tomonida joylashgan).
Qanday qilib qo'ng'iroq qilishni tushunish uchun kimyoviy tenglama, avvalo bu fanning maqsadini bilishingiz kerak.
Ta'rif
Kimyo moddalar, ularning xossalari va o'zgarishlarini o'rganadi. Agar rang, yog'ingarchilik yoki gazsimon moddaning chiqishi o'zgarmasa, kimyoviy o'zaro ta'sir sodir bo'lmaydi.
Misol uchun, temir tirnoqni topshirishda metall shunchaki kukunga aylanadi. Bu holda yo'q kimyoviy reaksiya sodir bo'lmayapti.
Kalsinatsiya kaliy permanganat marganets oksidi (4) hosil bo'lishi bilan birga kislorodning chiqishi, ya'ni o'zaro ta'sir kuzatiladi. Bu kimyoviy tenglamalarni qanday qilib to'g'ri tenglashtirish haqida mutlaqo tabiiy savol tug'diradi. Keling, bunday tartib bilan bog'liq barcha nuanslarni ko'rib chiqaylik.

Kimyoviy o'zgarishlarning o'ziga xos xususiyatlari
Moddalarning sifat va miqdoriy tarkibi o'zgarishi bilan kechadigan har qanday hodisalar kimyoviy transformatsiyalar deb tasniflanadi. Molekulyar shaklda temirning atmosferada yonish jarayonini belgilar va belgilar yordamida ifodalash mumkin.
Koeffitsientlarni belgilash metodikasi
Kimyoviy tenglamalarda koeffitsientlarni qanday tenglashtirish mumkin? Kimyo bo'yicha eng yangi o'rta maktab Elektron balans usuli muhokama qilinadi. Keling, jarayonni batafsil ko'rib chiqaylik. Boshlash uchun, dastlabki reaktsiyada har bir kimyoviy elementning oksidlanish darajasini tartibga solish kerak.
Har bir element uchun ularni aniqlash mumkin bo'lgan muayyan qoidalar mavjud. Oddiy moddalarda oksidlanish holatlari nolga teng bo'ladi. Ikkilik birikmalarda birinchi element eng yuqori valentlikka mos keladigan musbat qiymatga ega. Ikkinchisi uchun bu parametr guruh raqamini sakkizdan ayirish yo'li bilan aniqlanadi va minus belgisiga ega. Uch elementdan iborat formulalar oksidlanish darajasini hisoblashda o'z nuanslariga ega.
Birinchi va oxirgi element uchun tartib ikkilik birikmalardagi ta'rifga o'xshaydi va markaziy elementni hisoblash uchun tenglama tuziladi. Barcha ko'rsatkichlarning yig'indisi nolga teng bo'lishi kerak, bunga asoslanib, formulaning o'rta elementi uchun ko'rsatkich hisoblanadi.
Elektron balans usuli yordamida kimyoviy tenglamalarni qanday tenglashtirish haqida suhbatni davom ettiramiz. Oksidlanish darajalari aniqlangandan so'ng, kimyoviy o'zaro ta'sir paytida ularning qiymatini o'zgartirgan ionlar yoki moddalarni aniqlash mumkin.
Plyus va minus belgilari kimyoviy o'zaro ta'sir davomida qabul qilingan (ehson qilingan) elektronlar sonini ko'rsatishi kerak. Olingan sonlar orasida eng kichik umumiy karra topiladi.
Qabul qilingan va berilgan elektronlarga bo'linganda koeffitsientlar olinadi. Kimyoviy tenglamani qanday muvozanatlash mumkin? Balansda olingan ko'rsatkichlar tegishli formulalar oldiga joylashtirilishi kerak. Majburiy shart - chap va o'ng tomonlardagi har bir elementning miqdorini tekshirish. Agar koeffitsientlar to'g'ri joylashtirilgan bo'lsa, ularning soni bir xil bo'lishi kerak.

Moddalar massasining saqlanish qonuni
Kimyoviy tenglamani qanday muvozanatlash haqida o'ylayotganda, aynan shu qonundan foydalanish kerak. Kimyoviy reaktsiyaga kirgan moddalarning massasi hosil bo'lgan mahsulotlarning massasiga teng ekanligini hisobga olsak, formulalar oldiga koeffitsientlar qo'yish mumkin bo'ladi. Masalan, agar ular o'zaro ta'sir qilsa, kimyoviy tenglamani qanday muvozanatlash kerak oddiy moddalar kaltsiy va kislorod va jarayon tugagandan so'ng oksid olinadi?
Ushbu vazifani bajarish uchun kislorod ikki atomli molekula ekanligini hisobga olish kerak. kovalent qutbsiz aloqa, shuning uchun uning formulasi quyidagi shaklda yoziladi - O2. Yozish paytida o'ng tomonda kaltsiy oksidi(CaO) har bir elementning valentligini hisobga oladi.
Avval siz tenglamaning har bir tomonida kislorod miqdorini tekshirishingiz kerak, chunki u boshqacha. Moddalarning massasini saqlash qonuniga ko'ra, mahsulot formulasi oldiga 2 koeffitsienti qo'yilishi kerak Keyinchalik, kaltsiy tekshiriladi. Uni tenglashtirish uchun biz asl moddaning oldiga 2 koeffitsientini qo'yamiz, natijada biz quyidagi yozuvni olamiz.
- 2Ca+O2=2CaO.

Elektron balans usuli yordamida reaksiyani tahlil qilish
Kimyoviy tenglamalarni qanday muvozanatlash mumkin? OVR misollari javob berishga yordam beradi bu savol. Elektron balans usulidan foydalangan holda taklif qilingan sxemada koeffitsientlarni tartibga solish zarur deb faraz qilaylik:
- CuO + H2=Cu + H2O.
Boshlash uchun biz boshlang'ich moddalar va reaktsiya mahsulotlaridagi elementlarning har biri uchun oksidlanish darajasini belgilaymiz. olamiz keyingi ko'rinish tenglamalar:
- Cu(+2)O(-2)+H2(0)=Cu(0)+H2(+)O(-2).
Ko'rsatkichlar mis va vodorod uchun o'zgargan. Ularning asosida biz elektron balansni tuzamiz:
- Cu(+2)+2e=Cu(0) 1 qaytaruvchi, oksidlanish;
- H2(0)-2e=2H(+) 1 oksidlovchi, qaytarilish.
Elektron balansda olingan koeffitsientlarga asoslanib, biz taklif qilingan kimyoviy tenglama uchun quyidagi yozuvni olamiz:
- CuO+H2=Cu+H2O.
Keling, koeffitsientlarni belgilashni o'z ichiga olgan yana bir misolni olaylik:
- H2+O2=H2O.
Moddalarning saqlanish qonuniga asoslangan ushbu sxemani tenglashtirish uchun kisloroddan boshlash kerak. Ikki atomli molekula reaksiyaga kirishganligini hisobga olsak, reaksiya mahsuloti formulasi oldiga 2 koeffitsientini qo'yish kerak.
- 2H2+O2=2H2O.

Xulosa
Elektron balansga asoslanib, har qanday kimyoviy tenglamalarda koeffitsientlarni joylashtirishingiz mumkin. To‘qqizinchi va o‘n birinchi sinf bitiruvchilari ta'lim muassasalari Kimyo fanidan imtihonni tanlaganlarga yakuniy test topshiriqlaridan birida shu kabi topshiriqlar taklif etiladi.
13-darsda "" Kursdan " Dummies uchun kimyo» kimyoviy tenglamalar nima uchun kerakligini ko'rib chiqing; bilan kimyoviy reaksiyalarni tenglashtirishni o'rganamiz to'g'ri joylashtirish koeffitsientlar Ushbu dars sizdan bilishni talab qiladi kimyoviy asoslar oldingi darslardan. Empirik formulalar va kimyoviy tahlillarni chuqur o'rganish uchun elementar tahlil haqida o'qing.
Metan CH 4 ning kislorod O 2 dagi yonish reaktsiyasi natijasida karbonat angidrid CO 2 va suv H 2 O hosil bo'ladi kimyoviy tenglama:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Keling, kimyoviy tenglamadan shunchaki ko'rsatkichdan ko'ra ko'proq ma'lumot olishga harakat qilaylik mahsulotlar va reaktivlar reaktsiyalar. Kimyoviy tenglama (1) to'liq emas va shuning uchun 1 CH 4 molekulasiga qancha O 2 molekulasi sarflanishi va buning natijasida qancha CO 2 va H2 O molekulalari olinishi haqida hech qanday ma'lumot berilmaydi. Ammo reaksiyada har bir turdagi nechta molekula ishtirok etishini ko'rsatadigan tegishli molekulyar formulalar oldiga raqamli koeffitsientlarni yozsak, biz shunday bo'lamiz. to'liq kimyoviy tenglama reaktsiyalar.
Kimyoviy tenglamaning (1) tarkibini to'ldirish uchun siz bitta oddiy qoidani eslab qolishingiz kerak: tenglamaning chap va o'ng tomonlarida har bir turdagi atomlarning bir xil soni bo'lishi kerak, chunki kimyoviy reaktsiya paytida yangi atomlar bo'lmaydi. yaratilgan va mavjudlari yo'q qilinmaydi. Bu qoida bobning boshida ko'rib chiqqan massaning saqlanish qonuniga asoslanadi.
Bu oddiy kimyoviy tenglamadan to'liq tenglamani olish uchun kerak. Shunday qilib, keling, reaktsiyaning haqiqiy tenglamasiga (1) o'taylik: kimyoviy tenglamaga, aynan o'ng va chap tomonlardagi atomlar va molekulalarga yana bir nazar tashlang. Reaksiyada uch turdagi atomlar ishtirok etishini ko‘rish oson: uglerod C, vodorod H va kislorod O. Kimyoviy tenglamaning o‘ng va chap tomonidagi har bir turdagi atomlar sonini sanab, solishtiramiz.
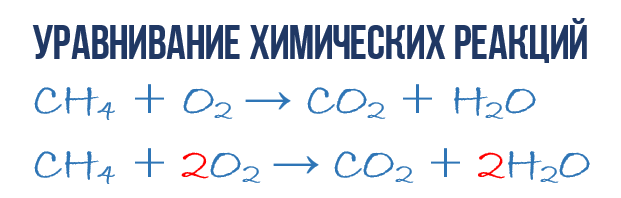
Keling, uglerod bilan boshlaylik. Chap tomonda bitta C atomi CH 4 molekulasining bir qismi, o'ng tomonda esa bitta C atomi CO 2 ning bir qismidir. Shunday qilib, chap va o'ng tomonlarda uglerod atomlarining soni bir xil, shuning uchun biz uni yolg'iz qoldiramiz. Aniqlik uchun uglerodli molekulalar oldiga 1 koeffitsientini qo'yaylik, garchi bu shart emas:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Keyin vodorod atomlarini hisoblashga o'tamiz H. Chap tomonda CH 4 molekulasida 4 ta H atomi (miqdoriy ma'noda H 4 = 4H), o'ng tomonda esa faqat 2 H atomi mavjud. H 2 O molekulasi, bu kimyoviy tenglamaning chap tomonidagidan ikki baravar kam (2). Keling, tenglashamiz! Buning uchun H 2 O molekulasi oldiga 2 koeffitsientini qo'yaylik, endi biz reaktivlarda ham, mahsulotlarda ham 4 ta vodorod molekulasiga ega bo'lamiz.
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
E'tibor bering, vodorod H ni tenglashtirish uchun suv molekulasi H 2 O oldiga yozgan 2 koeffitsienti uning tarkibiga kiradigan barcha atomlardan 2 barobar ortadi, ya'ni 2H 2 O 4H va 2O ni bildiradi. Mayli, biz buni saralab oldik shekilli, qolgan narsa kimyoviy tenglamadagi kislorod atomlari O sonini hisoblash va solishtirish (3). Chap tomonda O atomlari o'ngdagiga qaraganda roppa-rosa 2 baravar kam ekanligi darhol e'tiboringizni tortadi. Endi siz kimyoviy tenglamalarni qanday muvozanatlashni bilasiz, shuning uchun men darhol yakuniy natijani yozaman:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O yoki CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Ko'rib turganingizdek, kimyoviy reaktsiyalarni tenglashtirish unchalik qiyin narsa emas va bu erda kimyo emas, balki matematika muhim ahamiyatga ega. (4) tenglama deyiladi to'liq tenglama kimyoviy reaktsiya, chunki u massa saqlanish qonuniga bo'ysunadi, ya'ni. reaksiyaga kiradigan har bir turdagi atomlar soni reaksiya tugagandan so'ng ushbu turdagi atomlar soniga to'g'ri keladi. Ushbu to'liq kimyoviy tenglamaning har bir tomonida 1 ta uglerod atomi, 4 ta vodorod atomi va 4 ta kislorod atomi mavjud. Biroq, er-xotinni tushunishga arziydi muhim nuqtalar: kimyoviy reaksiya murakkab ketma-ketlik oraliq bosqichlarni ajratib turadi va shuning uchun, masalan, (4) tenglamani 1 metan molekulasi bir vaqtning o'zida 2 kislorod molekulasi bilan to'qnashishi kerak degan ma'noda izohlash mumkin emas. Reaksiya mahsulotlarini hosil qilish jarayonida sodir bo'ladigan jarayonlar ancha murakkab. Ikkinchi nuqta: to'liq tenglama reaksiya bizga uning molekulyar mexanizmi haqida, ya'ni uning paydo bo'lishi jarayonida molekulyar darajada sodir bo'ladigan hodisalar ketma-ketligi haqida hech narsa aytmaydi.
Kimyoviy reaksiya tenglamalarida koeffitsientlar
Yana bitta aniq misol uni qanday qilib to'g'ri joylashtirish kerak imkoniyatlar kimyoviy reaksiya tenglamalarida: Trinitrotoluol (TNT) C 7 H 5 N 3 O 6 kislorod bilan kuchli birikib H 2 O, CO 2 va N 2 ni hosil qiladi. Tenglashadigan reaksiya tenglamasini yozamiz:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Ikki TNT molekulasiga asoslangan to'liq tenglamani qurish osonroq, chunki chap tomonda mavjud toq raqam vodorod va azot atomlari va o'ngda - hatto:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Keyin 14 ta uglerod atomi, 10 ta vodorod atomi va 6 ta azot atomi 14 molekula karbonat angidrid, 5 molekula suv va 3 molekula azotga aylanishi aniq bo'ladi:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Endi ikkala qism ham kisloroddan tashqari barcha atomlarning bir xil sonini o'z ichiga oladi. Tenglamaning o'ng tomonida joylashgan 33 ta kislorod atomidan 12 tasi ikkita TNT molekulasi tomonidan, qolgan 21 tasi esa 10,5 O 2 molekulasi tomonidan ta'minlanishi kerak. Shunday qilib, to'liq kimyoviy tenglama quyidagicha ko'rinadi:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Siz ikkala tomonni 2 ga ko'paytirasiz va butun bo'lmagan koeffitsient 10,5 dan xalos bo'lishingiz mumkin:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Ammo buni qilish shart emas, chunki tenglamaning barcha koeffitsientlari butun son bo'lishi shart emas. Bitta TNT molekulasi asosida tenglama tuzish yanada to'g'ri bo'ladi:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
To'liq kimyoviy tenglama (9) juda ko'p ma'lumotlarni o'z ichiga oladi. Avvalo, bu boshlang'ich moddalarni ko'rsatadi - reaktivlar, shuningdek mahsulotlar reaktsiyalar. Bundan tashqari, u reaktsiya davomida har bir turdagi barcha atomlar alohida saqlanib qolganligini ko'rsatadi. Agar (9) tenglamaning ikkala tomonini Avogadro soniga ko‘paytirsak, 4 mol trotil 21 mol O 2 bilan reaksiyaga kirishib, 28 mol CO 2, 10 mol H 2 O va 6 hosil bo‘lishini aytishimiz mumkin. N 2 mollari.
Yana bitta hiyla bor. Davriy jadval yordamida aniqlaymiz molekulyar og'irliklar bu moddalarning barchasi:
- C 7 H 5 N 3 O 6 = 227,13 g / mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Endi 9-tenglama ham shuni ko'rsatadiki, 4 227,13 g = 908,52 g TNT reaksiyani yakunlash uchun 21 31,999 g = 671,98 g kislorod kerak bo'ladi va natijada 28 44,010 g = 1232,3 g CO 2 hosil bo'ladi, 101 g = 101.8. g H2O va 6 · 28,013 g = 168,08 g N2. Bu reaksiyada massaning saqlanish qonuni bajarilganligini tekshirib ko‘ramiz:
| Reaktivlar | Mahsulotlar | |
| 908,52 g TNT | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Jami | 1580,5 gr | 1580,5 gr |
Ammo alohida molekulalar kimyoviy reaksiyada qatnashishi shart emas. Masalan, ohaktosh CaCO3 va xlorid kislota HCl ning kaltsiy xlorid CaCl2 va karbonat angidrid CO2 ning suvli eritmasini hosil qilish uchun reaktsiyasi:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Kimyoviy tenglama (11) kaltsiy karbonat CaCO 3 (ohaktosh) va xlorid kislota HCl ning kaltsiy xlorid CaCl 2 va karbonat angidrid CO 2 ning suvli eritmasini hosil qilish reaktsiyasini tavsiflaydi. Bu tenglama to'liq, chunki uning chap va o'ng tomonidagi har bir turdagi atomlar soni bir xil.
Ushbu tenglamaning ma'nosi makroskopik (molyar) daraja quyidagicha: 1 mol yoki 100,09 g CaCO 3 reaksiyani yakunlash uchun 2 mol yoki 72,92 g HCl ni talab qiladi, natijada 1 mol CaCl 2 (110,99 g/mol), CO 2 (44,01 g/mol) va H 2 hosil bo‘ladi. O (18,02 g/mol). Ushbu raqamli ma'lumotlarga asoslanib, bu reaktsiyada massaning saqlanish qonuni bajarilganligini tekshirish oson.
(11) tenglamani talqin qilish mikroskopik (molekulyar) daraja unchalik aniq emas, chunki kaltsiy karbonat tuzdir va emas molekulyar birikma, va shuning uchun kimyoviy tenglamani (11) 1 molekula kaltsiy karbonat CaCO 3 2 molekula HCl bilan reaksiyaga kirishishi ma'nosida tushunish mumkin emas. Bundan tashqari, eritmadagi HCl molekulasi odatda H + va Cl - ionlariga ajraladi (parchalanadi). Shunday qilib, ko'proq to'g'ri tavsif Ushbu reaksiyada molekulyar darajada nima sodir bo'lishi tenglama bilan berilgan:
- CaCO 3 (sol.) + 2H + (oq.) → Ca 2+ (oq.) + CO 2 (g.) + H 2 O (l.) (12)
Bu erda har bir turdagi zarrachaning fizik holati qisqacha qavs ichida ko'rsatilgan ( televizor- qiyin, oq.- suvli eritmadagi gidratlangan ion; G.- gaz, va.- suyuqlik).
Tenglama (12) shuni ko'rsatadiki, qattiq CaCO 3 ikkita gidratlangan H + ionlari bilan reaksiyaga kirishib, ijobiy Ca 2+, CO 2 va H 2 O ionlarini hosil qiladi. (12) tenglama, boshqa to'liq kimyoviy tenglamalar kabi, molekulyar mexanizm reaktsiyalar va moddalar miqdorini hisoblash uchun unchalik qulay emas, ammo u beradi eng yaxshi tavsif mikroskopik darajada sodir bo'ladi.
Kimyoviy tenglamalarni tuzish bo'yicha bilimlaringizni o'zingiz yechim bilan misol orqali ishlang:
13-darsdan umid qilaman" Kimyoviy tenglamalarni yozish"Siz o'zingiz uchun yangi narsalarni o'rgandingiz. Agar sizda biron bir savol bo'lsa, ularni sharhlarda yozing.